Method Article
Оптимизация реакции транскрипции in vitro для продукции мРНК с использованием хроматографического мониторинга на линии
В этой статье
Резюме
Оптимизация транскрипции in vitro (IVT) имеет решающее значение для экономически эффективного производства мРНК. В этом протоколе подробно описан аналитический хроматографический метод для поточного анализа реакции IVT, мониторинга истощения NTP и производства мРНК в режимах batch или feed-batch, применимый к различным модальностям РНК, повышая производительность и снижая затраты.
Аннотация
Реакция транскрипции in vitro (IVT) представляет собой сложный, многокомпонентный ферментативный синтез мРНК из линейной матрицы ДНК, катализируемый РНК-полимеразой, например, Т7. Из-за высокой стоимости реагентов IVT, IVT является критически важным этапом в процессе производства мРНК-фармацевтической субстанции и находится в центре интенсивной оптимизации в этой области. Чтобы снизить затраты на производство мРНК, необходимо оптимально использовать реагенты. Эффективная оптимизация требует всестороннего понимания влияния отдельных реагентов на кинетику реакции, т.е. потребление нуклеозидтрифосфатов (НТП) и производство мРНК. Традиционно для анализа мРНК использовались методы анализа с низкой пропускной способностью, конечными точками. Несмотря на то, что такие методы дают ценную информацию о содержании мРНК, для полного понимания реакции ИВТ необходима аналитика в режиме реального времени. Мы демонстрируем, как аналитический метод жидкостной хроматографии, который разделяет NTP, а также пДНК и мРНК, может быть использован практически в режиме реального времени для изучения кинетики реакции IVT. Благодаря знаниям о влиянии различных компонентов IVT на кинетику и выход, быстрый хроматографический анализ может быть использован для преобразования реакции IVT в режим подачи партии, что еще больше повышает производительность и снижает общую стоимость реакции.
Введение
Пандемия COVID-19 стала катализатором беспрецедентной революции в биомедицине, что привело к быстрой разработке и разрешению вакцин на основе мРНК, таких как Comirnaty от BioNTech/Pfizer и Spikevax от Moderna, как в Европе, так и в США 1,2,3. Впечатляющая эффективность и быстрое развитие этих вакцин подчеркнули огромный терапевтический потенциал технологии мРНК не только для борьбы с инфекционными заболеваниями, но и для иммунотерапии рака, заместительной белковой терапии, регенеративной медицины и клеточногоперепрограммирования. Эта эпоха, которую часто называют революцией мРНК, подчеркивает необходимость эффективных и экономичных процессов производства мРНК.
Производство мРНК включает в себя несколько единичных операций, при этом реакция транскрипции in vitro (IVT) является критической и наиболее затратной операцией 6,7,8. Реакция IVT синтезирует мРНК из матрицы ДНК с использованием РНК-полимеразы, обычно РНК-полимеразы Т7, и нуклеозидтрифосфатов (НТП) в присутствии ионов магния. Процесс относительно прост и позволяет производить большое количество мРНК за короткий промежуток времени, достигая выходов реакции 2-5 г/л в течение нескольких часов и до 14 г/л в некоторых отчетах 9,10,11. Тем не менее, оптимизация выхода реакции ИВТ имеет решающее значение для снижения производственных затрат и обеспечения масштабируемости мРНК-вакцин и терапевтических средств12 и, из-за различий в последовательностях, влияющих на потребление NTP, может потребоваться для каждой конструкции или семейства конструктов.
Реакция обычно выполняется в виде периодического процесса, но последние достижения в области обработки подаваемых партий и поточной аналитики открыли новые возможности для оптимизации производства мРНК 7,13. Реакции с партиями FED, которые включают в себя болюсное или непрерывное добавление реагентов, потенциально могут увеличить время реакции и увеличить выход за счет предотвращения ингибирования субстрата и кофактор-зависимой деградации продукта14,15.
Развитие быстрой поточной аналитики стало значительным шагом вперед в области IVT, позволив отслеживать ключевые компоненты реакции, такие как NTP и мРНК, с минимальным аналитическим лагом13,16, добавляя дополнительное измерение к мониторингу IVT, который обычно сосредоточен только на концентрации мРНК17. Традиционно мРНК анализировались с помощью таких методов, как электрофорез в полиакриламидном геле (PAGE), электрофорез в агарозном геле или капиллярный электрофорез. Эти методы являются конечными точками и, следовательно, не могут быть использованы для мониторинга ИВТ в режиме реального времени. Альтернативой аналитике, описанной в этом протоколе, являются методы с использованием аптамера светящейся РНК и пар флуоресцентных красителей. В этом методе аптамер РНК помечается до РНК и инкубируется с помощью светящегося флуоресцентного красителя. Затем транскрипционная активность может быть визуализирована с помощью интенсивности флуоресценции17. Это позволяет анализировать количество и качество транскрибируемой мРНК во время IVT 21 в режиме реального времени, но не позволяет одновременно контролировать другие компоненты IVT, например, NTP. Другой альтернативой, которая потенциально позволяет количественно оценить NTP и мРНК в режиме реального времени, является рамановская спектроскопия18, но на сегодняшний день ни один отчет не показал ее полезности для мониторинга IVT, что говорит о том, что для получения необходимой селективности и чувствительности все еще требуется дальнейшая оптимизация метода.
Непрерывная разработка более быстрой и селективной аналитики поддерживает оптимизацию IVT для повышения производительности в режимах «партия» и «подача партии». Реакция остается сложным, многопараметрическим процессом с множеством взаимодействующих факторов, для которых оптимума может различаться в зависимости от типа конструктов (например, мРНК против саРНК). Концентрация и соотношение ионовMg2+ и NTP имеют особое значение, и их оптимальные уровни должны быть тщательно сбалансированы, чтобы максимизировать выход мРНК при минимизации образования двухцепочечной РНК (дцРНК), мощного стимулятора врожденной иммунной системы19,20. Недавно сообщалось, что кормление UTP на стационарных уровнях является подходом к снижению образования дцРНК21. Мониторинг уровней UTP в режиме, близком к реальному времени, добавит дополнительный уровень контроля над процессом.
В этом протоколе мы демонстрируем, как поточный мониторинг реакции IVT может увеличить выход продукции мРНК в периодическом режиме и в режиме подачи партии.
протокол
1. Подготовка буфера
ПРИМЕЧАНИЕ: Все буферы должны быть подготовлены без РНКазы, а это означает, что все химикаты и стеклянная посуда должны использоваться только для работы без РНКазы и работать с ними с осторожностью. Вода, используемая для приготовления буфера и очистки стеклянной посуды, должна быть сертифицирована как не содержащая нуклеаз. Перед проведением эксперимента все рабочие поверхности и стеклянную посуду необходимо опрыскать обеззараживающим реагентом, устраняющим РНКазы. Перед использованием стеклянной посуды/рабочей зоны реагент для обеззараживания необходимо тщательно смыть водой, не содержащей РНКазы. По возможности используйте стерильные и одноразовые расходные материалы.
- Приготовление буферов IVT: приготовить 10x IVT буфер с добавлением 400 мМ Трис, 10 мМ DTT, 20 мМ спермидина, pH 7,9. Приготовьте буфер для гашения, содержащий 100 мМ ЭДТА, pH 8. Отфильтруйте каждый буфер через фильтр PES 0,22 мкм.
- Приготовление подвижных фаз: получение подвижной фазы А (МПА) путем добавления 50 мМ HEPES, pH 7,0, мобильной фазы B (MPB) путем добавления 50 мМ HEPES, 100 мМ Na4P2O7, pH 8,3, подвижной фазы C (MPC) путем добавления 0,1 М NaOH, 1 М NaCl, подвижной фазы D (MPD) путем добавления 0,5 М HEPES, рН 7,0. Отфильтруйте каждый буфер через фильтр PES 0,22 мкм.
2. Приготовление реакции транскрипции in vitro (IVT)
ПРИМЕЧАНИЕ 1: Реакция IVT может быть периодической реакцией, в которой все реагенты добавляются в начале, и реакция останавливается после того, как NTP истощены/продукция мРНК достигает плато, или может быть реакцией с подачей партии, при которой обедненные NTP пополняются дополнительными NTP и при этом производство мРНК дополнительно увеличивается. Линейная матрица пДНК, используемая в реакции IVT, может быть получена с помощью фермента рестрикции, который расщепляется сразу после поли(А)-последовательности в плазмидной ДНК или с помощью ПЦР-реакции. В обоих случаях реакция должна сопровождаться очисткой, либо хроматографической, либо с использованием коммерческих наборов для очистки ДНК.
- Реакция периодического ИВТ
- Установите термоблок на 37 °C и 300 об/мин. Разморозьте все реагенты, перечисленные в таблице 1 , кроме ферментов, и предварительно нагрейте их при 37 °C в термоблоке. Приготовьте смесь NTP 25 мМ с использованием 100 мМ исходного раствора АТФ, CTP, UTP и GTP.
- Пока реагенты оттаивают, подготовьте образцы аликвот для временного эксперимента. Возьмите 0,5 мл стерильных пробирок и пипетку 2 мкл 100 мМ ЭДТА в каждую пробирку. Отметьте каждую пробирку обозначенным номером IVT (например, IVT001, IVT002 и т. д.) и временной точкой (например, 0 мин, 15 мин, 30 мин, 60 мин и т. д.).
- Когда реагенты разморозятся и будут храниться при температуре 37 °C в течение примерно 15 минут, извлеките ферменты (РНК-полимераза T7, пирофсфатаза, ингибитор рназы) из морозильной камеры при температуре -20 °C и храните в холодильнике до хранения в морозильной камере.
- Для смешивания отдельных реагентов ИВТ (кроме ферментов) используют вихревой. Смешайте ферменты, аккуратно пипетируя вверх и вниз.
- Смешайте реагенты ИВТ в соотношениях, установленных в схеме эксперимента (например, общий протокол ИВТ приведен в таблице 1) в пробирке объемом 1,5 мл. При выполнении оптимизации ИВТ конечный объем ИВТ может находиться в диапазоне 50-100 мкл. При расчете общего объема ИВТ учитывайте количество образцов объемом 2 мкл, которые должны быть изъяты из реакции во время эксперимента по времени. Убедитесь, что общий объем образцов не превышает 50% от общего объема ИВТ (например, если отбор проб составляет 2 мкл каждые 15 мин в течение 3 ч, общий объем взятых аликвот составляет 30 мкл, что означает, что общий объем ИВТ должен составлять минимум 60 мкл).
- Тщательно перемешайте ИВТ, в качестве последнего реагента добавьте Т7 РНК-полимеразу. Когда все реагенты будут добавлены, тщательно перемешать ИВТ путем пипетирования вверх и вниз, не использовать вортекс.
- Сразу после того, как все реагенты IVT добавлены и гомогенизированы, извлеките 2 мкл смеси IVT из пробирки и пипетируйте ее в заранее подготовленные пробирки объемом 0,5 мл, содержащие 2 мкл 100 мМ ЭДТА, описанных в шаге 2.1.2 (временная точка 0 мин).
- Поместите реакционные пробирки, содержащие реакционные смеси IVT, в термоблок и инкубируйте их при 37 °C.
- Установите таймер на нужные временные интервалы (например, 15 мин/30 мин). В каждый момент времени отбирают 2 мкл образца ИВТ из каждой приготовленной реакционной смеси ИВТ и пипетируют его в предварительно подготовленную пробирку (см. шаг 2.1.2), содержащую 2 мкл 100 мМ ЭДТА. Эти алицитаты будут использоваться для хроматографического анализа (см. шаг 3).
- После того как хроматографический анализ подтвердит полное истощение NTP, угасите объемные реакции IVT с помощью ЭДТА до конечной концентрации 50 мМ (например, 30 мкл IVT инактивировать с 30 мкл 100 мМ ЭДТА).
- Реакция ИВТ в партии FED
Примечание: производство мРНК может быть дополнительно увеличено путем добавления NTP и ионов Mg2+ после истощения NTP.- Смешайте партию IVT реакцию и отберите образец, как описано в шаге 2.1. Приготовьте комбикорм NTP+MgCl2 для скармливаемой партии. Для приготовления, например, 500 мкл смеси NTP+MgCl2, смешайте 106 мкл каждого 200 мМ NTP, 76,25 мкл 1 М MgCl2и 5,5 мкл ddH2O. Конечные концентрации в смеси составляют 42,4 мМ каждого NTP и 152,5 мМ MgCl2.
- Контролируйте потребление NTP с помощью онлайн-аналитики, описанной в шаге 3. Когда поточный анализ подтвердит, что концентрация NTP упадет ниже 10% от начальной концентрации, добавьте корм, содержащий NTP+Mg2+ , в объемный IVT.
- Измерьте/рассчитайте точный объем объемной реакции IVT, оставшийся в пробирке объемом 1,5 мл после того, как все аликвоты будут взяты для анализа. Добавьте соответствующий объем смеси NTP+MgCl2 в IVT так, чтобы конечная концентрация составляла 4 мМ каждого NTP и 12 мМ MgCl2. Например, на 80 мкл объемного IVT, оставленного в пробирке объемом 1,5 мл, добавьте 16,8 мклсмеси NTP+MgCl2.
- Продолжайте отбор проб, как описано в шаге 2.1. После того как NTP снова будут исчерпаны, повторите раздел 2.2.2. Продолжайте кормление и забор образцов до тех пор, пока не будет достигнуто желаемое производство мРНК.
- После достижения желаемого производства мРНК инактивируйте всю реакцию, как показано на шаге 2.1.10.
3. Подготовка к хроматографическому анализу
- Подготовка к стандартным и системным испытаниям на пригодность (SST)
- Приготовьте ТПМ, объединив реагент для укупорки, NTP, матрицу пДНК и мРНК. Убедитесь, что конечные концентрации составляют приблизительно 3 мкМ для укупорочного реагента, 5 мкМ для каждого NTP, 4 нг/л для матрицы пДНК и 10 нг/л для мРНК. Убедитесь, что конечный SST содержит 0,1 M NaCl.
- Подготовка новой калибровочной кривой перед каждым анализом. Создание калибровочного стандарта путем разбавления очищенного образца мРНК известной концентрации МФА. Точки калибровки должны составлять 0,5 нг/μл, 2 нг/μл, 5 нг/μл, 10 нг/μл, 15 нг/μл и 20 нг/μл, каждая с конечной концентрацией 0,1 М NaCl.
- При необходимости подготовьте калибровочную кривую для всех NTP. Убедитесь, что конечные концентрации каждого NTP в калибровочных стандартах составляют 0,5 μM, 2 μM, 5 μM, 10 μM, 15 μM и 20 μM.
- Кондиционирование колонны и подготовка к анализу
- Уравновесить 0,1 мл аналитической колонки при комнатной температуре в течение 12 ч перед анализом. Прикрепите колонку к хроматографической системе в направлении, указанном на корпусе колонки.
- Промойте колонку с расходом 1 мл/мин: сначала 50 объемами колонны (CV) ddH, 2O, а затем 50 CV MPA.
- Перед анализом выполните не менее 3 пустых проб (вводя только MPA), чтобы установить базовый уровень. Используйте хроматографический метод, описанный в Skok et al.15.
- После того как исходный уровень стабилен и два последовательных холостых измерения сопоставимы (воспроизводимый базовый уровень), перейдите к выборке SST и образцам калибровочной кривой.
- Если критерии SST соблюдены и разделение укупорочного реагента и NTP удовлетворительно, следует приступить к анализу образцов IVT. После анализа всех образцов IVT введите стандарт SST еще раз, чтобы подтвердить, что условия в системе оставались стабильными на протяжении всего анализа.
- Подготовка образцов
ПРИМЕЧАНИЕ: Образцы для хроматографического анализа подготавливаются непосредственно перед анализом. В противном случае образцы хранятся в морозильной камере при температуре -20 °C (максимум 24 часа) или <-65 °C (более 24 часов).- Перед разведением для хроматографического анализа завихрение и вращение затушеванного образца IVT. Проанализируйте все образцы ИВТ, инактивированные ЭДТА (см. шаг 2.1.9) с помощью хроматографического анализа с использованием метода, описанного в Skok et al.15.
- Перед анализом разбавьте образцы IVT для достижения концентрации в пределах калибровочной кривой. Используйте один и тот же коэффициент разбавления на протяжении всего эксперимента, чтобы убедиться, что области NTP можно сравнить для определения того, когда NTP истощен.
- Чтобы определить минимальное необходимое разведение для образцов IVT, используйте следующую формулу: Необходимое разведение = (ожидаемая конечная концентрация мРНК) / (разведение во время инактивации) / (наивысший стандарт калибровки)
Например, если при ИВТ ожидается выработка мРНК на уровне 8 мг/мл, то концентрация в закаленном образце составит 4 мг/мл. Чтобы достичь концентрации в пределах калибровочной кривой, дополнительно разбавьте образец в 200 раз.
Необходимое разведение = (8000 нг/μл]) / 2 / (20 нг/μл) = 200 - Дозируйте MPA и 4 М NaCl в конический стеклянный флакон. Убедитесь, что конечная концентрация NaCl в образце составляет 100 мМ. Наконец, добавьте закаленный образец IVT.
- Vortex подготавливает образец и вставляет его в автосамплер для анализа. Установите температуру автосамплера на 4 °C.
- Введите 100 μл разбавленных образцов в аналитическую колонку. Измерьте абсорбцию A260 и A280 для каждого образца IVT.
- Для анализа образцов с известными концентрациями или если отслеживание потребления NTP на основе разницы площадей не требуется, разбавьте образцы до достижения целевой концентрации 10 нг/мкл.
4. Количественная оценка образцов и анализ данных
- Перед интеграцией каждого образца ИВТ вычтите пустой образец из хроматограммы образца.
- Интегрируйте все пики NTP, пДНК и мРНК в A260 и используйте области пиков для расчета концентраций NTP и мРНК в IVT.
Примечание: В качестве альтернативы, пиковые области могут быть использованы для сравнения процентного соотношения каждого NTP, оставшегося в реакции IVT, при условии, что коэффициент разведения был постоянным во всех временных точках. - На основе концентраций мРНК/НТФ, определенных с помощью хроматографического анализа на линии, решите, можно ли инактивировать ИВТ или следует вводить дополнительные НТП в реакцию ИВТ (см. шаг 2).
Результаты
Хроматографический анализ, описанный в данном протоколе, может быть использован либо для оптимизации ИВТ, либо для преобразования реакции партии ИВТ в реакцию с подачей партии (Рисунок 1).
Чтобы проверить влияние различных буферных композиций на кинетику реакции IVT, три различные реакции IVT смешивали в соответствии с протоколом, приведенным в таблице 2. Буфер, содержащий Трис, в котором pH регулировали с помощью HCl, сравнивали с Трис-буфером, где pH регулировали уксусной кислотой. Кроме того, оба трис-буфера сравнивали с буфером HEPES, где pH корректировали с помощью NaOH. Все 1х буферные растворы IVT включали 40 мМ Трис/HEPES, 10 мМ DTT, 2 мМ спермидина и pH 7,9.
Из 100 мкл смеси реакций IVT 2 мкл образца IVT извлекали из реакции IVT и гасили 2 мкл 100 мМ ЭДТА каждые 15 мин в течение первого часа инкубации, а затем каждые 30 мин до 180 мин инкубации. Ожидаемый конечный выход мРНК для этого условия реакции составлял 15 мг/мл, что означает, что за 2-кратным разведением из-за гашения следовало 400-кратное разведение MPA+NaCl для анализа. Образец был разбавлен в общей сложности в 800 раз, что означает, что даже при производстве 15 мг/мл концентрация мРНК, загруженная на аналитическую хроматографическую колонку, все еще находилась в пределах концентраций калибровочной кривой.
Области NTP и мРНК в A260 были интегрированы для каждого отдельного образца в каждой отдельной временной точке (tx). Затем участки преобразовывали в концентрации мРНК с использованием калибровочной кривой мРНК и процента потребления NTP, используя площадь A260 NTP при 0 мин (t0) в качестве 100% (см. уравнение ниже).
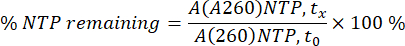
Результаты могут быть представлены в виде графиков для каждой отдельной реакции IVT, где время показано по оси x, а концентрация мРНК и оставшиеся NTP показаны по оси y (рис. 2A). Все ИВТ, то есть концентрации мРНК в зависимости от времени, также могут быть построены на одном графике, а кинетика производства мРНК может быть изучена и выбраны оптимальные условия ИВТ (рис. 2B).
Для эксперимента с откормленной партией ИВТ смешивали, как описано в таблице 3. Из 300 мкл реакционной смеси IVT 2 мкл образца IVT удаляли из реакции IVT и гасили 2 мкл 100 мМ ЭДТА каждые 30 мин. Кроме того, образец отбирали сразу после каждого объемного добавления NTP+MgCl2. Заранее готовили исходный раствор, содержащий 42,4 мМ каждого NTP и 152,5 мМ MgCl2, и 106 мкл каждого отдельного 200 мМ NTP смешивали с 76,2 мкл 1 М MgCl2. Был установлен режим кормления, при котором болюсный корм добавлялся каждый час (через 60 мин, 120 мин, 180 мин и 240 мин инкубации). Режим кормления описан в таблице 3 Образцы анализировались практически в режиме реального времени с помощью аналитики, как описано для реакции объемного IVT. После 300 мин мониторинга реакция ИВТ была погашена.
Результаты могут быть показаны как остаточная продукция NTP/мРНК во время инкубации. Поскольку болюсные добавки корма также разбавляют реакцию IVT, концентрация мРНК в IVT снижается при каждом добавлении корма (рис. 3A). Увеличение массы мРНК также может быть измерено и представлено с помощью факторов транскрипции (определяемых как mмРНК/мпДНК), показывающих линейное увеличение продукции мРНК с течением времени (рис. 3B).
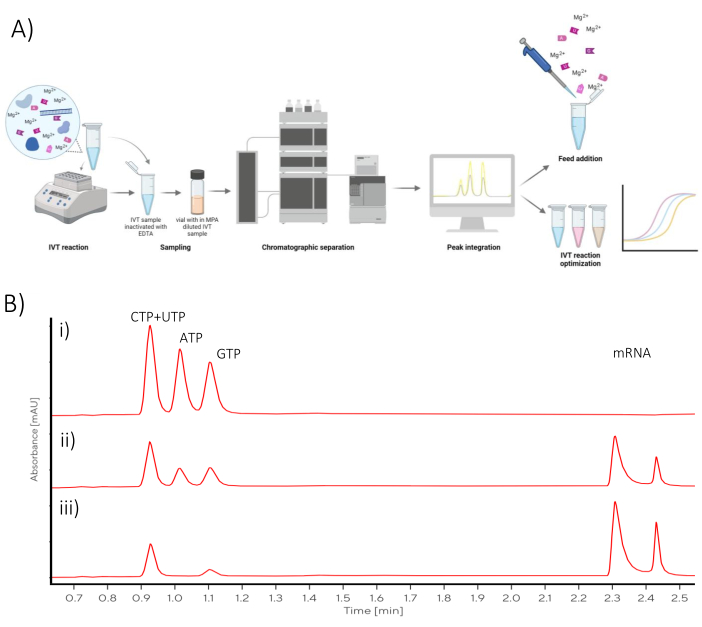
Рисунок 1: Схематический обзор (А) Представление рабочего процесса оптимизации ИВТ с помощью хроматографического анализа на линии, количественного определения NTP и мРНК. (B) Репрезентативные хроматограммы реакции серии IVT, отобранные в точках (i) t0, (ii) в средней точке, (iii) во временных точках конечной реакции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
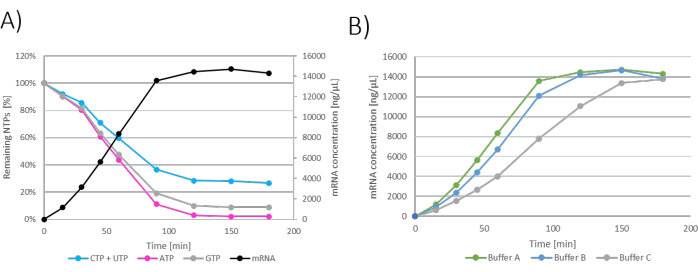
Рисунок 2: Графики пакетной ИВТ. (A) Репрезентативный график реакции IVT с продукцией мРНК и потреблением NTP по оси y. Плато концентрации мРНК видно через 120 - 180 мин инкубации, что коррелирует с потреблением НТФ, так как предельный НТФ (АТФ) потребляют через 120 мин. (В) График ИВТ, показывающий влияние буфера ИВТ на кинетику ИВТ. IVT, содержащий буфер A (Tris+уксусная кислота), показал самую быструю продукцию мРНК, за ним следуют буфер B (Tris+HCl) и буфер C (HEPES+NaOH) как самые медленные. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: График IVT для партии FED. (A) График IVT, на котором NTP+MgCl2 добавляли при 60-, 120-, 180- и 240-минутной концентрации мРНК в реакции IVT, падает при каждом добавлении корма из-за разведения с NTP+MgCl2 . (B) Увеличение массы мРНК, проявляемое фактором транскрипции, является линейным на протяжении всей инкубации реакции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Общий протокол IVT. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Протокол пакетного ИВТ. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Протокол ИВТ для партии FED. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
В этом методе образцы IVT анализируются в разные моменты времени инкубации с использованием аналитической хроматографической мультимодальной колонки, которая разделяет NTP, пДНК и мРНК, что позволяет тщательно контролировать потребление NTP и производство мРНК. Этот метод измеряет концентрацию NTP и мРНК количественным образом на основе изменений в областях A260 в определенные моменты времени. Поскольку метод предоставляет информацию о концентрации NTP и мРНК, он очень подходит для оптимизации IVT, где основной целью часто является максимизация выхода мРНК и минимизация времени реакции; поэтому понимание влияния различных реагентов IVT на кинетику продукции мРНК имеет решающее значение22. Мы показываем, как мониторинг на линии может быть применен для оптимизации реакции IVT в режимах batch и feed-batch.
Основным преимуществом этого метода является поточный анализ, который позволяет осуществлять мониторинг ИВТ практически в режиме реального времени, поскольку каждый образец анализируется менее чем за 8 минут. Подготовка образцов к анализу не вызывает трудностей, так как требуется только разведение в МПА без предварительной обработки проб. Объем образца, необходимый для анализа, очень мал, например, 1 мкл IVT. Такой малый объем пипетирования потенциально может привести к аналитическим отклонениям из-за ошибок пипетирования. Однако, поскольку высокая пропускная способность аналитического подхода позволяет проводить тройные измерения, выбросы легко идентифицировать, а отклонения от ожидаемой кинетической кривой нетрудно обнаружить.
Одним из ограничений метода является хроматографическое коэлюирование УТФ и ЦТФ. Точное количественное определение UTP и CTP обычно не требуется, поскольку предельным NTP в последовательности мРНК часто является либо АТФ, либо ГТФ. Если требуется раздельное количественное определение UTP и CTP, то разница в поглощении УФ-излучения на длинах 260 нм и 280 нм для UTP и CTP может быть использована для получения относительного содержания каждого NTP на хроматографическом пике.
Этот аналитический метод не разделяет виды РНК длиной более 100 нуклеотидов; следовательно, он не может быть использован для выявления различий в качестве мРНК, например, он не дифференцирует между неполиаденилированной и полиаденилированной мРНК, между дцРНК или абортивными транскриптами и ссРНК и не подходит для исследований стабильности, поскольку он не может дифференцировать деградированную и недеградированную мРНК. Тем не менее, метод может быть использован для количественной оценки других модальностей РНК, таких как циркРНК, тРНК и саРНК. Несмотря на то, что эти молекулы различаются по размеру и структуре, один и тот же аналитический метод может быть использован для изучения продуктивных выходов каждой из них в реакции IVT.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят Томаша Костелеца, Блажа Бакалара, Нейца Павлина, Андрею Грамц Ливк и Анже Мартинчич Целяр за полезные дискуссии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm PES membrane filter, e. g. Sartolab BT 500 | Sartorius | 180E14---------E | |
| 0.5 mL plastic tubes; e. g. e. g. DNA LoBind, PCR clean | Eppendorf | 30108035 | |
| 1.5 mL plastic tubes; e. g. DNA LoBind, PCR clean | Eppendorf | 30108051 | |
| ATP Solution | MEBEP BIOSCIENCE | R1331T2 | |
| Benchtop cooler -20 °C | Brand | 114935 | |
| CIMac PrimaS 0.1 mL Analytical Column (2 µm) | Sartorius BIA Separations | 110.5118-2, 2 µm channels | |
| CTP Solution | MEBEP BIOSCIENCE | R3331T2 | |
| DTT | Sigma | 10197777001 | |
| EDTA-Na2 x 2H2O | Kemika | e.g. 11368 08 | |
| GTP Solution | MEBEP BIOSCIENCE | R2331T2 | |
| HEPES | Merck | 1.10110.1000 | |
| HPLC high recovery vial | Macherey-Nagel | 702860 | |
| MgCl2 | Invitrogen | AM 9530G | |
| Microvolume spectrophotometer | Thermo Scientic | Nanodrop | |
| mRNA standard, mFix4, 4000 nt | Sartorius BIA Separations | BIA-mFix4.1.1 | |
| Na4P2O7 + 10 H2O | Sigma | S6422-500G | |
| NaCl | Fluka | 31434-1KG-M | |
| NaOH | Merck | 1064691000 | |
| PATfix mRNA analytical platform | Sartorius BIA Separations | PAT0021 | |
| Pipette 100 – 1000 μL | Eppendorf | Reference 2 | |
| Pipette 2 – 10 μL | Eppendorf | Reference 2 | |
| Pipette 20 – 200 μL | Eppendorf | Reference 2 | |
| Pyrophosphatase | MEBEP BIOSCIENCE | M2403L | |
| Rnase Away Decontamination Reagent | Thermo Scientic | 10328011 | |
| RNAse inhibitor | MEBEP BIOSCIENCE | RNK3501 | |
| Spermidine | Sigma | 85558-5G | |
| T7 mRNA polymerase | MEBEP BIOSCIENCE | TR01 | |
| Thermoblock | Thermo Scientic | EPPE5382000.015 | |
| Trizma Base | Sigma | T6066-1KG | |
| UTP Solution | MEBEP BIOSCIENCE | R5331T2 | |
| Vial caps | Macherey-Nagel | 70245 | |
| Vortex | IKA | V1900 |
Ссылки
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol. 40, 840-854 (2022).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 384 (5), 403 (2021).
- Lopez Bernal, J., et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 385 (7), 585-594 (2021).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. mRNA-based therapeutics - developing a new class of drugs. Nat Rev Drug Discov. 13, 759-780 (2014).
- Baptista, B. R., Carapito, N., Pichon, C., Sousa, F. mRNA, a revolution in Biomedicine. Pharmaceutics. 13, 2090 (2021).
- Rosa, S. S., Prazeres, D. M. F., Azevedo, A. M., Marques, M. P. C. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 39, 2190 (2021).
- Whitley, J., et al. Development of mRNA manufacturing for vaccines and therapeutics: mRNA platform requirements and development of a scalable production process to support early phase clinical trials. Transl. Res. 242, 38-55 (2022).
- Kis, Z., Kontoravdi, C., Shattock, R., Shah, N. Resources, production scales and time required for producing RNA vaccines for the global pandemic demand. Vaccines. 9 (1), 3 (2021).
- Hengelbrock, A., Schmidt, A., Helgers, H., Vetter, F. L., Strube, J. Scalable mRNA machine for regulatory approval of variable scale between 1000 clinical doses to 10 million manufacturing scale doses. Processes. 11, 745 (2023).
- Rosa, S. S., et al. Maximizing mRNA vaccine production with Bayesian optimization. Biotechnol Bioeng. 119 (11), 3127-3139 (2022).
- Sari, Y., Sousa, S. S., Jeffries, J., Marques, M. P. C. Comprehensive evaluation of T7 promoter for enhanced yield and quality in mRNA production. Sci Rep. 14, 9655 (2024).
- Kumar, A., et al. The mRNA vaccine development landscape for infectious diseases. Nat Rev Drug Discov. 21 (5), 333-334 (2022).
- Pregeljc, D., et al. Increasing yield of in vitro transcription reaction with at-line high pressure liquid chromatography monitoring. Biotechnol Bioeng. 120 (3), 737-747 (2023).
- Kern, J. A., Davis, R. H. Application of a fed-batch system to produce RNA by in vitro transcription. Biotechnol Prog. 15 (2), 174-184 (1999).
- Skok, J., et al. Gram-Scale mRNA Production Using a 250-mL Single-Use Bioreactor. Chemie Ingenieur Technik. 94 (12), 1928-1935 (2022).
- Welbourne, E. N., et al. Anion exchange HPLC monitoring of mRNA in vitro transcription reactions to support mRNA manufacturing process development. Front Mol Biosci. 11, 1250833 (2024).
- Lee, K. H., Song, J., Kim, S., Han, S. R., Lee, S. W. Real-time monitoring strategies for optimization of in vitro transcription and quality control of RNA. Front Mol Biosci. 10, 1229246 (2023).
- Matuszczyk, J. C., et al. Raman spectroscopy provides valuable process insights for cell-derived and cellular products. Curr Opin Biotechnol. 81, 102937 (2023).
- Mu, X., Hur, S. Immunogenicity of in vitro-transcribed RNA. Acc Chem Res. 54 (21), 4012-4023 (2021).
- Cho, E., et al. Mesoporous silica particle as an RNA adsorbent for facile purification of in vitro-transcribed RNA. Int J Mol Sci. 24 (15), 12408 (2023).
- Ziegenhals, T., et al. Formation of dsRNA by-products during in vitro transcription can be reduced by using low steady-state levels of UTP. Front Mol Biosci. 10, 1291045 (2023).
- Höfer, K., Langejürgen, L. V., Jäschke, A. Universal aptamer-based real-time monitoring of enzymatic RNA synthesis. J Am Chem Soc. 135 (37), 13692-13694 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены