Method Article
使用色谱旁在线监测优化用于 mRNA 生产的 体外 转录反应
摘要
优化 体外 转录 (IVT) 对于经济高效的 mRNA 生产至关重要。该方案详细介绍了一种分析色谱方法,用于 IVT 反应的旁线分析,以批量或补料分批模式监测 NTP 消耗和 mRNA 生成,适用于各种 RNA 模式,提高生产率并降低成本。
摘要
体外 转录反应 (IVT) 是由 RNA 聚合酶(例如 T7)催化的线性 DNA 模板的复杂、多组分酶促合成 mRNA。由于 IVT 试剂成本高,IVT 是 mRNA 原料药生产过程中的关键步骤,并且一直是该领域密集优化的重点。为了降低 mRNA 生产成本,必须以最佳方式使用试剂。有效的优化需要全面了解单个试剂对反应动力学的影响,即三磷酸核苷 (NTP) 的消耗和 mRNA 的产生。传统上,低通量、终点分析技术用于 mRNA 分析。尽管这些方法提供了有关 mRNA 含量的宝贵信息,但需要近乎实时的在线分析才能充分了解 IVT 反应。我们展示了如何近乎实时地使用分离 NTP 以及 pDNA 和 mRNA 的液相色谱分析方法来研究 IVT 反应动力学。了解不同 IVT 组分对动力学和产率的影响后,可以使用快速色谱分析将间歇 IVT 反应转换为补料分批模式,从而进一步提高生产率并降低反应的总体成本。
引言
COVID-19 大流行催化了生物医学领域前所未有的革命,导致基于 mRNA 的疫苗在欧洲和美国迅速开发和授权,例如 BioNTech/Pfizer 的 Comirnaty 和 Moderna 的 Spikevax1,2,3。这些疫苗令人印象深刻的疗效和快速发展凸显了 mRNA 技术的巨大治疗潜力,不仅适用于传染病,还适用于癌症免疫疗法、蛋白质替代疗法、再生医学和细胞重编程 4,5。这个时代通常被称为 mRNA 革命,强调了对高效且具有成本效益的 mRNA 生产工艺的需求。
mRNA 的生产涉及多个单元作,其中体外转录 (IVT) 反应是一个关键且成本最高的单元作 6,7,8。IVT 反应使用 RNA 聚合酶(通常是 T7 RNA 聚合酶)和在镁离子存在下使用三磷酸核苷 (NTP) 从 DNA 模板合成 mRNA。该工艺相对简单,可在短时间内生产大量 mRNA,可在数小时内实现 2-5 g/L 的反应产量,在一些报道中高达 14 g/L的反应产量 9,10,11。然而,优化 IVT 反应产量对于降低生产成本和确保 mRNA 疫苗和治疗药物的可扩展性至关重要12,并且由于影响 NTP 消耗的序列差异,每个构建体或构建体家族可能需要优化。
该反应通常以批处理过程的形式进行,但补料批处理和在线分析的最新进展为优化 mRNA 生产开辟了新途径 7,13。补料分批反应(涉及推注或连续添加试剂)可以通过防止底物抑制和辅因子依赖性产物降解来延长反应时间并提高产量14,15。
快速近线分析的发展是 IVT 领域的重大进步,能够以最小的分析滞后监测关键反应组分,如 NTP 和 mRNA13,16,为 IVT 监测增加了一个额外的维度,而 IVT 监测通常只关注 mRNA 浓度17。传统上,使用聚丙烯酰胺凝胶电泳 (PAGE)、琼脂糖凝胶电泳或毛细管电泳等技术分析 mRNA。这些是终点方法,因此不能用于实时 IVT 监控。本协议中描述的分析的替代方法是使用发光 RNA 适配体和荧光染料对的方法。在该方法中,RNA 适体被标记到 RNA 上并与发光荧光染料一起孵育。然后可以通过荧光强度17 可视化转录活性。这能够在 IVT 21 期间实时分析转录 mRNA 的数量和质量,但不允许同时监测其他 IVT 成分,例如 NTP。另一种可能提供 NTP 和 mRNA 实时定量的替代方案是拉曼光谱18,但迄今为止,还没有报告表明它对 IVT 监测有用,这表明仍然需要进一步优化该方法以获得必要的选择性和灵敏度。
持续开发更快、更具选择性的分析有助于优化 IVT,从而在分批和补料分批模式下获得更高的产量。该反应仍然是一个复杂的多参数过程,具有多个相互作用因素,其最佳状态可能因构建体类型(例如,mRNA 与 saRNA)而异。Mg2+ 离子和 NTP 的浓度和比例特别有影响力,必须仔细平衡它们的最佳水平,以最大限度地提高 mRNA 产量,同时最大限度地减少双链 RNA (dsRNA) 的形成,双链 RNA (dsRNA) 是先天免疫系统的一种有效刺激剂19,20。最近,据报道,以稳态水平饲喂 UTP 是减少 dsRNA 形成的一种方法21。近乎实时地监测 UTP 水平将增加额外的过程控制水平。
在该协议中,我们展示了 IVT 反应的在线监测如何提高分批和补料分批模式下 mRNA 生产的产量。
研究方案
1. 缓冲液制备
注:所有缓冲液必须制备不含 RNase,这意味着所有化学品和玻璃器皿只能用于无 RNase 的工作,并谨慎处理。用于缓冲液制备和玻璃器皿清洁的水必须经认证为无核酸酶。在进行实验之前,所有工作表面和玻璃器皿都必须喷洒去除 RNase 的去污试剂。在使用玻璃器皿/工作区域之前,必须用不含 RNase 的水彻底冲洗去污试剂。如果可能,请使用无菌和一次性耗材。
- IVT 缓冲液的制备:通过添加 400 mM Tris、10 mM DTT、20 mM 亚精胺(pH 7.9)制备 10x IVT 缓冲液。制备含有 100 mM EDTA(pH 值为 8)的淬灭缓冲液。通过 0.22 μm PES 过滤器过滤每个缓冲液。
- 流动相的制备:添加 50 mM HEPES 制备流动相 A (MPA),pH 7.0,添加 50 mM HEPES 制备流动相 B (MPB),添加 100 mM Na4P2O7,pH 8.3,添加 0.1 M NaOH 制备流动相 C (MPC),添加 0.5 M NaCl 制备流动相 D (MPD), pH 值 7.0。通过 0.22 μm PES 过滤器过滤每个缓冲液。
2. 体外 转录反应 (IVT) 的制备
注 1:IVT 反应可以是间歇反应,其中所有试剂在开始时添加,并在 NTP 耗尽/mRNA 产生达到平台期后停止反应,也可以是补料分批反应,其中耗尽的 NTP 用额外的 NTP 补充,并且 mRNA 产量进一步增加。IVT 反应中使用的线性 pDNA 模板可以通过使用限制性内切酶(在质粒 DNA 中的 poly(A) 序列后立即裂解或通过 PCR 反应获得。在这两种情况下,反应后都必须进行纯化,无论是色谱法还是使用市售 DNA 纯化试剂盒。
- 批量 IVT 反应
- 将加热块设置为 37 °C 和 300 rpm。解冻 表 1 中列出的除酶之外的所有试剂,并在 37 °C 下在热块中预热。使用 100 mM ATP、CTP、UTP 和 GTP 储备液制备 25 mM NTP 混合物。
- 在试剂解冻时,准备用于时程实验的样品等分试样。取 0.5 mL 无菌管,将 2 μL 100 mM EDTA 移液到每个管中。用指定的 IVT 编号(例如,IVT001、IVT002 等)和时间点(例如,0 分钟、15 分钟、30 分钟、60 分钟等)标记每个试管。
- 当试剂解冻并在 37 °C 下保持约 15 分钟时,从 -20 °C 冰箱中取出酶(T7 RNA 聚合酶、焦磷酸酶、Rnase 抑制剂)并将其保存在冷却器中,直到重新存放在冰箱中。
- 对于混合单个 IVT 试剂(酶除外),请使用涡旋。通过轻轻上下移液来混合酶。
- 在 1.5 mL 试管中按实验设计中设定的比例混合 IVT 试剂(例如,通用 IVT 方案如 表 1 所示)。执行 IVT 优化时,最终 IVT 体积可在 50-100 μL 之间。在设计总 IVT 体积时,请考虑在时程实验期间要从反应中取出的 2 μL 样品数量。确保样品总体积不超过总 IVT 体积的 50%(例如,如果每 15 分钟采样 2 μL,持续 3 小时,则取的等分试样总体积为 30 μL,这意味着 IVT 的总体积应至少为 60 μL)。
- 小心混合 IVT,加入 T7 RNA 聚合酶作为最后试剂。添加所有试剂后,通过上下移液彻底混合 IVT,不要使用涡旋。
- 添加所有 IVT 试剂并均质化后,立即从试管中取出 2 μL IVT 混合物,并将其移液到先前制备的 0.5 mL 试管中,该试管含有步骤 2.1.2 中描述的 2 μL 100 mM EDTA(时间点 0 分钟)。
- 将含有 IVT 反应混合物的反应管放入热块中,并在 37 °C 下孵育。
- 将计时器设置为所需的时间间隔(例如,15 分钟/30 分钟)。在每个时间点,从每个准备好的 IVT 反应混合物中取出 2 μL 的 IVT 样品,并将其移液到先前制备的含有 2 μL 100 mM EDTA 的试管中(参见步骤 2.1.2)。这些等分试样将用于色谱分析(参见步骤 3)。
- 在色谱分析确认 NTP 完全耗尽后,用 EDTA 淬灭大量 IVT 反应至终浓度为 50 mM(例如,用 30 μL 100 mM EDTA 灭活 30 μL IVT)。
- 补料分批 IVT 反应
注:在 NTP 耗尽后添加 NTP 和 Mg2+ 离子可以额外增加 mRNA 的产生。- 混合批量 IVT 反应并按照步骤 2.1 中的说明进行采样。为补料批次准备 NTP+MgCl2 饲料。要制备,例如 500 μL 的 NTP+MgCl2 混合物,混合 106 μL 的每 200 mM NTP、76.25 μL 的 1 M MgCl2 和 5.5 μL 的 ddH2O。混合物中的最终浓度为 42.4 mM 每个 NTP 和 152.5 mM MgCl2。
- 使用步骤 3 中描述的在线分析监控 NTP 消耗。当在线分析确认 NTP 浓度降至起始浓度的 10% 以下时,将含有 NTP+Mg2+ 的进料添加到散装 IVT 中。
- 测量/计算所有等分试样进行分析后,1.5 mL 试管中剩余的大量 IVT 反应的精确体积。向 IVT 中加入适当体积的 NTP+MgCl 2 混合物,使最终浓度为 4 mM 的每种 NTP 和 12 mM 的 MgCl2。例如,对于 1.5 mL 试管中剩余的 80 μL 散装 IVT,添加 16.8 μL NTP+MgCl2 混合物。
- 继续进行步骤 2.1 中写入的采样。在 NTP 再次耗尽后,重复第 2.2.2 节。继续补料和取样,直到达到所需的 mRNA 产量。
- 在达到所需的 mRNA 产生后,如步骤 2.1.10 所示灭活整个反应。
3. 色谱分析的准备
- 标准和系统适用性测试 (SST) 准备
- 通过混合加帽试剂、NTP、pDNA 模板和 mRNA 来制备 SST。确保加帽试剂的最终浓度约为 3 μM,每个 NTP 的最终浓度约为 5 μM,pDNA 模板的最终浓度约为 4 ng/μL,mRNA 的最终浓度约为 10 ng/μL。确保最终的 SST 含有 0.1 M NaCl。
- 在每次分析之前准备新的校准曲线。通过用 MPA 稀释已知浓度的纯化 mRNA 样品来制备校准标准品。校准点应为 0.5 ng/μL、2 ng/μL、5 ng/μL、10 ng/μL、15 ng/μL 和 20 ng/μL,每个校准点的最终浓度为 0.1 M NaCl。
- 如果需要,为所有 NTP 准备校准曲线。确保校准标准品中每个 NTP 的最终浓度为 0.5 μM、2 μM、5 μM、10 μM、15 μM 和 20 μM。
- 色谱柱老化和分析准备
- 分析前,在室温下平衡 0.1 mL 分析柱 12 小时。按照色谱柱外壳上指示的方向将色谱柱连接到色谱系统。
- 以 1 mL/min 的流速冲洗色谱柱:首先使用 50 柱体积 (CV) 的 ddH2O,然后使用 50 CV 的 MPA。
- 分析前至少运行 3 个空白样品(仅注入 MPA)以设置基线。使用 Skok 等人 15 中描述的色谱方法。
- 一旦基线稳定并且两个连续的空白测量值具有可比性(可重现的基线),请继续运行 SST 样品和校准曲线样品。
- 如果满足 SST 标准并且加帽试剂和 NTP 的分离令人满意,则继续分析 IVT 样品。分析完所有 IVT 样品后,再次进样 SST 标准品,以确认系统条件在整个分析过程中保持稳定。
- 样品制备
注:用于色谱分析的样品在分析前立即制备。否则,将样品保存在-20°C(最长24小时)或<-65°C(超过24小时)的冰箱中。- 在稀释用于色谱分析之前,涡旋并旋转淬灭的 IVT 样品。使用 Skok 等人 15 中描述的方法通过色谱分析分析所有 EDTA 灭活的 IVT 样品(参见步骤 2.1.9)。
- 分析前,稀释 IVT 样品以达到校准曲线内的浓度。在整个时程实验中使用相同的稀释因子,以确保可以比较 NTP 面积以确定 NTP 何时耗尽。
- 要确定 IVT 样品所需的最小稀释度,请使用以下公式:所需稀释度 =(预期最终 mRNA 浓度)/(灭活期间的稀释度)/(最高校准标准)
例如,如果 IVT 中预计 mRNA 产量为 8 mg/mL,则淬灭样品中的浓度将为 4 mg/mL。为了在校准曲线内达到浓度,请将样品进一步稀释 200 倍。
所需稀释度 = (8000 ng/μL) / 2 / (20 ng/μL) = 200 - 将 MPA 和 4 M NaCl 移液到锥形玻璃瓶中。确保样品中 NaCl 的最终浓度为 100 mM。最后,加入淬灭的 IVT 样品。
- 涡旋制备样品并将其插入自动进样器进行分析。将自动进样器温度设置为 4 °C。
- 将 100 μL 稀释样品注入分析柱上。测量每个 IVT 样品的吸光度 A 260 和 A280 。
- 对于分析已知浓度的样品,或者如果不需要根据面积差异跟踪 NTP 消耗量,请稀释样品以达到 10 ng/μL 的目标浓度。
4. 样品定量和数据分析
- 在积分每个 IVT 样品之前,从样品色谱图中减去空白样品。
- 对 A260 处的所有 NTP、pDNA 和 mRNA 峰进行积分,并使用峰面积计算 IVT 中 NTP 和 mRNA 的浓度。
注:或者,如果稀释因子在所有时间点一致,则可以使用峰面积来比较 IVT 反应中剩余的每个 NTP 的百分比。 - 根据通过邻线色谱分析确定的 mRNA/NTP 浓度,决定是否可以灭活 IVT,或者是否应将其他 NTP 加入 IVT 反应中(参见步骤 2)。
结果
该方案中描述的色谱分析可用于 IVT 优化或将间歇 IVT 反应转化为补料间歇反应(图 1)。
为了测试不同缓冲液成分对 IVT 反应动力学的影响,根据 表 2 中写的方案混合三种不同的 IVT 反应。将含有 Tris 的缓冲液(其中 pH 值用 HCl 调节)与 Tris 缓冲液(其中 pH 值)用乙酸调节。此外,将两种 Tris 缓冲液与 HEPES 缓冲液进行了比较,其中 pH 值用 NaOH 调节。所有 1x IVT 缓冲液的组成为 40 mM Tris/HEPES、10 mM DTT、2 mM 亚精胺和 pH 7.9。
从 100 μL IVT 反应混合物中,从 IVT 反应中取出 2 μL IVT 样品,在孵育的第一个小时内每 15 分钟用 2 μL 100 mM EDTA 淬灭,然后每 30 分钟淬灭一次,直至孵育 180 分钟。该反应条件的预期最终 mRNA 产量为 15 mg/mL,这意味着由于淬灭而稀释 2 倍后,在 MPA+NaCl 中稀释 400 倍以进行分析。样品总共稀释了 800 倍,这意味着即使在 15 mg/mL 的产量下,上样到分析色谱柱上的 mRNA 浓度仍保持在校准曲线浓度范围内。
在每个单独的时间点 (tx) 对每个单独样品的 A260 处的 NTP 和 mRNA 面积进行积分。然后使用 NTP 的 mRNA 校准曲线和消耗百分比,使用 0 分钟 (t0) 时 NTP 的 A260 面积作为 100%,将面积转换为 mRNA 浓度(参见下面的方程式)。
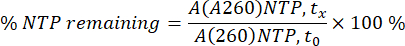
结果可以显示为每个单独 IVT 反应的图表,其中时间显示在 x 轴上,mRNA 浓度和剩余的 NTP 显示在 y 轴上(图 2A)。所有 IVT,即 mRNA 浓度随时间的变化,也可以一起绘制在一个图表中,并且可以研究 mRNA 产生动力学并选择最佳 IVT 条件(图 2B)。
对于补料分批实验,按照 表 3 中所示混合 IVT。从 300 μL IVT 反应混合物中,从 IVT 反应中去除 2 μL IVT 样品,并每 30 分钟用 2 μL 100 mM EDTA 淬灭。此外,在每次大量添加 NTP+MgCl2 后立即采集样品。预先制备含有 42.4 mM 每种 NTP 和 152.5 mM MgCl2 的补料溶液,并将 106 μL 每种 200 mM NTP 与 76.2 μL 1 M MgCl2 混合。建立了一个喂养方案,每小时添加一次推注补料(在孵育的 60 分钟、120 分钟、180 分钟和 240 分钟)。补料方案如 表 3 所示:通过对本体 IVT 反应描述的分析,近乎实时地分析样品。监测 300 分钟后,IVT 反应被淬灭。
结果可以显示为孵育时间内剩余的 NTP/mRNA 产生。由于推注饲料添加也会稀释 IVT 反应,因此每次添加饲料时 IVT 中的 mRNA 浓度都会下降 (图 3A)。 mRNA 质量的增加也可以通过转录因子(定义为 mmRNA/mpDNA)来测量和表示,显示 mRNA 产生的随时间呈线性增加 (图 3B)。
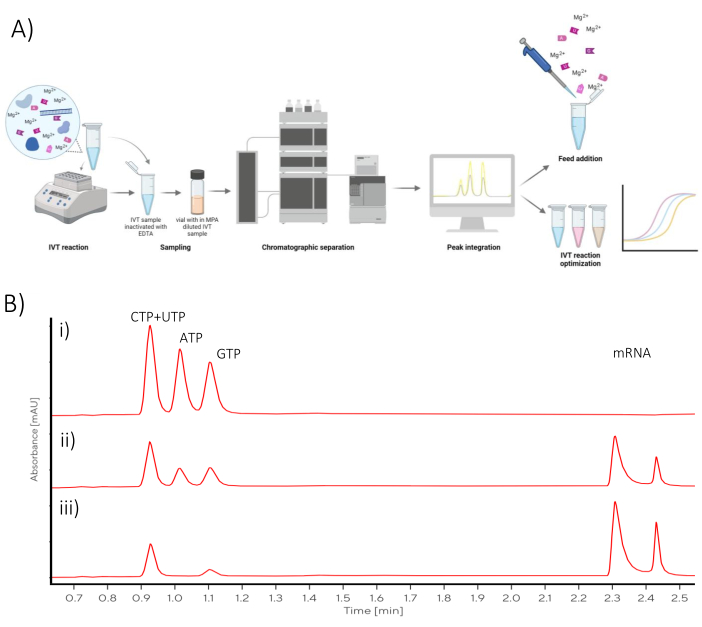
图 1:示意图概述 (A) IVT 优化工作流程与 NTP 和 mRNA 的近线色谱分析定量的表示。(B) 在 (i) t0、(ii) 中点和 (iii) 最终反应时间点采样的批次 IVT 反应的代表性色谱图。 请单击此处查看此图的较大版本。
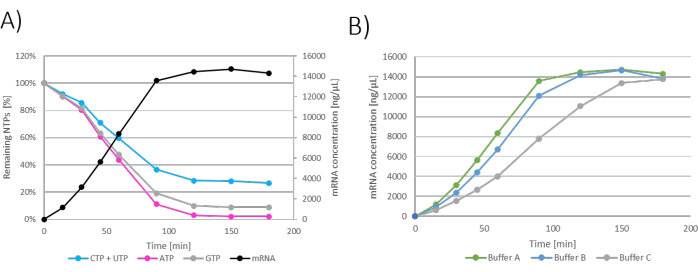
图 2:批量 IVT 图。 (A) y 轴上 mRNA 产生和 NTP 消耗的 IVT 反应的代表性图。在孵育 120 - 180 分钟时可以看到 mRNA 浓度平台,这与 NTP 消耗相关,因为在 120 分钟时消耗了限制性 NTP (ATP)。含有缓冲液 A (Tris + 乙酸) 的 IVT 显示 mRNA 产生最快,其次是缓冲液 B (Tris + HCl) 和缓冲液 C (HEPES+NaOH) 最慢。请单击此处查看此图的较大版本。

图 3:补料分批 IVT 图。 (A) IVT 图,其中 NTP+MgCl2 补料以 60、120、180 和 240 分钟添加。由于用 NTP+MgCl2 补料稀释,IVT 反应中的 mRNA 浓度在每次补料添加时下降。(B) 转录因子显示的 mRNA 质量增加在整个反应孵育过程中是线性的。 请单击此处查看此图的较大版本。
表 1:通用 IVT 协议。请点击此处下载此表格。
表 2:批量 IVT 协议。请点击此处下载此表格。
表 3:补料分批 IVT 方案。请点击此处下载此表格。
讨论
在该方法中,使用分离 NTP、pDNA 和 mRNA 的分析型多模式色谱柱在孵育过程中的不同时间点分析 IVT 样品,从而可以密切监测 NTP 消耗和 mRNA 产生。该方法根据指定时间点 A260 区域的变化以定量方式测量 NTP 和 mRNA 浓度。由于该方法提供了有关 NTP 和 mRNA 浓度的信息,因此非常适合 IVT 优化,其中主要目标通常是最大限度地提高 mRNA 产量和最小化反应时间;因此,了解不同 IVT 试剂对 mRNA 产生动力学的影响至关重要22。我们展示了如何应用在线监测来优化分批和补料分批模式下的 IVT 反应。
该方法的主要优点是旁线分析,允许近乎实时地监测 IVT,因为每个样品都在 8 分钟内进行分析。用于分析的样品制备非常简单,因为只需要在 MPA 中稀释,无需事先进行任何样品预处理。分析所需的样品量非常低,例如 1 μL IVT。这种小移液量可能会因移液错误而导致分析偏差。然而,由于分析方法的高通量允许进行三次重复测量,因此很容易识别异常值,并且与预期动力学曲线的偏差并不难检测。
该方法的局限性之一是 UTP 和 CTP 的色谱共洗脱。通常不需要精确定量 UTP 和 CTP,因为 mRNA 序列中的限制性 NTP 通常是 ATP 或 GTP。如果需要单独定量 UTP 和 CTP,则可以利用 UTP 和 CTP 在 260 nm 和 280 nm 处的紫外吸光度差异来得出色谱峰中每个 NTP 的相对丰度。
这种分析方法不能分离长度超过 100 个核苷酸的 RNA 种类;因此,它不能用于检测 mRNA 质量的差异,例如,它不区分非多聚腺苷酸化和多聚腺苷酸化 mRNA、dsRNA 或流产转录物与 ssRNA,并且不适合稳定性研究,因为它不能区分降解和未降解的 mRNA。然而,该方法可用于定量其他 RNA 模式,例如 circRNA、tRNA 和 saRNA。尽管这些分子的大小和结构各不相同,但可以采用相同的分析方法来研究 IVT 反应中每个分子的生产产率。
披露声明
作者没有什么可披露的。
致谢
作者感谢 Tomas Kostelec、Blaž Bakalar、Nejc Pavlin、Andreja Gramc Livk 和 Anže Martinčič Celjar 提供的有益讨论。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 µm PES membrane filter, e. g. Sartolab BT 500 | Sartorius | 180E14---------E | |
| 0.5 mL plastic tubes; e. g. e. g. DNA LoBind, PCR clean | Eppendorf | 30108035 | |
| 1.5 mL plastic tubes; e. g. DNA LoBind, PCR clean | Eppendorf | 30108051 | |
| ATP Solution | MEBEP BIOSCIENCE | R1331T2 | |
| Benchtop cooler -20 °C | Brand | 114935 | |
| CIMac PrimaS 0.1 mL Analytical Column (2 µm) | Sartorius BIA Separations | 110.5118-2, 2 µm channels | |
| CTP Solution | MEBEP BIOSCIENCE | R3331T2 | |
| DTT | Sigma | 10197777001 | |
| EDTA-Na2 x 2H2O | Kemika | e.g. 11368 08 | |
| GTP Solution | MEBEP BIOSCIENCE | R2331T2 | |
| HEPES | Merck | 1.10110.1000 | |
| HPLC high recovery vial | Macherey-Nagel | 702860 | |
| MgCl2 | Invitrogen | AM 9530G | |
| Microvolume spectrophotometer | Thermo Scientic | Nanodrop | |
| mRNA standard, mFix4, 4000 nt | Sartorius BIA Separations | BIA-mFix4.1.1 | |
| Na4P2O7 + 10 H2O | Sigma | S6422-500G | |
| NaCl | Fluka | 31434-1KG-M | |
| NaOH | Merck | 1064691000 | |
| PATfix mRNA analytical platform | Sartorius BIA Separations | PAT0021 | |
| Pipette 100 – 1000 μL | Eppendorf | Reference 2 | |
| Pipette 2 – 10 μL | Eppendorf | Reference 2 | |
| Pipette 20 – 200 μL | Eppendorf | Reference 2 | |
| Pyrophosphatase | MEBEP BIOSCIENCE | M2403L | |
| Rnase Away Decontamination Reagent | Thermo Scientic | 10328011 | |
| RNAse inhibitor | MEBEP BIOSCIENCE | RNK3501 | |
| Spermidine | Sigma | 85558-5G | |
| T7 mRNA polymerase | MEBEP BIOSCIENCE | TR01 | |
| Thermoblock | Thermo Scientic | EPPE5382000.015 | |
| Trizma Base | Sigma | T6066-1KG | |
| UTP Solution | MEBEP BIOSCIENCE | R5331T2 | |
| Vial caps | Macherey-Nagel | 70245 | |
| Vortex | IKA | V1900 |
参考文献
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol. 40, 840-854 (2022).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 384 (5), 403 (2021).
- Lopez Bernal, J., et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 385 (7), 585-594 (2021).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. mRNA-based therapeutics - developing a new class of drugs. Nat Rev Drug Discov. 13, 759-780 (2014).
- Baptista, B. R., Carapito, N., Pichon, C., Sousa, F. mRNA, a revolution in Biomedicine. Pharmaceutics. 13, 2090 (2021).
- Rosa, S. S., Prazeres, D. M. F., Azevedo, A. M., Marques, M. P. C. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 39, 2190 (2021).
- Whitley, J., et al. Development of mRNA manufacturing for vaccines and therapeutics: mRNA platform requirements and development of a scalable production process to support early phase clinical trials. Transl. Res. 242, 38-55 (2022).
- Kis, Z., Kontoravdi, C., Shattock, R., Shah, N. Resources, production scales and time required for producing RNA vaccines for the global pandemic demand. Vaccines. 9 (1), 3 (2021).
- Hengelbrock, A., Schmidt, A., Helgers, H., Vetter, F. L., Strube, J. Scalable mRNA machine for regulatory approval of variable scale between 1000 clinical doses to 10 million manufacturing scale doses. Processes. 11, 745 (2023).
- Rosa, S. S., et al. Maximizing mRNA vaccine production with Bayesian optimization. Biotechnol Bioeng. 119 (11), 3127-3139 (2022).
- Sari, Y., Sousa, S. S., Jeffries, J., Marques, M. P. C. Comprehensive evaluation of T7 promoter for enhanced yield and quality in mRNA production. Sci Rep. 14, 9655 (2024).
- Kumar, A., et al. The mRNA vaccine development landscape for infectious diseases. Nat Rev Drug Discov. 21 (5), 333-334 (2022).
- Pregeljc, D., et al. Increasing yield of in vitro transcription reaction with at-line high pressure liquid chromatography monitoring. Biotechnol Bioeng. 120 (3), 737-747 (2023).
- Kern, J. A., Davis, R. H. Application of a fed-batch system to produce RNA by in vitro transcription. Biotechnol Prog. 15 (2), 174-184 (1999).
- Skok, J., et al. Gram-Scale mRNA Production Using a 250-mL Single-Use Bioreactor. Chemie Ingenieur Technik. 94 (12), 1928-1935 (2022).
- Welbourne, E. N., et al. Anion exchange HPLC monitoring of mRNA in vitro transcription reactions to support mRNA manufacturing process development. Front Mol Biosci. 11, 1250833 (2024).
- Lee, K. H., Song, J., Kim, S., Han, S. R., Lee, S. W. Real-time monitoring strategies for optimization of in vitro transcription and quality control of RNA. Front Mol Biosci. 10, 1229246 (2023).
- Matuszczyk, J. C., et al. Raman spectroscopy provides valuable process insights for cell-derived and cellular products. Curr Opin Biotechnol. 81, 102937 (2023).
- Mu, X., Hur, S. Immunogenicity of in vitro-transcribed RNA. Acc Chem Res. 54 (21), 4012-4023 (2021).
- Cho, E., et al. Mesoporous silica particle as an RNA adsorbent for facile purification of in vitro-transcribed RNA. Int J Mol Sci. 24 (15), 12408 (2023).
- Ziegenhals, T., et al. Formation of dsRNA by-products during in vitro transcription can be reduced by using low steady-state levels of UTP. Front Mol Biosci. 10, 1291045 (2023).
- Höfer, K., Langejürgen, L. V., Jäschke, A. Universal aptamer-based real-time monitoring of enzymatic RNA synthesis. J Am Chem Soc. 135 (37), 13692-13694 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。