Method Article
تحسين تفاعل النسخ في المختبر لإنتاج mRNA باستخدام المراقبة الكروماتوغرافية على الخط
In This Article
Summary
يعد تحسين النسخ في المختبر (IVT) أمرا بالغ الأهمية لإنتاج mRNA الفعال من حيث التكلفة. يوضح هذا البروتوكول بالتفصيل طريقة كروماتوغرافية تحليلية للتحليل الخطي لتفاعل IVT ، ومراقبة استنفاد NTP وإنتاج mRNA في أوضاع الدفعات أو الدفعات الفيدرالية ، والتي تنطبق على طرائق الحمض النووي الريبي المختلفة ، وتعزيز الإنتاجية وتقليل التكاليف.
Abstract
تفاعل النسخ في المختبر (IVT) هو توليف إنزيمي معقد ومتعدد المكونات ل mRNA من قالب DNA خطي ، محفز بواسطة بوليميراز الحمض النووي الريبي ، على سبيل المثال T7. نظرا للتكلفة العالية لكواشف IVT ، يعد IVT خطوة حاسمة في عملية إنتاج مادة عقار mRNA وكان محور التحسين المكثف في هذا المجال. لتقليل تكلفة إنتاج الرنا المرسال ، يجب استخدام الكواشف على النحو الأمثل. يتطلب التحسين الفعال فهما شاملا لتأثير الكواشف الفردية على حركية التفاعل ، أي استهلاك ثلاثي فوسفات النوكليوزيد (NTPs) وإنتاج mRNA. تقليديا ، تم استخدام التقنيات التحليلية منخفضة الإنتاجية ونقطة النهاية لتحليل mRNA. على الرغم من أن هذه الأساليب تعطي معلومات قيمة عن محتوى الرنا المرسال ، إلا أن هناك حاجة إلى تحليلات في الإنترنت في الوقت الفعلي تقريبا لفهم تفاعل IVT بشكل كامل. نوضح كيف يمكن استخدام طريقة تحليلية للكروماتوغرافيا السائلة تفصل NTPs ، بالإضافة إلى pDNA و mRNA ، في الوقت الفعلي تقريبا لدراسة حركية تفاعل IVT. مع معرفة تأثير مكونات IVT المختلفة على الحركية والعائد ، يمكن استخدام التحليل الكروماتوغرافي السريع لتحويل تفاعل IVT الدفعي إلى وضع دفعة فيد يزيد من الإنتاجية ويقلل من التكلفة الإجمالية للتفاعل.
Introduction
حفز جائحة COVID-19 ثورة غير مسبوقة في الطب الحيوي ، مما أدى إلى التطوير السريع والترخيص للقاحات القائمة على mRNA ، مثل BioNTech / Pfizer's Comirnaty و Spikevax من Moderna ، في كل من أوروبا والولايات المتحدة الأمريكية1،2،3. سلطت الفعالية المثيرة للإعجاب والتطور السريع لهذه اللقاحات الضوء على الإمكانات العلاجية الهائلة لتقنية mRNA ، ليس فقط للأمراض المعدية ولكن أيضا للعلاجات المناعية للسرطان ، وعلاجات بدائل البروتين ، والطب التجديدي ، وإعادة برمجةالخلايا 4،5. يؤكد هذا العصر ، الذي يشار إليه غالبا باسم ثورة الرنا المرسال ، على الحاجة إلى عمليات إنتاج mRNA فعالة وفعالة من حيث التكلفة.
يتضمن إنتاج mRNA عمليات وحدة متعددة ، حيث يكون تفاعل النسخ في المختبر (IVT) عملية وحدة حرجة وأكثر كثافة من حيث التكلفة6،7،8. يقوم تفاعل IVT بتصنيع mRNA من قالب DNA باستخدام بوليميراز الحمض النووي الريبي ، وعادة ما يكون بوليميراز T7 RNA ، وثلاثي فوسفات النوكليوزيد (NTPs) في وجود أيونات المغنيسيوم. العملية بسيطة نسبيا وتسمح بإنتاج كميات كبيرة من الرنا المرسال في إطار زمني قصير ، وتحقيق عوائد تفاعل تتراوح من 2-5 جم / لتر في غضون ساعات قليلة وما يصل إلى 14 جم / لتر في بعض التقارير9،10،11. ومع ذلك ، فإن تحسين إنتاجية تفاعل IVT أمر بالغ الأهمية لتقليل تكاليف الإنتاج وضمان قابلية توسع لقاحات وعلاجات mRNA12 ، وبسبب اختلافات التسلسل التي تؤثر على استهلاك NTP ، قد تكون هناك حاجة لكل عائلة بناء أو بناء.
عادة ما يتم تنفيذ التفاعل كعملية مجمعة ، لكن التطورات الحديثة في معالجة الدفعات الفيدرالية والتحليلات عبر الإنترنت فتحت طرقا جديدة لتحسين إنتاج mRNA7،13. يمكن لتفاعلات الدفعات الفيدرالية ، التي تتضمن بلعة أو إضافة مستمرة للكواشف ، أن تطيل أوقات التفاعل وتزيد من الغلة عن طريق منع تثبيط الركيزة وتدهور المنتج المعتمد على العاملالمشترك 14،15.
كان تطوير التحليلات السريعة عبر الإنترنت تقدما كبيرا في مجال IVT ، مما مكن من مراقبة مكونات التفاعل الرئيسية مثل NTPs و mRNA مع الحد الأدنى من التأخر التحليلي13،16 ، مما يضيف بعدا إضافيا لمراقبة IVT ، والتي تركز عادة فقط على تركيز الرناالمرسال 17. تقليديا ، تم تحليل mRNAs باستخدام تقنيات مثل الرحلان الكهربائي لهلام بولي أكريلاميد (PAGE) ، أو الرحلان الكهربائي لهلام الاغاروز ، أو الرحلان الكهربائي الشعري. هذه طرق نقطة النهاية ، وبالتالي ، لا يمكن استخدامها لمراقبة IVT في الوقت الفعلي. بديل للتحليلات الموضحة في هذا البروتوكول هو الطرق التي تستخدم أبتامر الحمض النووي الريبي المضيء وأزواج الصبغة الفلورية. في هذه الطريقة ، يتم تمييز أبتامر الحمض النووي الريبي بالحمض النووي الريبي وتحضنه بصبغة مضان مضيئة. يمكن بعد ذلك تصور نشاط النسخ من خلال شدة التألق17. يتيح ذلك التحليل في الوقت الفعلي لكمية ونوعية mRNA المكتوب أثناء IVT 21 ولكنه لا يسمح بالمراقبة المتزامنة لمكونات IVT الأخرى ، على سبيل المثال ، NTPs. بديل آخر من المحتمل أن يوفر القياس الكمي في الوقت الفعلي ل NTP و mRNA هو التحليل الطيفي Raman18 ، ولكن حتى الآن ، لم يظهر أي تقرير فائدته لمراقبة IVT ، مما يشير إلى أن المزيد من التحسين للطريقة لا يزال مطلوبا لاشتقاق الانتقائية والحساسية اللازمة.
يدعم التطوير المستمر للتحليلات الأسرع والأكثر انتقائية تحسين IVT للحصول على عائد أعلى في أوضاع الدفعات والدفعات الفيدرية. يظل التفاعل عملية معقدة ومتعددة المعلمات مع عوامل تفاعلية متعددة ، والتي قد تختلف الأمثل بين أنواع البناء (على سبيل المثال ، mRNA مقابل saRNA). تركيز ونسبة أيونات Mg2+ و NTPs مؤثرة بشكل خاص ، ويجب موازنة مستوياتها المثلى بعناية لزيادة إنتاجية mRNA مع تقليل تكوين الحمض النووي الريبي المزدوج الشريطة (dsRNA) ، وهو منبه قوي لجهاز المناعة الفطري19،20. في الآونة الأخيرة ، تم الإبلاغ عن تغذية UTP عند مستويات الحالة المستقرة كنهج لتقليل تكوين dsRNA21. ومن شأن مراقبة مستويات UTP في الوقت الفعلي تقريبا أن تضيف مستوى إضافيا من التحكم في العملية.
في هذا البروتوكول ، نوضح كيف يمكن للمراقبة الخطية لتفاعل IVT أن تزيد من إنتاجية إنتاج الرنا المرسال في وضع الدفعات والدفعات التغذية.
Protocol
1. إعداد العازلة
ملاحظة: يجب تحضير جميع المخازن المؤقتة خالية من RNase ، مما يعني أنه يجب استخدام جميع المواد الكيميائية والأواني الزجاجية فقط للعمل الخالي من RNase والتعامل معها بحذر. يجب أن تكون المياه المستخدمة في تحضير العازلة وتنظيف الأواني الزجاجية معتمدة على أنها خالية من النوكلياز. قبل إجراء التجربة ، يجب رش جميع أسطح العمل والأواني الزجاجية بكاشف إزالة التلوث الذي يزيل RNaseses. يجب غسل كاشف إزالة التلوث جيدا بالماء الخالي من RNase قبل استخدام الأواني الزجاجية / منطقة العمل. إذا أمكن ، استخدم المواد الاستهلاكية المعقمة وللاستخدام مرة واحدة فقط.
- تحضير مخازن IVT: قم بإعداد 10x IVT buffer عن طريق إضافة 400 ملي ملي تريس ، 10 ملي مولار DTT ، 20 ملي سبيرميدين ، درجة الحموضة 7.9. قم بإعداد مخزن تخزين مؤقت يحتوي على 100 ملي مولار EDTA ، درجة الحموضة 8. قم بتصفية كل مخزن مؤقت من خلال مرشح PES 0.22 ميكرومتر.
- تحضير المراحل المتنقلة: تحضير المرحلة المتنقلة A (MPA) بإضافة 50 ملي مولار HEPES ، درجة الحموضة 7.0 ، المرحلة المتنقلة B (MPB) بإضافة 50 ملي مولار HEPES ، 100 ملي Na4P2O7 ، درجة الحموضة 8.3 ، المرحلة المتنقلة C (MPC) بإضافة 0.1 M هيدروكسيد الصوديوم ، 1 م كلوريد الصوديوم ، المرحلة المتنقلة D (MPD) بإضافة 0.5 M HEPES ، الرقم الهيدروجيني 7.0. قم بتصفية كل مخزن مؤقت من خلال مرشح PES 0.22 ميكرومتر.
2. تحضير تفاعل النسخ في المختبر (IVT)
ملاحظة 1: يمكن أن يكون تفاعل IVT تفاعلا دفعيا ، حيث تتم إضافة جميع الكواشف في البداية ، ويتوقف التفاعل بعد استنفاد NTPs / يصل إنتاج mRNA إلى هضبة ، أو يمكن أن يكون تفاعلا دفعيا تغذية ، حيث يتم تجديد NTPs المستنفدة ب NTPs إضافية ومع ذلك يزداد إنتاج mRNA بشكل إضافي. يمكن الحصول على قالب pDNA الخطي المستخدم في تفاعل IVT باستخدام إنزيم التقييد الذي ينشق مباشرة بعد تسلسل poly (A) في الحمض النووي البلازميد أو عن طريق تفاعل تفاعل البوليميراز المتسلسل (PCR). في كلتا الحالتين ، يجب أن يتبع التفاعل التنقية ، إما كروماتوجرافي أو باستخدام مجموعات تنقية الحمض النووي التجارية.
- تفاعل IVT دفعي
- اضبط الكتلة الحرارية على 37 درجة مئوية و 300 دورة في الدقيقة. قم بإذابة جميع الكواشف المدرجة في الجدول 1 باستثناء الإنزيمات وتسخينها مسبقا عند 37 درجة مئوية في الكتلة الحرارية. تحضير خليط NTP 25 ملي باستخدام محلول مخزون 100 ملي من ATP و CTP و UTP و GTP.
- أثناء ذوبان الكواشف ، قم بإعداد عينات من الحصص لتجربة الدورة الزمنية. خذ 0.5 مل أنابيب معقمة وماصة 2 ميكرولتر من 100 ملي EDTA في كل أنبوب. ضع علامة على كل أنبوب برقم IVT معين (على سبيل المثال ، IVT001 ، IVT002 ، إلخ) والنقطة الزمنية (على سبيل المثال ، 0 دقيقة ، 15 دقيقة ، 30 دقيقة ، 60 دقيقة ، إلخ).
- عندما يتم إذابة الكواشف وحفظها عند 37 درجة مئوية لمدة 15 دقيقة تقريبا ، قم بإزالة الإنزيمات (T7 RNA Polymerase ، Pyrophosphatase ، Rnase Inhibitor) من الفريزر -20 درجة مئوية واحتفظ بها في مبرد حتى يتم تخزينها مرة أخرى في الفريزر.
- لخلط الكواشف IVT الفردية (باستثناء الإنزيمات) ، استخدم دوامة. امزج الإنزيمات عن طريق سحب العينة برفق لأعلى ولأسفل.
- امزج الكواشف IVT بنسب محددة في التصميم التجريبي (على سبيل المثال ، يظهر بروتوكول IVT العام في الجدول 1) في أنبوب 1.5 مل. عند إجراء تحسين IVT ، يمكن أن يتراوح حجم IVT النهائي بين 50-100 ميكرولتر. عند تصميم الحجم الكلي ل IVT ، ضع في اعتبارك عدد عينات 2 ميكرولتر التي سيتم إخراجها من التفاعل أثناء تجربة الدورة الزمنية. تأكد من أن الحجم الإجمالي للعينات لا يتجاوز 50٪ من إجمالي حجم IVT (على سبيل المثال ، إذا تم أخذ عينات 2 ميكرولتر كل 15 دقيقة لمدة 3 ساعات ، فإن الحجم الإجمالي للحصص المأخوذة هو 30 ميكرولتر ، مما يعني أن الحجم الإجمالي ل IVT يجب أن يكون 60 ميكرولتر كحد أدنى).
- امزج IVTs بعناية ، أضف T7 RNA Polymerase ككاشف أخير. عند إضافة جميع الكواشف ، امزج IVT جيدا عن طريق سحب العينات لأعلى ولأسفل ، ولا تستخدم الدوامة.
- مباشرة بعد إضافة جميع كواشف IVT وتجانسها ، قم بإزالة 2 ميكرولتر من خليط IVT من الأنبوب وقم بتثبيته في أنابيب 0.5 مل معدة مسبقا تحتوي على 2 ميكرولتر من 100 ملي مولار EDTA الموصوفة في الخطوة 2.1.2 (النقطة الزمنية 0 دقيقة).
- ضع أنابيب التفاعل التي تحتوي على مخاليط تفاعل IVT في كتلة حرارية واحتضنها عند 37 درجة مئوية.
- اضبط المؤقت على الفواصل الزمنية المطلوبة (على سبيل المثال ، 15 دقيقة / 30 دقيقة). في كل نقطة زمنية ، خذ 2 ميكرولتر من عينة IVT من كل مخاليط تفاعل IVT محضرة وماصتها في أنبوب معد مسبقا (انظر الخطوة 2.1.2) يحتوي على 2 ميكرولتر من 100 ملي مولار EDTA. سيتم استخدام هذه الاقتباسات للتحليل الكروماتوغرافي (انظر الخطوة 3).
- بعد أن يؤكد التحليل الكروماتوغرافي الاستنفاد الكامل ل NTPs ، قم بإخماد تفاعلات IVT السائبة مع EDTA إلى تركيز نهائي يبلغ 50 ملي مولار (على سبيل المثال ، 30 ميكرولتر من IVT غير نشط مع 30 ميكرولتر من 100 ملي مولار EDTA).
- تفاعل IVT دفعة الاحتياطي الفيدرالي
ملاحظة: يمكن زيادة إنتاج mRNA بشكل إضافي عن طريق إضافة NTPs و Mg2+ أيونات بعد استنفاد NTPs.- امزج تفاعل IVT الدفعي وأخذ عينات منه كما هو موضح في الخطوة 2.1. تحضير تغذية NTP + MgCl2 للدفعة التغذية. للتحضير ، على سبيل المثال 500 ميكرولتر من خليط NTP + MgCl2 ، اخلطي 106 ميكرولتر من كل 200 ملي NTP ، و 76.25 ميكرولتر من 1 M MgCl2 و 5.5 ميكرولتر من ddH2O. التركيزات النهائية في الخليط هي 42.4 ملي مولار لكل NTP و 152.5 ملي مللي كلوريد2.
- مراقبة استهلاك NTP باستخدام التحليلات الخطية الموضحة في الخطوة 3. عندما تؤكد التحليلات الخطية أن تركيز NTP ينخفض إلى أقل من 10٪ من تركيز البداية ، أضف التغذية التي تحتوي على NTP + Mg2 + إلى IVT السائبة.
- قم بقياس / حساب الحجم الدقيق لتفاعل IVT السائب المتبقي في أنبوب 1.5 مل بعد أخذ جميع الحصص للتحليلات. أضف حجما مناسبا من خليط NTP + MgCl2 إلى IVT بحيث يكون التركيز النهائي 4 ملي مولار من كل NTP و 12 ملي مولار من MgCl2. على سبيل المثال ، بالنسبة ل 80 ميكرولتر من IVT السائبة المتبقية في أنبوب 1.5 مل ، أضف 16.8 ميكرولتر من خليط NTP + MgCl2 .
- تابع أخذ العينات كما هو مكتوب في الخطوة 2.1. بعد استنفاد NTPs مرة أخرى، كرر القسم 2.2.2. استمر في التغذية وأخذ العينات حتى يتم تحقيق إنتاج mRNA المطلوب.
- بعد تحقيق إنتاج mRNA المطلوب ، قم بتعطيل التفاعل بأكمله كما في الخطوة 2.1.10.
3. إعداد التحليل الكروماتوغرافي
- إعداد اختبار ملاءمة النظام وقياسي (SST)
- قم بإعداد SST من خلال الجمع بين كاشف السد و NTPs وقالب pDNA و mRNA. تأكد من أن التركيزات النهائية تبلغ حوالي 3 ميكرومتر لكاشف السد ، و 5 ميكرومتر لكل NTP ، و 4 نانوغرام / ميكرولتر لقالب pDNA ، و 10 نانوغرام / ميكرولتر ل mRNA. تأكد من أن SST النهائي يحتوي على 0.1 M كلوريد الصوديوم.
- قم بإعداد منحنى معايرة جديد قبل كل تحليل. قم بإنشاء معيار المعايرة عن طريق تخفيف عينة mRNA منقاة بتركيز معروف باستخدام MPA. يجب أن تكون نقاط المعايرة 0.5 نانوغرام / ميكرولتر ، 2 نانوغرام / ميكرولتر ، 5 نانوغرام / ميكرولتر ، 10 نانوغرام / ميكرولتر ، 15 نانوغرام / ميكرولتر ، و 20 نانوغرام / ميكرولتر ، كل منها بتركيز نهائي قدره 0.1 متر كلوريد الصوديوم.
- إذا لزم الأمر، قم بإعداد منحنى معايرة لجميع NTPs. تأكد من أن التركيزات النهائية لكل NTP في معايير المعايرة هي 0.5 ميكرومتر و2 ميكرومتر و5 ميكرومتر و10 ميكرومتر و15 ميكرومتر و20 ميكرومتر.
- تكييف العمود والتحضير للتحليل
- قم بموازنة عمود تحليلي 0.1 مل في درجة حرارة الغرفة لمدة 12 ساعة قبل التحليل. قم بتوصيل العمود بنظام الكروماتوغرافيا في الاتجاه الموضح على مبيت العمود.
- اغسل العمود بمعدل تدفق 1 مل / دقيقة: أولا ب 50 وحدة تخزين عمود (CV) من ddH2O وبعد ذلك ب 50 سيرة ذاتية من MPA.
- قم بتشغيل 3 عينات فارغة على الأقل (حقن MPA فقط) قبل التحليل لتعيين الخط الأساسي. استخدم الطريقة الكروماتوغرافية الموضحة في Skok et al.15.
- بمجرد أن يكون خط الأساس مستقرا ويكون قياسان فارغان متتاليان قابلين للمقارنة (خط الأساس القابل للتكرار) ، تابع تشغيل عينة SST وعينات منحنى المعايرة.
- إذا تم استيفاء معايير SST وكان الفصل بين كاشف السد و NTPs مرضيا ، فتابع تحليل عينات IVT. بعد تحليل جميع عينات IVT ، قم بحقن معيار SST مرة أخرى للتأكد من أن ظروف النظام ظلت مستقرة طوال التحليل.
- تحضير العينة
ملاحظة: يتم تحضير عينات للتحليل الكروماتوغرافي مباشرة قبل التحليل. خلاف ذلك ، يتم حفظ العينات في الفريزر عند -20 درجة مئوية (24 ساعة كحد أقصى) أو <-65 درجة مئوية (أكثر من 24 ساعة).- قبل التخفيف للتحليل الكروماتوغرافي ، قم بتدوير الدوامة وتدوير عينة IVT المروية. قم بتحليل جميع عينات IVT المعطلة ب EDTA (انظر الخطوة 2.1.9) باستخدام التحليل الكروماتوغرافي باستخدام الطريقة الموضحة في Skok et al.15.
- قبل التحليل ، قم بتخفيف عينات IVT لتحقيق التركيز داخل منحنى المعايرة. استخدم نفس عامل التخفيف طوال تجربة الدورة التدريبية الزمنية للتأكد من إمكانية مقارنة مناطق NTP لتحديد وقت استنفاد NTP.
- لتحديد الحد الأدنى من التخفيف المطلوب لعينات IVT ، استخدم الصيغة التالية: التخفيف المطلوب = (تركيز الرنا المرسال النهائي المتوقع) / (التخفيف أثناء التنشيط) / (أعلى معيار معايرة)
على سبيل المثال ، إذا كان من المتوقع إنتاج mRNA بمقدار 8 مجم / مل في IVT ، فسيكون التركيز في العينة المروية 4 مجم / مل. لتحقيق التركيز داخل منحنى المعايرة ، قم بتخفيف العينة 200 ضعف.
التخفيف المطلوب = (8000 نانوغرام / ميكرولتر]) / 2 / (20 نانوغرام / ميكرولتر) = 200 - ماصة MPA و 4 M كلوريد الصوديوم في قارورة زجاجية مخروطية الشكل. تأكد من أن التركيز النهائي لكلوريد الصوديوم في العينة هو 100 ملليمتر. أخيرا ، أضف عينة IVT المروية.
- أعدت Vortex العينة وأدخلها في جهاز أخذ العينات الآلي لتحليلها. اضبط درجة حرارة جهاز أخذ العينات التلقائي على 4 درجات مئوية.
- حقن 100 ميكرولتر من العينات المخففة في العمود التحليلي. قم بقياس الامتصاص A260 و A280 لكل عينة IVT.
- لتحليل العينات ذات التركيزات المعروفة ، أو إذا لم يكن تتبع استهلاك NTP بناء على اختلافات المنطقة مطلوبا ، فقم بتخفيف العينات لتحقيق تركيز مستهدف يبلغ 10 نانوغرام / ميكرولتر.
4. القياس الكمي للعينة وتحليل البيانات
- قبل دمج كل عينة IVT ، اطرح العينة الفارغة من عينة كروماتوجرام.
- قم بدمج جميع قمم NTP و pDNA و mRNA عند A260 واستخدم مناطق الذروة لحساب تركيزات NTPs و mRNA في IVT.
ملاحظة: بدلا من ذلك ، يمكن استخدام مناطق الذروة لمقارنة النسبة المئوية لكل NTP المتبقية في تفاعل IVT ، بشرط أن يكون عامل التخفيف متسقا عبر جميع النقاط الزمنية. - بناء على تركيزات mRNA / NTP ، التي يتم تحديدها بواسطة التحليل الكروماتوغرافي الخطي ، حدد ما إذا كان يمكن تعطيل IVT أو ما إذا كان يجب تغذية NTPs إضافية في تفاعل IVT (انظر الخطوة 2).
النتائج
يمكن استخدام التحليل الكروماتوغرافي الموصوف في هذا البروتوكول إما لتحسين IVT أو لتحويل تفاعل IVT دفعي إلى تفاعل دفعة فيدرالية (الشكل 1).
لاختبار تأثير تركيبات العازلة المختلفة على حركية تفاعل IVT ، تم خلط ثلاثة تفاعلات IVT مختلفة وفقا للبروتوكول المكتوب في الجدول 2. تمت مقارنة المخزن المؤقت المحتوي على تريس ، حيث تم تعديل الأس الهيدروجيني باستخدام حمض الهيدروكلوريك ، مع مخزن تريس المؤقت ، حيث تم تعديل الأس الهيدروجيني بحمض الخليك. علاوة على ذلك ، تمت مقارنة كل من المخازن المؤقتة Tris مع المخزن المؤقت HEPES ، حيث تم تعديل الأس الهيدروجيني باستخدام هيدروكسيد الصوديوم. كان كل تكوين 1x IVT المخزن المؤقت 40 ملي مولار تريس / HEPES ، و 10 ملي مولار DTT ، و 2 ملي سبيرميدين ، ودرجة الحموضة 7.9.
من 100 ميكرولتر من مزيج تفاعلات IVT ، تم إخراج 2 ميكرولتر من عينة IVT من تفاعل IVT وإخمادها ب 2 ميكرولتر من 100 ملي مولار EDTA كل 15 دقيقة في الساعة الأولى من الحضانة ثم كل 30 دقيقة حتى 180 دقيقة من الحضانة. كان عائد mRNA النهائي المتوقع لحالة التفاعل هذه 15 مجم / مل ، مما يعني أن التخفيف بمقدار 2 ضعفا بسبب التبريد تبعه تخفيف 400 مرة في MPA + NaCl للتحليل. تم تخفيف العينة بمقدار 800 ضعف في المجموع ، مما يعني أنه حتى عند إنتاج 15 مجم / مل ، كان تركيز الرنا المرسال المحمل على العمود الكروماتوغرافي التحليلي لا يزال ضمن تركيزات منحنى المعايرة.
تم دمج مناطق NTP و mRNA في A260 لكل عينة فردية في كل نقطة زمنية فردية (tx). ثم تم تحويل المناطق إلى تركيزات ل mRNA ، باستخدام منحنى معايرة mRNA ونسبة الاستهلاك ل NTPs ، باستخدام منطقة A260 من NTPs في 0 دقيقة (t0) ك100٪ (انظر المعادلة أدناه).
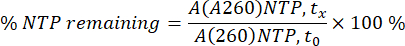
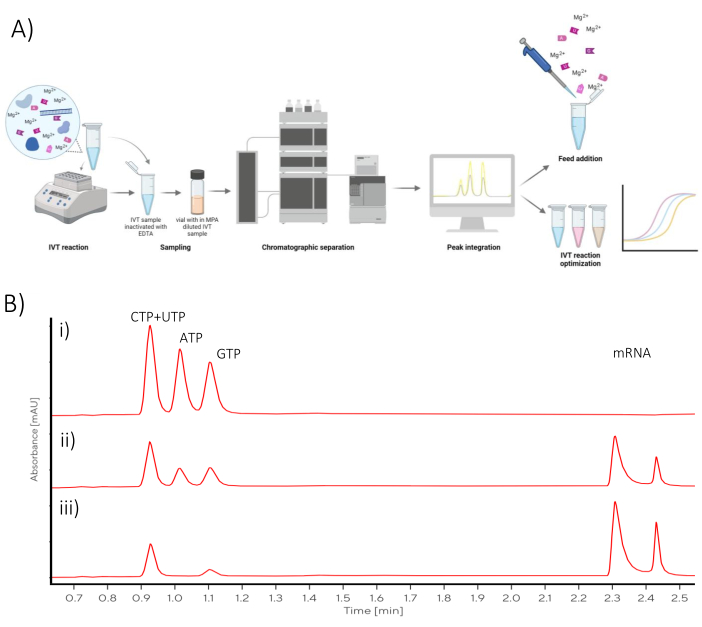
يمكن عرض النتائج كرسوم بيانية لكل تفاعل IVT فردي ، حيث يظهر الوقت على المحور x وتركيز mRNA وتظهر NTPs المتبقية على المحور y (الشكل 2 أ). يمكن أيضا رسم جميع IVT ، مما يعني تركيزات mRNA في الاعتماد على الوقت ، معا في رسم بياني واحد ، ويمكن دراسة حركية إنتاج mRNA واختيار ظروف IVT المثلى (الشكل 2 ب).
بالنسبة لتجربة الدفعة الفيدرالية ، تم خلط IVT كما هو مكتوب في الجدول 3. من 300 ميكرولتر من مزيج تفاعل IVT ، تمت إزالة 2 ميكرولتر من عينة IVT من تفاعل IVT وإخمادها ب 2 ميكرولتر من 100 ملي مولار EDTA كل 30 دقيقة. بالإضافة إلى ذلك ، تم أخذ العينة مباشرة بعد كل إضافة مجمعة NTP + MgCl2 . تم تحضير محلول علف يحتوي على 42.4 ملي مولار من كل NTP و 152.5 ملي ملي كلوريد2 مسبقا ، وتم خلط 106 ميكرولتر من كل 200 ملي NTP مع 76.2 ميكرولتر من 1 M MgCl2. تم إنشاء نظام تغذية ، حيث تمت إضافة علف البلعة كل ساعة (في 60 دقيقة و 120 دقيقة و 180 دقيقة و 240 دقيقة من الحضانة). تم وصف نظام التغذية في الجدول 3 تم تحليل العينات في الوقت الفعلي تقريبا باستخدام التحليلات كما هو موضح لتفاعل IVT بالجملة. بعد 300 دقيقة من المراقبة ، تم إخماد تفاعل IVT.
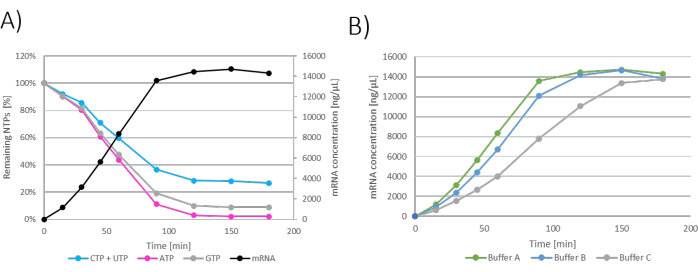
يمكن إظهار النتائج على أنها إنتاج NTPs / mRNA المتبقي بمرور وقت الحضانة. نظرا لأن إضافات تغذية البلعة تخفف أيضا من تفاعل IVT ، فإن تركيز mRNA في IVT ينخفض عند كل إضافة تغذية (الشكل 3 أ). يمكن أيضا قياس الزيادة في كتلة الرنا المرسال وتقديمها بواسطة عوامل النسخ (المعرفة على أنها mmRNA / mpDNA) ، مما يدل على زيادة خطية في إنتاج mRNA بمرور الوقت (الشكل 3 ب).
الشكل 1: نظرة عامة تخطيطية (أ) تمثيل سير عمل تحسين IVT مع التحليل الكموماتوغرافي الخطي ل NTPs و mRNA. (ب) الكروماتوغرامات التمثيلية لتفاعل IVT دفعي تم أخذ عينات منه عند (i) t0 ، (ii) نقطة المنتصف ، (iii) النقاط الزمنية للتفاعل النهائي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: الرسوم البيانية IVT الدفعية. (أ) رسم بياني تمثيلي لتفاعل IVT مع إنتاج mRNA واستهلاك NTP على المحور y. هضبة تركيز الرنا المرسال مرئية عند 120 - 180 دقيقة من الحضانة والتي ترتبط باستهلاك NTP حيث يتم استهلاك NTP (ATP) في 120 دقيقة. (ب) الرسم البياني IVT يوضح تأثير المخزن المؤقت IVT على حركية IVT. أظهر IVT المحتوي على Buffer A (Tris + acidic acid) أسرع إنتاج mRNA ، يليه Buffer B (Tris + HCl) و Buffer C (HEPES + NaOH) باعتباره الأبطأ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الرسم البياني IVT لدفعة الاحتياطي الفيدرالي. (أ) الرسم البياني IVT حيث تمت إضافة تغذية NTP + MgCl2 عند 60 و 120 و 180 و 240 دقيقة. (ب) الزيادة في كتلة الرنا المرسال التي يظهر بها عامل النسخ تكون خطية طوال فترة حضانة التفاعل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: بروتوكول IVT العام. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: بروتوكول IVT الدفعي. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: بروتوكول IVT الدفعة الفيدرالي. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
في هذه الطريقة ، يتم تحليل عينات IVT في نقاط زمنية مختلفة أثناء الحضانة باستخدام عمود كروماتوغرافي تحليلي متعدد الوسائط يفصل NTPs و pDNA و mRNA ، مما يسمح بمراقبة دقيقة لاستهلاك NTP وإنتاج mRNA. تقيس هذه الطريقة تركيز NTPs و mRNA بطريقة كمية بناء على التغييرات في مناطق A260 في نقاط زمنية محددة. نظرا لأن الطريقة توفر معلومات عن تركيز NTP و mRNA ، فهي مناسبة للغاية لتحسين IVT ، حيث يكون الهدف الأساسي غالبا هو زيادة إنتاجية mRNA وتقليل وقت التفاعل. لذلك ، فإن فهم تأثير كواشف IVT المختلفة على حركية إنتاج الرنا المرسال أمر بالغ الأهمية22. نوضح كيف يمكن تطبيق المراقبة عبر الإنترنت لتحسين تفاعل IVT في أوضاع الدفعات والدفعات الفيدرية.
الميزة الرئيسية لهذه الطريقة هي التحليل الخطي الذي يسمح بمراقبة IVT في الوقت الفعلي تقريبا حيث يتم تحليل كل عينة في أقل من 8 دقائق. يعد تحضير العينات للتحليلات أمرا بسيطا ، حيث لا يلزم سوى التخفيف في MPA دون أي معالجة مسبقة للعينة. حجم العينة المطلوب للتحليل منخفض جدا ، على سبيل المثال ، 1 ميكرولتر من IVT. يمكن أن يؤدي حجم سحب العينات الصغير هذا إلى انحرافات تحليلية بسبب أخطاء سحب العينات. ومع ذلك ، نظرا لأن الإنتاجية العالية للنهج التحليلي تسمح بقياسات ثلاثية ، يمكن التعرف بسهولة على القيم المتطرفة ، وليس من الصعب اكتشاف الانحرافات عن المنحنى الحركي المتوقع.
أحد قيود الطريقة هو الشطف الكروماتوغرافي ل UTP و CTP. عادة ما يكون القياس الكمي الدقيق ل UTP و CTP ضروريا لأن NTP المحدد في تسلسل mRNA غالبا ما يكون إما ATP أو GTP. إذا كان القياس الكمي المنفصل ل UTP و CTP مطلوبا ، فيمكن تسخير الفرق في امتصاص الأشعة فوق البنفسجية عند 260 نانومتر و 280 نانومتر ل UTP و CTP لاشتقاق الوفرة النسبية لكل NTP في الذروة الكروماتوغرافية.
لا تفصل هذه الطريقة التحليلية بين أنواع الحمض النووي الريبي التي يزيد طولها عن 100 نيوكليوتيد. لذلك ، لا يمكن استخدامه للكشف عن الاختلافات في جودة mRNA ، على سبيل المثال ، لا يفرق بين mRNA غير متعدد الأدينيل ومتعدد الأدينيل ، بين dsRNA أو النصوص المجهضة و ssRNA وهو غير مناسب لدراسات الاستقرار لأنه لا يمكنه التفريق بين mRNA المتدهور وغير المتدهور. ومع ذلك ، يمكن استخدام الطريقة للقياس الكمي لطرائق الحمض النووي الريبي الأخرى ، مثل circRNA و tRNA و saRNA. على الرغم من أن هذه الجزيئات تختلف في الحجم والهيكل ، إلا أنه يمكن استخدام نفس الطريقة التحليلية لدراسة عوائد الإنتاج لكل منها في تفاعل IVT.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا توماس كوستيليك ، وبلاش باكالار ، بافلين ، وأندريا جراماك ليفك ، وأنزي مارتينتشيتش سيلجار على المناقشات المفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm PES membrane filter, e. g. Sartolab BT 500 | Sartorius | 180E14---------E | |
| 0.5 mL plastic tubes; e. g. e. g. DNA LoBind, PCR clean | Eppendorf | 30108035 | |
| 1.5 mL plastic tubes; e. g. DNA LoBind, PCR clean | Eppendorf | 30108051 | |
| ATP Solution | MEBEP BIOSCIENCE | R1331T2 | |
| Benchtop cooler -20 °C | Brand | 114935 | |
| CIMac PrimaS 0.1 mL Analytical Column (2 µm) | Sartorius BIA Separations | 110.5118-2, 2 µm channels | |
| CTP Solution | MEBEP BIOSCIENCE | R3331T2 | |
| DTT | Sigma | 10197777001 | |
| EDTA-Na2 x 2H2O | Kemika | e.g. 11368 08 | |
| GTP Solution | MEBEP BIOSCIENCE | R2331T2 | |
| HEPES | Merck | 1.10110.1000 | |
| HPLC high recovery vial | Macherey-Nagel | 702860 | |
| MgCl2 | Invitrogen | AM 9530G | |
| Microvolume spectrophotometer | Thermo Scientic | Nanodrop | |
| mRNA standard, mFix4, 4000 nt | Sartorius BIA Separations | BIA-mFix4.1.1 | |
| Na4P2O7 + 10 H2O | Sigma | S6422-500G | |
| NaCl | Fluka | 31434-1KG-M | |
| NaOH | Merck | 1064691000 | |
| PATfix mRNA analytical platform | Sartorius BIA Separations | PAT0021 | |
| Pipette 100 – 1000 μL | Eppendorf | Reference 2 | |
| Pipette 2 – 10 μL | Eppendorf | Reference 2 | |
| Pipette 20 – 200 μL | Eppendorf | Reference 2 | |
| Pyrophosphatase | MEBEP BIOSCIENCE | M2403L | |
| Rnase Away Decontamination Reagent | Thermo Scientic | 10328011 | |
| RNAse inhibitor | MEBEP BIOSCIENCE | RNK3501 | |
| Spermidine | Sigma | 85558-5G | |
| T7 mRNA polymerase | MEBEP BIOSCIENCE | TR01 | |
| Thermoblock | Thermo Scientic | EPPE5382000.015 | |
| Trizma Base | Sigma | T6066-1KG | |
| UTP Solution | MEBEP BIOSCIENCE | R5331T2 | |
| Vial caps | Macherey-Nagel | 70245 | |
| Vortex | IKA | V1900 |
References
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol. 40, 840-854 (2022).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 384 (5), 403 (2021).
- Lopez Bernal, J., et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 385 (7), 585-594 (2021).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. mRNA-based therapeutics - developing a new class of drugs. Nat Rev Drug Discov. 13, 759-780 (2014).
- Baptista, B. R., Carapito, N., Pichon, C., Sousa, F. mRNA, a revolution in Biomedicine. Pharmaceutics. 13, 2090 (2021).
- Rosa, S. S., Prazeres, D. M. F., Azevedo, A. M., Marques, M. P. C. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 39, 2190 (2021).
- Whitley, J., et al. Development of mRNA manufacturing for vaccines and therapeutics: mRNA platform requirements and development of a scalable production process to support early phase clinical trials. Transl. Res. 242, 38-55 (2022).
- Kis, Z., Kontoravdi, C., Shattock, R., Shah, N. Resources, production scales and time required for producing RNA vaccines for the global pandemic demand. Vaccines. 9 (1), 3 (2021).
- Hengelbrock, A., Schmidt, A., Helgers, H., Vetter, F. L., Strube, J. Scalable mRNA machine for regulatory approval of variable scale between 1000 clinical doses to 10 million manufacturing scale doses. Processes. 11, 745 (2023).
- Rosa, S. S., et al. Maximizing mRNA vaccine production with Bayesian optimization. Biotechnol Bioeng. 119 (11), 3127-3139 (2022).
- Sari, Y., Sousa, S. S., Jeffries, J., Marques, M. P. C. Comprehensive evaluation of T7 promoter for enhanced yield and quality in mRNA production. Sci Rep. 14, 9655 (2024).
- Kumar, A., et al. The mRNA vaccine development landscape for infectious diseases. Nat Rev Drug Discov. 21 (5), 333-334 (2022).
- Pregeljc, D., et al. Increasing yield of in vitro transcription reaction with at-line high pressure liquid chromatography monitoring. Biotechnol Bioeng. 120 (3), 737-747 (2023).
- Kern, J. A., Davis, R. H. Application of a fed-batch system to produce RNA by in vitro transcription. Biotechnol Prog. 15 (2), 174-184 (1999).
- Skok, J., et al. Gram-Scale mRNA Production Using a 250-mL Single-Use Bioreactor. Chemie Ingenieur Technik. 94 (12), 1928-1935 (2022).
- Welbourne, E. N., et al. Anion exchange HPLC monitoring of mRNA in vitro transcription reactions to support mRNA manufacturing process development. Front Mol Biosci. 11, 1250833 (2024).
- Lee, K. H., Song, J., Kim, S., Han, S. R., Lee, S. W. Real-time monitoring strategies for optimization of in vitro transcription and quality control of RNA. Front Mol Biosci. 10, 1229246 (2023).
- Matuszczyk, J. C., et al. Raman spectroscopy provides valuable process insights for cell-derived and cellular products. Curr Opin Biotechnol. 81, 102937 (2023).
- Mu, X., Hur, S. Immunogenicity of in vitro-transcribed RNA. Acc Chem Res. 54 (21), 4012-4023 (2021).
- Cho, E., et al. Mesoporous silica particle as an RNA adsorbent for facile purification of in vitro-transcribed RNA. Int J Mol Sci. 24 (15), 12408 (2023).
- Ziegenhals, T., et al. Formation of dsRNA by-products during in vitro transcription can be reduced by using low steady-state levels of UTP. Front Mol Biosci. 10, 1291045 (2023).
- Höfer, K., Langejürgen, L. V., Jäschke, A. Universal aptamer-based real-time monitoring of enzymatic RNA synthesis. J Am Chem Soc. 135 (37), 13692-13694 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved