Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Цифровая планиметрия для оценки кинетики закрытия раны на мышиной модели
В этой статье
Резюме
Раны представляют собой глобальную проблему здравоохранения. В рамках этого исследования была разработана стандартизированная фотокабина с использованием цифровой планиметрии для минимизации вариабельности измерений раны. Мониторинг ран у мышей в течение 14 дней выявил первоначальное увеличение площади раны и периметра с последующим постепенным закрытием. Эта методология может помочь в оценке кинетики закрытия раны в доклинических моделях.
Аннотация
Хронические раны, из-за их высокой распространенности, представляют собой серьезную глобальную проблему для здравоохранения. Эффективные терапевтические стратегии позволяют значительно ускорить заживление, тем самым снижая риск осложнений и облегчая экономическую нагрузку на системы здравоохранения. Несмотря на то, что заживление ран изучалось в многочисленных экспериментальных исследованиях, большинство из них основаны на качественных наблюдениях или количественных прямых измерениях. Целью данного исследования была стандартизация метода косвенного измерения раны с использованием цифровой планиметрии, включающей цифровое масштабирование и сегментацию. Такой подход устраняет проблему отсутствия подробных, пошаговых методологий точной оценки раны. Была спроектирована и изготовлена кабина для фотодокументации, а также использованы компьютерные инструменты цифровой планиметрии для минимизации вариабельности в измерениях площади раны, периметра и расстояния от центра раны до ее краев. Циркулярная травматическая рана (5 мм в диаметре) была создана на тыльной средней линии на уровне лопаток у самцов мышей CD1 (n = 4, 10 недель, 30-35 г). Эволюция раны фотографировалась в течение 14 дней с помощью специально разработанной фотокабины, которая контролировала условия освещения, фокусное расстояние и позиционирование объекта. Масштабирование и измерения ран выполняли с помощью сегментации в программном обеспечении ImageJ, а статистический анализ проводили с помощью программного обеспечения для статистического анализа. Кинетика закрытия раны показала небольшое увеличение размера и периметра раны между 0-м и 2-м днем, за которым следовало постепенное снижение до полного закрытия к 14-му дню. Кабина для фотодокументации и компьютерная цифровая планиметрия позволили проводить количественные измерения с минимальной вариативностью. В заключение следует отметить, что эти инструменты обеспечивают надежный и воспроизводимый метод оценки кинетики закрытия раны в доклинических моделях.
Введение
Заживление травматических ран занимает примерно 21 день и имеет четко определенную последовательность из четырех различных фаз: (1) гемостаз, (2) воспаление, (3) пролиферация и (4) ремоделирование1. Если какая-либо фаза заживления раны затягивается, это может привести к развитию хронических ран1. Из-за их высокой распространенности, потенциальных осложнений и значительного экономического бремени они считаются глобальной проблемой здравоохранения.
Доклинические исследования направлены на достижение более быстрого заживления за счет содействия комплексной реэпителизации раны 3,4,5, предотвращения осложнений и снижения затрат на лечение. В этих исследованиях оцениваются различные стратегии, включая разработку биоматериалов, фармакологические вмешательства и другие процедуры регенеративной медицины 6,7,8,9.
Разработано множество экспериментальных моделей для изучения травматических ран. Некоторые из них сосредотачиваются на макроскопически видимых качественных характеристиках, таких как размер, показатели воспаления, наличие грануляционной ткани, выделения и образование струпа5. Другие анализируют количественные данные, включая площадь, периметр, радиус, диаметр, цвет, глубину и расстояния от центра до краев раны.
В связи с этим в большинстве исследований in vivo напрямую измеряется радиус и глубина раны. Тем не менее, ручное очерчивание краев раны на макроскопическом изображении может привести к смещению при измерении10. В других исследованиях используется механическая планиметрия с использованием прозрачных сетчатых пластиковых листов, где предварительно очерчены края раны; В обоих случаях для определения площади или периметра требуются ручные инструменты, такие как линейки или цифровые планиметры. В настоящее время компьютерная цифровая планиметрия позволяет проводить компьютерный анализ макроскопических изображений ран или пластиковых листов. Манипуляции in situ и качество макроскопического изображения являются ограничением, однако этот инструмент 11,12,13,14 значительно снижает вариативность между измерениями площади и периметра.
Предлагаемая методология имеет значительные преимущества по сравнению с существующими методами оценки закрытия раны у мышей 15,16,17,18,19,20. В то время как фотодокументирование считается точным и последовательным инструментом для оценки кинетики закрытия раны, предыдущие исследования21,22 выявили ограничения ручного измерения раны, такие как смещение наблюдателя и вариабельность из-за непостоянного освещения и расположения камеры. Текущий подход решает эти проблемы за счет стандартизации условий визуализации с помощью специально построенной кабины, что повышает воспроизводимость и точность. Кроме того, компьютеризированная цифровая планиметрия позволяет проводить более точные количественные оценки, улучшая оценку терапевтических вмешательств и сводя к минимуму ошибки измерения, о чем свидетельствуют другие исследования, сравнивающие ручные и цифровые методы12,22, что делает ее особенно подходящей для изучения кинетики закрытия раны на мышиных моделях, позволяя точно оценивать лечение за счет поддержания строгого контроля над условиями получения изображений.
протокол
Все экспериментальные процедуры с участием лабораторных мышей проводились в соответствии с этическими стандартами и правилами, установленными в Официальном мексиканском стандарте (NOM-062-ZOO-1999) по обращению с лабораторными животными и уходу за ними. Протокол был рассмотрен и одобрен Внутренним комитетом по уходу за лабораторными животными и их использованию (CICUAL) Национального института ядерных исследований (ININ) под номером CICUAL-01-23. В данном исследовании использовались самцы мышей CD1 (n = 4) в возрасте 10 недель с массой тела от 28 до 32 г. Все животные были отобраны таким образом, чтобы обеспечить однородность по штамму, возрасту, полу и массе тела, сводя к минимуму вариабельность результатов эксперимента. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Строительство фотокабины для получения макроскопических изображений
ПРИМЕЧАНИЕ: Лицензионное программное обеспечение SolidWorks (версия 2015) использовалось для проектирования фотокабины с целью устранения внешних источников освещения. Куб размером 40 см × 40 см был сконструирован с использованием белого алюминиевого профиля толщиной в один дюйм. Куб состоял из трех секций, собранных последовательно: крыши, боковых стен и пола (рис. 1А).
- Строительство кровли
ПРИМЕЧАНИЕ: Крыша была регионализирована как передний край (A), задний край (B) и боковые края (C и D) для ориентации (Рисунок 1B).- Закрепите на внутренней поверхности бокового края крыши (C и D) прорезной алюминиевый профиль (предназначенный для удержания стекла) шириной 1,5 см, толщиной 2,51 см и длиной 34,9 см (рисунок 1B).
- Поместите две прямоугольные алюминиевые пластины длиной 34,5 см и шириной 13 см с полиэтиленом в центре в паз каждого профиля крыши (пластина 1 и 2 на рисунке 1C), чтобы обеспечить продвижение через паз обоих профилей.
- Установите светодиодную трубку RGB диаметром 20 см с диапазоном цветовой температуры 2500-9000 К (рис. 1C) под углом 45° на нижний край панели 1 с помощью двустороннего скотча.
- Установите на панели крыши 1 и 2 прямоугольную панель из пенопласта размером 32 см x 12 см с центральным круглым вырезом диаметром 7,82 см для установки объектива камеры (рис. 1C).
- Устройство пола
- Поместите квадратный кусок белой пенопластовой плиты размером 40 см х 40 см поверх профилей пола. Вырежьте квадраты со стороной 2,54 см с каждого угла пенокартона (рисунок 1E).
- Строительство боковых стен
- Вырежьте четыре четырехугольные панели из пенопласта размером 40 см х 40 см.
- Склейте две панели силиконом с боков C и D, чтобы сформировать левую и правую боковые стенки (рисунок 1F).
- Прикрепите застежки-липучки к алюминиевым профилям A и B для облегчения манипуляций с внутренними элементами фотобудки. Дополнительно прикрепите в 1 см от края линию клеевых креплений к двум квадратам из пенокартона с одной стороны, и разместите их на передней и задней стенках (рисунок 1F).
- Построение эталонной базы
ПРИМЕЧАНИЕ: Эталонная база была необходима для поддержания мыши в положении лежа во время анестезии и на протяжении всего документирования развития раны. 3D-компоненты были спроектированы и изготовлены с использованием метода моделирования методом наплавления (FDM) с материалом PLA и 3D-принтером 23,24.- Напечатайте на 3D-принтере маску с основанием 2 см в ширину, длину и высоту и поместите ее на расстоянии 11,5 см от края предварительно вырезанного прямоугольника из белого пенопласта размером 40 x 28 см, чтобы мыши находились под ингаляционной анестезией (рис. 1D, красный цвет).
- Напечатайте на 3D-принтере прямоугольную платформу (9 см в длину, 5 см в ширину, 2,5 см в высоту) с четырьмя вытянутыми областями для выравнивания тыльной стороны мыши во время получения изображения. Эти области поддерживали голову, конечности и брюшную область для поддержания положения лежа. Приклейте эту платформу к центру опорной основы (рисунок 1D, зеленый цвет).
- Напечатайте на 3D-принтере блок линейки (шириной 2 см, длиной 8 см, высотой 2,5 см) и закрепите его на расстоянии 1 см от левой стороны основания мыши, чтобы разместить измерительный контрольный элемент, необходимый для цифровой обработки изображений (рисунок 1D, синий цвет).
- Прикрепите к блоку линейки градуированную линейку из нержавеющей стали диаметром 15 см и установите всю опорную базу внутри кабины для масштабирования изображения (Рисунок 1D).
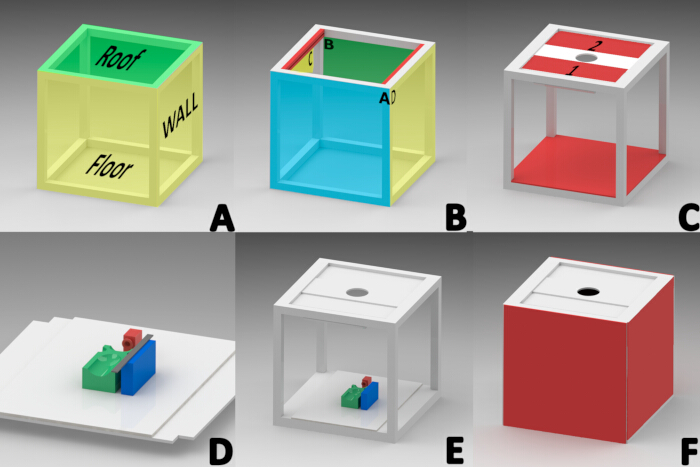
Рисунок 1: Схема конструкции шкафа для получения макроскопических изображений. (А) Секции кабины (крыша, боковые стены, пол). (В)Ориентация профилей, образующих кровлю; спереди (A), сзади (B) и по бокам (внутренняя сторона профилей красного цвета «C,D»). (C) Панели крыши 1 и 2, установка светодиодной лампы, линзовой пластины камеры и установка пола. (D) Установка маски для анестезии (RED), платформы для мыши (GREEN) и прямоугольной платформы для позиционирования измерительной линейки (BLUE) на опорном основании. (Д) Окончательное местоположение опорной базы. (F) Установка боковых, передних и задних стенок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Содержание животных
- Получите разрешение от комитета по биоэтике учреждения на проведение испытаний на животных. Используйте мышей CD1 (n = 4), возрастом 10 недель, массой 28-32 г.
- Содержание мышей в стандартных условиях: поддержание температуры 21 °C, 12/12 часов циклов света/темноты, 45% влажности и обеспечение свободного доступа к воде и пище, за исключением сеансов фотосъемки.
3. Образование травматической раны
- Голодайте на мышах в течение 8 часов до процедуры. Обезболить мышей внутрибрюшинным пентобарбиталом натрия в дозе 65 мг/кг25 (в соответствии с утвержденными в учреждении протоколами).
- Подтвердите глубину анестезии, проверив отсутствие рефлекса отмены во время межпальцевого щипка. Нанесите офтальмологическую мазь на глаза, чтобы предотвратить сухость во время анестезии. Поддерживайте стабильную температуру мышей на уровне 37 °C во время операции и восстановления (20 минут).
- Поместите мышь в вентральное положение пролежня и депилируйте область размером 2,5 см x 3 см от шейного отдела каудально с помощью хирургических лезвий. Растяните кожу, чтобы избежать рваных ран. Проведите асептику и антисептику с помощью чередования повидон-йода и полосканий стерильной водой.
- Используйте стерильный биопсийный перфоратор диаметром 5 мм и надавите круговыми движениями, чтобы создать дермоэпидермальный разрез на уровне лопатки. Снимите лоскут с помощью зубчатых щипцов и разрежьте ножницами с радужной оболочкой (рисунок 2А).
- В случае наличия кровоточащих точек в ране применяют электрошок с электрокаутерным устройством для достижения гемостаза.
- Наложите на рану круглую дермальную пленку диаметром 1 см с помощью щипцов Jeweller, чтобы предотвратить загрязнение и сокращение.
- Выполняйте все операции по выживанию в стерильных условиях. Подготовьте место операции с помощью дезинфицирующих средств, таких как повидон-йод. Надевайте стерильные перчатки и маску и поддерживайте стерильность на протяжении всей процедуры, используя стерильные инструменты и сводя к минимуму контакт с нестерильными поверхностями.
- После операции поместите мышей в отдельные клетки при температуре 24 °C и наблюдайте за ними до тех пор, пока они не придут в сознание, достаточное для поддержания положения грудины. Убедитесь, что температура тела контролируется во время и после операции, чтобы предотвратить переохлаждение, используя внешние источники тепла.
- Вводите анальгезию до 4-го дня, разводя кеторолак в питьевой воде в дозе 5 мг/кг26.
- Через 14 дней, когда раны у здоровых грызунов обычно достигают поздних стадий заживления, усыпляют мышейпутем замещения О2 в камере сСО2 в соответствии с международными стандартами. Это знаменует собой конечную точку исследования.
4. Получение макроскопических изображений
- Делайте снимки ран ежедневно в течение 14 дней подряд, чтобы контролировать непрерывную кинетику закрытия раны. Используйте полупрофессиональную или профессиональную камеру; Расположите объектив через круглое отверстие в крыше фотокабины.
ПРИМЕЧАНИЕ: При необходимости корректируйте график в зависимости от условий эксперимента. - Используйте светодиодную трубку RGB в режиме коррелированной цветовой температуры (CCT), установленной на 9000 K и 100% яркости для освещения.
- Расположите референсную базу в центре пола фотобудки.
- Поместите мышь в ингаляционную анестезиологическую камеру на 3 минуты (рисунок 2B).
- После введения анестезии поместите мышь в положение лежа на мышиной платформе. Закрепите рыло внутри анестезиологической маски с севофлураном, подавая 5% севофлуран со скоростью потока кислорода 1,5 л/мин (рис. 2C).
- Перед съемкой снимите дермальную пленку с раны с помощью щипцов Jeweller и совместите референсную основу с объективом камеры.
- Установите переднюю стенку фотобудки, и делайте макроскопические снимки со следующими настройками: диафрагма f/3.2, время экспозиции 1/200 с, чувствительность ISO 80, фокусное расстояние 4 мм.
- С помощью щипцов Jeweller наложите на рану дермальную пленку диаметром 1 см перед снятием маски для анестезии. Пересадите мышей в отдельные клетки и наблюдайте до тех пор, пока моторика не восстановится.
5. Обработка изображений
- Создайте резервную копию макроскопических изображений. Обработайте изображения с помощью программного обеспечения ImageJ.
- Откройте образ резервной копии в ImageJ, следуя по пути: Файл > Открыть > Поиск в изображениях, затем нажмите Открыть.
- Масштабирование изображения по образцу: разверните изображение, выберите инструмент для создания прямых линий , увеличьте линейку рядом с мышью с помощью клавиши +, нарисуйте прямую линию 10 мм на изображении линейки, затем перейдите в раздел «Анализ» > установите масштаб > введите «10» для известного расстояния > установите единицу длины на мм, а затем нажмите «ОК». Это определяет отношение пикселей к расстоянию для макроскопического изображения (рис. 2D).
- Отделите область раны от изображения: С помощью инструмента «Прямоугольник» выделите область вокруг раны (w = 150, h = 150). Запишите значения X и Y, щелкните правой кнопкой мыши по прямоугольнику > Дублировать > Назовите тему > нажмите Enter. На новом изображении нажмите + дважды, чтобы увеличить масштаб (Рисунок 2E).
- Сохраните обрезанное изображение, следуя по пути: Файл > Сохранить как > Tiff > Введите имя > Сохранить.
- Создайте дубликат обрезанного изображения, чтобы избежать изменений во время сегментации: щелкните правой кнопкой мыши по обрезанному изображению > Дублировать > Назовите его , добавив «Сегментация» в конце. Далее нажмите Enter. На новом изображении дважды нажмите + для увеличения.
- Разделите изображение на цветовые каналы, следуя следующему пути: Тип изображения > > RGB Stack. На изображении с красным каналом (1/3 Красный) щелкните правой кнопкой мыши по Дублировать и нажмите OK в окне Дублировать.
- Сегментируйте изображение красного канала. Нажмите на изображение красного канала, Изображение > Настроить > порог. Затем выберите Default > Apply (рисунок 2F).
- Выпрямляйте область интереса (ROI), чтобы обеспечить полное покрытие раны и избежать искажений сегментации.
ПРИМЕЧАНИЕ: Если области вокруг раны не включены в сегментацию, перейдите в раздел «Процесс > бинарных > заполнение отверстий». Чтобы удалить черные точки за пределами раны, перейдите в раздел Process > Binary > Erode. Если команда Erode уменьшает размер раны, исправьте его с помощью команды Process > Binary > Distributate. - Отметьте периметр ROI: Редактирование > Выделение > Создать выделение. Окупаемость инвестиций будет обведена желтым цветом. Добавьте его в менеджер ROI, следуя инструкциям Edit > Selection > Add to Manager (рисунок 2G).
- Проверьте сегментацию: откройте окно «Менеджер ROI» и выберите ROI для просмотра: «Больше > переводе». Введите значения X и Y, записанные на шаге 4, и нажмите OK.
- Разверните исходное изображение, затем выберите ROI в Менеджере ROI. Отрегулируйте ROI с помощью клавиш со стрелками до тех пор, пока он не совпадет с раной (рисунок 2H). Если ROI совпадал с раной, сегментация прошла успешно. В противном случае повторите шаг 2.
- Как только сегментация будет подтверждена, проведите измерения раны: анализируйте > измеряйте. В таблице результатов будут отображаться значения площади, периметра и положения по осям X/Y. Скопируйте эти значения в программное обеспечение SPSS для документирования и статистического анализа (рис. 2I).
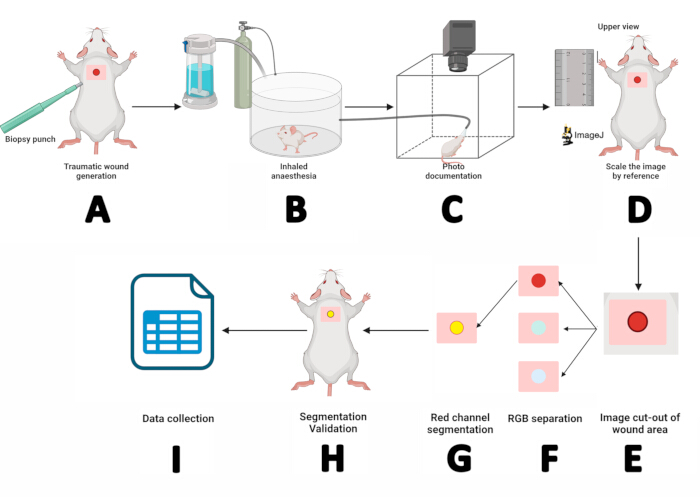
Рисунок 2: Рабочий процесс измерения раны с использованием цифровой планиметрии и методов сегментации. (A) Дермо-эпидермальный разрез с использованием стерильного 5-миллиметрового биопсийного пунша. (B) Помещение мыши в камеру ингаляционной анестезии на 3 мин. (C) Фотодокументирование путем размещения мыши, находящейся под наркозом, в фотобудке и закрепления ее морды в маске севофлурана. (D) Открытие полученного изображения в ImageJ и масштабирование его с использованием линейки в качестве эталона. (E) Извлечение области раны с помощью прямоугольного инструмента. (F) Разделение изображения на RGB-каналы и обработка красного канала. (G) Определение и управление областью интересов (ROI). (H) Валидация сегментации путем сопоставления ROI с раной. (I) Измерение параметров раны и запись результатов для статистического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Постпроцедурная эвтаназия
Примечание: Исследование завершается через 14 дней, когда раны у здоровых грызунов обычно достигают поздних стадий заживления. На этом этапе мыши были гуманно усыплены в соответствии с установленной институционально одобренной процедурой эвтаназии.
- Подготовьте оборудование. Убедитесь, что камера для эвтаназии чистая, сухая и соответствующего размера, чтобы вместить мышей без перенаселенности. Подключите камеру к медицинскому источнику CO2 с помощью регулятора расхода.
- Аккуратно перенесите мышей в камеру, чтобы свести к минимуму стресс. Убедитесь, что они находятся в спокойной обстановке с минимальными внешними помехами.
- Установите расход CO2 на уровне 20%-30% от объема камеры в минуту, как рекомендовано Руководством AVMA по эвтаназии животных. Постепенно увеличивайте концентрацию CO2, чтобы не вызывать дистресс или дискомфорт у мышей.
- Внимательно наблюдайте за мышами во время процедуры. Ищите признаки постепенной потери сознания, включая снижение активности и дыхания с последующим апноэ и остановкой сердца.
- Подтвердите смерть, как только мыши перестанут дышать и не проявят признаков движения; Подождите еще 1-2 минуты, чтобы обеспечить полное прекращение жизнедеятельности. Подтвердите смерть, подтвердив отсутствие рефлексов (например, роговичного рефлекса) и сердечной деятельности.
- Переложите туши в специальные контейнеры для биологически опасных отходов. Следуйте институциональным протоколам и национальным рекомендациям по безопасной утилизации останков животных.
- Записывайте количество усыпленных животных, дату и любые соответствующие наблюдения, чтобы обеспечить соблюдение этических и институциональных стандартов.
Результаты
После масштабирования изображений в программном обеспечении ImageJ средний периметр (Таблица 1) и площадь (Таблица 2) ран, а также их соответствующие стандартные отклонения были получены с помощью цифровой сегментации. Эти значения регистрировались с н...
Обсуждение
В доклинических моделях количественный анализ эволюции травматических ран в доклинических моделях сталкивается с трудностями из-за таких факторов, как размер раны, локализованная воспалительная реакция34, локализация и/или манипуляция. Для этих измерен...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, связанного с данным исследованием.
Благодарности
Авторы выражают признательность Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) за предоставленное финансирование, а также Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) за их поддержку. Кроме того, рисунок 2 был подготовлен с помощью программного обеспечения BioRender (2020 г.), доступного по адресу BioRender.com/p67z056.
Материалы
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Ссылки
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены