Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Planimétrie numérique pour l’évaluation de la cinétique de fermeture des plaies dans un modèle murin
Dans cet article
Résumé
Les plaies représentent un défi de santé mondial. Cette étude a mis au point un photomaton standardisé utilisant la planimétrie numérique pour minimiser la variabilité des mesures des plaies. Le suivi des plaies chez la souris pendant 14 jours a révélé une augmentation initiale de la surface et du périmètre de la plaie, suivie d’une fermeture progressive. Cette méthodologie peut aider à évaluer la cinétique de fermeture des plaies dans des modèles précliniques.
Résumé
Les plaies chroniques, en raison de leur prévalence élevée, constituent un grave problème de santé mondial. Des stratégies thérapeutiques efficaces peuvent accélérer considérablement la guérison, réduisant ainsi le risque de complications et allégeant le fardeau économique des systèmes de santé. Bien que de nombreuses études expérimentales aient porté sur la cicatrisation des plaies, la plupart reposent sur des observations qualitatives ou des mesures directes quantitatives. L’objectif de cette étude était de standardiser une méthode de mesure indirecte des plaies à l’aide de la planimétrie numérique, intégrant la mise à l’échelle et la segmentation numériques. Cette approche remédie au manque de méthodologies détaillées, étape par étape, pour une évaluation précise des plaies. Une cabine de photodocumentation a été conçue et construite, et des outils de planimétrie numérique assistés par ordinateur ont été utilisés pour minimiser la variabilité des mesures de la zone de la plaie, du périmètre et de la distance entre le centre de la plaie et ses bords. Une plaie traumatique circulaire (5 mm de diamètre) a été créée sur la ligne médiane dorsale au niveau de l’omoplate de souris CD1 mâles (n = 4, âgées de 10 semaines, 30-35 g). L’évolution de la plaie a été photodocumentée pendant 14 jours à l’aide du photomaton conçu sur mesure, qui contrôlait les conditions d’éclairage, la distance focale et le positionnement du sujet. Les mesures de détartrage et de plaie ont été effectuées à l’aide de la segmentation dans le logiciel ImageJ, et l’analyse statistique a été effectuée à l’aide d’un logiciel d’analyse statistique. La cinétique de fermeture de la plaie a montré une légère augmentation de la taille et du périmètre de la plaie entre le jour 0 et le jour 2, suivie d’une diminution progressive jusqu’à la fermeture complète au jour 14. La cabine de photodocumentation et la planimétrie numérique assistée par ordinateur ont permis des mesures quantitatives avec une variabilité minimale. En conclusion, ces outils fournissent une méthode fiable et reproductible pour évaluer la cinétique de fermeture des plaies dans des modèles précliniques.
Introduction
La cicatrisation traumatique des plaies prend environ 21 jours et comporte une séquence bien définie de quatre phases distinctes : (1) hémostase, (2) inflammation, (3) prolifération et (4) remodelage1. Si une phase de cicatrisation des plaies est prolongée, elle peut entraîner le développement de plaies chroniques1. En raison de leur prévalence élevée, de leurs complications potentielles2 et de leur fardeau économique important, ils sont considérés comme un problème de santé mondial.
Les études précliniques visent à accélérer la cicatrisation en favorisant la réépithélialisation complète des plaies 3,4,5, en prévenant les complications et en réduisant les coûts de traitement. Ces études évaluent diverses stratégies, y compris le développement de biomatériaux, d’interventions pharmacologiques et d’autres procédures de médecine régénérative 6,7,8,9.
De multiples modèles expérimentaux ont été développés pour l’étude des plaies traumatiques. Certains se concentrent sur des caractéristiques qualitatives macroscopiquement visibles telles que la taille, les indicateurs d’inflammation, la présence de tissu de granulation, les sécrétions et la formation de croûtes5. D’autres analysent des données quantitatives, notamment la surface, le périmètre, le rayon, le diamètre, la couleur, la profondeur et les distances entre le centre et les bords des plaies.
À cet égard, la plupart des investigations in vivo mesurent directement le rayon et la profondeur de la plaie. Cependant, la délimitation manuelle des bords de la plaie dans une image macroscopique peut introduire des biais dans la mesure10. D’autres études utilisent la planimétrie mécanique, à l’aide de feuilles de plastique transparentes quadrillées, où les bords de la plaie sont préalablement délimités ; Dans les deux cas, l’obtention de l’aire ou du périmètre nécessite des instruments manuels tels que des règles ou des planimètres numériques. De nos jours, la planimétrie numérique assistée par ordinateur permet l’analyse informatisée d’images macroscopiques de plaies ou de feuilles de plastique. La manipulation in situ et la qualité de l’image macroscopique sont une limitation, cependant, cet outil 11,12,13,14 réduit considérablement la variabilité entre les mesures de surface et de périmètre.
Cette méthodologie proposée offre des avantages significatifs par rapport aux techniques existantes d’évaluation de la fermeture de la plaie chez la souris 15,16,17,18,19,20. Bien que la documentation photographique ait été considérée comme un outil précis et cohérent pour évaluer la cinétique de fermeture des plaies, des études antérieures21,22 ont mis en évidence les limites de la mesure manuelle des plaies, telles que le biais de l’observateur et la variabilité dues à un éclairage et à un positionnement incohérents de la caméra. L’approche actuelle répond à ces problèmes en standardisant les conditions d’imagerie à l’aide d’une cabine construite sur mesure, améliorant ainsi la reproductibilité et la précision. De plus, la planimétrie numérique informatisée permet des évaluations quantitatives plus précises, améliorant l’évaluation des interventions thérapeutiques et minimisant les erreurs de mesure, comme en témoignent d’autres études comparant les techniques manuelles et numériques12,22, ce qui la rend particulièrement adaptée aux études de la cinétique de fermeture des plaies dans des modèles murins, permettant une évaluation précise des traitements en maintenant un contrôle strict des conditions d’acquisition d’images.
Protocole
Toutes les procédures expérimentales impliquant des souris de laboratoire ont été menées conformément aux normes et règlements éthiques établis dans la norme officielle mexicaine (NOM-062-ZOO-1999) pour la manipulation et les soins des animaux de laboratoire. Le protocole a été examiné et approuvé par le Comité interne pour le soin et l’utilisation des animaux de laboratoire (CICUAL) de l’Institut national de recherche nucléaire (ININ) sous la référence CICUAL-01-23. Des souris CD1 mâles (n = 4), âgées de 10 semaines, avec un poids corporel variant de 28 à 32 g, ont été utilisées dans cette étude. Tous les animaux ont été sélectionnés pour assurer l’uniformité de la souche, de l’âge, du sexe et du poids corporel, minimisant ainsi la variabilité des résultats expérimentaux. Les détails des réactifs et de l’équipement utilisé sont répertoriés dans la table des matériaux.
1. Construction d’un photomaton pour l’acquisition d’images macroscopiques
REMARQUE : Le logiciel SolidWorks sous licence (version 2015) a été utilisé pour concevoir un photomaton afin d’éliminer les sources d’éclairage externes. Un cube de 40 cm × 40 cm a été construit à l’aide d’un profilé en aluminium blanc d’un pouce d’épaisseur. Le cube se composait de trois sections, assemblées séquentiellement : le toit, les parois latérales et le sol (Figure 1A).
- Construction de toiture
REMARQUE : Le toit a été régionalisé en fonction du bord avant (A), du bord arrière (B) et des bords latéraux (C et D) pour s’orienter (figure 1B).- Fixez sur la zone intérieure du bord latéral du toit (C et D) un profilé en aluminium fendu (conçu pour retenir le verre) de 1,5 cm de large, 2,51 cm d’épaisseur et 34,9 cm de long (Figure 1B).
- Placez deux plaques d’aluminium rectangulaires de 34,5 cm de long x 13 cm de large avec du polyéthylène au centre dans la rainure de chaque profil de toit (plaques 1 et 2 de la figure 1C) pour permettre le glissement à travers la rainure des deux profilés.
- Installez un tube LED RVB de 20 cm avec une plage de température de couleur de 2500 à 9000 K (Figure 1C) à un angle de 45° sur le bord inférieur du panneau 1 à l’aide de ruban adhésif double face.
- Montez sur les panneaux de toit 1 et 2 un panneau rectangulaire en mousse de 32 cm x 12 cm avec une découpe circulaire centrale de 7,82 cm de diamètre pour permettre l’installation de l’objectif de la caméra (Figure 1C).
- Construction du sol
- Placez un morceau carré de 40 cm x 40 cm de panneau de mousse blanche sur les profilés de la surface de sol. Découpez des carrés d’une longueur de côté de 2,54 cm à chaque coin du panneau de mousse (Figure 1E).
- Construction des parois latérales
- Découpez quatre panneaux de mousse quadrangulaires de 40 cm x 40 cm.
- Collez deux panneaux avec du silicone sur les côtés C et D pour former les parois latérales gauche et droite (Figure 1F).
- Fixez des bandes de fixation auto-agrippantes aux profilés en aluminium A et B pour faciliter la manipulation des éléments internes du photomaton. De plus, fixez à 1 cm du bord d’une ligne d’attaches adhésives deux carrés de carton mousse sur un côté et placez-les sur les parois avant et arrière (Figure 1F).
- Construction de la base de référence
REMARQUE : Une base de référence était nécessaire pour maintenir la souris en position couchée pendant l’anesthésie et tout au long de la documentation de l’évolution de la plaie. Les composants 3D ont été conçus et fabriqués à l’aide de la technique de modélisation par dépôt de fil en fusion (FDM) avec un matériau PLA et une imprimante 3D23,24.- Imprimez en 3D le masque avec une base de 2 cm de largeur, de longueur et de hauteur et placez-le à 11,5 cm du bord d’un rectangle prédécoupé en carton mousse blanc de 40 cm x 28 cm pour maintenir les souris sous anesthésie par inhalation (Figure 1D, couleur rouge).
- Imprimez en 3D la plate-forme rectangulaire (9 cm de long, 5 cm de large, 2,5 cm de haut) avec quatre zones extrudées pour aligner le dos de la souris lors de l’acquisition de l’image. Ces zones soutenaient la tête, les membres et la région abdominale pour maintenir la position couchée. Collez cette plate-forme au centre de la base de référence (Figure 1D, couleur verte).
- Imprimez en 3D le bloc de règle (2 cm de large, 8 cm de long, 2,5 cm de haut) et fixez-le à 1 cm du côté gauche de la base de la souris pour y placer l’élément de référence de mesure nécessaire au traitement numérique de l’image (Figure 1D, couleur bleue).
- Fixez une règle graduée en acier inoxydable de 15 cm au bloc de règle et installez l’intégralité de la base de référence à l’intérieur de la cabine pour la mise à l’échelle de l’image (Figure 1D).
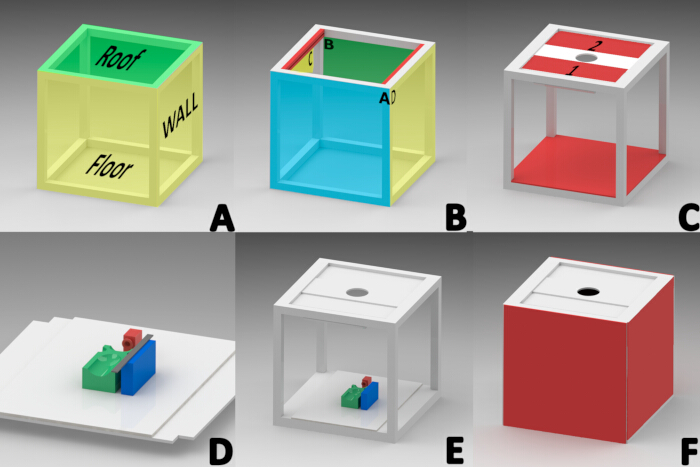
Figure 1 : Schéma de construction de l’armoire d’acquisition d’images macroscopiques. (A) Sections de la cabine (toit, parois latérales, sol). (B)Orientation des profilés formant le toit ; avant (A), arrière (B) et côtés (face intérieure des profilés en rouge « C,D »). (C) Panneaux de toit 1 et 2, installation du tube lumineux LED, de la plaque d’objectif de la caméra et installation au sol. (D) Installation du masque d’anesthésie (ROUGE), de la plate-forme de la souris (VERT) et de la plate-forme rectangulaire pour le positionnement de la règle de mesure (BLEU) sur la base de référence. (E) Emplacement final de la base de référence. (F) Installation des parois latérales, avant et arrière. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Entretien des animaux
- Obtenir l’autorisation du comité de bioéthique de l’établissement pour les expérimentations animales. Utiliser des souris CD1 (n = 4), âgées de 10 semaines, pesant de 28 à 32 g.
- Hébergez les souris dans des conditions standard : maintenez une température de 21 °C, des cycles lumière/obscurité de 12/12 h, 45 % d’humidité, et fournissez un accès ad libitum à l’eau et à la nourriture, sauf pendant les séances de photodocumentation.
3. Génération de plaies traumatiques
- Faites jeûner les souris pendant 8 h avant la procédure. Anesthésier les souris avec du pentobarbital sodique intrapéritonéal à 65 mg/kg25 (selon les protocoles approuvés par l’établissement).
- Confirmez la profondeur de l’anesthésie en vérifiant l’absence de réflexe de retrait lors d’un pincement interdigital. Appliquez une pommade ophtalmique sur les yeux pour prévenir la sécheresse pendant l’anesthésie. Maintenez les souris à une température stable de 37 °C pendant la chirurgie et la récupération (20 min).
- Placez la souris en position de décubitus ventral et épilez une zone de 2,5 cm x 3 cm de la région cervicale par voie caudale à l’aide de lames chirurgicales. Étirez la peau pour éviter les lacérations. Effectuez l’asepsie et l’antisepsie en alternant des rinçages à la povidone iodée et à l’eau stérile.
- Utilisez un poinçon de biopsie stérile de 5 mm et appliquez une pression avec des mouvements circulaires pour créer une incision dermo-épidermique au niveau de l’omoplate. Retirez le rabat à l’aide d’une pince dentelée et coupez-le à l’aide de ciseaux à pointe d’iris (Figure 2A).
- En cas de présence de points de saignement dans la plaie, appliquez un choc électrique avec un appareil d’électrocautérisation pour obtenir l’hémostase.
- Placez un film dermique circulaire de 1 cm de diamètre sur la plaie à l’aide d’une pince Jeweler pour éviter la contamination et la contraction.
- Effectuer toutes les chirurgies de survie dans des conditions stériles. Préparez le site chirurgical avec des désinfectants comme la povidone iodée. Portez des gants stériles et un masque, et maintenez la stérilité tout au long de l’intervention en utilisant des instruments stériles et en minimisant le contact avec les surfaces non stériles.
- Après l’opération, placez les souris dans des cages individuelles à 24 °C et surveillez-les jusqu’à ce qu’elles retrouvent une conscience suffisante pour maintenir la position sternale. Assurez-vous que la température corporelle est contrôlée pendant et après la chirurgie pour prévenir l’hypothermie en utilisant des sources de chaleur externes.
- Administrer l’analgésie jusqu’au jour 4 en diluant le kétorolac dans l’eau de boisson à 5 mg/kg26.
- Après 14 jours, lorsque les plaies chez les rongeurs sains atteignent généralement des stades avancés de cicatrisation, euthanasiez les souris par remplacement de l’O2 dans une chambre de CO2 conformément aux normes internationales. Cela marque le point final de l’étude.
4. Acquisition d’images macroscopiques
- Capturez des images des plaies quotidiennement pendant 14 jours consécutifs pour surveiller la cinétique continue de la fermeture de la plaie. Utiliser un appareil photo semi-professionnel ou professionnel ; Positionnez l’objectif à travers l’ouverture circulaire dans le toit du photomaton.
REMARQUE : Ajustez le calendrier si nécessaire en fonction des conditions expérimentales. - Utilisez un tube lumineux LED RVB en mode CCT (Correlated Colour Temperature), réglé sur 9000 K et une luminosité de 100 % pour l’éclairage.
- Positionnez la base de référence au centre du sol du photomaton.
- Placez la souris dans la chambre d’anesthésie inhalée pendant 3 min (Figure 2B).
- Après avoir induit l’anesthésie, placez la souris en position couchée sur la plate-forme de la souris. Fixez le museau à l’intérieur du masque d’anesthésie au sévoflurane et délivrez 5 % de sévoflurane à un débit d’oxygène de 1,5 L/min (figure 2C).
- Avant de capturer des images, retirez le film dermique de la plaie à l’aide d’une pince Jeweller et alignez la base de référence avec l’objectif de l’appareil photo.
- Installez la paroi avant du photomaton et capturez des images macroscopiques avec les paramètres suivants : ouverture f/3.2, temps d’exposition 1/200s, sensibilité ISO 80, distance focale 4mm.
- À l’aide d’une pince Jeweller, placez un film dermique de 1 cm de diamètre sur la plaie avant de retirer le masque d’anesthésie. Transférez les souris dans des cages individuelles et observez jusqu’à la récupération motrice.
5. Traitement d’image
- Générez une copie de sauvegarde des images macroscopiques. Traitez les images à l’aide du logiciel ImageJ.
- Ouvrez l’image de sauvegarde dans ImageJ en suivant le chemin d’accès : Fichier > Ouvrir > Rechercher dans les images, puis cliquez sur Ouvrir.
- Mettez l’image à l’échelle par référence : Agrandissez l’image, sélectionnez l’outil Ligne droite , zoomez sur la règle à côté de la souris à l’aide de la touche +, tracez une ligne droite de 10 mm sur l’image de la règle, puis allez dans Analyser > Définir l’échelle > Entrez « 10 » pour la distance connue > Définir l’unité de longueur en mm, puis cliquez sur Ok. Cela détermine le rapport pixels/distance de l’image macroscopique (Figure 2D).
- Séparez la zone de la plaie de l’image : utilisez l’outil rectangle pour sélectionner la zone autour de la plaie (w = 150, h = 150). Enregistrez les valeurs X et Y, faites un clic droit sur le rectangle > Dupliquez > Nommez le sujet > Appuyez sur Entrée. Dans la nouvelle image, appuyez deux fois sur + pour effectuer un zoom avant (Figure 2E).
- Enregistrez l’image recadrée en suivant le chemin d’accès : Fichier > Enregistrer sous > Tiff > Entrez le nom > Enregistrer.
- Créez un duplicata de l’image recadrée pour éviter toute modification lors de la segmentation : Faites un clic droit sur l’image recadrée > Dupliquez > Nommez-la en ajoutant « Segmentation » à la fin. Ensuite, appuyez sur Entrée. Dans la nouvelle image, appuyez deux fois sur + pour effectuer un zoom avant.
- Séparez l’image en couches de couleur en suivant le chemin suivant : Image > Type > Pile RVB. Dans l’image du canal rouge (1/3 rouge), faites un clic droit sur Dupliquer, puis appuyez sur OK dans la fenêtre Dupliquer.
- Segmentez l’image du canal rouge. Cliquez sur l’image du canal rouge, Image > Ajuster > seuil. Ensuite, sélectionnez Par défaut > Appliquer (Figure 2F).
- Rectifiez la région d’intérêt (ROI) pour assurer une couverture complète de la plaie et éviter les distorsions de segmentation.
REMARQUE : Si les zones autour de la plaie ne sont pas incluses dans la segmentation, passez à la section Traiter > Binaire > Remplir les trous. Pour supprimer les points noirs à l’extérieur de la plaie, allez dans Traiter > Binary > Erode. Si la commande Erode réduit la taille de la plaie, corrigez-la à l’aide de Traiter > Binaire > Dilater. - Marquez le périmètre du retour sur investissement : Modifier > sélection > Créer une sélection. Le retour sur investissement sera décrit en jaune. Ajoutez-le au gestionnaire de retour sur investissement en suivant les > Modifier > Sélection (Edit Add to Manager (Figure 2G).
- Validez la segmentation : Ouvrez la fenêtre Gestionnaire de ROI et sélectionnez le ROI à examiner : Plus > Traduire. Entrez les valeurs X et Y enregistrées à l’étape 4, puis appuyez sur OK.
- Maximisez l’image d’origine, puis sélectionnez le retour sur investissement dans le gestionnaire de retour sur investissement. Ajustez le retour d’intérêt à l’aide des touches fléchées jusqu’à ce qu’il s’aligne avec l’enroulement (Figure 2H). Si le ROI est à la hauteur de la plaie, la segmentation a été réussie. Sinon, répétez l’opération à partir de l’étape 2.
- Une fois la segmentation confirmée, obtenez les mesures de la plaie : Analyser > Mesurer. Un tableau de résultats affichera les valeurs de surface, de périmètre et de position X/Y. Copiez ces valeurs dans le logiciel SPSS à des fins de documentation et d’analyse statistique (Figure 2I).
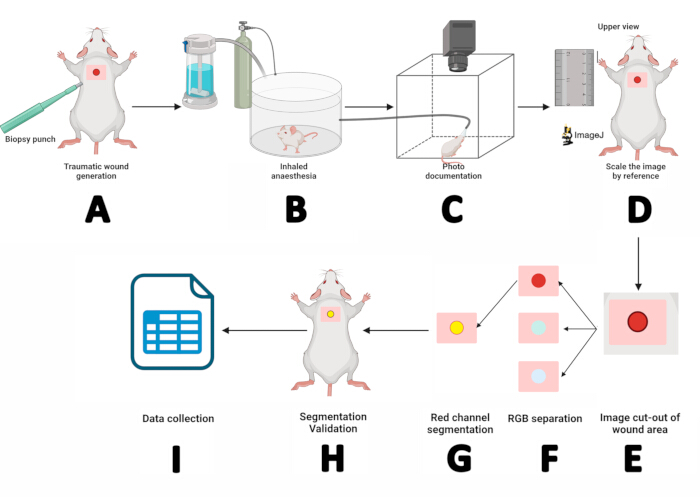
Figure 2 : Déroulement de la mesure de la plaie à l’aide de techniques de planimétrie numérique et de segmentation. (A) Incision dermo-épidermique à l’aide d’un poinçon de biopsie stérile de 5 mm. (B) Placer la souris dans une chambre d’anesthésie inhalée pendant 3 min. (C) Documentation photographique en positionnant la souris anesthésiée dans le photomaton et en fixant son museau dans un masque au sévoflurane. (D) Ouvrir l’image obtenue dans ImageJ et la mettre à l’échelle en utilisant la règle comme référence. (E) Extraire la zone de la plaie à l’aide de l’outil rectangle. (F) Séparation de l’image en canaux RVB et traitement du canal rouge. (G) Définir et gérer la région d’intérêt (ROI). (H) Valider la segmentation en faisant correspondre le retour sur investissement avec la plaie. (I) Mesurer les paramètres de la plaie et enregistrer les résultats pour l’analyse statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Euthanasie post-opératoire
REMARQUE : L’étude se termine après 14 jours, moment auquel les plaies chez les rongeurs sains atteignent généralement des stades avancés de guérison. À ce stade, les souris ont été euthanasiées sans cruauté selon la procédure d’euthanasie établie et approuvée par l’établissement.
- Préparez l’équipement. Assurez-vous que la chambre d’euthanasie est propre, sèche et de taille appropriée pour accueillir les souris sans surpeuplement. Connectez la chambre à une alimentation en CO2 de qualité médicale à l’aide d’un régulateur de débit.
- Transférez doucement les souris dans la chambre pour minimiser le stress. Assurez-vous qu’ils sont dans un environnement calme avec un minimum de perturbations externes.
- Réglez le débit de CO2 à 20 % à 30 % du volume de la chambre par minute, comme recommandé par les directives de l’AVMA pour l’euthanasie des animaux. Augmentez progressivement la concentration de CO2 pour éviter d’induire une détresse ou une gêne chez les souris.
- Observez attentivement les souris pendant la procédure. Recherchez des signes de perte de conscience progressive, y compris une activité et une respiration réduites, suivies d’une apnée et d’un arrêt cardiaque.
- Confirmez la mort une fois que les souris ne respirent plus et ne montrent aucun signe de mouvement ; Attendez 1 à 2 minutes supplémentaires pour assurer un arrêt complet des fonctions vitales. Vérifier la mort en confirmant l’absence de réflexes (p. ex., réflexe cornéen) et d’activité cardiaque.
- Transférer les carcasses dans des conteneurs de déchets biologiques dangereux désignés. Suivre les protocoles institutionnels et les directives nationales pour l’élimination sécuritaire des restes d’animaux.
- Consigner le nombre d’animaux euthanasiés, la date et toute observation pertinente afin de s’assurer du respect des normes éthiques et institutionnelles.
Résultats
Après mise à l’échelle des images dans le logiciel ImageJ, le périmètre moyen (tableau 1) et la surface (tableau 2) des plaies, ainsi que leurs écarts-types respectifs, ont été obtenus par segmentation numérique. Ces valeurs ont été enregistrées du jour zéro au quatorzième jour (J0-J14).
| Jour | Périmètre (mm) |
Discussion
Dans les modèles précliniques, l’analyse quantitative de l’évolution des plaies traumatiques dans les modèles précliniques se heurte à des défis en raison de facteurs tels que la taille de la plaie, la réponse inflammatoire localisée34, la localisation et/ou la manipulation. Des méthodes de planimétrie manuelles directes36 et numériques indirectes 11,16,37,38 existent pour ces mesures.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts liés à cette recherche.
Remerciements
Les auteurs tiennent à remercier le Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU : 933600) par le biais de la subvention pour le financement, ainsi que le Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) pour leur soutien. De plus, la figure 2 a été préparée à l’aide du logiciel BioRender (2020), disponible à l’BioRender.com/p67z056.
matériels
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Références
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon