A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المخطط الرقمي لتقييم حركية إغلاق الجرح في نموذج الماوس
In This Article
Summary
تمثل الجروح تحديا صحيا عالميا. طورت هذه الدراسة كشك صور موحد يستخدم المخطط الرقمي لتقليل تقلب قياس الجرح. كشفت مراقبة الجروح في الفئران على مدى 14 يوما عن زيادة أولية في مساحة الجرح ومحيطه ، تليها الإغلاق التدريجي. قد تساعد هذه المنهجية في تقييم حركية إغلاق الجرح في النماذج قبل السريرية.
Abstract
وتشكل الجروح المزمنة، بسبب انتشارها المرتفع، مصدر قلق صحي عالمي خطير. يمكن للاستراتيجيات العلاجية الفعالة أن تسرع الشفاء بشكل كبير ، وبالتالي تقليل مخاطر المضاعفات وتخفيف العبء الاقتصادي على أنظمة الرعاية الصحية. على الرغم من أن العديد من الدراسات التجريبية قد حققت في التئام الجروح ، إلا أن معظمها يعتمد على الملاحظات النوعية أو القياسات الكمية المباشرة. كان الهدف من هذه الدراسة هو توحيد طريقة قياس الجرح غير المباشرة باستخدام القياس الرقمي ، بما في ذلك القياس الرقمي والتجزئة. يعالج هذا النهج الافتقار إلى منهجيات مفصلة خطوة بخطوة لتقييم الجروح بدقة. تم تصميم وبناء كشك للتوثيق الضوئي ، وتم استخدام أدوات قياس المخطط الرقمي بمساعدة الكمبيوتر لتقليل التباين في قياسات منطقة الجرح والمحيط والمسافة من مركز الجرح إلى حوافه. تم إنشاء جرح مؤلم دائري (قطره 5 مم) على خط الوسط الظهري على مستوى لوح الكتف لذكور الفئران CD1 (ن = 4 ، 10 أسابيع ، 30-35 جم). تم توثيق تطور الجرح لمدة 14 يوما باستخدام كشك الصور المصمم خصيصا ، والذي يتحكم في ظروف الإضاءة والمسافة البؤرية وتحديد موضع الموضوع. تم إجراء قياسات التحجيم والجروح باستخدام التجزئة في برنامج ImageJ ، وتم إجراء التحليل الإحصائي باستخدام برنامج التحليل الإحصائي. أظهرت حركية إغلاق الجرح زيادة طفيفة في حجم الجرح ومحيطه بين اليوم 0 واليوم 2 ، يليه انخفاض تدريجي حتى الإغلاق الكامل بحلول اليوم 14. مكن كشك التوثيق الضوئي والمخطط الرقمي بمساعدة الكمبيوتر من إجراء قياسات كمية بأقل قدر من التباين. في الختام ، توفر هذه الأدوات طريقة موثوقة وقابلة للتكرار لتقييم حركية إغلاق الجرح في النماذج قبل السريرية.
Introduction
يستغرق التئام الجروح الرضحية حوالي 21 يوما وله تسلسل محدد جيدا من أربع مراحل متميزة: (1) الإرقاء ، (2) الالتهاب ، (3) الانتشار ، و (4) إعادةالتشكيل 1. إذا طال أي مرحلة من مراحل التئام الجروح ، فقد يؤدي ذلك إلى تطور الجروحالمزمنة 1. نظرا لانتشارها المرتفع والمضاعفاتالمحتملة 2 والعبء الاقتصادي الكبير ، فإنها تعتبر مشكلة صحية عالمية.
تهدف الدراسات قبل السريرية إلى تحقيق شفاء أسرع من خلال تعزيز إعادة تكوين الجروح الظهاريةالشاملة 3،4،5 ، ومنع المضاعفات ، وتقليل تكاليف العلاج. تقيم هذه الدراسات استراتيجيات مختلفة ، بما في ذلك تطوير المواد الحيوية والتدخلات الدوائية وإجراءات الطب التجديديالأخرى 6،7،8،9.
تم تطوير نماذج تجريبية متعددة لدراسة الجروح الرضحية. يركز البعض على الخصائص النوعية المرئية مجهريا مثل الحجم ومؤشرات الالتهاب ووجود الأنسجة الحبيبية والإفرازات وتكوين الجرب5. يقوم آخرون بتحليل البيانات الكمية ، بما في ذلك المساحة والمحيط ونصف القطر والقطر واللون والعمق والمسافات من المركز إلى حواف الجروح.
في هذا الصدد ، تقيس معظم التحقيقات في الجسم الحي نصف قطر الجرح وعمقه بشكل مباشر. ومع ذلك ، فإن التحديد اليدوي لحواف الجرح في صورة عيانية يمكن أن يؤدي إلى تحيزات في القياس10. تستخدم دراسات أخرى المخططات الميكانيكية ، باستخدام صفائح بلاستيكية شبكية شفافة ، حيث تم تحديد حواف الجرح مسبقا. في كلتا الحالتين ، يتطلب الحصول على المنطقة أو المحيط أدوات يدوية مثل المساطر أو المسطحات الرقمية. في الوقت الحاضر ، يسمح القياس الرقمي بمساعدة الكمبيوتر بالتحليل المحوسب للصور العيانية للجروح أو الألواح البلاستيكية. يعد التلاعب في الموقع وجودة الصورة العيانية قيدا ، ومع ذلك ، فإن هذه الأداة11،12،13،14 تقلل بشكل كبير من التباين بين قياسات المنطقة والمحيط.
تقدم هذه المنهجية المقترحة مزايا كبيرة على التقنيات الحالية لتقييم إغلاق الجرح في الفئران15،16،17،18،19،20. بينما تم اعتبار توثيق الصور أداة دقيقة ومتسقة لتقييم حركية إغلاق الجرح ، فقد سلطت الدراسات السابقة21،22 الضوء على قيود القياس اليدوي للجرح ، مثل تحيز المراقب والتباين بسبب الإضاءة غير المتسقة ووضع الكاميرا. يعالج النهج الحالي هذه المشكلات من خلال توحيد ظروف التصوير من خلال كشك مصمم خصيصا ، مما يحسن قابلية التكرار والدقة. علاوة على ذلك ، يتيح القياس الرقمي المحوسب تقييمات كمية أكثر دقة ، مما يعزز تقييم التدخلات العلاجية ويقلل من أخطاء القياس ، كما يتضح من دراسات أخرى تقارن التقنيات اليدوية والرقمية12،22 مما يجعلها مناسبة بشكل خاص لدراسات حركية إغلاق الجرح في نماذج الفئران ، مما يسمح بالتقييم الدقيق للعلاجات من خلال الحفاظ على رقابة صارمة على ظروف الحصول على الصور.
Protocol
تم إجراء جميع الإجراءات التجريبية التي شملت فئران المختبر وفقا للمعايير واللوائح الأخلاقية المنصوص عليها في المعيار المكسيكي الرسمي (NOM-062-ZOO-1999) للتعامل مع المختبر ورعايتها. تمت مراجعة البروتوكول والموافقة عليه من قبل اللجنة الداخلية لرعاية واستخدام المختبر (CICUAL) التابعة للمعهد الوطني للبحوث النووية (ININ) تحت الرقم المرجعي CICUAL-01-23. تم استخدام ذكور الفئران CD1 (ن = 4) ، بعمر 10 أسابيع ، ووزن الجسم الذي يتراوح من 28 إلى 32 جم ، في هذه الدراسة. تم اختيار جميع لضمان التوحيد في الإجهاد والعمر والجنس ووزن الجسم ، مما يقلل من التباين في النتائج التجريبية. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. بناء كشك الصور للحصول على الصور العيانية
ملاحظة: تم استخدام برنامج SolidWorks المرخص (الإصدار 2015) لتصميم كشك صور للتخلص من مصادر الإضاءة الخارجية. تم بناء مكعب 40 سم × 40 سم باستخدام ملف تعريف من الألومنيوم الأبيض بسمك بوصة واحدة. يتكون المكعب من ثلاثة أقسام ، تم تجميعها بالتتابع: السقف والجدران الجانبية والأرضية (الشكل 1 أ).
- بناء السقف
ملاحظة: تم تقسيم السقف إقليميا إلى الحافة الأمامية (A) والحافة الخلفية (B) والحواف الجانبية (C و D) للتوجيه (الشكل 1 ب).- قم بتثبيت الجزء الداخلي من الحافة الجانبية للسقف (C و D) على شكل ألومنيوم مشقوق (مصمم لحمل الزجاج) بعرض 1.5 سم وسمك 2.51 سم وطول 34.9 سم (الشكل 1 ب).
- ضع لوحين من الألومنيوم المستطيل بطول 34.5 سم × عرض 13 سم مع البولي إيثيلين في المنتصف في أخدود كل ملف تعريف سقف (اللوحة 1 و 2 في الشكل 1C) لتمكين الانزلاق عبر أخدود كلا الملفين الشخصيين.
- قم بتثبيت مصباح أنبوب RGB LED مقاس 20 سم مع نطاق درجة حرارة اللون من 2500-9000 كلفن (الشكل 1C) بزاوية 45 درجة على الحافة السفلية للوحة 1 باستخدام شريط على الوجهين.
- قم بالتركيب على ألواح السقف 1 و 2 لوحة لوح إسفنجية مستطيلة مقاس 32 سم × 12 سم مع فتحة دائرية مركزية بقطر 7.82 سم للسماح بتركيب عدسة الكاميرا (الشكل 1 ج).
- بناء الأرضية
- ضع قطعة مربعة مقاس 40 سم × 40 سم من لوح الرغوة الأبيض أعلى ملامح مساحة الأرضية. قطع المربعات بطول جانبي 2.54 سم من كل ركن من أركان لوح الرغوة (الشكل 1E).
- بناء الجدران الجانبية
- قطع أربع ألواح من ألواح الرغوة رباعية الزوايا مقاس 40 سم × 40 سم.
- قم بلصق لوحين من السيليكون على الجانبين C و D لتشكيل الجدران الجانبية اليمنى واليسرى (الشكل 1F).
- قم بتوصيل شرائط قفل الخطاف والحلقة بمقاطع الألمنيوم A و B لسهولة التلاعب بعناصر كشك الصور الداخلية. بالإضافة إلى ذلك ، قم بإرفاق 1 سم من حافة خط من السحابات اللاصقة بمربعين من الورق المقوى الرغوي على جانب واحد ، ووضعهما على الجدران الأمامية والخلفية (الشكل 1F).
- بناء القاعدة المرجعية
ملاحظة: كانت القاعدة المرجعية ضرورية للحفاظ على الفأر في وضع الانبطاح أثناء التخدير وطوال توثيق تطور الجرح. تم تصميم المكونات ثلاثية الأبعاد وتصنيعها باستخدام تقنية نمذجة الترسيب المنصهرة (FDM) مع مادة PLA وطابعة ثلاثية الأبعاد23،24.- اطبع القناع ثلاثي الأبعاد بقاعدة 2 سم في العرض والطول والارتفاع وضعه على بعد 11.5 سم من حافة مستطيل لوح الرغوة الأبيض المقطوع مسبقا مقاس 40 سم × 28 سم للحفاظ على الفئران تحت التخدير بالاستنشاق (الشكل 1D ، اللون الأحمر).
- طباعة ثلاثية الأبعاد للمنصة المستطيلة (بطول 9 سم وعرض 5 سم وارتفاع 2.5 سم) مع أربع مناطق مقذوفة لمحاذاة ظهر الماوس أثناء الحصول على الصورة. دعمت هذه المناطق الرأس والأطراف ومنطقة البطن للحفاظ على وضعية الانبطاح. قم بلصق هذه المنصة في وسط القاعدة المرجعية (الشكل 1D ، اللون الأخضر).
- اطبع كتلة المسطرة ثلاثية الأبعاد (بعرض 2 سم وطول 8 سم وارتفاع 2.5 سم) وثبتها على بعد 1 سم من الجانب الأيسر من قاعدة الماوس لوضع العنصر المرجعي للقياس المطلوب لمعالجة الصور الرقمية (الشكل 1D ، اللون الأزرق).
- قم بتوصيل مسطرة متدرجة من الفولاذ المقاوم للصدأ مقاس 15 سم بكتلة المسطرة ، وقم بتثبيت القاعدة المرجعية بالكامل داخل المقصورة لقياس الصورة (الشكل 1D).
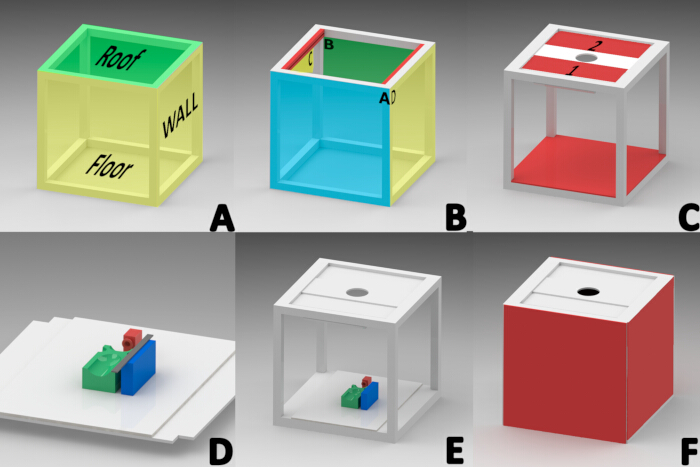
الشكل 1: رسم تخطيطي لبناء خزانة الحصول على الصور العيانية (أ) أقسام المقصورة (السقف ، الجدران الجانبية ، الأرضية). (ب)اتجاه الملامح التي تشكل السقف. الأمامي (A) والخلفي (B) والجانبين (الجانب الداخلي من الملامح باللون الأحمر "C ، D"). (ج) ألواح السقف 1 و 2 ، تركيب أنبوب إضاءة LED ، لوحة عدسة الكاميرا ، وتركيب الأرضية. (د) تركيب قناع التخدير (RED) ومنصة الماوس (GREEN) والمنصة المستطيلة لوضع مسطرة القياس (BLUE) على القاعدة المرجعية. (ه) الموقع النهائي للقاعدة المرجعية. (و) تركيب الجدران الجانبية والأمامية والخلفية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. صيانة
- الحصول على ترخيص من لجنة أخلاقيات علم الأحياء في المؤسسة لإجراء التجارب على. استخدم الفئران CD1 (ن = 4) ، عمرها 10 أسابيع ، تزن 28-32 جم.
- قم بإيواء الفئران في ظل الظروف القياسية: حافظ على درجة حرارة 21 درجة مئوية ، و 12/12 ساعة من دورات الضوء / الظلام ، والرطوبة بنسبة 45٪ ، ووفر الوصول المخصص إلى الماء والطعام ، باستثناء جلسات التوثيق الضوئي.
3. توليد الجروح المؤلمة
- قم بتسريع الفئران لمدة 8 ساعات قبل الإجراء. تخدير الفئران باستخدام البنتوباربيتال الصوديوم داخل الصفاق عند 65 مجم / كجم25 (باتباع البروتوكولات المعتمدة مؤسسيا).
- تأكد من عمق التخدير عن طريق التحقق من عدم وجود منعكس انسحابي أثناء القرص بين الأصابع. ضع مرهم العين على العينين لمنع الجفاف أثناء التخدير. حافظ على الفئران عند درجة حرارة ثابتة تبلغ 37 درجة مئوية أثناء الجراحة والتعافي (20 دقيقة).
- ضع الفأر في وضع الاستلقاء البطني وقم بإزالة مساحة 2.5 سم × 3 سم من منطقة عنق الرحم ذيليا باستخدام شفرات جراحية. مد الجلد لتجنب التمزقات. إجراء التعقيم والتعقيم باستخدام الشطف المتناوب بين اليود والبوفيدون.
- استخدم لكمة خزعة معقمة مقاس 5 مم واضغط بحركات دائرية لإنشاء شق جلدي بشرة على مستوى الكتف. قم بإزالة الغطاء بالملقط المسنن وقطعه بمقص طرف القزحية (الشكل 2 أ).
- في حالة وجود نقاط نزيف في الجرح ، قم بتطبيق صدمة كهربائية بجهاز الكي الكهربائي لتحقيق الإرقاء.
- ضع طبقة جلدية دائرية قطرها 1 سم فوق الجرح باستخدام ملقط Jeweler لمنع التلوث والانقباض.
- إجراء جميع جراحات البقاء على قيد الحياة في ظل ظروف معقمة. جهز موقع الجراحة بمطهرات مثل بوفيدون اليود. ارتد قفازات معقمة وقناعا ، وحافظ على العقم طوال العملية باستخدام أدوات معقمة وتقليل ملامسة الأسطح غير المعقمة.
- بعد الجراحة ، ضع الفئران في أقفاص فردية عند 24 درجة مئوية وراقبها حتى تستعيد وعيها الكافي للحفاظ على الوضع القصي. تأكد من التحكم في درجة حرارة الجسم أثناء الجراحة وبعدها لمنع انخفاض حرارة الجسم باستخدام مصادر حرارة خارجية.
- يدير التسكين حتى اليوم 4 عن طريق تخفيف الكيتورولاك في مياه الشرب بمعدل 5 مجم / كجم26.
- بعد 14 يوما ، عندما تصل الجروح في القوارض السليمة عادة إلى مراحل متقدمة من الشفاء ، قم بالقتل الرحيم للفئران عن طريق استبدال O2 في غرفة ثاني أكسيد الكربون2 وفقا للمعايير الدولية. هذا يمثل نقطة نهاية الدراسة.
4. الحصول على الصور العيانية
- التقط صورا للجروح يوميا لمدة 14 يوما متتاليا لمراقبة الحركية المستمرة لإغلاق الجرح. استخدم كاميرا شبه احترافية أو احترافية ؛ ضع العدسة من خلال الفتحة الدائرية في سقف كشك الصور.
ملاحظة: اضبط الجدول الزمني حسب الضرورة بناء على الظروف التجريبية. - استخدم أنبوب إضاءة RGB LED في وضع درجة حرارة اللون المترابطة (CCT)، واضبطه على 9000 كلفن وسطوع 100٪ للإضاءة.
- ضع القاعدة المرجعية في وسط أرضية كشك الصور.
- ضع الماوس في غرفة التخدير المستنشقة لمدة 3 دقائق (الشكل 2 ب).
- بعد تحفيز التخدير ، ضع الماوس في وضع الانبطاح على منصة الماوس. قم بتأمين الخطم داخل قناع التخدير سيفوفلوران ، مما يوفر 5٪ سيفوفلوران بمعدل تدفق أكسجين يبلغ 1.5 لتر / دقيقة (الشكل 2 ج).
- قبل التقاط الصور ، قم بإزالة الطبقة الجلدية من الجرح باستخدام ملقط Jeweller وقم بمحاذاة القاعدة المرجعية مع عدسة الكاميرا.
- قم بتثبيت الجدار الأمامي لكابينة الصور، والتقط صورا عيانية بالإعدادات التالية: فتحة العدسة f/3.2، وقت التعرض 1/200 ثانية، سرعة ISO 80، البعد البؤري 4 مم.
- باستخدام ملقط المجوهرات ، ضع طبقة جلدية قطرها 1 سم على الجرح قبل إزالة قناع التخدير. انقل الفئران إلى أقفاص فردية وراقب حتى الشفاء الحركي.
5. معالجة الصور
- إنشاء نسخة احتياطية من الصور العيانية. قم بمعالجة الصور باستخدام برنامج ImageJ.
- افتح صورة النسخ الاحتياطي في ImageJ باتباع المسار: ملف > افتح > البحث في الصور ، ثم انقر فوق فتح.
- تغيير حجم الصورة حسب المرجع: قم بتكبير الصورة ، وحدد أداة الخط المستقيم ، وتكبير المسطرة بجوار الماوس باستخدام المفتاح + ، وارسم خطا مستقيما مقاس 10 مم على صورة المسطرة ، ثم انتقل إلى تحليل > تعيين المقياس > أدخل "10" للمسافة المعروفة > اضبط وحدة الطول على مم ، ثم انقر فوق موافق. يحدد هذا نسبة البكسل إلى المسافة للصورة العيانية (الشكل 2D).
- افصل منطقة الجرح عن الصورة: استخدم أداة المستطيل لتحديد المنطقة المحيطة بالجرح (w = 150 ، h = 150). سجل قيم X و Y ، وانقر بزر الماوس الأيمن على المستطيل > تكرار > قم بتسمية الموضوع > اضغط على Enter. في الصورة الجديدة، اضغط على + مرتين للتكبير (الشكل 2E).
- احفظ الصورة التي تم اقتصاصها باتباع المسار: File > Save As > Tiff > أدخل الاسم > Save.
- قم بإنشاء نسخة مكررة من الصورة التي تم اقتصاصها لتجنب التعديل أثناء التجزئة: انقر بزر الماوس الأيمن على الصورة التي تم اقتصاصها > تكرار > قم بتسميته بإضافة "تجزئة" إلى النهاية. بعد ذلك ، اضغط على Enter. في الصورة الجديدة ، اضغط على + مرتين للتكبير.
- افصل الصورة إلى قنوات ملونة باتباع هذا المسار: Image > Type > RGB Stack. في صورة القناة الحمراء (1/3 أحمر) ، انقر بزر الماوس الأيمن فوق تكرار ، واضغط على موافق في نافذة التكرار.
- تقسيم صورة القناة الحمراء. انقر فوق صورة القناة الحمراء ، الصورة > ضبط > الحد. بعد ذلك ، حدد الافتراضي > تطبيق (الشكل 2F).
- تصحيح منطقة الاهتمام (ROI) لضمان تغطية الجرح بالكامل وتجنب تشوهات التجزئة.
ملاحظة: إذا لم يتم تضمين المناطق المحيطة بالجرح في التجزئة، فانتقل إلى معالجة > ثقوب تعبئة > الثنائية. لإزالة النقاط السوداء خارج الجرح، انتقل إلى عملية > Binary > Erode. إذا كان الأمر Erode يقلل من حجم الجرح، فقم بتصحيحه باستخدام Process > Binary > Dilate. - ضع علامة على محيط عائد الاستثمار: تحرير > التحديد > إنشاء تحديد. سيتم تحديد عائد الاستثمار باللون الأصفر. أضفه إلى مدير عائد الاستثمار باتباع تحرير > تحديد > إضافة إلى المدير (الشكل 2G).
- التحقق من صحة التجزئة: افتح نافذة مدير العائد على الاستثمار، وحدد عائد الاستثمار المراد مراجعته: المزيد > ترجمة. أدخل قيم X وY المسجلة في الخطوة 4، ثم اضغط على موافق.
- قم بتكبير الصورة الأصلية، ثم حدد عائد الاستثمار في مدير العائد على الاستثمار. اضبط عائد الاستثمار باستخدام مفاتيح الأسهم حتى يتماشى مع الجرح (الشكل 2H). إذا تطابق عائد الاستثمار مع الجرح، فقد نجح التجزئة. خلاف ذلك ، كرر من الخطوة 2.
- بمجرد تأكيد التجزئة ، احصل على قياسات الجرح: تحليل > القياس. سيعرض جدول النتائج قيم المنطقة والمحيط والموضع X / Y. انسخ هذه القيم إلى برنامج SPSS للتوثيق والتحليل الإحصائي (الشكل 2I).
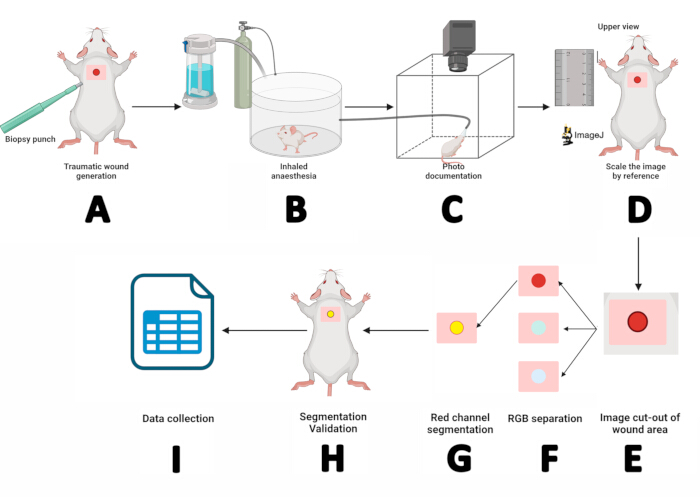
الشكل 2: سير عمل قياس الجرح باستخدام تقنيات قياس المخطط والتجزئة الرقمية. (أ) شق الجلد والبشرة باستخدام لكمة خزعة معقمة 5 مم. (ب) وضع الفأر في حجرة التخدير المستنشقة لمدة 3 دقائق. (ج) توثيق الصور عن طريق وضع الفأر المخدر في كشك التصوير وتثبيت أنفه داخل قناع سيفوفلوران. (د) فتح الصورة التي تم الحصول عليها في ImageJ وتغيير حجمها باستخدام المسطرة كمرجع. (ه) استخراج منطقة الجرح باستخدام أداة المستطيل. (F) فصل الصورة إلى قنوات RGB ومعالجة القناة الحمراء. (ز) تحديد وإدارة منطقة الاهتمام. (ح) التحقق من صحة التجزئة عن طريق مطابقة عائد الاستثمار مع الجرح. (ط) قياس معلمات الجرح وتسجيل النتائج للتحليل الإحصائي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. القتل الرحيم بعد الإجراءات
ملاحظة: تختتم الدراسة بعد 14 يوما ، وعند هذه النقطة تصل الجروح في القوارض السليمة عادة إلى مراحل متقدمة من الشفاء. في هذه المرحلة ، تم القتل الرحيم للفئران بشكل إنساني بعد إجراء القتل الرحيم المعتمد مؤسسيا.
- تجهيز المعدات. تأكد من أن غرفة القتل الرحيم نظيفة وجافة وذات حجم مناسب لاستيعاب الفئران دون اكتظاظ. قم بتوصيل الغرفة بمصدر ثاني أكسيد الكربون2 من الدرجة الطبية مع منظم التدفق.
- انقل الفئران برفق إلى الغرفة لتقليل التوتر. تأكد من أنهم في بيئة هادئة مع الحد الأدنى من الاضطرابات الخارجية.
- اضبط معدل تدفق ثاني أكسيد الكربون2 على 20٪ -30٪ من حجم الغرفة في الدقيقة ، على النحو الموصى به في إرشادات AVMA للقتل الرحيم للحيوانات. قم بزيادة تركيز ثاني أكسيد الكربونتدريجيا لتجنب إحداث الضيق أو الانزعاج لدى الفئران.
- راقب الفئران عن كثب أثناء العملية. ابحث عن علامات فقدان الوعي التدريجي ، بما في ذلك انخفاض النشاط والتنفس ، يليه انقطاع النفس والسكتة القلبية.
- تأكد من الوفاة بمجرد أن تتوقف الفئران عن التنفس ولا تظهر عليها أي علامات على الحركة. انتظر 1-2 دقيقة إضافية لضمان التوقف التام عن الوظائف الحيوية. تحقق من الوفاة من خلال تأكيد عدم وجود ردود أفعال (مثل منعكس القرنية) ونشاط القلب.
- نقل الذبائح إلى حاويات النفايات البيولوجية الخطرة المخصصة. اتباع البروتوكولات المؤسسية والمبادئ التوجيهية الوطنية للتخلص الآمن من بقايا.
- سجل عدد التي تم قتلها رحيما والتاريخ وأي ملاحظات ذات صلة لضمان الامتثال للمعايير الأخلاقية والمؤسسية.
النتائج
بعد تحجيم الصور في برنامج ImageJ ، تم الحصول على متوسط محيط الجروح (الجدول 1) والمساحة (الجدول 2) ، جنبا إلى جنب مع الانحرافات المعيارية الخاصة بها ، من خلال التجزئة الرقمية. تم تسجيل هذه القيم من اليوم صفر إلى اليوم الرابع عشر (D0-D14).
Discussion
في النماذج قبل السريرية ، يواجه التحليل الكمي لتطور الجروح الرضحية في النماذج قبل السريرية تحديات بسبب عوامل مثل حجم الجرح والاستجابة الالتهابية الموضعية34 والموقع و / أو التلاعب. توجد طرق قياس القياس اليدويةالمباشرة 36 والرقمية غير المباشرة
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح يتعلق بهذا البحث.
Acknowledgements
ويود المؤلفان أن يشكروا المجلس الوطني للإنسانية، والعلوم والتكنولوجيا، من خلال المنحة المقدمة من التمويل، والمختبر الوطني للبحوث والتنمية للدراسات النووية على دعمهم. بالإضافة إلى ذلك ، تم إعداد الشكل 2 بمساعدة برنامج BioRender (2020) ، المتاح في BioRender.com/p67z056.
Materials
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
References
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved