Method Article
Количественное определение микро- и нанопластика на основе полибутиленадипаттерефталата из почвы с помощью протонной ядерной магнитно-резонансной спектроскопии
В этой статье
Резюме
Описан метод количественного определения микро- и нанопластиков, происходящих из полибутиленадипаттерефталата в почве, с помощью спектроскопии ядерного магнитного резонанса. Этот метод улучшает существующую методологию, поскольку он распространяется на количественное определение нанопластиков и может быть легко адаптирован для обработки образцов окружающей среды в больших количествах.
Аннотация
Для точной оценки разложения и воздействия на окружающую среду биоразлагаемых пластиковых изделий необходим метод восстановления и количественного определения микро- и нанопластика (МП и НП), образующегося в почве в процессе биоразложения. Присутствие МП и НЧ в почве может изменить свойства почвы, такие как агрегационное поведение, или оказывать токсическое воздействие на почвенную биоту. Существующие методы извлечения МП не всегда подходят для измерения биоразлагаемых полимеров, таких как полибутиленадипаттерефталат (ПБАТ); некоторые распространенные процедуры разложения с кислотами или окислителями могут разрушать биоразлагаемые МП на основе ПБАТ. Методы идентификации, такие как микро-ИК-Фурье и микрорамановская спектроскопия, также ограничены минимальным размером частиц, которые могут быть восстановлены и проанализированы. Поэтому был разработан этот метод для извлечения и количественного определения PBAT из почвы для оценки массовой доли MP и NP в почве без химического преобразования PBAT. В протоколе для селективного извлечения ПБАТ из почвы используется хлороформ-метанольный раствор. Растворитель испаряется из экстракта, а затем экстракт повторно растворяется в дейтерированном хлороформе. Экстракт анализируют методом протонной спектроскопии ядерного магнитного резонанса (1H-QNMR) с количественными параметрами для количественной оценки количества PBAT в каждом образце. Эффективность экстракции растворителем для PBAT колеблется от 76% в тенистой суглинистой почве до 45% в песчаной почве Элкхорн. Извлечение PBAT может быть снижено для фотоокисленных материалов по сравнению с нетронутыми и может быть снижено для почв с высоким содержанием глины. Эффективность экстракции не зависит от концентрации PBAT в пределах тестового диапазона, но для NP наблюдалась более низкая эффективность экстракции, чем для MP. Результаты количественной оценки PBAT были сопоставимы с количественной оценкой разложения пластика путем измерения кумулятивного дыхания почвы в лабораторном инкубационном исследовании.
Введение
Методы измерения загрязнения почвы МП необходимы для понимания масштабов загрязнения почв пластиком1, источников загрязнения пластиком2 и потенциальных решений3. Сельскохозяйственные почвы уникально подвержены загрязнению пластиком: по состоянию на 2021 год в сельском хозяйстве ежегодно используется более 15 миллионов метрических тоннпластика4, в том числе 2,5 миллиона тонн пластиковой мульчи5. Пластиковая мульча используется в тесном контакте с почвой, повторно применяется один или несколько раз в год6, и ее может быть трудно полностью удалить из почвы после окончания срока ее службы7. Одной из ключевых областей, в которой необходимы методы измерения МП, является оценка биоразлагаемых пластиковых изделий, таких как биоразлагаемые пластиковые мульчи, для использования в овощных системах8.
Биоразлагаемые в почве пластиковые изделия являются многообещающей альтернативой обычному сельскохозяйственному пластику, потому что они могут устранить пластиковое загрязнение почвы путем пластикового мульчирования, если они работают должным образом. В 2022 году в мире было произведено менее 1 миллиона метрических тонн биоразлагаемого пластика, при этомв отрасли ожидается быстрый рост9. Четыре наиболее распространенных биоразлагаемых полимера: полимолочная кислота (PLA), полимеризованный крахмал, полигидроксиалканоаты (PHA) и полибутиленадипаттерефталат (PBAT) используются в коммерческих или экспериментальных целях в сельскохозяйственной биоразлагаемой пластиковой мульче10. Несмотря на их многообещающие результаты, разложение этих биоразлагаемых пластиковых изделий в полевых условиях варьируется11. В то время как некоторые исследования разложения биоразлагаемой пластиковой мульчи в полевых условиях были сосредоточены на макропластиковых фрагментах11, оценка полного разложения пластиковых материалов требует способности извлекать МП и НЧ из почвы. Количественное определение микропластика из почвы также важно для оценки потенциального негативного воздействия загрязнения МП на почвенные экосистемы12.
Некоторые часто используемые методы идентификации и количественного определения МП включают визуальный анализ, микрофурье-преобразованную инфракрасную спектроскопию (μFTIR), микрорамановскую спектроскопию (μRaman), газовую хромато-масс-спектроскопию (GCMS, включая пиролиз, GCMS и термическую экстракционную десорбцию GCMS) и термогравиметрическийанализ13. Другие разрабатываемые методы включают ближнюю инфракрасную спектроскопию для измерения МП in situ в почвах14, экстракцию метилэтерификации жирных кислот для анализа GCMS15 и спектроскопию ядерного магнитного резонанса16. В 90% исследований по количественному определению МП в почве использовался визуальный анализ (отдельно или в сочетании с другими методами) для идентификации пластиковых частиц, в то время как в 77%использовались методы ИК-Фурье, Рамана или GCMS-спектроскопии. Разработка и гармонизация разнообразных методов количественной оценки МП может помочь расширить возможности научного сообщества по ответу на различные вопросы исследований в области микропластика18. Существуют три общих подхода к подготовке образцов почвы для количественного определения микропластика: 1) выделение отдельных частиц микропластика в неизменном виде из почвы (например, путем разделения по плотности), 2) извлечение преобразованного пластика или полимерного материала (например, путем растворения) или 3) анализ сыпучего грунта. Как ИК-ИК, так и спектроскопия комбинационного рассеяния света требуют, чтобы отдельные МП были отделены от почвы до того, как они могут быть химически идентифицированы19, в то время как пиро-ГКМС может быть выполнена на изолированных пластиковых частицах, отделенных от почвы или сыпучего грунта20. Отделение биоразлагаемых МП от почвы может быть затруднено, потому что некоторые сбраживающие вещества, используемые для удаления органического вещества из почвы, могут разлагать или иным образом химически изменять биоразлагаемые полимеры, включая PBAT21. Микрорамановская спектроскопия и μИК-Фурье спектроскопия также имеют предел пространственного разрешения: частицы должны быть размером более 10-20 мкм для μИК-Фурье и 1 мкм для мкФургонье (если отдельные частицы такого размера могут быть подготовлены для анализа)19,22. Эти методы могут обеспечить химическую идентификацию полимеров МП, а спектроскопическая визуализация может быть использована для измерения размера МП22. Все типы пиро-ГКМС ограничены тем, что образцы разрушаются во время анализа.
ЯМР был успешно использован для определения характеристик компонентов почвы и загрязняющих веществ23, для количественного определения МП 16,24,25,26 и для оценки деградации ПБАТ и другого полимера, полистирола27,28. При прохождении с количественными параметрами 1H-ЯМР-спектроскопия позволяет получить спектры, в которых площадь каждого спектрального пика прямо пропорциональна количеству составляющих водорода в образце; Это позволяет количественно определить составляющие компоненты в образце29. ЯМР является ценным аналитическим методом для количественного определения некоторых МП, включая PBAT, в почве, поскольку он позволяет проводить одновременную количественную оценку и идентификацию, подходит для сложных и нечистых смесей и не требует химически идентичных стандартных образцов30,31. ЯМР-спектроскопия экстракта растворителя может количественно определять МП или НЧ меньшего размера, чем те, которые могут быть обработаны для количественного определения μFTIR, μRaman или GCMS. Несмотря на эти преимущества, количественные подходы ЯМР по-прежнему обеспечивают более низкую чувствительность, чем подходы, основанные на деструктивной масс-спектроскопии32.
Предлагаемый метод, представленный на рисунке 1, описывает рабочий процесс обработки и анализа образцов почвы, содержащих PBAT, включая наноразмерные пластики PBAT. В этом методе полимер PBAT извлекают из образцов почвы путем встряхивания почвы смесью хлороформа и метанола. Экстракты растворителей, содержащие ПБАТ, сушат, а затем повторно растворяют в дейтерированном хлороформе с добавлением внутреннего калибра. На экстрактах проводят ЯМР-спектроскопию с использованием количественных параметров. Полученные спектры анализируются для количественной оценки PBAT путем сравнения площади аппроксимированных пиков, соответствующих атомам водорода PBAT и молекул калибра. В этом методе используется подход экстракции растворителем и протонной ядерной магнитно-резонансной спектроскопии (1H-ЯМР), продемонстрированный Nelson et al.33. Цель состояла в том, чтобы использовать метод, подходящий для обработки образцов в масштабе окружающей среды (~100 г почвы) и для параллельной обработки ряда образцов без специализированного оборудования для экстракции.
протокол
1. Сбор и подготовка почвы
ПРИМЕЧАНИЕ: Оборудование для отбора проб и обработки не должно содержать полимер PBAT или его составляющие во избежание загрязнения пробы. Другие полимерные материалы не обязательно препятствуют количественному определению PBAT из почвы. Например, полиэтилен и полипропилен не образуют спектральных пиков в хлороформе 1H-ЯМР, которые мешают количественному определению PBAT34, но полиэтилентерефталат с его терефталатной группой, скорее всего, будет мешать35, как и другие сложные полиэфиры. Справочные тексты, такие как Brandolini и Hills34 , могут быть использованы для определения спектров 1H-ЯМР различных полимеров и скрининга перекрывающихся пиков с пиками PBAT, используемыми для количественной оценки (описаны ниже).
- Соберите не менее 100 г эквивалента сухого веса почвы для каждого образца. Определение размера образца почвы на основе ожидаемой концентрации пластика для сбора репрезентативной пробы и гомогенизации почвы для сбора подобразца, если это необходимо36.
ПРИМЕЧАНИЕ: Почвенные системы по своей природе неоднородны37, как и распределение загрязняющих веществ (например, МП) внутри них38. Существует также вариативность, связанная с методами, используемыми для измерения концентраций загрязняющих веществ39. В связи с этим рекомендуется разработать схему отбора проб или экспериментальную схему, включающую повторные образцы в качестве инструмента для оценки неопределенности и сбора репрезентативных объемов проб на основе концентрации пластика40. Документально подтверждено, что концентрации МП в почве варьируются от почти нуля до 1 x 107 ед. на кг почвы, при этом на большинстве участков содержится менее 10 000 ед. на кг почвы41. Теоретически репрезентативный элементарный объем может находиться в диапазоне от 23м2 при концентрации МР 10 единиц на квадратный метр до 0,02м2 при концентрации МП 10 000 единиц на квадратныйметр36.- Чтобы увеличить эффективную площадь отбора проб с полевого участка при минимизации количества почвы, которую необходимо обработать, соберите почву с большой площади (например, 1м2), а затем используйте метод четвертования для гомогенизации и консолидации пробы (например, до 500 г почвы)36.
- При методе четвертования насыпьте грунт с большой площади на брезент или другую поверхность, тщательно перемешайте с помощью лопаты, затем разделите на четвертинки. Оставьте одну четверть образца и выбросьте остальные три четверти. Повторяйте этот процесс до тех пор, пока образец не достигнет нужного размера.
- Просейте почву через сито с ячейкой 2 мм. Полностью очистите сито и поддон между образцами почвы.
- Высушите почву на воздухе, затем храните в герметичных пакетах для образцов. Сухая почва может храниться в таком состоянии до извлечения PBAT.
2. Извлечение ПБАТ из грунтов
ВНИМАНИЕ: Хлороформ летуч и токсичен. Храните его в темноте в янтарном стекле, вдали от окислителей. Во время работы с ним надевайте соответствующие перчатки, средства защиты глаз и защитную одежду. Обрабатывать его можно только в вытяжном шкафу. Метанол легковоспламеняющийся, летучий и токсичный. Храните метанол в огнеупорном шкафу. При работе с метанолом надевайте соответствующие перчатки, средства защиты глаз и защитную одежду. Обрабатывать метанол можно только в вытяжном шкафу. Стеклянная посуда может разбиться и привести к травмам. Надевайте защитные очки при работе со стеклянной посудой. Не прикасайтесь к битому стеклу голыми руками. Вместо этого убирайте битое стекло с помощью устойчивых к порезам перчаток, щипцов, метлы или другого инструмента.
ПРИМЕЧАНИЕ: Хлороформ не совместим с большинством пластмасс или металлов. Убедитесь, что все материалы совместимы друг с другом (например, стекло или политетрафторэтилен, пластик ПТФЭ).
- В вытяжном шкафу приготовьте 100 мл смеси хлороформа 90:10 об/в (трихлорметан; CHCl3) и метанол (CH3OH) на каждую извлекаемую пробу. Например, для извлечения из 5 образцов смешайте 450 мл хлороформа с 50 мл метанола.
- Добавьте 100 г сухой почвы, 100 мл раствора хлороформа-метанола и 20 стеклянных шариков в стеклянную банку для экстракции. Плотно закройте экстракционные банки крышками с покрытием из ПТФЭ, чтобы пары растворителя не могли выйти из банок.
ПРИМЕЧАНИЕ: ПБАТ хорошо растворяется в хлороформе; Использовали смесь хлороформа и метанола, поскольку метанол может образовывать водородные связи с растворенными веществами, конкурируя с почвенными минеральными и органическими компонентами и увеличивая извлечение PBAT из почвы33. - Используйте вибростенд для встряхивания банок для экстракции в течение 8 часов при 200 об/мин. После встряхивания дайте почве в банках для экстракции отстояться не менее 4 ч.
- Отделите вытяжку от почвы. В вытяжном шкафу откройте крышку экстракционной банки и переведите жидкость пипеткой через качественный бумажный фильтр с размером пор 11 мкм в промаркированную чистую стеклянную банку. Запишите объем растворителя, извлеченного из банки для экстракции. Избегайте переноса твердых частиц почвы вместе с экстрактом; При необходимости оставьте несколько мл растворителя.
ПРИМЕЧАНИЕ: Фильтровальная бумага предназначена для удаления крупных частиц органических веществ из растворителя. - Высушите экстракты, оставив их в вытяжном шкафу до полного испарения растворителя. Это может занять до 24 часов. Просушите почву и в вытяжном шкафу. Как только почва полностью высохнет, выбросьте ее.
- Как только экстракты высохнут, закройте крышкой каждую банку с образцами и храните их в прохладном, темном сухом месте до тех пор, пока они не понадобятся.
3. Сбор спектров ЯМР
ВНИМАНИЕ: Дейтерированный хлороформ представляет те же риски и требует тех же мер предосторожности, что и протонированный хлороформ, описанный выше.
- Добавьте к образцу внутренний калибр42 . Используйте весы, чтобы взвесить 1,00 мг 1,4-диметоксибензола (DMB; C6H14O) в каждую банку с образцом, содержащую высушенный экстракт.
- Повторно суспендируйте образец в дейтерированном хлороформе (CDCl3; трихлор(дейтеро)метан). В вытяжном шкафу с помощью микропипетки добавьте 500 мкл дейтерированного хлороформа в банку с высушенным экстрактом образца.
- Закройте банку крышкой и встряхните, чтобы высохший экстракт растворился, осторожно постучав банкой по руке или столешнице, примерно в 10 раз с каждой стороны. Затем с помощью чистого наконечника пипетки переложите жидкость в ЯМР-трубку.
- Повторите шаги 3.2 и 3.3 с добавлением еще 500 мкл дейтерированного хлороформа, добавив вторую порцию образца в ту же ЯМР-пробирку, что и первую. Второе полоскание призвано обеспечить полное растворение и извлечение высушенной вытяжки из емкости.
- Закройте пробирку ЯМР и храните ее в течение 3 дней, прежде чем собирать спектры ЯМР. Подходящее время хранения будет зависеть от скорости испарения растворителя из ЯМР-трубки. Анализируйте образцы вскоре после их подготовки с помощью дейтерированного хлороформа.
- Для транспортировки ЯМР-трубок к спектрометру используйте держатель, предназначенный для поддержки длинных тонких трубок. Они обычно имеют опору у основания и верхней части трубы. Во время транспортировки держите трубки в вертикальном положении.
- Используя ЯМР-спектрометр с частотой 500 МГц, соберите спектр протонов 1 Н с углом импульса 90° 29, длительностью импульса 8 мкс33, временем задержки 25 с (определенным по результатам эксперимента по восстановлению инверсии29,43), 262 тыс. точек на сканирование и 32 составных сканирования29,44 с углом импульса 90°29 для общего времени выполнения 25 минут.
ПРИМЕЧАНИЕ: Мы использовали спектрометр Bruker Neo 500 МГц с широкополосным зондом и автосамплером при контролируемой температуре 300 К. Могут использоваться и другие подобные спектрометры. При использовании прибора с другой напряженностью магнитного поля соответствующее время задержки может быть рассчитано на основе времени релаксации Т1 для PBAT и 1,4-диметоксибензола с использованием эксперимента по восстановлению инверсии29,43. - После запуска выборки сохраните, передайте или получите доступ к спектральным данным по мере необходимости.
Проверка спектральных данных. Убедитесь, что все пики PBAT, используемые при количественной оценке, четко разрешены, если они присутствуют. Для количественной оценки используйте пики PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) и 3 (4,09 ppm) (подробности в таблице 1). Используйте пики DMB A (6,84 ppm) и B (3,77 ppm) также для количественной оценки (подробности в таблице 2). Обратите особое внимание на 6, 6', 3' и 3 пика PBAT, которые расположены очень близко друг к другу и могут перекрываться. - Если некоторые пики четко не прописаны, разбавьте пробу. Смешайте 100 мкл образца и 500 мкл дейтерированного хлороформа в чистой ЯМР-пробирке и повторно запустите образец с теми же параметрами, определенными на шаге 3.7.
4. Анализ спектров ЯМР для количественного определения PBAT
ПРИМЕЧАНИЕ: Спектральный анализ может быть проведен в любое время после сбора. Предпочтительно анализировать данные в тот же день, когда были получены спектры, чтобы гарантировать, что образцы все еще доступны для повторного запуска в случае каких-либо проблем.
- Откройте файл FID, созданный спектрометром, в программе обработки NMR FID (мы использовали MestreNova от MestreLab, другие варианты, но доступны и другие варианты).
- Примените уширение линий к спектрам: В программном обеспечении для обработки FID выберите «Шаблон обработки » в меню «Обработка», затем перейдите в раздел «Аподизация». Выберите экспоненциальную модель с амплитудой 0,5 Гц и первой точкой 0,5 Гц.
- Примените автоматическую коррекцию фазы, нажав кнопку « Автоматическая коррекция фазы » в меню «Обработка». Примените автоматическую коррекцию базовой линии, нажав кнопку « Автоматическая коррекция базовой линии » в меню «Обработка».
- Используйте деконволюцию пиков для подгонки измеренных спектральных пиков: на вкладке «Анализ» программы обработки спектров в разделе «Подгонка» нажмите кнопку «Новая подгонка ». Используйте курсор, чтобы щелкнуть по спектрам со сдвигом 8,5 ppm, затем перетащите курсор на сдвиг 3,0 и отпустите.
- Нажмите «Таблица подгонки линии» в разделе «Подгонка», чтобы просмотреть все подогнанные пики.
- Сохраните пики, используемые для количественной оценки, как описано в Таблице 1 и Таблице 2 и обозначены на Рисунке 2. Используйте пики PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) и 3 (4,09 ppm) для количественного определения (подробности в таблице 1), а также пики DMB A (6,84 ppm) и B (3,77 ppm). Атомы водорода, соответствующие каждому пику, перечисленному в Таблице 1 и Таблице 2, обозначены на структурных схемах на Рисунке 3, где на Рисунке 3А показана структура двух димеров PBAT, на Рисунке 3В показано, как положение димеров в полимере взаимодействует с изменением сдвига пика в водороде от мономера 1,4-бутандиола. и на рисунке 3C, показывающем структуру DMB.
- Удалите все остальные пики из посадки, выбрав ненужные пики и нажав кнопку «Удалить пик».
- Используйте таблицу подгонки, чтобы скопировать площадь каждой вершины в приложение для электронных таблиц для расчетов (мы выбрали электронную таблицу).
- Чтобы скопировать пиковые площади в электронную таблицу, сначала выберите всю информацию о пиках в таблице подгонки линий. Затем щелкните правой кнопкой мыши и выберите «Копировать » во всплывающем меню. Вставьте данные в таблицу.
- Рассчитайте количество молей ДМБ, добавленных в образец, nДМБ, используя уравнение
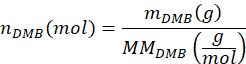
где mDMB — масса DMB, добавленного к образцу, в граммах (рекомендуется 1,00 мг), а MMDMB — молярная масса DMB (138,17 г/моль). - Вычислить количество молей димера бутилентерефталата PBAT в образце, nBT, используя уравнение
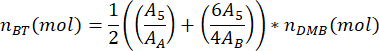
где A5 – измеренная площадь пика PBAT 5, AA – измеренная площадь пика A DMB, а AB – измеренная площадь пика B DMB. Единицы площади, полученные с помощью программного обеспечения для спектрального анализа, являются произвольными. - Вычислить количество молей димера бутиленадипата PBAT в образце, nБА, используя уравнение

где A3 – измеренная площадь пика PBAT 3', A3' – измеренная площадь пика PBAT 3', A6 – измеренная площадь пика PBAT 6', а A6' – измеренная площадь пика PBAT 6'. Единицы площади, полученные с помощью программного обеспечения для спектрального анализа, являются произвольными. - Рассчитайте массу ПБАТ в образце, мПБАТ, восстановленном, с помощью уравнения
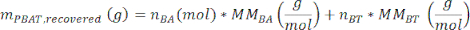
где MMBA — молярная масса димера BA из PBAT (200 г/моль), а MMBT — молярная масса димера BT из PBAT (220 г/моль). - Если в образце присутствовало известное количество ПБАТ, то процент восстановления, η, может быть рассчитан для образца в качестве меры эффективности экстракции в соответствии с уравнением
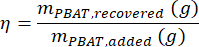
- Рассчитайте концентрацию PBAT в образце, CPBAT, используя уравнение
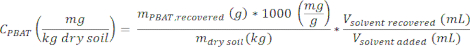
где mсухая почва — масса сухой почвы, использованной для производства экстракта (0,1 кг), Vвосстановленный растворитель — объем растворителя, извлеченного из почвы на стадии 2.4, а Vдобавленный растворитель — исходное количество растворителя, добавленного в образец почвы (100 мл).
5. Подготовка калибровочной кривой для количественного определения PBAT из конкретного грунта
ПРИМЕЧАНИЕ: Калибровочная кривая, созданная на основе образцов почвы с добавлением известных количеств PBAT, предоставит полезную информацию о том, как PBAT извлекается и восстанавливается из конкретной почвы. Экстракция не одинакова для всех почв или всех форм PBAT. Мы подозреваем, что эффективность добычи зависит от содержания глины и органических веществ в почве33, и рекомендуем создать калибровочную кривую для каждого интересующего ряда почвы и горизонта. Калибровочная кривая может быть создана до или после обработки неизвестных образцов с помощью этого метода.
- Соберите и подготовьте эквивалент 2,5 кг сухой почвы, как описано в шагах 1.1-1.3.
- Определение диапазона, который должен быть охвачен калибровочной кривой; максимальная концентрация ПБАТ, используемая в калибровочной кривой, должна быть выше, чем самая высокая концентрация ПБАТ среди неизвестных образцов.
- Приготовьте или получите достаточное количество пластика PBAT для создания 5 образцов с шипами по 100 г почвы с концентрацией 0%, 25%, 50%, 75% и 100% от максимальной концентрации (всего 25 образцов). Например, если желаемая максимальная концентрация составляет 40 мг/кг, то для создания образцов с шипами потребуется в общей сложности 50 мг ПБАТ.
- Подготовьте по 25 образцов по 100 г грунта каждый. Взбейте образцы, взвесив пластик на основе PBAT и добавив его в образцы почвы в установленных нормах. Например, если желаемой максимальной концентрацией является 40 мг/кг ПБАТ, создайте 5 образцов без ПБАТ, 5 образцов с 1 мг ПБАТ, 5 образцов с 2 мг ПБАТ, 5 образцов с 3 мг ПБАТ и 5 образцов с 4 мг ПБАТ. После добавления ПБАТ в почву хорошо перемешиваем.
- Извлеките PBAT из 25 образцов с шипами, затем соберите спектры ЯМР из экстрактов и проанализируйте полученные спектры, как описано в шагах с 2.1 по 4.16.
- Определите уравнение калибровочной кривой для PBAT в этой почве, выполнив линейную регрессию между измеренным количеством PBAT в каждом образце с шипами и фактическим количеством PBAT, добавленным в инструменте статистического анализа. Мы использовали электронную таблицу. Если в пиковых образцах не обнаружен PBAT без добавления PBAT, то сила b = 0 в регрессии.
ПРИМЕЧАНИЕ: Тест линейной регрессии оценивает силу линейной зависимости между двумя непрерывными числовыми переменными x и y в соответствии с соотношением y = mx + b. С помощью теста вычисляются значения m и b, которые лучше всего соответствуют данным. Коэффициент r2 регрессионного теста описывает, насколько тесно коррелируют эти две переменные друг с другом. - Проверьте наличие значимой взаимосвязи между эффективностью экстракции и концентрацией PBAT с помощью инструмента статистического анализа. Рассчитайте эффективность экстракции PBAT из образцов с шипами как
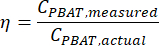
- Используйте инструмент статистического анализа для вычисления вероятности того, что наблюдаемые данные могут возникать случайным образом без корреляции между эффективностью добычи и концентрацией PBAT. Если это p-значение больше заданного порога значимости, α, то оно не может отвергнуть нулевую гипотезу об отсутствии связи между двумя переменными. Если это так, то можно предположить, что эффективность экстракции постоянна для всех концентраций PBAT в пределах испытуемого диапазона. Если нулевая гипотеза отвергнута, описанная здесь линейная модель может оказаться не лучшим способом моделирования данных.
- Используйте уравнение линейной регрессии калибровочной кривой для оценки количества PBAT в неизвестных образцах, обработанных с помощью этого метода. Если переменная регрессии x была фактическим количеством PBAT в выборках с пиками калибровочной кривой, переменная y была измеренным количеством PBAT, а b было установлено равным 0, то
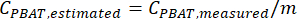
ПРИМЕЧАНИЕ: Содержание PBAT в реплицированных образцах, оцененное с помощью уравнения калибровочной кривой, может быть использовано для создания доверительного интервала для количества PBAT в конкретной почве, или, если среднее значение и доверительный интервал могут быть рассчитаны для концентраций PBAT в реплицированных экстрактах, то калибровочная кривая может быть применена для оценки концентрации PBAT в почве. Любой порядок операций дает одинаковый доверительный интервал для содержания PBAT в почве. Например, рассмотрим экстракты из 10 повторяющихся образцов, которые имеют концентрации PBAT 10, 5, 2, 4, 10, 11, 2, 6, 8 и 5 мг/кг, и уравнение калибровочной кривой y (измеренный PBAT в экстракте) = 0,75 x (истинный PBAT в почве). Концентрации PBAT в почве в каждой реплике могут быть оценены как 13, 7, 3, 5, 13, 15, 3, 8, 11 и 7 мг/кг. Тогда средняя концентрация ПБАТ в почве будет оценена в 8,4 мг/кг со стандартным отклонением 4,4 мг/кг. Если сначала рассчитать среднее значение и стандартное отклонение для концентраций ПБАТ в экстракте (10, 5, 2, 4, 10, 11, 2, 6, 8 и 5), то будет рассчитано среднее значение 6,3 мг/кг и стандартное отклонение 3,3 мг/кг. Затем калибровочная кривая может быть применена как к среднему, так и к стандартному отклонению для оценки концентрации ПБАТ в почве: среднее значение 8,4 мг/кг, стандартное отклонение 4,4 мг/кг.
Результаты
Для оценки эффективности этого метода в количественном определении полимера PBAT из почвы были построены калибровочные кривые путем извлечения PBAT из образцов с шипами, созданных из трех различных почв. Для каждого из трех почв (подробнее см. Таблицу 3) почву пропускали через сито толщиной 2 мм, а затем сушили на воздухе. Образцы с шипами создавали путем добавления 0, 9, 18, 27 или 36 мг МП на основе ПБАТ на 100 г сухой почвы (по 5 повторений каждого). Это эквивалентно 0, 63, 126, 189 или 252 мг/кг полимера ПБАТ. МП изготавливали из пластиковой мульчи с 70% PBAT по массе и толщиной 50 мкм в соответствии с процедурой измельчения, описанной в Astner et al.45 , и имели размер менее 840 мкм. Для создания каждой калибровочной кривой PBAT извлекался из каждого образца с шипами в соответствии с процедурой, описанной выше. Затем извлечение PBAT сравнивали с количеством PBAT, добавленным в каждый образец. Также проверяли скорость извлечения и количественное определение НЧ (средний диаметр 780 нм, индекс полидисперсии 0,77, подготовленные по Astner et al.45) в одной почве (тенистый суглинок).
Для всех почв в пробах без добавления PBAT не было обнаружено PBAT, т.е. ложноположительных результатов данного метода не наблюдалось. На дополнительном рисунке 1 показан спектр, собранный из тенистой суглинистой почвы, которая не содержала PBAT (и содержала DMB, добавленный в процессе приготовления). Два характерных пика от внутреннего калибра DMB присутствуют, а характерные пики PBAT отсутствуют. Для почв с добавленным PBAT присутствовали пять характерных пиков, используемых для идентификации PBAT. На рисунке 2 показан спектр, собранный из тенистой суглинистой почвы с добавлением 63 мг/кг ПБАТ. Все пики PBAT и DMB, используемые при количественной оценке, четко определены. На дополнительном рисунке 2 показана подогнанная область спектра, показанная на рисунке 2 , с наложенными интегрированными пиками. Из-за перекрытия 3, 3', 6 и 6' пиков с другими сигналами в спектре важно рассчитывать содержание PBAT на основе интегралов аппроксимированных пиков, а не простых интегралов пиков. Это устраняет площадь, вносимую другими составляющими почвенного экстракта, и перекрывающиеся пики PBAT. На дополнительном рисунке 3 показано влияние разбавления на спектральное разрешение ЯМР. На рисунке показан спектр, собранный из супесчаного суглинка Элкхорн с добавлением 252 мг/кг ПБАТ. На панели A пики PBAT 3, 3', 6 и 6' в диапазоне 4,5–4,0 ppm не могут быть устранены. На дополнительном рисунке 3B показан спектр, собранный из того же образца после его разбавления в соотношении 1:5 с добавлением дейтерированного хлороформа. После разведения четыре пика становятся четкими, и их площадь может быть подходящей.
Калибровочные кривые различались между тремя протестированными нами грунтами. На рисунке 4 показаны расчетные концентрации PBAT для каждой почвы на основе измеренного PBAT (CPBAT,m) в каждом экстракте по сравнению с фактическим количеством PBAT (CPBAT,a), добавленного в почву. Количество PBAT, извлеченного из тенистых суглинистых почв, сильно коррелировало с количеством добавленного PBAT (r2 = 0,99). Для калибровочной кривой уравнение CPBAT,m = m*CPBAT,a, m = 0,76 ± 0,02 (среднее значение ± одной стандартной ошибки), а m значительно отличалось от нуля (df = 24; F = 2000; p < 1*10-16). PBAT был извлечен с эффективностью η = 76 % ± 10 % (в среднем ± одно стандартное отклонение) из этой почвы. Эффективность извлечения из тенистой почвы не коррелировала с количеством PBAT в образцах (r2 = 0,009; p = 0,7). НЧ восстанавливали с эффективностью η = 59 % ± 8 % (среднее значение ± одним стандартным отклонением). На рисунке 5 показана эффективность извлечения МП и НЧ из суглинка Шейди; эффективность была достоверно ниже для NP (p = 0,0002). Количество PBAT, извлеченного из суглинка Лос-Осос, менее сильно коррелировало с количеством добавленного PBAT (r2 = 0,85), чем в тенистой почве. Для калибровочной кривой уравнение CPBAT,m = m*CPBAT,a, m = 0,57 ± 0,05 (среднее значение ± одной стандартной ошибки), а m значительно отличалось от нуля (df = 23; F = 100; p = 8*10-11). PBAT был извлечен из этой почвы с эффективностью η = 57 % ± 22 % (в среднем ± одно стандартное отклонение). Эффективность экстракции в почве Лос-Осос не коррелировала с количеством PBAT в образцах (r2 = 0,01; p = 0,6). Количество PBAT, извлеченного из супесей Элкхорна, сильно коррелировало с количеством добавленного PBAT (r2 = 0,88). Для калибровочной кривой уравнение CPBAT,m = m*CPBAT,a, m = 0,70 ± 0,05 (среднее значение ± одной стандартной ошибки), а m значительно отличалось от нуля (df = 23; F = 200; p = 5*10-12). PBAT был извлечен из этой почвы с эффективностью η = 70 % ± 14 % (в среднем ± одно стандартное отклонение). Эффективность экстракции не коррелировала с количеством PBAT в образцах (r2 = 0,006; p = 0,7) для почвы Элкхорна.
Кроме того, этот метод был применен для количественного определения PBAT в грунте серии Элкхорн. В этом эксперименте почва Элкхорна была собрана с двух участков на сельскохозяйственном поле, просеяна через сито толщиной 2 мм, а затем высушена на воздухе. Почву смешивали с мульчирующими МП на основе ПБАТ (созданными, как описано выше, диаметр < 840 мкм), с 50 мг МП и 150 г сухой почвы в каждом мезокосме (250 мг/кг ПБАТ) для создания 5 мезокосмов с МП, смешанных с почвой с участка А и 5 с МП, смешанных с почвой с участка В (всего 10). Пять мезокосмов, составленных из почвы с каждого участка без добавления МП, служили отрицательным контролем (всего 10). Мезокосмы инкубировали в течение 6 месяцев для исследования биодеградации мульчирующих МП на основе PBAT. Во время инкубации кумулятивное дыхание почвы измерялось с помощью концентрацийCO2 в надземном пространстве (с помощью инфракрасного газоанализатора) и использовалось для количественной оценки разложения PBAT. Количество пластика, оставшегося в мезокосмах в конце инкубации, рассчитывалось как
CГидроразрыв пласта, конечный = [mПластик, i / CПластик ГРП - (CCO2, пластик добавлен - CCO2 без пластика)*mсухой грунт]/(mПластик, i/ CГРП пластик)
где mсухая почва – количество почвы в каждой инкубационной банке, Cfrac Plastic – содержание углерода в добавленном микропластике, CCO2, добавленный пластик – совокупное количествоCO2 , произведенного в мезокосме с добавлением пластика на грамм сухой почвы, CCO2 no plastic – количествоCO2 , произведенного в мезокосме без добавления пластика на грамм сухой почвы, и mпластика, I — начальная масса добавляемого пластика.
Мы использовали бутстреппинг для оценки доверительных интервалов для остатков пластика в почвах А и В путем расчета остатков пластика с 10 000 теоретических подобразцов случайных пар из 10 экспериментальных мезокосмов с каждого участка. В точке А расчетное среднее количество пластика, оставшегося по данным дыхания, составило 86%, с 95% доверительным интервалом от 62 до >100%. На участке B расчетное среднее значение остатка пластика составило 98% с 95% доверительным интервалом от 79 до >100%. По истечении 6 месяцев содержание PBAT также измеряли с помощью метода экстракции и количественного определения ЯМР, описанного в данной рукописи (n = 5 для сайта A и n = 4 для сайта B). На участке А расчетное среднее количество пластика, оставшегося по данным ЯМР, составило 79% с 95% доверительным интервалом (среднее значение ± 1,96xSE) в диапазоне от 71% до 87%. На участке В расчетное среднее значение остаточного пластика составило 88% с 95% доверительным интервалом от 71% до 100%. На рисунке 6 показаны доверительные интервалы для содержания пластики в почве на двух участках, оцененных двумя различными методами. Оценки содержания пластика, полученные с помощью двух методов, кажутся взаимно согласованными на основе большой доли перекрытия между каждой парой доверительных интервалов.
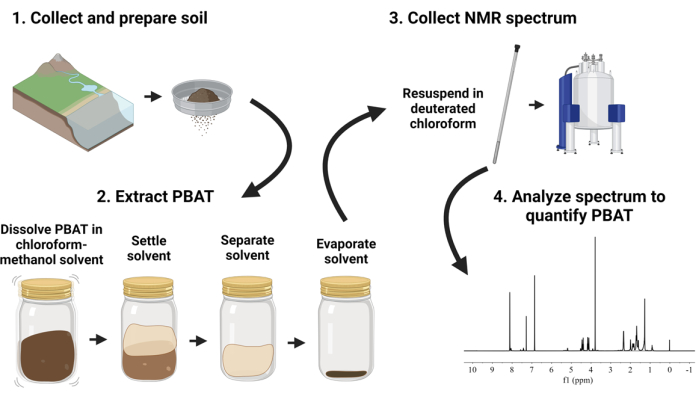
Иллюстрация 1: Визуальный обзор процедуры экстракции и количественного определения полибутиленадипаттерефталата (PBAT). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
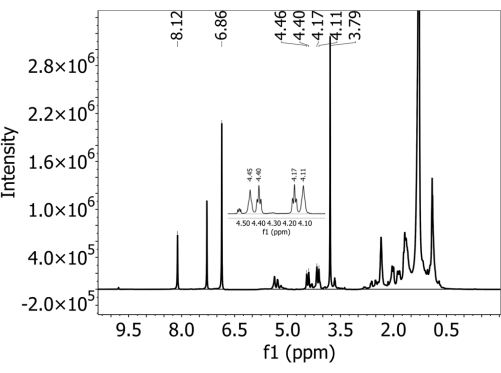
Рисунок 2: 1спектр H-ЯМР, собранный в дейтерированном растворителе хлороформа с помощью спектрометра с частотой 500 МГц на экстракте из тенистой суглинистой почвы с полибутиленадипаттерефталатом (PBAT) MPS. Перед ЯМР-анализом в экстракт добавляли 1,4-диметоксибензол (ДМБ). В спектре присутствуют как PBAT, так и DMB характерные пики. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
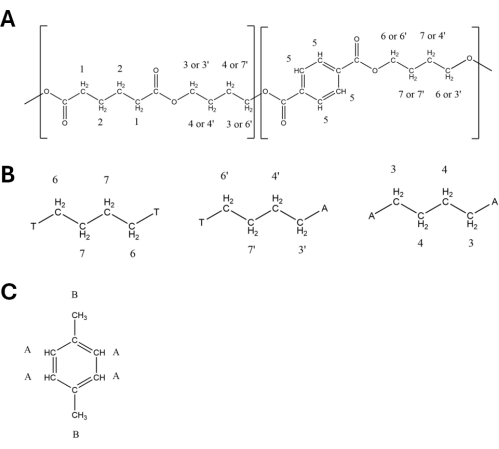
Рисунок 3: Структуры полибутиленадипаттерефталата (ПБАТ) и 1,4-диметоксибензола (ДМБ) с мечеными протонами. Соответствующие структуры показаны в Таблице 1 и Таблице 2. (А) Структура одной единицы БА-БТ ПБАТ. (B) Структура триад T-B-T, T-B-A и A-B-A из PBAT. (c) Структура DMB. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
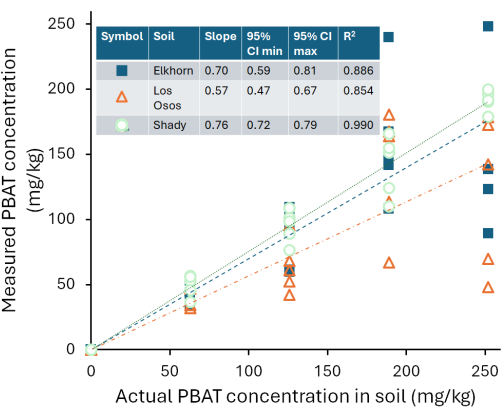
Рисунок 4: Концентрации ПБАТ, измеренные с помощью 1H-QNMR в экстрактах в дейтерированном растворителе хлороформа из тенистой суглинистой почвы, суглинка Лос-Осос и песчаной суглинки Элкхорн, содержащих известные количества PBAT. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
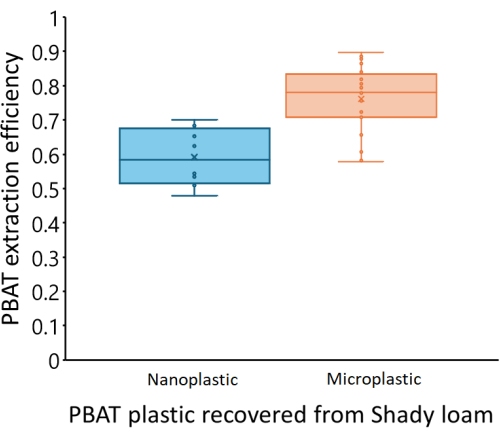
Рисунок 5: Эффективность экстракции PBAT MP и NP из образцов с шипами в тенистой суглинистой почве. Извлечение PBAT значительно ниже для NP (p = 0,0002). Средняя линия каждого прямоугольника представляет среднее значение измеренных точек данных, в то время как верхняя и нижняя границы прямоугольника отражают Q3 и Q1 соответственно. Верхняя и нижняя границы усов отражают максимальную и минимальную точки данных соответственно. Отдельные точки данных отображаются в рамке и на бакенбардах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
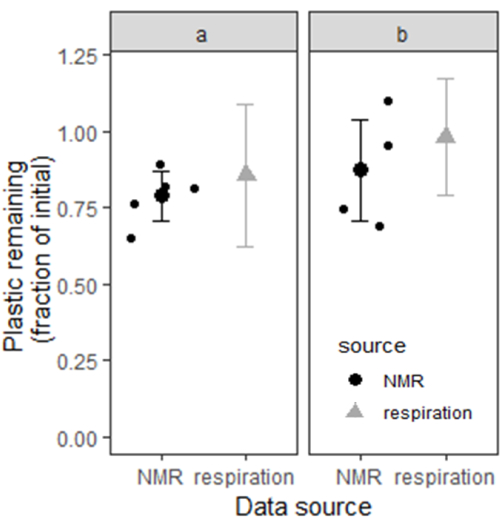
Рисунок 6: Содержание пластика в двух почвах Элкхорна измеряли с помощью кумулятивного инкубационного дыхания и экстракции растворителем в сочетании с ЯМР. Для содержания пластика, измеряемого дыханием, стержни представляют собой начальный 95% доверительный интервал. Для содержания пластика, измеренного с помощью ЯМР, столбцы представляют собой 95% доверительный интервал, основанный на двукратной стандартной ошибке выше и ниже средней оценки (n = 5 для участка a и n = 4 для участка b). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Идентификатор пика | Местоположение | Количество протонов | Многочисленность | Мономер | используется в количественном определении |
| 5 | 8.1 | 4 | Майка | T | да |
| 6 | 4.44 | 2 | Триплет | B | да |
| 6’ | 4.38 | 2 | Триплет | B | да |
| 3’ | 4.15 | 2 | Триплет | B | да |
| 3 | 4.09 | 2 | Триплет | B | да |
| 1 | 2.34 | 4 | Триплет | A | Нет |
| 7 | 1.97 | 2 | Мультиплет | B | Нет |
| 7’ | 1.87 | 2 | Мультиплет | B | Нет |
| 4’ | 1.81 | 2 | Мультиплет | B | Нет |
| 4 | 1.68 | 2 | Мультиплет | B | Нет |
| 2 | 1.66 | 4 | Мультиплет | A | Нет |
Таблица 1: 1H-ЯМР спектральные пики полибутиленадипаттерефталата (ПБАТ) в дейтерированном растворителе хлороформа. Водороды, относящиеся к каждому пику, обозначены на рисунке 3. Присвоения пиковых значений основаны на Herrera et al.27.
| Идентификатор пика | Местоположение | Количество протонов | Многочисленность | Используется в количественном определении |
| A | 6.84 | 4 | Майка | да |
| B | 3.77 | 6 | Майка | да |
Таблица 2: 1H-пики ЯМР 1,4-диметоксибензола (ДМБ) в дейтерированном растворителе хлороформа. Атомы водорода, относящиеся к каждому пику, обозначены на рисунке 3B. Присвоения пиков основаны на Nelson et al.33.
| Серия «Почва» | Классификация | Текстура | Общий органический углерод | pH | Место сбора | Глубина сбора (см) |
| Тенистый | Мелкосуглинистый, смешанный, субактивный, термический Typic Hapludult | Суглинок | 1.70% | 6 | Ноксвилл, штат Теннесси, США | 0-5 |
| Лос-Осос | Тонкий, смектитовый, термический Typic Argixeroll | Суглинок | 3.00% | 6 | Сан-Луис-Обиспо, Калифорния, США | 0-5 |
| Лосиный рог | Тонкосуглинистый, смешанный, сверхактивный, термический Pachic Argixeroll | Супесь | 1% | 7 | Уотсонвилль, Калифорния, США | 0-5 |
Таблица 3: Свойства трех грунтов, которые были использованы для демонстрации метода экстракции PBAT.
Дополнительный рисунок 1: 1спектр H-ЯМР, собранный в дейтерированном растворителе хлороформа с помощью спектрометра с частотой 500 МГц на экстракте суглинка Shady без присутствия полимера PBAT. Характерные пики PBAT отсутствуют, в то время как пики DMB (добавленные как внутренний калибр) присутствуют. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Подогнанная область спектра 1H-ЯМР, как показано на рисунке 4. Спектр собирали в дейтерированном хлороформном растворителе. Зеленым фоном обозначена область спектра, которая была подогнана. Фиолетовые линии показывают подогнанные пики, в то время как красные линии показывают ошибку (части спектрального сигнала, не включенные в подогнанные пики). Пики PBAT 5, 6, 6', 3' и 3 включены в посадку вместе с пиками DMB A и B. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок 3: 1Спектры H-ЯМР в дейтерированном растворителе хлороформа, собранные с помощью спектрометра с частотой 500 МГц на экстракте супесчаных супесей Элкхорна с добавлением PBAT MPS. В спектре присутствуют как PBAT, так и DMB характерные пики. (A) Пики PBAT не могут быть выделены для количественного определения полимера. Если из экстрактов образцов получаются такие спектры, разбавьте образец, а затем используйте его для сбора нового спектра 1H-ЯМР. (B) Тот же экстракт разбавляют таким образом, чтобы все спектральные пики были четко разрешены. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Предложен метод экстракции ПБАТ растворителем из почвы в сочетании с 1Н-ЯМР для количественного определения ПБАТ в экстракте. Ключевыми элементами процесса экстракции являются метод и оборудование экстракции, растворитель, используемый для экстракции, и требования по времени. Мы решили использовать метод экстракции, который требует относительно простого и недорогого оборудования (стеклянные банки, стеклянные бусины и стол для шейкера) по сравнению с экстракцией по методу Сокслета и ускоренной экстракцией растворителем (ASE), продемонстрированной Nelson et al.33. Цель этого метода заключается в том, чтобы можно было извлекать много образцов параллельно с ускорением обработки сыпучих образцов почвы. Еще одно преимущество простой экстракции растворителем заключается в том, что можно вместить большие объемы почвы по сравнению с подходами Сокслета или ASE, что позволяет легче обрабатывать экологически репрезентативные образцы13,36. Мы выбрали растворитель хлороформ-метанол на основе успешных результатов, представленных Nelson et al.33, и доступности дейтерированного хлороформа в качестве растворителя 1H-ЯМР. Мы протестировали ультразвук смесей растворителя и матрицы в соответствии с протоколом, описанным в Nelson et al.33, по сравнению с методом простого встряхивания растворителем и не обнаружили существенной разницы в скоростях восстановления PBAT между двумя методами. Мы обнаружили, что 8 часов встряхивания при 200 об/мин было достаточно для разрушения почвенных агрегатов в 100 г почвенной матрицы для трех протестированных нами почв, в то время как более короткое время встряхивания или более низкие скорости встряхивания были недостаточными. Затем требовалось отстаивание для получения растворителя без частиц почвы. Извлечение PBAT было протестировано с использованием наноразмерных пластиков, и извлечение было значительно ниже, чем у MP. Это означает, что метод может нуждаться в дальнейшем развитии для точного количественного определения проб окружающей среды неизвестных НЧ, но частичное извлечение и измерение НЧ по-прежнему ценно по сравнению с другими методами с ограниченным размером, даже несмотря на то, что информация о размере частиц не может быть получена с помощью этого метода.
В то время как Nelson et al.33 сообщили об эффективности экстракции, близкой к 100% для метода ультразвуковой экстракции, мы обнаружили, что ультразвук и метод экстракции на основе шейкера, описанные здесь, привели к эффективности экстракции значительно ниже 100%. Мы считаем, что это может быть связано с воздействием атмосферного воздействия, в том числе фотоокислением пластиковой мульчи. Nelson et al.33 наблюдали значительно более низкую эффективность экстракции УФ-облученных PBAT MP по сравнению с материалом, не подверженным атмосферному воздействию. Пластик, который мы использовали для тестирования этого метода количественной оценки, подвергался выветриванию на солнце в течение всего вегетационного периода, прежде чем он был переработан в MP. Несмотря на то, что фотостабилизаторы добавляются в коммерческие пластиковые пленки для мульчи, структура полимера мульчи изменяется из-за ультрафиолетового излучения (например, сшивки цепи, которые увеличивают содержание геля в материале)46 в условиях атмосферных воздействий окружающей среды, и деградация полимера может изменить его ЯМР-спектр47. Это может способствовать более низким показателям восстановления PBAT, которые мы наблюдали по сравнению с Nelson et al.33. Мы также обнаружили, что эффективность извлечения PBAT варьировалась между тремя протестированными нами почвами. Тенистая почва содержит в основном малоактивные глины, в то время как две другие почвы содержат смектитовые (Лос-Осос) и смешанные, сверхактивные (Элкхорн) глины. Присутствие высокой активности и глинистых минералов в соотношении 2:1, возможно, ингибировало экстракцию PBAT растворителем из этих почв33,48, что приводило к более низкому извлечению PBAT, которое мы наблюдали. Мы рекомендуем дальнейшие исследования по изучению пластических минеральных ассоциаций в почве на биоразлагаемые МП и НЧ, включая ПБАТ, а также на обычные неразлагаемые полимерные МП и НЧ. Это важно как для понимания того, как полимеры MP могут быть извлечены и измерены из почвы, так и для понимания того, как они могут биоразлагаться или иным образом влиять на почвенные системы.
Ключевыми элементами процесса получения спектра ЯМР являются сила магнита прибора, количество использованных сканирований, время релаксации образца между сканированиями и общее время измерения на образец. Мы использовали спектрометр с частотой 500 МГц; более высокая напряженность магнитного поля обеспечивает большую чувствительность и разрешение в спектрах ЯМР. Спектральное отношение сигнал/шум можно увеличить, собрав повторные сканы одного и того же образца и сложив их вместе. Сбор n сканов увеличит отношение сигнал/шум в √ раза, но увеличит время измерения в29 раз. Это означает, что если для количественного определения PBAT в образце требуется более высокое отношение сигнал/шум, количество сканирований может быть увеличено за счет более длительного времени выполнения выборки. Отношение сигнал/шум 150 для конкретного сигнала необходимо для поддержания погрешности <1% при количественном определении44. В соответствии с нашими параметрами сбора данных (прибор, зонд, количество сканирований) для получения отношения сигнал/шум 150 и, следовательно, ошибки <1% при количественном определении) было необходимо около 5 мг PBAT на образец (или 50 г PBAT на мл экстракта); Эта концентрация специфична для нашей системы сбора данных. Эта концентрация PBAT превышает пределы количественного определения, достигнутые другими методами количественного определения с использованием 1H-ЯМР для количественного определения других типов МП в отсутствие почвы16,24, что свидетельствует о влиянии органического вещества почвы и других совместно экстрагированных соединений на метод количественного определения. Количественный диапазон ПБАТ также ограничен в верхней части из-за расширения линии, наблюдаемого при концентрациях ПБАТ более 25 мг на образец (250 мкг ПБАТ на мл экстракта), что привело к перекрытию пиков ПБАТ, как описано в репрезентативных результатах и показано на дополнительном рисунке 3. Тем не менее, этот метод обеспечивает гибкость в реагировании на эти ограничения, чтобы гарантировать количественную оценку образцов. Количество почвы, используемой для создания экстрактов, может быть увеличено или уменьшено, а экстракты могут быть разбавлены и повторно проанализированы для корректировки концентрации PBAT в оптимальном диапазоне.
Ключевыми элементами процесса количественного определения PBAT на основе спектров ЯМР являются пики, используемые для количественного определения PBAT, использование линейной аппроксимации для расчета пиковых площадей и калибровочная кривая. Концептуально, любая пара пиков PBAT и DMB может быть сравнена, чтобы рассчитать соотношение двух соединений в образце. Мы обнаружили наиболее точные результаты, когда рассчитали отношение БТ/ДМБ как среднее арифметическое площадей пика 5:А и площадей пика 5:В (нормализованных по их соответствующему количеству протонов). Пик 5 PBAT обеспечивает количественное определение только мономера 1,4-бутандиолтерефталата (BT), поэтому площадь пиков 3 и 3' (представляющих мономер 1,4-бутандиол-адипат, или BA) сравнивали с площадью пиков 6 и 6' (представляющих мономер BT) для количественной оценки групп BA, присутствующих в образце. Количество BT и BA было сложено, чтобы представить общее оставшееся количество PBAT. Использовать пик PBAT 1 или 2 в количественном определении BA не представлялось возможным из-за интерференции совместно экстрагированных соединений (предположительно являющихся органическим веществом почвы), которые создавали множественные широкие пики в диапазоне 2,7-0,7 ppm. Мы исследовали возможность удаления этих нежелательных сигналов из спектров с помощью коррекции фона (т.е. вычитания пустого спектра из каждого спектра выборки), но обнаружили, что создание эквивалентных сопоставимых фоновых и выборочных спектров без использования калибра является ненадежным. Для вычисления площади аппроксимированных пиков использовалась аппроксимация линий, а не прямое интегрирование спектральных пиков. Из-за перекрытия между пиками PBAT 3 и 3' и между пиками 6 и 6' это позволило получить более точные оценки содержания PBAT на основе предварительного анализа. Мы рекомендуем создать калибровочную кривую для учета различных скоростей извлечения PBAT из разных почв. Коэффициенты извлечения PBAT значительно различались для одной пары из трех протестированных нами грунтов, на что указывают неперекрывающиеся 95% доверительные интервалы для наклона калибровочной кривой. Извлечение PBAT в третьем слое почвы существенно не отличалось от любого из двух других. В отсутствие механистического понимания того, как состав почвы влияет на извлечение PBAT, мы рекомендуем создавать калибровочные кривые для оценки извлечения PBAT в каждой интересующей серии почв и для каждого горизонта в пределах почвенного профиля. Если будет обнаружено, что калибровочные кривые статистически схожи между почвами, почвы могут быть легко проанализированы в комбинации.
Мы считаем, что этот метод может стать ценным инструментом для тех, кто заинтересован в количественном определении МОТ и НЧ PBAT в почве, особенно для количественного определения PBAT в большом количестве образцов, собранных в аналогичных почвах, например, в долгосрочном полевом исследовании биоразложения пластика. Метод ЯМР для количественного определения МП из почвы ценен, потому что он позволяет исследователям, имеющим доступ к ЯМР и обладающим опытом в этой области, внести свой вклад в удовлетворение потребностей развивающейся области, отвечая на важные вопросы о присутствии и поведении МП в почвенных системах. Несмотря на то, что доступ к приборам и экспертным знаниям, вероятно, будет одной из первых практических проблем, ограничивающих выбор исследователями методов количественной оценки, ЯМР не является наиболее эффективным или наиболее подходящим инструментом для количественного определения микропластика из почвы при любых условиях. Информация о форме и размерах частиц не может быть получена с помощью метода экстракции растворителем; если форма и размер МП представляют интерес, исследователям было бы лучше использовать метод идентификации отдельных частиц МП, такой как ИК-Фурье или рамановская спектроскопия. Одним из преимуществ методов экстракции растворителем, подобных представленным здесь и в работе Nelson et al.33 , по сравнению с другими подходами к количественной оценке МП, такими как ИК-Фурье или рамановская спектроскопия, является то, что концептуально не существует ограничений по размеру МП и НЧ, которые могут быть количественно определены; Экстракция растворителем может быть наиболее полезной, когда информация о размере частиц не требуется или когда представляющие интерес частицы слишком трудно отделить другими способами. Пиролиз ГКМС может быть ценен, потому что он имеет более высокую чувствительность, чем ЯМР, но результаты также подвержены матричным эффектам, как, вероятно, и экстракция растворителем PBAT.
Мы надеемся, что дальнейшая работа повысит надежность этого метода за счет устранения коэкстрагированных компонентов почвы, которые влияют на пиковое разрешение PBAT в спектрах ЯМР. Дальнейшая работа также необходима для установления взаимосвязи между выветриванием пластика PBAT и эффективностью экстракции с помощью этого метода, возможно, в сочетании с более детальным пониманием продуктов распада PBAT и их спектров 1H-ЯМР. Основываясь на наших результатах, а также на результатах Nelson et al.33, эта процедура количественной оценки лучше всего подходит для количественного определения невыветренных пластиков PBAT в почвах с низким содержанием органического вещества и без высокоактивных глин. В то время как мы использовали этот метод только для количественного определения МП на основе ПБАТ из почвы, экстракция растворителем и процедура количественного определения 1H-ЯМР могут быть полезны для количественного определения других МП и НЧ из дополнительных почв26,49. Распространение метода на МП, изготовленные из другого полимера, требует обеспечения растворимости полимера в растворителе и идентификации характерных пиков ЯМР от полимера в выбранном растворителе. Может возникнуть необходимость в выборе нового внутреннего калибра, который растворим в выбранном растворителе и который не образует пиков, перекрывающихся с пиками исследуемого полимера42.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье.
Благодарности
Благодарим USDA-NIFA за финансирование этого проекта в виде гранта No 2020-67019-31167 SMS и программе Исследовательских инициатив стратегического планирования Университета Теннесси (SPRINT) за внутренний грант DGH и SMS. Спонсоры не играли никакой роли в дизайне исследования, сборе, анализе, интерпретации данных, написании отчета или принятии решения о представлении статьи для публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Ссылки
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены