Method Article
Cuantificación de micro y nanoplásticos a base de tereftalato de adipato de polibutileno del suelo mediante espectroscopía de resonancia magnética nuclear de protones
En este artículo
Resumen
Aquí se describe un método para cuantificar micro y nanoplásticos originados por tereftalato de adipato de polibutileno en el suelo utilizando espectroscopia de resonancia magnética nuclear. Esta técnica mejora la metodología existente porque se extiende a la cuantificación de nanoplásticos y se puede adaptar fácilmente para el procesamiento de muestras ambientales a granel.
Resumen
Se necesita un método para recuperar y cuantificar los micro y nanoplásticos (MP y NP) formados en el suelo durante la biodegradación para evaluar con precisión la degradación y el impacto ambiental de los productos plásticos biodegradables. La presencia de MP y NP en el suelo puede alterar las propiedades del suelo, como el comportamiento de agregación, o tener efectos tóxicos en la biota del suelo. Los métodos de recuperación de MP existentes no siempre son adecuados para medir polímeros biodegradables como el tereftalato de adipato de polibutileno (PBAT); algunos procedimientos comunes de digestión con ácidos u oxidantes pueden destruir los MP biodegradables basados en PBAT. Los métodos de identificación, como la espectroscopia micro-FTIR y la micro-Raman, también están limitados por el tamaño mínimo de las partículas que se pueden recuperar y analizar. Por lo tanto, este método se desarrolló para extraer y cuantificar PBAT del suelo para evaluar la fracción de masa de MPs y NP en el suelo sin transformar químicamente el PBAT. En el protocolo, se utiliza una solución de cloroformo-metanol para extraer selectivamente PBAT del suelo. El solvente se evapora del extracto y luego el extracto se vuelve a disolver en cloroformo deuterado. El extracto se analiza mediante espectroscopía de resonancia magnética nuclear de protones (1H-QNMR) bajo parámetros cuantitativos para cuantificar la cantidad de PBAT en cada muestra. Las eficiencias de extracción con solventes para PBAT oscilan entre el 76% en un suelo franco sombreado y el 45% en un suelo franco arenoso Elkhorn. La recuperación de PBAT puede reducirse para los materiales fotooxidados en comparación con los prístinos y puede reducirse en suelos con alto contenido de arcilla. Las eficiencias de extracción no dependen de la concentración de PBAT dentro del rango de prueba, pero se observaron eficiencias de extracción más bajas para las NP que para las MP. Los resultados de la cuantificación de PBAT fueron comparables a la cuantificación de la degradación del plástico mediante la medición de la respiración acumulativa del suelo en un estudio de incubación de laboratorio.
Introducción
Los métodos para medir la contaminación por MP en el suelo son necesarios para comprender el alcance de la contaminación plástica en los suelos globales1, las fuentes de contaminación plástica2 y las posibles soluciones3. Los suelos agrícolas están expuestos de manera única a la contaminación plástica: más de 15 millones de toneladas métricas de plástico se utilizan en la agricultura cada año a partir de 20214, incluidas 2,5 millones de toneladas de mantillo plástico5. El mantillo plástico se utiliza en estrecho contacto con el suelo, se reaplica una o más veces al año6 y puede ser difícil de eliminar completamente del suelo después de su vida útil7. Un área clave en la que se necesitan métodos de medición de MP es en la evaluación de productos de plástico biodegradables, como los mantillos de plástico biodegradables, para su uso en sistemas vegetales8.
Los productos plásticos biodegradables en el suelo son alternativas prometedoras a los plásticos agrícolas convencionales porque podrían eliminar la contaminación plástica del suelo por el acolchado plástico si funcionan según lo previsto. En 2022, se produjeron menos de 1 millón de toneladas métricas de plástico biodegradable en todo el mundo, y se espera un rápido crecimiento para la industria9. Los cuatro polímeros biodegradables más comunes, el ácido poliláctico (PLA), el almidón polimerizado, los polihidroxialcanoatos (PHA) y el tereftalato de adipato de polibutileno (PBAT), se utilizan comercial o experimentalmente en acolchados de plástico biodegradables agrícolas10. A pesar de su promesa, la degradación de estos productos plásticos biodegradables en condiciones de campo es de variable11. Si bien algunos estudios sobre la degradación del mantillo plástico biodegradable en el campo se han centrado en fragmentos macroplásticos11, la evaluación de la degradación completa de los materiales plásticos requiere la capacidad de recuperar MP y NP del suelo. La cuantificación de microplásticos del suelo también es importante para evaluar el potencial de impactos negativos en los ecosistemas del suelo de la contaminación por MP12.
Algunas técnicas comúnmente utilizadas para la identificación y cuantificación de MP incluyen el análisis visual, la espectroscopia infrarroja microtransformada de Fourier (μFTIR), la espectroscopia micro-Raman (μRaman), la cromatografía de gases-espectroscopia de masas (GCMS, incluida la pirólisis, GCMS y la desorción por extracción térmica, GCMS) y el análisis termogravimétrico13. Otras técnicas en desarrollo incluyen la espectroscopia de infrarrojo cercano para la medición in situ de MP en suelos14, la extracción de esterificación de metilo de ácidos grasos para el análisis GCMS15 y la espectroscopia de resonancia magnética nuclear16. Hasta el 90% de los estudios que cuantificaron los MP en el suelo utilizaron el análisis visual (solo o en combinación con otras técnicas) para identificar partículas de plástico, mientras que el 77% utilizó técnicas de espectroscopia FTIR, Raman o GCMS17. El desarrollo y la armonización de una gran variedad de técnicas de cuantificación de MP pueden ayudar a ampliar la capacidad de la comunidad científica para responder a diversas preguntas de investigación sobre microplásticos18. Existen tres enfoques genéricos para preparar muestras de suelo para cuantificar microplásticos: 1) separar las partículas de microplástico individuales inalteradas del suelo (por ejemplo, mediante separación por densidad), 2) extraer material plástico o polimérico transformado (por ejemplo, por disolución), o 3) analizar el suelo a granel. Tanto la espectroscopia μFTIR como la μRaman requieren que los MP individuales se separen del suelo antes de que puedan identificarse químicamente19, mientras que el piro-GCMS puede realizarse en partículas de plástico aisladas, separadas del suelo o suelo a granel20. Separar los MP biodegradables del suelo puede ser difícil porque algunas digestiones utilizadas para eliminar la materia orgánica del suelo pueden degradar o alterar químicamente los polímeros biodegradables, incluido el PBAT21. Tanto la espectroscopia micro-Raman como la μFTIR también tienen un límite de resolución espacial: las partículas deben ser mayores de 10-20 μm para μFTIR y 1 μm para μRaman (si se pueden preparar partículas individuales tan pequeñas para el análisis)19,22. Estas técnicas pueden proporcionar la identificación química de los polímeros MP, y las imágenes espectroscópicas se pueden emplear para medir el tamaño22 de MP. Todos los tipos de piro-GCMS están limitados en el sentido de que las muestras se destruyen durante el análisis.
La RMN se ha utilizado con éxito para caracterizar los constituyentes y contaminantes del suelo23, para cuantificar los MP 16,24,25,26 y para evaluar la degradación del PBAT y de otro polímero, el poliestireno 27,28. Cuando se ejecuta bajo parámetros cuantitativos, la espectroscopia de RMN-1H produce espectros en los que el área de cada pico espectral es directamente proporcional al número de hidrógenos contribuyentes en la muestra; Esto permite cuantificar los componentes constituyentes en una muestra29. La RMN es una técnica analítica valiosa para cuantificar algunos MPs, incluyendo el PBAT, dentro del suelo porque permite la cuantificación e identificación simultánea, es adecuada para mezclas complejas e impuras, y no requiere patrones de referencia químicamente idénticos30,31. La espectroscopia de RMN de un extracto solvente podría cuantificar MPs o NPs más pequeños que los que se pueden procesar para la cuantificación de μFTIR, μRaman o GCMS. A pesar de estas ventajas, los enfoques cuantitativos de RMN siguen proporcionando sensibilidades más bajas que los enfoques basados en espectroscopia de masas destructiva32.
El método propuesto, diagramado en la Figura 1, describe un flujo de trabajo para procesar y analizar muestras de suelo que contienen PBAT, incluidos los plásticos PBAT de tamaño nanométrico. En el método, el polímero PBAT se extrae de muestras de suelo agitando el suelo con una mezcla de cloroformo y metanol. Los extractos solventes que contienen PBAT se secan y luego se vuelven a disolver en cloroformo deuterado con un calibrante interno añadido. La espectroscopia de RMN se realiza en los extractos utilizando parámetros cuantitativos. Los espectros resultantes se analizan para cuantificar el PBAT comparando el área de los picos ajustados correspondientes a los átomos de hidrógeno del PBAT y las moléculas calibrantes. Este método aplica el enfoque de extracción con solventes y espectroscopia de resonancia magnética nuclear de protones (1H-RMN) demostrado por Nelson et al.33. El objetivo era emplear un método adecuado para procesar muestras a escala ambiental (~100 g de suelo) y procesar un número de muestras en paralelo sin equipo de extracción especializado.
Protocolo
1. Recolección y preparación del suelo
NOTA: El equipo de muestreo y procesamiento no debe contener el polímero PBAT ni sus componentes para evitar la contaminación de la muestra. Otros materiales poliméricos no interfieren necesariamente con la cuantificación de PBAT del suelo. Por ejemplo, el polietileno y el polipropileno no producen picos espectrales en la RMN-H del cloroformo 1que interfieran con la cuantificación de PBAT34, pero el tereftalato de polietileno, con su grupo tereftalato, probablemente interferiría conel 35, al igual que otros poliésteres. Textos de referencia como Brandolini y Hills34 se pueden utilizar para determinar los espectros de RMN-1H de varios polímeros y detectar picos superpuestos con los picos PBAT utilizados para la cuantificación (descritos a continuación).
- Recoja al menos 100 g de peso seco equivalente de suelo para cada muestra. Determine el tamaño de la muestra de suelo en función de la concentración esperada de plásticos con el fin de recolectar una muestra representativa y homogeneizar el suelo para recolectar una submuestra si es necesario36.
NOTA: Los sistemas de suelos son inherentemente heterogéneos37, al igual que las distribuciones de contaminantes (por ejemplo, MP) dentro de ellos38. También existe variabilidad asociada a los métodos utilizados para medir las concentraciones de contaminantes39. Por lo tanto, se recomienda crear un diseño de muestreo o diseño experimental que incluya muestras replicadas como herramienta para estimar la incertidumbre y recolectar volúmenes de muestra representativos en función de la concentración de plástico40. Se ha documentado que las concentraciones de MP en el suelo oscilan entre casi cero y 1 x 107 elementos por kg de suelo, y la mayoría de los sitios contienen menos de 10.000 elementos por kg de suelo41. Un volumen elemental teórico representativo podría oscilar entre 23m2 a una concentración de MP de 10 ítems por metro cuadrado y 0,02m2 cuando las concentraciones de MP son de 10.000 ítems por metro cuadrado36.- Para aumentar el área efectiva de muestreo de un sitio de campo y minimizar la cantidad de tierra que debe procesarse, recoja tierra de un área grande (por ejemplo, 1 m2), luego use el método de despiece para homogeneizar y consolidar la muestra (por ejemplo, a 500 g de suelo)36.
- En el método de descuartizamiento, apile la tierra de un área grande sobre una lona u otra superficie, mezcle bien con una pala y luego divídala en cuartos. Conserve una cuarta parte de la muestra y deseche las otras tres cuartas partes. Repita este proceso hasta que la muestra tenga el tamaño deseado.
- Tamizar la tierra a través de un tamiz de malla de 2 mm. Limpie completamente el tamiz y la bandeja de recogida entre las muestras de suelo.
- Seque la tierra al aire, luego guárdela en bolsas de muestra selladas. El suelo seco puede almacenarse en este estado antes de la extracción de PBAT.
2. Extracción de PBAT de los suelos
PRECAUCIÓN: El cloroformo es volátil y tóxico. Guárdelo en la oscuridad en vidrio ámbar, lejos de oxidantes. Mientras trabaja con él, use guantes, protección ocular y ropa protectora adecuados. Manéjelo solo en una campana extractora. El metanol es inflamable, volátil y tóxico. Almacene el metanol en un armario ignífugo. Mientras trabaja con metanol, use guantes adecuados, protección para los ojos y ropa protectora. Manipule el metanol solo en una campana extractora. La cristalería puede romperse y causar lesiones. Use protección para los ojos cuando manipule cristalería. Evite tocar vidrios rotos con las manos desnudas. En su lugar, limpie los vidrios rotos con guantes, pinzas, escobas u otra herramienta resistentes a los cortes.
NOTA: El cloroformo no es compatible con la mayoría de los plásticos o metales. Asegúrese de que todos los materiales sean compatibles (por ejemplo, vidrio o politetrafluoroetileno, plástico PTFE).
- En una campana extractora, prepare 100 mL de mezcla 90:10 v/v de cloroformo (triclorometano; CHCl3) y metanol (CH3OH) por muestra a extraer. Por ejemplo, para extraer de 5 muestras, mezcle 450 mL de cloroformo con 50 mL de metanol.
- Agregue 100 g de tierra seca, 100 ml de solución de cloroformo y metanol y 20 perlas de vidrio en un frasco de extracción de vidrio. Selle herméticamente los frascos de extracción con tapas revestidas de PTFE para que el vapor de solvente no pueda salir de los frascos.
NOTA: El PBAT es altamente soluble en cloroformo; se utilizó una mezcla de cloroformo y metanol porque el metanol puede formar enlaces de hidrógeno con solutos, compitiendo con los constituyentes minerales y orgánicos del suelo y aumentando la recuperación de PBAT del suelo33. - Utilice una mesa agitadora para agitar los frascos de extracción durante 8 h a 200 rpm. Después de agitar, deje que la tierra de los frascos de extracción se asiente durante al menos 4 h.
- Separe el extracto del suelo. En la campana extractora, destape un frasco de extracción y transfiera el líquido por pipeta a través de un filtro de papel cualitativo con un tamaño de poro de 11 μm a un frasco de vidrio limpio etiquetado. Registre el volumen de disolvente recuperado del frasco de extracción. Evite transferir sólidos del suelo con el extracto; deje unos mL de solvente si es necesario.
NOTA: El papel de filtro está diseñado para eliminar trozos grandes de materia orgánica de la solución solvente. - Seque los extractos dejándolos en la campana extractora hasta que el disolvente se evapore por completo. Esto puede tardar hasta 24 horas. Seque también la tierra en la campana extractora. Una vez que la tierra esté completamente seca, deséchala.
- Una vez que los extractos estén secos, tape cada frasco de muestra y guárdelos en un lugar fresco, oscuro y seco hasta que los necesite.
3. Colección de espectros de RMN
PRECAUCIÓN: El cloroformo deuterado presenta los mismos riesgos y requiere las mismas precauciones que el cloroformo protonado descrito anteriormente.
- Añada un calibrador interno42 a la muestra. Use una balanza para pesar 1.00 mg de 1,4-dimetoxibenceno (DMB; C6H14O) en cada frasco de muestra que contenga un extracto seco.
- Vuelva a suspender la muestra en cloroformo deuterado (CDCl3; tricloro(deutero)metano). En la campana extractora, utilice una micropipeta para añadir 500 μL de cloroformo deuterado al frasco con extracto de muestra seco.
- Tape el frasco y agite para disolver el extracto seco golpeando suavemente el frasco contra una mano o una mesa de trabajo, aproximadamente 10 veces en cada lado. A continuación, utilice una punta de pipeta limpia para transferir el líquido a un tubo de RMN.
- Repita los pasos 3.2 y 3.3 con 500 μL adicionales de cloroformo deuterado, añadiendo la segunda porción de la muestra al mismo tubo de RMN que la primera. El segundo enjuague está destinado a garantizar la disolución completa y la recuperación del extracto seco del recipiente.
- Tape el tubo de RMN y guárdelo durante 3 días antes de recolectar los espectros de RMN. El tiempo de almacenamiento adecuado dependerá de la tasa de evaporación del solvente del tubo de RMN. Analice las muestras poco después de prepararlas con cloroformo deuterado.
- Para transportar los tubos de RMN al espectrómetro, utilice un soporte diseñado para soportar los tubos largos y delicados. Por lo general, tienen soporte cerca de la base y la parte superior del tubo. Mantenga los tubos en posición vertical durante el transporte.
- Usando un espectrómetro de RMN de 500 MHz, recoja un espectro de protones de 1H con un ángulo de pulso de 90°29, un ancho de pulso de 8 μs33, un tiempo de retardo de 25 s (determinado por el experimento de recuperación de inversión29,43), 262K puntos por escaneo y 32 escaneos compuestos29,44 de 12 a -2 ppm para un tiempo de ejecución total de 25 minutos.
NOTA: Utilizamos un espectrómetro Bruker Neo de 500 MHz con una sonda optimizada para banda ancha y un muestreador automático a una temperatura controlada de 300 K. Se pueden utilizar otros espectrómetros similares. Si se utiliza un instrumento con una intensidad de campo magnético diferente, el tiempo de retardo apropiado puede calcularse sobre la base del tiempo de relajación T1 para PBAT y 1,4-dimetoxibenceno utilizando un experimento de recuperación de inversión29,43. - Una vez que se haya ejecutado la muestra, guarde, transfiera o acceda a los datos espectrales según sea necesario.
Inspeccionar los datos espectrales. Compruebe que todos los picos de PBAT utilizados en la cuantificación se resuelvan claramente si están presentes. Utilice los picos PBAT 5 (8.10 ppm), 6 (4.44 ppm), 6' (4.38 ppm), 3' (4.15 ppm) y 3 (4.09 ppm) para la cuantificación (detalles en la Tabla 1). Utilice los picos DMB A (6,84 ppm) y B (3,77 ppm) también para la cuantificación (detalles en la Tabla 2). Tome nota en particular de los picos 6, 6', 3' y 3 de PBAT, que parecen estar muy cerca unos de otros y pueden superponerse. - Si algunos picos no se resuelven claramente, diluya la muestra. Combine 100 μL de muestra y 500 μL de cloroformo deuterado en un tubo de RMN limpio y vuelva a ejecutar la muestra con los mismos parámetros definidos en el paso 3.7.
4. Análisis de espectros de RMN para cuantificar PBAT
NOTA: El análisis espectral se puede realizar en cualquier momento después de la recolección. Es preferible analizar los datos el mismo día en que se producen los espectros para garantizar que las muestras aún estén disponibles para volver a ejecutarlas en caso de que surja algún problema.
- Abra el archivo FID creado por el espectrómetro en el software de procesamiento FID de RMN (usamos MestreNova de MestreLab, otras opciones pero otras opciones están disponibles).
- Aplicar ensanchamiento de línea a los espectros: En el software de procesamiento FID, seleccione Plantilla de procesamiento en el menú Procesamiento, luego navegue hasta la sección Apodización. Seleccione un modelo exponencial con una magnitud de 0,5 Hz y un primer punto de 0,5 Hz.
- Aplique la corrección de fase automática haciendo clic en el botón Corrección de fase automática en el menú Procesamiento. Aplique la corrección automática de la línea de base haciendo clic en el botón Corrección automática de la línea de base en el menú Procesamiento.
- Utilice la deconvolución de picos para ajustar los picos espectrales medidos: en la pestaña Análisis del software de procesamiento de espectros, en la sección Ajuste, haga clic en el botón Nuevo ajuste . Utilice el cursor para hacer clic en los espectros con un desplazamiento de 8,5 ppm, luego arrastre el cursor a un desplazamiento de 3,0 y suéltelo.
- Haga clic en Tabla de ajuste de línea en la sección Ajuste para ver todos los picos instalados.
- Conserve los picos utilizados para la cuantificación como se describe en la Tabla 1 y la Tabla 2 y etiquetados en la Figura 2. Utilice los picos PBAT 5 (8.10 ppm), 6 (4.44 ppm), 6' (4.38 ppm), 3' (4.15 ppm) y 3 (4.09 ppm) en la cuantificación (detalles en la Tabla 1), así como los picos DMB A (6.84 ppm) y B (3.77 ppm). Los átomos de hidrógeno que corresponden a cada pico enumerado en la Tabla 1 y la Tabla 2 están etiquetados en los diagramas estructurales de la Figura 3, con la Figura 3A que muestra la estructura de los dos dímeros PBAT, la Figura 3B que muestra cómo la posición de los dímeros en el polímero interactúa para alterar el cambio de pico en los hidrógenos del monómero de 1,4-butanodiol, y la Figura 3C que muestra la estructura de DMB.
- Elimine todos los demás picos del ajuste seleccionando los picos no deseados y haciendo clic en Eliminar pico.
- Utilice la tabla de ajuste para copiar el área de cada pico en una aplicación de hoja de cálculo para los cálculos (elegimos usar una hoja de cálculo).
- Para copiar áreas de picos en una hoja de cálculo, primero seleccione toda la información de picos en la Tabla de ajuste de líneas. A continuación, haga clic con el botón derecho del ratón y seleccione Copiar en el menú emergente. Pega los datos en la hoja de cálculo.
- Calcule el número de moles de DMB agregados a la muestra, nDMB, usando la ecuación
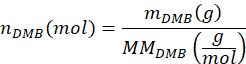
donde mDMB es la masa de DMB añadida a la muestra en gramos (sugerido 1,00 mg) y MMDMB es la masa molar de DMB (138,17 g/mol). - Calcule el número de moles del dímero de tereftalato de butileno de PBAT en la muestra, nBT, utilizando la ecuación
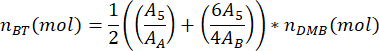
donde A5 es el área medida del pico 5 de PBAT, AA es el área medida del pico A de DMB y AB es el área medida del pico B de DMB. Las unidades de área producidas por el software de análisis espectral son arbitrarias. - Calcule el número de moles del dímero de adipato de butileno de PBAT en la muestra, nBA, utilizando la ecuación

donde A3 es el área medida del pico PBAT 3, A3' es el área medida del pico PBAT 3', A6 es el área medida del pico PBAT 6 y A6' es el área medida del pico PBAT 6'. Las unidades de área producidas por el software de análisis espectral son arbitrarias. - Calcule la masa de PBAT en la muestra, mPBAT, recuperada, usando la ecuación
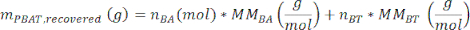
donde MMBA es la masa molar de un dímero BA de PBAT (200 g/mol), y MMBT es la masa molar de un dímero BT de PBAT (220 g/mol). - Si una cantidad conocida de PBAT estaba presente en la muestra, entonces el porcentaje de recuperación, η, se puede calcular para la muestra como una medida de la eficiencia de extracción de acuerdo con la ecuación
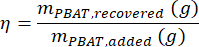
- Calcule la concentración de PBAT en una muestra, CPBAT, utilizando la ecuación
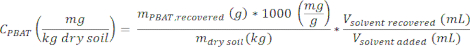
donde msuelo seco es la masa de suelo seco utilizada para producir el extracto (0,1 kg), Vdisolvente recuperado es el volumen de disolvente recuperado del suelo en el paso 2.4, y Vsegundo añadido es la cantidad inicial de disolvente añadido a la muestra de suelo (100 mL).
5. Preparación de la curva de calibración para la cuantificación de PBAT de un suelo en particular
NOTA: Una curva de calibración creada en base a muestras de suelo con cantidades conocidas de PBAT agregadas proporcionará información útil sobre cómo se extrae y recupera el PBAT de un suelo en particular. La extracción no es igual para todos los suelos ni para todas las formas de PBAT. Sospechamos que la eficiencia de la extracción depende del contenido de arcilla y materia orgánicadel suelo 33, y recomendamos crear una curva de calibración para cada serie de suelo y horizonte de interés. La curva de calibración se puede crear antes o después de que se procesen muestras desconocidas con este método.
- Recoja y prepare el equivalente a 2,5 kg de tierra seca, como se describe en los pasos 1.1 a 1.3.
- Determine el rango que debe cubrir la curva de calibración; la concentración máxima de PBAT utilizada en la curva de calibración debe ser superior a la concentración más alta de PBAT entre muestras desconocidas.
- Prepare u obtenga suficiente plástico PBAT para crear 5 muestras enriquecidas de 100 g de suelo con 0%, 25%, 50%, 75% y 100% de la concentración máxima (25 muestras en total). Por ejemplo, si 40 mg/kg es la concentración máxima deseada, se necesitará un total de 50 mg de PBAT para crear las muestras enriquecidas.
- Prepara 25 muestras de 100 g de tierra cada una. Aumente las muestras pesando el plástico a base de PBAT y agregándolo a las muestras de suelo a las dosis prescritas. Por ejemplo, si 40 mg/kg de PBAT es la concentración máxima deseada, cree 5 muestras sin PBAT, 5 muestras con 1 mg de PBAT, 5 muestras con 2 mg de PBAT, 5 muestras con 3 mg de PBAT y 5 muestras con 4 mg de PBAT. Después de agregar PBAT al suelo, mezcle bien.
- Extraiga PBAT de las 25 muestras enriquecidas, luego recoja los espectros de RMN de los extractos y analice los espectros resultantes como se describe en los pasos 2.1 a 4.16.
- Identifique la ecuación de una curva de calibración para PBAT en este suelo realizando una regresión lineal entre la cantidad medida de PBAT en cada muestra enriquecida y la cantidad real de PBAT agregada en una herramienta de análisis estadístico. Usamos una hoja de cálculo. Si no se detecta ningún PBAT en las muestras con picos sin PBAT agregado, entonces la fuerza b = 0 en la regresión.
NOTA: Una prueba de regresión lineal evalúa la fuerza de la relación lineal entre dos variables numéricas continuas x e y, de acuerdo con la relación y = mx + b. La prueba calcula los valores de m y b que mejor se ajustan a los datos. El coeficiente r2 de la prueba de regresión describe el grado de correlación entre ambas variables. - Pruebe una relación significativa entre la eficiencia de extracción y la concentración de PBAT utilizando la herramienta de análisis estadístico. Calcule la eficiencia de extracción de PBAT de las muestras enriquecidas como
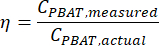
- Utilice la herramienta de análisis estadístico para calcular la probabilidad de que los datos observados puedan ocurrir aleatoriamente sin una correlación entre la eficiencia de extracción y la concentración de PBAT. Si este valor p es mayor que el umbral de significación predeterminado, α, entonces no puede rechazar la hipótesis nula de que no hay relación entre las dos variables. Si este es el caso, se puede suponer que la eficiencia de extracción es constante para todas las concentraciones de PBAT dentro del rango probado. Si se rechaza la hipótesis nula, es posible que el modelo lineal descrito aquí no sea la mejor manera de modelar los datos.
- Utilice la ecuación de regresión lineal de la curva de calibración para estimar la cantidad de PBAT en muestras desconocidas procesadas con este método. Si la variable x de la regresión era la cantidad real de PBAT en las muestras con picos de la curva de calibración, la variable y era la cantidad medida de PBAT, y b se establecía en 0, entonces
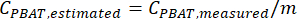
NOTA: El contenido de PBAT de las muestras replicadas estimado utilizando una ecuación de curva de calibración se puede utilizar para generar un intervalo de confianza para la cantidad de PBAT en un suelo en particular, o si se puede calcular una media y un intervalo de confianza para las concentraciones de PBAT en extractos replicados, entonces se podría aplicar la curva de calibración para estimar la concentración de PBAT en el suelo. Cualquiera de los dos órdenes de operaciones produce el mismo intervalo de confianza para el contenido de PBAT en el suelo. Por ejemplo, considere extractos de 10 muestras replicadas que tienen concentraciones de PBAT de 10, 5, 2, 4, 10, 11, 2, 6, 8 y 5 mg/kg y la ecuación de la curva de calibración y (PBAT medido en extracto) = 0,75 x (PBAT verdadero en el suelo). Las concentraciones de PBAT en el suelo en cada réplica podrían estimarse en 13, 7, 3, 5, 13, 15, 3, 8, 11 y 7 mg/kg. Entonces la concentración media de PBAT en el suelo se estimaría en 8,4 mg/kg con una desviación estándar de 4,4 mg/kg. Si primero se calcula una media y una desviación estándar para las concentraciones de PBAT del extracto (10, 5, 2, 4, 10, 11, 2, 6, 8 y 5), se calcularía una media de 6,3 mg/kg y una desviación estándar de 3,3 mg/kg. A continuación, se pudo aplicar la curva de calibración tanto a la media como a la desviación estándar para estimar la concentración de PBAT en el suelo: media de 8,4 mg/kg, desviación estándar de 4,4 mg/kg.
Resultados
Para evaluar la eficacia de este método en la cuantificación del polímero PBAT del suelo, se construyeron curvas de calibración extrayendo PBAT de muestras enriquecidas creadas en tres suelos diferentes. Para cada uno de los tres suelos (detalles en la Tabla 3), el suelo se pasó a través de un tamiz de 2 mm y luego se secó al aire. Las muestras enriquecidas se crearon añadiendo 0, 9, 18, 27 o 36 mg de MP a base de PBAT a 100 g de suelo seco (5 réplicas de cada uno). Esto equivale a 0, 63, 126, 189 o 252 mg/kg de polímero PBAT. Los MP se elaboraron a partir de mantillo plástico con 70% de PBAT en masa y 50 μm de espesor según el procedimiento de molienda descrito en Astner et al.45 y fueron menores de 840 μm. Para crear cada curva de calibración, se extrajo PBAT de cada muestra enriquecida siguiendo el procedimiento definido anteriormente. A continuación, se comparó la recuperación de PBAT con la cantidad de PBAT añadida a cada muestra. También se evaluó la tasa de recuperación y cuantificación de PBAT para NPs (diámetro medio 780 nm, índice de polidispersidad 0.77, preparado de acuerdo con Astner et al.45) en un suelo (franco sombrío).
Para todos los suelos, no se detectó PBAT en las muestras sin PBAT agregado, es decir, no se observaron falsos positivos por este método. La Figura Suplementaria 1 muestra un espectro recolectado de un suelo franco sombrío que no contenía PBAT (y sí contenía DMB agregado durante el proceso de preparación). Los dos picos característicos del calibrador interno DMB están presentes, pero los picos característicos de PBAT no lo están. Para los suelos con PBAT agregado, los cinco picos característicos utilizados para identificar el PBAT estaban presentes. La Figura 2 muestra un espectro recolectado de un suelo franco sombrío con 63 mg/kg de PBAT agregados. Todos los picos PBAT y DMB utilizados en la cuantificación se resuelven claramente. La Fig. 2 suplementaria muestra la región ajustada del espectro que se muestra en la Fig. 2 con crestas integradas superpuestas. Debido a la superposición de los picos 3, 3', 6 y 6' con otras señales en el espectro, es importante calcular el contenido de PBAT en función de las integrales de los picos ajustados en lugar de las integrales de pico simples. Esto elimina el área aportada por otros constituyentes del extracto del suelo y de los picos de PBAT superpuestos. La Figura 3 suplementaria muestra los efectos de la dilución en la resolución espectral de RMN. La figura muestra un espectro recogido de una marga arenosa de cuerno de alce con 252 mg/kg de PBAT añadidos. En el panel A, no se pueden resolver los picos de PBAT de 3, 3', 6 y 6' en el rango de 4.5 a 4.0 ppm. La Figura 3B suplementaria muestra un espectro recogido de la misma muestra después de que se diluyó en 1:5 con cloroformo deuterado adicional. Después de la dilución, los cuatro picos son distintos y su área puede ser adecuada.
Las curvas de calibración variaron entre los tres suelos que probamos. La Figura 4 muestra las concentraciones estimadas de PBAT de cada suelo en función del PBAT medido (CPBAT,m) en cada extracto en comparación con la cantidad real de PBAT (CPBAT,a) agregado al suelo. La cantidad de PBAT recuperado de los suelos franco sombríos se correlacionó fuertemente con la cantidad de PBAT agregado (r2 = 0.99). Para la curva de calibración, la ecuación CPBAT,m = m*CPBAT,a, m = 0,76 ± 0,02 (media ± un error estándar), y m fue significativamente diferente de cero (df = 24; F = 2000; p < 1*10-16). El PBAT se recuperó con una eficiencia de η = 76 % ± 10 % (media ± una desviación estándar) de este suelo. La eficiencia de extracción del suelo sombrío no se correlacionó con la cantidad de PBAT en las muestras (r2 = 0.009; p = 0.7). La NP se recuperó con una eficiencia de η = 59 % ± 8 % (media ± una desviación estándar). En la Figura 5 se muestra la eficiencia de extracción de MPs y NPs de la marga sombreada; la eficiencia fue significativamente menor para NP (p = 0,0002). La cantidad de PBAT recuperado de la marga de Los Osos se correlacionó menos fuertemente con la cantidad de PBAT agregado (r2 = 0.85) que en el suelo sombrío. Para la curva de calibración, la ecuación CPBAT,m = m*CPBAT,a, m = 0,57 ± 0,05 (media ± un error estándar), y m fue significativamente diferente de cero (df = 23; F = 100; p = 8*10-11). El PBAT se recuperó con una eficiencia de η = 57 % ± 22 % (media ± una desviación estándar) de este suelo. La eficiencia de extracción en el suelo de Los Osos no se correlacionó con la cantidad de PBAT en las muestras (r2 = 0.01; p = 0.6). La cantidad de PBAT recuperado de la marga arenosa de Elkhorn se correlacionó fuertemente con la cantidad de PBAT agregada (r2 = 0.88). Para la curva de calibración, la ecuación CPBAT,m = m*CPBAT,a, m = 0,70 ± 0,05 (media ± un error estándar), y m fue significativamente diferente de cero (df = 23; F = 200; p = 5*10-12). El PBAT se recuperó con una eficiencia de η = 70 % ± 14 % (media ± una desviación estándar) de este suelo. La eficiencia de extracción no se correlacionó con la cantidad de PBAT en las muestras (r2 = 0.006; p = 0.7) para el suelo Elkhorn.
Además, este método se aplicó para cuantificar el PBAT en un suelo de la serie Elkhorn. En este experimento, se recolectó suelo de cuerno de alce de dos sitios dentro de un campo agrícola, se tamizó a través de un tamiz de 2 mm y luego se secó al aire. El suelo se mezcló con mantillo MPs a base de PBAT (creado como se describió anteriormente, diámetro < 840 μm), con 50 mg de MP y 150 g de suelo seco en cada mesocosmos (250 mg/kg de PBAT) para crear 5 mesocosmos con MP mezclados en el suelo desde el sitio A y 5 con MP mezclados con el suelo desde el sitio B (10 en total). Cinco mesocosmos compuestos por suelo de cada sitio sin MP añadidos sirvieron como control negativo (10 en total). Los mesocosmos se incubaron durante 6 meses para investigar la biodegradación de los MP de mantillo a base de PBAT. Durante la incubación, la respiración acumulada del suelo se midió a través de las concentraciones de CO2 en el espacio de cabeza (utilizando un analizador de gases infrarrojos) y se utilizó para cuantificar la degradación de PBAT. La cantidad de plástico que queda en el mesocosmos al final de la incubación se calculó de la siguiente manera:
CFractura de plástico, final = [mPlástico, i / Cplástico de fractura - (CCO2, plástico agregado - CCO2 sin plástico)*msuelo seco]/(mPlástico, i/ Cplástico de fractura)
donde msuelo seco es la cantidad de tierra en cada frasco de incubación, Cfrac Plastic es el contenido de carbono de los microplásticos añadidos, CCO2, plástico añadido es la cantidad acumulada de CO2 producido en un mesocosmos con plástico añadido por gramo de suelo seco, CCO2 sin plástico es la cantidad de CO2 producido en un mesocosmos sin plástico añadido por gramo de suelo seco, y mplástico, i es la masa inicial del plástico añadido.
Utilizamos bootstrapping para estimar los intervalos de confianza para el plástico que permanece en los suelos A y B mediante el cálculo del plástico restante con 10.000 submuestras teóricas de emparejamientos aleatorios de los 10 mesocosmos experimentales de cada sitio. En el sitio A, la media estimada de plástico restante de los datos de respiración fue del 86%, con un intervalo de confianza del 95% de 62 a >100%. En el sitio B, la media estimada de plástico restante fue del 98%, con un intervalo de confianza del 95% de 79 a >100%. Al final de los 6 meses, el contenido de PBAT también se midió mediante el método de extracción y cuantificación de RMN descrito en este manuscrito (n = 5 para el sitio A y n = 4 para el sitio B). En el sitio A, la media estimada de plástico restante de los datos de RMN fue del 79%, con un intervalo de confianza del 95% (media ± 1,96xSE) que osciló entre el 71% y el 87%. En el sitio B, la media estimada de plástico restante fue del 88%, con un intervalo de confianza del 95% entre el 71% y el 100%. La Figura 6 muestra los intervalos de confianza para el contenido de plástico del suelo de los dos sitios estimados por los dos métodos diferentes. Las estimaciones del contenido de plástico de los dos métodos parecen mutuamente consistentes en función de la gran porción de superposición entre cada par de intervalos de confianza.
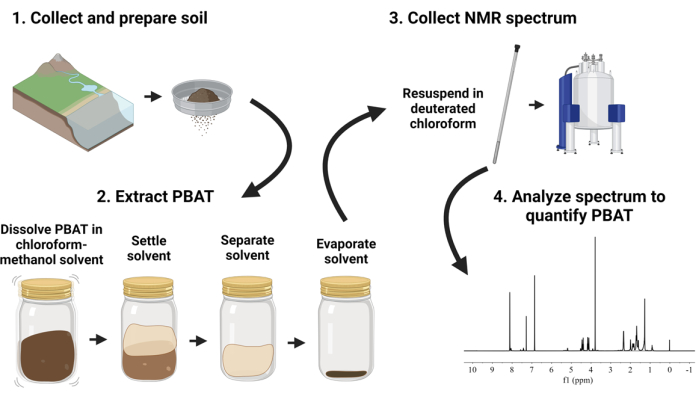
Figura 1: Descripción visual del procedimiento de extracción y cuantificación de tereftalato de adipato de polibutileno (PBAT). Haga clic aquí para ver una versión más grande de esta figura.
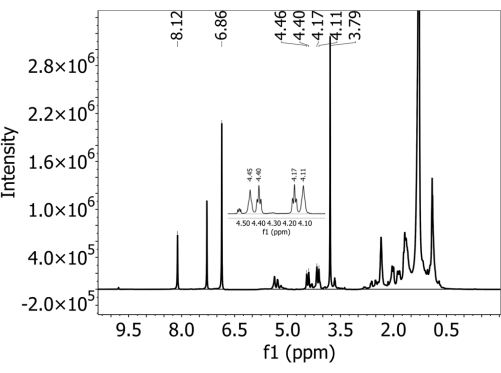
Figura 2: 1espectro de H-RMN recogido en disolvente de cloroformo deuterado con un espectrómetro de 500 MHz en un extracto de un suelo franco sombrío con tereftalato de adipato de polibutileno (PBAT) MPs. Se añadió 1,4-dimetoxibenceno (DMB) al extracto como calibrante interno antes del análisis de RMN. Los picos característicos de PBAT y DMB están presentes en el espectro. Haga clic aquí para ver una versión más grande de esta figura.
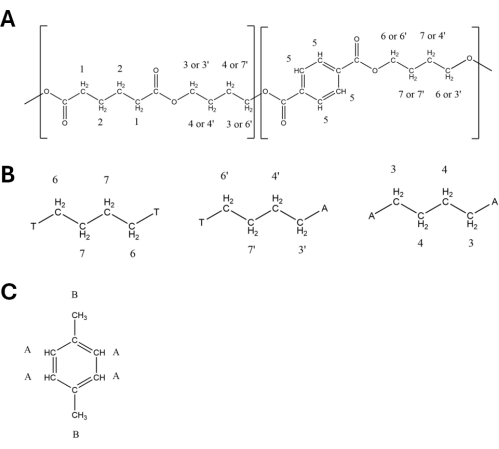
Figura 3: Estructuras de tereftalato de adipato de polibutileno (PBAT) y 1,4-dimetoxibenceno (DMB) con protones marcados. Las estructuras correspondientes se muestran en la Tabla 1 y la Tabla 2. (A) Estructura de una unidad BA-BT de PBAT. (B) Estructura de las tríadas T-B-T, T-B-A y A-B-A de PBAT. c) Estructura de DMB. Haga clic aquí para ver una versión más grande de esta figura.
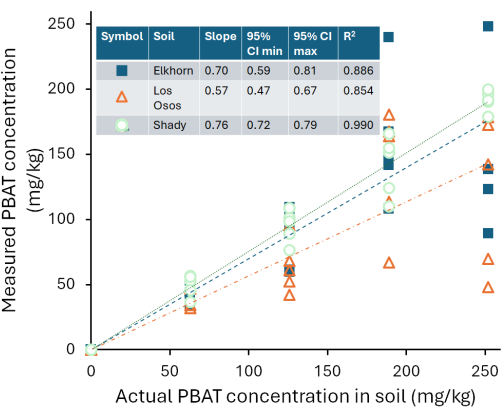
Figura 4: Concentraciones de PBAT medidas por 1H-QNMR en extractos en solvente de cloroformo deuterado de un suelo franco sombrío, un suelo franco de Los Osos y un suelo franco arenoso de cuerno de alce que contiene cantidades conocidas de PBAT. Haga clic aquí para ver una versión más grande de esta figura.
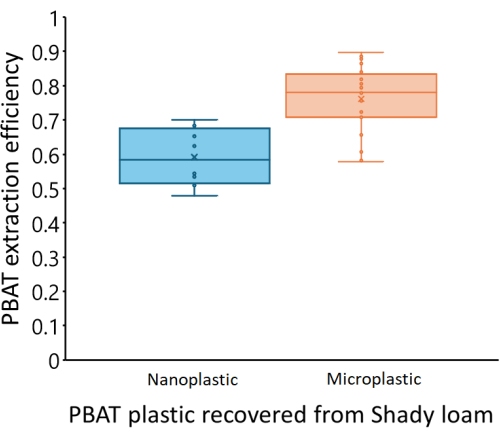
Figura 5: Eficiencia de extracción de PBAT MPs y NPs de muestras enriquecidas en un suelo franco sombrío. La recuperación de PBAT es significativamente menor para los NP (p = 0,0002). La línea central de cada cuadro representa la media de los puntos de datos medidos, mientras que los límites superior e inferior del cuadro reflejan Q3 y Q1, respectivamente. Los límites superior e inferior de los bigotes reflejan los puntos de datos máximo y mínimo, respectivamente. Los puntos de datos individuales se muestran dentro de la caja y los bigotes. Haga clic aquí para ver una versión más grande de esta figura.
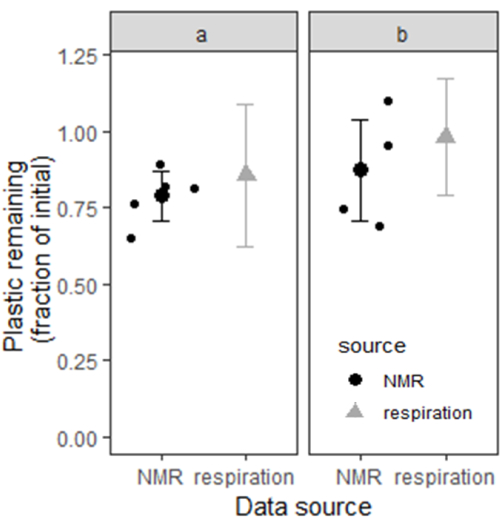
Figura 6: El contenido de plástico de dos suelos de cuerno de alce se midió mediante respiración de incubación acumulativa y extracción con solvente junto con RMN. Para el contenido de plástico medido por la respiración, las barras representan un intervalo de confianza del 95%. Para el contenido de plástico medido por RMN, las barras representan un intervalo de confianza del 95% basado en dos veces el error estándar por encima y por debajo de la estimación media (n = 5 para el sitio a y n = 4 para el sitio b). Haga clic aquí para ver una versión más grande de esta figura.
| ID de pico | Ubicación | Número de protones | Multiplicidad | Monómero | Utilizado en la cuantificación |
| 5 | 8.1 | 4 | Singlete | T | Sí |
| 6 | 4.44 | 2 | Triplete | B | Sí |
| 6’ | 4.38 | 2 | Triplete | B | Sí |
| 3’ | 4.15 | 2 | Triplete | B | Sí |
| 3 | 4.09 | 2 | Triplete | B | Sí |
| 1 | 2.34 | 4 | Triplete | Un | No |
| 7 | 1.97 | 2 | Multiplete | B | No |
| 7’ | 1.87 | 2 | Multiplete | B | No |
| 4’ | 1.81 | 2 | Multiplete | B | No |
| 4 | 1.68 | 2 | Multiplete | B | No |
| 2 | 1.66 | 4 | Multiplete | Un | No |
Tabla 1: Picosespectrales de 1 H-RMN de tereftalato de adipato de polibutileno (PBAT) en disolvente de cloroformo deuterado. Los hidrógenos atribuidos a cada pico están etiquetados en la Figura 3. Las asignaciones de picos se basan en Herrera et al.27.
| ID de pico | Ubicación | Número de protones | Multiplicidad | Utilizado en la cuantificación |
| Un | 6.84 | 4 | Singlete | Sí |
| B | 3.77 | 6 | Singlete | Sí |
Tabla 2: Picos de 1H-RMN de 1,4-dimetoxibenceno (DMB) en disolvente de cloroformo deuterado. Los hidrógenos atribuidos a cada pico están etiquetados en la Figura 3B. Las asignaciones de picos se basan en Nelson et al.33.
| Serie de suelos | Clasificación | Textura | Carbono orgánico total | pH | Lugar de recogida | Profundidad de recolección (cm) |
| Umbrío | Franco-fino, mixto, subactivo, térmico Typic Hapludult | Marga | 1.70% | 6 | Knoxville, Tennessee, Estados Unidos | 0-5 |
| Los Osos | fino, esmecánico, térmico Typic Argixeroll | Marga | 3.00% | 6 | San Luis Obispo, California, Estados Unidos | 0-5 |
| Elkhorn | Franco fino, mixto, superactivo, térmico Pachic Argixeroll | Franco arenoso | 1% | 7 | Watsonville, California, Estados Unidos | 0-5 |
Tabla 3: Propiedades de los tres suelos que se utilizaron para demostrar el método de extracción PBAT.
Figura suplementaria 1: 1espectro de H-RMN recogido en disolvente de cloroformo deuterado con un espectrómetro de 500 MHz en un extracto de marga sombreada sin polímero PBAT presente. Los picos característicos de PBAT no están presentes, mientras que los picos DMB (agregados como calibrador interno) sí lo están. Haga clic aquí para descargar este archivo.
Figura suplementaria 2: Región ajustada del espectro de RMN-H1 como se muestra en la Figura 4. El espectro se recogió en disolvente de cloroformo deuterado. El fondo verde muestra la región del espectro que se ajustó. Las líneas moradas muestran los picos ajustados, mientras que las líneas rojas muestran el error (partes de la señal del espectro no incluidas en los picos ajustados). Los picos PBAT 5, 6, 6', 3' y 3 están incluidos en el ajuste junto con los picos DMB A y B. Haga clic aquí para descargar este archivo.
Figura suplementaria 3: 1Espectros de H-RMN en solvente de cloroformo deuterado recolectados con un espectrómetro de 500 MHz en un extracto de franco arenoso de cuerno de alce con PBAT MP agregados. Los picos característicos de PBAT y DMB están presentes en el espectro. (A) Los picos de PBAT no se pueden distinguir para cuantificar el polímero. Si los extractos de muestra producen espectros como este, diluya la muestra y luego utilícela para recolectar un nuevo espectro de RMN-H de 1H. (B) El mismo extracto se diluye para que todos los picos espectrales se resuelvan claramente. Haga clic aquí para descargar este archivo.
Discusión
Proponemos un método para la extracción con solventes de PBAT del suelo junto con 1H-RMN para cuantificar PBAT en el extracto. Los elementos clave del proceso de extracción incluyen la técnica y el equipo de extracción, el solvente utilizado para extraer y los requisitos de tiempo. Se optó por utilizar una técnica de extracción que requiere un equipo relativamente sencillo y económico (tarros de vidrio, perlas de vidrio y una mesa agitadora) en comparación con la extracción Soxhlet y la extracción acelerada con solventes (ASE) demostradas por Nelson et al.33. El objetivo de este método es que se puedan extraer muchas muestras en paralelo a la velocidad en el procesamiento de muestras de suelo a granel. Otra ventaja de la extracción simple por agitación con solvente es que se pueden acomodar mayores volúmenes de suelo en comparación con los enfoques Soxhlet o ASE, lo que permite un procesamiento más fácil de muestras ambientalmente representativas13,36. Seleccionamos la solución solvente de cloroformo-metanol en base a los exitosos resultados presentados por Nelson et al.33 y la disponibilidad de cloroformo deuterado como solvente de RMN-1H. Probamos la ultrasonicación de mezclas de matriz de disolvente alineadas con el protocolo descrito en Nelson et al.33 en comparación con el método simple de agitación de disolventes y no encontramos diferencias significativas en las tasas de recuperación de PBAT entre los dos métodos. Encontramos que 8 h de agitación a 200 rpm fueron suficientes para romper los agregados del suelo en 100 g de matriz de suelo para los tres suelos que probamos, mientras que los tiempos de agitación más cortos o las velocidades de agitación más bajas fueron insuficientes. A continuación, se requirió la sedimentación para recuperar el solvente sin partículas de suelo. La recuperación de PBAT se probó con plásticos de tamaño nanométrico y la recuperación fue significativamente menor que la de los MP. Esto significa que el método puede necesitar un mayor desarrollo para cuantificar con precisión muestras ambientales de NPs desconocidas, pero la recuperación parcial y la medición de NPs sigue siendo valiosa en comparación con otros métodos de tamaño limitado, aunque la información sobre el tamaño de partícula no se pueda obtener con este método.
Mientras que Nelson et al.33 informaron de eficiencias de extracción cercanas al 100% para un método de extracción por ultrasonidos, encontramos que la ultrasonicación y el método de extracción basado en agitadores descritos aquí condujeron a eficiencias de extracción significativamente inferiores al 100%. Creemos que esto puede deberse a los efectos de la intemperie ambiental, incluida la fotooxidación en el mantillo plástico. Nelson et al.33 observaron una reducción significativa de la eficiencia de extracción de los PBAT MP irradiados con UV en comparación con el material no meteorizado. El plástico que utilizamos para probar este método de cuantificación se desgastó a la luz del sol durante una temporada de crecimiento completa antes de ser procesado en MPs. A pesar de los fotoestabilizadores agregados a las películas de acolchado de plástico comerciales, la estructura del polímero de los acolchados cambia debido a la radiación UV (por ejemplo, la reticulación de la cadena que aumenta el contenido de gel del material)46 en condiciones ambientales de meteorización y la degradación del polímero puede cambiar su espectro de RMN47. Esto puede contribuir a las menores tasas de recuperación de PBAT que observamos en comparación con Nelson et al.33. También encontramos que la eficiencia de extracción de PBAT varió entre los tres suelos que probamos. El suelo sombrío contiene principalmente arcillas de baja actividad, mientras que los otros dos suelos tienen arcillas esmectíticas (Los Osos) y mixtas superactivas (Elkhorn). La presencia de minerales de alta actividad y arcilla 2:1 puede haber inhibido la extracción con solventes de PBAT de esos suelos33,48 lo que llevó a la menor recuperación de PBAT que observamos. Recomendamos realizar más investigaciones que investiguen las asociaciones plástico-mineral en el suelo para los MP y NP biodegradables, incluido el PBAT, así como los MP y NP de polímeros convencionales no degradables. Esto es importante tanto para comprender cómo se pueden extraer y medir los polímeros MP del suelo como para comprender cómo podrían biodegradarse o afectar los sistemas del suelo.
Los elementos clave del proceso de adquisición del espectro de RMN incluyen la fuerza del imán del instrumento, el número de exploraciones utilizadas, el tiempo de relajación de la muestra entre exploraciones y el tiempo total de medición por muestra. Se utilizó un espectrómetro de 500 MHz; las intensidades de campo magnético más altas proporcionan una mayor sensibilidad y resolución en los espectros de RMN. La relación señal-ruido espectral se puede aumentar mediante la recopilación de exploraciones repetidas de la misma muestra y la suma de ellas. La recopilación de n exploraciones aumentará la relación señal-ruido en un factor de √n, pero aumentará el tiempo de medición en un factor de n29. Esto significa que si se necesita una relación señal-ruido más alta para cuantificar PBAT en una muestra, el número de escaneos se puede aumentar a costa de tiempos de ejecución de muestra más largos. Se necesita una relación señal/ruido de 150 para una señal determinada a fin de mantener un error <1% en la cuantificación44. Según nuestros parámetros de adquisición (instrumento, sonda, número de exploraciones), se necesitaron alrededor de 5 mg de PBAT por muestra (o 50 μg de PBAT por ml de extracto) para obtener una relación señal-ruido de 150 y, por lo tanto, un error del <1% en la cuantificación; Esta concentración es específica de nuestra configuración de recopilación de datos. Esta concentración de PBAT es superior a los límites de cuantificación alcanzados por otros que utilizan 1H-RMN para cuantificar otros tipos de MP en ausencia de suelo16,24, lo que demuestra el impacto de la materia orgánica del suelo y otros compuestos coextraídos en el método de cuantificación. El rango cuantificable de PBAT también está limitado en el extremo superior debido al ensanchamiento de la línea observado a concentraciones de PBAT superiores a 25 mg por muestra (250 μg de PBAT por mL de extracto), lo que condujo a la superposición de picos de PBAT como se describe en los resultados representativos y se muestra en la Figura complementaria 3. Sin embargo, este método permite flexibilidad para responder a estas limitaciones con el fin de garantizar que las muestras sean cuantificables. La cantidad de tierra utilizada para crear extractos se puede aumentar o disminuir, y los extractos se pueden diluir y volver a analizar para ajustar la concentración de PBAT dentro del rango óptimo.
Los elementos clave del proceso para cuantificar PBAT en función de los espectros de RMN incluyen los picos utilizados para cuantificar PBAT, el uso de ajuste de línea para calcular las áreas de pico y la curva de calibración. Conceptualmente, cualquier par de picos de PBAT y DMB podría compararse para calcular la proporción de los dos compuestos en una muestra. Encontramos los resultados más precisos cuando calculamos la relación BT:DMB como el promedio de las áreas de pico 5:A y las áreas de pico 5:B (normalizadas por su respectivo número de protones). El pico 5 de PBAT solo proporciona cuantificación del monómero 1,4-butanodiol-tereftalato (BT), por lo que el área de los picos 3 y 3' (que representan el monómero de 1,4-butanodiol-adipato, o BA) se comparó con el área de los picos 6 y 6' (que representan el monómero BT) para cuantificar los grupos BA presentes en la muestra. La cantidad de BT y BA se sumó para representar la cantidad total de PBAT restante. No fue posible utilizar el pico 1 o 2 de PBAT en la cuantificación de BA debido a la interferencia de compuestos coextraídos (con la hipótesis de que era materia orgánica del suelo), lo que creó múltiples picos amplios en el rango de 2,7-0,7 ppm. Exploramos la eliminación de estas señales no deseadas de los espectros con corrección de fondo (es decir, restando un espectro en blanco de cada espectro de muestra), pero descubrimos que la creación de espectros de fondo y muestra comparables equivalentes sin el uso de un calibrante no era confiable. El ajuste de línea se utilizó para calcular el área de los picos ajustados en lugar de integrar los picos espectrales directamente. Debido a la superposición entre los picos PBAT de 3 y 3' y entre los picos de 6 y 6', esto proporcionó estimaciones más precisas del contenido de PBAT basadas en un análisis preliminar. Recomendamos la creación de una curva de calibración para tener en cuenta las diferentes tasas de recuperación de PBAT de diferentes suelos. Las tasas de recuperación de PBAT fueron significativamente diferentes para un par, de los tres suelos que probamos, como lo indican los intervalos de confianza del 95% no superpuestos para la pendiente de la curva de calibración. La recuperación de PBAT en un tercer suelo no fue significativamente diferente de ninguno de los otros dos. En ausencia de una comprensión mecanicista de cómo la composición del suelo afecta la recuperación de PBAT, recomendamos que se creen curvas de calibración para evaluar la recuperación de PBAT en cada serie de suelo de interés y para cada horizonte dentro de un perfil de suelo. Si se encuentra que las curvas de calibración son estadísticamente similares entre suelos, los suelos se pueden analizar fácilmente en combinación.
Creemos que este método puede proporcionar una herramienta valiosa para aquellos interesados en cuantificar PBAT MP y NP en el suelo, especialmente para cuantificar PBAT en un gran número de muestras recolectadas en suelos similares, por ejemplo, en un estudio de campo de biodegradación plástica a largo plazo. Un método de RMN para cuantificar los MP del suelo es valioso porque permite a los investigadores con acceso y experiencia en RMN contribuir a satisfacer las necesidades del campo emergente al responder preguntas importantes sobre la presencia y el comportamiento de los MP en los sistemas de suelo. Si bien es probable que el acceso a la instrumentación y la experiencia sean algunas de las primeras preocupaciones prácticas que limiten la selección de técnicas de cuantificación por parte de los investigadores, la RMN no es la herramienta más eficiente o adecuada para cuantificar los microplásticos del suelo en todas las condiciones. La información sobre la forma y el tamaño de las partículas no se puede obtener con una técnica de extracción con disolventes; si la forma y el tamaño de MP son de interés, los investigadores estarían mejor atendidos por una técnica para identificar partículas MP individuales como FTIR o espectroscopia Raman. Una ventaja de los métodos de extracción con solventes como los presentados aquí y en Nelson et al.33 en comparación con otros enfoques de cuantificación de MP como el FTIR o la espectroscopia Raman es que conceptualmente no existe un límite de tamaño para los MP y NP que se pueden cuantificar; La extracción con solventes puede ser más beneficiosa cuando la información sobre el tamaño de las partículas no es necesaria o cuando las partículas de interés son demasiado difíciles de separar por otros medios. La pirólisis GCMS puede ser valiosa porque tiene una mayor sensibilidad que la RMN, pero los resultados también están sujetos a los efectos de la matriz, como probablemente lo esté la extracción con solventes PBAT.
Esperamos que el trabajo adicional mejore la robustez de este método al abordar los constituyentes del suelo coextraídos que interfieren con la resolución máxima de PBAT en los espectros de RMN. También se necesita más trabajo para establecer la relación entre la meteorización del plástico PBAT y la eficiencia de la extracción a través de este método, tal vez acompañado de una comprensión más detallada de los productos de degradación de PBAT y sus espectros de RMN-1H. Con base en nuestros resultados y los de Nelson et al.33, este procedimiento de cuantificación funciona mejor para cuantificar plásticos PBAT no meteorizados en suelos con baja materia orgánica y sin arcillas de alta actividad. Si bien utilizamos este método solo para cuantificar los MP basados en PBAT del suelo, el procedimiento de extracción con solventes y cuantificación de RMN-1H podría ser útil para cuantificar otros MP y NP de suelos adicionales26,49. Extender el método a los MP hechos de otro polímero requiere garantizar la solubilidad del polímero en el solvente e identificar los picos característicos de RMN del polímero en el solvente elegido. Puede ser necesario seleccionar un nuevo calibrante interno que sea soluble en el disolvente elegido y que no produzca picos que se superpongan con los del polímero de interés42.
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contrapuestas que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Gracias al USDA-NIFA por financiar este proyecto a través de la adjudicación número 2020-67019-31167 a SMS y al programa de Iniciativas de Investigación de Planificación Estratégica de la Universidad de Tennessee (SPRINT) por una subvención interna DGH y SMS. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación de datos, el análisis, la interpretación, la redacción del informe o la decisión de enviar el artículo para su publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Referencias
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados