Method Article
양성자 핵 자기 공명 분광법을 사용한 토양에서 폴리부틸렌 아디페이트 테레프탈레이트 기반 마이크로 및 나노 플라스틱의 정량화
요약
핵 자기 공명 분광법을 사용하여 토양의 폴리부틸렌 아디페이트 테레프탈레이트에서 유래한 마이크로 및 나노 플라스틱을 정량화하는 방법이 여기에 설명되어 있습니다. 이 기술은 나노 플라스틱의 정량화로 확장되고 환경 시료를 대량으로 처리하는 데 쉽게 적용할 수 있기 때문에 기존 방법론을 개선합니다.
초록
생분해 시 토양에 형성된 미세 및 나노 플라스틱(MP 및 NP)을 회수하고 정량화하는 방법은 생분해성 플라스틱 제품의 분해 및 환경 영향을 정확하게 평가하기 위해 필요합니다. 토양에 MP와 NP가 존재하면 응집 거동과 같은 토양 특성이 변경되거나 토양 생물군에 독성 영향을 미칠 수 있습니다. 기존 MP 회수 방법이 폴리부틸렌 아디페이트 테레프탈레이트(PBAT)와 같은 생분해성 폴리머를 측정하는 데 항상 적합한 것은 아닙니다. 산 또는 산화제를 사용한 몇 가지 일반적인 분해 절차는 PBAT 기반 생분해성 MP를 파괴할 수 있습니다. 마이크로 FTIR 및 마이크로 라만 분광법과 같은 식별 방법도 회수 및 분석할 수 있는 입자의 최소 크기에 의해 제한됩니다. 따라서 이 방법은 PBAT를 화학적으로 변형시키지 않고 토양 내 MP 및 NP의 질량 분율을 평가하기 위해 토양에서 PBAT를 추출하고 정량화하기 위해 개발되었습니다. 프로토콜에서는 클로로포름-메탄올 용액을 사용하여 토양에서 PBAT를 선택적으로 추출합니다. 용매는 추출물에서 증발된 후 추출물을 중수소화 클로로포름에 재용해시킵니다. 추출물은 각 샘플의 PBAT의 양을 정량화하기 위해 정량적 매개변수에서 양성자 핵 자기 공명 분광법(1H-QNMR)으로 분석됩니다. PBAT의 용매 추출 효율은 그늘진 양토 토양에서 76%에서 Elkhorn 모래 양토 토양에서 45%까지 다양합니다. 광산화된 물질의 경우 원시 물질에 비해 PBAT 회수율이 감소할 수 있으며 점토 함량이 높은 토양에서는 감소할 수 있습니다. 추출 효율은 테스트 범위 내의 PBAT 농도에 의존하지 않지만, MP보다 NP에서 더 낮은 추출 효율이 관찰되었습니다. PBAT 정량화 결과는 실험실 배양 연구에서 누적 토양 호흡을 측정하여 플라스틱 분해를 정량화하는 것과 유사했습니다.
서문
토양 내 MP 오염을 측정하는 방법은 전 세계 토양의 플라스틱 오염범위1, 플라스틱 오염원2 및 잠재적 해결책3을 이해하는 데 필요합니다. 농업 토양은 플라스틱 오염에 유일하게 노출되어 있습니다: 2021년 기준 매년 1,500만 미터톤 이상의 플라스틱이 농업에 사용됩니다4, 이 중 250만 톤의 플라스틱 뿌리 덮개5. 플라스틱 뿌리 덮개는 토양과 밀접하게 접촉하여 사용되며,1년에 한 번 이상 다시 적용되며6 사용 수명이 지난 후 토양에서 완전히 제거하기 어려울 수 있습니다7. MP 측정 방법이 필요한 한 가지 핵심 영역은 채소 시스템에 사용되는 생분해성 플라스틱 뿌리 덮개와 같은 생분해성 플라스틱 제품의 평가입니다8.
생분해성 토양 내 플라스틱 제품은 의도한 대로 작동한다면 플라스틱 멀칭으로 인한 토양의 플라스틱 오염을 제거할 수 있기 때문에 기존 농업용 플라스틱에 대한 유망한 대안입니다. 2022년에는 전 세계적으로 100만 미터톤 미만의 생분해성 플라스틱이 생산되었으며, 이는 업계에서 급속한 성장이 예상됩니다9. 가장 일반적인 4가지 생분해성 고분자인 폴리락트산(PLA), 중합 전분, 폴리하이드록시알카노에이트(PHA) 및 폴리부틸렌 아디페이트 테레프탈레이트(PBAT)는 모두 농업용 생분해성 플라스틱 덮개에 상업적으로 또는 실험적으로 사용됩니다10. 그들의 약속에도 불구하고, 현장 조건에서 이러한 생분해성 플라스틱 제품의 분해는 변수11입니다. 이 분야에서의 생분해성 플라스틱 뿌리 덮개 분해에 대한 일부 연구는 거대 플라스틱 파편11에 초점을 맞추고 있지만, 플라스틱 재료의 완전한 분해를 평가하려면 토양에서 MP와 NP를 회수할 수 있는 능력이 필요합니다. 토양의 미세플라스틱 정량화는 MP 오염12로 인해 토양 생태계에 부정적인 영향을 미칠 수 있는 가능성을 평가하는 데에도 중요합니다.
MP 식별 및 정량화를 위해 일반적으로 사용되는 기술로는 시각적 분석, 마이크로 푸리에 변환 적외선 분광법(μFTIR), 마이크로 라만 분광법(μRaman), 가스 크로마토그래피-질량 분광법(열분해 GCMS 및 열 추출 탈착 GCMS를 포함한 GCMS) 및 열중량 분석13이 있습니다. 다른 개발 기술로는 토양14의 현장 MP 측정을 위한 근적외선 분광법, GCMS 분석을 위한 지방산 메틸 에스테르화 추출15, 핵 자기 공명 분광법(16)이 있습니다. 토양 내 MP를 정량화한 연구의 90%는 플라스틱 입자를 식별하기 위해 시각적 분석(단독 또는 다른 기법과 쌍을 이루는)을 사용했으며, 77%는 FTIR, Raman 또는 GCMS 분광 기법을 사용했다17. 다양한 MP 정량화 기법을 개발하고 조화시키면 다양한 미세플라스틱 연구 질문에 답할 수 있는 과학계의 능력을 확장하는 데 도움이 될 수 있습니다18. 미세 플라스틱을 정량화하기 위해 토양 샘플을 준비하기 위한 세 가지 일반적인 접근 방식이 있습니다: 1) 토양에서 변경되지 않은 개별 미세 플라스틱 입자를 분리(예: 밀도 분리에 의해), 2) 변형된 플라스틱 또는 폴리머 물질 추출(예: 용해에 의해) 또는 3) 벌크 토양 분석. μFTIR 및 μRaman 분광법은 화학적으로 식별하기 전에 개별 MP를 토양에서 분리해야 하며19 pyro-GCMS는 토양 또는 벌크 토양에서 분리된 분리된 플라스틱 입자에서 수행할 수 있습니다20. 토양 유기물을 제거하는 데 사용되는 일부 소화는 PBAT21을 포함한 생분해성 폴리머를 분해하거나 화학적으로 변형시킬 수 있기 때문에 토양에서 생분해성 MP를 분리하는 것이 어려울 수 있습니다. 마이크로 라만 및 μFTIR 분광법은 모두 공간 해상도 제한이 있습니다 : 입자는 μFTIR의 경우 10-20 μm, μRaman의 경우 1 μm보다 커야합니다 (이 정도 작은 입자가 분석을 위해 준비 될 수있는 경우) 19 , 22. 이러한 기술은 MP 폴리머의 화학적 식별을 제공할 수 있으며 분광 이미징을 사용하여 MP 크기22를 측정할 수 있습니다. 모든 유형의 pyro-GCMS는 분석 중에 샘플이 파괴된다는 점에서 제한적입니다.
NMR은 토양 성분 및 오염 물질23을 특성화하고, MP 16,24,25,26을 정량화하고, PBAT 및 또 다른 폴리머인 폴리스티렌 27,28의 분해를 평가하는 데 성공적으로 사용되었습니다. 정량적 매개변수에서 실행할 때 1H-NMR 분광법은 각 스펙트럼 피크의 면적이 샘플에 기여하는 수소의 수에 정비례하는 스펙트럼을 생성합니다. 이것은 샘플(29)에서 구성 성분의 정량화를 가능하게 한다. NMR은 동시 정량화 및 식별이 가능하고 복잡하고 불순한 혼합물에 적합하며 화학적으로 동일한 참조 표준이 필요하지 않기 때문에 토양 내에서 PBAT를 포함한 일부 MP를 정량화하기 위한 귀중한 분석 기술입니다30,31. 용매 추출물의 NMR 분광법은 μFTIR, μRaman 또는 GCMS 정량을 위해 처리할 수 있는 것보다 작은 MP 또는 NP를 정량화할 수 있습니다. 이러한 장점에도 불구하고 정량적 NMR 접근 방식은 여전히 파괴적인 질량 분광법 기반 접근 방식보다 낮은 감도를 제공합니다32.
그림 1에 도표로 나와 있는 제안된 방법은 나노 크기의 PBAT 플라스틱을 포함하여 PBAT가 포함된 토양 샘플을 처리하고 분석하는 워크플로를 설명합니다. 이 방법에서 PBAT 폴리머는 클로로포름과 메탄올의 혼합물로 토양을 흔들어 토양 샘플에서 추출합니다. PBAT를 함유한 용매 추출물을 건조시킨 다음 내부 캘리브rant를 첨가하여 중수소화 클로로포름에 재용해시킵니다. NMR 분광법은 정량적 매개변수를 사용하여 추출물에 대해 수행됩니다. 결과 스펙트럼을 분석하여 PBAT와 보정 분자의 수소 원자에 해당하는 피팅 피크 면적을 비교하여 PBAT를 정량화합니다. 이 방법은 Nelson et al.33에서 입증한 용매 추출 및 양성자 핵 자기 공명 분광법(1H-NMR) 접근 방식을 적용합니다. 목표는 환경 규모 샘플(~100g의 토양)을 처리하는 데 적합한 방법을 채택하고 특수 추출 장비 없이 여러 샘플을 병렬로 처리하는 것이었습니다.
프로토콜
1. 토양의 수집 및 준비
참고: 시료 채취 및 처리 장비에는 시료 오염을 방지하기 위해 고분자 PBAT 또는 그 성분이 포함되어서는 안 됩니다. 다른 고분자 재료가 토양에서 PBAT의 정량화를 반드시 방해하는 것은 아닙니다. 예를 들어, 폴리에틸렌 및 폴리프로필렌은 PBAT34의 정량화를 방해하는 클로로포름 1H-NMR에서 스펙트럼 피크를 생성하지 않지만, 테레프탈레이트기를 가진 폴리에틸렌 테레프탈레이트는 다른 폴리에스터와 마찬가지로35를 방해할 가능성이 가장 높습니다. Brandolini 및 Hills34와 같은 참조 텍스트를 사용하여 다양한 폴리머의 1H-NMR 스펙트럼을 결정하고 정량화에 사용되는 PBAT 피크와 겹치는 피크를 스크리닝할 수 있습니다(아래 설명 참조).
- 각 샘플에 대해 최소 100g의 건조 중량의 토양을 수집합니다. 대표 샘플을 수집하고 필요한 경우 하위 샘플을 수집하기 위해 토양을 균질화하기 위해 예상되는 플라스틱 농도를 기반으로 토양 샘플 크기를 결정합니다36.
참고: 토양 시스템은 본질적으로 이질적이며37, 토양 내 오염 물질 분포(예: MP)도 마찬가지입니다38. 또한 오염 물질 농도를 측정하는 데 사용되는 방법과 관련된 변동성이 있습니다39. 그러므로, 불확실성을 추정하고 플라스틱 농도(40)를 기반으로 대표 샘플 부피를 수집하기 위한 도구로서 반복 샘플을 포함하는 샘플링 설계 또는 실험 설계를 생성하는 것이 좋습니다. 토양 내 MP 농도는 토양 1kg당 거의 0에서 1 x 107 항목까지 다양하며, 대부분의 현장에는 토양 kg당 10,000개 미만의 항목이 포함되어 있는 것으로 기록되어 있습니다41. 이론적으로 대표적인 초등 부피는 평방 미터당 10개 항목의 MP 농도에서 23m2에서 MP 농도가 평방 미터당 10,000개 항목일 때 0.02m2까지 다양할 수 있습니다36.- 처리해야 하는 토양의 양을 최소화하면서 현장 현장에서 효과적인 샘플링 영역을 늘리려면 넓은 지역(예: 1m2)에서 토양을 수집한 다음 쿼터링 방법을 사용하여 샘플을 균질화하고 통합합니다(예: 토양 500g까지)36.
- 쿼터링 방법에서는 넓은 지역의 흙을 방수포나 다른 표면에 쌓고 삽을 사용하여 완전히 섞은 다음 4등분합니다. 샘플의 1/4을 유지하고 나머지 3/4을 버립니다. 샘플이 원하는 크기가 될 때까지 이 과정을 반복합니다.
- 2mm 메쉬 체를 통해 토양을 체로 칩니다. 체를 완전히 청소하고 토양 사이에 팬을 잡습니다.amp레.
- 토양을 자연 건조시킨 다음 밀봉된 샘플 백에 보관하십시오. 건조한 토양은 PBAT 추출 전에 이 상태로 보관할 수 있습니다.
2. 토양에서 PBAT 추출
주의: 클로로포름은 휘발성이며 독성이 있습니다. 산화제에서 멀리 떨어진 호박색 유리에 어두운 곳에 보관하십시오. 작업하는 동안 적절한 장갑, 보안경 및 보호복을 착용하십시오. 흄 후드에서만 다루십시오. 메탄올은 가연성, 휘발성 및 독성이 있습니다. 메탄올은 내화성이 있는 캐비닛에 보관하십시오. 메탄올로 작업하는 동안 적절한 장갑, 보안경 및 보호복을 착용하십시오. 메탄올은 흄 후드에서만 취급하십시오. 유리 제품이 깨져 부상을 입을 수 있습니다. 유리 제품을 취급할 때는 보안경을 착용하십시오. 깨진 유리를 맨손으로 만지지 마십시오. 대신 절단 방지 장갑, 집게, 빗자루 또는 다른 도구로 깨진 유리를 청소하십시오.
알림: 클로로포름은 대부분의 플라스틱 또는 금속과 호환되지 않습니다. 모든 재료가 호환되는지 확인합니다(예: 유리 또는 폴리테트라플루오로에틸렌, PTFE 플라스틱).
- 흄 후드에서 클로로포름(트리클로로메탄; 추출할 시료당 CHCl3) 및 메탄올(CH3OH)을 추출할 수 있습니다. 예를 들어, 5개의 샘플에서 추출하려면 클로로포름 450mL와 메탄올 50mL를 혼합합니다.
- 유리 추출 용기에 마른 흙 100g, 클로로포름-메탄올 용액 100mL, 유리 구슬 20개를 추가합니다. 용매 증기가 용기에서 빠져나가지 않도록 PTFE 라이닝 뚜껑으로 추출 용기를 단단히 밀봉합니다.
참고: PBAT는 클로로포름에 잘 용해됩니다. 클로로포름-메탄올 혼합물은 메탄올이 용질과 수소 결합을 형성하여 토양 광물 및 유기 성분과 경쟁하고 토양에서 PBAT의 회수를 증가시킬 수 있기 때문에 사용되었습니다33. - 셰이커 테이블을 사용하여 추출 용기를 200rpm에서 8시간 동안 흔듭니다. 흔든 후 추출 항아리의 흙이 최소 4시간 동안 가라앉도록 합니다.
- 토양에서 추출물을 분리하십시오. 흄 후드에서 추출 용기의 뚜껑을 풀고 공극 크기가 11μm인 정성적 종이 필터를 통해 피펫으로 액체를 라벨이 붙은 깨끗한 유리 용기에 넣습니다. 추출 용기에서 회수된 용매의 부피를 기록합니다. 추출물과 함께 토양 고형물을 옮기지 마십시오. 필요한 경우 몇 mL의 용매를 남겨 두십시오.
알림: 여과지는 용제 용액에서 큰 유기물 조각을 제거하기 위한 것입니다. - 용매가 완전히 증발할 때까지 추출물을 흄 후드에 두어 건조시킵니다. 최대 24시간이 소요될 수 있습니다. 흄 후드의 흙도 말리십시오. 흙이 완전히 마르면 버리십시오.
- 추출물이 건조되면 각 샘플 용기의 뚜껑을 닫고 필요할 때까지 서늘하고 어둡고 건조한 곳에 보관하십시오.
3. NMR 스펙트럼 수집
주의: 중수소화 클로로포름은 동일한 위험을 내포하며 위에서 설명한 양성자 클로로포름과 동일한 예방 조치가 필요합니다.
- 샘플에 내부 캘리브rant42 를 추가합니다. 저울을 사용하여 1.00mg의 1,4-디메톡시벤젠(DMB; C, 6H, 14O)를 건조된 추출물을 함유한 각 샘플 항아리에 넣는다.
- 샘플을 중수소화 클로로포름(CDCl3, 트리클로로(deutero)메탄)에 재현탁합니다. 흄 후드에서 마이크로피펫을 사용하여 건조된 샘플 추출물이 담긴 용기에 500μL의 중수소화 클로로포름을 추가합니다.
- 병의 뚜껑을 덮고 흔들어 건조된 추출물을 녹이도록 손이나 탁상에 양쪽을 약 10회씩 가볍게 두드려 녹입니다. 그런 다음 깨끗한 피펫 팁을 사용하여 액체를 NMR 튜브로 옮깁니다.
- 추가로 500μL의 중수소화 클로로포름으로 3.2단계와 3.3단계를 반복하여 샘플의 두 번째 부분을 첫 번째와 동일한 NMR 튜브에 추가합니다. 두 번째 헹굼은 용기에서 건조된 추출물의 완전한 용해 및 회수를 보장하기 위한 것입니다.
- NMR 튜브를 덮고 NMR 스펙트럼을 수집하기 전에 3일 동안 보관하십시오. 적절한 보관 시간은 NMR 튜브에서 용매의 증발 속도에 따라 달라집니다. 중수소화 클로로포름으로 시료를 준비한 직후 시료를 분석합니다.
- NMR 튜브를 분광계로 운반하려면 길고 섬세한 튜브를 지지하도록 설계된 홀더를 사용하십시오. 이들은 일반적으로 튜브의 바닥과 상단 근처에 지지대가 있습니다. 운송하는 동안 튜브를 똑바로 세우십시오.
- 500MHz NMR 분광계를 사용하여 90° 펄스 각도29, 펄스 폭 8μs33, 25초 지연 시간(반전 복구 실험29,43에 의해 결정됨), 스캔당 262K 포인트 및 32개의 복합 스캔29,44를 12ppm에서 -2ppm까지 25분 총 런타임.
참고: 300K의 제어 온도에서 광대역에 최적화된 프로브와 오토샘플러가 있는 Bruker Neo 500MHz 분광계를 사용했습니다. 다른 유사한 분광계를 사용할 수 있습니다. 자기장 강도가 다른 기기를 사용하는 경우 반전 회수 실험29,43을 사용하여 PBAT 및 1,4-디메톡시벤젠에 대한 T1 이완 시간을 기반으로 적절한 지연 시간을 계산할 수 있습니다. - 샘플을 실행한 후 필요에 따라 스펙트럼 데이터를 저장, 전송 또는 액세스할 수 있습니다.
스펙트럼 데이터를 검사합니다. 정량화에 사용된 모든 PBAT 피크가 존재하는 경우 명확하게 분리되었는지 확인합니다. 정량화를 위해 PBAT 피크 5(8.10ppm), 6(4.44ppm), 6'(4.38ppm), 3'(4.15ppm) 및 3(4.09ppm)을 사용합니다( 자세한 내용은 표 1 참조). 정량화를 위해 DMB 피크 A(6.84ppm) 및 B(3.77ppm)도 사용할 수 있습니다( 자세한 내용은 표 2 참조). PBAT의 6, 6', 3' 및 3 피크는 서로 매우 가깝게 나타나고 겹칠 수 있습니다. - 일부 피크가 명확하게 분리되지 않으면 샘플을 희석하십시오. 깨끗한 NMR 튜브에 100μL의 샘플과 500μL의 중수소화 클로로포름을 결합하고 3.7단계에서 정의한 것과 동일한 매개변수로 샘플을 다시 실행합니다.
4. PBAT를 정량화하기 위한 NMR 스펙트럼 분석
참고: 스펙트럼 분석은 수집 후 언제든지 수행할 수 있습니다. 스펙트럼이 생성되는 당일에 데이터를 분석하는 것이 문제가 발생할 경우 샘플을 다시 실행할 수 있도록 하는 것이 좋습니다.
- NMR FID 처리 소프트웨어에서 분광계로 생성된 FID 파일을 엽니다(여기서는 MestreLab의 MestreNova를 사용했지만 다른 옵션을 사용할 수 있음).
- 스펙트럼에 라인 확장 적용: FID 프로세싱 소프트웨어의 프로세싱 메뉴에서 프로세싱 템플릿(Processing Template )을 선택한 다음 아포디제이션(Apodization) 섹션으로 이동합니다. 크기가 0.5Hz이고 첫 번째 점이 0.5Hz인 지수 모형을 선택합니다.
- Processing 메뉴에서 Auto Phase Correction 버튼을 클릭하여 자동 위상 보정을 적용합니다. Processing 메뉴에서 Auto Baseline Correction 버튼을 클릭하여 자동 기준선 보정을 적용합니다.
- 피크 디콘볼루션을 사용하여 측정된 스펙트럼 피크를 피팅합니다: 스펙트럼 처리 소프트웨어의 Analysis 탭에 있는 Fitting 섹션에서 New Fit 버튼을 클릭합니다. 커서를 사용하여 8.5ppm의 시프트에서 스펙트럼을 클릭한 다음 커서를 3.0의 시프트로 끌어다 놓습니다.
- 피팅 섹션 아래에 있는 Line Fitting Table 을 클릭하여 모든 피팅 피크를 확인합니다.
- 정량화에 사용된 피크는 표 1 및 표 2에 설명되어 있고 그림 2에 표시되어 있습니다. 정량화에서 PBAT 피크 5(8.10ppm), 6(4.44ppm), 6'(4.38ppm), 3'(4.15ppm) 및 3(4.09ppm)과 DMB 피크 A(6.84ppm) 및 B(3.77ppm)를 사용합니다. 표 1 및 표 2에 나열된 각 피크에 해당하는 수소 원자는 그림 3의 구조도에 표시되어 있으며, 그림 3A는 두 PBAT 이량체의 구조를 보여주고, 그림 3B는 고분자 내 이량체의 위치가 1,4-부탄디올 단량체에서 수소의 피크 이동을 변경하기 위해 어떻게 상호 작용하는지를 보여줍니다. 및 도 3C는 DMB의 구조를 나타낸다.
- 원하지 않는 피크를 선택하고 Delete Peak를 클릭하여 피팅에서 다른 모든 피크를 삭제합니다.
- 피팅 테이블을 사용하여 계산을 위해 각 피크의 면적을 스프레드시트 응용 프로그램에 복사합니다(여기서는 스프레드시트를 사용하도록 선택했습니다).
- 피크 면적을 스프레드시트에 복사하려면 먼저 Line Fitting Table에서 모든 피크 정보를 선택하십시오. 그런 다음 마우스 오른쪽 버튼을 클릭하고 팝업 메뉴에서 복사 를 선택합니다. 스프레드시트에 데이터를 붙여넣습니다.
- 다음 방정식을 사용하여 샘플에 추가된 DMB의 몰 수 nDMB를 계산합니다.
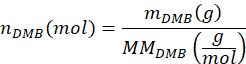
여기서 mDMB는 샘플에 첨가된 DMB의 질량(1.00mg 권장)이고 MMDMB 는 DMB의 몰 질량(138.17g/mol)입니다. - 다음 방정식을 사용하여 샘플에서 PBAT의 부틸렌 테레프탈레이트 이량체의 몰 수 nBT를 계산합니다.
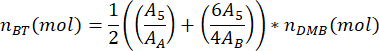
여기서, A5 는 PBAT 피크 5의 측정 영역, A는 DMB 피크 A의 측정 영역, AB는 DMB 피크 B의 측정 영역입니다. 스펙트럼 분석 소프트웨어에서 생성되는 면적 단위는 임의적입니다. - 다음 방정식을 사용하여 샘플 nBA에서 PBAT의 부틸렌 아디페이트 이량체의 몰 수를 계산합니다.

여기서, A3는 PBAT 피크 3의 측정 면적이고, A3'는 PBAT 피크 3'의 측정 면적이고, A6은 PBAT 피크 6의 측정 면적이고, A6'는 PBAT 피크 6'의 측정 면적이다. 스펙트럼 분석 소프트웨어에서 생성되는 면적 단위는 임의적입니다. - 다음 방정식을 사용하여 샘플의 PBAT 질량 m PBAT,회수됨을 계산합니다.
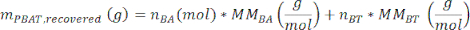
여기서 MMBA는 PBAT의 BA 이량체의 몰 질량(200g/mol)이고 MMBT는 PBAT의 BT 이량체의 몰 질량(220g/mol)입니다. - 샘플에 알려진 양의 PBAT가 존재하는 경우 방정식에 따라 추출 효율의 척도로 샘플에 대한 회수율 η을 계산할 수 있습니다
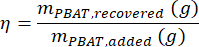
- 다음 방정식을 사용하여 시료 CPBAT의 PBAT 농도를 계산합니다.
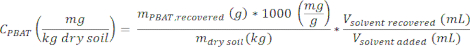
여기서 m건조 토양 은 추출물(0.1kg)을 생산하는 데 사용되는 건조 토양의 질량이고, 회수된 V용매 는 2.4단계에서 토양에서 회수된 용매의 부피이며,V sovlent added 는 토양 샘플(100mL)에 첨가된 용매의 초기 양입니다.
5. 특정 토양에서 PBAT의 정량화를 위한 검량선 준비
참고: 알려진 양의 PBAT가 첨가된 토양 샘플을 기반으로 생성된 보정 곡선은 특정 토양에서 PBAT를 추출하고 회수하는 방법에 대한 유용한 정보를 제공합니다. 추출은 모든 토양 또는 모든 형태의 PBAT에서 동일하지 않습니다. 추출 효율은 토양 점토와 유기물 함량33에 따라 달라지는 것으로 생각되며, 각 토양 계열 및 관심 지평에 대한 보정 곡선을 만들 것을 권장합니다. 검량선은 이 방법으로 알려지지 않은 샘플을 처리하기 전이나 후에 생성할 수 있습니다.
- 1.1-1.3단계에 설명된 대로 2.5kg에 해당하는 마른 토양을 수집하고 준비합니다.
- 보정 곡선이 커버할 범위를 결정합니다. 검량선에 사용된 PBAT의 최대 농도는 미지 시료 중 가장 높은 PBAT 농도보다 높아야 합니다.
- 최대 농도의 0%, 25%, 50%, 75% 및 100%(총 25개 샘플)로 100g의 토양으로 구성된 5개의 스파이크 샘플을 만들기 위해 충분한 PBAT 플라스틱을 준비하거나 확보합니다. 예를 들어, 40mg/kg이 원하는 최대 농도인 경우 스파이크된 샘플을 생성하려면 총 50mg의 PBAT가 필요합니다.
- 각각 100g의 토양 25개 샘플을 준비합니다. PBAT 기반 플라스틱의 무게를 측정하고 규정된 비율로 토양 샘플에 첨가하여 샘플을 스파이크합니다. 예를 들어, PBAT 40mg/kg이 원하는 최대 농도인 경우 PBAT가 없는 샘플 5개, PBAT 1mg이 있는 샘플 5개, PBAT 2mg이 있는 샘플 5개, PBAT 3mg이 있는 샘플 5개, PBAT 4mg이 있는 샘플 5개를 생성합니다. PBAT를 흙에 넣은 후 잘 섞는다.
- 25개의 스파이크 샘플에서 PBAT를 추출한 다음 추출물에서 NMR 스펙트럼을 수집하고 2.1단계에서 4.16단계까지 설명된 대로 결과 스펙트럼을 분석합니다.
- 각 스파이크된 샘플에서 측정된 PBAT의 양과 통계 분석 도구에 추가된 실제 PBAT의 양 사이의 선형 회귀를 수행하여 이 토양에서 PBAT에 대한 보정 곡선의 방정식을 식별합니다. 우리는 스프레드시트를 사용했습니다. PBAT가 추가되지 않은 스파이크 표본에서 PBAT가 검출되지 않으면 회귀 분석에서 force b = 0이 됩니다.
참고: 선형 회귀 테스트는 y = mx + b 관계에 따라 두 연속 숫자 변수 x와 y 사이의 선형 관계의 강도를 평가합니다. 데이터에 가장 적합한 m과 b의 값이 검정에 의해 계산됩니다. 회귀 검정의 r2 계수는 두 변수가 서로 얼마나 밀접한 상관 관계가 있는지를 설명합니다. - 통계 분석 도구를 사용하여 추출 효율과 PBAT 농도 간의 유의미한 관계를 테스트합니다. 스파이크된 샘플에서 PBAT의 추출 효율을 다음과 같이 계산합니다.
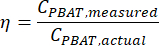
- 통계 분석 도구를 사용하여 추출 효율과 PBAT 농도 간의 상관 관계 없이 관찰된 데이터가 무작위로 발생할 수 있는 확률을 계산합니다. 이 p-값이 미리 결정된 유의성 임계값 α보다 크면 두 변수 사이에 관계가 없다는 귀무 가설을 기각하지 못합니다. 이 경우 추출 효율은 테스트 범위 내의 모든 PBAT 농도에 대해 일정하다고 가정할 수 있습니다. 귀무 가설이 기각되면 여기에 설명된 선형 모형이 데이터를 모형화하는 가장 좋은 방법이 아닐 수 있습니다.
- 검량곡선 선형 회귀 방정식을 사용하여 이 방법을 사용하여 처리된 미지 샘플의 PBAT량을 추정합니다. 회귀 x 변수가 검량선 스파이크 샘플의 실제 PBAT 양이고, y 변수가 측정된 PBAT의 양이며, b가 0으로 설정된 경우,
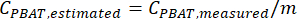
참고: 검량선 방정식을 사용하여 추정된 반복 샘플의 PBAT 함량을 사용하여 특정 토양의 PBAT 양에 대한 신뢰 구간을 생성하거나, 복제 추출물의 PBAT 농도에 대한 평균 및 신뢰 구간을 계산할 수 있는 경우 검량선을 적용하여 토양의 PBAT 농도를 추정할 수 있습니다. 두 작업 순서에 관계없이 토양의 PBAT 함량에 대해 동일한 신뢰 구간이 생성됩니다. 예를 들어, PBAT 농도가 10, 5, 2, 4, 10, 11, 2, 6, 8 및 5mg/kg인 10개의 반복 샘플에서 추출하고 보정 곡선 방정식 y(추출물에서 측정된 PBAT) = 0.75 x (토양에서 실제 PBAT)를 고려합니다. 각 복제의 토양 PBAT 농도는 13, 7, 3, 5, 13, 15, 3, 8, 11 및 7mg/kg으로 추정할 수 있습니다. 그런 다음 토양의 평균 PBAT 농도는 표준 편차가 4.4mg/kg인 8.4mg/kg으로 추정됩니다. 추출물 PBAT 농도(10, 5, 2, 4, 10, 11, 2, 6, 8, 5)에 대해 평균 및 표준 편차를 먼저 계산하면 평균 6.3mg/kg과 3.3mg/kg의 표준 편차가 계산됩니다. 그런 다음 검량선을 평균 편차와 표준 편차 모두에 적용하여 토양 내 PBAT 농도(평균 8.4mg/kg, 표준 편차 4.4mg/kg)를 추정할 수 있습니다.
결과
토양에서 PBAT 폴리머를 정량화하는 이 방법의 효능을 평가하기 위해 세 가지 다른 토양에서 생성된 스파이크 샘플에서 PBAT를 추출하여 보정 곡선을 구성했습니다. 세 가지 토양 각각에 대해( 자세한 내용은 표 3 참조) 토양을 2mm 체에 통과시킨 다음 공기 건조했습니다. 스파이크 샘플은 100g의 건조 토양에 0, 9, 18, 27 또는 36mg의 PBAT 기반 MP를 첨가하여 생성되었습니다(각 5회 반복). 이는 PBAT 폴리머의 0, 63, 126, 189 또는 252mg/kg에 해당합니다. MP는 Astner et al.45 에 기술된 분쇄 절차에 따라 질량 기준 70% PBAT 및 50μm 두께의 플라스틱 뿌리 덮개로 만들어졌으며 840μm보다 작았습니다. 각 검량선을 생성하기 위해 위에 정의된 절차에 따라 각 스파이크 샘플에서 PBAT를 추출했습니다. 그런 다음 PBAT의 회수율을 각 샘플에 첨가된 PBAT의 양과 비교했습니다. PBAT 회수율 및 정량화는 또한 하나의 토양(그늘진 양토)에서 NP(평균 직경 780nm, 다분산 지수 0.77, Astner et al.45에 따라 준비)에 대해 테스트되었습니다.
모든 토양의 경우, PBAT가 첨가되지 않은 샘플에서 PBAT가 검출되지 않았으며, 즉, 이 방법에서 관찰된 위양성(false positive)이 없었습니다. 보충 그림 1 은 PBAT를 포함하지 않은(그리고 준비 과정에서 추가된 DMB를 포함한) 그늘진 양토 토양에서 수집된 스펙트럼을 보여줍니다. 내부 캘리브rant DMB의 두 개의 특성 피크는 존재하지만 PBAT 특성 피크는 존재하지 않습니다. PBAT가 첨가된 토양의 경우, PBAT를 식별하는 데 사용된 5개의 특징적인 피크가 존재했습니다. 그림 2 는 63mg/kg의 PBAT가 첨가된 그늘진 양토 토양에서 수집한 스펙트럼을 보여줍니다. 정량화에 사용되는 모든 PBAT 및 DMB 피크는 명확하게 분리됩니다. 보충 그림 2 는 그림 2 에 표시된 스펙트럼의 적합 영역을 적분 피크가 겹쳐진 상태로 보여줍니다. 3, 3', 6, 6' 피크는 스펙트럼의 다른 신호와 겹치기 때문에 단순한 피크 적분보다는 피팅된 피크의 적분을 기반으로 PBAT 함량을 계산하는 것이 중요합니다. 이것은 토양 추출물의 다른 성분과 겹치는 PBAT 피크에 의해 기여하는 영역을 제거합니다. 보충 그림 3 은 NMR 스펙트럼 분해능에 대한 희석의 효과를 보여줍니다. 이 그림은 252mg/kg의 PBAT가 첨가된 Elkhorn 사질양토에서 수집한 스펙트럼을 보여줍니다. 패널 A에서 4.5 - 4.0ppm 범위의 3, 3', 6 및 6' PBAT 피크는 분리할 수 없습니다. 보충 그림 3B 는 추가 중수소화 클로로포름으로 1:5로 희석한 후 동일한 샘플에서 수집된 스펙트럼을 보여줍니다. 희석 후 4개의 피크가 뚜렷하고 그 면적이 적합할 수 있습니다.
보정 곡선은 우리가 테스트한 세 가지 토양 간에 다양했습니다. 그림 4는 토양에 첨가된 실제 PBAT(C,PBAT, a)와 비교하여 각 추출물에서 측정된 PBAT(CPBAT,m)를 기반으로 각 토양의 예상 PBAT 농도를 보여줍니다. 그늘진 양토 토양에서 회수된 PBAT의 양은 첨가된 PBAT의 양과 강한 상관관계가 있었습니다(r2 = 0.99). 검량곡선 방정식 CPBAT,m = m*CPBAT,a, m = 0.76 ± 0.02(평균± 1 표준 오차)의 경우 m은 0과 유의하게 달랐습니다(df = 24; F = 2000; p < 1*10-16). PBAT는 이 토양에서 η = 76% ± 10%(평균 ± 1 표준 편차)의 효율로 회수되었습니다. 그늘진 토양에서의 추출 효율은 샘플의 PBAT의 양과 상관관계가 없었습니다(r2 = 0.009; p = 0.7). NP는 η = 59% ± 8%(평균 ± 1 표준 편차)의 효율로 회수되었습니다. 그림 5는 Shady loam에서 MP와 NP의 추출 효율을 보여줍니다. NP의 효율은 유의하게 낮았다(p=0.0002). Los Osos 양토에서 회수된 PBAT의 양은 Shady 토양보다 첨가된 PBAT의 양(r2 = 0.85)과 덜 강한 상관관계가 있었습니다. 검량곡선 방정식 CPBAT,m = m*CPBAT,a, m = 0.57 ± 0.05(평균± 1개의 표준 오차)의 경우 m은 0과 유의하게 달랐습니다(df = 23; 에프 = 100; p = 8*10-11). PBAT는 이 토양에서 η = 57% ± 22%(평균 ± 1 표준 편차)의 효율로 회수되었습니다. Los Osos 토양의 추출 효율은 샘플의 PBAT의 양과 상관관계가 없었습니다(r2 = 0.01; p = 0.6). 엘크혼 사질양토에서 회수된 PBAT의 양은 첨가된 PBAT의 양과 강한 상관관계가 있었습니다(r2 = 0.88). 검량곡선 방정식 CPBAT,m = m*CPBAT,a, m = 0.70 ± 0.05(평균± 1 표준 오차)의 경우, m은 0과 유의하게 달랐습니다(df = 23; 에프 = 200; p = 5*10-12)입니다. PBAT는 이 토양에서 η = 70% ± 14%(평균 ± 1 표준 편차)의 효율로 회수되었습니다. 추출 효율은 Elkhorn 토양에 대한 샘플의 PBAT의 양(r2 = 0.006; p = 0.7)과 상관관계가 없었습니다.
또한, 이 방법은 Elkhorn 시리즈 토양에서 PBAT를 정량화하기 위해 적용되었습니다. 이 실험에서는 농경지 내의 두 곳에서 Elkhorn 토양을 수집하여 2mm 체로 체로 거른 다음 공기 건조했습니다. 토양을 각 반폐쇄 생태계(250 mg/kg PBAT)에서 50 mg의 MP와 150 g의 건조 토양과 함께 PBAT 기반 뿌리 덮개 MP(상술한 바와 같이 생성됨, <직경 840 μm)와 혼합하여 A 부지의 토양에 MP가 혼합된 5개의 반폐쇄 생태계와 B 부지의 토양에 MP가 혼합된 5개의 반폐쇄 생태계(총 10개)를 생성했습니다. MP가 추가되지 않은 각 사이트의 토양으로 구성된 5개의 반폐쇄 생태계가 음성 대조군으로 작용했습니다(총 10개). PBAT 기반 뿌리 덮개 MP의 생분해를 조사하기 위해 반폐쇄 생태계를 6개월 동안 배양했습니다. 배양 동안 누적 토양 호흡은 헤드스페이스 CO2 농도(적외선 가스 분석기 사용)를 통해 측정되었으며 PBAT 분해를 정량화하는 데 사용되었습니다. 배양이 끝날 때 반폐쇄 생태계에 남아 있는 플라스틱의 양은 다음과 같이 계산되었습니다.
플라스틱의 C Frac, 최종 = [m플라스틱, i / Cfrac 플라스틱 - (CCO2, 플라스틱 추가 - CCO2 플라스틱 없음)*m 건조 토양]/(m플라스틱, i/ Cfrac 플라스틱)
여기서 m건조 토양 은 각 배양 용기의 토양 양, Cfrac 플라스틱 은 첨가 된 미세 플라스틱의 탄소 함량, CCO2, 추가 된 플라스틱 은 건조 토양 그램 당 플라스틱이 첨가 된 반폐쇄 생태계에서 생성 된 CO2 의 누적 양, CCO2 플라스틱 없음 은 건조 토양 그램 당 플라스틱이 첨가되지 않은 반폐쇄 생태계에서 생성 된 CO2 의 양입니다. 그리고 m플라스틱, i 는 추가된 플라스틱의 초기 질량입니다.
우리는 부트스트래핑을 사용하여 각 사이트에서 10개의 실험적 반폐쇄 생태계의 무작위 쌍에 대한 10,000개의 이론적 하위 샘플로 남아 있는 플라스틱을 계산하여 토양 A와 B에 남아 있는 플라스틱에 대한 신뢰 구간을 추정했습니다. 사이트 A에서 호흡 데이터에서 추정된 평균 플라스틱은 86%였으며, 부트스트랩된 95% 신뢰 구간의 범위는 62에서 >100% 사이였습니다. 사이트 B에서 추정된 평균 플라스틱 잔량은 98%였으며 95% 신뢰 구간 범위는 79에서 >100% 사이였습니다. 6개월이 끝날 무렵, PBAT 함량은 본 원고에 기술된 추출 및 NMR 정량화 방법(부위 A의 경우 n = 5, 부위 B의 경우 n = 4)으로 측정되었습니다. 사이트 A에서 NMR 데이터에서 남아 있는 추정 평균 플라스틱은 79%였으며 95% 신뢰 구간(평균 ± 1.96xSE)은 71%에서 87% 사이였습니다. 사이트 B에서 추정된 평균 플라스틱 잔량은 88%였으며 95% 신뢰 구간 범위는 71%에서 100% 사이였습니다. 그림 6 은 두 가지 다른 방법으로 추정한 두 현장의 토양의 플라스틱 함량에 대한 신뢰 구간을 보여줍니다. 두 방법의 플라스틱 함량 추정치는 각 신뢰 구간 쌍 간의 큰 중첩 부분을 기반으로 상호 일관성이 있는 것으로 보입니다.
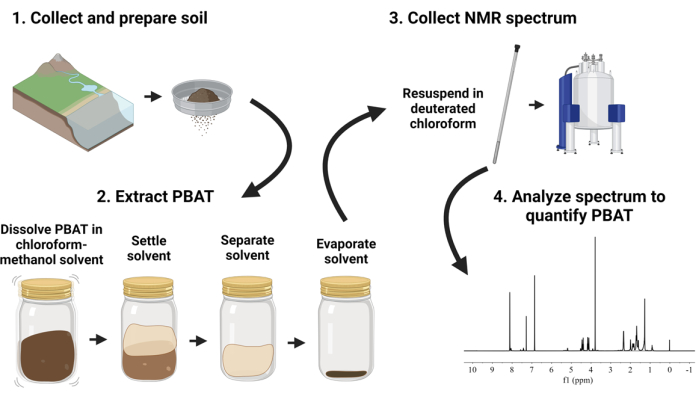
그림 1: 폴리부틸렌 아디페이트 테레프탈레이트(PBAT) 추출 및 정량화 절차의 시각적 개요.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
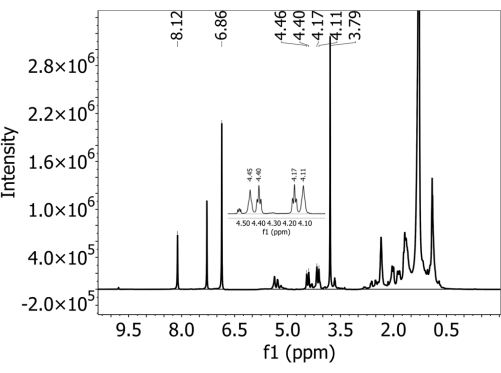
그림 2: 폴리부틸렌 아디페이트 테레프탈레이트(PBAT) MP가 있는 그늘진 양토 토양의 추출물에 대해 500MHz 분광계를 사용하여 중수소화 클로로포름 용매에서 수집된 1개의 H-NMR 스펙트럼. 1,4-디메톡시벤젠(DMB)을 NMR 분석 전에 내부 보정제로 추출물에 첨가했습니다. PBAT 및 DMB 특성 피크는 모두 스펙트럼에 존재합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
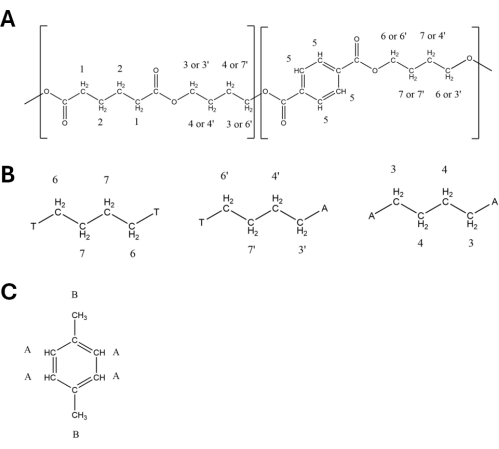
그림 3: 표지된 양성자가 있는 폴리부틸렌 아디페이트 테레프탈레이트(PBAT) 및 1,4-디메톡시벤젠(DMB)의 구조. 해당 구조체는 표 1 및 표 2 에 나타내었다.(A) PBAT의 한 BA-BT 단위의 구조. (B) PBAT의 T-B-T, T-B-A 및 ABA 트라이어드의 구조. (c) DMB의 구조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
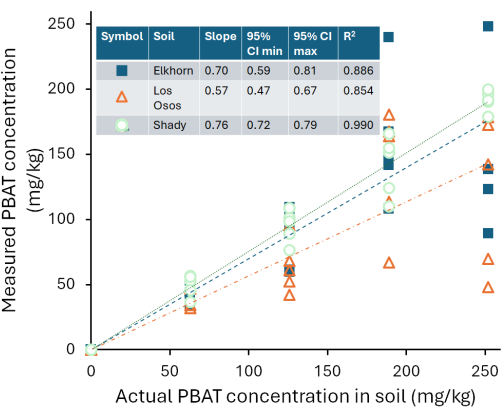
그림 4: 알려진 양의 PBAT를 함유한 그늘진 양토 토양, 로스 오소스 양토 및 엘크혼 사질양토의 중수소화 클로로포름 용매 추출물에서 1H-QNMR로 측정한 PBAT 농도.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
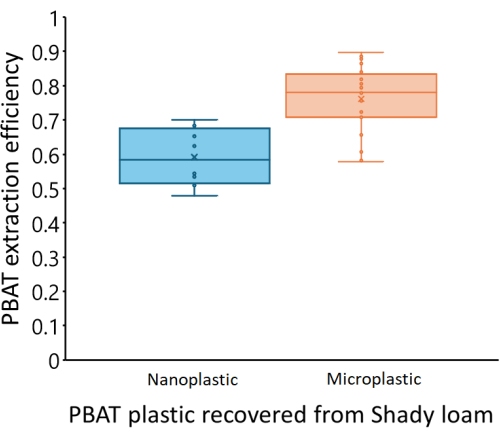
그림 5: 그늘진 양토 토양의 스파이크 샘플에서 PBAT MP 및 NP의 추출 효율. PBAT 회수율은 NP의 경우 현저히 낮습니다(p = 0.0002). 각 상자의 중간선은 측정된 데이터 포인트의 평균을 나타내고, 상자의 상한과 하한은 각각 Q3 및 Q1을 나타냅니다. 수염의 상한과 하한은 각각 최대 데이터 점과 최소 데이터 점을 반영합니다. 개별 데이터 포인트는 상자와 수염 내에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
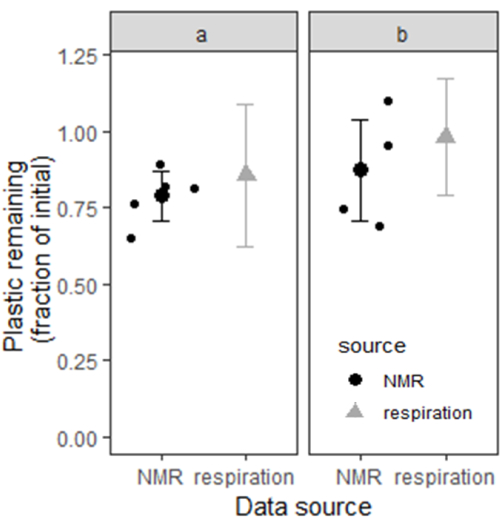
그림 6: 두 Elkhorn 토양의 플라스틱 함량은 누적 배양 호흡 및 NMR과 결합된 용매 추출로 측정되었습니다. 호흡으로 측정된 플라스틱 함량의 경우 막대는 부트스트랩된 95% 신뢰 구간을 나타냅니다. NMR로 측정한 플라스틱 함량의 경우, 막대는 평균 추정치보다 위와 아래의 표준 오차의 2배를 기반으로 하는 95% 신뢰 구간을 나타냅니다(부위 a의 경우 n = 5, 부위 b의 경우 n = 4). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 피크 ID | 위치 | 양성자의 수 | 다양성 | 단위체 | 정량화에 사용됨 |
| 5 | 8.1 | 4 | 싱글릿 | T | 예 |
| 6 | 4.44 | 2 | 트리플렛 | B | 예 |
| 6’ | 4.38 | 2 | 트리플렛 | B | 예 |
| 3’ | 4.15 | 2 | 트리플렛 | B | 예 |
| 3 | 4.09 | 2 | 트리플렛 | B | 예 |
| 1 | 2.34 | 4 | 트리플렛 | A | 아니요 |
| 7 | 1.97 | 2 | 멀티플렉 | B | 아니요 |
| 7’ | 1.87 | 2 | 멀티플렉 | B | 아니요 |
| 4’ | 1.81 | 2 | 멀티플렉 | B | 아니요 |
| 4 | 1.68 | 2 | 멀티플렉 | B | 아니요 |
| 2 | 1.66 | 4 | 멀티플렉 | A | 아니요 |
표 1: 1중수소화 클로로포름 용매에서 폴리부틸렌 아디페이트 테레프탈레이트(PBAT)의 H-NMR 스펙트럼 피크. 각 피크에 기인하는 수소는 그림 3에 표시되어 있습니다. 피크 할당은 Herrera et al.27을 기반으로 합니다.
| 피크 ID | 위치 | 양성자의 수 | 다양성 | 정량화에 사용됨 |
| A | 6.84 | 4 | 싱글릿 | 예 |
| B | 3.77 | 6 | 싱글릿 | 예 |
표 2: 1중수소화 클로로포름 용매에서 1,4-디메톡시벤젠(DMB)의 H-NMR 피크. 각 피크에 기인하는 수소는 그림 3B에 표시되어 있습니다. 피크 할당은 Nelson et al.33을 기반으로 합니다.
| 토양 시리즈 | 분류 | 텍스처 | 총 유기탄소 | 산도 | 수거 장소 | 수집 깊이(cm) |
| 그늘진 | 미세양토, 혼합, subactive, 열 Typic Hapludult | 롬 | 1.70% | 6 | 녹스빌, 테네시, 미국 | 0-5 |
| 로스 오소스 | 미세하고 smectitic, 열 Typic Argixeroll | 롬 | 3.00% | 6 | 샌 루이스 오비스포, 캘리포니아, 미국 | 0-5 |
| 엘크혼 | 미세양토, 혼합, 초활성, 열 Pachic Argixeroll | 사질양토 | 1% | 7 | 왓슨빌, 캘리포니아, 미국 | 0-5 |
표 3: PBAT 추출 방법을 시연하는 데 사용된 3가지 토양의 특성.
보충 그림 1: PBAT 폴리머가 없는 그늘진 양토 추출물에 대해 500MHz 분광계를 사용하여 중수소화 클로로포름 용매에서 수집된 1H-NMR 스펙트럼. PBAT 특성 피크는 존재하지 않는 반면 DMB(내부 보정제로 추가됨) 피크는 존재합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 그림 4와 같이 1H-NMR 스펙트럼의 적합 영역. 스펙트럼은 중수소화 클로로포름 용매에서 수집되었습니다. 녹색 배경은 피팅된 스펙트럼의 영역을 보여줍니다. 보라색 선은 피팅된 피크를 나타내고, 빨간색 라인은 오차(스펙트럼 신호의 일부는 피팅된 피크에 포함되지 않음)를 나타냅니다. PBAT 피크 5, 6, 6', 3', 3은 DMB 피크 A 및 B와 함께 핏에 포함됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: PBAT MP가 첨가된 Elkhorn 모래 양토 추출물에 대해 500MHz 분광계로 수집된 중수소화 클로로포름 용매의 1H-NMR 스펙트럼. PBAT 및 DMB 특성 피크는 모두 스펙트럼에 존재합니다. (A) PBAT 피크는 고분자를 정량화하기 위해 구별할 수 없습니다. 샘플 추출물이 이와 같은 스펙트럼을 생성하는 경우 샘플을 희석한 다음 이를 사용하여 새로운 1H-NMR 스펙트럼을 수집합니다. (B) 모든 스펙트럼 피크가 명확하게 분리되도록 동일한 추출물을 희석합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
추출물의 PBAT를 정량화하기 위해 1H-NMR과 결합된 토양에서 PBAT의 용매 추출 방법을 제안합니다. 추출 공정의 핵심 요소에는 추출 기술 및 장비, 추출에 사용되는 용매 및 시간 요구 사항이 포함됩니다. 우리는 Nelson et al.33이 입증한 Soxhlet 추출 및 가속 용매 추출(ASE)에 비해 상대적으로 간단하고 저렴한 장비(유리병, 유리 구슬 및 셰이커 테이블)가 필요한 추출 기술을 사용하기로 결정했습니다. 이 방법의 목표는 벌크 토양 샘플을 빠르게 처리할 수 있도록 많은 샘플을 병렬로 추출할 수 있다는 것입니다. 간단한 용매 진탕 추출의 또 다른 장점은 Soxhlet 또는 ASE 접근법에 비해 더 많은 양의 토양을 수용할 수 있어 환경적으로 대표적인 샘플을 더 쉽게 처리할 수 있다는 것입니다13,36. 우리는 Nelson et al.33에 의해 제시된 성공적인 결과와 1H-NMR 용매로서의 중수소화 클로로포름의 가용성에 기초하여 클로로포름-메탄올 용매 용액을 선택했습니다. 우리는 간단한 용매 진탕 방법과 비교하여 Nelson et al.33에 설명 된 프로토콜에 부합하는 용매 매트릭스 혼합물의 초음파를 테스트했으며 두 방법 간의 PBAT 회수율에 큰 차이가 없음을 발견했습니다. 우리는 우리가 테스트한 세 가지 토양에 대해 200rpm에서 8시간의 진탕만으로도 100g의 토양 매트릭스에서 토양 응집체를 파괴하기에 충분하지만 더 짧은 진탕 시간이나 더 낮은 진탕 속도는 충분하지 않다는 것을 발견했습니다. 그런 다음 토양 입자가 없는 용매를 회수하기 위해 침전이 필요했습니다. PBAT 회수율은 나노 크기의 플라스틱으로 테스트했으며 회수율은 MP보다 현저히 낮았습니다. 이는 알려지지 않은 NP의 환경 샘플을 정확하게 정량화하기 위해 이 방법에 대한 추가 개발이 필요할 수 있음을 의미하지만, 이 방법으로 입자 크기 정보를 얻을 수 없더라도 NP의 부분 회수 및 측정은 다른 크기 제한 방법에 비해 여전히 가치가 있습니다.
Nelson et al.33은 초음파 추출 방법에 대해 100%에 가까운 추출 효율을 보고했지만, 여기에 설명된 초음파 처리와 셰이커 기반 추출 방법 모두 추출 효율이 100% 미만으로 크게 낮다는 것을 발견했습니다. 우리는 이것이 플라스틱 뿌리 덮개에 대한 광산화를 포함한 환경 풍화의 영향 때문일 수 있다고 생각합니다. Nelson 등[33]은 비풍화 물질에 비해 UV가 조사된 PBAT MP의 추출 효율이 현저히 감소하는 것을 관찰했습니다. 이 정량화 방법을 테스트하는 데 사용한 플라스틱은 MP로 가공되기 전에 전체 성장기 동안 햇빛에서 현장 풍화 처리되었습니다. 상업용 플라스틱 뿌리 덮개 필름에 첨가 된 광 안정제에도 불구하고, 환경 풍화 조건 및 중합체의 열화에서 UV 방사선 (예 : 재료의 겔 함량을 증가시키는 사슬 가교) (46)으로 인해 멀치의 폴리머 구조가 변화하고 중합체의 분해는 NMR 스펙트럼(47)을 변화시킬 수 있습니다. 이는 Nelson et al.33에 비해 관찰된 PBAT 회수율이 낮은 데 기여할 수 있습니다. 또한 PBAT 추출 효율이 테스트한 세 가지 토양 간에 차이가 있음을 발견했습니다. 그늘진 토양에는 대부분 활동이 적은 점토가 포함되어 있는 반면 다른 두 토양에는 스멕타이트(Los Osos)와 혼합된 초활성(Elkhorn) 점토가 있습니다. 높은 활성과 2:1 점토 광물의 존재는 이러한 토양에서 PBAT의 용매 추출을 억제했을 수 있으며,33,48 우리가 관찰한 PBAT 회수율을 낮출 수 있습니다. PBAT를 포함한 생분해성 MP 및 NP뿐만 아니라 기존의 비분해성 고분자 MP 및 NP에 대한 토양 내 플라스틱-광물 연관성을 조사하는 추가 연구를 권장합니다. 이는 MP 폴리머가 토양에서 추출 및 측정되는 방법을 이해하고 MP 폴리머가 생분해되거나 토양 시스템에 어떤 영향을 미칠 수 있는지 이해하는 데 중요합니다.
NMR 스펙트럼 획득 프로세스의 핵심 요소에는 기기 자석 강도, 사용된 스캔 수, 스캔 사이의 샘플 이완 시간 및 샘플당 총 측정 시간이 포함됩니다. 우리는 500MHz 분광계를 사용했습니다. 더 높은 자기장 강도는 NMR 스펙트럼에서 더 큰 감도와 해상도를 제공합니다. 스펙트럼 신호 대 잡음비는 동일한 샘플의 반복 스캔을 수집하고 함께 추가함으로써 증가시킬 수 있습니다. n개의 스캔을 수집하면 신호 대 잡음비는 √n배 증가하지만 측정 시간은n29배 증가합니다. 이는 샘플에서 PBAT를 정량화하기 위해 더 높은 신호 대 잡음비가 필요한 경우 더 긴 샘플 런타임을 희생하면서 스캔 수를 늘릴 수 있음을 의미합니다. 정량화(quantification) 44에서 에러<1%를 유지하기 위해서는 특정 신호에 대한 신호 대 잡음비 150이 필요하다. 당사의 수집 매개변수(기기, 프로브, 스캔 횟수)에 따라 150의 신호 대 잡음비를 얻기 위해 샘플당 약 5mg의 PBAT(또는 추출물 mL당 50μg PBAT)가 필요하여 정량화에서 <1%의 오차를 얻었습니다. 이 농도는 데이터 수집 설정에 따라 다릅니다. 이 PBAT 농도는 토양이 없는 상태에서 다른 유형의 MP를 정량화하기 위해 1H-NMR을 사용하여 다른 사람들이 달성한 정량화 한계보다 높으며, 16,24, 정량화 방법에 대한 토양 유기물 및 기타 공동 추출 화합물의 영향을 보여줍니다. PBAT의 정량화 가능한 범위는 샘플당 25mg(추출물 mL당 250μg PBAT)보다 큰 PBAT 농도에서 볼 수 있는 선 확장으로 인해 상한선이 제한되어 있으며, 이로 인해 대표 결과에 기술되고 보충 그림 3에 표시된 바와 같이 PBAT 피크 중복이 발생했습니다. 그러나 이 방법을 사용하면 샘플이 정량화될 수 있도록 이러한 제한 사항에 유연하게 대응할 수 있습니다. 추출물을 만드는 데 사용되는 토양의 양을 늘리거나 줄일 수 있으며, 추출물을 희석하고 재분석하여 PBAT 농도를 최적 범위 내로 조정할 수 있습니다.
NMR 스펙트럼을 기반으로 PBAT를 정량화하는 프로세스의 핵심 요소에는 PBAT를 정량화하는 데 사용되는 피크, 피크 면적을 계산하기 위한 라인 피팅 사용 및 보정 곡선이 포함됩니다. 개념적으로, PBAT 및 DMB 피크의 모든 쌍을 비교하여 샘플에서 두 화합물의 비율을 계산할 수 있습니다. BT: DMB 비율을 5:A 피크 영역과 5:B 피크 영역(각각의 양성자 수로 정규화)의 평균으로 계산했을 때 가장 정확한 결과를 찾았습니다. PBAT 피크 5는 1,4-부탄디올-테레프탈레이트(BT) 단량체의 정량화만 제공하므로 3 및 3' 피크 영역(1,4-부탄디올-아디페이트 또는 BA 단량체를 나타냄)을 6 및 6' 피크 영역(BT 단량체를 나타냄)과 비교하여 샘플에 존재하는 BA 그룹을 정량화했습니다. BT와 BA의 양을 더하여 남은 PBAT의 총량을 나타냅니다. 2.7-0.7ppm 범위에서 여러 개의 넓은 피크를 생성한 공동 추출된 화합물(토양 유기물로 가정됨)의 간섭으로 인해 BA 정량화에서 PBAT 피크 1 또는 2를 사용할 수 없었습니다. 우리는 백그라운드 보정(즉, 각 샘플 스펙트럼에서 빈 스펙트럼을 빼기)을 통해 스펙트럼에서 이러한 원치 않는 신호를 제거하는 방법을 모색했지만, 캘리브란트를 사용하지 않고 동등한 비교 가능한 배경 및 샘플 스펙트럼을 생성하는 것은 신뢰할 수 없다는 것을 발견했습니다. 스펙트럼 피크를 직접 적분하는 대신 피팅된 피크의 면적을 계산하기 위해 라인 피팅이 사용되었습니다. PBAT 3과 3' 피크와 6과 6' 피크 사이가 겹치기 때문에 예비 분석을 기반으로 PBAT 함량을 보다 정확하게 추정할 수 있었습니다. 다양한 토양에서 PBAT의 다양한 회수율을 설명하기 위해 검량선을 생성하는 것이 좋습니다. PBAT 회수율은 우리가 테스트한 3개의 토양 중 한 쌍에서 유의하게 달랐으며, 이는 검량선 기울기에 대한 95% 신뢰 구간이 겹치지 않는 것에서 알 수 있습니다. 제3의 토양에서의 PBAT 회수율은 다른 두 토양과 크게 다르지 않았다. 토양 구성이 PBAT 회수에 미치는 영향에 대한 기계론적 이해가 없는 경우, 각 관심 토양 시리즈와 토양 프로파일 내의 각 지평선에서 PBAT 회수율을 평가하기 위해 보정 곡선을 만드는 것이 좋습니다. 보정 곡선이 토양 간에 통계적으로 유사한 것으로 확인되면 토양을 쉽게 조합하여 분석할 수 있습니다.
우리는 이 방법이 토양 내 PBAT MP 및 NP를 정량화하는 데 관심이 있는 사람들, 특히 장기 플라스틱 생분해 현장 연구와 같이 유사한 토양에서 수집된 많은 수의 샘플에서 PBAT를 정량화하는 데 관심이 있는 사람들에게 유용한 도구를 제공할 수 있다고 믿습니다. 토양에서 MP를 정량화하는 NMR 방법은 NMR에 대한 접근성과 전문 지식을 갖춘 연구자가 토양 시스템에서 MP의 존재 및 행동에 대한 중요한 질문에 답함으로써 신흥 분야의 요구 사항을 충족하는 데 기여할 수 있기 때문에 가치가 있습니다. 기기 및 전문 지식에 대한 접근이 연구자의 정량화 기술 선택을 제한하는 첫 번째 실질적인 문제 중 일부가 될 가능성이 높지만, NMR은 모든 조건에서 토양의 미세 플라스틱을 정량화하는 데 가장 효율적이거나 가장 적합한 도구는 아닙니다. 입자 형상 및 크기 정보는 용매 추출 기술로 얻을 수 없습니다. MP의 모양과 크기에 관심이 있는 경우, 연구자들은 FTIR 또는 라만 분광법과 같은 개별 MP 입자를 식별하는 기술을 사용하는 것이 더 좋습니다. FTIR 또는 라만 분광법과 같은 다른 MP 정량화 접근법과 비교하여 여기와 Nelson et al.33 에 제시된 것과 같은 용매 추출 방법의 한 가지 장점은 정량화할 수 있는 MP 및 NP에 개념적으로 크기 제한이 없다는 것입니다. 용매 추출은 입자 크기 정보가 필요하지 않거나 관심 입자를 다른 수단으로 분리하기가 너무 어려운 경우에 가장 유용할 수 있습니다. 열분해 GCMS는 NMR보다 감도가 높기 때문에 가치가 있을 수 있지만 PBAT 용매 추출이 가능하기 때문에 결과도 매트릭스 효과의 영향을 받을 수 있습니다.
우리는 추가 작업이 NMR 스펙트럼에서 PBAT 피크 분해능을 방해하는 공동 추출된 토양 성분을 해결하여 이 방법의 견고성을 향상시킬 수 있기를 바랍니다. 이 방법을 통해 PBAT 플라스틱 내후성과 추출 효율 사이의 관계를 확립하기 위해서는 추가 작업이 필요하며, 아마도 PBAT 분해 생성물과 1H-NMR 스펙트럼에 대한 보다 자세한 이해가 수반될 것입니다. 본 연구와 Nelson et al.33의 결과를 바탕으로 한 이 정량화 절차는 유기물이 적고 활성이 높은 점토가 없는 토양에서 풍화되지 않은 PBAT 플라스틱을 정량화하는 데 가장 적합합니다. 이 방법은 토양에서 PBAT 기반 MP를 정량화하는 데만 사용했지만 용매 추출 및 1H-NMR 정량화 절차는 추가 토양26,49에서 다른 MP 및 NP를 정량화하는 데 유용 할 수 있습니다. 이 방법을 다른 중합체로 만들어진 MP로 확장하려면 용매에서 중합체의 용해도를 보장하고 선택한 용매에서 중합체로부터 특징적인 NMR 피크를 식별해야 합니다. 선택한 용매에 용해되고 관심 중합체(42)의 피크와 중첩되는 피크를 생성하지 않는 새로운 내부 캘리브rant를 선택해야 할 수도 있습니다.
공개
저자들은 이 논문에 보고된 연구에 영향을 미칠 수 있는 경쟁적인 재정적 이해관계나 개인적 관계를 알려진 바가 없다고 선언합니다.
감사의 말
SMS에 수여 번호 2020-67019-31167을 통해 이 프로젝트에 자금을 지원해 준 USDA-NIFA와 내부 보조금 DGH 및 SMS를 위한 테네시 대학교 전략 계획 연구 이니셔티브(SPRINT) 프로그램에 감사드립니다. 자금 제공자는 연구 설계, 데이터 수집, 분석, 해석, 보고서 작성 또는 논문 출판 결정에 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
참고문헌
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유