Method Article
Modelagem imunológica preditiva de tumores sólidos
Neste Artigo
Resumo
O uso de uma abordagem baseada em RNA para determinar perfis imunológicos quantitativos de tecidos tumorais sólidos e aproveitar coortes clínicas para a descoberta de biomarcadores imuno-oncologia é descrito através de protocolos moleculares e informativos.
Resumo
Imunoterápicos mostram promessa no tratamento de pacientes oncológicos, mas a heterogeneidade complexa do microambiente tumoral torna a previsão de resposta ao tratamento desafiadora. A capacidade de resolver as populações relativas de células imunes presentes dentro e ao redor do tecido tumoral tem se mostrado clinicamente relevante para entender a resposta, mas é limitada por técnicas tradicionais como citometria de fluxo e imunohistoquímica ( O IHC), devido à grande quantidade de tecido necessário, à falta de marcadores precisos do tipo celular e muitos obstáculos técnicos e logísticos. Um ensaio (por exemplo, o ImmunoPrism Immune Perfil Assay) supera esses desafios acomodando pequenas quantidades de RNA e RNA altamente degradada, características comuns de RNA extraídos de tecido tumorado sólido clinicamente arquivado. O ensaio é acessado através de um kit de reagente e informática baseada em nuvem que fornece uma solução de perfil imunológico quantitativo de ponta a ponta para plataformas de sequenciamento illumina. Os pesquisadores começam com apenas duas seções de tecido formalinado parafina -embedded (FFPE) ou 20-40 ng de RNA total (dependendo da qualidade da amostra), e o protocolo gera um relatório de perfil imunológico quantificando oito tipos de células imunes e dez de escape imunológica genes, capturando uma visão completa do microambiente tumoral. Nenhuma análise bioinformática adicional é necessária para fazer uso dos dados resultantes. Com as coortes amostrais apropriadas, o protocolo também pode ser usado para identificar biomarcadores estatisticamente significativos dentro de uma população de interesse do paciente.
Introdução
Quantificação de linfócitos infiltrados em tumores (TILs) e outras moléculas relacionadas à imunológica em amostras de tecido humano de tumor fixo e parafina (FFPE) demonstrou valor na pesquisa clínica1,2,3. Técnicas comuns como citometria de fluxo e sequenciamento de ácido ribonucleico de célula única (RNA) são úteis para tecido fresco e sangue4,mas são inadequadas para análise de materiais ffpe devido à incapacidade de criar suspensões celulares viáveis. Os métodos atuais que têm sido usados para quantificar essas células no tecido FFPE sofrem de grandes desafios. Imunohistoquímica (IHC) e outros fluxos de trabalho semelhantes de imagem requerem anticorpos específicos para detectar proteínas de superfície celular, o que pode ser difícil de padronizar entre laboratórios para permitir quantificação reprodutível5. Plataformas como o sistema nCounter dependem da expressão de genes únicos para definir as principais células imunes6,limitando a sensibilidade e especificidade da detecção. Métodos mais genéricos de sequenciamento de RNA, aliados a ferramentas de software autônomos, estão disponíveis, mas requerem otimização e validação significativas antes do uso7,8,9,10,11,12. Os recentes avanços na combinação de microdissecção de captura a laser (LCM) com sequenciamento de RNA para tecido FFPE mostraram-se promissores; no entanto, uma solução de ponta e turnkey é necessária para estudos translacionais destinados a identificar biomarcadores robustos13,14. Métodos para gerar biomarcadores multidimensionais, como modelagem imunológica preditiva, que definem coortes de pacientes, incluindo atendentes de terapia, subtipos de câncer ou desfechos de sobrevivência com alta precisão preditiva e significância estatística estão se tornando cada vez mais importantes na era da medicina de precisão e imunoterapia15,16.
Para atender a essa necessidade, um ensaio imunológico de perfil foi desenvolvido para permitir quantificação sensível e específica de células imunes em tecido ffpe tumorsólido usando reagentes padronizados de sequenciamento de RNA e informática baseada em nuvem. Além de acomodar RNA degradado do tecido FFPE, o protocolo é capaz de acomodar RNA derivado de amostras de tecido limitante, como biópsias de agulhas principais, aspiradores de agulhas e tecido micro ou macrodissecado. Os dados de RNA de cada amostra são comparados a um banco de dados de modelos de expressão genética de células imunes, chamados modelos imunológicos de expressão da saúde, para quantificar células imunes como uma porcentagem do total de células presentes na amostra. Resumidamente, esses modelos foram construídos usando métodos de aprendizagem de máquina para identificar padrões exclusivos de expressão multigênica de dados de transcrição total gerados a partir de populações de células imunes purificadas (isoladas usando marcadores canônicos de superfície celular)17,18. Os Modelos multidimensionais de expressão em saúde subjacentes à tecnologia permitem que o ensaio quantifique cada célula imune como um por cento do total de células presentes na mistura heterogêneo. Isso permite ao pesquisador gerar comparações de células imunes inter e intraamostrais, que têm mostrado ter valor clínico19,20. Outras aplicações incluem quantificação da resposta imune pré e pós-tratamento, como descrito nos resultados representativos. O ensaio relata múltiplas características de contextura imunológica do microambiente tumoral e tumoral, incluindo os percentuais absolutos de oito tipos de células imunes (derivados de modelos de expressão genética): células CD4+ T, células CD8+ T, células CD56+ Natural Killer, células CD19+ B, CD14+ monocytes, Tregs, macrófagos M1phag e macrófagos M2. Além disso, o ensaio relata a expressão (em transcrições por milhão, ou TPM) de dez genes de fuga imunológica: PD-1, PD-L1, CTLA4, OX40, TIM-3, BTLA, ICOS, CD47, IDO1 e ARG1.
O kit de reagente é usado para fazer bibliotecas de alta qualidade prontas para sequenciamento em uma plataforma illumina seguindo um método híbrido de preparação de biblioteca susceptífica de captura, como mostrado na Figura 1. Se um pesquisador não tiver uma plataforma de sequenciamento illumina em seu laboratório, eles podem submeter suas amostras a um laboratório central para sequenciamento. Uma vez gerados, os dados de sequenciamento são enviados ao Portal Prisma para análise automatizada, e um perfil abrangente e quantitativo para cada amostra individual, a forma do Relatório Imunológico (Figura 2A),é devolvido ao usuário. Os usuários também podem definir agrupamentos amostrais no Portal Prisma para gerar um Relatório Biomarcador (Figura 2B),destacando biomarcadores estatisticamente significativos que distinguem duas coortes de pacientes. É importante ressaltar que os dados gerados pelo kit de reagente são apenas para uso de pesquisa e não podem ser utilizados para fins diagnósticos.

Figura 1: Visão geral do fluxo de trabalho. Neste protocolo, o RNA é convertido pela primeira vez em cDNA. Os adaptadores de sequenciamento são ligados, e o CDNA adaptador é amplificado e codificado pelo PCR para criar uma biblioteca de pré-captura. As sondas biotinyuladas são então hibrificadas para alvos específicos de CDNA que são então capturados usando contas de streptavidina. CDNA não-direcionado sem limites é removido lavando. Um enriquecimento final do PCR rende uma biblioteca pós-captura pronta para sequenciamento. *O RNA total deve ser de amostras humanas; pode estar intacto ou degradado RNA (FFPE). Clique aqui para ver uma versão maior deste valor.

Figura 2: Relatórios imunológicos representativos. O fluxo de trabalho gera dois relatórios, um relatório imunológico individual (A) para cada amostra processada, e um relatório biomarcador(B)para coortes de pacientes definidos. Clique aqui para ver uma versão maior deste valor.
O protocolo requer aproximadamente 16 h de tempo de preparação (do RNA total às bibliotecas prontas para sequenciamento); no entanto, há uma série de pontos de parada opcionais, como observado no protocolo. O ensaio faz uso da rica natureza dinâmica da transcriptômica para ir além de biomarcadores legados de analito para modelos multidimensionais de expressão genética, permitindo assim caracterização biológica abrangente de amostras de tecido com padronização reagentes e ferramentas de software fáceis de usar. Ele capacita os pesquisadores a utilizar uma tecnologia contemporânea em seu próprio laboratório, aproveitando o aprendizado de máquina e um banco de dados de Modelos de Expressão em Saúde para derivar perfis imunológicos mais precisos e quantitativos de amostras clínicas preciosas e descobrir Biomarcadores rna multidimensionais com análise estatística completa.
Protocolo
As amostras de tecido humano utilizadas nos Resultados Representativos aqui mostradas foram compradas de uma entidade respeitável (TriStar Technology Group) e informaram o consentimento do doador permitindo pesquisas acadêmicas e comerciais, bem como aprovação de um ético competente Comité.
Parte I: Preparação da Biblioteca pré-captura
1. Quantificação e Qualificação de RNA
- Quantifique o RNA usando um ensaio fluorométrico para determinar a entrada apropriada para o ensaio. Avalie a qualidade do RNA de entrada utilizando eletroforese para determinar os valores do RNA Integrity Number (RIN) e a porcentagem de fragmentos >200 nucleotídeos (DV200).
- Para amostras de RNA intactas (RIN > 7) ou parcialmente degradadas (RIN = 2 a 7) sigam os passos de preparação da biblioteca para RNA de alta qualidade/intacto, começando com a Etapa 2.1. A qualidade do RNA é importante para selecionar o tempo correto de fragmentação no Programa ciclor térmico #1 (Tabela Suplementar 2).
- Para amostras altamente degradadas (por exemplo, RIN = 1 a 2 ou FFPE), determine o valor DV200. Estas amostras não requerem fragmentação e seguirão as instruções para RNA degradada, começando com a Etapa 2.2.
- Prepare a quantidade adequada de RNA total para cada amostra para diluir 20 ng de RNA (RNA de Alta Qualidade/Intacto com RIN > 2) ou 40 ng de RNA (RNA Degradado/FFPE com DV200 > 20%) a 5 μL em água livre de nuca. O processamento de amostras com DV200 < 20% não é recomendado. Para as amostras de RNA de controle fornecidas com o kit, diluir 1 μL do RNA apropriado em 4 μL de água livre de nuca. As amostras de controle seguirão o mesmo processamento descrito para materiais de RNA de Alta Qualidade (Intactos) ou Degradados (FFPE), conforme rotulado. Consulte a Tabela Suplementar 1 para todos os reagentes incluídos no kit.
2. Fragmentação de RNA e Priming
- Siga o Passo 2.1.1 para RNA de Alta Qualidade/Intacto com RIN > 2.
- Para RNA de alta qualidade, monte a fragmentação e a reação de priming no gelo em um tubo PCR livre de nuca, de acordo com a Tabela 1.
- Misture bem, canalizando para cima e para baixo várias vezes. Em seguida, girar brevemente para baixo as amostras em um microcentrífuga
NOTA: Para todas as giros de centrífuga no protocolo, recomenda-se uma velocidade de ≥ 1.000 x g para pelo menos 3 s. - Coloque as amostras em uma cicloteira térmica e use o Programa #1 (Tabela Suplementar 2).
- Transfira imediatamente os tubos para gelo e prossiga para a Síntese de CDNA first strand para RNA de alta qualidade (Passo 3.1). Para a preparação simultânea tanto do RNA de Alta Qualidade quanto da FFPE, inicie a preparação do RNA FFPE (Passo 2.2) durante a Incubação de Fragmentação.
- Misture bem, canalizando para cima e para baixo várias vezes. Em seguida, girar brevemente para baixo as amostras em um microcentrífuga
- Para RNA de alta qualidade, monte a fragmentação e a reação de priming no gelo em um tubo PCR livre de nuca, de acordo com a Tabela 1.
| Fragmentação e Mistura de Priming | Volume (μL) |
| RNA intacto ou parcialmente degradado (20 ng) | 5 |
| Primeiro buffer de reação de síntese de vertente | 4 |
| Primers aleatórios | 1 |
| Total Volume | 10 |
Tabela 1: Fragmentação e reação de priming para RNA de alta qualidade. Os componentes da fragmentação e da reação de priming para rna de alta qualidade devem ser montados e misturados no gelo de acordo com os volumes mostrados. Uma mistura mestre de Buffer de Reação de Síntese de Primeira Vertente e Primers Aleatórios pode ser feita e adicionada às amostras de RNA.
- Siga o Passo 2.2.1 para RNA Degradado/FFPE com DV200 > 20%.
- Para rna altamente degradada (FFPE) que não requer fragmentação, monte a reação de priming como descrito na Tabela 2. Para rna intacto, lembre-se de seguir o Passo 2.1.
- Misture bem, canalizando para cima e para baixo várias vezes. Em seguida, giro brevemente para baixo as amostras em um microcentrífuga.
- Coloque as amostras em uma cicloteira térmica e use o Programa #2 (Tabela Suplementar 2).
- Transfira os tubos para gelo e prossiga para a Síntese de CDNA de Primeira Strand para RNA altamente degradado (FFPE) (Passo 3.2).
- Para rna altamente degradada (FFPE) que não requer fragmentação, monte a reação de priming como descrito na Tabela 2. Para rna intacto, lembre-se de seguir o Passo 2.1.
| Reação primiante | Volume (μL) |
| Ffpe RNA (40 ng) | 5 |
| Primers aleatórios | 1 |
| Total Volume | 6 |
Tabela 2: Reação aleatória de priming para RNA altamente degradada. Componentes da reação de priming para RNA altamente degradado devem ser montados no gelo em um tubo PCR sem nuca.
3. Síntese de cDNA de primeira vertente
- Siga o Passo 3.1.1 para RNA de Alta Qualidade/Intacto com RIN > 2.
- Para RNA intacto (alta qualidade), monte a reação da Primeira Vertente Síntese no gelo em um tubo PCR sem nuca, de acordo com a Tabela 3.
- Mantendo as reações no gelo, misture completamente, encando para cima e para baixo várias vezes. Giro brevemente as amostras em um microcentrífuga, e proceda diretamente para a incubação da síntese da Primeira Strand (Passo 4).
- Para RNA intacto (alta qualidade), monte a reação da Primeira Vertente Síntese no gelo em um tubo PCR sem nuca, de acordo com a Tabela 3.
| Primeira Síntese de Vertente | Volume (μL) |
| RNA fragmentado e Primed (Passo 2.1.3) | 10 |
| Reagente de especificidade da síntese do primeiro fio | 8 |
| Primeira mistura de enzima sintetizador de fios | 2 |
| Total Volume | 20 |
Tabela 3: Primeira reação de síntese de fios para RNA de alta qualidade. Os componentes da fragmentação e da reação de priming para RNA de alta qualidade devem ser montados e misturados no gelo de acordo com os volumes dados. Uma mistura mestre de Reagente de Especificidade de Síntese de Primeira Vertente e Mistura de Enzimas de Síntese de Primeira Vertente pode ser feita e adicionada às amostras de RNA fragmentadas e preparadas.
- Siga o Passo 3.2.1 para RNA Degradado/FFPE com DV200 > 20%.
- Para rna altamente degradada (FFPE), monte a reação da Primeira Síntese de Fios no gelo em um tubo PCR sem nuclease de acordo com a Tabela 4.
- Mantendo as reações no gelo, misture completamente, encando para cima e para baixo várias vezes. Giro brevemente as amostras em um microcentrífuga, e proceda diretamente para a incubação da síntese da Primeira Strand (Passo 4).
- Para rna altamente degradada (FFPE), monte a reação da Primeira Síntese de Fios no gelo em um tubo PCR sem nuclease de acordo com a Tabela 4.
| Primeira Síntese de Vertente | Volume (μL) |
| RNA Primed (Passo 2.2.3) | 6 |
| Primeiro buffer de reação de síntese de vertente | 4 |
| Reagente de especificidade do primeiro fio | 8 |
| Primeira mistura de enzima sintetizador de fios | 2 |
| Total Volume | 20 |
Tabela 4: Primeira reação de síntese de fios para RNA altamente degradada. Os componentes da fragmentação e da reação de priming para RNA altamente degradado devem ser montados e misturados no gelo de acordo com os volumes mostrados. Uma mistura mestre de Buffer de Reação de Síntese de Primeira Vertente, Reagente de especificidade de síntese de primeira vertente e mix de enzimas de síntese de primeira vertente podem ser feitas e adicionadas às amostras de RNA preparadas.
4. Incubação da Síntese de Primeira Vertente
- Mantendo os tubos no gelo, misture completamente, encando para cima e para baixo várias vezes. Giro brevemente as amostras em um microcentrífuga. Incubar as amostras em uma cicloteira térmica pré-aquecida seguindo o Programa #3 (Tabela Suplementar 2).
5. Segunda Síntese de CDNA de Fio
- Prepare a segunda reação de síntese de cDNA de fio no gelo, montando os componentes listados na Tabela 5,incluindo o primeiro produto de reação de fios da Etapa 4.1.
| Reação de síntese de segunda fio | Volume (μL) |
| Primeiro Produto de Síntese de Fios (Passo 4.1) | 20 |
| Segundo tampão de reação de síntese de fios | 8 |
| Mistura de enzima sintetizador de segunda vertente | 4 |
| Água livre de nuclease | 48 |
| Total Volume | 80 |
Tabela 5: Segunda Reação síntese de fios. Os componentes da reação de síntese do segundo fio cDNA devem ser montados e misturados no gelo de acordo com os volumes mostrados. Uma mistura mestre do Buffer de Reação de Síntese de Segunda Vertente, Mistura de Enzimas de Síntese de Segunda Vertente e Água Livre de Nuclease podem ser feitas e adicionadas ao Produto de Síntese do Primeiro Fio.
- Mantendo os tubos no gelo, misture completamente, encando para cima e para baixo várias vezes. Incubar em uma cicloteira térmica seguindo o Programa #4 (Tabela Suplementar 2).
6. limpeza cDNA Usando SPRI (Fase Sólida Imobilização Reversível) Contas
- Permita que as contas SPRI aqueçam a temperatura ambiente por pelo menos 30 min antes do uso e, em seguida, o vórtice SPRI Beads por aproximadamente 30 s para resuspender.
- Adicione 144 μL de contas resuspensas à reação de síntese do segundo fio (~80 μL). Misture bem, encante para cima e para baixo pelo menos 10 vezes e incubar por 5 min à temperatura ambiente.
- Gire brevemente os tubos em um microcentrífuga e coloque os tubos em um rack magnético para separar contas do supernatante. Depois que a solução estiver clara, remova cuidadosamente e descarte o supernatante. Tenha cuidado para não perturbar as contas, que contêm DNA.
- Adicione 180 μL de etanol recém-preparado 80% aos tubos enquanto estiver no rack magnético. Incubar a temperatura ambiente para 30 s, e depois remover cuidadosamente e descartar o supernatant.
- Repita o Passo 6.4 uma vez para um total de 2 etapas de lavagem.
- Remova completamente o etanol residual. Deixe os tubos no rack magnético e seque as contas por aproximadamente 3 min com a tampa aberta, ou até ficar visivelmente seca. Não seque as contas, pois isso pode resultar em menor recuperação do DNA.
- Remova os tubos do ímã e adicione 53 μL 0,1x TE Buffer (incluído no kit de reagente, consulte a Tabela Suplementar 1) às contas. Pipette para cima e para baixo pelo menos 10 vezes para misturar completamente. Incubar por 2 min à temperatura ambiente.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Transfira 50 μL do supernatante para limpar tubos PCR sem nuca. Tenha cuidado para não perturbar as contas. Este é um ponto de parada opcional no protocolo, as amostras de cDNA podem ser armazenadas a -20 °C.
7. Reparo final da Biblioteca CDNA
- Monte a reação final de reparo no gelo, montando os componentes listados na Tabela 6 para o segundo produto de síntese de fios a partir da Etapa 6.8.
| Reação de reparo final | Volume (μL) |
| Segundo Produto de Síntese de Fios (Passo 6.8) | 50 |
| Buffer de reação de reparo final | 7 |
| Mistura de enzimade reparo final | 3 |
| Total Volume | 60 |
Tabela 6: Reação de reparo final. Os componentes da reação de reparo final devem ser montados e misturados no gelo de acordo com os volumes mostrados. Uma mistura mestre do Buffer de Reação de Reparo Final e do Mix de Enzimas de Reparo Final podem ser feitas e adicionadas ao Segundo Produto de Síntese de Fios.
- Defina uma pipeta a 50 μL e, em seguida, pipeta todo o volume para cima e para baixo pelo menos 10 vezes para misturar completamente. Brevemente centrífuga para coletar todo o líquido das laterais dos tubos. É importante misturar bem. A presença de uma pequena quantidade de bolhas não interferirá no desempenho.
- Incubar as amostras em uma cicloteira térmica seguindo o Programa #5 (Tabela Suplementar 2).
8. Ligation Adaptador
- Antes de configurar a reação da ligação, diluir o Adaptador no Tampão de Diluição do Adaptador frio-gelo, como mostrado na Tabela 7,multiplicando-se pelo número necessário de amostras, mais 10% a mais. Mantenha o adaptador diluído no gelo.
| Diluição da Ligação | Volume (μL) |
| Adaptador | 0.5 |
| Buffer de diluição do adaptador | 2 |
| Total Volume | 2.5 |
Tabela 7: Diluição do Adaptador. O adaptador deve ser diluído no gelo com buffer de diluição adaptador de acordo com os volumes mostrados.
- Monte a reação de ligadura no gelo adicionando os componentes descritos na Tabela 8,na ordem listada, ao produto final de reação preparatória da Etapa 7.3. Note que o Jogador de Mixe Master e Ligation da Ligation pode ser misturado com antecedência. Esta mistura fica estável por pelo menos 8h a 4 °C. Não premisture o Mistura Mestre da Ligação, O Melhorador de Ligação e Adaptador antes de usar na Etapa de Ligação Adaptador.
| Reação da Ligação | Volume (μL) |
| DNA prepado final (Passo 7.3) | 60 |
| Adaptador diluído (Passo 8.1) | 2.5 |
| Melhorador de Ligation | 1 |
| Mistura Mestre da Ligação | 30 |
| Total Volume | 93.5 |
Tabela 8: Reação da Ligação. Os componentes da reação de ligação do adaptador devem ser montados no gelo de acordo com os volumes mostrados na ordem mostrada. Uma mistura mestre de Melhoradora de Ligation e Ligation Master Mix pode ser feita e adicionada ao DNA Final Preped com Adaptador Diluído. Não misture o adaptador diluído e o Misturador Mestre da Ligação ou O Melhorador de Ligação antes de misturar o DNA Final Preped.
- Defina uma pipeta a 80 μL e, em seguida, pipeta todo o volume para cima e para baixo pelo menos 10 vezes para misturar completamente. Faça uma rotação rápida para coletar todo o líquido das laterais dos tubos. O Mistura Mestre da Ligação é muito viscoso. Tome cuidado para garantir a mistura adequada da reação da ligação, pois a mistura incompleta resultará em redução da eficiência da ligação. A presença de uma pequena quantidade de bolhas não interferirá no desempenho.
- Incubar seguindo o Programa #6 (Tabela Suplementar 2), e depois remover a mistura de ligadura da ciclor térmica e adicionar 3 μL de Enzima de Processamento adaptador, resultando em um volume total de 96,5 μL.
- Pipette para cima e para baixo várias vezes para misturar bem, e depois incubar seguir o Programa #7 (Tabela Suplementar 2) antes de prosseguir imediatamente para a Purificação da Reação da Ligação.
9. Purificação da Reação da Ligação usando Neads SPRI
- Permita que as contas SPRI aqueçam a temperatura ambiente por pelo menos 30 min antes do uso e, em seguida, o vórtice SPRI Beads por aproximadamente 30 s para resuspender.
- Adicione 87 μL de contas SPRI resuspensas e misture bem, canalizando para cima e para baixo pelo menos 10 vezes. Incubar por 10 min à temperatura ambiente.
- Gire brevemente os tubos em um microcentrífuga e coloque os tubos em um rack magnético para separar contas do supernatante. Depois que a solução estiver clara (~5 min), remova cuidadosamente e descarte o supernatant. Não descarte as contas.
- Adicione 180 μL de etanol recém-preparado 80% aos tubos enquanto estiver no rack magnético. Incubar a temperatura ambiente para 30 s, e depois remover cuidadosamente e descartar o supernatant. Repita o Passo 9.4 uma vez para um total de 2 etapas de lavagem.
- Remova completamente o etanol residual. Deixe os tubos no rack magnético e seque as contas por aproximadamente 3 min com a tampa aberta, ou até ficar visivelmente seca. Não seque as contas, pois isso pode resultar em menor recuperação do DNA.
- Remova os tubos do ímã e adicione 17 μL de tampão TE de 0,1x às contas. Pipette para cima e para baixo pelo menos 10 vezes para misturar completamente. Incubar por 2 min à temperatura ambiente e, em seguida, coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatante.
- Transfira 15 μL do supernatante para limpar tubos PCR sem nuca. Tenha cuidado para não perturbar as contas. Este é um ponto de parada opcional no protocolo, o DNA adaptador-ligado pode ser armazenado a -20 °C.
10. Enriquecimento PCR de DNA Ligado adaptador
- Configure a reação do PCR como descrito na Tabela 9. Um Mix Mestre contendo o PcR Master Mix pré-captura e o Primer Universal podem ser feitos e adicionados ao DNA ligado adaptante. Para sequenciamento multiplexed, use primers de índice exclusivos para cada reação e adicione a cada amostra individualmente.
| Enriquecimento pcr | Volume (μL) |
| DNA ligado adaptor (Passo 10.1) | 15 |
| Mix Mestre PCR pré-captura | 25 |
| Universal PCR Primer | 5 |
| Primer de índice (X) | 5 |
| Total Volume | 50 |
Tabela 9: Enriquecimento pcr de DNA ligado adaptador. Componentes do enriquecimento pcr de reação de DNA ligada adaptador devem ser montados e misturados no gelo de acordo com os volumes mostrados. Uma mistura master do PcR Master Mix pré-captura e do Primer UNIVERSAL PCR pode ser feita e adicionada ao DNA ligado adaptador. Para sequenciamento multiplexed, cada amostra deve receber um Primer de índice único.
- Misture bem, encanando suavemente para cima e para baixo 10 vezes. Gire brevemente os tubos em uma microcentrífuga e coloque em uma cicloteira térmica e realize amplificação PCR usando o Programa #8 (Tabela Suplementar 2).
11. Purificação da reação do PCR usando contas spri
- Permita que as contas SPRI aqueçam a temperatura ambiente por pelo menos 30 min antes do uso e, em seguida, o vórtice SPRI Beads por aproximadamente 30 s para resuspender.
- Adicione 45 μL de contas resuspensas a cada reação pcr (~50 μL). Misture bem, encanando para cima e para baixo pelo menos 10 vezes, antes de mergulhar por 5 min à temperatura ambiente.
- Gire brevemente os tubos em um microcentrífuga e coloque os tubos em um rack magnético para separar contas do supernatante. Depois que a solução estiver clara (~5 min), remova cuidadosamente e descarte o supernatant. Tenha cuidado para não perturbar as contas que contêm DNA.
- Adicione 180 μL de etanol recém-preparado 80% aos tubos enquanto estiver no rack magnético. Incubar a temperatura ambiente para 30 s, e depois remover cuidadosamente e descartar o supernatant. Repita o Passo 11.4 uma vez para um total de 2 etapas de lavagem.
- Remova completamente o etanol residual. Deixe os tubos no rack magnético e seque as contas por aproximadamente 3 min com a tampa aberta, ou até ficar visivelmente seca. Não seque as contas, pois isso pode resultar em menor recuperação do DNA.
- Remova os tubos do ímã e adicione 23 μL 0,1x TE Buffer às contas. Pipette para cima e para baixo pelo menos 10 vezes para misturar completamente. Incubar por 2 min à temperatura ambiente.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Transfira 20 μL do supernatante para limpar tubos PCR sem nuca. Tenha cuidado para não perturbar as contas. Este é um ponto de parada opcional no protocolo, as Bibliotecas pré-captura podem ser armazenadas a -20 °C.
12. Validar e Quantificar Biblioteca de Pré-Captura
- Meça a concentração da biblioteca pré-captura usando um kit de ensaio de fluorômetro e alta sensibilidade. Um rendimento mínimo de 200 ng é necessário para prosseguir para a Parte II: Hibridização e Captura.
- Execute 1 μL de biblioteca em um sistema de eletroforese digital. Se necessário, diluir a amostra para evitar sobrecarregar o Chip de Alta Sensibilidade, de acordo com as recomendações do protocolo do fabricante.
- Verifique se o eletropherograma mostra uma distribuição estreita com um tamanho de pico de aproximadamente 250-400 bp (ver Resultados Representativos, Figura 3 e Figura 4).
- Se um pico de 128 bp (adaptador-dimer) é visível nos traços do Bioanalisador, e a intensidade do sinal é ≥ a intensidade do sinal de biblioteca de 250-400 bp (ver Resultados Representativos, Figura 5),e, em seguida, trazer o volume amostral (da Etapa 11,7) a 50 μL com 0,1x TE Buffer e repetir a purificação do SPRI Bead (Passo 11). Este é um ponto de parada opcional no protocolo, as bibliotecas de pré-captura podem ser armazenadas a -20 °C antes de passar para a Parte II: ImunoPrism Hibridização e Captura.
Parte II: Hibridização e Captura
13. Combine oligos de bloqueio, DNA Cot-1, DNA da Biblioteca pré-captura e seco
- Misture a biblioteca de código de barras preparada na Etapa 11 e Quantificada na Etapa 12, com DNA Cot-1 e Oligos bloqueadores em um tubo PCR sem nuclease ou microtubo de 1,5 mL, como mostrado na Tabela 10.
| Reagente | Quantidade/Volume |
| Biblioteca de código de barras a partir do Passo 10.10 | 200 ng |
| Cot-1 DNA | 2 μg |
| Bloqueando oligos | 2 μL |
Tabela 10: Preparação de hibridização e secagem. Os componentes a serem combinados para a secagem das bibliotecas na preparação da hibridização devem ser montados de acordo com as quantidades mostradas.
- Seque o conteúdo do tubo usando um concentrador de vácuo definido para 30-45 °C. Este é um ponto de parada opcional no protocolo. Após a secagem, os tubos podem ser armazenados durante a noite à temperatura ambiente (15-25 °C) ou por mais tempo a -20 °C.
14. Hibridizar sondas de captura de DNA com a Biblioteca
- Descongele 2x tampão de lavagem de feijão e tampão de hibrid, enhancer de buffer de hibridização, painel de sonda imunoprism, buffer de lavagem de 10x 1, 10x Tampão de Lavagem 2, 10x Tampão de Lavagem 3 e 10x Buffer de lavagem rigoroso à temperatura ambiente. Antes de usar, inspecione o Tampão de Hibridização para cristalização de sais. Se os cristais estiverem presentes, aqueça o tubo a 65 °C, tremendo intermitentemente, até que o tampão esteja completamente solubilizado.
- À temperatura ambiente, crie o Hybridization Master Mix em um tubo. Multiplique volumes pelo número de amostras e adicione 10% a mais, seguindo a Tabela 11.
| Mix mestre de hibridização | Volume (μL) |
| Tampão de hibridização | 8.5 |
| Enhancer de buffer de hibridização | 2.7 |
| Painel de sonda sinuosa imunoprism | 5 |
| Água Livre de Nuclease | 0.8 |
| Total Volume | 17 |
Tabela 11: Mistura Master de Hibridização. Os componentes do Hybridization Master Mix devem ser montados e misturados à temperatura ambiente de acordo com os volumes mostrados.
- Vórtice ou pipeta para cima e para baixo para misturar bem. Em seguida, adicione 17 μL do Hybridization Master Mix a cada tubo contendo DNA seco. Sele os tubos e incuba por 5 min à temperatura ambiente.
- Vortex as amostras, garantindo que elas são completamente misturadas, e gire as amostras brevemente em um microcentrífuga. Se aplicável, transfira cada amostra de um microtubo de 1,5 mL para um tubo PCR sem nuca.
- Coloque as amostras em uma cicloteira térmica e execute o Programa #9 (Tabela Suplementar 2).
- Durante a incubação, prepare os buffers de lavagem (Passo 15) e contas de streptavidin (Passo 16), permitindo tempo suficiente para pré-aquecer buffers e equilibrar as contas de streptavidin.
15. Prepare buffers de lavagem
NOTA: Os buffers de lavagem são fornecidos como 2x (Buffer de Lavagem de Contas) ou 10x (todos os outros buffers de lavagem).
- Durante a incubação da Hibridização, diluir o Buffer de Lavagem de Contas 2x e os Buffers de Lavagem de 10x para criar soluções de trabalho de 1x, multiplicando-se pelo número necessário de amostras e adicionando 10% a mais, seguindo a Tabela 12. Se 10x Wash Buffer 1 estiver nublado, aqueça a garrafa em um banho de água de 65 °C ou bloco de aquecimento para resuspender partículas. Buffers congelados de lavagem de 1x devem ser misturados após o descongelamento.
| Tampões de lavagem | Buffer Concentrado (μL) | Água livre de nuclease (μL) | Total (μL) |
| Tampão de lavagem de feijão | 150 | 150 | 300 |
| Tampão de lavagem 1 | 25 | 225 | 250 |
| Tampão de lavagem 2 | 15 | 135 | 150 |
| Tampão de lavagem 3 | 15 | 135 | 150 |
| Buffer de lavagem rigoroso | 30 | 270 | 300 |
Tabela 12: Diluição tampão de lavagem. Os buffers de lavagem de concentração devem ser diluídos com água livre de nucato sem nucação à temperatura ambiente de acordo com os volumes mostrados.
- Aliquot os Buffers de Lavagem 1x em tubos PCR sem náclocação e coloque nas temperaturas apropriadas, conforme indicado na Tabela 13. Certifique-se de incluir excesso de idade suficiente para pipetting. Para buffers aquecidos, use uma ciclovia térmica fixada a 65 °C com a tampa definida para 70 °C.
| Tampões de lavagem | Temperatura de espera | Volume/Tubo (μL) | Número de tubos/amostra |
| Tampão de lavagem de feijão | RT (15-25 °C) | 100 | 3 |
| Tampão de lavagem 1 | 65 °C | 100 | 1 |
| Tampão de lavagem 1 | RT (15-25 °C) | 150 | 1 |
| Tampão de lavagem 2 | RT (15-25 °C) | 150 | 1 |
| Tampão de lavagem 3 | RT (15-25 °C) | 150 | 1 |
| Buffer de lavagem rigoroso | 65 °C | 150 | 2 |
Tabela 13: Tampões diluídos de lavagem. Os buffers de lavagem diluídos devem ser citados em tubos separados de acordo com os volumes e número de tubos por amostra mostrado. Os buffers de lavagem devem ser mantidos na temperatura indicada antes do uso.
- Prepare o Mix de Resuspensão de Feijão à temperatura ambiente, como mostrado na Tabela 14,multiplicando-se pelo número necessário de amostras e adicionando 10% a mais.
| Mistura de resuspensão de bead | Volume (μL) |
| Tampão de hibridização | 8.5 |
| Enhancer de buffer de hibridização | 2.7 |
| Água Livre de Nuclease | 5.8 |
| Total Volume | 17 |
Tabela 14: Mistura de resuspensão de feijão. Os componentes do Mix de Resuspensão de Feijão devem ser montados e misturados à temperatura ambiente de acordo com os volumes mostrados.
16. Prepare as Contas streptavidin
- Equilibre as contas de streptavidin a temperatura ambiente por pelo menos 30 min antes do uso. Misture as contas minuciosamente, vórtices para 15 s e aliquot 50 μL de contas por captura em um tubo PCR sem nuca.
- Adicione 100 μL de 1x tampão de lavagem de bico (preparado na Etapa 15.1) a cada tubo. Gentilmente pipette para cima e para baixo 10 vezes para misturar. Coloque o tubo em um rack magnético, permitindo que as contas se separem totalmente do supernatant.
- Remova e descarte o supernatante claro. Tenha cuidado para não perturbar as contas.
- Realize a lavagem a seguir.
- Remova do rack magnético. Adicione 100 μL de 1x Tampão de Lavagem de Contas a cada tubo contendo contas e, em seguida, pipeta para cima e para baixo 10 vezes para misturar.
- Coloque o tubo no rack magnético, permitindo que as contas se separem totalmente do supernatante.
- Remova cuidadosamente e descarte o supernatante claro.
- Repita o Passo 16.4 uma vez para um total de duas lavas.
- Remova do rack magnético. Adicione 17 μL de Mistura de Resuspensão de Bead da Etapa 15.3 a cada tubo. Pipette para cima e para baixo várias vezes para misturar completamente. Certifique-se de que as contas não estão presas às laterais dos tubos. Se necessário, gire brevemente os tubos para coletar as contas na parte inferior.
17. Ligue alvo hibridizado às contas de Streptavidin
- Após a incubação hibridização de 4 horas estiver completa, remova as amostras da ciclota térmica e ajuste a ciclograma térmica para incubar a 65 °C com a tampa aquecida fixada a 70 °C.
- Usando uma pipeta multicanal, transfira 17 μL de contas totalmente homogeneizadas para as amostras. Misture completamente, encanando para cima e para baixo 10 vezes.
- Amarre o DNA às contas colocando os tubos na ciclolatérmica seguindo o Programa #10 (Tabela Suplementar 2). Durante a incubação, remova brevemente os tubos de tira a cada 10-12 min e suavemente vórtice por 3 s para garantir que as contas permaneçam em suspensão. Alternativamente, misture canalizando para cima e para baixo várias vezes. Proceda imediatamente para wash Streptavidin Beads (Passo 18).
18. Wash Streptavidin Beads para remover DNA desvinculado
- Use os Buffers de Lavagem 1x da Etapa 15.2 e armazene buffers aquecidos na motocicleta térmica durante as lavagens.
- Adicione 100 μL pré-aquecido 1x Tampão de lavagem 1 aos tubos a partir da Etapa 17.3. Misture completamente, encanando para cima e para baixo 10 vezes. Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant.
- Pipette e descartar o supernatant, que contém DNA desvinculado. Remova do rack magnético.
- Realize a seguinte lavagem de 65 °C.
- Adicione 150 μL de buffer de lavagem rigoroso pré-aquecido.
- Misture bem, canalizando para cima e para baixo pelo menos 10 vezes. Evite bolhas durante a pipetação. Certifique-se de que as contas estão completamente suspensas em todos os tubos.
- Incubar na ciclota térmica a 65 °C por 5 min.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Pipette e descartar o supernatant, que contém DNA desvinculado. Remova do rack magnético.
- Repita o Passo 18.4 para um total de duas Lava-00s Rigorosas.
- Faça a primeira lavagem de temperatura ambiente.
- Adicione 150 μL de temperatura ambiente 1x Tampão de Lavagem 1.
- Pipette para cima e para baixo 10 a 20 vezes para resuspender completamente as contas.
- Selar os tubos e incubar por 2 min, alternando entre o vórtice suavemente por 30 s e descansar por 30 segundos. Certifique-se de que as contas em todos os poços permaneçam completamente resuspensas em todos os tubos durante toda a incubação.
- Brevemente centrífuga os tubos.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Pipette e descartar o supernatante.
- Selar os tubos e brevemente centrífugas. Volte ao rack magnético e use uma pipeta de 10 μl para remover qualquer tampão de lavagem residual.
- Faça a segunda lavagem de temperatura ambiente.
- Adicione 150 μL de temperatura ambiente 1x Tampão de Lavagem 2.
- Pipette para cima e para baixo 10 a 20 vezes para resuspender completamente as contas.
- Selar os tubos e incubar por 2 min, alternando entre o vórtice suavemente por 30 s e descansar por 30 segundos. Certifique-se de que as contas em todos os poços permaneçam completamente resuspensas em todos os tubos durante toda a incubação.
- Brevemente centrífuga os tubos.
- Transfira todo o volume de contas resuspensos no Wash Buffer 2 para limpar tubos PCR sem nuca. Importante: Transferir as contas para tubos frescos é importante para evitar a contaminação fora do alvo.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Pipette e descartar o supernatante.
- Selar os tubos e brevemente centrífugas. Volte ao rack magnético e use uma pipeta de 10 μl para remover qualquer tampão de lavagem residual.
- Realize a terceira lavagem de temperatura ambiente.
- Adicione 150 μL de temperatura ambiente 1x Tampão de Lavagem 3.
- Pipette para cima e para baixo 10 a 20 vezes para resuspender completamente as contas.
- Selar os tubos e incubar por 2 min, alternando entre o vórtice suavemente por 30 s e descansar por 30 segundos. Certifique-se de que as contas em todos os poços permaneçam completamente resuspensas em todos os tubos durante toda a incubação.
- Brevemente centrífuga os tubos.
- Coloque os tubos em um rack magnético, permitindo que as contas se separem totalmente do supernatant. Pipette e descartar o supernatante.
- Selar os tubos e brevemente centrífugas. Volte ao rack magnético e use uma pipeta de 10 μL para remover qualquer tampão de lavagem residual.
- Retire do rack magnético e adicione 20 μL de água sem nuprenda às contas.
- Pipette para cima e para baixo 10 vezes para garantir que quaisquer contas presas ao lado dos tubos tenham sido resuspensas.
- Importante: não descarte as contas. Use todo o 20 μL de contas resuspensas com DNA capturado na Etapa 19.
19. Realize o enriquecimento final e pós-captura do PCR
- Prepare o PcR Master Mix pós-captura de acordo com a tabela a seguir, multiplicando-se pelo número necessário de amostras e adicionando 10% a mais, de acordo com a Tabela 15.
| Componente de mix de mestrepcr pós-captura | Volume (μL) |
| MasterMix PCR pós-captura | 25 |
| Mix de primer PCR pós-captura | 1.25 |
| Água Livre de Nuclease | 3.75 |
| Total Volume | 30 |
Tabela 15: Mistura Master PCR pós-captura. Os componentes do PcR Master Mix pós-captura devem ser montados e misturados no gelo de acordo com os volumes mostrados.
- Adicione 30 μL do PcR Master Mix pós-captura a cada amostra para um volume de reação final de 50 μL. Misture completamente, canalizando para cima e para baixo 10 vezes.
- Coloque os tubos PCR na ciclor térmica e incuba restou seguindo o Programa #11 (Tabela Suplementar 2).
20. Purify Fragmentos PCR pós-captura
- Permita que as contas SPRI aqueçam a temperatura ambiente por pelo menos 30 min antes do uso e, em seguida, o vórtice SPRI Beads por aproximadamente 30 s para resuspender.
- Adicione 75 μL de contas resuspensas a cada captura enriquecida com PCR (50 μL). Misture bem, encanando para cima e para baixo pelo menos 10 vezes. As contas streptavidin não interferirão na purificação da contas SPRI. Incubar por 5 min à temperatura ambiente.
- Gire brevemente os tubos em um microcentrífuga e coloque os tubos em um rack magnético para separar contas do supernatante. Depois que a solução estiver clara, remova cuidadosamente e descarte o supernatante. Tenha cuidado para não perturbar as contas, que contêm DNA.
- Adicione 180 μL de etanol recém-preparado 80% ao tubo enquanto estiver no rack magnético. Incubar a temperatura ambiente para 30 s, e depois remover cuidadosamente e descartar o supernatant.
- Repita o Passo 20.4 uma vez para um total de 2 etapas de lavagem.
- Remova completamente o etanol residual. Deixe o tubo no rack magnético e seque o ar 3 min com a tampa aberta, ou até ficar visivelmente seco. Não seque demais as contas. Isso pode resultar em menor recuperação do DNA.
- Remova o tubo do ímã. Elute o DNA das contas adicionando 22 μL de 0,1x TE Buffer. Misture bem, encanando para cima e para baixo várias vezes. Incubar por 2 min à temperatura ambiente. Coloque o tubo no rack magnético até que a solução esteja clara.
- Remova 20 μL do supernatant e transfira para um tubo PCR livre de nucação limpa, tomando cuidado para não perturbar as contas. Este é um ponto de parada opcional no protocolo, as bibliotecas podem ser armazenadas a -20 °C.
21. Validação e Biblioteca Quantificantes
- Meça a concentração da biblioteca capturada usando um fluorômetro e kit de ensaio de alta sensibilidade.
- Meça o comprimento médio do fragmento da biblioteca capturada usando um chip de DNA de eletroforese digital de alta sensibilidade e calcule o tamanho médio do fragmento para cada biblioteca usando o software do sistema. O tamanho médio do fragmento deve ser de aproximadamente 250-400 bp (ver Resultados Representativos, Figura 6 e Figura 7). Este é um ponto de parada opcional no protocolo, as bibliotecas concluídas podem ser armazenadas a -20 °C.
22. Sequenciamento em uma plataforma de sequenciamento
- Para sequenciamento, dilua as bibliotecas a 2 nM e siga as diretrizes do fabricante para carregar e operar o sequenciador. Bibliotecas de sequência a uma profundidade mínima de 15 milhões de leituras de extremidade única de pelo menos 50 bp de comprimento.
23. Análise de dados de sequenciamento para gerar perfis imunológicos e descobrir biomarcadores com o Portal Prisma, uma Ferramenta de Informática baseada em nuvem
- Crie uma conta prism visitando https://prism.cofactorgenomics.com/
- Uma vez conectado, clique em Enviar novo projeto na barra de ferramentas superior de qualquer página em Prism para carregar os arquivos de sequenciamento FASTQ devários ou carregar arquivos armazenados no BaseSpace com a conta Prisma.
- Complete o formulário do Novo Projeto, incluindo o nome do projeto, e amostras por grupo ou coorte. O agrupamento de amostras, e os nomes de agrupamento correspondentes, são necessários para gerar o Biomarker Discovery Report. Observe que um mínimo de 3 amostras por grupo são necessárias para gerar o Biomarker Discovery Report. Clique no botão De aplicação de lançamento para enviar o formulário; uma página de confirmação aparecerá se for bem sucedida.
- Enquanto estiver conectado, clique em Ver Resultados na barra de ferramentas superior ou em qualquer página do Prisma. O Prisma permite que o usuário veja o status dos projetos submetidos e visualize relatórios de amostra e biomarcadores por projeto. Haverá uma tabela de projetos que o usuário criou no Prisma. A tabela tem três colunas para o status, nome e a data de submissão.
NOTA: O status de cada projeto pode ser:
• "Running", onde a análise do projeto está em execução, ou,
• "Sucesso", onde a análise do projeto está completa e os relatórios estão disponíveis. - Se um projeto tiver concluído a análise (indicada por um status de "Sucesso", consulte os Relatórios de Amostra Individual e um Relatório de Descoberta biomarcador. Observe que o Biomarker Discovery Report só estará disponível se o projeto incluir o mínimo necessário de três amostras por grupo.
- Para acessar esses relatórios, retorne à tabela de projetos e clique no nome do projeto. Nesta página do projeto, haverá uma tabela com uma linha para cada amostra do projeto. Clique no link em cada linha, na coluna Relatório, para acessar o Relatório Individual de cada amostra. Imediatamente abaixo da tabela, clique no link para o Biomarker Discovery Report. Se nenhum link estiver nesta página, seu projeto não concluiu a análise.
Resultados
Há uma série de pontos de verificação em todo o protocolo que permitem ao usuário avaliar a qualidade e quantidade de materiais gerados. Após o Passo 12 descrito no protocolo, um eletropherograma é gerado como mostrado na Figura 3, representante de uma típica biblioteca de pré-captura para uma amostra de RNA intacta (RIN = 7,8).

Figura 3: Típico rastreamento bioanalisador da biblioteca de pré-captura para uma amostra de RNA intacta. Bibliotecas de pré-captura aparecem como um pico amplo em torno de 250-400 pares de base (bp) em tamanho. Clique aqui para ver uma versão maior deste valor.
Deve-se tomar cuidado para evitar a superamplificação, como indicado pelo segundo pico em torno de 1.000 bp mostrado na Figura 4, um eletropedorgrama representativo de uma biblioteca de pré-captura gerada a partir de uma amostra de RNA FFPE (DV200 = 46). Se esse pico for pequeno em relação ao pico principal (cerca de 250-400 pares de base (bp), como mostrado), ele não interferirá com etapas ou análises a jusante. Se o segundo pico for grande em relação ao pico de 250-400 bp, a biblioteca de pré-captura pode ser refeita com menos ciclos pcr, a fim de reduzir a superamplificação.
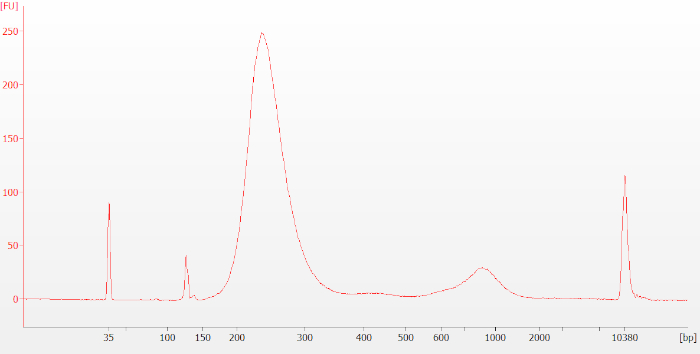
Figura 4: Típico rastreamento bioanalisador da biblioteca de pré-captura para uma amostra de RNA FFPE. O segundo pico em torno de 1.000 bp é indicativo de excesso de amplificação. Se esse pico for pequeno em relação ao pico principal em torno de 250-400 bp (como mostrado), ele não interferirá com etapas ou análises a jusante. Se o segundo pico for grande em relação ao pico de 250-400 bp, a biblioteca de pré-captura pode ser refeita com menos ciclos pcr, a fim de reduzir a amplificação excessiva. Clique aqui para ver uma versão maior deste valor.
Conforme descrito na Etapa 12.1.3, a presença de dimers adaptadores deve ser avaliada para determinar se é necessária uma limpeza adicional. Os eletropherogramas mostrados na Figura 5 são representativos de níveis inaceitáveis (Figura 5A,DV200 = 33) e aceitáveis (Figura 5B,DV200 = 46) de dimer adaptador, aparecendo como o pico acentuado em torno de 128 bp.

Figura 5: Traços bioanalisadores da biblioteca de pré-captura. O dimer adaptador aparece como um pico acentuado em torno de 128 bp.(A) Os dimers adaptadores excessivos estão presentes neste eletropherograma. (B)Níveis aceitáveis de dimer adaptador são retratados neste traço. Ambos os traços mostram evidências de leve superamplificação, mas isso não deve interferir com o Ensaio ImunoPrism. Clique aqui para ver uma versão maior deste valor.
Na conclusão do protocolo, antes do sequenciamento, as bibliotecas finais são novamente avaliadas por meio de eletroforese digital. Bibliotecas feitas de RNA FFPE tendem a ter uma distribuição de tamanho médio menor do que bibliotecas feitas de RNA intacta. Para amostras intactas de RNA, o traço resultante deve ser semelhante à Figura 6 (RIN = 9,5). Para RNA degradado ou FFPE, o traço resultante deve ser semelhante ao Figura 7 (DV200 = 36).

Figura 6: Típico rastreamento bioanalisador da Biblioteca Final para uma amostra de RNA intacta. Bibliotecas finais aparecem como um pico amplo em torno de 250-400 pares de base (bp) em tamanho. Clique aqui para ver uma versão maior deste valor.

Figura 7: Típico rastreamento bioanalisador da Biblioteca Final para uma amostra de RNA FFPE. Bibliotecas feitas de RNA FFPE tendem a ter uma distribuição de tamanho médio menor do que bibliotecas feitas de RNA intacta. Clique aqui para ver uma versão maior deste valor.
Como descrito, os resultados gerados com este protocolo podem ser aplicados de duas formas-chave, como mostra a Figura 8.
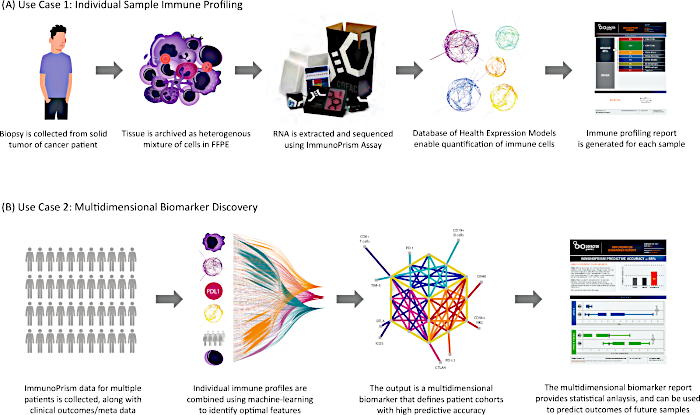
Figura 8: Dois casos de uso do protocolo. Os resultados gerados por este ensaio de perfil imunológico são aplicados em duas aplicações translacionais importantes. (A) O primeiro caso de uso começa a partir de tecido tumoral sólido humano (incluindo arquivos FFPE) e gera um perfil imunológico individual para a amostra. (B) Uma vez gerados para uma coorte de amostras humanas, os dados são combinados usando o Portal Prisma para gerar um Biomarcador multidimensional e um Relatório Biomarcador correspondente. Clique aqui para ver uma versão maior deste valor.
Para demonstrar cada um desses casos de uso, os dados representativos de um pequeno estudo translacional estão incluídos21. As amostras utilizadas neste estudo são um conjunto de espécimes de 7 pacientes diagnosticados e tratados para câncer de pulmão de células não pequenas (NSCLC). As amostras são tecido tumorais sólidos compatível com pacientes de biópsias pré e pós-tratamento. Primeiro, amostras individuais foram analisadas para gerar um perfil imunológico, como o relatório de exemplo mostrado na Figura 9.

Figura 9: Exemplo relatório imunológico individual para uma amostra NSCLC. O oleoduto Do Portal Prisma gera um relatório gráfico para cada amostra processada, com um relatório representativo gerado para uma amostra de tumor sólido NSCLC mostrada aqui. (A) A parte frontal do relatório retrata graficamente a quebra das células imunes presentes na amostra de RNA extraída do tecido FFPE. (B) O lado inverso do relatório inclui uma tabela de células imunes (em percentuais absolutos) e a expressão genética de fuga (em transcrições por milhão, ou TPM), bem como uma declaração de desempenho para o ensaio. Clique aqui para ver uma versão maior deste valor.
Os perfis imunológicos pré e pós-tratamento podem ser usados para entender como uma terapia (quimioterapia ou radiação, neste estudo) modificou o microambiente tumoral. Um exemplo é mostrado na Figura 10,onde as mudanças na porcentagem para cada célula imune e conteúdo imunológico total são mostradas pré e pós-quimioterapia, para um único paciente.
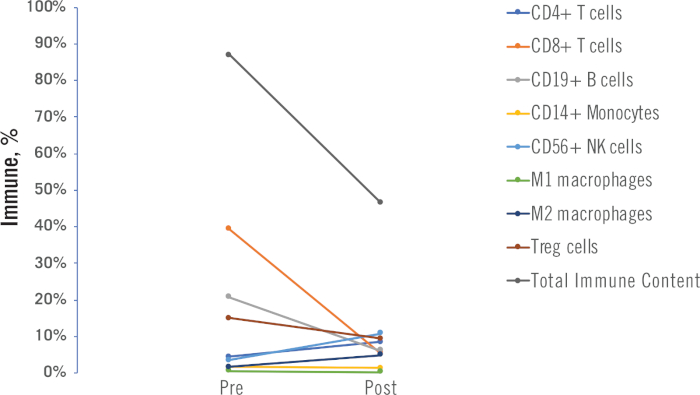
Figura 10: Exemplo resultados pré e pós-tratamento. São mostrados dados individuais de células imunes e conteúdo imunológico total gerados a partir de amostras pré e pós-tratamento de um único paciente nsclc. Neste exemplo, o paciente recebeu um regime de quimioterapia como tratamento. Clique aqui para ver uma versão maior deste valor.
Os pacientes podem ser agrupados por critérios como desfechos clínicos ou fenótipos para comparação. Por exemplo, na Figura 11,as amostras do estudo do NSCLC foram comparadas de acordo com o tempo à progressão da doença após o tratamento. Um subconjunto dos pacientes apresentou recidiva da doença em >18 meses, e outro subconjunto progrediu mais rápido, em ≤18 meses. O valor delta mediano (diferença entre valores pré e pós-tratamento) é comparado para cada amostra para identificar biomarcadores putativos da progressão da doença.
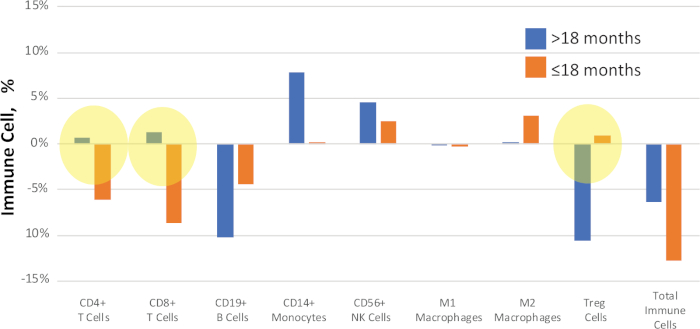
Figura 11: Exemplo comparação de desfechoclínico. Foram calculadas alterações quantitativas entre os percentuais das células imunes em amostras de NSCLC pré e pós-tratamento combinadas e relatadas como o valor "delta". Os destacados em amarelo mostram claras mudanças de sinal entre o status de sobrevivência. As barras azuis representam valores delta medianos por >18 meses até a progressão da doença, as barras laranjas representam valores delta medianos por ≤18 meses até a progressão da doença. Clique aqui para ver uma versão maior deste valor.
Finalmente, agrupamentos de amostras semelhantes podem ser usados para olhar especificamente para amostras de pré-tratamento para identificar biomarcadores preditivos usando o Portal Prisma para gerar um Relatório Biomarcador. Mostrado na Figura 12, o mesmo fenótipo clínico (progressão da doença) descrito acima define os agrupamentos amostrais. Neste exemplo, dois genes de fuga imunológica foram identificados como diferenciais estatisticamente significativos dos agrupamentos amostrais (CD47 e OX40, mostrados no painel inferior da Figura 12A). Neste exemplo, como os biomarcadores genéticos individuais são robustos com significância estatística clara, o biomarcador multidimensional não agrega valor preditivo significativo (ImmunoPrism, como rotulado no gráfico de barras superior direito da Figura 12B). A tabela completa de dados, incluindo resultados para todos os 18 analytes para o ensaio, é resumida no lado inverso do relatório, incluindo análise estatística e um breve resumo de métodos.

Figura 12: Relatório biomarcador de exemplo para amostras nsclc. O gasoduto Biomarker Discovery fornece um relatório visual de biomarcadores individuais e um biomarcador multidimensional de aprendizagem de máquina, com estatísticas detalhadas. (A) Para este estudo, o gasoduto identificou dois biomarcadores individuais (CD47 e OX40) como estatisticamente significativos para a definição da progressão da doença com um limite de 18 meses. (B)Detalhes sobre o método e resultados completos estão incluídos no lado inverso do relatório. Clique aqui para ver uma versão maior deste valor.
Mesa Suplementar 1: Materiais de Kit de Reagente. Uma lista de materiais fornecidos no Kit ImunoPrism está listada, juntamente com os números de peça que se referiram no protocolo do fabricante. Todos os outros equipamentos e materiais necessários estão listados na Tabela de Materiais. Visite https://cofactorgenomics.com/product/immunoprism-kit/ para folhas de dados de segurança (SDS). Clique aqui para ver este arquivo (Clique certo para baixar).
Mesa Suplementar 2: Programas de Ciclor Térmico. Os programas de ciclovia recomendados referenciados ao longo do protocolo são resumidos para facilitar a programação. Clique aqui para ver este arquivo (Clique certo para baixar).
Tabela Suplementar 3: Guia do Índice de Sequenciamento. Os primers de índice fornecidos no kit de reagente estão listados; uma cartilha única é adicionada a cada reação para desmultipleagem pós-seqüencial. Combinações recomendadas de multipleexamento de baixo nível também são fornecidas. Clique aqui para ver este arquivo (Clique certo para baixar).
Discussão
O protocolo requer RNA intacto ou 40 ng altamente degradado (FFPE). A amostra de RNA deve ser livre de DNA, sais (por exemplo, Mg2+, ou sais de guanidinium), agentes de cisão divalente (por exemplo, EDTA, EGTA, citrato) ou orgânicos (por exemplo, fenol e etanol). Não é recomendável prosseguir com amostras de RNA que tenham um DV200 <20%. O uso do RNA de controle em kit é fortemente recomendado, pois esses controles fornecem um meio de avaliar o desempenho em todo o protocolo, desde a preparação da biblioteca até a análise.
O protocolo foi projetado para ser executado usando tubos de tira PCR de 0,2 mL. Se preferir, o protocolo também pode ser realizado usando os poços em uma placa PCR de 96 poços. Basta usar os poços de uma placa PCR de 96 poços no lugar de todas as referências a tubos PCR ou tubos de tira. Use placas PCR apenas com poços claros, pois é fundamental confirmar visualmente a resuspensão completa das contas durante purificações de contas e etapas de lavagem.
Ao longo do protocolo, mantenha os reagentes congelados ou no gelo, a menos que seja especificado de outra forma. Não use reagentes até que fiquem completamente descongelados. Certifique-se de misturar completamente todos os reagentes antes do uso.
Mantenha enzimas em -20 °C até que estejam prontas para uso e retornem a -20 °C prontamente após o uso. Use apenas água livre de nuclease de grau molecular; não é recomendável usar água tratada com DEPC. Ao se misturar, gentilmente aspira e dispense pelo menos 50% do volume total até que as soluções sejam bem misturadas. Pipette mistura todas as misturas mestres contendo enzimas. Usar vórtice para misturar as enzimas pode levar à desnaturação e comprometer seu desempenho. Durante a purificação de bico, o uso fez soluções de etanol de 80% de etanol de grau molecular. O uso de soluções de etanol que não são frescas pode resultar em rendimentos mais baixos. Evite secar as contas, pois isso pode reduzir a eficiência de elusão (as contas parecem rachadas se mais secas).
Como descrito na Etapa 10, primers de índice exclusivos são adicionados a cada reação. Com base nas sequências desses índices, para multiplexação de baixo nível, certas combinações de índice são ótimas. As sequências desses índices são necessárias para desmultiplear os dados após o sequenciamento. As sequências e combinações multiplexantes recomendadas são fornecidas na Tabela Suplementar 3. Nesta mesma etapa, é importante notar que o número de ciclos PCR recomendados varia dependendo da qualidade do RNA utilizado e, alguma otimização pode ser necessária para evitar a superamplificação do PCR. Para o RNA do Controle Intacto imunoprism e outros RNA de alta qualidade, inicie a otimização com 10 ciclos pcr. Para o RNA de Controle ImmunoPrism FFPE e outros RNA altamente degradados/FFPE, inicie a otimização com 15 ciclos pcr. Recomenda-se produzir uma biblioteca de testes utilizando rna representante do material a ser analisado, a fim de otimizar os ciclos de PCR. O número mínimo de ciclos PCR que consistentemente produzem rendimentos suficientes da biblioteca pré-captura (>200 ng) deve ser usado. Um pico secundário em torno de 1000 bp no traço bioanalisador é indicativo de superamplificação(Figura 4). A superamplificação deve ser minimizada, mas a presença de um pequeno pico secundário não interferirá nos resultados do ensaio.
Para minimizar a perda de amostras e evitar a troca de tubos, o Passo 13 pode ser realizado em tubos PCR, tubos de tira ou uma placa PCR de 96 poços em vez de microtubos de 1,5 mL, se o seu concentrador de vácuo permitir. O rotor pode ser removido em muitos concentradores. Isso permite que os tubos de tira ou placas se encaixem no vácuo. A concentração de vácuo pode então ser executada usando o ajuste de dessecação aquoso sem centrífuga. Consulte o manual para obter instruções sobre o seu concentrador de vácuo. Se as amostras forem secas em tubos de tira ou uma placa de 96 poços, a etapa de hibridização pode ser realizada no mesmo vaso.
Durante a Etapa 17, certifique-se de vórtice a cada 10-12 min para aumentar a eficiência de captura de esferas. Segure cuidadosamente as tampas dos tubos de tira quente ao misturar para evitar que os tubos abram.
As lavadeiras descritas na Etapa 18 são fundamentais para evitar alta contaminação não específica e devem ser seguidas de perto. Certifique-se de suspender completamente as contas a cada lavagem, remover completamente os buffers de lavagem e durante a lavagem do Tampão de Lavagem 2, transfira as amostras para um tubo de tira fresco (Passo 18.6.5). Certifique-se de que as contas de streptavidin estão completamente suspensas e permaneçam suspensas durante toda a incubação. Espirrar nas tampas do tubo não afetará negativamente a captura. Durante as lavas de temperatura ambiente, uma misturador de vórtice microplacapode ser usada para vórtice simindo as amostras durante todo o período de incubação de dois minutos para uma resuspensão mais fácil. Não deixe as contas streptavidin secarem. Se necessário, estender incubações nos buffers para evitar a secagem das contas. Se usar mais de um tubo de tira, trabalhe com um tubo de tira de cada vez para cada lavagem enquanto os outros tubos de tira se sentam no termociclo. Isso pode ajudar a evitar a secagem das contas ou a pressa, resultando em má resuspensão ou outras técnicas sub-ideais. Pela primeira vez, os usuários não são recomendados processar mais de 8 reações da biblioteca por vez.
As técnicas atuais de perfil imunológico fornecem um contínuo de informações - de milhares de pontos de dados que requerem interpretação significativa (sequenciamento de RNA) a um ponto de dados individual e discreto (IHC monoplex). O protocolo descrito aqui representa uma abordagem que está em algum lugar no meio, com um escopo focado permitindo alta sensibilidade, mas capturando apenas um subconjunto de dados transcritômicos clinicamente relevantes. Devido à natureza da extração de RNA a granel, este protocolo não fornece informações sobre as relações espaciais entre células imunes e o microambiente tumoral, no entanto, os resultados podem ser complementados com tecnologias de imagem para adicionar essas informações. Há uma miríade de aplicações para os dados gerados por este protocolo, pois há muito a ser aprendido sobre a biologia do câncer como uma doença, e as terapias que estão sendo desenvolvidas para tratá-lo. Como mostrado nos resultados representativos, o relatório imunológico individual é útil para entender como o perfil imunológico do paciente pode mudar em resposta a eventos como progressão da doença ou tratamento. Embora os resultados aqui apresentados forneçam alguns casos de uso de exemplo, outras aplicações, incluindo a investigação do mecanismo de ação de uma terapia e a identificação de biomarcadores putativos de desfechos clínicos, como a progressão livre e a sobrevivência geral também são Prático. Ao utilizar este protocolo para aplicações de descoberta de biomarcadores, é importante praticar um bom projeto de estudo para garantir que as populações homogêneas sejam analisadas, amostras suficientes sejam incluídas para poder estatístico e fontes de viés sejam consideradas. Devido à natureza focada e simplificada do ensaio, é viável imaginar um caminho para a validação clínica e a aplicação a jusante desses biomarcadores uma vez descobertos.
Divulgações
Todos os autores são empregados pela Cofactor Genomics, Inc., empresa que desenvolveu e produz o kit de reagente ImunoPrism e ferramentas de informática utilizadas neste artigo. O Ensaio ImunoPrism é apenas para uso de pesquisa, e não é para uso em procedimentos diagnósticos.
Agradecimentos
Os autores desejam reconhecer o TriStar Technology Group por fornecer os espécimes biológicos para os resultados representativos, bem como toda a equipe molecular, análise, produto e comercial da Cofactor Genomics para sua experiência técnica e Apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR 8 tube strip | USA Scientific | 1402-2700 | USA Scientific 0.2 mL PCR 8-tube strip |
| 200 Proof Ethanol | MilliporeSigma | EX0276-1 | Prepare 80% by mixing with nuclease-free water on the day of the experiment |
| 96-well thermal cyclers | BioRad | 1861096 | |
| Solid-phase Reversible Immobilization (SPRI) Beads | Beckman-Coulter | A63882 | Agencourt AMPure XP – PCR Purification beads |
| Digital electrophoresis chips and kit | Agilent Technologies | 5067-4626 | Agilent High Sensitivity DNA chips and kit |
| Digital electrophoresis system | Agilent Technologies | G2939AA | Agilent 2100 Electrophoresis Bioanalyzer |
| Streptavidin Beads | ThermoFisher Scientific | 65306 | Dynabeads M-270 Streptavidin |
| ImmunoPrism Kit – 24 reaction | Cofactor Genomics | CFGK-302 | Cofactor ImmunoPrism Immune Profiling Kit – 24 reactions |
| Human Cot-1 DNA | ThermoFisher Scientific | 15279011 | Invitrogen brand |
| Magnetic separation rack | Alpaqua/Invitrogen | A001322/12331D | 96-well Magnetic Ring Stand |
| Microcentrifuge | Eppendorf | 22620701 | |
| Microcentrifuge tubes | USA Scientific | 1415-2600 | USA Scientific 1.5 mL low-adhesion microcentrifuge tube |
| NextSeq550 | Illumina | SY-415-1002 | Any Illumina sequencer may be used for this protocol |
| Nuclease-free water | ThermoFisher Scientific | AM9937 | |
| Prism Extraction Kit | Cofactor Genomics | CFGK-401 | Cofactor Prism FFPE Extraction Kit – 24 samples |
| Purified RNA | - | - | Purified from human tissue samples |
| Fluorometer | ThermoFisher Scientific | Q33226 | Qubit 4 System |
| Fluorometric Assay Tubes | Axygen | PCR-05-C | 0.5mL Thin Wall PCR Tubes with Flat Caps |
| High Sensitivity Fluorometric Reagent Kit | Life Technologies | Q32854 | Qubit dsDNA HS Assay Kit |
| Vacuum concentrator | Eppendorf | 22820001 | VacufugePlus |
| Vortex mixer | VWR | 10153-838 | |
| Water bath or heating block | VWR/USA Scientific | NA/2510-1102 | VWR water bath/USA Scientific heating block |
Referências
- Brambilla, E., et al. Prognostic Effect of Tumor Lymphocytic Infiltration in Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 34 (11), 1223-1230 (2016).
- Iacono, D., et al. Tumour-infiltrating lymphocytes, programmed death ligand 1 and cyclooxygenase-2 expression in skin melanoma of elderly patients: clinicopathological correlations. Melanoma Research. 28 (6), 547-554 (2018).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nature Reviews Clinical Oncology. 14 (12), 717-734 (2017).
- Sierant, M. C., Choi, J. Single-Cell Sequencing in Cancer: Recent Applications to Immunogenomics and Multi-omics Tools. Genomics Inform. 16, (2018).
- Klauschen, F., et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Seminars in Cancer Biology. 52 (Pt 2), 151-157 (2018).
- Danaher, P., et al. Gene expression markers of Tumor Infiltrating Leukocytes. Journal for ImmunoTherapy of Cancer. 5, 18 (2017).
- Aran, D., Hu, Z., Butte, A. J. xCell: digitally portraying the tissue cellular heterogeneity landscape. Genome Biology. 18 (1), 220 (2017).
- Newman, A. M., et al. Robust enumeration of cell subsets from tissue expression profiles. Nature Methods. 12 (5), 453-457 (2015).
- Becht, E., et al. Estimating the population abundance of tissue-infiltrating immune and stromal cell populations using gene expression. Genome Biology. 17 (1), 218 (2016).
- Newman, A. M., Gentles, A. J., Liu, C. L., Diehn, M., Alizadeh, A. A. Data normalization considerations for digital tumor dissection. Genome Biology. 18 (1), 128 (2017).
- Chen, S. H., et al. A gene profiling deconvolution approach to estimating immune cell composition from complex tissues. BMC Bioinformatics. 19 (Suppl 4), 154 (2018).
- Yoshihara, K., et al. Inferring tumour purity and stromal and immune cell admixture from expression data. Nature Communications. 4, 2612 (2013).
- Foley, J. W., et al. Gene-expression profiling of single cells from archival tissue with laser-capture microdissection and Smart-3SEQ. Genome Research. , (2019).
- Civita, P., et al. Laser Capture Microdissection and RNA-Seq Analysis: High Sensitivity Approaches to Explain Histopathological Heterogeneity in Human Glioblastoma FFPE Archived Tissues. Front Oncol. 9, 482 (2019).
- . PD-L1 in cancer: ESMO Biomarker Factsheet | OncologyPRO Available from: https://oncologypro.esmo.org/Education-Library/Factsheets-on-Biomarkers/PD-L1-in-Cancer (2019)
- Haslam, A., Prasad, V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Network Open. 2 (5), e192535 (2019).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews Immunology. 12 (3), 191-200 (2012).
- Schillebeeckx, I., et al. Analytical Performance of an Immunoprofiling Assay Based on RNA Models. Association for Molecular Pathology 2019 Annual Meeting. Journal of Molecular Diagnostics. 21, (2019).
- Uryvaev, A., Passhak, M., Hershkovits, D., Sabo, E., Bar-Sela, G. The role of tumor-infiltrating lymphocytes (TILs) as a predictive biomarker of response to anti-PD1 therapy in patients with metastatic non-small cell lung cancer or metastatic melanoma. Medical Oncology. 35 (3), 25 (2018).
- Wang, K., Shen, T., Siegal, G. P., Wei, S. The CD4/CD8 ratio of tumor-infiltrating lymphocytes at the tumor-host interface has prognostic value in triple-negative breast cancer. Human Pathology. 69, 110-117 (2017).
- Carney, W. P., Bhagat, M., LaFranzo, N. Multidimensional gene expression models for characterizing response and metastasis in solid tumor samples [abstract]. American Association for Cancer Research Annual Meeting. Cancer Research. 79 (13 Suppl), (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados