Method Article
ヒトCD59/インターメディリシン細胞アブレーションツールを用いた腎マクロファージの急速な枯渇
要約
プロトコルは、ヒトCD59 /インターメディリシン細胞アブレーションツールを使用して、腎臓マクロファージの再生を研究するための選択的アブレーションのためのここで報告されています。この方法は、腎臓、肝臓、および脂肪組織における他の細胞集団の機能と再生の研究にも適用できます。
要約
腎マクロファージ(RM)は、腎臓の健康、免疫監視、組織の恒常性、および損傷への反応のオーケストレーションに不可欠です。以前に、骨髄または胚起源のRMの明確な運命、ダイナミクス、およびニッチを研究するために、ヒトCD59(hCD59)/インターメディライシン(ILY)細胞アブレーションツールの使用を報告しました。RMは、卵黄嚢由来マクロファージ、胎児肝臓単球、および骨髄由来単球に由来し、循環単球の局所増殖と動員を通じて成人期に維持されます。ここでは、1)マウスRMにおけるhCD59のCre誘導性発現の生成と特性評価、2)ILYの精製とILY活性の特性評価、3)化合物マウスにおけるRMに対するhCD59発現の誘導、4)ILYを介したRMアブレーション後の再生の特性評価など、RMの再生を研究するための選択的アブレーションの詳細なプロトコルを報告します。ILYは、ILY投与から1日以内に効率的なマクロファージアブレーションにより、化合物マウスのRMを特異的かつ急速に枯渇させます。.腎マクロファージの再生はアブレーション後3日目までに始まり、7日目までに~88%回復しました。このモデルは、マクロファージの生物学を研究するための強力なツールを提供し、腎臓、肝臓、および脂肪組織の他の細胞集団を選択的に切除して、それらの機能と再生を調査するために使用できます。
概要
腎マクロファージ(RM)は、腎臓の恒常性を維持し、免疫応答を調節し、損傷後の組織修復を促進する必須免疫細胞です。それらは、食作用、抗原提示、および炎症反応と抗炎症反応の両方のオーケストレーションを含むさまざまな機能を実行します1,2,3。局所環境に応じて、RMは炎症誘発性(M1)または抗炎症性(M2)の表現型のいずれかに分極し、損傷を悪化させるか治癒を促進する可能性があります4,5,6。RMの調節不全は、急性腎障害(AKI)および慢性腎臓病(CKD)の発症と進行に関与しており、腎臓の健康と病理において重要な役割を果たしています7,8。RMは、胚形成期の卵黄嚢由来マクロファージ、胎児の肝臓単球、成人期の骨髄由来単球など、さまざまな発生源から発生します。RMは、出生後の腎成長と並行して拡大および成熟し、主に出生前の胎児の肝臓単球に由来し、成人期までの自己維持は末梢単球によって補完されます9。成人では、循環する単球は恒常性シグナルまたは損傷シグナルによって腎臓に動員され、局所的な微小環境の影響下でマクロファージに分化します。RMの維持は、局所増殖および循環単球からの定期的な補充によって維持される9,10,11,12。
我々は以前に、骨髄または胚起源に由来するRMの明確な運命、ダイナミクス、および微小環境ニッチを調査するためのツール13,14として、ヒトCD59(hCD59)/インターメディライシン(ILY)細胞アブレーションシステムの使用を実証した9。ILYは、標的細胞膜に細孔を形成することにより、数秒以内にヒト細胞を選択的に溶解する15。この特異性は、ILYのヒトCD59(hCD59)に対する排他的な結合親和性から生じ、この受容体を欠く他の種由来の細胞に対する相互作用または溶解効果はない15。この概念に基づいて、トランスジェニックマウスモデルにおけるヒトCD59発現細胞の迅速、条件付き、および標的アブレーションを可能にするツールを設計しました インターメディライシン(ILY)14。このツールの使用を容易にするために、ヒトCD59の発現がCre媒介組換え13の後にのみ起こるフロックスSTOP-CD59ノックインマウス(ihCD59)を生成することにより、条件付きおよび標的細胞アブレーションのモデルを開発しました。以前には、CX3CR1cre-EFP遺伝子がCD11bintF480hi(腎マクロファージ9と定義)上に排他的に発現していることがわかりました。そこで、CX3CR1CreER2+/+ 系統を用いてihCD59マウスと交配し、腎マクロファージ上にhCD59を発現させた。遺伝子型がihCD59+/-/CX3CR1CreER+/-9(+/-、+/+、-/-はホモ接合体、ヘミジゾット、ノンキャリアトランスジェニックマウス)の化合物マウスの作製に成功しました。hCD59 +/-/CX3CR1CreER+/- 複合マウスにおけるタモキシフェンの投与 hCD59 発現により RM を条件付きで標識および標識9.ILY治療によるRMニッチの枯渇に続いて、末梢単球は速やかに骨髄由来のRMに分化し、前述した9で述べたようにニッチを効果的に再増殖させた。この再生は、CX3CR1/CX3CL1のシグナル伝達軸に大きく依存しており、RM集団の維持と回復の両方において重要な役割を果たしていることを強調しています9。また、その明確な解糖能力により、胚起源のRMは骨髄由来のRMよりも免疫複合体を捕捉する能力が高く、免疫課題に対してより敏感であることも示しています9。
CR誘導性hCD59(ihCD59)を介したILY投与後の迅速な細胞アブレーションを使用したRMの再生を調査するためのRMの選択的アブレーションの詳細なプロトコルを提示します。ILYの注射は、 CX3CR1CreER+/-/ihCD59+/- 化合物マウスでhCD59を条件付きかつ特異的に発現するRMの標的アブレーションを引き起こしました。アブレーション後、フローサイトメトリーを用いてマクロファージの動態変化をモニターし、マクロファージの急速な枯渇とそれに続くRMの再生を発見しました。組換えILYは 大腸菌 BL21(DE3)細胞で発現し、ニッケル-NTAアフィニティークロマトグラフィーを用いて精製しました。リコンビナントILYの純度と機能性は、SDS-PAGE、分光光度法、および溶血アッセイによって確認され、その特徴的なコレステロール依存性細胞溶解活性が実証されました。ILYを使用してマウスのRMを枯渇させ、ILY投与後1日以内に効率的なマクロファージアブレーションを達成しました。腎マクロファージの再生はアブレーション後3日目に始まり、7日目までに~85%回復しました。このデータは、再生が主に単球の動員によって駆動されることを示唆しています。このモデルは、マクロファージの生物学を研究するための強力なツールを提供し、腎臓病におけるマクロファージ集団の標的操作に対する治療の可能性を秘めています。 ihCD59/ILY細胞アブレーションツールは、腎臓、肝臓、脂肪組織、その他の臓器の細胞機能と再生を研究するために使用できます。
プロトコル
動物実験のプロトコルは、テュレーン大学医学部の動物管理および使用委員会(IACUC)によって承認されました(プロトコル番号1482)。実験マウス Cx3cr1CreER+/+ および ihCD59+/+は、10〜12週齢、体重25〜30gで、大学の動物施設で特定の病原体フリー(SPF)条件下で飼育されました。腎臓の分離を含むすべての手順は、研究者が汚染を防ぐために手袋とフェイスマスクを着用して、無菌環境で行われました。本試験で使用した試薬および機器の詳細については、 資料表をご覧ください。
1.動物の調理
- ジャクソン研究所から CX3CR1CreER+/+マウスを入手してください。テュレーン大学医学部(SOM)の特定の病原体フリー(SPF)施設にマウスを収容します。制御された環境条件で、動物を12時間の明暗サイクルの下に維持します。
- 以前に生成したihCD59+/+マウスをC57BL/6遺伝的背景で繁殖させます。ホモ接合体CX3CR1CreER+/+マウス(CX3CR1発現欠損)とihCD59+/-マウスを交配して、次の子孫遺伝子型を産生します:CX3CR1CreER+/-/ihCD59-/-およびCX3CR1CreER+/-/ihCD59+/-。
- ヘテロ接合型 CX3CR1CreER+/- マウスは機能的なCX3CR1発現を保持し、ホモ接合型 CX3CR1CreER+/+ マウスはCX3CR1欠損であることを、抗CX3CR1抗体9を用いたフローサイトメトリー解析により確認します。
2. ILY生産(14,15から派生)
- 0日目
- -80°Cで保存したpTrcHis-Aプラスミド (補足図1 )にHisタグ付きILY配列を持つILY細菌株BL21-DE3-RIPLの凍結ストックを回収します。 10 μLの細菌ストックを、アンピシリンを含む40 μLのLuria broth(LB)培地に1 μg/mLの濃度で接種します。
- 接種した混合物を、アンピシリン(1μg/mL)を添加したLB寒天プレートに広げます。プレートを細菌インキュベーターで37°Cで一晩インキュベートします。
- 1日目
- LB寒天プレートから6つのコロニーを選択します。各コロニーをアンピシリンを含む3.5mLのLB培地に接種します。培養物を37°Cで一晩インキュベートします。
- 2日目
- 各3.5 mLスターター培養物を、アンピシリンを添加した250 mLのLB培地に移します。培養物を37°Cで3時間インキュベートし、230 x g で振とうして細菌の増殖を可能にします。
- 3時間後、1 Mストック溶液(-20°Cで保存)からイソプロピルβ-D-1-チオガラクトピラノシド(IPTG)を1:1000希釈で加え、最終濃度1 mMにします。さらに4時間インキュベートを続けて、タンパク質発現を誘導します。
- 空の遠心分離機のボトルの重量を量り、重量を記録します。誘導した培養物を約250mLを遠心分離ボトルに移します。
- 細胞を10,000 x g で4°Cで15分間遠心分離してペレット化します。 上清を捨ててから、ペレットの入ったボトルの重さを量ります。遠心分離後の総重量から空のボトル重量を差し引いて、ペレットの重量を計算します。
- バクテリアペレットを-20°Cで保存し、その後のILYの抽出と精製に使用します。
- 3日目:ILYの抽出と精製
- 50 mLの遠心チューブに、30 mLのBug Buster Protein Extraction Reagentと30 μLのベンゾナーゼヌクレアーゼ(1200 Kunitz単位)および0.9 μLのリゾチーム(10,000 Unitの酵素活性)を組み合わせて、溶解バッファーを調製します。
- 溶液を穏やかに混合して、溶解バッファーが均一であることを確認します。調製した溶解緩衝液を細菌ペレット(2〜5g)に加えます。混合物を30〜60秒間完全にボルテックスして、細菌細胞を完全に再懸濁します。
- 再懸濁した溶液を2本の50 mL遠心分離チューブに均等に分けます。チューブを氷の上に置き、30〜90分間インキュベートします。インキュベーション中は、オービタルシェーカーを使用してチューブを穏やかに振とうし、5〜10分ごとに10〜15秒間短時間ボルテックスして細胞溶解を促進します。
- インキュベーション後、ライセートを4,900 x g で4°Cで30分間遠心分離します。
- 1 mLのピペットチップを使用して水道水でカラムを十分に洗浄し、以前に使用したレジンをすべて取り除きます。
- カラムを70%エタノールですすいで消毒します。カラムを冷たいddH2Oで2x-3x洗浄し、残留エタノールを除去します。カラムをホルダーに置きます。
- 6〜10 mLの冷たいddH2Oを加えて、カラムをさらに洗浄し、精製のために平衡化します。約3 mLのレジンビーズをカラムに加えます。カラムを速度30に設定された蠕動ポンプに接続します。
- 10 mLの冷たくしたddH2Oを加えて樹脂を完全に懸濁し、タンパク質結合の準備をします。レジンビーズを15 mLの1x Charging Bufferで洗浄し、レジンがタンパク質結合する準備をします。
- 遠心分離後、細菌溶解物の上清を新しいチューブに集め、ペレットが廃棄されるようにします。シリンジ付きの0.45μmフィルターを使用して上清をろ過し、残っている細胞の破片を取り除きます。
- ろ過した細菌溶解物20〜25 mLをカラムに3回に分けて通過させます。各パスの後、フロースルーを20μL収集し、後で光学密度(OD)測定のためにP.E.とラベル付けします。
- カラムを20〜30 mLのBinding Bufferで洗浄し、未結合のタンパク質を除去します。カラムを20〜30 mLのWash Bufferで洗浄します。OD測定のために20μLの洗浄画分を回収します。
- 10-20 mLのElution Bufferを添加して、結合したタンパク質を溶出します。3〜4分後に微量遠心チューブを使用して溶出物の収集を開始します。チューブあたり約1mLを収集し、15〜17本のチューブを満たします。
- A280 における各溶出画分の吸光度を分光光度計で測定します。A280読み取り時のブランクとしてElution Bufferを使用します。A280で吸光度が劇的に増加したチューブは、チューブ13の周りの画分に通常見られるHisタグ付きILYタンパク質を含んでいるため、回収してください。
- ILYタンパク質を含む溶出画分(またはチューブ)を4°Cで保存します。 最適なタンパク質安定性を確保するために、翌日中にさらなる手順に進みます。
注:タンパク質の完全性を維持するために、氷上または可能な場合は4°Cですべての手順を実行します。
- 4日目:溶出からのエンドトキシンの除去
- エンドトキシン除去樹脂カラムを6〜10 mLの超純水ですすいでください。カラムをそっと押して、流れを調整します。
- 10 mLの1%デオキシコール酸ナトリウム溶液(作りたてまたは1か月以内)でカラムをすすぎ、結合したエンドトキシンを除去します。カラムを6〜10 mLの超純水で再度すすぎ、残留界面活性剤を取り除きます。
- 調製したタンパク質サンプルをレジンカラムに塗布します。カラム内でサンプルを室温(RT)で1時間インキュベートし、エンドトキシンが最適に結合できるようにします。
- 初期フロースルーフラクションを収集します。ddH2Oをカラムに添加してさらに溶出させ、溶出した画分を約10本のチューブ(チューブあたり1 mL)に回収します。
- レジンカラムは、将来の使用のために25%エタノールで4°Cで保存します。溶出したタンパク質サンプルの光学密度(O.D.)を測定して、収量を定量化します。最初の溶出バッチから全タンパク質の約50%〜70%を回収することを期待してください。
- 5-6日目:透析
- 1600 mLの蒸留脱イオン水(ddH2O)をオートクレーブして、2 Lの透析緩衝液を調製します。オートクレーブ水に、10x PBS200 mL、グリセロール200 mL、MES(2-(N-モルホリノ)エタンスルホン酸)3.5115 gを加えます。
- すべての試薬が完全に溶解するまで、マグネチックスターバーで混合物を攪拌します。得られたバッファーを4°Cで保存します。
- 保存した溶出画分を透析キットに加え、針で透析キットから空気を抜いてください。透析キットを使用して、攪拌速度を約2に設定した状態で、4°Cで24時間タンパク質溶液を透析します。
- 透析キットがバッファーに完全に浸かるように構成します。翌日、透析キットの透析バッファーを2L容器に入った新しい透析バッファーと交換してください。透析をさらに24時間続けます。
- 白色の沈殿物を含む溶液全体を滅菌チューブに慎重に移し、凝集する可能性のあるILYタンパク質を保存します。遠心分離のための製造元の指示に従って、遠心分離のための遠心分離のための遠心分離のユニットを使用してILYタンパク質を濃縮します。
- 濃縮されたILYタンパク質を滅菌チューブ内の200 μLの部分に分注します。各チューブに日付と名前のラベルを付けます。アリコートは、ゲル電気泳動および溶血アッセイで将来使用するために-80°Cで保存してください。
3. SDS-PAGE電気泳動によるILY評価
- MOPS SDSランニングバッファー(1x)をddH2Oで20xに希釈して調製します。
- 90 μLの6xローディングバッファーと10 μLのβ-メルカプトエタノール(β-ME)を混合して、ドラフト内でサンプルバッファーを調製します。溶液を完全に混合して、完全な均質化を確保します。
- 調製したサンプルをローディングバッファーと組み合わせ、最終容量30 μLを達成します。サンプルを解凍し、激しくボルテックスして完全に混合します。
- サンプルを95°Cで5分間加熱して、タンパク質を変性させます。サンプルを4%-20%SDS-PAGEゲルにロードします。電気泳動を80Vの定電圧で90分間実行します。
- ゲルカセットを慎重に開き、ゲルをddH2Oに5分間浸します。シェーカーを使用して洗浄手順を2回繰り返します。
- ゲルをCoomassie Brilliant Blueで室温(RT)で1時間染色します。ゲルをddH2Oで30分間洗浄し、水を新鮮なddH2Oと交換し、シェーカーでゲルを一晩から3日間インキュベートして完全に脱染させます。
- カメラを使用して染色されたゲルの画像をキャプチャします(図1A)。ImageJソフトウェアを使用してゲルを分析し、定量的および定性的な評価を行います。
4. ILY活性の溶血アッセイ
- 保存したILY(インターメディリシン)サンプルを室温で完全に解凍します。解凍したサンプルを徹底的にボルテックスして均質性を確保します。これは、ILYが解凍時に凝集する可能性があるためです。
- 96ウェルプレートを段階希釈用にセットアップします。160 μLのILYストック溶液(26.7 ng/μL)を最初のウェルに加えます。80 μLの1x PBSを、同じ行または列の後続の各ウェルに加えます。
- 80 μLのILY溶液を第1のウェルから第2のウェルに移します。ピペッティングで上下に動かして完全に混合し、溶液が均一になるようにします。80 μLを第2ウェルから第3ウェルに移し、十分に混合します。
- このプロセスをウェルごとに繰り返し、前のウェルから次のウェルに80 μLを移し、必要な希釈回数が調製されるまで進めます。80 μLを最後のウェルに移した後、そのウェルから80 μLを廃棄して、プレート全体に一定の容量を確保します。
5. ヒト赤血球(RBC)の調製
- EDTAなどの抗凝固剤を含むチューブに1〜2mLの新鮮な人間の血液を吸い込みます。血液を室温で3,000 x g で5分間遠心分離します。
- 上清を捨て、上清が透明になるまでヒトRBCペレットをPBS 2x-3xで洗浄します。1x PBSの900 μLに10 μLのRBCを添加して、洗浄したヒトRBCを希釈し、1:100の希釈を達成します。
- 希釈したヒト赤血球10μLを各ウェルに加えます。希釈プレートから30 μLの段階希釈したILY溶液を各ウェルに加えます。1x PBSを160 μL加えて、最終容量をウェルあたり200 μLにします(開始濃度:4 ng/μL)。
- 希釈したヒトRBC10 μLをコントロールウェルに加えます。ネガティブコントロール用のコントロールウェルに190μLの水または1x PBSを加えます。プレートを軽くたたいて混ぜます。
- プレートを37°Cで30分間インキュベートし、溶血が起こるまで待ちます。プレートを3,000 x g で5分間遠心分離し、無傷のヒトRBCをペレット化します。
- 各ウェルから100 μLの上清を新しい平底96ウェルプレートに慎重に移します。マイクロプレートリーダーを使用して、405 nmで上清の吸光度を測定します。
- サンプルの吸光度値をコントロール16と比較することにより、ILYの溶血活性を計算します。
6.タモキシフェン治療、RM枯渇、再生
- コーン油を42°Cに予熱します。 100 mgのタモキシフェンを5 mLの予熱コーン油に溶解して、20 mg / mLの濃度のストック溶液を調製します。.
- タモキシフェンを腹腔内(i.p.)で10〜12週齢の男性 CX3CR1CreER+/-/ihCD59+/- マウスに100μg / g体重の用量で投与します。.タモキシフェン注射を3日間連続して繰り返します。.
- Creを介したhCD59発現を可能にするために、最終的なタモキシフェン注射後15日間待ちます。.
- 120 ng / g体重の用量で 、CX3CR1CreER+/-/ihCD59+/-マウス および CX3CR1CreER+/-/ihCD59-/- リターメイトコントロールに、インターメディリシン(ILY)の単回投与を静脈内注射します。.
- ILY投与後1、3、および7日でフローサイトメトリーを行うことにより、RMアブレーションおよびその後の再生をモニターおよび確認する17。
7.マウスの安楽死
- 動物を適切なチャンバーに入れ、IACUCプロトコルに従ってイソフルランにさらします。.ペダル離脱反射などの反射神経がないことを確認して、麻酔を確認します。
- マウスが完全に麻酔され、反応しなくなったら、安楽死を確実にするために頸部脱臼を行います。ペダル離脱反射などの反射神経がないことを確認して安楽死を確認します。
- 滅菌メスを使用して腹部に約2cmの正中線切開を行い、皮膚を静かに引っ込めて胸腔を露出させます。先端が鈍い手術用ハサミを使用して胸骨に沿って胸郭を開き、心臓を露出させます。
- 21G-23Gの針を左心室に挿入します。10〜20mLの冷たいPBSで灌流を開始し、血液を洗い流します。
- 右心房を切り開いて、血液が循環から排出されるようにします。腎臓が青白く見えるまで灌流を続け、効果的な血液クリアランスを示します。
- 腎臓を背側体壁に当てて位置を特定します。鉗子とはさみを使用して、腎臓を周囲の組織からそっと分離します。腎臓嚢を切除し、すぐに腎臓を冷たいPBSに入れて劣化を防ぎます。
8.腎臓の消化
- 9 mLのHBSS(Ca/Mgフリー)、1 mLのコラゲナーゼIV(5 mg/mL)、および20 μLのDNase I(10 mg/mL)を混合して、消化酵素カクテルを調製します。酵素溶液を新鮮に調製し、使用するまで氷の上に置いておきます。
- 5mLのHBSSが入ったシャーレで滅菌ハサミを使用して、腎臓を小さな断片(理想的には≤1mm)に刻みます。腎臓組織の断片を、調製した酵素溶液10mLを含む15mLチューブに移します。
- チューブを37°Cで30分間インキュベートし、穏やかに攪拌しながら組織を解離させます。ピペットまたはシリンジプランジャーを使用して組織を穏やかに粉砕し、細胞凝集をさらに解離します。
- 細胞懸濁液を40 μmの細胞ストレーナーに通すことにより、組織破片を除去します。細胞懸濁液を650 x g で10分間、18°Cで遠心分離します。
- 遠心分離後、バッファーを慎重にデカントします。ペレットを5 mLの溶解緩衝液に再懸濁し、室温で5分間インキュベートして赤血球を溶解します。
- 細胞をPBSで洗浄し、溶解バッファーを除去します。得られた単一細胞懸濁液は、さらに使用するまで氷上に保持します。
9.密度勾配遠心分離
- 造血細胞を濃縮するには、前回の洗浄で得た細胞ペレットを10 mLの30%密度勾配溶液に再懸濁します。遠心分離チューブ内の3 mLの70%密度グラジエント溶液に溶液を慎重に重ねます。
- グラジエントを500 x g で30分間、ブレーキをかけずに遠心分離します。遠心分離後、30%溶液と70%溶液の間の相間層を慎重に収集します。このレイヤーには、エンリッチされた単一セルが含まれています。
- 収集した細胞を10 mLのPBSで2回洗浄し、毎回500 x g で10分間遠心分離します。最終細胞ペレットを1.5 mLチューブ内の1 mLのFACSバッファー(1x PBSと2% FBS)に再懸濁します。
- 明視野顕微鏡下の血球計算盤を使用して細胞をカウントします。細胞濃度を2 x 106細胞/mLに調整します。
10. フローサイトメトリー染色、取得
- マウス腎臓組織から調製したシングルセル懸濁液からの細胞濃度を2-3 x 106細胞/mLに調整して、フローサイトメトリー解析を行います。
- 1.5 mLチューブ内の細胞を650 x g で5分間遠心分離してペレット化します。細胞ペレットを1 mLのFACS緩衝液に再懸濁します。
- 抗CD16/32抗体を1:200の希釈率で添加し、非特異的なFc受容体の結合をブロックします。細胞を室温で15分間インキュベートします。
- Aqua Live/Dead色素を使用して、メーカーの指示に従って生細胞と死細胞を区別します。
- CD45-e450、CD11b-PE-Cy7、hCD59-PE、F4/80-BV605などの希釈率1:100の標識済み抗体で細胞を染色します。抗体カクテルを細胞懸濁液に加えます。
- サンプルを暗所で4°Cで30分間インキュベートし、蛍光色素を光退色から保護します。染色した細胞をFACSバッファー(PBSと2%ウシ胎児血清)で2回洗浄し、650 x g で5分間遠心分離します。
- 細胞を1%パラホルムアルデヒド(PFA)に氷上で30分間固定します。固定細胞をFACSバッファーで2回洗浄し、残留PFAを除去します。
- フローサイトメーターを使用して、染色および固定された細胞を取得します。ソフトウェアを使用してデータを分析します。
- 9 で説明されているように、マーカー CD45、CD11b、および F4/80 を使用して、腎臓およびその他の組織に常在するマクロファージとミクログリアを同定します。
- 初期ゲーティングを実行して、前方散乱光(FSC)プロファイルと側方散乱光(SSC)プロファイルに基づいて生細胞を選択します。前方散乱領域 (FSC-A) と前方散乱高さ (FSC-H) でゲートすることで、ダブレットを排除します。LIVE/DEAD生存率色素を使用して死細胞を除外します。
- CD45+集団をゲーティングすることにより、免疫細胞を濃縮します。ゲーティング戦略に示されているように、腎臓に常在するマクロファージをCD45+集団内のCD11b+F4/80++細胞として定義します(図2A)。
- ミクログリア集団をCD11b+CD45i・t細胞と定義します(図2B)。フローサイトメーターでデータ取得を行います。ソフトウェアを使用して最終解析を行い、フローサイトメトリー研究を完了します。
結果
His-Tag組換えILYの精製は、14で前述したのと同じプロトコルに従っていました。ILYは、Streptococcus intermedius由来のILY遺伝子をコードするプラスミドで形質転換された大腸菌BL21(DE3)細胞で発現することに成功しました。IPTGによる誘導では、標的タンパク質の過剰発現が明らかでした。発現後、ILYをニッケル-NTAアフィニティークロマトグラフィーを用いて精製し、C末端のHisタグを特異的結合に利用しました。ILYの純度と分子量(~54 kDa)は、SDS-PAGE分析により確認されました(図1A)。タンパク質バンド強度は、ImageJソフトウェアを使用したデンシトメトリーによって定量化され、タンパク質濃度は分光光度分析によってさらに検証され、最終濃度は1.27 mg/mLになりました。精製されたILYの生物学的活性は、コレステロール依存性細胞溶解性を評価するための標準的なアッセイであるヒト赤血球(RBC)を用いた溶血アッセイを用いて評価されました。このアッセイは用量依存的な溶血活性を示し、組換えタンパク質の機能的完全性を確認しました。ポジティブコントロール(水)では完全な溶血が達成されましたが、ネガティブコントロール(BPSバッファー)では溶血は起こりませんでした。精製されたILYは強力な溶血活性を示し、7.24 ng/mLの濃度でhRBCの50%溶解が観察され、650 ng/mLでほぼ完全な溶血(99.62%)が観察されました(図1B)。これらの知見は、組換えILYがその特徴的な細孔形成活性を保持し、コレステロール依存性細胞溶解剤の特性と一致することを確認しています。ILYの発現と精製に成功した結果、高純度の組換えタンパク質が得られ、その溶血活性により、その機能的な細胞溶解特性が適切に折り畳まれ、保存されることが確認されました。
RMは病理学的状態に対して非常に脆弱であり、治療戦略を進める上で鍵となる可能性があるため、ニッチな枯渇後にRMがどのように補充されるかを完全に理解することが重要です18.腎臓のマクロファージニッチを枯渇させ、操作するために、マウスのhCD59発現細胞の選択的アブレーションを促進するILYとヒトCD59(hCD59)との間の特異的な相互作用を標的としました13.誘導性hCD59発現マウスに各種Cre-driver系統を交配したILYの投与により、オフターゲット効果なしに免疫細胞および上皮細胞を迅速かつ正確にアブレーション可能13.RMの選択的枯渇を達成するために、タモキシフェン導入の15日後にILYを投与しました。 CX3CR1CreER+/-/ihCD59+/- マウス。この時点が選ばれたのには、2つの重要な理由があります。まず、15日目までに、これらのマウスの脳と腎臓のほぼすべてのCX3CR1+細胞がhCD59を発現し続けますが、hCD59の発現は血液、脾臓、肺、骨髄、および肝臓で最小限または存在しません。第二に、ILYのサイズが大きい(54 kDa)ため、血液脳関門を通過できず、hCD59を発現するミクログリア細胞が影響を受けないことを保証します9.これを検証するために、タモキシフェン治療の15日後に、hCD59標識CD11b + CX3CR1+マクロファージを複数の臓器で定量しました。腎臓と脳ではhCD59+マクロファージの安定した保持(~90%)が観察されましたが、他の組織では発現が5%≤でした。ILY投与後、腎マクロファージの完全かつ選択的な枯渇を達成し、ミクログリアの枯渇は検出されず、ILYが血液脳関門を通過しないことが確認されました(補足図2A-B).CD59発現の安定性と腎臓常在性マクロファージ(KRM)再増殖の動態を確認するために、タモキシフェン導入後15日および30日でKRM上のhCD59発現を評価しました。フローサイトメトリー解析により、hCD59の発現が長期にわたって安定していることが確認されました(補足図2C).さらに、の潜在的なCre非依存性の漏れを評価するために、 CX3CR1CreER+/-/ihCD59+/- モデルとして、ビヒクル処理(コーン油)マウスにおけるhCD59の発現を評価した。これらのマウスは、CD11bintF480hihCD59+(0.93%)のCD11b+CX3CR1+hCD59+集団(1.8%)を示し、対照的に、タモキシフェンで処理したマウスは、両方の集団で顕著な増加(それぞれ87%と81%)を示し、最小限の基礎漏出(補足図2D).これらの知見は、誘導システムの特異性を検証し、将来の研究におけるビヒクル処理制御の使用を支持しています。(補足図2D).に示すように 図2A - イ、RMの枯渇は、ILY投与の1日以内に効率的に達成されました。 CX3CR1CreER+/-/ihCD59+/- マウスでは、対照マウス(CX3CR1CreER+/-/ihCD59-/-).注射の3日後、RMの個体数は回復し始め、元のレベルの約50%に達しました。7日目までに、それはほぼ88%に回復しました(図2B - ハ).次に、単球に由来する可能性のある再生RMの起源を調査しました, in situ 残留マクロファージ、または組み合わせの増殖。新たに生成されたRMのうち、hCD59を発現したのはわずか~5%であり、これは in situ 増殖は彼らの再増殖に最小限の役割を果たし、大多数は単球の動員から生じる可能性があります(図2D).これらの結果は、以前の観察結果と一致しています9 また、RM再生の根底にあるメカニズムに関する貴重な洞察を提供し、マクロファージニッチの枯渇後の単球由来の補充の優位性を強調しています。この研究で提示された代表的なデータは、私たちが以前に報告した調査結果と一致しています9 .
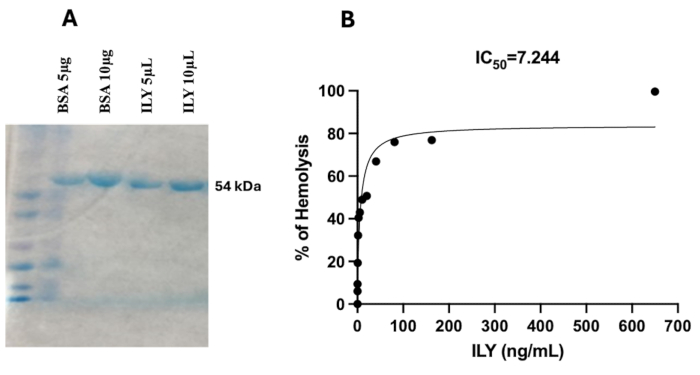
図1:SDS-PAGEおよび組換えILYタンパク質の溶血アッセイ (A)SDS-PAGEゲル画像は、精製された組換えインターメディライシン(ILY)タンパク質を示しています。予想される分子量54 kDaで単一のバンドが見え、ILYの発現と精製が成功したことが確認されています。タンパク質の純度は明らかで、大きな汚染バンドは観察されません。参照用に分子量マーカー(ラダー)が含まれており、既知の分子量に対するILYタンパク質の正しい位置を示しています。(B)このグラフは、hRBCに対する精製ILYの用量依存的な溶血活性を示しています。細胞溶解の割合は、ILYの濃度の増加に対してプロットされ、IC50、または細胞の50%を溶解するために必要な濃度は7.224 ng/mLであると決定されました。 この図の拡大版を表示するには、ここをクリックしてください。
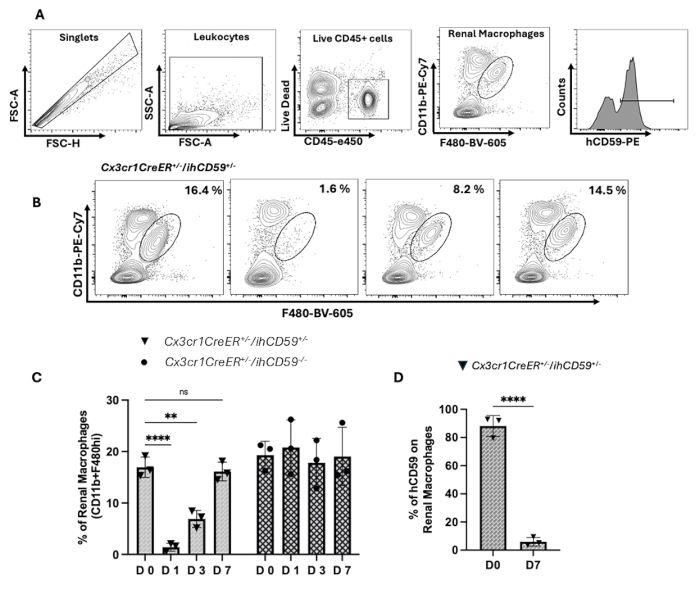
図2:ILY注射後の腎臓常在性マクロファージ(RM)のアブレーションと再生。 (A)腎臓組織の単一細胞懸濁液から、CD11b + F4 / 80 ^ high細胞として定義される腎マクロファージ(RM)を同定するために使用されるゲーティング戦略。最初のゲーティングでは、破片、ダブレット、および死細胞を除外し、次にCD11b+およびF4/80high細胞を選択しました。(B)ベースライン時(0日目)および1日目、3日目、7日目のILY注入後のRM(CD11b + F4 / 80 ^ hi)集団の割合を示すフローサイトメトリードットプロット分析。(C)ILYの静脈内(静脈内)投与後のさまざまな時点(0、1、3、および7日目)における腎臓あたりのRM細胞の割合(120 ng / g体重)。 Cx3cr1CreER+/-/ihCD59+/- マウスと Cx3cr1CreER+/-/ihCD59-/-マウスの比較(n = 3、2つの独立した実験、二元配置分散分析)。(D)腎臓常在マクロファージに対するヒトCD59(hCD59)の発現は、0日目のコントロールで、ILY注射後7日目の再生RMで。フローサイトメトリー解析の結果、再生されたRMでは、元のRM集団と比較してhCD59の発現が減少することが明らかになりました(n = 3、2つの独立した実験、不対応のt検定)。データは、各時点でグループごとにn = 3匹のマウスを使用した2つの独立した実験を表しています。結果は平均±標準偏差(SD)で示され、*p < 0.05 は統計的有意性を示します。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:pTrcHis-A細菌発現ベクターのILY配列。 ベクトル内の ILY の 5' および 3' 境界領域シーケンスは黄色で強調表示されています。 この図をダウンロードするには、ここをクリックしてください。
補足図2:タモキシフェン誘導性hCD59の発現とCD11b + CX3CR1 +細胞の異なる組織での安定性、およびCreを介した組換え効率の検証。 (A)タモキシフェン導入後15日後のhCD59標識CD11b+CX3CR1+マクロファージの複数の臓器にわたるフローサイトメトリー解析では、腎臓と脳でのhCD59+マクロファージの安定した保持(~90%)が示され、他の組織での発現は5%≤。(B)1日目のILY投与後、ミクログリアは影響を受けず、ILYが血液脳関門を通過しないことが確認されました。(C)タモキシフェン導入後15日および30日での腎臓常在マクロファージ(KRM)上のhCD59発現の安定性、フローサイトメトリーによって評価。(D) CX3CR1CreER+/-/ihCD59+/- マウスにおけるCre非依存性の評価。ビヒクル処理(VC=コーン油)マウスは、CD11bintF480hihCD59+(0.93%)、CD11b+CX3CR1+hCD59+集団(1.8%)、タモキシフェン処理マウスは87%および81%の顕著な増加を示し、タモキシフェンによって誘導される効率的なCre媒介組換えを確認しました。 この図をダウンロードするには、ここをクリックしてください。
ディスカッション
この研究におけるHisタグ付き組換えILYの発現、精製、および機能検証の成功は、確立されたプロトコル15に従って行われました。しかし、このプロセスには、高いタンパク質収量、純度、および生物学的活性を確保するためのいくつかの重要なステップが含まれていました。IPTGによる 大腸菌 BL21(DE3)細胞の誘導は、封入体の形成を最小限に抑えながらタンパク質発現レベルのバランスをとるように最適化されました。このプロトコルの堅牢性にもかかわらず、収量と機能性を最大化するためには、特定の変更とトラブルシューティング手順が必要でした。重要な変更の1つは、IPTG濃度と誘導温度の最適化であり、高温での過剰な発現は不溶性凝集体につながるためでした 。IPTGが37°Cで0.2 mMから0.5 mMに段階的に増加すると、溶解度が大幅に向上しました。さらに、精製中に、洗浄バッファー中のイミダゾール濃度を慎重に調整して、効率的な溶出を維持しながら非特異的タンパク質の結合を最小限に抑えました。
この原稿では、ILY-hCD59システムを使用した腎マクロファージ(RM)の選択的アブレーションとその後の再生のための非常に特異的なプロトコルについて説明します。このアプローチは、特異性に欠けたり、オフターゲット効果を誘発したりすることが多い従来のアブレーション技術と比較して、マクロファージの生物学と再生の研究に独自の利点を提供します。この研究は、腎臓の恒常性、免疫調節、および組織修復におけるRMの役割を解剖するための正確な方法の重要性を強調しています。RMは、腎機能の維持、免疫応答への影響、組織修復、および線維化に重要な役割を果たします。調節不全のRMは、慢性炎症や再生障害など、いくつかの腎臓の病状に関与しています11,17,18。クロドロン酸リポソーム、ジフテリア毒素受容体(DTR)システム、または遺伝的ノックアウトなどのマクロファージ枯渇に対する現在のアプローチは、特異性の欠如、オフターゲット効果、またはアポトーシスを介したゆっくりとした細胞死の誘導などの制限に悩まされることがよくあります19。これらの制限は、マクロファージの再生ダイナミクスを研究する能力を複雑にします。対照的に、ILY-hCD59システムは、hCD59を発現するCX3CR1+ RMの迅速かつ特異的なアブレーションを提供し、腎臓におけるマクロファージニッチ再生を研究するための強力なプラットフォームを提供します。重要なことに、以前の研究では、ILY-hCD59相互作用がhCD59発現を欠く組織でオフターゲット効果を生じさせないことが示され、このプロトコルの特異性と再現性が確保されています13,14。注目すべきは、健康なマウス腎臓に関する以前の研究では、RMの2つの主要なサブセット、RMの2つの主要なサブセット、1つはCcr2+RMともう1つはCd63+RM20であることが示されたことです。今後の研究では、タモキシフェンで処理されたCX3CR1CreER+/-/ihCD59+/-でこれら2つの集団をILYがどのように効率的にアブレーションするかを決定することは興味深いでしょう。
マクロファージの枯渇だけでなく、このシステムはマクロファージと他の腎細胞タイプとの相互作用を研究するための汎用性の高いツールを提供します。例えば、尿細管上皮細胞(TEC)は、損傷後の生存と修復のためにマクロファージ由来のシグナルに依存している21。RMを枯渇させ再生する能力は、マクロファージ-TECクロストークがTECの増殖、修復、および全体的な腎機能にどのように影響するかを調査するユニークな機会を提供する22。さらに、このプロトコルは、炎症誘発性マクロファージが線維形成に寄与し、修復マクロファージが線維症の解決をサポートする線維症調節におけるRMの役割を調査するために使用できます23。これらの研究から得られた知見は、慢性腎臓病における線維化の調節を目的としたマクロファージ標的療法の開発を導く可能性があります。この方法の意味は、マクロファージの生物学にとどまらず、内皮細胞や周皮細胞など、他の腎細胞タイプとのRM相互作用の研究を容易にします。これらの細胞は、血管の完全性を維持し、炎症を調節するために重要です24。ILY-hCD59システムは、RMの枯渇と再生が腎血管の健康と全体的な腎機能にどのように影響するかを研究するためのプラットフォームを提供し、腎疾患におけるマクロファージ活性の広範な影響への窓を提供します。
ILYベースの枯渇技術は高い特異性を提供しますが、固有の制限があります。この方法はhCD59の発現に依存しており、その適用はヒト化CD59を発現するトランスジェニックモデルに限定され、一般化可能性は非トランスジェニックマウスに限定されます。さらに、示されているように、ILYはCX3CR1CreER+/-/ihCD59+/- のミクログリア細胞を枯渇させません(補足図1B)、ILY/hCD59アブレーションツールはミクログリア集団の特定の操作には使用できません。さらに、ILYはhCD59+マクロファージを選択的に枯渇させますが、腎臓内の異なるマクロファージサブセットを区別しません。
腎臓での有用性に加えて、ILY-hCD59プラットフォームは、他の細胞タイプの再生能力の研究に幅広い適用性を示しています。例えば、このシステムは胆管細胞を切除するために採用されており、胆管再生の研究を可能にし、脂肪細胞を標的とし、脂肪細胞媒介性肝障害の研究を促進している25,26。さらに、腎臓に挿入された細胞を切除するために使用され、挿入された細胞再生の研究を促進しています27。これらのアプリケーションは、複数の臓器系にわたる細胞再生と組織修復の理解を深める上で、ILY-hCD59システムの汎用性を強調しています。要約すると、ILY-hCD59システムは、マクロファージアブレーションプロトコルの大幅な進歩を表しています。その特異性、オフターゲット効果の欠如、およびRM再生の詳細な研究を促進する能力は、腎臓の健康と疾患におけるマクロファージ生物学を研究するための堅牢なプラットフォームを提供します。さらに、このプロトコルから得られる洞察は、マクロファージの機能の理解を進めるだけでなく、腎臓病、線維症、およびさまざまな組織タイプの細胞修復のダイナミクスの治療戦略にも情報を提供します。
開示事項
著者らは、この原稿で報告された研究に影響を与えたと思われる可能性のある競合する金銭的利益や個人的な関係がないことを宣言します。金銭的、非金銭的、専門的、または個人的な所属を含む利益相反は、研究のデザイン、実施、解釈、またはプレゼンテーションに影響を与えていません。
謝辞
この研究で使用されたプロトコルの開発と改良に貢献してくれたQin Labの過去と現在のメンバーに感謝の意を表します。また、オクラホマ大学健康科学センターのR.K.トゥイーテン博士のグループには、この研究に役立った組換えILYプラスミドを寛大に提供していただいたことに感謝します。この研究は、国立衛生研究所(NIH)の助成金NIH 5 P51OD011104-58、R01DK129881(X.Q.)、およびR21OD024931(X.Q.)を通じて支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Millipore | SLHVR33RS | |
| 4-15% TGX Stain-Free Protein Gels | Bio-Rad | 4568084 | |
| 6X Loading buffer | Fisher | 50-103-6570 | |
| 70% Ethanol | WWR Life Science | 64-17-5 | |
| ACK (Ammonium-Chloride-Potassium) Lysing Buffer | Gibco | A1049201 | |
| Affinity resin beads | Millipore | 69670 | |
| Ampicillin sodium solution | Zymo Research | A1001-5 | |
| Anti-CD11b-PE-Cy7 (Clone M1/70) | Invitrogen | 25-0112-82 | |
| Anti-CD16/32 (FcγRIII/II, Clone 93) | eBioscience | 48-0161-80 | |
| Anti-CD45-e450 (Clone 30-F11) | eBioscience | 48-0451-82 | |
| Anti-F4/80-BV605(Clone BM8) | BioLegend | 123133 | |
| Anti-hCD59-PE (Clone OV9A2) | Invitrogen | 12-0596-42 | |
| Aqua Live/Dead dye | Invitrogen | L34957A | |
| Beads (resin) | Millipore | 69670 | |
| Benzonase Nuclease | Millipore | 70664-10KUN | |
| BugBuster protein extraction reagent | Millipore | 70584-4 | |
| Centrifuge for microtubes | Eppendorf | 5424 | |
| Centrifuge for tubes | Thermo Scientific | 75-001-241 | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Corn oil | Sigma Aldrich | C8267 | |
| Deoxyribonuclease (DNAse) I | Worthington Biochemical Corporation | LS002007 | |
| Detoxi-Gel resin column | Millipore | 69670 | |
| DPBS (Dulbecco’s phosphate-buffered saline) solution | Corning | 21-031-CV | |
| EDTA tubes | BD | 365974 | |
| FBS (Fetal bovine serum) | Gibco | 10082-139 | |
| Glycerol | Fisher | BP229-1 | |
| HBSS (Hank’s Ballanced Salt Solution) | Gibco | 24020117 | |
| IPTG (Isopropyl β-D-1-thiogalactopyranoside) | Millipore-Sigma | 206-703-0 | |
| Isoflurane | VET one | 502017 | |
| LB media | |||
| LSRFortessa flow cytometer | BD Biosciences | ||
| MES [2-(N-morpholino) ethanesulfonic acid] | Fisher | 50-488-796 | |
| MOPS [3-(N-morpholino) propanesulfonic acid] | Fisher | 50-213-522 | |
| Percoll density gradient media | Cytiva | 17089101 | |
| Peristaltic pump | Fisher Scientific | Discontinued now, use alternative | |
| PFA (Paraformaldehyde) | Thermo Scientific | I28800 | |
| Purification column | Millipore | UFC900308 | |
| rLysozyme solution | Novagen | 20C71110 | |
| Shaking water bath | Thermo Scientific | TSSB15 | |
| Slide-A-Lyzer dialysis kit | Thermo | 66107 | |
| Sodium deoxycholate | Fisher | BP349-100 | Fresh made or less than a month |
| Sterile cell strainer (40 μm) | Fisher Scientific | 22-363-547 | |
| Tamoxifen | Sigma Aldrich | 6734 | |
| Ultra centrifugal filter | Millipore | UFC900308 | |
| Ultrapure water | Thermo | 10977-015 | |
| Vortex mixer | Fisher Scientific | 2215365 | |
| β-ME (β-mercaptoethanol) | Fisher | BP176-100 |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved