Method Article
Déplétion rapide des macrophages rénaux à l’aide d’un outil d’ablation cellulaire CD59/Intermedilysin humain
Dans cet article
Résumé
Un protocole est rapporté ici pour l’ablation sélective des macrophages rénaux afin d’étudier leur régénération à l’aide de l’outil d’ablation cellulaire CD59/intermédidilysine humaine. Cette méthode est également applicable pour étudier la fonction et la régénération des autres populations cellulaires dans les reins, le foie et les tissus adipeux.
Résumé
Les macrophages rénaux (MR) sont essentiels à la santé rénale, orchestrant la surveillance immunitaire, l’homéostasie tissulaire et les réponses aux blessures. Précédemment, nous avons rapporté l’utilisation d’un outil d’ablation de cellules CD59 (hCD59)/intermedilysine (ILY) humaines pour étudier le destin, la dynamique et les niches distinctes des MR d’origine osseuse ou embryonnaire. Les MR proviennent de macrophages dérivés du sac vitellin, de monocytes hépatiques fœtaux et de monocytes dérivés de la moelle osseuse et sont maintenus à l’âge adulte par la prolifération locale et le recrutement de monocytes circulants. Ici, nous rapportons un protocole détaillé pour l’ablation sélective des MR afin d’étudier leur régénération, y compris 1) la génération et la caractérisation de l’expression inductible par Cre de hCD59 dans les MR de souris, 2) la purification de l’ILY et la caractérisation de l’activité de l’ILY, 3) l’induction de l’expression de hCD59 sur les MR chez les souris composées, et 4) la caractérisation de la régénération après l’ablation du MR médiée par l’ILY. L’ILY épuise spécifiquement et rapidement les RM chez les souris composées, avec une ablation efficace des macrophages dans la journée suivant l’administration de l’ILY. La régénération rénale des macrophages a commencé le 3e jour après l’ablation, avec ~88 % de récupération au 7e jour. Ce modèle offre un outil puissant pour étudier la biologie des macrophages et peut être utilisé pour l’ablation sélective d’autres populations cellulaires dans les reins, le foie et les tissus adipeux afin d’étudier leur fonction et leur régénération.
Introduction
Les macrophages rénaux (MR) sont des cellules immunitaires essentielles qui maintiennent l’homéostasie rénale, régulent les réponses immunitaires et favorisent la réparation des tissus après une lésion. Ils remplissent diverses fonctions, notamment la phagocytose, la présentation de l’antigène et l’orchestration des réponses inflammatoires et anti-inflammatoires1,2,3. Selon l’environnement local, les MR peuvent se polariser en phénotypes pro-inflammatoires (M1) ou anti-inflammatoires (M2), exacerbant les lésions ou facilitant la guérison 4,5,6. La dérégulation des MR a été impliquée dans l’apparition et la progression de l’insuffisance rénale aiguë (IRA) et de l’insuffisance rénale chronique (IRC), ce qui en fait des acteurs essentiels de la santé rénale et de la pathologie 7,8. Les MR proviennent de diverses sources, notamment des macrophages dérivés du sac vitellin au cours de l’embryogenèse, des monocytes hépatiques fœtaux et des monocytes dérivés de la moelle osseuse à l’âge adulte. Les MR se développent et mûrissent parallèlement à la croissance rénale postnatale, principalement à partir des monocytes hépatiques fœtaux avant la naissance, l’auto-entretien à l’âge adulte étant complété par les monocytes périphériques9. Chez l’adulte, les monocytes circulants sont recrutés dans le rein par des signaux homéostatiques ou de blessure, se différenciant en macrophages sous l’influence microenvironnementale locale. L’entretien de la MR est maintenu par la prolifération locale et le réapprovisionnement périodique à partir des monocytescirculants 9,10,11,12.
Nous avons précédemment démontré l’utilisation du système d’ablation des cellules CD59 (hCD59)/intermedilysine (ILY) humaines comme outil13,14 pour étudier les destins, la dynamique et les niches microenvironnementales distinctes des MR dérivés de la moelle osseuse ou d’origines embryonnaires9. L’ILY lyse sélectivement les cellules humaines en quelques secondes en formant des pores dans les membranes cellulaires ciblées15. Cette spécificité découle de l’affinité de liaison exclusive d’ILY pour le CD59 humain (hCD59), sans interaction ni effet lytique sur les cellules d’autres espèces dépourvues de ce récepteur15. Sur la base de ce concept, nous avons conçu un outil permettant l’ablation rapide, conditionnelle et ciblée des cellules humaines exprimant CD59 dans des modèles de souris transgéniques grâce à l’application d’intermédilysine (ILY)14. Pour faciliter l’utilisation de cet outil, nous avons développé un modèle d’ablation cellulaire conditionnelle et ciblée en générant des souris knockin STOP-CD59 floxées (ihCD59), chez lesquelles l’expression de CD59 humain ne se produit qu’après une recombinaison médiée par Cre13. Auparavant, il avait été constaté que le gène CX3CR1cre-EFP était exclusivement exprimé sur CD11bintF480hi, défini comme des macrophages rénaux9. Par conséquent, nous avons utilisé des lignées CX3CR1CreER2+/+ pour croiser avec des souris ihCD59 afin d’exprimer hCD59 sur les macrophages rénaux. Nous avons réussi à générer des souris composées avec le génotype ihCD59+/-/CX3CR1CreER+/-9 (+/-, +/+ et -/- indiquant respectivement l’homozygote, l’hémizygote et les souris transgéniques non porteuses). Administration de tamoxifène chez des souris composées ihCD59+/-/CX3CR1CreER+/- marquées conditionnellement et marquées RM par l’expression de hCD599. Suite à l’épuisement de la niche RM par le traitement IEL, les monocytes périphériques se sont rapidement différenciés en MR dérivés de la moelle osseuse, repeuplant efficacement la niche comme décrit précédemment en9. Cette régénération était extrêmement dépendante de l’axe de signalisation CX3CR1/CX3CL1, soulignant son rôle essentiel dans la maintenance et la restauration de la population RM9. Nous montrons également qu’en raison de leurs capacités glycolytiques distinctes, les MR d’origine embryonnaire ont une capacité plus élevée à piéger les complexes immunitaires et sont plus sensibles aux défisimmunitaires que les MR 9 dérivés de la moelle osseuse.
Nous présentons un protocole détaillé pour l’ablation sélective des MR afin d’étudier leur régénération à l’aide de l’ablation cellulaire rapide médiée par le hCD59 inductible par Cre (ihCD59) après l’administration d’ILY. L’injection d’ILY a provoqué l’ablation ciblée des MR qui expriment conditionnellement et spécifiquement hCD59 chez les souris CX3CR1CreER+/-/ihCD59+/- composées. Après l’ablation, nous avons surveillé les changements dynamiques des macrophages à l’aide de la cytométrie en flux et avons constaté une déplétion rapide des macrophages suivie d’une régénération des MR. L’ILY recombinant a été exprimé dans les cellules E . coli BL21(DE3) et purifié à l’aide de la chromatographie d’affinité nickel-NTA. La pureté et la fonctionnalité de l’ILY recombinant ont été confirmées par SDS-PAGE, la spectrophotométrie et un test d’hémolyse, démontrant son activité cytolysine dépendante du cholestérol caractéristique. Nous avons utilisé l’ILY pour épuiser les RM chez les souris, ce qui a permis une ablation efficace des macrophages dans la journée suivant l’administration de l’ILY. La régénération rénale des macrophages a commencé le 3e jour après l’ablation, avec ~85 % de récupération au 7e jour. Les données suggèrent que la régénération est principalement due au recrutement des monocytes. Ce modèle offre un outil puissant pour l’étude de la biologie des macrophages et a un potentiel thérapeutique pour la manipulation ciblée des populations de macrophages dans les maladies rénales. L’outil d’ablation cellulaire ihCD59/ILY peut être utilisé pour étudier la fonction et la régénération cellulaires dans les reins, le foie, les tissus adipeux et d’autres organes.
Protocole
Les protocoles d’étude sur les animaux ont été approuvés par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) de la faculté de médecine de l’Université de Tulane (numéro de protocole 1482). Les souris expérimentales, Cx3cr1CreER+/+ et ihCD59+/+, âgées de 10 à 12 semaines et pesant de 25 à 30 g, ont été hébergées dans des conditions spécifiques exemptes d’agents pathogènes (SPF) dans l’animalerie de l’université. Toutes les procédures impliquant l’isolement rénal ont été menées dans un environnement stérile, les chercheurs portant des gants et des masques faciaux pour éviter la contamination. Les détails concernant les réactifs et l’équipement utilisés dans l’étude se trouvent dans la table des matériaux.
1. Préparation des animaux
- Procurez-vous les souris CX3CR1CreER+/+du Jackson Laboratory. Hébergez les souris à la faculté de médecine de l’Université de Tulane (SOM) dans une installation spécifique exempte d’agents pathogènes (SPF). Maintenez les animaux sous un cycle lumière/obscurité de 12 heures dans des conditions environnementales contrôlées.
- Utilisez des souris ihCD59+/+ précédemment générées avec un patrimoine génétique C57BL/6 pour la reproduction. Croisez des souris homozygotes CX3CR1CreER+/+ (déficientes en expression de CX3CR1) avec des souris ihCD59+/- pour produire les génotypes de progéniture suivants : CX3CR1CreER+/-/ihCD59-/-et CX3CR1CreER+/-/ihCD59+/-.
- Assurez-vous que les souris hétérozygotes CX3CR1CreER+/- conservent l’expression fonctionnelle de CX3CR1, tandis que les souris homozygotes CX3CR1CreER+/+ sont déficientes en CX3CR1 par analyse par cytométrie en flux avec l’anticorps anti-CX3CR19.
2. Production ILY (dérivée de 14,15)
- Jour 0
- Récupérer des souches congelées de la souche bactérienne ILY BL21-DE3-RIPL portant des séquences ILY marquées par His dans le plasmide pTrcHis-A (figure supplémentaire 1) stockées à -80 °C. Inculquer 10 μL du stock bactérien dans 40 μL de milieu de bouillon Luria (LB) contenant de l’ampicilline à une concentration de 1 μg/mL.
- Étaler le mélange inoculé sur une plaque de gélose LB complétée par de l’ampicilline (1 μg/mL). Incuber la plaque pendant une nuit à 37 °C dans un incubateur bactérien.
- Jour 1
- Sélectionner six colonies individuelles dans la plaque de gélose LB. Inoculer chaque colonie dans 3,5 mL de milieu LB contenant de l’ampicilline. Incuber les cultures pendant la nuit à 37 °C.
- Jour 2
- Transférez chaque culture de démarrage de 3,5 mL dans 250 mL de milieu LB complété par de l’ampicilline. Incuber les cultures à 37 °C pendant 3 h en secouant à 230 x g pour permettre la croissance bactérienne.
- Après 3 h, ajouter de l’isopropyle β-D-1-thiogalactopyranoside (IPTG) à partir d’une solution mère de 1 M (conservée à -20 °C) à une dilution de 1:1000 pour obtenir une concentration finale de 1 mM. Poursuivre l’incubation pendant 4 heures supplémentaires pour induire l’expression des protéines.
- Pesez une bouteille de centrifugeuse vide et notez le poids. Transférez environ 250 ml de la culture induite dans le flacon de la centrifugeuse.
- Granulez les cellules par centrifugation à 10 000 x g pendant 15 min à 4 °C. Jetez le surnageant, puis pesez la bouteille contenant la pastille. Calculez le poids des granulés en soustrayant le poids de la bouteille vide du poids total après centrifugation.
- Stockez la pastille bactérienne à -20 °C pour l’extraction et la purification ultérieures d’ILY.
- Jour 3 : Extraction et purification de l’ILY
- Préparez le tampon de lyse en combinant 30 ml de réactif d’extraction de protéines Bug Buster avec 30 μL de nucléase benzonase (1200 unités Kunitz) et 0,9 μL de lysozyme (10 000 unités d’activité enzymatique) dans un tube à centrifuger de 50 ml.
- Mélangez doucement la solution pour vous assurer que le tampon de lyse est homogène. Ajouter le tampon de lyse préparé à la pastille bactérienne (2-5 g). Agitez soigneusement le mélange pendant 30 à 60 s pour remettre complètement les cellules bactériennes en suspension.
- Répartir la solution remise en suspension également entre deux tubes à centrifuger de 50 ml. Placez les tubes sur de la glace et incubez pendant 30 à 90 min. Pendant l’incubation, agitez doucement les tubes à l’aide d’un agitateur orbital et agitez brièvement tous les 5 à 10 minutes pendant 10 à 15 s pour favoriser la lyse cellulaire.
- Après l’incubation, centrifuger les lysats à 4 900 x g pendant 30 min à 4 °C.
- Lavez soigneusement la colonne à l’eau du robinet à l’aide d’une pointe de pipette de 1 ml pour enlever toute résine restante de l’utilisation précédente.
- Rincez la colonne avec de l’éthanol à 70 % pour l’assainir. Laver la colonne 2x-3x avec du ddH2O froid pour éliminer tout résidu d’éthanol. Placez la colonne dans le support.
- Ajouter 6 à 10 ml de ddH2O froid pour laver davantage et équilibrer la colonne pour la purification. Ajoutez environ 3 ml de billes de résine dans la colonne. Connectez la colonne à une pompe péristaltique réglée à une vitesse de 30.
- Ajouter 10 mL de ddH2O froid pour suspendre complètement la résine et la préparer à la liaison des protéines. Lavez les billes de résine avec 15 ml de 1x tampon de charge pour préparer la résine à la liaison des protéines.
- Recueillir le surnageant de lysat bactérien après centrifugation dans un tube frais, en veillant à ce que la pastille soit jetée. Filtrez le surnageant à l’aide d’un filtre de 0,45 μm avec une seringue pour éliminer tous les débris cellulaires restants.
- Passez 20 à 25 ml de lysat bactérien filtré dans la colonne en trois tours distincts. Après chaque passage, prélevez 20 μL de l’écoulement continu et étiquetez-le comme EP pour une mesure ultérieure de la densité optique (DO).
- Lavez la colonne avec 20 à 30 ml de tampon de liaison pour éliminer les protéines non liées. Lavez la colonne avec 20 à 30 ml de tampon de lavage. Recueillir 20 μL de la fraction de lavage pour la mesure de la DO.
- Éluer la protéine liée en ajoutant 10 à 20 ml de tampon d’élution. Commencez à recueillir l’élution après 3-4 minutes à l’aide de microtubes à centrifuger. Prélever environ 1 mL par tube, en remplissant 15 à 17 tubes.
- Mesurez l’absorbance de chaque fraction d’élution à A280 à l’aide d’un spectrophotomètre. Utilisez le tampon d’élution comme blanc lors des lectures A280. Collectez les tubes avec une absorbance considérablement accrue à A280 car ils contiennent la protéine ILY marquée par His qui se trouve généralement dans les fractions autour du tube 13.
- Conservez les fractions d’élution (ou tubes) contenant la protéine ILY à 4 °C. Passez à d’autres étapes dans la journée suivante pour assurer une stabilité optimale des protéines.
REMARQUE : Effectuez toutes les étapes sur de la glace ou à 4 °C si possible pour maintenir l’intégrité des protéines.
- Jour 4 : Élimination des endotoxines de l’élution
- Rincez la colonne de résine d’élimination des endotoxines avec 6 à 10 ml d’eau ultra-pure. Appuyez doucement sur la colonne pour réguler le débit.
- Rincer la colonne avec 10 ml de solution de désoxycholate de sodium à 1 % (fraîchement préparée ou datant de moins d’un mois) pour éliminer les endotoxines liées. Rincez à nouveau la colonne avec 6 à 10 ml d’eau ultra-pure pour éliminer tout résidu de détergent.
- Appliquez l’échantillon de protéines préparé sur la colonne de résine. Incuber l’échantillon dans la colonne pendant 1 h à température ambiante (RT) pour permettre une liaison optimale des endotoxines.
- Recueillir la fraction de transfert initiale. Ajouter du ddH2O dans la colonne pour une élution ultérieure et recueillir les fractions éluées dans environ 10 tubes (1 mL par tube).
- Stockez la colonne de résine dans de l’éthanol à 25 % à 4 °C pour une utilisation future. Mesurer la densité optique (D.E.) des échantillons de protéines éluées pour quantifier le rendement. Attendez-vous à récupérer environ 50 à 70 % des protéines totales du premier lot d’élution.
- Jour 5-6 : Dialyse
- Préparez 2 L de tampon de dialyse en autocavant 1600 mL d’eau distillée désionisée (jdH2O). Ajouter 200 ml de 10x PBS, 200 ml de glycérol et 3,5115 g de MES (acide 2-(N-morpholino)éthanesulfonique) à l’eau autoclave.
- Mélangez le mélange à l’aide d’un barreur magnétique jusqu’à ce que tous les réactifs soient complètement dissous. Stockez le tampon obtenu à 4 °C.
- Ajoutez les fractions d’élution stockées dans le kit de dialyse, puis retirez l’air du kit de dialyse à l’aide d’une aiguille. Dialyser la solution protéique à l’aide du kit de dialyse pendant 24 h à 4 °C avec une vitesse d’agitation réglée sur environ 2.
- Configurez le kit de dialyse pour vous assurer qu’il est complètement immergé dans le tampon. Le lendemain, remplacez le tampon de dialyse dans le kit de dialyse par un tampon de dialyse frais dans un récipient de 2 L. Poursuivez la dialyse pendant 24 heures supplémentaires.
- Transférez soigneusement toute la solution, y compris les précipités blancs, dans un tube stérile pour préserver la protéine LILY, qui peut s’agréger. Concentrez la protéine ILY à l’aide d’une unité de filtration centrifuge, en suivant les instructions du fabricant pour la centrifugation.
- Aliquote de la protéine ILY concentrée en portions de 200 μL dans des tubes stériles. Étiquetez chaque tube avec la date et le nom. Conservez les aliquotes à -80 °C pour une utilisation future dans les tests d’électrophorèse sur gel et d’hémolyse.
3. Caractérisation ILY par électrophorèse SDS-PAGE
- Préparez le tampon de fonctionnement MOPS SDS (1x) en diluant le tampon de fonctionnement (20x) avec du jdH2O.
- Préparez le tampon d’échantillon dans une hotte en mélangeant 90 μL de tampon de charge 6x avec 10 μL de β-mercaptoéthanol (β-ME). Mélangez soigneusement la solution pour assurer une homogénéisation complète.
- Combinez l’échantillon préparé avec le tampon de chargement pour obtenir un volume final de 30 μL. Décongelez les échantillons et agitez-les vigoureusement pour assurer un mélange complet.
- Chauffer les échantillons à 95 °C pendant 5 min pour dénaturer les protéines. Chargez les échantillons sur un gel SDS-PAGE à 4 % à 20 %. Faites fonctionner l’électrophorèse à une tension constante de 80 V pendant 90 min.
- Ouvrez délicatement la cassette de gel et plongez le gel dans du ddH2O pendant 5 min. Répétez l’étape de lavage 2 fois à l’aide d’un shaker.
- Teignez le gel avec Coomassie Brilliant Blue pendant 1 h à température ambiante (RT). Laver le gel pendant 30 min dans du ddH2O. Remplacer l’eau par du ddH2O frais et incuber le gel sur un shaker pendant une période allant d’une nuit à 3 jours pour un décoloration complet.
- Prenez une image du gel coloré à l’aide d’un appareil photo (Figure 1A). Analysez le gel à l’aide du logiciel ImageJ pour des évaluations quantitatives et qualitatives.
4. Dosage hémolytique de l’activité ILY
- Décongelez complètement les échantillons d’ILY (Intermedilysin) stockés à température ambiante. Vortex soigneusement les échantillons décongelés pour assurer l’homogénéité, car ILY peut s’agréger lors de la décongélation.
- Mettre en place une plaque à 96 puits pour les dilutions en série. Ajouter 160 μL de la solution mère d’ILY (26,7 ng/μL) dans le premier puits. Ajouter 80 μL de 1x PBS à chacun des puits suivants dans la même rangée ou colonne.
- Transférer 80 μL de la solution ILY du premier puits au deuxième puits. Mélangez soigneusement en pipetant de haut en bas pour vous assurer que la solution est homogène. Transférez 80 μL du deuxième puits au troisième puits et mélangez soigneusement.
- Répétez ce processus pour chaque puits, en transférant 80 μL du puits précédent au suivant jusqu’à ce que le nombre souhaité de dilutions soit préparé. Après avoir transféré 80 μL dans le dernier puits, jetez 80 μL de ce puits pour assurer des volumes constants sur toute la plaque.
5. Préparation des globules rouges humains (GR)
- Prélevez 1 à 2 ml de sang humain frais dans un tube contenant un anticoagulant, tel que l’EDTA. Centrifuger le sang à température ambiante à 3 000 x g pendant 5 min.
- Jetez le surnageant et lavez la pastille de globules rouges humains avec du PBS 2x-3x jusqu’à ce que le surnageant soit clair. Diluez les globules rouges humains lavés en ajoutant 10 μL de globules rouges à 900 μL de 1x PBS pour obtenir une dilution de 1:100.
- Ajouter 10 μL de globules rouges humains dilués dans chaque puits. Ajouter 30 μL de la solution d’ILY diluée en série de la plaque de dilution dans chaque puits. Ajouter 160 μL de 1x PBS pour porter le volume final à 200 μL par puits (concentration de départ : 4 ng/μL).
- Ajouter 10 μL de globules rouges humains dilués dans les puits témoins. Ajouter 190 μL d’eau ou 1x PBS dans les puits de contrôle pour les contrôles négatifs. Mélangez les assiettes en les tapotant doucement.
- Incuber les plaques à 37 °C pendant 30 min pour permettre à l’hémolyse de se produire. Centrifugez les plaques à 3 000 x g pendant 5 minutes pour granuler les globules rouges humains intacts.
- Transférez avec précaution 100 μL du surnageant de chaque puits dans une nouvelle plaque à fond plat de 96 puits. Mesurer l’absorbance des surnageants à 405 nm à l’aide d’un lecteur de microplaques.
- Calculer l’activité hémolytique de l’ILY en comparant les valeurs d’absorbance des échantillons à celles du témoin16.
6. Traitement au tamoxifène, épuisement et régénération du RM
- Préchauffer l’huile de maïs à 42 °C. Dissoudre 100 mg de tamoxifène dans 5 mL d’huile de maïs préchauffée pour préparer une solution mère à une concentration de 20 mg/mL.
- Administrer du tamoxifène par voie intrapéritonéale (i.p.) à des souris mâles CX3CR1CreER+/-/ihCD59+/- âgées de 10 à 12 semaines à une dose de 100 μg/g de poids corporel. Répétez l’injection de tamoxifène pendant 3 jours consécutifs.
- Attendez 15 jours après l’injection finale de tamoxifène pour permettre l’expression de hCD59 médiée par Cre.
- Injecter une dose unique d’intermèlysine (ILY) par voie intraveineuse à des souris CX3CR1CreER+/-/ihCD59+/- et à des témoins CX3CR1CreER+/-/ihCD59-/- à une dose de 120 ng/g de poids corporel.
- Surveiller et confirmer l’ablation du MR et la régénération subséquente en effectuant une cytométrie en flux 1, 3 et 7 jours après l’administration de l’ILY17.
7. Euthanasie de souris
- Placez l’animal dans une chambre appropriée et exposez-le à l’isoflurane conformément aux protocoles de l’IACUC. Vérifiez l’anesthésie en vérifiant l’absence de réflexes, tels que le réflexe de retrait de la pédale.
- Une fois que la souris est complètement anesthésiée et ne répond plus, effectuez une luxation cervicale pour assurer l’euthanasie. Confirmer l’euthanasie en vérifiant l’absence de réflexes, tels que le réflexe de retrait de la pédale.
- Faites une incision médiane d’environ 2 cm sur l’abdomen à l’aide d’un scalpel stérile et rétractez doucement la peau pour exposer la cavité thoracique. Ouvrez la cage thoracique le long du sternum à l’aide de ciseaux chirurgicaux à bout émoussé pour exposer le cœur.
- Insérez une aiguille 21G-23G dans le ventricule gauche. Commencer la perfusion avec 10 à 20 ml de PBS froid pour évacuer le sang.
- Ouvrez l’oreillette droite pour permettre au sang de s’écouler de la circulation. Continuez la perfusion jusqu’à ce que les reins apparaissent pâles, indiquant une clairance sanguine efficace.
- Placez les reins contre la paroi dorsale du corps. Séparez doucement les reins des tissus environnants à l’aide de pinces et de ciseaux. Excisez les capsules rénales et placez immédiatement les reins dans du PBS froid pour éviter la dégradation.
8. Digestion rénale
- Préparez le cocktail d’enzymes de digestion en mélangeant 9 ml de HBSS (sans Ca/Mg), 1 ml de collagénase IV (5 mg/mL) et 20 μL de DNase I (10 mg/mL). Préparez la solution enzymatique fraîche et conservez-la sur de la glace jusqu’à utilisation.
- Coupez les reins en minuscules fragments (idéalement ≤ 1 mm) à l’aide de ciseaux stériles dans une boîte de Pétri contenant 5 ml de HBSS. Transférez les fragments de tissu rénal dans des tubes de 15 mL contenant 10 mL de la solution enzymatique préparée.
- Incuber les tubes à 37 °C pendant 30 min en agitant doucement pour dissocier les tissus. Triturez doucement le tissu à l’aide d’une pipette ou d’un piston de seringue pour dissocier davantage les amas cellulaires.
- Éliminez les débris tissulaires en faisant passer la suspension cellulaire à travers une crépine cellulaire de 40 μm. Centrifuger la suspension cellulaire à 650 x g pendant 10 min à 18 °C.
- Décantez soigneusement le tampon après la centrifugation. Remettre la pastille en suspension dans 5 mL de tampon de lyse et l’incuber pendant 5 min à température ambiante pour lyser les globules rouges.
- Lavez les cellules avec du PBS pour éliminer le tampon de lyse. Maintenez la suspension unicellulaire résultante sur de la glace jusqu’à ce qu’elle soit utilisée ultérieurement.
9. Centrifugation à gradient de densité
- Pour enrichir les cellules hématopoïétiques, remettre en suspension la pastille cellulaire du lavage précédent dans 10 ml de solution à gradient de densité de 30 %. Superposer soigneusement la solution sur 3 mL de solution à gradient de densité de 70 % dans un tube à centrifuger.
- Centrifuger le gradient à 500 x g pendant 30 min sans freiner. Après la centrifugation, recueillir soigneusement la couche d’interphase entre les solutions à 30 % et à 70 %; Cette couche contient les cellules individuelles enrichies.
- Laver les cellules collectées 2 fois avec 10 mL de PBS en les centrifugant à 500 x g pendant 10 min à chaque fois. Remettre en suspension la pastille de cellule finale dans 1 mL de tampon FACS (1x PBS avec 2 % FBS) dans un tube de 1,5 mL.
- Comptez les cellules à l’aide d’un hémocytomètre sous un microscope à fond clair. Ajustez la concentration cellulaire à 2 x 106 cellules/mL.
10. Coloration par cytométrie en flux, acquisition
- Ajuster la concentration cellulaire à partir de suspensions unicellulaires préparées à partir de tissu rénal de souris à 2-3 x 106 cellules/mL pour l’analyse cytométrique en flux.
- Granulez les cellules dans des tubes de 1,5 mL en les centrifugant à 650 x g pendant 5 min. Remettre la pastille de cellule en suspension dans 1 mL de tampon FACS.
- Ajouter l’anticorps anti-CD16/32 à une dilution de 1:200 pour bloquer la liaison non spécifique du récepteur Fc. Incuber les cellules pendant 15 min à température ambiante.
- Utilisez le colorant Aqua Live/Dead pour distinguer les cellules vivantes des cellules mortes, en suivant les instructions du fabricant.
- Colorer les cellules avec des anticorps préconjugués à une dilution de 1:100, y compris CD45-e450, CD11b-PE-Cy7, hCD59-PE et F4/80-BV605. Ajoutez le cocktail d’anticorps à la suspension cellulaire.
- Incuber l’échantillon pendant 30 min à 4 °C dans l’obscurité pour protéger les fluorophores du photoblanchiment. Laver les cellules colorées 2 fois avec un tampon FACS (PBS avec 2 % de sérum de bovin fœtal) par centrifugation à 650 x g pendant 5 min.
- Fixez les cellules dans du paraformaldéhyde à 1 % (PFA) pendant 30 min sur de la glace. Lavez les cellules fixes 2x avec un tampon FACS pour éliminer les résidus de PFA.
- Acquérir des cellules colorées et fixées à l’aide d’un cytomètre en flux. Analysez les données à l’aide du logiciel.
- Identifier les macrophages et les microglies résidant dans les reins et les autres tissus à l’aide des marqueurs CD45, CD11b et F4/80, comme décrit à lasection 9 .
- Effectuez un déclenchement initial pour sélectionner des cellules vivantes en fonction des profils de diffusion directe (FSC) et de diffusion latérale (SSC). Éliminez les doublets en fonction de la zone de diffusion vers l’avant (FSC-A) par rapport à la hauteur de diffusion vers l’avant (FSC-H). Excluez les cellules mortes à l’aide du colorant de viabilité LIVE/DEAD.
- Enrichir les cellules immunitaires en se concentrant sur les populations CD45+. Définir les macrophages résidents du rein comme des cellules CD11b+F4/80++ au sein de la population CD45+, comme le montre la stratégie de déclenchement (Figure 2A).
- Définir les populations de microglies comme des cellules CD11b + CD45iⁿt (Figure 2B). Effectuer l’acquisition de données sur le cytomètre en flux. Effectuez l’analyse finale à l’aide du logiciel pour compléter l’étude de cytométrie en flux.
Résultats
La purification de l’ILY recombinant His-Tag a suivi le même protocole que celui décrit précédemment en14. ILY a été exprimé avec succès dans les cellules d’E. coli BL21(DE3), transformées avec un plasmide codant pour le gène ILY de Streptococcus intermedius. Lors de l’induction avec IPTG, la surexpression de la protéine cible était évidente. Après l’expression, ILY a été purifié à l’aide d’une chromatographie d’affinité nickel-NTA, en exploitant une étiquette His-tag C-terminale pour une liaison spécifique. La pureté et la masse moléculaire de l’ILY (~54 kDa) ont été confirmées par l’analyse SDS-PAGE (figure 1A). L’intensité de la bande protéique a été quantifiée par densitométrie à l’aide du logiciel ImageJ, et la concentration en protéines a été vérifiée par analyse spectrophotométrique, ce qui a donné une concentration finale de 1,27 mg/mL. L’activité biologique de l’ILY purifié a été évaluée à l’aide d’un test d’hémolyse avec des globules rouges humains (GR), un test standard pour évaluer les cytolysines dépendantes du cholestérol. Le test a démontré une activité hémolytique dose-dépendante, confirmant l’intégrité fonctionnelle de la protéine recombinante. Une hémolyse complète a été obtenue avec le témoin positif (eau), tandis qu’aucune hémolyse n’a été obtenue avec le témoin négatif (tampon BPS). L’ILY purifié a montré une puissante activité hémolytique, avec une lyse de 50 % des hRBC observée à une concentration de 7,24 ng/mL et une hémolyse presque complète (99,62 %) à 650 ng/mL (figure 1B). Ces résultats confirment que l’ILY recombinant conserve son activité caractéristique de formation de pores, compatible avec les propriétés des cytolysines dépendantes du cholestérol. L’expression et la purification réussies d’ILY ont permis d’obtenir une protéine recombinante très pure, et son activité hémolytique a confirmé le bon repliement et la préservation de ses propriétés cytolytiques fonctionnelles.
Les MR sont très vulnérables aux conditions pathologiques et peuvent être essentiels à l’avancement des stratégies thérapeutiques, de sorte qu’une compréhension approfondie de la façon dont ils se reconstituent après l’épuisement de la niche est cruciale18. Pour appauvrir et manipuler la niche des macrophages rénaux, nous avons ciblé l’interaction spécifique entre l’ILY et le CD59 humain (hCD59), qui facilite l’ablation sélective des cellules exprimant le hCD59 chez la souris13. L’administration d’ILY chez des souris exprimant hCD59 inductibles croisées avec diverses lignées Cre-driver permet une ablation rapide et précise des cellules immunitaires et épithéliales sans effets hors cible13. Pour obtenir une déplétion sélective des MR, nous avons administré ILY 15 jours après l’induction du tamoxifène dans CX3CR1CreER+/-/ihCD59+/- souris. Ce moment a été choisi pour deux raisons essentielles. Tout d’abord, au 15e jour, presque toutes les cellules CX3CR1+ du cerveau et des reins de ces souris continuent d’exprimer hCD59, tandis que l’expression de hCD59 est minime ou absente dans le sang, la rate, les poumons, la moelle osseuse et le foie. Deuxièmement, en raison de la grande taille de l’ILY (54 kDa), il est incapable de traverser la barrière hémato-encéphalique, ce qui garantit que les cellules microgliales exprimant le hCD59 ne sont pas affectées9. Pour valider cela, nous avons quantifié les macrophages CD11b+CX3CR1+ marqués hCD59 dans plusieurs organes 15 jours après le traitement au tamoxifène. Nous avons observé une rétention stable des macrophages hCD59+ dans les reins et le cerveau (~90 %), tandis que l’expression était ≤ 5 % dans les autres tissus. Après l’administration d’ILY, nous avons obtenu une déplétion complète et sélective des macrophages rénaux, sans déplétion détectable de la microglie, confirmant que l’ILY ne pénètre pas la barrière hémato-encéphalique (Figure supplémentaire 2A - B). Pour confirmer la stabilité de l’expression de CD59 et la dynamique de la repopulation des macrophages résidents du rein (KRM), nous avons évalué l’expression de hCD59 sur les KRM 15 et 30 jours après l’induction du tamoxifène. Les analyses par cytométrie en flux ont confirmé que l’expression de hCD59 reste stable dans le temps (Figure supplémentaire 2C). De plus, pour évaluer la fuite potentielle indépendante de Cre de la CX3CR1CreER+/-/ihCD59+/- modèle, nous avons évalué l’expression de hCD59 chez des souris traitées à l’huile de maïs. Ces souris ont présenté une population CD11bintF480hihCD59+ négligeable (0,93 %) CD11b+CX3CR1+hCD59+ (1,8 %), En revanche, les souris traitées au tamoxifène ont montré une augmentation marquée dans les deux populations (87 % et 81 %, respectivement), confirmant une recombinaison robuste médiée par Cre avec une fuite basale minimale (Figure supplémentaire 2D). Ces résultats valident la spécificité du système inductible et soutiennent l’utilisation de témoins traités par véhicule dans les études futures. (Figure supplémentaire 2D). Comme le montre le Graphique 2A - L, l’épuisement des MR a été réalisé efficacement en un jour après l’administration de l’ILY CX3CR1CreER+/-/ihCD59+/- chez les souris, bien qu’aucun épuisement ne se soit produit chez les souris témoins (CX3CR1CreER+/-/ihCD59-/-). Trois jours après l’injection, la population de MR a commencé à se rétablir, atteignant environ 50 % de son niveau initial. Au jour 7, il était rétabli à près de 88 % (Graphique 2B - L). Ensuite, nous avons étudié l’origine des MR régénérés, qui pourraient provenir des monocytes, in situ prolifération de macrophages résiduels, ou une combinaison des deux. Seulement ~5 % des MR nouvellement générés exprimaient hCD59, ce qui suggère que in situ La prolifération joue un rôle minime dans leur repeuplement, et la majorité d’entre eux proviennent probablement du recrutement de monocytes (Figure 2D). Ces résultats sont cohérents avec les observations précédentes9 et fournissent des informations précieuses sur les mécanismes sous-jacents à la régénération des MR, mettant en évidence la prédominance de la reconstitution dérivée des monocytes après l’épuisement de la niche des macrophages. Les données représentatives présentées dans cette étude s’alignent sur les résultats que nous avons précédemment rapportés9 .
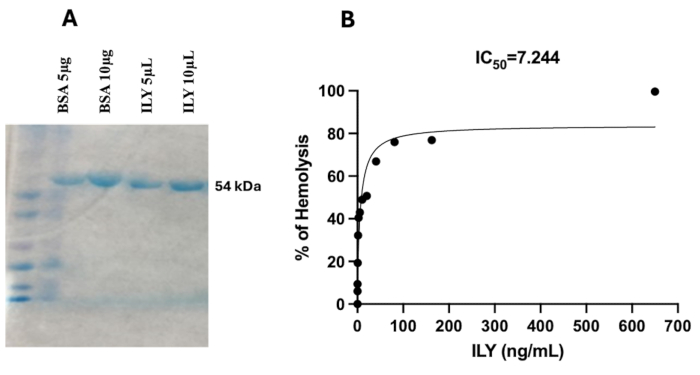
Figure 1 : SDS-PAGE et test d’hémolyse de la protéine ILY recombinante. (A) L’image du gel SDS-PAGE montre la protéine intermédilysine recombinante (ILY) purifiée. Une seule bande est visible à la masse moléculaire attendue de 54 kDa, confirmant l’expression et la purification réussies d’ILY. La pureté des protéines est évidente, sans bandes contaminantes majeures observées. Un marqueur de poids moléculaire (échelle) est inclus à titre de référence, démontrant le positionnement correct de la protéine ILY par rapport aux poids moléculaires connus. (B) Ce graphique présente l’activité hémolytique dose-dépendante des ILY purifiés sur les globules rouges. Le pourcentage de lyse cellulaire est représenté en fonction des concentrations croissantes d’ILY, et la CI50, ou la concentration nécessaire pour lyser 50 % des cellules, a été déterminée à 7,224 ng/mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.
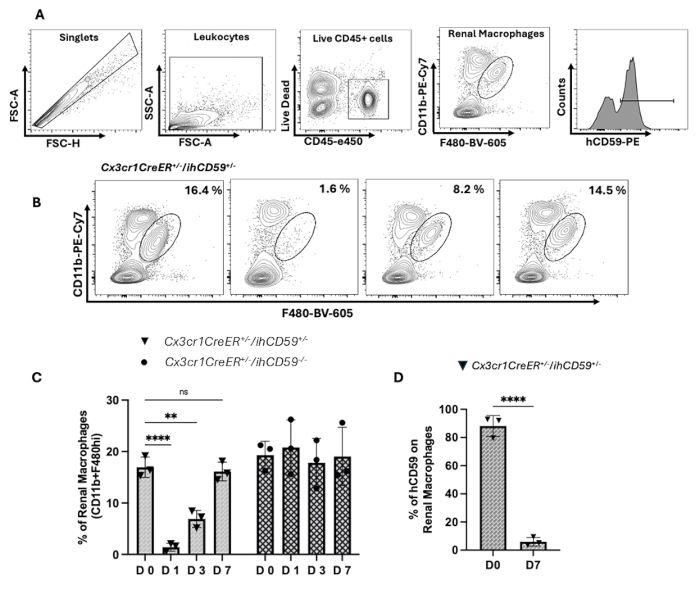
Figure 2 : Ablation et régénération des macrophages résidents du rein (MR) après l’injection d’ILY. (A) Stratégie de déclenchement utilisée pour identifier les macrophages rénaux (MR), définis comme des cellules élevées CD11b+F4/80^, à partir de suspensions unicellulaires de tissu rénal. Le contrôle initial a exclu les débris, les doublets et les cellules mortes, puis a sélectionné les cellules CD11b+ et F4/80high. (B) Analyse par cytométrie en flux montrant le pourcentage de populations de MR (CD11b+F4/80^hi) au départ (jour 0) et après l’injection d’ILY aux jours 1, 3 et 7. (C) La proportion de cellules MR par rein à divers moments (jours 0, 1, 3 et 7) après l’administration intraveineuse (i.v.) d’ILY (120 ng/g de poids corporel). Comparaison entre les souris Cx3cr1CreER+/-/ihCD59+/- et Cx3cr1CreER+/-/ihCD59-/- (n=3, deux expériences indépendantes, ANOVA à deux facteurs). (D) Expression de CD59 humain (hCD59) sur les macrophages résidents du rein chez les témoins au jour 0 et dans les MR régénérés au jour 7 après l’injection d’ILY. L’analyse par cytométrie en flux a révélé une expression réduite de hCD59 dans les MR régénérés par rapport aux populations de MR d’origine (n = 3, deux expériences indépendantes, tests t non appariés). Les données sont représentatives de deux expériences indépendantes avec n = 3 souris par groupe à chaque point temporel. Les résultats sont présentés sous forme de moyenne ± d’écart-type (ET), *p < 0,05 indiquant la signification statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Séquences ILY dans le vecteur d’expression bactérienne pTrcHis-A. Les séquences de régions limites 5' et 3' d’ILY dans le vecteur sont surlignées en jaune. Veuillez cliquer ici pour télécharger cette figure.
Figure supplémentaire 2 : Validation de l’expression et de la stabilité de hCD59 induites par le tamoxifène dans les cellules CD11b + CX3CR1 + à travers différents tissus et efficacité de recombinaison médiée par Cre. (A) Analyse par cytométrie en flux des macrophages CD11b+CX3CR1+ marqués hCD59 dans plusieurs organes 15 jours après l’induction du tamoxifène, montrant une rétention stable des macrophages hCD59+ dans le rein et le cerveau (~90 %), tandis que l’expression était ≤ 5 % dans d’autres tissus. (B) Après l’administration d’ILY le jour 1, la microglie n’a pas été affectée, confirmant que l’ILY ne traverse pas la barrière hémato-encéphalique. (C) Stabilité de l’expression de hCD59 sur les macrophages résidents du rein (KRM) 15 et 30 jours après l’induction du tamoxifène, évaluée par cytométrie en flux. (D) Évaluation de la fuite indépendante de Cre chez les souris CX3CR1CreER+/-/ihCD59+/ . Les souris traitées avec un véhicule (VC = huile de maïs) ont présenté une population CD11b+CX3CR1+hCD59+ (1,8 %) négligeable (1,8 %), tandis que les souris traitées au tamoxifène ont montré une augmentation marquée de 87 % et 81 %, confirmant l’efficacité de la recombinaison induite par le tamoxifène. Veuillez cliquer ici pour télécharger cette figure.
Discussion
L’expression, la purification et la validation fonctionnelle réussies de l’ILY recombinant marqué à His dans cette étude ont suivi un protocole15 bien établi. Cependant, le processus comportait plusieurs étapes critiques qui garantissaient un rendement élevé en protéines, une pureté et une activité biologique. L’induction des cellules E . coli BL21 (DE3) avec l’IPTG a été optimisée pour équilibrer les niveaux d’expression des protéines tout en minimisant la formation de corps d’inclusion. Malgré la robustesse de ce protocole, certaines modifications et étapes de dépannage ont été nécessaires pour maximiser le rendement et la fonctionnalité. L’une des principales modifications a été l’optimisation de la concentration et de la température d’induction de l’IPTG, car une expression excessive à des températures plus élevées conduisait à des agrégats insolubles. Une augmentation progressive de l’IPTG de 0,2 mM à 0,5 mM à 37 °C a considérablement amélioré la solubilité. De plus, pendant la purification, les concentrations d’imidazole dans les tampons de lavage ont été soigneusement ajustées pour minimiser la liaison aux protéines non spécifiques tout en conservant une élution efficace.
Dans ce manuscrit, nous décrivons un protocole très spécifique pour l’ablation sélective et la régénération ultérieure des macrophages rénaux (MR) à l’aide du système ILY-hCD59. Cette approche offre des avantages uniques pour l’étude de la biologie et de la régénération des macrophages par rapport aux techniques d’ablation traditionnelles, qui manquent souvent de spécificité ou induisent des effets hors cible. L’étude souligne l’importance de méthodes précises pour disséquer le rôle des MR dans l’homéostasie rénale, la régulation immunitaire et la réparation des tissus. Les MR jouent un rôle essentiel dans le maintien de la fonction rénale, influençant les réponses immunitaires, la réparation des tissus et la fibrose. Les MR dérégulés sont impliqués dans plusieurs pathologies rénales, notamment l’inflammation chronique et l’altération de la régénération 11,17,18. Les approches actuelles pour la déplétion des macrophages, telles que les liposomes de clodronate, les systèmes de récepteurs de la toxine diphtérique (DTR) ou les knock-outs génétiques, souffrent souvent de limites telles que le manque de spécificité, les effets hors cible ou l’induction d’une mort cellulaire lente médiée par l’apoptose19. Ces limitations compliquent la capacité d’étudier la dynamique de régénération des macrophages. En revanche, le système ILY-hCD59 offre une ablation rapide et hautement spécifique des RM CX3CR1+ exprimant hCD59, fournissant une plate-forme puissante pour étudier la régénération de la niche des macrophages dans le rein. Il est important de noter que des études antérieures ont démontré que l’interaction ILY-hCD59 ne produit pas d’effets hors cible dans les tissus dépourvus d’expression de hCD59, assurant ainsi la spécificité et la reproductibilité de ce protocole13,14. Il convient de noter qu’une étude antérieure portant sur des reins de souris en bonne santé a mis en évidence deux sous-ensembles majeurs de MR, l’un Ccr2+RM et l’autre Cd63+RM20. Il serait intéressant de déterminer dans quelle mesure l’ILY élimine efficacement ces deux populations chez CX3CR1CreER+/-/ihCD59+/- traitées au tamoxifène dans des études futures.
Au-delà de la déplétion des macrophages, ce système fournit un outil polyvalent pour étudier les interactions entre les macrophages et d’autres types de cellules rénales. Par exemple, les cellules épithéliales tubulaires (TEC) dépendent de signaux dérivés de macrophages pour survivre et se réparer après une blessure21. La capacité d’épuiser et de régénérer les MR offre une occasion unique d’étudier comment la diaphonie macrophage-TEC influence la prolifération, la réparation et la fonction rénale globaledes TEC 22. De plus, le protocole peut être utilisé pour explorer le rôle des MR dans la régulation de la fibrose, où les macrophages pro-inflammatoires contribuent à la fibrogenèse et les macrophages réparateurs soutiennent la résolution de la fibrose23. Les connaissances acquises grâce à ces études pourraient guider le développement de thérapies ciblant les macrophages visant à moduler la fibrose dans les maladies rénales chroniques. Les implications de cette méthode s’étendent au-delà de la biologie des macrophages, car elle facilite l’étude des interactions des MR avec d’autres types de cellules rénales, y compris les cellules endothéliales et les péricytes. Ces cellules sont essentielles au maintien de l’intégrité vasculaire et à la régulation de l’inflammation24. Le système ILY-hCD59 offre une plate-forme pour étudier comment la déplétion et la régénération de RM affectent la santé vasculaire rénale et la fonction rénale globale, offrant une fenêtre sur les implications plus larges de l’activité des macrophages dans la maladie rénale.
Bien que la technique d’appauvrissement basée sur ILY offre une grande spécificité, elle présente des limites inhérentes. La méthode repose sur l’expression de hCD59, limitant son application aux modèles transgéniques exprimant CD59 humanisé et limitant la généralisabilité aux souris non transgéniques. De plus, comme démontré, l’ILY n’épuise pas les cellules microgliales dans CX3CR1CreER+/-/ihCD59+/- (Figure supplémentaire 1B), l’outil d’ablation ILY/hCD59 ne peut pas être utilisé pour une manipulation spécifique de la population microgliale. De plus, bien que l’ILY épuise sélectivement les macrophages hCD59+, il ne fait pas la distinction entre les sous-ensembles distincts de macrophages dans le rein.
En plus de son utilité dans le rein, la plateforme ILY-hCD59 a démontré une large applicabilité dans l’étude de la capacité de régénération d’autres types de cellules. Par exemple, ce système a été utilisé pour ablater les cellules des canaux biliaires, ce qui a permis d’étudier la régénération des canaux biliaires, de cibler les adipocytes et de faciliter les études des lésions hépatiques médiées par les adipocytes25,26. De plus, il a été utilisé pour ablater les cellules intercalaires rénales, facilitant ainsi la recherche sur la régénération des cellules intercalaires27. Ces applications mettent en évidence la polyvalence du système ILY-hCD59 pour faire progresser notre compréhension de la régénération cellulaire et de la réparation tissulaire dans plusieurs systèmes d’organes. En résumé, le système ILY-hCD59 représente une avancée significative dans les protocoles d’ablation des macrophages. Sa spécificité, l’absence d’effets hors cible et sa capacité à faciliter des études détaillées de la régénération des MR constituent une plate-forme solide pour l’étude de la biologie des macrophages dans la santé et les maladies rénales. De plus, les connaissances acquises grâce à ce protocole feront non seulement progresser notre compréhension de la fonction des macrophages, mais éclaireront également les stratégies thérapeutiques pour les maladies rénales, la fibrose et la dynamique de la réparation cellulaire dans divers types de tissus.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents ou de relations personnelles qui auraient pu sembler influencer le travail rapporté dans ce manuscrit. Aucun conflit d’intérêts, y compris des affiliations financières, non financières, professionnelles ou personnelles, n’a influencé la conception, la conduite, l’interprétation ou la présentation de l’étude.
Remerciements
Nous exprimons notre gratitude aux membres passés et actuels du Qin Lab pour leurs contributions au développement et au perfectionnement des protocoles utilisés dans cette étude. Nous remercions également le groupe du Dr R. K. Tweten du Centre des sciences de la santé de l’Université de l’Oklahoma pour avoir généreusement fourni le plasmide recombinant LILY, qui a joué un rôle déterminant dans cette recherche. Cette étude a été financée par les National Institutes of Health (NIH) par le biais des subventions NIH 5 P51OD011104-58, R01DK129881 (X.Q.) et R21OD024931 (X.Q.).
matériels
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Millipore | SLHVR33RS | |
| 4-15% TGX Stain-Free Protein Gels | Bio-Rad | 4568084 | |
| 6X Loading buffer | Fisher | 50-103-6570 | |
| 70% Ethanol | WWR Life Science | 64-17-5 | |
| ACK (Ammonium-Chloride-Potassium) Lysing Buffer | Gibco | A1049201 | |
| Affinity resin beads | Millipore | 69670 | |
| Ampicillin sodium solution | Zymo Research | A1001-5 | |
| Anti-CD11b-PE-Cy7 (Clone M1/70) | Invitrogen | 25-0112-82 | |
| Anti-CD16/32 (FcγRIII/II, Clone 93) | eBioscience | 48-0161-80 | |
| Anti-CD45-e450 (Clone 30-F11) | eBioscience | 48-0451-82 | |
| Anti-F4/80-BV605(Clone BM8) | BioLegend | 123133 | |
| Anti-hCD59-PE (Clone OV9A2) | Invitrogen | 12-0596-42 | |
| Aqua Live/Dead dye | Invitrogen | L34957A | |
| Beads (resin) | Millipore | 69670 | |
| Benzonase Nuclease | Millipore | 70664-10KUN | |
| BugBuster protein extraction reagent | Millipore | 70584-4 | |
| Centrifuge for microtubes | Eppendorf | 5424 | |
| Centrifuge for tubes | Thermo Scientific | 75-001-241 | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Corn oil | Sigma Aldrich | C8267 | |
| Deoxyribonuclease (DNAse) I | Worthington Biochemical Corporation | LS002007 | |
| Detoxi-Gel resin column | Millipore | 69670 | |
| DPBS (Dulbecco’s phosphate-buffered saline) solution | Corning | 21-031-CV | |
| EDTA tubes | BD | 365974 | |
| FBS (Fetal bovine serum) | Gibco | 10082-139 | |
| Glycerol | Fisher | BP229-1 | |
| HBSS (Hank’s Ballanced Salt Solution) | Gibco | 24020117 | |
| IPTG (Isopropyl β-D-1-thiogalactopyranoside) | Millipore-Sigma | 206-703-0 | |
| Isoflurane | VET one | 502017 | |
| LB media | |||
| LSRFortessa flow cytometer | BD Biosciences | ||
| MES [2-(N-morpholino) ethanesulfonic acid] | Fisher | 50-488-796 | |
| MOPS [3-(N-morpholino) propanesulfonic acid] | Fisher | 50-213-522 | |
| Percoll density gradient media | Cytiva | 17089101 | |
| Peristaltic pump | Fisher Scientific | Discontinued now, use alternative | |
| PFA (Paraformaldehyde) | Thermo Scientific | I28800 | |
| Purification column | Millipore | UFC900308 | |
| rLysozyme solution | Novagen | 20C71110 | |
| Shaking water bath | Thermo Scientific | TSSB15 | |
| Slide-A-Lyzer dialysis kit | Thermo | 66107 | |
| Sodium deoxycholate | Fisher | BP349-100 | Fresh made or less than a month |
| Sterile cell strainer (40 μm) | Fisher Scientific | 22-363-547 | |
| Tamoxifen | Sigma Aldrich | 6734 | |
| Ultra centrifugal filter | Millipore | UFC900308 | |
| Ultrapure water | Thermo | 10977-015 | |
| Vortex mixer | Fisher Scientific | 2215365 | |
| β-ME (β-mercaptoethanol) | Fisher | BP176-100 |
Références
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon