Method Article
Évaluation de la dominance sociale dans des modèles murins à l’aide du test en tube
Dans cet article
Résumé
Ce protocole décrit un test comportemental pour évaluer la dominance sociale chez les rongeurs à l’aide du test en tube. La dominance sociale reste stable au fil du temps, et plusieurs modèles de troubles développementaux et neurologiques présentent de fortes anomalies de dominance sociale. Par conséquent, le test en tube sert de mesure de résultat pratique pour les études mécanistes ou le dépistage thérapeutique préclinique.
Résumé
La dominance sociale est altérée dans les maladies neurodéveloppementales et neurodégénératives et sert de mesure de résultat utile dans les études précliniques de ces troubles. Le test en tube est un test comportemental simple pour évaluer la dominance sociale qui ne nécessite pas d’équipement coûteux. Dans ce test, deux souris entrent aux extrémités opposées d’un tube en plastique transparent, et après s’être rencontrées au milieu, l’une d’entre elles (la moins dominante) doit reculer. Le test en tube peut être utilisé pour les souris mâles et femelles et comprend plusieurs paramètres adaptables pour répondre aux besoins de l’enquêteur. Les souris peuvent être testées contre plusieurs adversaires uniques pour fournir un indice de dominance sociale. La dominance sociale dans l’essai en tube reste stable au fil des tests répétés et est corrélée avec la performance dans d’autres essais sociaux. De plus, le test peut être effectué entre compagnons de cage pour évaluer les hiérarchies de dominance sociale à l’intérieur de la cage. Le test en tube est particulièrement utile dans les études thérapeutiques précliniques, car il permet des tests longitudinaux avant et après les interventions expérimentales. Par conséquent, il s’agit d’une mesure de résultat pratique pour les études mécanistes et le dépistage thérapeutique préclinique.
Introduction
La perturbation du comportement social est une caractéristique de nombreux troubles humains, y compris les troubles du développement, psychiatriques et neurodégénératifs 1,2. Des modèles murins sont utilisés pour mieux comprendre la pathogenèse de ces troubles et pour fournir une plate-forme pour les essais précliniques de traitements. Cependant, de nombreux tests sur le comportement social de la souris prennent du temps à réaliser, nécessitent un équipement coûteux et/ou un logiciel de suivi vidéo pour analyser, ou ont des algorithmes de notation subjectifs. En revanche, le test de dominance sociale en tube est rapide et simple à réaliser et ne nécessite aucun équipement spécialisé ni suivi vidéo. Le test a un résultat binaire gagnant/perdant, ce qui rend l’interprétation des résultats simple.
Le test en tube pour la dominance sociale a été développé par Lindzey et ses collègues dans le but d’évaluer la dominance sociale chez les souris3. Depuis son développement, le test sur tube a également été établi comme un moyen d’évaluer les hiérarchies de dominance sociale à l’intérieur de la cage4. Les phénotypes des tests en tube sont corrélés avec d’autres mesures de dominance sociale comme le barbier, la compétition de récompense et la fabrication d’urine chez les souris mâles5. Cependant, les résultats de l’essai en tube sont mitigés et sa corrélation avec la compétition pour l’accès à la nourriture et à l’eau et l’agression 3,6,7. Il est important de noter que les phénotypes des tests en tube sont corrélés avec d’autres phénotypes sociaux tels que la sociabilité à trois chambres 8,9.
L’un des avantages du test en tube est que son anatomie est bien définie, ce qui le rend particulièrement utile dans divers modèles de souris, y compris les modèles de troubles du spectre autistique et d’autres maladies caractérisées par des déficits sociaux comme la démence frontotemporale 8,9,10,11,12,13,14,15,16 . Le cortex préfrontal médian (mPFC) est un médiateur clé du comportement des tests de tube de souris6. Wang et ses collègues ont montré que l’activité dans le mPFC entraîne la dominance sociale chez la souris6, et des données plus récentes ont affiné cette idée en montrant que l’entrée thalamique médiodorsale dans les cortex prélimbique et cingulaire antérieur entraîne la dominance sociale17. Conformément à un rôle clé du mPFC dans la dominance sociale du test en tube, les anomalies des arborescences dendritiques, des épines dendritiques, des récepteurs du glutamate et/ou de l’excitabilité neuronale, le mPFC a été associé à des anomalies du test en tube dans des modèles de rongeurs de troubles du spectre autistique15,18, de démence frontotemporale 8,19, de stress chronique20 et d’isolement social21.
Un autre avantage clé du test en tube est la possibilité de tester la dominance sociale avant et après l’intervention thérapeutique, car la dominance sociale de la souris dans le test en tube est stable dans le temps, ce qui permet des tests répétés avant et après une intervention expérimentale 6,8,22,23. Un exemple de cela provient de modèles murins hétérozygotes de progranuline (Grn+/−) de démence frontotemporale causée par des mutations de la progranuline (GRN), une maladie d’haplosuffisance. Les souris hétérozygotes à la progranuline ont un déficit de dominance sociale8. Ce déficit peut être inversé en restaurant la progranuline par la thérapie génique AAV-progranuline22 ou l’administration d’anticorps anti-sortiline conçus pour réduire la dégradation de la progranuline23. Ces exemples démontrent l’utilité du test en tube dans la conception d’essais précliniques pour la recherche sur la démence.
Ce protocole fournit des méthodes de base pour effectuer le test en tube entre non-cagemates afin d’évaluer les différences entre les groupes expérimentaux, et entre les cagemates pour évaluer les hiérarchies de dominance sociale à l’intérieur de la cage.
Protocole
Toutes les procédures expérimentales ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Université de l’Alabama à Birmingham et exécutées conformément à l’Association pour l’évaluation et l’accréditation des soins aux animaux de laboratoire (AAALAC). Des souris hétérozygotes à la progranuline ont été générées et croisées sur un fond C57BL/6J comme décrit précédemment9. Les souris utilisées pour cette étude avaient été rétrocroisées sur le fond C57BL/6J sur au moins 12 générations. Des souris âgées de 9 à 16 mois ont été utilisées dans les données de l’échantillon. Les mâles et les femelles ont été utilisés dans cette étude. Les souris ont été maintenues sur un cycle lumière/obscurité de 12:12 h avec les lumières allumées à 06:00 h, et tous les tests ont été effectués pendant la phase d’éclairage. Les souris ont eu un accès ad libitum à la nourriture et à l’eau tout au long de toutes les expériences. Les détails des réactifs et de l’équipement utilisé sont répertoriés dans la table des matériaux.
1. Conception de correspondance d’essai de tube
- Planifiez les correspondances d’essai de tube avant de tester. Assurez-vous qu’il n’y a pas de note de génotype pour garder l’expérimentateur aveugle aux groupes (voir le tableau supplémentaire 1).
REMARQUE : Nous testons généralement des souris contre 3 adversaires uniques du groupe expérimental opposé 8,9,22,23, mais certaines études rapportent des tests contre plus d’adversaires 10,11,13. - Contrebalancez l’affectation des souris expérimentales aux côtés gauche et droit du tube pour éviter tout effet de confusion potentiel de biais latéral.
- Lorsque vous testez des souris qui ne sont pas en cage, minimisez le mouvement des cages pour éviter de stresser les souris plus que nécessaire. Pour minimiser le mouvement de la cage, chevauchez autant que possible les correspondances entre les deux mêmes cages.
- Lorsque vous testez des compagnons de cage, testez chaque souris d’une cage contre toutes les autres souris de manière circulaire. Si l’on répète le test sur plusieurs jours, le côté du tube dans lequel la souris doit entrer (c’est-à-dire gauche ou droite) doit être alterné d’un jour à l’autre.
2. Choix des tubes
REMARQUE : En règle générale, le test du tube est effectué avec des tubes en plastique transparent en PVC disponibles dans le commerce (voir le tableau des matériaux). Il est important de noter que ce protocole est optimisé pour les souris mais peut être appliqué à d’autres modèles de rongeurs tels que les rats, les campagnols et les hamsters2.
- Coupez le tube en PVC à une longueur de 30,5 cm. Le tube en PVC est légèrement flexible et est souvent stocké en rouleaux, il peut donc être nécessaire de le redresser avant de l’utiliser. Un chauffage doux aidera à redresser les tubes incurvés.
- Le diamètre intérieur du tube est essentiel pour le succès de l’essai. Assurez-vous que le tube est suffisamment grand pour que les souris puissent se déplacer, mais pas assez grand pour permettre aux souris de se croiser les unes sur les autres.
REMARQUE : Le test ne fonctionnera pas si le tube est suffisamment grand pour que les souris puissent se dépasser sans s’engager dans un concours de dominance sociale. Voici des lignes directrices approximatives pour des tailles de tube appropriées chez les souris C57BL/6J : (1) diamètre intérieur (ID) de 1 pouce/2,5 cm pour les souris mâles <6 mois, les souris femelles <9 mois ; (2) 1,25 pouce/3,2 cm de diamètre intérieur pour les souris mâles âgées de 6 à 9 mois, souris femelles >9 mois ; et (3) 1,5 pouce/3,5 cm de diamètre intérieur pour les souris mâles > 9 mois. - Si possible, utilisez un tube de la même taille pour tous les tests au sein d’un groupe de souris. Si les souris se croisent pendant les premières correspondances, exécutez toutes les correspondances suivantes avec le tube le plus petit suivant.
3. Lieu de test
- Effectuez le test du tube sur n’importe quelle surface plane et stable ou sur une hotte filtrée sous un éclairage ambiant.
REMARQUE : Le test est généralement effectué pendant la journée entre 8 h et 17 h. Dans les cas où les souris sont testées sur plusieurs jours, chaque souris doit être testée au même moment de la journée pour chaque test (par exemple, entre 11 h et 15 h). À notre connaissance, les effets de l’heure de la journée n’ont pas été étudiés auparavant. - Effectuez le test en tube dans un endroit calme avec un minimum de stimuli externes. Idéalement, l’enquêteur devrait être la seule personne dans la pièce.
4. Accoutumance
- L’habituation est une pratique importante dans les tests comportementaux qui permet aux souris de se familiariser avec l’environnement de test, ce qui peut conduire à des résultats plus cohérents et plus fiables24. Pour le test en tube, acclimatez les souris à la salle d’essai avant le test. Si les tests ne sont pas effectués dans la salle d’hébergement des animaux, laissez les souris s’habituer au moins 1 h à la nouvelle pièce avant de les tester.
- (Facultatif) Si vous le souhaitez, les souris peuvent être habituées au tube avant le test. Pour s’habituer au tube, placez la souris dans le tube sans adversaire et laissez-la traverser le tube 2 à 3 fois, 2 à 3 jours avant le test. Ce n’est pas notre pratique habituelle.
5. Test de tube standard
REMARQUE : (Facultatif) Les chercheurs qui débutent dans l’essai en tube peuvent souhaiter s’entraîner à placer des souris dans le tube en utilisant un groupe distinct de souris non expérimentales. Les enquêteurs doivent souvent s’entraîner à placer des souris dans le tube. Un enquêteur expérimenté induira moins de stress chez les souris subissant le test. Plus d’informations sur le placement des souris dans le tube sont données à l’étape 5.3.
- Placez toutes les cages contenant des souris du même sexe à tester sur un chariot. Transporter les cages jusqu’à la zone d’essai. Nettoyez les tubes et la zone d’essai avec de la chlorhexidine à 2 % suivie de l’éthanol à 70 %. Les tubes sont facilement nettoyés à l’aide d’une pipette sérologique de 50 mL en enfonçant une serviette en papier dans le tube.
- Placez les deux cages pour la première correspondance sur la surface d’essai. Retirez les couvercles et placez-les près de chaque cage.
- Localisez les deux souris à tester. Tenez une souris dans chaque main, correspondant à son côté assigné du tube. Après avoir trouvé la première souris, tenez doucement sa queue et gardez-la dans la cage pendant que vous cherchez la seconde.
REMARQUE : Tenir la queue de la souris près du centre de sa longueur permettra à l’enquêteur de contrôler doucement la souris sans la retenir trop serrée. Tenez la souris de manière à ce que ses quatre pattes restent sur la litière de la cage pour éviter de stresser inutilement la souris. - Retirez simultanément les deux souris de chaque cage et placez-les délicatement avec leur tête à l’entrée du tube.
REMARQUE : Si les souris ont été habituées ou ont déjà fait l’objet de tests, elles entrent généralement dans le tube en quelques secondes. Si les souris sont naïves face au tube, elles peuvent hésiter à entrer pour le premier essai. Si nécessaire, les souris peuvent être commutées dans le tube le plus grand suivant pour encourager l’entrée dans le tube. - Maintenez une prise sur la queue de chaque souris pour éviter que les souris n’entrent en contact prématurément. Assurez-vous que les souris ne sont pas forcées dans le tube. Cependant, une fois qu’ils commencent à entrer dans le tube, ils peuvent être doucement poussés pour encourager l’entrée complète dans le tube.
- Lorsque les deux souris sont entrées dans le tube, relâchez les queues et éloignez-vous du tube (Figure 1A). Les deux souris doivent avancer dans le tube et se rencontrer près du centre (Figure 1B).
- Observez le match et notez le gagnant et le perdant. On considère qu’une souris a perdu la correspondance lorsque deux de ses pattes sortent du tube et entrent en contact avec la surface d’essai (figure 1C).
REMARQUE : Une souris poussera généralement l’autre hors du tube, bien que certaines souris effectueront une retraite non forcée après avoir contacté la souris adverse. Parfois, les deux souris battent en retraite simultanément, ou l’une d’elles se retire immédiatement après être entrée dans le tube sans entrer en contact avec la souris adverse. Si l’un de ces événements se produit, remettez les deux souris dans le tube et relancez la correspondance. Les souris effectueront généralement une correspondance plus standard lors de la deuxième tentative. Si aucune des souris n’a reculé dans les 2 minutes, interrompez le match et exécutez-le à nouveau à la fin de la session.
- Observez le match et notez le gagnant et le perdant. On considère qu’une souris a perdu la correspondance lorsque deux de ses pattes sortent du tube et entrent en contact avec la surface d’essai (figure 1C).
- Une fois le match terminé, remettez les souris dans leurs cages d’origine. Nettoyez le tube et la surface d’essai avec de l’éthanol à 70 %.
- Continuez à exécuter des correspondances en utilisant la conception décrite à l’étape 1. Chaque tour commence immédiatement après le tour précédent. Lorsque tous les matchs d’un sexe ont été exécutés, remettez les cages dans le râtelier/chariot et testez les souris du sexe opposé en utilisant la même procédure.
- Nettoyez soigneusement la surface d’essai et les tubes entre les souris femelles et mâles en cours d’exécution. Une fois l’analyse terminée, nettoyez les tubes et la zone d’analyse avec de la chlorhexidine à 2 %.
- Pour l’analyse statistique, comptez le nombre de victoires pour chaque groupe et analysez à l’aide du test binomial pour comparer la distribution observée par rapport à la distribution attendue, la distribution attendue étant fixée à 50 % de victoires pour chaque groupe.
- Calculez le pourcentage de victoires pour chaque souris en divisant le nombre de victoires par le nombre de correspondances (généralement trois parties, sauf si une partie a été annulée en raison d’une souris manquante ou d’autres problèmes). Comparez le pourcentage de victoire pour chaque groupe à l’aide du test de Mann-Whitney.
REMARQUE : Si elles sont répétées, ces correspondances produisent des résultats similaires en l’absence de manipulations expérimentales supplémentaires. Par exemple, une étude précédente a observé que 40 des 47 matchs produisaient le même résultat lorsqu’ils étaient exécutés sur les jours8 successifs.
- Calculez le pourcentage de victoires pour chaque souris en divisant le nombre de victoires par le nombre de correspondances (généralement trois parties, sauf si une partie a été annulée en raison d’une souris manquante ou d’autres problèmes). Comparez le pourcentage de victoire pour chaque groupe à l’aide du test de Mann-Whitney.
6. Test à l’intérieur de la cage pour évaluer les hiérarchies de dominance sociale
REMARQUE : Les souris forment des hiérarchies de dominance sociale stables qui peuvent être révélées par des tests sur tube de toutes les souris dans une cage 4,6. Les souris mâles et femelles forment ces hiérarchies8. Les hiérarchies de dominance sociale sont mieux évaluées dans des cages contenant au moins 5 souris.
- Planifiez des correspondances à l’avance, avec un contrepoids comme décrit à l’étape 1.
- Exécutez des allumettes d’essai de tube comme décrit à l’étape 5. Testez une cage à la fois et testez toutes les souris en un tour de rôle. Nettoyez le tube et la zone de test avec de l’éthanol à 70 % entre chaque allumette.
- Testez chaque cage une fois par jour pendant au moins 5 jours pour établir les ordres de classement stables de chaque souris.
- À des fins d’analyse statistique, évaluez le nombre de victoires par souris. Classez chaque souris en fonction du nombre de victoires.
7. Utilisation du test en tube pour le dépistage thérapeutique préclinique
REMARQUE : La robustesse et la stabilité des phénotypes de dominance sociale dans de nombreux modèles de souris, ainsi que la facilité d’exécution du test en tube, font du test en tube un paradigme utile pour les tests précliniques de stratégies thérapeutiques. Pour cela, le test en tube peut être effectué en utilisant une conception à l’intérieur de l’animal, car le test peut être effectué en série. Il est également possible de faire un plan croisé avec le médicament, puis le contrôle ou vice-versa. Le test en tube a déjà été utilisé pour évaluer les thérapies stimulant la progranuline chez les souris Grn+/− 22,23, ce qui a montré que les phénotypes de dominance sociale sont réversibles dans ce modèle murin. Pour clarifier la discussion ci-dessous, les souris seront décrites comme « témoins » (de type sauvage, non transgéniques, etc.) ou « modèles » (knock-out, transgéniques, etc.), et les interventions expérimentales seront décrites comme « véhicule » ou « traitées » (intervention thérapeutique). Bien que les souris soient appelées « contrôle » et « modèle » ci-dessous, il est idéal d’utiliser des compagnons de portée pour chacun de ces groupes.
- Avant une intervention expérimentale, effectuez un pré-test pour confirmer la présence du phénotype de dominance sociale attendu chez les souris modèles à utiliser pour le test. Testez l’ensemble du groupe de souris témoins et modèles les unes par rapport aux autres et utilisez ces données pour attribuer des souris à des groupes de traitement afin de vous assurer que les groupes sont équilibrés au départ.
- Différentes durées de traitement peuvent être nécessaires en fonction du traitement. Par exemple, s’il s’agit d’un AAV, laissez les souris se remettre de la chirurgie et avoir le temps pour que le médicament fasse effet. S’il s’agit d’une petite molécule, déterminer les paradigmes de traitement avant le test en tube22.
- Assignez les souris à des groupes expérimentaux de sorte que les souris vehicules et traitées de chaque génotype aient des phénotypes de dominance sociale de base de degré similaire. Si des souris sont testées plusieurs fois contre plusieurs adversaires, le pourcentage de victoire de chaque souris (décrit à l’étape 5.9) peut être utilisé pour créer deux groupes avec des phénotypes similaires.
- Pour une distribution vraiment aléatoire des souris en groupes basée sur les directives ARRIVE, utilisez un protocole de randomisation par blocs basé sur le pourcentage de victoire de chaque souris8.
- Une fois les groupes attribués, testez les souris à plusieurs moments pendant le traitement. Pour plus de détails sur les comparaisons généralement effectuées, voir la REMARQUE ci-dessous :
REMARQUE : (1) Souris de contrôle du véhicule vs. souris modèle véhicule (il s’agit d’une comparaison de contrôle pour montrer que le traitement véhicule n’obscurcit pas le phénotype du modèle murin) ; (2) souris de contrôle de véhicule vs. souris modèles traitées (cela teste l’hypothèse selon laquelle les souris modèles traitées sont différentes des témoins normaux) ; (3) modèle de véhicule souris vs. souris modèles traitées (cela teste l’hypothèse selon laquelle le traitement modifie le phénotype du modèle murin) ; (4) souris de contrôle de véhicule vs. souris témoins traitées (il s’agit d’une comparaison de contrôle pour déterminer les effets du traitement chez les souris sans phénotype de dominance sociale). - En règle générale, les tests seront effectués sur deux jours, à raison d’environ 6 correspondances par jour, avec des comparaisons (1-4) mentionnées à l’étape 7.4. Pour éviter de trop tester, exécutez les comparaisons (1) et (2) le jour 1, et les comparaisons (3) et (4) le jour 2. Étant donné que les souris de contrôle du véhicule sont testées contre les deux groupes de modèles le jour 1, les correspondances de chaque comparaison doivent être intercalées.
- Une fois les tests terminés, remettez les souris dans leurs cages domestiques. Nettoyez le tube et la surface d’essai avec de l’éthanol à 70 %.
Résultats
Le test en tube a été largement utilisé dans un modèle murin de démence frontotemporale due à des mutations de la progranuline, Grn+/− souris 8,9,22,23,25. Ces souris présentent une faible dominance sociale à l’âge de 9 mois (figure 2A-D)8. Le phénotype de faible dominance sociale des souris Grn+/− plus âgées est stable grâce à des tests répétés (Figure 2A)8, ce qui en fait une mesure de résultat expérimentale robuste22,25.
Des tests à l’intérieur de la cage ont également été effectués chez des souris Grn+/− pour étudier les hiérarchies de dominance sociale entre les cagemates (Figure 3A-D)8. Il est important de noter que les souris mâles (Figure 3A, B) et femelles (Figure 3C, D) forment ces hiérarchies, et que les souris Grn+/− présentent également une faible dominance sociale parmi leurs cagemates (Figure 3E). Il est intéressant de noter que les souris Grn−/− n’avaient pas cette anomalie (Figure 3E).
Le phénotype de faible dominance sociale présenté par les souris Grn+/− plus âgées (Figure 2) en fait une mesure de résultat attrayante pour les interventions thérapeutiques stimulant la progranuline. Avant l’injection d’AAV, les souris Grn+/− présentent un phénotype de faible dominance sociale (Figure 4A). Les souris Grn+/− injectées avec un virus témoin présentent toujours un phénotype de faible dominance (Figure 4B). Les souris Grn+/− injectées avec un virus pour augmenter les niveaux de progranuline n’ont plus le phénotype de faible dominance sociale (Figure 4C). Lorsque l’on compare les souris Grn+/− injectées avec un AAV témoin aux souris Grn+/− injectées avec un AAV stimulant la progranuline, les souris Grn+/− injectées avec un AAV témoin présentent une faible dominance sociale (Figure 4D).
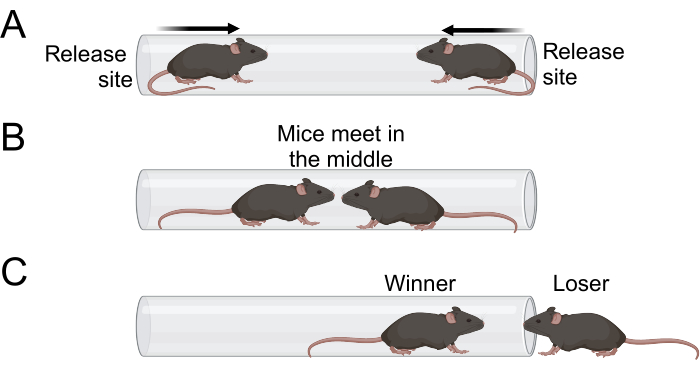
Figure 1 : Schéma de l’essai sur tube. (A) Les expérimentateurs libèrent les souris une fois qu’elles sont entrées dans le tube avec leurs quatre pattes. Le tube doit être suffisamment petit pour qu’une souris ne puisse pas se retourner ou grimper sur une autre souris. (B) Les deux souris se déplacent ensuite vers le milieu du tube, où elles se rencontrent. (C) La souris la plus dominante restera dans le tube, tandis que la souris la moins dominante se retirera. La souris est considérée comme perdante une fois que deux pattes sortent du tube. Veuillez cliquer ici pour voir une version agrandie de cette figure.
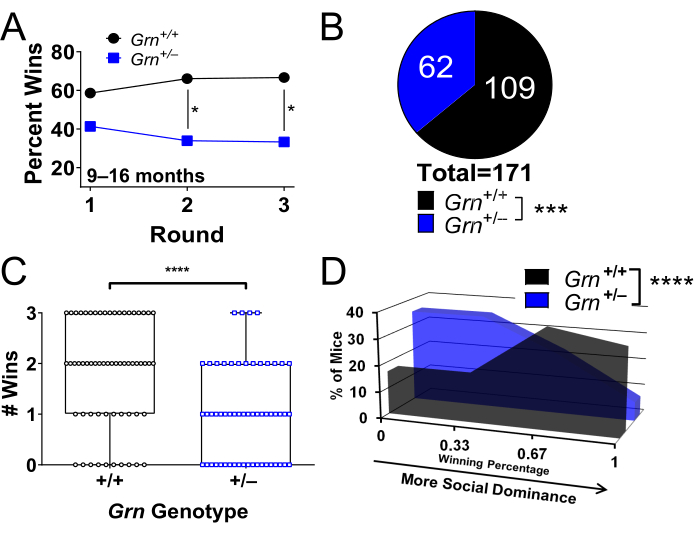
Figure 2 : Résultats représentatifs obtenus à l’aide du test en tube pour identifier un phénotype de dominance sociale. Cette étude portait sur le modèle murin Grn+/− de démence frontotemporale. Les souris ont été testées 3 tours contre 3 nouveaux adversaires, comme décrit à l’étape 1. Différentes façons de présenter les données sont présentées. (A) Les souris Grn+/− âgées de plus de 9 mois ont un phénotype de dominance sociale faible qui est stable lors de tests répétés (* = test binomial, p < 0,05 ; les points de données représentent le pourcentage de victoires de chaque génotype). (B) Données agrégées des trois séries de tests traçant le pourcentage global de victoires par génotype (*** = test binomial, p = 0,0004). (C) Tracez le nombre de victoires de chaque souris sur ses 3 matchs. Les souris Grn+/− ont eu un nombre inférieur de victoires (**** = test de Mann-Whitney, p < 0,0001). Chaque point est une souris. (D) Graphique du pourcentage de souris dans chaque génotype avec un pourcentage de victoire donné. Les souris Grn+/− étaient plus susceptibles d’avoir un faible pourcentage de victoires. (**** = test de Mann-Whitney, p < 0,0001). Souris âgées de 9 à 16 mois, n = 58 souris par groupe. Les données sont adaptées avec la permission d’Arrant et al.8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
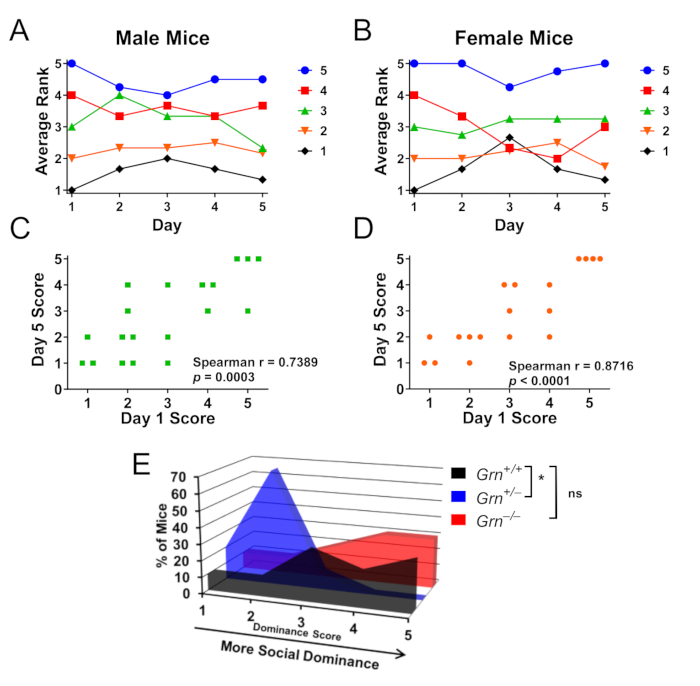
Figure 3 : Résultats représentatifs à l’aide du test en tube pour déterminer la hiérarchie de dominance sociale à l’intérieur de la cage. Des cages de souris mâles ou femelles (n = 4 cages par sexe de 4 à 5 souris chacune) ont été testées en alternance pendant 5 jours pour permettre de tester la hiérarchie de dominance sociale. (A,B) Les scores de dominance sociale des souris mâles et femelles ont été déterminés par le nombre de victoires, 5 étant la souris la plus dominante et 1 étant la souris la moins dominante dans chaque cage. Au jour 5, les souris mâles (A) et femelles (B) sont restées en moyenne à un rang de leur score initial. Le codage couleur se fait par classement du jour 1. (C, D) Le rang au jour 5 avait une corrélation très significative avec le rang au jour 1 pour les deux sexes. (E) En utilisant ce paradigme à l’intérieur de la cage pour évaluer les cages où les souris Grn+/+, Grn+/− et Grn−/− étaient logées en groupe, les souris Grn+/− présentaient également une faible dominance sociale (test de Kruskal-Wallis, p = 0,0063, * = p < 0,05 par le test post-hoc de Dunn). Il est intéressant de noter qu’une faible dominance sociale n’a pas été observée chez les souris Grn−/− . Les données sont adaptées avec la permission d’Arrant et al., 20168. Veuillez cliquer ici pour voir une version agrandie de cette figure.
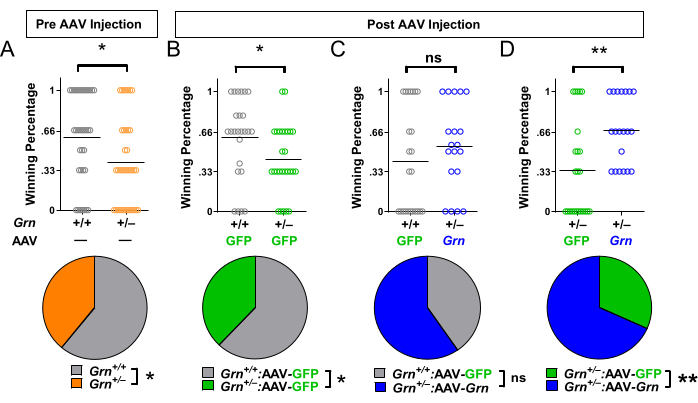
Figure 4 : Résultats représentatifs obtenus à l’aide du test en tube pour évaluer l’efficacité thérapeutique préclinique. (A) Dans les tests de référence avant l’injection d’AAV, les souris Grn+/− avaient une faible dominance sociale (* = test de Mann-Whitney, p = 0,0157 ; ou * = test binomial, p = 0,0281). À l’aide de la randomisation en blocs, les souris ont ensuite été assignées à des groupes de traitement, soit un AAV pour augmenter les niveaux de protéines de progranuline (AAV-Grn), soit un AAV DE CONTRÔLE (AAV-GFP). (B) Les souris Grn+/− injectées avec le contrôle AAV-GFP avaient une faible dominance sociale (* = test de Mann-Whitney, p = 0,0196 ; ou * = test binomial, p = 0,0330). (C) Les souris Grn+/− injectées avec l’AAV-Grn n’avaient plus une faible dominance sociale. (D) En comparant les souris Grn+/− injectées avec AAV-GFP par rapport à AAV-Grn, les souris injectées AAV-Grn avaient une dominance sociale plus élevée que les souris témoins injectées AAV-GFP (** = Mann-Whitney, p = 0,0034 ; ou ** = binomiale, p = 0,0062). n = 19 à 36 souris par groupe. Les données sont adaptées avec la permission d’Arrant et al.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 et 2 : Plan d’expérience. Un exemple de feuille de conception de correspondance d’essai de tube. Notez la répartition de chaque groupe expérimental entre les côtés gauche et droit du tube, et l’effort pour minimiser le mouvement des cages à l’intérieur et à l’extérieur de la zone d’essai. Le groupe A est noir et le groupe B est répertorié en rouge pour visualiser cette distribution. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le test en tube pour la dominance sociale fournit un test facile à adopter et rapidement réalisé que les chercheurs peuvent trouver utile comme mesure de résultat primaire ou dans le cadre d’une batterie de tests comportementaux dans des modèles murins. Cet article fournit des protocoles de base pour effectuer le test en tube entre inconnus ou entre compagnons de cage.
Les chercheurs doivent être conscients de plusieurs paramètres qui peuvent affecter le comportement des tests en tube. Pour l’ensemble de ces paramètres, des études pilotes sont conseillées afin de déterminer leurs effets sur un modèle murin particulier. Les souris mâles et femelles peuvent effectuer le test en tube, mais les souris de chaque sexe doivent être analysées séparément car certains modèles de souris présentent des différences entre les sexes dans le phénotype de dominance sociale26, tandis que d’autres ne le font pas 8,15,27,28. Le test en tube peut être répété plusieurs fois chez le même animal, à la fois au cours d’une session de test (permettant de calculer un pourcentage de victoire pour chaque souris) et entre plusieurs sessions (permettant des tests longitudinaux pour évaluer l’âge ou les effets de l’intervention). Cependant, la répétition du test peut affecter les phénotypes de dominance sociale dans certains modèles de souris 8,11,26. Enfin, la déformation de fond a un effet sur le comportement des essais en tube, comme indiqué dans la toute première publication sur les essais en tube3. Tous les travaux décrits ici ont été réalisés sur des souris sur le fond C57BL/6J, et des articles récents sur le test en tube ont également été réalisés sur des souris C57BL/6 ou C57BL/6J4, 6, 17, 29. Les chercheurs travaillant sur d’autres souches voudront peut-être confirmer la stabilité et la reproductibilité du comportement de dominance sociale avant de procéder à de nouvelles expériences.
Le principal critère d’évaluation du test en tube est la victoire ou la défaite. Cependant, d’autres groupes ont enregistré la durée de chaque match et même les sous-comportements au sein de chaque match. Les chercheurs peuvent donc souhaiter recueillir de telles informations afin d’augmenter la richesse des données obtenues à partir de chaque test. Wang et ses collègues ont rapporté que les correspondances étaient plus courtes lors de l’appariement de souris présentant de grandes différences dans les hiérarchies à l’intérieur de la cage que lors de l’appariement de souris étroitement classées, montrant que les souris les plus dominantes gagnent rapidement des correspondances6. Zhou et ses collègues ont noté plusieurs sous-comportements dans le test en tube : « poussée initiée », « poussée en arrière », « résistance » et « retraite », et ont constaté que les souris gagnantes s’engageaient dans plus de poussée et de résistance, mais moins de retraite que les souris perdantes17. Bien qu’il ne soit pas nécessaire d’enregistrer des matchs sur vidéo, les enquêteurs intéressés par ces analyses plus détaillées du comportement de dominance sociale voudront peut-être enregistrer chaque match.
Comme pour de nombreux tests comportementaux, le test en tube peut être confondu par d’autres déficits non liés au comportement social. La déficience motrice est susceptible d’avoir un impact sur les performances des tests en tube, de sorte que les chercheurs peuvent souhaiter effectuer un dépistage de base des phénotypes moteurs avec des tests tels que la tige rotative, le champ ouvert, le test des pôles, etc. Les signaux olfactifs sont un aspect important du comportement social de la souris30,31, de sorte que les enquêteurs devraient également dépister les déficits olfactifs qui pourraient avoir un impact sur le comportement du test en tube. Une façon simple de le faire est de mesurer le temps que les souris passent à examiner l’urine d’une souris inconnue par rapport à l’eau9.
Les chercheurs caractérisant le comportement social dans de nouveaux modèles de souris devraient envisager d’utiliser le test en tube dans le cadre d’une batterie de tests sociaux. Les modèles murins présentant des anomalies du test en tube présentent souvent un comportement social anormal dans d’autres tests tels que le test de sociabilité à trois chambres, le test résident-intrus et le scoring qualitatif de l’interaction sociale 9,10,11,12,13,14,15,20,27,32,33,34 ,35. La dominance sociale dans le test en tube est corrélée à la dominance sociale dans d’autres tâches telles que le barbier, le marquage d’urine et la compétition pour une place chaude dans une cage 17,36,37. Cependant, la dominance sociale dans d’autres tâches, telles que la compétition pour la nourriture, l’eau ou l’accès aux souris femelles, est moins bien corrélée à la dominance sociale des tests en tube 7,38. En utilisant une batterie de tests, les enquêteurs peuvent obtenir des mesures de la dominance sociale, de l’agressivité, de l’enquête sociale et de la reconnaissance sociale dans leurs modèles murins.
Le test en tube a été utilisé comme critère de jugement principal dans les tests d’approches thérapeutiques précliniques 22,23,25 dans le modèle murin Grn+/− en raison de la stabilité des phénotypes de dominance sociale au fil du temps et de la capacité de tester les souris à plusieurs reprises. Les chercheurs intéressés à utiliser le test en tube pour dépister les interventions doivent d’abord déterminer la stabilité des phénotypes de dominance sociale à travers des tests répétés dans leur modèle murin. Pour ce faire, testez d’abord les souris, puis testez à plusieurs reprises les mêmes correspondances à des intervalles d’un jour, d’une semaine ou d’un mois. Si des délais expérimentaux plus longs sont nécessaires, ces répétitions peuvent être effectuées à des intervalles encore plus longs. La concordance entre ces correspondances peut être déterminée statistiquement en calculant la valeur kappa entre les tests. Si le test en tube atteint une stabilité appropriée dans le modèle murin, il constitue un test de dépistage idéal en raison de sa simplicité et de sa rapidité.
Déclarations de divulgation
Erik D. Roberson a été consultant pour AGTC et Lilly et a reçu des redevances de Genentech.
Remerciements
Nous remercions James Black et Miriam Roberson pour leur aide à la reproduction des souris et à l’entretien des colonies, Anthony Filiano et Alicia Hall pour leur aide dans les essais pilotes en tube, et Robert Farese, Jr. pour avoir fourni des souris knock-out à la progranuline. Ce travail a été soutenu par le Consortium for FTD Research et le Bluefield Project to Cure FTD, le National Institute of Neurological Disorders and Stroke (R01NS075487, P30NS047466 et F32NS090678) et le National Institute on Aging (P30AG086401, R00AG056597 et K00AG068428). Des expériences comportementales ont été réalisées dans l’installation centrale d’évaluation du comportement animal de l’Université de l’Alabama à Birmingham.
matériels
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
Références
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon