Method Article
使用 Tube 测试评估小鼠模型中的社会优势地位
摘要
该协议描述了一种行为测定法,用于使用试管测试评估啮齿动物的社会优势。社会支配地位随着时间的推移保持稳定,几种发育和神经系统疾病模型表现出强烈的社会支配地位异常。因此,试管试验可作为机制研究或临床前治疗筛选的便捷结果测量。
摘要
社会主导地位在神经发育和神经退行性疾病中发生改变,并作为这些疾病临床前研究的有用结果指标。试管测试是一种简单的行为分析,用于评估社会支配地位,不需要昂贵的设备。在该测试中,两只小鼠进入透明塑料管的两端,在中间相遇后,一只(较不占优势的)必须退出。试管测试可用于雄性和雌性小鼠,并包括几个适应性参数以满足研究者的需要。小鼠可以与多个独特的对手进行测试,以提供社会优势指数。试管测试中的社会优势在重复测试中保持稳定,并且与其他社会分析中的表现相关。此外,该测试可以在笼中伙伴之间进行,以评估笼内的社会支配等级。试管试验在临床前治疗研究中特别有用,因为它可以在实验干预之前和之后进行纵向测试。因此,它可以作为机制研究和临床前治疗筛选的便捷结果测量。
引言
社会行为的破坏是许多人类疾病的一个特征,包括发育、精神和神经退行性疾病 1,2。小鼠模型用于深入了解这些疾病的发病机制,并为治疗学的临床前测试提供平台。然而,许多小鼠社交行为的检测非常耗时,需要昂贵的设备和/或视频跟踪软件来分析,或者需要主观评分算法。相比之下,社交支配地位的试管测试执行起来既快速又简单,不需要专门的设备或视频跟踪。该检测具有二元赢/输结果,使结果的解释变得简单明了。
Lindzey 及其同事开发了社会支配地位的试管测试,旨在评估小鼠的社会支配地位3。自开发以来,试管测试也被确立为评估笼内社会支配等级制度4 (in-cage social dominance hierarchyies) 的一种方式。试管测试表型与雄性小鼠的其他社会主导指标相关,例如理发、奖励竞争和排尿5。然而,试管测试的结果喜忧参半,它与食物和水获取竞争以及攻击性 3,6,7。重要的是,试管测试表型与其他社会表型相关,例如三室社交能力 8,9。
试管测试的一个优点是其解剖结构清晰,使其在各种小鼠模型中特别有用,包括自闭症谱系障碍和其他以社交缺陷为特征的疾病模型,如额颞叶痴呆 8,9,10,11,12,13,14,15,16 .内侧前额叶皮层 (mPFC) 是小鼠试管测试行为的关键介质6。Wang 及其同事表明,mPFC 中的活动驱动小鼠的社会支配地位6,最近的数据通过表明丘脑中侧对前边缘和前扣带皮层的输入驱动社会支配地位来完善这一见解17。与 mPFC 在管测试社会优势、树突状乔木异常、树突棘异常、谷氨酸受体和/或神经元兴奋性中的关键作用一致,mPFC 与自闭症谱系障碍15,18、额颞叶痴呆8、19、慢性压力20 和社会孤立21 的啮齿动物模型中的管测试异常有关。
试管试验的另一个关键优势是能够在治疗干预前后测试社会优势,因为小鼠在试管试验中的社会优势随着时间的推移是稳定的,允许在实验干预前后重复测试6,8,22,23。这方面的一个例子来自由颗粒蛋白前体 (GRN) 突变(一种单倍体不足疾病)引起的额颞叶痴呆的前颗粒蛋白杂合子 (Grn+/-) 小鼠模型。颗粒蛋白前体杂合子小鼠具有社会优势缺陷8。这种试管检测缺陷可以通过使用 AAV-颗粒蛋白前体基因疗法22 或施用旨在减少颗粒蛋白前体降解的抗颗粒蛋白抗体23 来逆转。这些例子证明了试管测试在设计痴呆相关研究的临床前试验中的有用性。
该协议提供了在非 cagemates 之间运行试管测试以评估实验组之间的差异,以及在 cagemates 之间运行试管测试以评估笼内社会优势层次结构的基本方法。
研究方案
所有实验程序均已获得阿拉巴马大学伯明翰分校机构动物护理和使用委员会的批准,并根据实验动物护理评估和认证协会 (AAALAC) 进行。如前所述,生成颗粒蛋白前体杂合子小鼠并杂交到 C57BL/6J 背景上9。用于本研究的小鼠已经回交到至少 12 代的 C57BL/6J 背景上。样本数据中使用 9-16 个月大的小鼠。本研究使用了男性和女性。将小鼠保持在 12:12 小时的光照/黑暗循环中,在 06:00 小时开灯,所有测试均在光照阶段进行。在所有实验中,小鼠都可以 随意 获取食物和水。材料 表中列出了试剂和所用设备的详细信息。
1. 管材测试匹配设计
- 在测试之前计划试管测试匹配项。确保没有基因型注释,以使实验者对组不知情(参见 补充表 1)。
注意:我们通常将小鼠与相反实验组8、9、22、23 的 3 个独特对手进行测试,但一些研究报告称与更多的对手10、11、13 进行测试。 - 平衡将实验小鼠分配到管的左侧和右侧,以避免侧面偏倚的任何潜在混杂效应。
- 在测试非笼子时,尽量减少笼子的移动,以避免给小鼠带来不必要的压力。为了最大限度地减少框架移动,请尽可能在相同的两个框架之间重叠匹配项。
- 在测试笼子伙伴时,以循环方式将笼子中的每只鼠标与其他每只鼠标进行测试。如果在多天内重复测试,则应每天交替使用鼠标输入的试管一侧(即左侧或右侧)。
2. 管材的选择
注:通常,试管测试是使用市售的 PVC 透明塑料管进行的(参见 材料表)。需要注意的是,该协议针对小鼠进行了优化,但可以应用于其他啮齿动物模型,例如大鼠、田鼠和仓鼠2。
- 将 PVC 管剪成 30.5 厘米的长度。PVC 管略有弹性,通常成卷存放,因此在使用前可能需要拉直。温和的加热将有助于拉直弯曲的管子。
- 管子的内径对于测试的成功至关重要。确保管子足够大,以便老鼠通过,但又不能大到让老鼠相互交叉。
注意:如果管子足够大,以至于老鼠可以在不进行社会支配地位竞争的情况下相互通过,则测试将不起作用。以下是 C57BL/6J 小鼠适当试管尺寸的大致指南:(1) 雄性小鼠 <6 个月大,雌性小鼠 <9 个月大) 1 英寸/2.5 厘米内径 (ID);(2) 1.25 英寸/3.2 厘米内径,适用于 6-9 个月大的雄性小鼠,>9 个月大的雌性小鼠;(3) 1.5 英寸/3.5 厘米 ID 用于 >9 个月大的雄性小鼠。 - 如果可能,使用相同尺寸的试管进行一组小鼠内的所有测试。如果小鼠在前几次比赛中交叉,则使用下一个最小的试管运行所有后续比赛。
3. 检测地点
- 在环境照明下,在任何平坦、稳定的表面或过滤罩上进行试管测试。
注意:测试通常在白天上午 8 点至下午 5 点之间进行。对于小鼠多天测试的情况,每只小鼠应在一天中的相同时间进行每次测试(例如,上午 11 点至下午 3 点之间)进行测试。据我们所知,以前没有研究过昼夜效应。 - 在安静的地方进行试管测试,尽量减少外部刺激。理想情况下,调查员应该是房间里唯一的人。
4. 习惯化
- 习惯化是行为分析中的一种重要做法,它使小鼠能够熟悉测试环境,从而获得更一致和可靠的结果24。对于试管测试,请在测试前让小鼠适应测试室。如果不在动物的饲养室进行测试,请在测试前让小鼠至少 1 小时适应新房间。
- (可选)如果需要,小鼠可以在测试前习惯于试管。要适应试管,请在测试前 2-3 天将鼠标放入试管中,让其穿过试管 2-3 次。这不是我们的标准做法。
5. 标准管测试
注意:(可选)刚接触试管测试的研究人员可能希望使用单独的非实验小鼠组练习将小鼠放入试管中。研究人员通常需要练习将小鼠放入试管中。经验丰富的研究者将在接受测试的小鼠中诱导较小的压力。有关将小鼠放入试管中的更多信息,请参见步骤 5.3。
- 将所有装有待测试的同性小鼠的笼子放在推车上。将笼子运送到测试区域。用 2% 氯己定和 70% 乙醇清洁试管和测试区域。使用 50 mL 血清移液管将纸巾推入试管即可轻松清洁试管。
- 将第一个匹配项的两个笼子放在测试表面上。取下盖子并将它们放在每个笼子旁边。
- 找到要测试的两只小鼠。每只手握住一只鼠标,对应于管的指定一侧。找到第一只老鼠后,轻轻握住它的尾巴,把它放在笼子里,同时寻找第二只老鼠。
注意:将鼠标的尾巴靠近其长度的中心可以让调查员轻轻控制鼠标,而不会将其束缚得太紧。握住老鼠,使其所有四只爪子都留在笼子床上,以避免对老鼠造成不必要的压力。 - 同时从每个笼子中取出两只小鼠,并轻轻地将它们的头部放在管的入口处。
注意:如果小鼠已经习惯或有过测试经验,它们通常会在几秒钟内进入试管。如果小鼠对试管很幼稚,它们可能会犹豫是否要参加第一次试验。如果需要,可以将小鼠切换到下一个最大的试管以鼓励进入试管。 - 紧紧抓住每只老鼠的尾巴,以防止老鼠过早接触。确保鼠标没有被强行放入试管中。然而,一旦它们开始进入管中,可能会轻轻推动它们以促进它们完全进入管中。
- 当两只小鼠都进入管中时,松开尾巴并离开管(图 1A)。两只小鼠都应进入管中并在中心附近相遇(图 1B)。
- 观察比赛并记录获胜者和失败者。当鼠标的两个爪子离开管子并接触测试表面时,认为老鼠已经失去了匹配项(图 1C)。
注意:一只老鼠通常会将另一只老鼠从管中推出,尽管有些老鼠在接触对方老鼠后会进行非受迫性撤退。偶尔,两只小鼠同时撤退,或者一只老鼠在进入试管后立即撤退,而不接触对方小鼠。如果发生上述任何一种情况,请将两只小鼠放回试管中并重新开始匹配。小鼠通常会在第二次尝试时执行更标准的匹配。如果在 2 分钟内没有鼠标撤退,请中止比赛并在会话结束时再次运行。
- 观察比赛并记录获胜者和失败者。当鼠标的两个爪子离开管子并接触测试表面时,认为老鼠已经失去了匹配项(图 1C)。
- 比赛结束后,将老鼠放回它们的家笼中。用 70% 乙醇清洁试管和测试表面。
- 使用步骤 1 中描述的设计继续运行匹配项。每一轮都在前一轮之后立即开始。当一种性别的所有匹配都已运行后,将笼子放回机架/推车上,并使用相同的程序测试异性的小鼠。
- 彻底清洁正在运行的雌性和雄性小鼠之间的测试表面和管道。测试完成后,用 2% 洗必泰清洁试管和测试区域。
- 对于统计分析,请计算每组的获胜次数,并使用二项式检验进行分析,以比较观察到的分布与预期的分布,预期分布设置为每组的 50% 获胜。
- 通过将获胜次数除以匹配项数来计算每个鼠标的获胜百分比(通常为三个匹配项,除非由于缺少鼠标或其他问题而取消匹配项)。使用 Mann-Whitney 检验比较每个组的胜率。
注意:如果重复,这些匹配在没有额外实验作的情况下会产生类似的结果。例如,之前的一项研究观察到,在连续第8 天运行时,47 场比赛中有 40 场比赛产生了相同的结果。
- 通过将获胜次数除以匹配项数来计算每个鼠标的获胜百分比(通常为三个匹配项,除非由于缺少鼠标或其他问题而取消匹配项)。使用 Mann-Whitney 检验比较每个组的胜率。
6. 用于评估社会支配地位层次结构的笼内管检验
注:小鼠形成稳定的社会优势层次结构,这可以通过对笼内所有小鼠的循环管测试来揭示 4,6。雄性和雌性小鼠都形成了这些层次结构8。社会支配地位层次结构最好在包含至少 5 只小鼠的笼子中进行评估。
- 提前规划匹配项,并按照步骤 1 中的说明进行平衡。
- 按照步骤 5 中的说明运行试管测试匹配项。一次测试一个笼子,并以循环方式测试所有小鼠。在每根匹配之间用 70% 乙醇清洁试管和测试区域。
- 每天测试每个笼子一次,至少持续 5 天,以确定每只小鼠的稳定等级顺序。
- 对于统计分析,请评估每只鼠标的获胜次数。按获胜次数对每只鼠标进行排名。
7. 使用试管检测进行临床前治疗筛选
注意:许多小鼠模型中社会优势表型的稳健性和稳定性,以及进行试管测试的便利性,使试管测试成为治疗策略临床前测试的有用范例。为此,试管测试可以使用动物内设计进行,因为测试可以连续进行。也可以先用药物做交叉设计,然后用 control 进行交叉设计,反之亦然。试管试验以前曾用于评估 Grn + / - 小鼠22,23 的颗粒蛋白前体增强疗法,结果表明社会优势表型在该小鼠模型中是可逆的。为了明确下面的讨论,小鼠将被描述为“对照”(野生型、非转基因等)或“模型”(敲除、转基因等),实验性干预将被描述为“载体”或“治疗”(治疗干预)。虽然小鼠在下面被称为 “对照 ”和 “模型”,但对这些组中的每一个使用同窝小鼠是理想的。
- 在实验干预之前,进行预测试以确认用于测试的模型小鼠中存在预期的社会优势表型。对整个对照和模型小鼠池进行相互测试,并使用这些数据将小鼠分配到治疗组,以确保各组在基线时保持平衡。
- 根据治疗情况,可能需要不同的治疗持续时间。例如,如果药物是 AAV,请让小鼠从手术中恢复并有时间让药物生效。如果药物是小分子,请在试管试验22 之前确定治疗范式。
- 将小鼠分配到实验组,以便每种基因型的载体和处理小鼠具有相似程度的基线社会优势表型。如果小鼠与几个对手进行多次测试,则每只小鼠的胜率(在步骤 5.9 中描述)可用于创建具有相似表型的两组。
- 为了根据 ARRIVE 指南将小鼠真正随机分配到组中,请使用基于每只小鼠的获胜百分比的块随机化协议8。
- 分配组后,在治疗期间的多个时间点测试小鼠。有关通常执行的比较的详细信息,请参阅以下注释:
注意:(1) 载体对照小鼠 vs.载体模型小鼠(这是一个对照比较,表明载体处理不会掩盖小鼠模型的表型);(2) 载体对照小鼠 vs.治疗模型小鼠(这检验了治疗模型小鼠与正常对照不同的假设);(3) 车辆模型小鼠 vs.治疗模型小鼠(这检验了治疗改变小鼠模型表型的假设);(4) 载体对照小鼠 vs.治疗对照小鼠 (这是一个对照比较,以确定治疗对没有社会优势表型的小鼠的影响)。 - 通常,测试将在两天内进行,每天大约 6 场比赛,比较 (1-4) 在步骤 7.4 中提到。为避免过度测试,请在第 1 天运行比较 (1) 和 (2),在第 2 天运行比较 (3) 和 (4)。由于在第 1 天针对两个模型组对载体对照小鼠进行了测试,因此必须穿插每个比较的匹配项。
- 测试结束后,将小鼠放回它们的家笼中。用 70% 乙醇清洁试管和测试表面。
结果
试管试验已广泛用于由于颗粒蛋白前体突变引起的额颞叶痴呆小鼠模型,Grn + / - 小鼠 8,9,22,23,25。这些小鼠在 9 个月大时表现出较低的社会优势(图 2A-D)8。通过重复测试,老年 Grn + /- 小鼠的低社会优势表型是稳定的(图 2A)8,使其成为一个稳健的实验结果测量22,25。
还在 Grn + / - 小鼠中进行了笼内测试,以研究 cagemates 之间的社会优势层次结构(图 3A-D)8。重要的是,雄性 (图 3A,B) 和雌性 (图 3C,D) 小鼠都形成了这些层次结构,并且 Grn + / - 小鼠在其同伴中也表现出较低的社会优势(图 3E)。有趣的是,Grn - / - 小鼠没有这种异常(图 3E)。
老年 Grn + / - 小鼠表现出的低社会优势表型(图 2)使其成为颗粒蛋白前体增强治疗干预的有吸引力的结果测量。在 AAV 注射前,Grn + /- 小鼠表现出低社会优势表型(图 4A)。注射对照病毒的 Grn + / - 小鼠仍然显示出低优势表型(图 4B)。注射病毒以提高颗粒蛋白前体水平的 Grn + / - 小鼠不再具有低社会优势表型(图 4C)。当比较注射对照 AAV 的 Grn + /- 小鼠与注射颗粒蛋白前体增强 AAV 的 Grn + / - 小鼠时,注射对照 AAV 的 Grn + / - 小鼠表现出较低的社会优势(图 4D)。
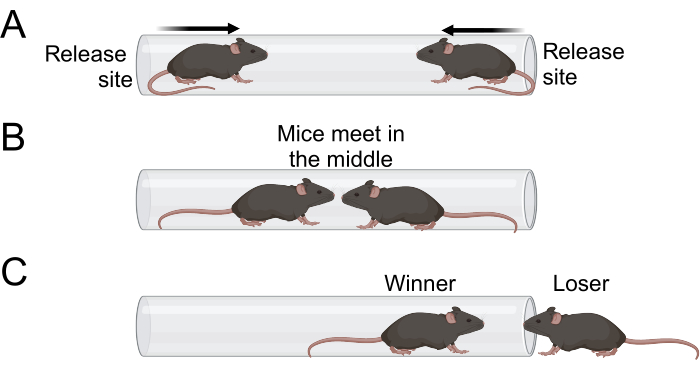
图 1:试管测试示意图。 (A) 实验人员在小鼠用所有四个爪子进入试管后释放它们。管子应该足够小,使老鼠无法转身或爬过另一只老鼠。(B) 然后两只小鼠都移动到管的中间,在那里它们相遇。(C) 优势较强的小鼠将留在试管中,而优势较差的小鼠将退出。一旦两只爪子离开管子,老鼠就算作输家。 请单击此处查看此图的较大版本。
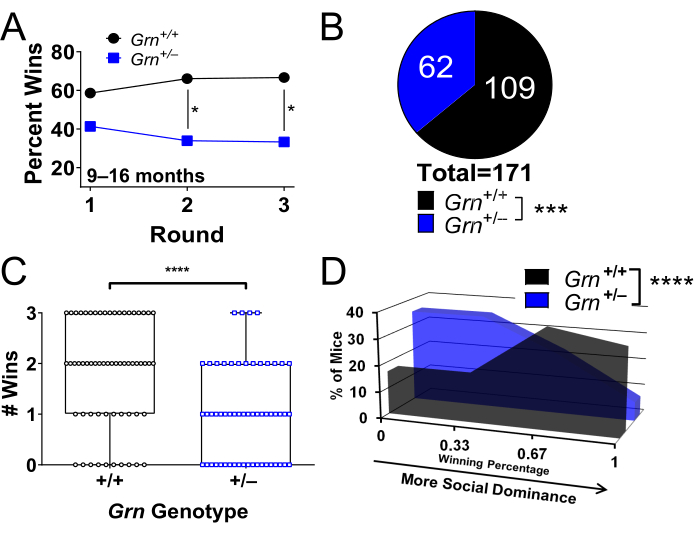
图 2:使用试管测试识别社会优势表型的代表性结果。这项研究是在额颞叶痴呆的 Grn + / - 小鼠模型中进行的。如步骤 1 所述,小鼠与 3 个新对手进行了 3 轮测试。显示了表示数据的不同方式。(A) 9 个月以上的 Grn + /- 小鼠具有低社会优势表型,在重复测试中保持稳定(* = 二项式测试,p < 0.05;数据点代表每种基因型的百分比胜利)。(B) 来自三轮测试的汇总数据,绘制了每种基因型的总体获胜百分比(*** = 二项式检验,p = 0.0004)。(C) 绘制每只鼠标在其所有 3 场比赛中的获胜次数。Grn + / − 小鼠的获胜次数较少(**** = Mann-Whitney 检验,p < 0.0001)。每个点都是一只鼠标。(D) 具有给定胜率的每种基因型中小鼠的百分比图。Grn + / - 小鼠更有可能具有较低的胜率。(**** = Mann-Whitney 检验,p < 0.0001)。9-16 个月大的小鼠,n = 每组 58 只小鼠。数据经 Arrant 等人许可改编8。请单击此处查看此图的较大版本。
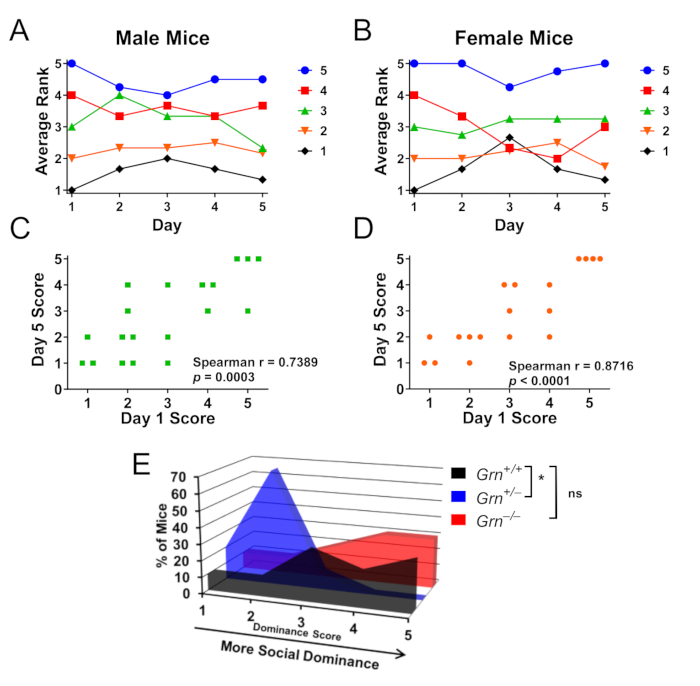
图 3:使用试管测试确定笼内社会优势层次结构的代表性结果。雄性或雌性小鼠的笼子(n = 4 个笼子,每只性别 4-5 只小鼠)以循环方式测试了 5 天,以允许测试社会优势层次结构。 (A,B)雄性和雌性小鼠的社会优势分数由获胜次数决定,每个笼子中 5 是最具优势的小鼠,1 是最具优势的小鼠。在第 5 天,雄性 (A) 和雌性 (B) 小鼠平均保持在初始分数的一个等级内。颜色编码根据第 1 天的排名。(C、D)第 5 天的排名与第 1 天的性别排名具有极显著的相关性。(E) 使用这种笼内范式来评估笼子,其中 Grn + / +、Grn +/- 和 Grn - /- 小鼠被分组饲养在一起,Grn + / - 小鼠也表现出较低的社会优势(Kruskal-Wallis 检验,p = 0.0063,* = p < 0.05 通过 Dunn 事后检验)。有趣的是,在 Grn-/- 小鼠中没有观察到低社会优势。数据经 Arrant et al., 2016 8 许可改编。请单击此处查看此图的较大版本。
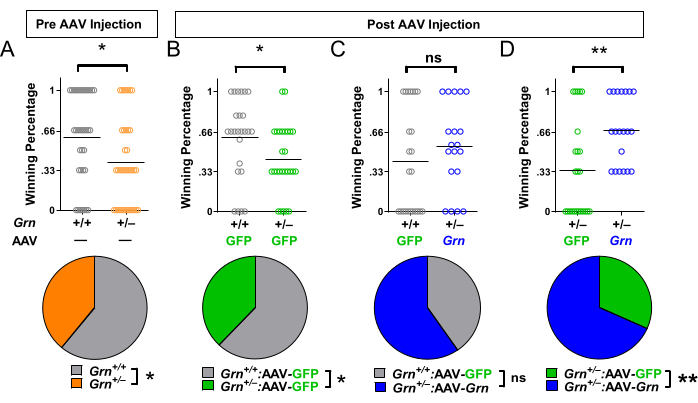
图 4:使用试管试验评估临床前治疗效果的代表性结果。(A) 在 AAV 注射前的基线测试中,Grn + / - 小鼠具有较低的社会优势(* = Mann-Whitney 检验,p = 0.0157;或 * = 二项式检验,p = 0.0281)。使用区组随机化,然后将小鼠分配到治疗组,即提高颗粒蛋白前体水平的 AAV (AAV-Grn) 或对照 AAV (AAV-GFP)。(B) 注射对照 AAV-GFP 的 Grn + /- 小鼠具有较低的社会优势(* = Mann-Whitney 检验,p = 0.0196;或 * = 二项式检验,p = 0.0330)。(C) 注射 AAV-Grn 的 Grn + /- 小鼠不再具有较低的社会优势。(D) 当比较注射 AAV-GFP 的 Grn +/- 小鼠与 AAV-Grn 时,与注射 AAV-GFP 的对照小鼠相比,注射 AAV-Grn 的小鼠具有更高的社会优势(** = Mann-Whitney,p = 0.0034;或 ** = 二项式,p = 0.0062)。n = 每组 19-36 只小鼠。数据经 Arrant 等人许可改编22。请单击此处查看此图的较大版本。
补充表 1 和 2:实验设计。 试管测试匹配设计表示例。注意每个实验组在试管左右两侧的分布,以及尽量减少笼进出测试区域的努力。组 A 为黑色,组 B 以红色列出,以直观显示此分布。 请点击此处下载此文件。
讨论
社会支配地位的试管测试提供了一种易于采用且快速执行的检测方法,研究人员可能会发现它可用作小鼠模型中的主要结果测量或一系列行为测试的一部分。本文提供了在陌生人之间或笼友之间进行试管测试的基本方案。
研究人员应了解可能影响试管测试行为的几个参数。对于所有这些参数,建议进行试点研究以确定它们对特定小鼠模型的影响。雄性和雌性小鼠都可以进行试管测试,但每种性别的小鼠都应分别分析,因为一些小鼠模型在社会优势表型26 中表现出性别差异,而另一些则没有 8,15,27,28。试管测试可以在同一只动物中重复多次,既可以在一个测试会话中(允许计算每只小鼠的胜率),也可以在几个会话之间(允许纵向测试以评估年龄或干预效果)。然而,重复该测试可能会影响某些小鼠模型中的社会优势表型 8,11,26。最后,背景应变对管材测试行为有影响,如第一份管材测试出版物3 中所述。此处描述的所有工作都是在 C57BL/6J 背景下的小鼠中进行的,最近关于试管测试的开创性论文也在 C57BL/6 或 C57BL/6J 小鼠中进行 4,6,17,29。研究其他菌株的研究人员可能希望在进行新的实验之前确认社会支配行为的稳定性和可重复性。
试管试验的主要结果指标是赢/输。但是,其他组已经记录了每场比赛的长度,甚至每场比赛中的子行为。因此,研究人员可能希望收集此类信息,以增加从每次测试中获得的数据的丰富性。Wang 及其同事报告说,与排名相近的小鼠配对时,配对笼内层次结构差异较大的小鼠时,匹配时间短,这表明最具优势的小鼠会迅速赢得匹配6。周 及其同事在试管测试中对几个子行为进行了评分:“推启动”、“推回”、“抵抗”和“撤退”,发现获胜小鼠参与更多的推力和抵抗,但比失败的小鼠更少17。虽然比赛的视频记录不是必需的,但对这些更详细的社会支配行为分析感兴趣的调查人员可能希望记录每场比赛。
与许多行为检测一样,试管测试可能会因与社会行为无关的其他缺陷而混淆。运动障碍可能会影响试管测试性能,因此研究人员可能希望通过旋转杆、旷场、杆测试等测试对运动表型进行基本筛选。嗅觉线索是小鼠社交行为的一个重要方面30,31,因此研究人员还应筛查可能影响试管测试行为的嗅觉缺陷。一种简单的方法是测量小鼠调查不熟悉的小鼠与水的尿液所花费的时间9。
研究人员在新小鼠模型中描述社交行为时应考虑将试管测试作为一系列社交测试的一部分。试管试验异常的小鼠模型通常在其他检测中表现出异常的社会行为,例如三室社交性测试、居民入侵者测试和社交互动定性评分 9,10,11,12,13,14,15,20,27,32,33,34 ,35.试管测试中的社会主导地位与其他任务中的社会主导地位相关,例如理发、尿液标记和在笼子中争夺温暖的地方 17,36,37。然而,在其他任务中的社会主导地位,例如争夺食物、水或获得雌性小鼠的机会,与试管测试的社会主导地位相关性较低 7,38。通过使用一系列测试,研究人员可以在他们的小鼠模型中获得社会支配地位、攻击性、社会调查和社会认可的测量。
由于社会优势表型随时间的稳定性以及重复测试小鼠的能力,试管测试已被用作测试 Grn + / / - 小鼠模型中临床前治疗方法 22,23,25 的主要结果指标。有兴趣使用试管测试筛选干预措施的研究人员应首先确定在其小鼠模型中重复测试中社会优势表型的稳定性。为此,首先测试小鼠,然后每隔一天、一周或一个月重复测试相同的匹配项。如果需要更长的实验时间,这些重复可以以更长的间隔进行。通过计算检验之间的 kappa 值,可以在统计上确定这些匹配项之间的一致性。如果试管试验在小鼠模型中达到适当的稳定性,则由于其简单性和速度,它是理想的筛选测定。
披露声明
Erik D. Roberson 曾担任 AGTC 和 Lilly 的顾问,并获得了 Genentech 的特许权使用费。
致谢
我们感谢 James Black 和 Miriam Roberson 在小鼠育种和菌落维护方面的帮助,感谢 Anthony Filiano 和 Alicia Hall 在试管试验试验分析方面的帮助,以及 Robert Farese, Jr. 提供颗粒蛋白前体敲除小鼠。这项工作得到了 FTD 研究联盟和治愈 FTD 的 Bluefield 项目、美国国家神经疾病和中风研究所 (R01NS075487、P30NS047466 和 F32NS090678) 以及美国国家老龄化研究所 (P30AG086401、 R00AG056597 和 K00AG068428 的支持。行为实验在阿拉巴马大学伯明翰分校的动物行为评估核心设施进行。
材料
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
参考文献
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。