Method Article
Evaluación de la dominancia social en modelos de ratón mediante la prueba del tubo
En este artículo
Resumen
Este protocolo describe un ensayo conductual para evaluar la dominancia social en roedores utilizando la prueba del tubo. La dominancia social se mantiene estable a lo largo del tiempo, y varios modelos de trastornos neurológicos y del desarrollo exhiben sólidas anormalidades de dominancia social. Por lo tanto, la prueba de tubo sirve como una medida de resultado conveniente para estudios mecanicistas o detección terapéutica preclínica.
Resumen
La dominancia social está alterada en las enfermedades neurodegenerativas y del neurodesarrollo y sirve como una medida de resultado útil en los estudios preclínicos de estos trastornos. La prueba del tubo es un ensayo conductual simple para evaluar la dominancia social que no requiere equipos costosos. En esta prueba, dos ratones entran en extremos opuestos de un tubo de plástico transparente, y después de encontrarse en el medio, uno (el menos dominante) debe retroceder. La prueba de tubo se puede utilizar tanto para ratones machos como hembras e incluye varios parámetros adaptables para adaptarse a las necesidades del investigador. Los ratones pueden ser probados contra múltiples oponentes únicos para proporcionar un índice de dominio social. La dominancia social en la prueba de tubo permanece estable durante las pruebas repetidas y se correlaciona con el rendimiento en otros ensayos sociales. Además, la prueba se puede realizar entre compañeros de jaula para evaluar las jerarquías de dominancia social dentro de la jaula. La prueba del tubo es particularmente útil en estudios terapéuticos preclínicos, ya que permite realizar pruebas longitudinales antes y después de las intervenciones experimentales. Por lo tanto, sirve como una medida de resultado conveniente para estudios mecanicistas y cribado terapéutico preclínico.
Introducción
La alteración del comportamiento social es una característica de muchos trastornos humanos, incluidos los trastornos del desarrollo, psiquiátricos y neurodegenerativos 1,2. Los modelos de ratón se utilizan para obtener información sobre la patogénesis de estos trastornos y para proporcionar una plataforma para las pruebas preclínicas de terapias. Sin embargo, muchos ensayos para el comportamiento social de los ratones requieren mucho tiempo, requieren equipos costosos y/o software de seguimiento de video para analizar, o tienen algoritmos de puntuación subjetivos. Por el contrario, la prueba de tubo para la dominancia social es rápida y sencilla de realizar y no requiere equipo especializado ni seguimiento de video. El ensayo tiene un resultado binario de ganar/perder, lo que hace que la interpretación de los resultados sea sencilla.
La prueba de tubo para la dominancia social fue desarrollada por Lindzey y sus colegas en un esfuerzo por evaluar la dominancia social en ratones3. Desde su desarrollo, la prueba del tubo también se ha establecido como una forma de evaluar las jerarquías de dominancia social dentro de la jaula4. Los fenotipos de la prueba de tubo se correlacionan con otras medidas de dominancia social como la barbería, la competencia de recompensa y la producción de orina en ratones macho5. Sin embargo, existen resultados mixtos de la prueba del tubo y su correlación con la competencia por el acceso a alimentos y agua y la agresión 3,6,7. Es importante destacar que los fenotipos de la prueba de tubo se correlacionan con otros fenotipos sociales, como la sociabilidad de tres cámaras 8,9.
Una ventaja de la prueba de tubo es que su anatomía está bien definida, lo que la hace particularmente útil en varios modelos de ratón, incluidos los modelos de trastornos del espectro autista y otras enfermedades caracterizadas por déficits sociales como la demencia frontotemporal 8,9,10,11,12,13,14,15,16 . La corteza prefrontal medial (mPFC) es un mediador clave del comportamiento de la prueba de tubo de ratón6. Wang y sus colegas demostraron que la actividad en el mPFC impulsa la dominancia social en ratones6, y datos más recientes han refinado esta visión al mostrar que la entrada talámica mediodorsal a las cortezas cinguladas prelímbica y anterior impulsa la dominancia social17. De acuerdo con un papel clave de la mPFC en la dominancia social de la prueba de tubo, anomalías en los árboles dendríticos, espinas dendríticas, receptores de glutamato y/o excitabilidad neuronal, la mPFC se ha asociado con anomalías de la prueba de tubo en modelos de roedores de trastornos del espectro autista15,18, demencia frontotemporal 8,19, estrés crónico20 y aislamiento social21.
Otra ventaja clave de la prueba de tubo es la capacidad de evaluar la dominancia social tanto antes como después de la intervención terapéutica, ya que la dominancia social del ratón en la prueba de tubo es estable en el tiempo, lo que permite repetir las pruebas tanto antes como después de una intervención experimental 6,8,22,23. Un ejemplo de esto proviene de modelos de ratón heterocigotos de progranulina (Grn+/-) de demencia frontotemporal causada por mutaciones en progranulina (GRN), una enfermedad de haploinsuficiencia. Los ratones heterocigotos progranulina tienen un déficit de dominancia social8. Este déficit de la prueba en tubo puede revertirse mediante la restauración de la progranulina con la terapia génica AAV-progranulina22 o mediante la administración de anticuerpos anti-sortilina diseñados para reducir la degradación de la progranulina23. Estos ejemplos demuestran la utilidad de la prueba del tubo en el diseño de ensayos preclínicos para la investigación relacionada con la demencia.
Este protocolo proporciona métodos básicos para ejecutar la prueba del tubo entre no compañeros de jaula para evaluar las diferencias entre grupos experimentales, y entre compañeros de jaula para evaluar las jerarquías de dominancia social dentro de la jaula.
Protocolo
Todos los procedimientos experimentales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Alabama en Birmingham y se realizaron de acuerdo con la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio (AAALAC). Se generaron ratones heterocigotos con progranulina y se cruzaron con un fondo C57BL/6J como se describió anteriormente9. Los ratones utilizados para este estudio habían sido retrocruzados con el fondo C57BL/6J durante al menos 12 generaciones. En los datos de la muestra se utilizaron ratones de 9 a 16 meses de edad. En este estudio se utilizaron tanto hombres como mujeres. Los ratones se mantuvieron en un ciclo de luz/oscuridad de 12:12 h con las luces encendidas a las 06:00 h, y todas las pruebas se realizaron durante la fase de luz. A los ratones se les dio acceso ad libitum a comida y agua durante todos los experimentos. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Diseño del partido de prueba del tubo
- Planifique las coincidencias de la prueba del tubo antes de la prueba. Asegúrese de que no haya ninguna nota de genotipo para mantener al experimentador ciego a los grupos (ver Tabla Suplementaria 1).
NOTA: Por lo general, probamos ratones contra 3 oponentes únicos del grupo experimental opuesto 8,9,22,23, pero algunos estudios informan pruebas contra más oponentes 10,11,13. - Contrarreste la asignación de ratones experimentales a los lados izquierdo y derecho del tubo para evitar cualquier posible efecto de confusión del sesgo lateral.
- Al realizar pruebas a los ratones que no son compañeros de jaula, minimice el movimiento de las jaulas para evitar estresar a los ratones más de lo necesario. Para minimizar el movimiento de la jaula, superponga las coincidencias entre las mismas dos jaulas tanto como sea posible.
- Al evaluar a los compañeros de jaula, pruebe cada ratón de una jaula contra todos los demás ratones en forma de round robin. Si se repite la prueba durante varios días, el lado del tubo al que se le asigna ingresar al mouse (es decir, izquierdo o derecho) debe alternarse de un día a otro.
2. Elección de los tubos
NOTA: Por lo general, la prueba del tubo se realiza con tubos de plástico transparente disponibles comercialmente hechos de PVC (consulte la Tabla de materiales). Es importante tener en cuenta que este protocolo está optimizado para ratones, pero se puede aplicar a otros modelos de roedores como ratas, ratones de campo y hámsters2.
- Corta el tubo de PVC a una longitud de 30,5 cm. El tubo de PVC es ligeramente flexible y a menudo se almacena en rollos, por lo que es posible que deba enderezarse antes de usarlo. Un calentamiento suave ayudará a enderezar los tubos curvos.
- El diámetro interior del tubo es fundamental para el éxito de la prueba. Asegúrese de que el tubo sea lo suficientemente grande para que los ratones se muevan, pero no lo suficientemente grande como para permitir que los ratones se crucen entre sí.
NOTA: La prueba no funcionará si el tubo es lo suficientemente grande como para que los ratones puedan cruzarse entre sí sin participar en un concurso de dominancia social. Las siguientes son pautas aproximadas para los tamaños de tubo apropiados en ratones C57BL/6J: (1) diámetro interior (ID) de 1 pulgada/2,5 cm para ratones machos de <6 meses de edad, ratones hembra de <9 meses de edad; (2) DI de 1,25 pulgadas/3,2 cm para ratones machos de 6 a 9 meses de edad, ratones hembra de >9 meses de edad; y (3) DI de 1,5 pulgadas/3,5 cm para ratones machos de >9 meses de edad. - Si es posible, use un tubo del mismo tamaño para todas las pruebas dentro de un grupo de ratones. Si los ratones se cruzan durante las primeras coincidencias, ejecute todas las coincidencias posteriores con el siguiente tubo más pequeño.
3. Lugar de prueba
- Realice la prueba del tubo en cualquier superficie plana y estable o campana filtrada bajo iluminación ambiental.
NOTA: La prueba generalmente se realiza durante el día entre las 8 a.m. y las 5 p.m. En los casos en los que los ratones se prueban durante varios días, cada ratón debe hacerse la prueba durante la misma hora del día para cada prueba (por ejemplo, entre las 11 a.m. y las 3 p.m.). Hasta donde sabemos, los efectos de la hora del día no se han estudiado previamente. - Realice la prueba del tubo en un lugar tranquilo con estímulos externos mínimos. Lo ideal es que el investigador sea la única persona en la sala.
4. Habituación
- La habituación es una práctica importante en los ensayos conductuales que permite a los ratones familiarizarse con el entorno de prueba, lo que puede conducir a resultados más consistentes y confiables24. Para la prueba de tubo, aclimate a los ratones a la sala de pruebas antes de la prueba. Si las pruebas no se realizan en la sala de alojamiento de los animales, permita que los ratones se habitúen a la nueva habitación al menos 1 hora antes de realizar la prueba.
- (Opcional) Si se desea, los ratones pueden habituarse al tubo antes de la prueba. Para habituarse al tubo, coloque al ratón en el tubo sin un oponente y permita que cruce a través del tubo 2 o 3 veces, 2 o 3 días antes de la prueba. Esta no es nuestra práctica habitual.
5. Ensayo de tubo estándar
NOTA: (Opcional) Los investigadores nuevos en la prueba del tubo pueden desear practicar la colocación de ratones en el tubo utilizando un grupo separado de ratones no experimentales. A menudo, los investigadores necesitan practicar la colocación de ratones en el tubo. Un investigador experimentado inducirá menos estrés en los ratones que se sometan a la prueba. En el paso 5.3 se proporciona más información sobre la colocación de ratones en el tubo.
- Coloque todas las jaulas que contengan ratones del mismo sexo para ser examinados en un carrito. Jaulas de transporte a la zona de pruebas. Limpie los tubos y el área de prueba con clorhexidina al 2% seguida de etanol al 70%. Los tubos se limpian fácilmente con una pipeta serológica de 50 ml empujando una toalla de papel a través del tubo.
- Coloque las dos jaulas para el primer partido en la superficie de prueba. Retire las tapas y colóquelas junto a cada jaula.
- Localice los dos ratones que se van a analizar. Sostenga un mouse en cada mano, correspondiente a su lado asignado del tubo. Después de encontrar el primer ratón, sostenga suavemente su cola y manténgalo en la jaula mientras busca el segundo.
NOTA: Sostener la cola del ratón cerca del centro de su longitud permitirá al investigador controlar suavemente el ratón sin sujetarlo con demasiada fuerza. Sostenga al ratón de modo que sus cuatro patas permanezcan en la cama de la jaula para evitar estresar innecesariamente al ratón. - Retire simultáneamente ambos ratones de cada jaula y colóquelos suavemente con sus cabezas en la entrada del tubo.
NOTA: Si los ratones se han habituado o tienen experiencia previa en pruebas, normalmente entran en el tubo en unos pocos segundos. Si los ratones son ingenuos al tubo, es posible que duden en participar en la primera prueba. Si es necesario, los ratones se pueden cambiar al siguiente tubo más grande para fomentar la entrada del tubo. - Mantenga un agarre en la cola de cada ratón para evitar que los ratones hagan contacto prematuramente. Asegúrese de que los ratones no sean forzados a entrar en el tubo. Sin embargo, una vez que comiencen a entrar en la trompa, se les puede empujar suavemente para fomentar la entrada completa en la trompa.
- Cuando ambos ratones hayan entrado en el tubo, suelte las colas y aléjese del tubo (Figura 1A). Ambos ratones deben avanzar hacia el tubo y encontrarse cerca del centro (Figura 1B).
- Observa el partido y registra el ganador y el perdedor. Se considera que un ratón ha perdido la cerilla cuando dos de sus patas salen del tubo y entran en contacto con la superficie de prueba (Figura 1C).
NOTA: Un ratón normalmente empujará al otro fuera del tubo, aunque algunos ratones realizarán una retirada no forzada después de entrar en contacto con el ratón oponente. Ocasionalmente, ambos ratones se retiran simultáneamente, o un ratón se retira inmediatamente después de entrar en el tubo sin entrar en contacto con el ratón oponente. Si ocurre alguno de estos eventos, vuelva a colocar ambos ratones en el tubo y reinicie el partido. Por lo general, los ratones realizarán una coincidencia más estándar en el segundo intento. Si ninguno de los ratones se ha retirado en 2 minutos, aborte la partida y vuelva a ejecutarla al final de la sesión.
- Observa el partido y registra el ganador y el perdedor. Se considera que un ratón ha perdido la cerilla cuando dos de sus patas salen del tubo y entran en contacto con la superficie de prueba (Figura 1C).
- Una vez que termine el partido, regrese a los ratones a sus jaulas de origen. Limpie el tubo y la superficie de prueba con etanol al 70%.
- Continúe ejecutando coincidencias con el diseño descrito en el paso 1. Cada ronda comienza inmediatamente después de la ronda anterior. Cuando se hayan realizado todas las coincidencias de un sexo, devuelva las jaulas al estante/carro y pruebe los ratones del sexo opuesto utilizando el mismo procedimiento.
- Limpie a fondo la superficie de prueba y los tubos entre los ratones hembra y macho corriendo. Una vez finalizada la prueba, limpie los tubos y el área de prueba con clorhexidina al 2%.
- Para el análisis estadístico, cuente el número de victorias de cada grupo y analice utilizando la prueba binomial para comparar la distribución observada frente a la esperada, con la distribución esperada establecida en 50% de victorias para cada grupo.
- Calcule el porcentaje de victorias de cada ratón dividiendo el número de victorias por el número de coincidencias (normalmente tres coincidencias, a menos que una partida se cancelara debido a la falta de un ratón u otros problemas). Compara el porcentaje de victorias de cada grupo usando la prueba de Mann-Whitney.
NOTA: Si se repiten, estas coincidencias producen resultados similares en ausencia de manipulaciones experimentales adicionales. Por ejemplo, un estudio anterior observó que 40 de 47 partidos produjeron el mismo resultado cuando se ejecutaron en días sucesivos8.
- Calcule el porcentaje de victorias de cada ratón dividiendo el número de victorias por el número de coincidencias (normalmente tres coincidencias, a menos que una partida se cancelara debido a la falta de un ratón u otros problemas). Compara el porcentaje de victorias de cada grupo usando la prueba de Mann-Whitney.
6. Prueba de tubo dentro de la jaula para evaluar las jerarquías de dominancia social
NOTA: Los ratones forman jerarquías estables de dominancia social que pueden ser reveladas por la prueba de tubo round-robin de todos los ratones dentro de una jaula 4,6. Tanto los ratones machos como las hembras forman estas jerarquías8. Las jerarquías de dominancia social se evalúan mejor en jaulas que contienen al menos 5 ratones.
- Planifique las coincidencias con anticipación, con contrapeso como se describe en el paso 1.
- Ejecute las coincidencias de prueba de tubo como se describe en el paso 5. Pruebe una jaula a la vez y pruebe a todos los ratones en forma de round robin. Limpie el tubo y el área de prueba con etanol al 70% entre cada cerilla.
- Pruebe cada jaula una vez al día durante al menos 5 días para establecer los órdenes de rango estables de cada ratón.
- Para el análisis estadístico, evalúe el número de victorias por ratón. Clasifica cada ratón por el número de victorias.
7. Uso de la prueba del tubo para el cribado terapéutico preclínico
NOTA: La robustez y estabilidad de los fenotipos de dominancia social en muchos modelos de ratón, así como la facilidad de realizar la prueba de tubo, hacen de la prueba de tubo un paradigma útil para las pruebas preclínicas de estrategias terapéuticas. Para ello, la prueba del tubo se puede realizar utilizando un diseño dentro del animal, ya que la prueba se puede realizar en serie. También es posible hacer un diseño cruzado con el fármaco, luego el control o viceversa. La prueba del tubo se ha utilizado previamente para evaluar terapias que aumentan la progranulina en ratones Grn+/− 22,23, lo que demostró que los fenotipos de dominancia social son reversibles en este modelo de ratón. Para mayor claridad de la discusión a continuación, los ratones se describirán como "control" (tipo salvaje, no transgénicos, etc.) o "modelo" (knockout, transgénicos, etc.), y las intervenciones experimentales se describirán como "vehículo" o "tratadas" (intervención terapéutica). Si bien los ratones se denominan "control" y "modelo" a continuación, es ideal usar compañeros de camada para cada uno de estos grupos.
- Antes de una intervención experimental, se realiza una prueba previa para confirmar la presencia del fenotipo de dominancia social esperado en los ratones modelo que se utilizarán para la prueba. Pruebe todo el grupo de ratones de control y modelo entre sí y utilice estos datos para asignar ratones a grupos de tratamiento para asegurarse de que los grupos estén equilibrados al inicio.
- Es posible que se necesiten diferentes duraciones de tratamiento en función de la terapéutica. Por ejemplo, si el medicamento es un AAV, permita que los ratones se recuperen de la cirugía y tengan tiempo para que el medicamento haga efecto. Si el fármaco es una molécula pequeña, determinar los paradigmas de tratamiento antes de la prueba del tubo22.
- Asigne los ratones a grupos experimentales de manera que los ratones vehículo y los ratones tratados de cada genotipo tengan fenotipos de dominancia social de referencia de grado similar. Si los ratones se prueban varias veces contra varios oponentes, el porcentaje de victorias de cada ratón (descrito en el paso 5.9) se puede usar para crear dos grupos con fenotipos similares.
- Para una distribución verdaderamente aleatoria de ratones en grupos basada en las pautas de ARRIVE, use un protocolo de aleatorización de bloques basado en el porcentaje ganador de cada ratón8.
- Después de asignar los grupos, pruebe a los ratones en varios puntos de tiempo durante el tratamiento. Para obtener más información sobre las comparaciones que se realizan normalmente, consulte la NOTA siguiente:
NOTA: (1) Ratones de control de vehículos vs. ratones modelo de vehículo (esta es una comparación de control para mostrar que el tratamiento del vehículo no oscurece el fenotipo del modelo de ratón); (2) ratones de control de vehículos vs. ratones modelo tratados (esto prueba la hipótesis de que los ratones modelo tratados son diferentes de los controles normales); (3) Modelos de vehículos MICE vs. ratones modelo tratados (esto prueba la hipótesis de que el tratamiento altera el fenotipo del modelo de ratón); (4) ratones de control de vehículos vs. Ratones control tratados (se trata de una comparación de control para determinar los efectos del tratamiento en ratones sin fenotipo de dominancia social). - Por lo general, las pruebas se realizarán durante dos días, con aproximadamente 6 coincidencias por día, con comparaciones (1-4) mencionadas en el paso 7.4. Para evitar pruebas excesivas, ejecute las comparaciones (1) y (2) el día 1 y las comparaciones (3) y (4) el día 2. Dado que los ratones de control del vehículo se prueban con ambos grupos de modelos el día 1, las coincidencias de cada comparación deben intercalarse.
- Una vez terminada la prueba, regrese a los ratones a sus jaulas domésticas. Limpie el tubo y la superficie de prueba con etanol al 70%.
Resultados
La prueba del tubo se ha utilizado ampliamente en un modelo de ratón de demencia frontotemporal debido a mutaciones en progranulina, ratones Grn+/− 8,9,22,23,25. Estos ratones exhiben una baja dominancia social a los 9 meses de edad (Figura 2A-D)8. El fenotipo de baja dominancia social de los ratones Grn+/− mayores es estable a través de pruebas repetidas (Figura 2A)8, lo que lo convierte en una medida de resultado experimental robusta22,25.
También se han realizado pruebas dentro de la jaula en ratones Grn+/− para investigar las jerarquías de dominancia social entre los compañeros de jaula (Figura 3A-D)8. Es importante destacar que tanto los ratones machos (Figura 3A,B) como las hembras (Figura 3C,D) forman estas jerarquías, y los ratones Grn+/− también exhiben un bajo dominio social entre sus compañeros de jaula (Figura 3E). Curiosamente, los ratones Grn-/- no tenían esta anormalidad (Figura 3E).
El fenotipo de baja dominancia social exhibido por los ratones Grn+/− mayores (Figura 2) lo convierte en una medida de resultado atractiva para las intervenciones terapéuticas que aumentan la progranulina. Antes de la inyección de AAV, los ratones Grn+/− exhiben un fenotipo de dominancia social baja (Figura 4A). Los ratones Grn+/− inyectados con un virus de control aún muestran un fenotipo de baja dominancia (Figura 4B). Los ratones Grn+/− inyectados con un virus para aumentar los niveles de progranulina ya no tienen el fenotipo de baja dominancia social (Figura 4C). Al comparar los ratones Grn+/− inyectados con AAV de control con los ratones Grn+/− inyectados con AAV potenciador de progranulina, los ratones Grn+/− inyectados con AAV de control exhiben una baja dominancia social (Figura 4D).
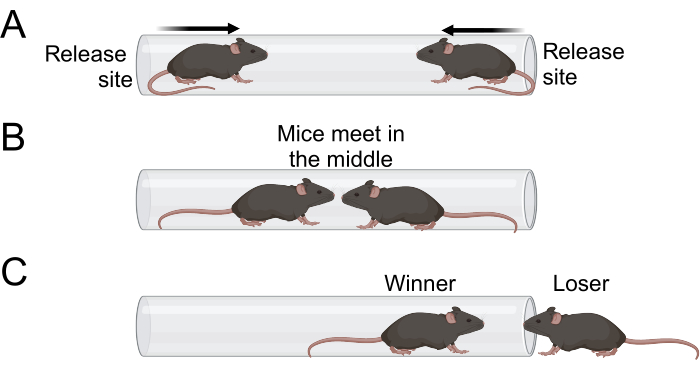
Figura 1: Esquema de la prueba del tubo. (A) Los experimentadores liberan a los ratones una vez que han entrado en el tubo con las cuatro patas. El tubo debe ser lo suficientemente pequeño como para que un ratón no pueda darse la vuelta ni trepar por encima de otro ratón. (B) Ambos ratones se mueven hacia el centro del tubo, donde se encuentran. (C) El ratón más dominante permanecerá en el tubo, mientras que el ratón menos dominante se retirará. El ratón se cuenta como el perdedor una vez que dos patas salen del tubo. Haga clic aquí para ver una versión más grande de esta figura.
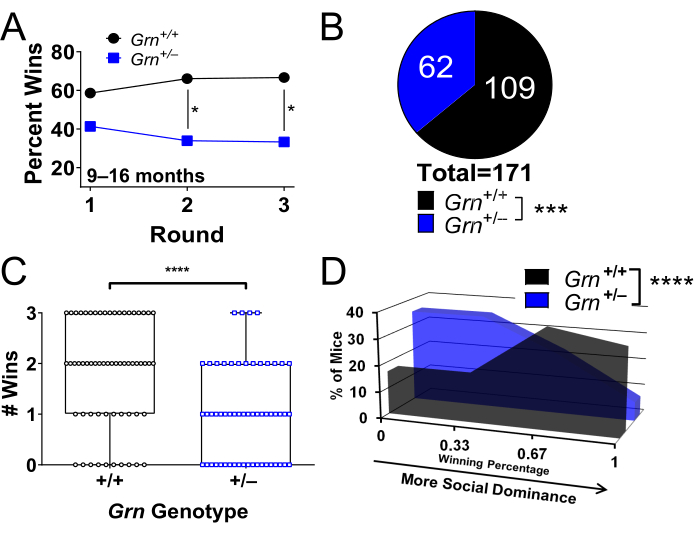
Figura 2: Resultados representativos utilizando la prueba del tubo para identificar un fenotipo de dominancia social. Este estudio se realizó en el modelo de ratón Grn+/− de demencia frontotemporal. Los ratones fueron probados 3 rondas contra 3 oponentes nuevos, como se describe en el paso 1. Se muestran diferentes medios de presentación de los datos. (A) Los ratones Grn+/− de más de 9 meses de edad tienen un fenotipo de baja dominancia social que es estable en pruebas repetidas (* = prueba binomial, p < 0,05; los puntos de datos representan el porcentaje de victorias de cada genotipo). (B) Datos agregados de las tres rondas de pruebas que trazan el porcentaje total de victorias por genotipo (*** = prueba binomial, p = 0.0004). (C) Traza el número de victorias de cada ratón en sus 3 partidos. Los ratones Grn+/− tuvieron un menor número de victorias (**** = prueba de Mann-Whitney, p < 0,0001). Cada punto es un ratón. (D) Gráfico del porcentaje de ratones en cada genotipo con un porcentaje de victorias dado. Los ratones Grn+/− tenían más probabilidades de tener un porcentaje de victorias bajo. (**** = prueba de Mann-Whitney, p < 0,0001). Ratones de 9 a 16 meses de edad, n = 58 ratones por grupo. Los datos se han adaptado con permiso de Arrant et al.8. Haga clic aquí para ver una versión más grande de esta figura.
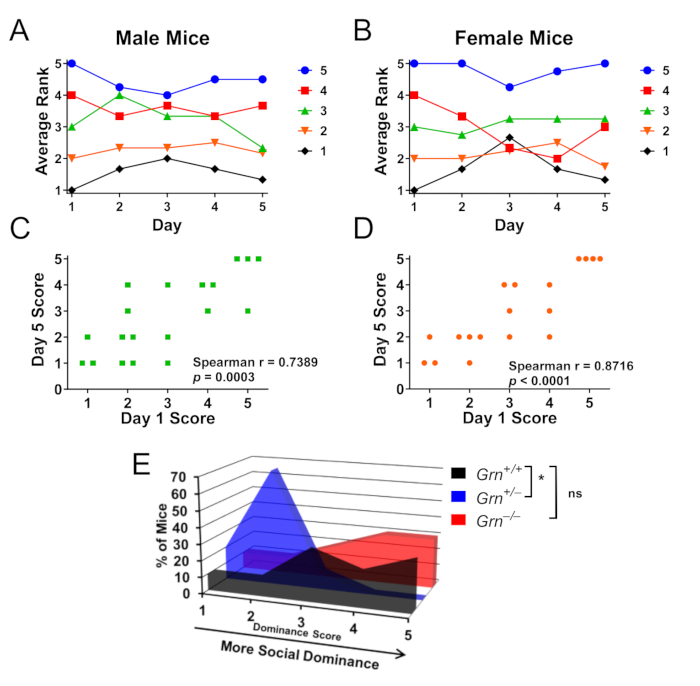
Figura 3: Resultados representativos utilizando la prueba del tubo para determinar la jerarquía de dominancia social dentro de la jaula. Las jaulas de ratones machos o hembras (n = 4 jaulas por sexo de 4-5 ratones cada una) se probaron en forma de round robin durante 5 días para permitir la prueba de la jerarquía de dominancia social. (A,B) Las puntuaciones de dominancia social para ratones machos y hembras se determinaron por el número de victorias, siendo 5 el ratón más dominante y 1 el ratón menos dominante en cada jaula. En el día 5, tanto los ratones machos (A) como los ratones hembra (B) permanecieron dentro de un rango de su puntuación inicial en promedio. La codificación por colores es por clasificación del día 1. (C, D) El rango del día 5 tuvo una correlación altamente significativa con el rango del día 1 para ambos sexos. (E) Utilizando este paradigma dentro de la jaula para evaluar jaulas donde los ratones Grn+/+, Grn+/- y Grn-/- se alojaban juntos en grupos, los ratones Grn+/− también exhibieron una baja dominancia social (prueba de Kruskal-Wallis, p = 0.0063, * = p < 0.05 según la prueba post-hoc de Dunn). Curiosamente, no se observó una baja dominancia social en los ratones Grn-/- . Los datos se han adaptado con permiso de Arrant et al., 20168. Haga clic aquí para ver una versión más grande de esta figura.
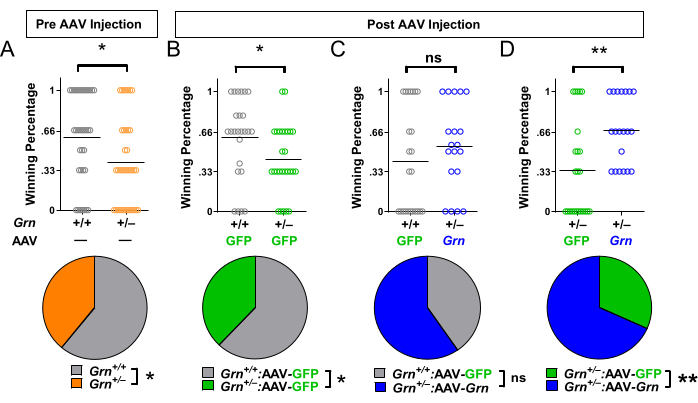
Figura 4: Resultados representativos utilizando la prueba del tubo para evaluar la eficacia terapéutica preclínica. (A) En las pruebas de referencia antes de la inyección de AAV, los ratones Grn+/− tenían una baja dominancia social (* = prueba de Mann-Whitney, p = 0,0157; o * = prueba binomial, p = 0,0281). Mediante la aleatorización en bloques, los ratones se asignaron a grupos de tratamiento, ya sea un AAV para aumentar los niveles de proteína progranulina (AAV-Grn) o un AAV DE CONTROL (AAV-GFP). (B) Los ratones Grn+/− inyectados con el control AAV-GFP tuvieron baja dominancia social (* = prueba de Mann-Whitney, p = 0,0196; o * = prueba binomial, p = 0,0330). (C) Los ratones Grn+/− inyectados con el AAV-Grn ya no tenían una baja dominancia social. (D) Al comparar los ratones Grn+/− inyectados con AAV-GFP frente a los ratones AAV-Grn, los ratones inyectados con AAV-Grn tuvieron una mayor dominancia social en comparación con los ratones de control inyectados con AAV-GFP (** = Mann-Whitney, p = 0,0034; o ** = binomial, p = 0,0062). n = 19-36 ratones por grupo. Los datos se adaptan con permiso de Arrant et al.22. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1 y 2: Diseño experimental. Un ejemplo de hoja de diseño de coincidencia de prueba de tubo. Obsérvese la distribución de cada grupo experimental entre los lados izquierdo y derecho del tubo, y el esfuerzo por minimizar el movimiento de las jaulas dentro y fuera del área de prueba. El grupo A es negro y el grupo B aparece en rojo para visualizar esta distribución. Haga clic aquí para descargar este archivo.
Discusión
La prueba de tubo para la dominancia social proporciona un ensayo fácil de adoptar y realizar rápidamente que los investigadores pueden encontrar útil como medida de resultado primaria o como parte de una batería de pruebas de comportamiento en modelos de ratón. Este artículo proporciona protocolos básicos para realizar la prueba del tubo entre extraños o entre compañeros de jaula.
Los investigadores deben ser conscientes de varios parámetros que pueden afectar el comportamiento de la prueba de tubo. Para todos estos parámetros, son recomendables estudios piloto para determinar sus efectos en un modelo de ratón en particular. Tanto los ratones machos como las hembras pueden realizar la prueba del tubo, pero los ratones de cada sexo deben analizarse por separado, ya que algunos modelos de ratón presentan diferencias sexuales en el fenotipo de dominancia social26, mientras que otros no 8,15,27,28. La prueba del tubo puede repetirse varias veces en el mismo animal, tanto dentro de una sesión de prueba (lo que permite calcular un porcentaje de victorias para cada ratón) como entre varias sesiones (lo que permite realizar pruebas longitudinales para evaluar la edad o los efectos de la intervención). Sin embargo, la repetición de la prueba puede afectar los fenotipos de dominancia social en algunos modelos de ratón 8,11,26. Finalmente, la deformación de fondo tiene un efecto en el comportamiento de la prueba de tubo, como se señaló en la primera publicación de prueba de tubo3. Todo el trabajo descrito aquí se realizó en ratones en el fondo C57BL/6J, y los artículos seminales recientes sobre la prueba del tubo también se realizaron en ratones C57BL/6 o C57BL/6J 4,6,17,29. Los investigadores que trabajan en otras cepas pueden desear confirmar la estabilidad y reproducibilidad del comportamiento de dominancia social antes de proceder a nuevos experimentos.
La medida de resultado principal de la prueba de tubo es ganar/perder. Sin embargo, otros grupos han registrado la duración de cada partido e incluso los subcomportamientos dentro de cada partido. Por lo tanto, es posible que los investigadores deseen recopilar dicha información para aumentar la riqueza de los datos obtenidos de cada prueba. Wang y sus colegas informaron que las coincidencias eran más cortas cuando se emparejaban ratones con grandes diferencias en las jerarquías dentro de la jaula que cuando se emparejaban ratones estrechamente clasificados, lo que demuestra que los ratones más dominantes gananpartidos rápidamente. Zhou y sus colegas puntuaron varios subcomportamientos en la prueba del tubo: "empuje iniciado", "empuje hacia atrás", "resistencia" y "retirada", y descubrieron que los ratones ganadores se involucraban en más empuje y resistencia, pero menos retrocesoque los ratones perdedores. Si bien no es necesaria la grabación en video de los partidos, los investigadores interesados en estos análisis más detallados del comportamiento de dominancia social pueden desear grabar cada partido.
Al igual que con muchos ensayos conductuales, la prueba del tubo puede confundirse con otros déficits no relacionados con el comportamiento social. Es probable que el deterioro motor afecte el rendimiento de la prueba de tubo, por lo que es posible que los investigadores deseen realizar una evaluación básica de los fenotipos motores con pruebas como la barra de rotación, campo abierto, prueba de pértiga, etc. Las señales olfativas son un aspecto importante del comportamiento social del ratón30,31, por lo que los investigadores también deben detectar déficits olfativos que podrían afectar el comportamiento de la prueba de tubo. Una forma sencilla de hacer esto es medir el tiempo que los ratones pasan investigando la orina de un ratón desconocido en comparación conel agua.
Los investigadores que caracterizan el comportamiento social en nuevos modelos de ratón deben considerar el uso de la prueba del tubo como parte de una batería de pruebas sociales. Los modelos de ratón con anomalías en la prueba de tubo a menudo exhiben un comportamiento social anormal en otros ensayos, como la prueba de sociabilidad de tres cámaras, la prueba de residente-intruso y la puntuación cualitativa de la interacción social 9,10,11,12,13,14,15,20,27,32,33,34 ,35. La dominancia social en la prueba del tubo se correlaciona con la dominancia social en otras tareas como la barbería, el marcado de orina y la competencia por un lugar cálido en una jaula 17,36,37. Sin embargo, la dominancia social en otras tareas, como la competencia por la comida, el agua o el acceso a ratones hembra, está menos correlacionada con la dominancia social de la prueba de tubo 7,38. Mediante el uso de una batería de pruebas, los investigadores pueden obtener medidas de dominancia social, agresión, investigación social y reconocimiento social en sus modelos de ratón.
La prueba de tubo se ha utilizado como medida de resultado primaria en la prueba de enfoques terapéuticos preclínicos 22,23,25 en el modelo de ratón Grn+/-, debido a la estabilidad de los fenotipos de dominancia social a lo largo del tiempo y a la capacidad de evaluar repetidamente a los ratones. Los investigadores interesados en utilizar la prueba del tubo para las intervenciones de cribado deben determinar primero la estabilidad de los fenotipos de dominancia social a través de pruebas repetidas en su modelo de ratón. Para hacer esto, primero pruebe los ratones, luego pruebe repetidamente los mismos partidos a intervalos de un día, una semana o un mes. Si se necesitan plazos experimentales más largos, estas repeticiones se pueden llevar a cabo a intervalos aún más largos. La concordancia entre estas coincidencias se puede determinar estadísticamente calculando el valor kappa entre las pruebas. Si la prueba de tubo logra una estabilidad adecuada en el modelo de ratón, es un ensayo de detección ideal debido a su simplicidad y velocidad.
Divulgaciones
Erik D. Roberson se ha desempeñado como consultor para AGTC y Lilly y ha recibido regalías de Genentech.
Agradecimientos
Agradecemos a James Black y Miriam Roberson por su ayuda con la cría de ratones y el mantenimiento de las colonias, a Anthony Filiano y Alicia Hall por su ayuda con los ensayos piloto de pruebas en tubo, y a Robert Farese, Jr. por proporcionar ratones knockout de progranulina. Este trabajo fue apoyado por el Consorcio para la Investigación de la DFT y el Proyecto Bluefield para Curar la DFT, el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (R01NS075487, P30NS047466 y F32NS090678) y el Instituto Nacional sobre el Envejecimiento (P30AG086401, R00AG056597 y K00AG068428). Los experimentos de comportamiento se llevaron a cabo en el Centro de Evaluación del Comportamiento Animal de la Universidad de Alabama en Birmingham.
Materiales
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
Referencias
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados