Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La cryobiopsie pulmonaire transbronchique pour diagnostiquer les maladies pulmonaires interstitielles et les lésions pulmonaires périphériques - une approche par étapes
Dans cet article
Résumé
La cryobiopsie pulmonaire transbronchique (TBLC) pour diagnostiquer la pneumopathie interstitielle et les lésions pulmonaires périphériques est une procédure diagnostique à haut rendement et sûre. Nous décrivons une approche par étapes pour effectuer une TBLC pour les différentes indications mentionnées avec un bronchoscope flexible, ce qui pourrait être utile pour les bronchoscopistes novices effectuant une TBLC.
Résumé
La cryobiopsie pulmonaire transbronchique (TBLC) est une procédure invasive de plus en plus mise en œuvre au cours de la dernière décennie comme alternative à la chirurgie thoracique vidéo-assistée : la biopsie pulmonaire (SLB) pour diagnostiquer les maladies pulmonaires interstitielles (MPI). L’indication de la TBLC a principalement été de sous-classifier un sous-type spécifique de MPI lorsque cela ne peut être réalisé sur la base d’une discussion d’équipe multidisciplinaire préalable. Bien que la SLB soit considérée comme l’étalon-or pour établir un diagnostic histologique, la TBLC a été progressivement suggérée comme la modalité de diagnostic histologique de premier choix chez les patients atteints de MPI non classifiées en raison d’un rendement diagnostique comparable à la SLB, mais supérieur à la SLB en termes de complications, y compris la mortalité. Au cours des dernières années, l’échographie endobronchique radiale (R-EBUS) et la bronchoscopie à navigation électromagnétique (ENB) pour les lésions pulmonaires périphériques ont également été décrites comme des procédures sûres, qui peuvent améliorer le rendement diagnostique par rapport aux biopsies par forceps. Pourtant, les propriétés diagnostiques du TBLC dépendent de la qualité de la performance de la procédure. Cet article vise à décrire l’approche par étapes de la réalisation d’une TBLC avec un bronchoscope flexible pour les différentes indications mentionnées, ce qui pourrait être utile pour les bronchoscopistes novices effectuant une TBLC.
Introduction
Les pneumopathies interstitielles (MPI) constituent un groupe de maladies pulmonaires aiguës et chroniques qui affectent un ou plusieurs de tous les composants parenchymateux pulmonaires formant l’interstitium, tels que les bronches, les alvéoles, le tissu conjonctif et les vaisseaux sanguins et lymphatiques. Bien qu’il s’agisse de maladies rares, les plus de 200 sous-types différents de MPI représentent une catégorie de maladie hétérogène avec des caractéristiques cliniques, radiologiques et cyto-histologiques différentes. Les MPI se manifestent généralement par une inflammation, une fibrose ou une combinaison des deux, qui sont les causes sous-jacentes des symptômes habituels perçus par les patients comme la toux sèche, la dyspnée à l’effort et la fatigue 1,2.
Les MPI sont classées en deux catégories : pneumonie interstitielle idiopathique (PII), pneumonie interstitielle d’étiologie connue (p. ex., maladie du tissu conjonctif, pneumopathie interstitielle, pneumopathie interstitielle d’origine médicamenteuse et pneumoconiose liée au travail), affection interstitielle granulomateuse (p. ex., sarcoïdose et pneumonie d’hypersensibilité) et MPI orphelines (p. ex., pneumocologites kystiques multiples et pneumonie à éosinophiles)1. Cette catégorisation et un sous-typage diagnostique plus poussé sont essentiels pour déterminer le traitement et le suivi optimaux, et permettent un pronostic. Cependant, comme le casse-tête diagnostique peut être difficile, ilest recommandé d’interpréter les informations cliniques disponibles (y compris l’anamnèse, la disposition et les expositions potentielles) et paracliniques telles que la tomodensitométrie thoracique à haute résolution (TDM), la physiologie pulmonaire et l’auto-immunologie obtenues sur la base d’une discussion d’équipe multidisciplinaire (TDM) 3,4,5. S’il n’est pas possible d’obtenir un diagnostic fiable de TDM 6,7, le prélèvement histologique visant à augmenter la probabilité d’un diagnostic définitif de sous-type de MPI est indiqué par l’utilisation de la cryobiopsie pulmonaire transbronchique (TBLC)8,9. Chez les patients bien sélectionnés, la TBLC est considérée comme une procédure invasive sûre avec une précision diagnostique proche de celle de la biopsie pulmonaire (SLB) de chirurgie thoracique vidéo-assistée, qui est toujours considérée comme l’étalon-or histologique pour le diagnostic histologique de la MPI 10,11,12,13,14. La procédure TBLC est réalisée comme une bronchoscopie systématique, en appliquant des cryosondes spéciales pour le prélèvement histologique et avec des conseils fluoroscopiques recommandés. Il est recommandé que la TBLC soit réalisée dans des centres tertiaires de MPI en utilisant un cadre de TDM et par des pneumologues interventionnels familiers avec la prise en charge des complications de la TBLC, qui ont suivi une formation dans un centre dédié avec une expertise TBLC 9,10,11,15,16,17.
La TBLC a également récemment attiré l’attention en tant que procédure à combiner avec l’échographie endobronchique radiale (R-EBUS) pour le diagnostic de la MPI18,19. De plus, la TBLC a été associée à la fois à la R-EBUS et à la bronchoscopie à navigation électromagnétique (ENB) pour diagnostiquer les lésions pulmonaires périphériques (PPL) afin d’améliorer le rendement diagnostique par rapport aux biopsies transbronchiques conventionnellespar pince 20,21. Cependant, cette approche relativement nouvelle pour le diagnostic PPL n’a pas encore été mise en œuvre en tant que procédure standard et justifie donc des preuves supplémentaires dans ce domaine spécifique. L’objectif du présent rapport est de décrire une approche par étapes de la réalisation d’une TBLC avec un bronchoscope flexible dans un cadre clinique pour les indications mentionnées.
Protocole
Les auteurs proviennent de deux centres danois de TBLC (l’hôpital universitaire d’Odense et l’hôpital universitaire d’Aarhus) qui mènent tous deux des recherches conformément aux principes de la Déclaration d’Helsinki. L’approbation éthique n’était pas nécessaire car l’étude était de nature observationnelle. Tous les patients inclus à des fins de recherche ont donné leur consentement éclairé par écrit. Il est important de souligner que l’approche par étapes décrite pour la conductance du TBLC se rapporte à l’utilisation d’un bronchoscope flexible et est basée sur une combinaison de recommandations de directives internationales, de déclarations d’experts, d’examens de l’état de l’art et d’expériences des deux centres TBLC 9,10,11,15,16,17,22,23,24 ,25.
1. Considérations pré-TBLC
- S’assurer que la TBLC est indiquée, ce qui est justifié chez les patients chez qui l’intégration des informations provenant de la TDM, de la biochimie et de l’auto-immunologie dans un TDM antérieur impliquant des pneumologues et des radiologues n’a pas permis d’établir un diagnostic fiable de MPI.
- Sélectionner les patients appropriés en évitant les contre-indications décrites dans le tableau 1.
| Contre-indications relatives | Contre-indications absolues |
| La capacité vitale forcée (CVF) < 50 % de la valeur prédite | Thrombocytopénie < 50 x 109/L ou INR > 1,5 |
| La capacité de diffusion du monoxyde de carbone pour les poumons (DLCO) < 35 % de la valeur prédite | Diathèse hémorragique non corrigée |
| Pression artérielle pulmonaire systolique > 50 mmHg (p. ex., estimation basée sur une échocardiographie) | Déclin progressif et clinique en raison d’un risque accru de complications chez les patients dont la fonction pulmonaire est compromise |
| Indice de masse corporelle > 35 kg/m2 |
Tableau 1 : Contre-indications au TBLC. Contre-indications relatives et absolues à la conductance TBLC. Abréviation : TBLC = cryobiopsie pulmonaire transbronchique.
2. Préparation préTBLC
- Passez en revue la TDM et les suggestions du radiologiste thoracique pour déterminer à partir duquel le prélèvement histologique des segments bronchiques est le mieux accessible en fonction de la manifestation de la maladie radiologique.
- Vérifiez que le système fonctionne avant les performances de TBLC.
- Appuyez sur le bouton de capacité du réservoir de gaz (dioxyde de carbone (CO2) ou protoxyde d’azote (NO)) sur le panneau de configuration pour vérifier le volume de gaz dans la bouteille.
- Placez la cryosonde sur un plateau et observez la sonde tout en appuyant sur la pédale pendant 5 à 10 secondes. Recherchez une boule de glace à l’extrémité de la sonde qui indiquera qu’elle fonctionne correctement (Figure 1).
- Utilisez une anesthésie générale (AG) ou une sédation profonde sous TBLC et envisagez une prémédication avec de l’acide tranexamique de 0,5 à 1 g pour réduire le risque de saignement.
- Placez un tube endotrachéal luminal spécial (ETT) de 7,5 à 8,5 mm dans la trachée.
REMARQUE : L’ETT a un canal principal qui permet l’accès au bronchoscope pendant que le patient est ventilé et a un canal latéral mineur qui sert de canal de travail pour le cathéter bloqueur bronchique.- Vaporiser en continu avec une anesthésie locale (par exemple, spray de lidocaïne 10 %) pour réduire la toux. Voir aussi l’étape 3.5.
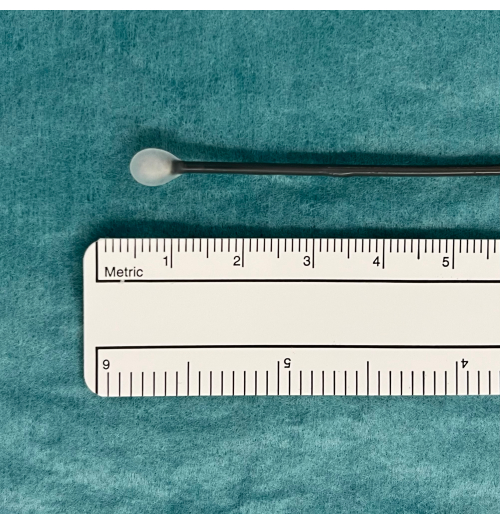
Figure 1 : Une boule de glace comme indication de l’équipement TBLC utilisable. Une pédale active la diffusion de gazCO2 du réservoir et la congélation induite. Ceci est testé dans l’eau où une boule de glace apparaîtra à l’extrémité de la cryosonde si elle fonctionne correctement. Abréviation : TBLC = cryobiopsie pulmonaire transbronchique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Conductance TBLC
- Introduisez un bronchoscope flexible à travers l’ETT et effectuez la procédure de bronchoscopie.
REMARQUE : Un bronchoscope rigide est utilisé dans certains centres TBLC pour intuber la trachée. Si la trachée est intubée par un bronchoscope rigide, un bronchoscope flexible peut être passé à travers le bronchoscope rigide.- Introduire la cryosonde flexible à travers le canal de travail du bronchoscope et dans le BS sélectionné.
REMARQUE : Les cryosondes se présentent à la fois comme des sondes à usage unique (1,1, 1,7 et 2,4 mm) et des sondes réutilisables (1,9 et 2,4 mm). - Utiliser la fluoroscopie pour s’assurer que l’extrémité de la cryosonde est placée à environ 10 mm de la paroi thoracique correspondant à la BS sélectionnée (Figure 2).
- Introduisez un cathéter bloqueur bronchique (par exemple, un ballonnet de Fogarty) dans le canal latéral de l’ETT double luminal et placez-le à l’ostium BS sélectionné (Figure 3).
- Gonflez le cathéter bloqueur des bronches pour évaluer la pertinence de l’emplacement et du blocage pour un saignement potentiel se produisant distalement par rapport au ballonnet (figure 4).
- Dégonflez le cathéter bloqueur des bronches si le ballonnet est bien placé.
- Sécurisez la mise en place du ballonnet en fixant le cathéter bloqueur des bronches à l’aide d’un spon.
- Utilisez de petites quantités de spray de lidocaïne ou de solution saline dans l’ETT respectif et son canal latéral afin de réduire toute friction due à l’introduction de la cryosonde dans l’ETT et du cathéter à ballonnet dans le canal latéral de l’ETT.
- Lorsque les étapes 3.1.1 à 3.1.3 sont exécutées de manière satisfaisante, appuyez sur la pédale de congélation pendant 3 à 6 s, en fonction de la taille de la cryosonde, pour exploiter la loi de Joule-Thompson afin de congeler le tissu parenchymateux pulmonaire à environ -45-79 °C pour le CO2 et -89 °C pour le NO.
- Rétractez le bronchoscope flexible contenant la cryosonde d’un seul mouvement rapide tout en maintenant la pédale de congélation enfoncée pour continuer à geler et empêcher la biopsie de tomber pendant la rétraction.
- Au cours de la manœuvre décrite à l’étape 3.1.5, demandez à une personne autre que le bronchoscopiste de maintenir le ballonnet gonflé pour bloquer le site de biopsie distal de l’ostium BS sélectionné afin de contrôler l’absence potentielle de saignement.
- Introduire la cryosonde flexible à travers le canal de travail du bronchoscope et dans le BS sélectionné.
- Poursuivre l’étape 3.1.6 jusqu’à ce qu’au moins deux biopsies de deux BS du même lobe soient obtenues.
- Placez les biopsies dans une solution saline, et lorsque toutes les biopsies sont obtenues, fixez-les dans du formaldéhyde (4 %) (Figure 5).
- Envoyez les biopsies pour un examen pathologique avant le TDM.
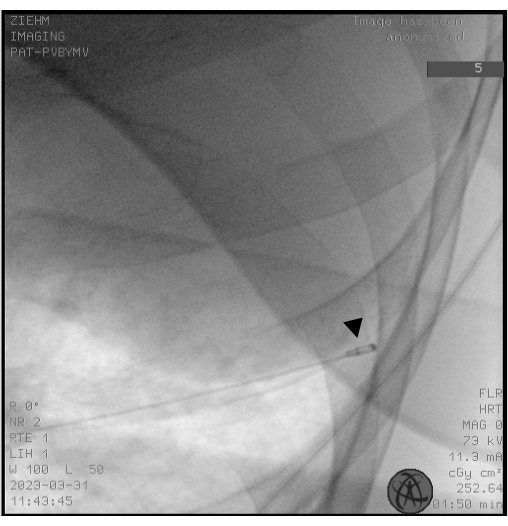
Figure 2 : Fluoroscopie. La fluoroscopie est utilisée pour assurer le placement correct de la cryosonde avant la congélation. L’extrémité de la cryosonde apparaît comme la tête d’un pilon (pointe de flèche noire). Veuillez cliquer ici pour voir une version agrandie de cette figure.
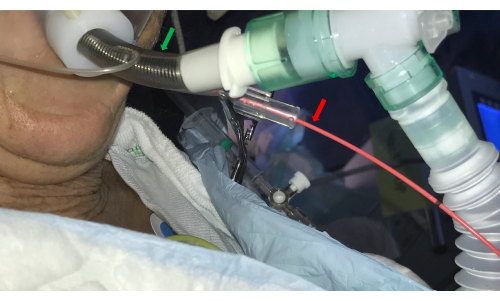
Figure 3 : Sonde endotrachéale. Un tube endotrachéal double-luminal (flèche verte) permet l’accès aux voies respiratoires par le bronchoscope et contrôle simultanément les saignements en introduisant un cathéter à ballonnet dans le canal latéral (flèche rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Gonflage du cathéter à ballonnet. Gonflage du cathéter à ballonnet pour assurer le blocage et prévenir les saignements distaux potentiels du ballonnet se distribuant à d’autres parties du lobe après avoir effectué une cryobiopsie pulmonaire transbronchique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
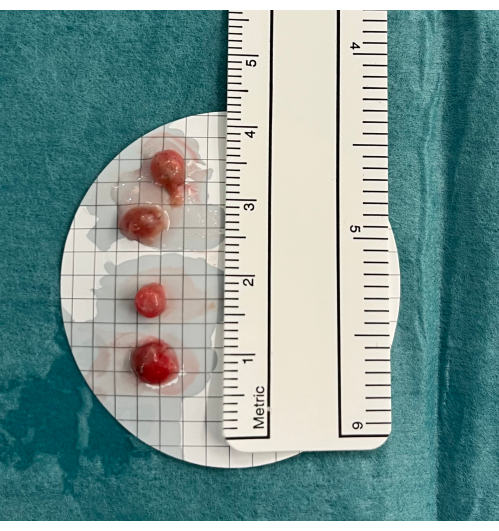
Figure 5 : Biopsies. Les cryobiopsies pulmonaires transbronchiques sont placées dans une solution saline froide avant d’être fixées dans du formaldéhyde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Procédures postTBLC
- Après chaque biopsie, réintroduisez le bronchoscope dans la BS et dégonflez le ballonnet pour observer s’il y a saignement.
- Regonflez le ballonnet si vous observez un saignement (figure 6). Si le ballonnet est dans la bonne position et bloque le BS, attendez quelques minutes que le saignement s’arrête, puis continuez la procédure TBLC.
- Si des saignements persistent après l’étape 4.1.1, installez une solution saline glacée distalement sur le ballonnet.
- En cas de saignement continu après l’étape 4.1.2. ou l’échec du ballon où le sang se déverse dans d’autres BS, utilisez une combinaison d’aspiration, de solution saline glacée administrée par endobronchie avec ou sans adrénaline et d’acide tranexamique.
- Si le sang coagulé bloque les voies respiratoires, utilisez la cryosonde pour ouvrir à nouveau les voies respiratoires en congelant l’extrémité de la cryosonde dans le caillot sanguin et en la rétractant vers le haut à travers l’ETT.
- Si le saignement n’est pas contrôlé, remplacez l’ETT par un système qui permet à la fois la ventilation du poumon non biopsié et l’obstruction de la bronche principale du poumon saignant, puis transférez le patient dans une unité de soins intensifs.
- Réaliser une échographie pulmonaire focalisée (FLUS) après TBLC, alors que le patient est encore sous sédation afin d’identifier les signes d’un pneumothorax iatrogène (PTX).
- Envisager l’insertion d’un drain pleural guidé par FLUS à l’aide d’un cathéter en queue de cochon (Fr 7-16) si les observations de FLUS indiquent une forte probabilité de PTX. Le drainage pleural est indiqué si le FLUS indique une augmentation rapide de la taille du PTX, et surtout si l’état clinique du patient se détériore.
- Retardez l’extubation de 5 à 10 minutes si FLUS révèle un petit PTX et que le patient est cliniquement stable. Si la taille du PTX progresse par la suite ou si le patient devient cliniquement instable, insérez un drain pleural avant l’extubation.
- Extuber le patient après l’étape 4.2 ou l’étape 4.2.2 s’il n’y a aucune indication de PTX ou de progression de la taille du PTX et que le patient reste cliniquement stable.
- Observez le patient dans une salle de réveil après une TBLC. Juste avant que le patient cliniquement stable ne rentre chez lui, assurez-vous qu’il n’y a pas de PTX d’apparition tardive par des FLUS répétés ou une radiographie pulmonaire.
- Discutez de la présentation des caractéristiques histologiques des biopsies lors d’un TDM ultérieur avec des pneumologues, des radiologues et des pathologistes en conjonction avec d’autres détails pour conclure à un sous-type de MPI avec une probabilité diagnostique élevée.
- Informez le patient de la conclusion du TDM à partir de l’étape 4.5 dans la clinique externe, et planifiez le traitement et le suivi potentiels.
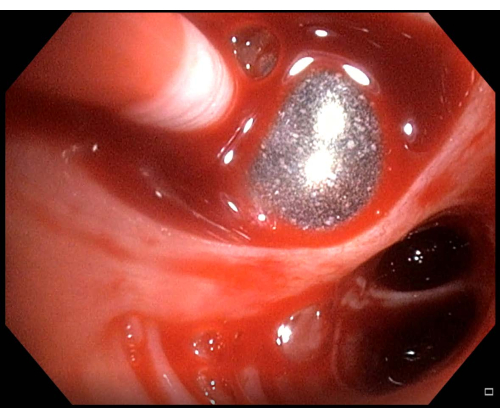
Figure 6 : Saignement mineur. Si un saignement est observé après avoir effectué une cryobiopsie pulmonaire transbronchique, dans ce cas, un saignement mineur, le cathéter à ballonnet doit être maintenu gonflé quelques minutes avant de retenter le dégonflage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. TBLC en conjonction avec R-EBUS et ENB pour le diagnostic PPL
- Naviguez et confirmez l’emplacement de la lésion pulmonaire périphérique.
- Insérez la cryosonde de 1,1 mm dans le canal de travail étendu sous la direction de la fluoroscopie.
- Faites correspondre l’extrémité de la sonde de congélation avec la position de la sonde EBUS radiale.
- Appuyez sur la pédale de congélation pendant 4 à 8 s.
- Rétractez la cryosonde à travers le canal de travail prolongé en un seul mouvement rapide tout en maintenant la pédale de congélation enfoncée pour continuer à geler et empêcher la biopsie de tomber pendant la rétraction.
- Maintenez le bronchoscope et le canal de travail étendu en position pendant que la cryosonde est rétractée.
- Répétez les étapes 5.2 à 5.4 jusqu’à ce qu’un nombre suffisant de biopsies soit obtenu.
- Manipulez les biopsies comme décrit aux étapes 3.3 et 3.4.
Résultats
D’après les observations des auteurs de deux centres TBLC, la procédure par étapes décrite pour le TBLC avec un bronchoscope flexible a permis un prélèvement histologique chez des patients danois bien sélectionnés avec des sous-types de MPI non encore diagnostiqués malgré un TDM antérieur. Des observations détaillées de ces cohortes sont rapportées dans deux études récemment publiées23,25 et, pour le centre du ...
Discussion
Quelle que soit l’indication de la TBLC, ses propriétés diagnostiques dépendent de la qualité de la performance de l’intervention et des critères retenus pour la subir. Cela met l’accent sur la recommandation de mettre en œuvre un programme de formation formel et certifié afin d’acquérir les compétences requises pour effectuer une procédure TBLC standardisée. Malgré le fait qu’il n’existe actuellement aucune formation officielle sur la TBLC, les récentes directiv...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier le personnel des départements de chirurgie thoracique et d’anesthésiologie du service de bronchoscopie de l’hôpital universitaire d’Odense, au Danemark, pour leur aide dans la préparation des figures de cet article.
matériels
| Name | Company | Catalog Number | Comments |
| "Chimney" for tube | |||
| CO2 gas bottle adapter | |||
| CO2 gas tank | Erbe | ||
| Endoscopy column | |||
| Endotracheal tube, size 7.5-8.5 mm | Erbe | ||
| Erbecryo pedal footswitch | Erbe | ||
| Erbecryo2 workstation | Erbe | ||
| Flexible bronchoscope | |||
| Flexible gas hose | Mediland | ||
| Flexible single use cryoprobe, OD 1.1 mm | Erbe | ||
| Flexible single use cryoprobe, OD 1.7 mm | Erbe | ||
| Flexible single use cryoprobe, OD 2.4 mm | |||
| Fluoroscope | |||
| Fogarty balloon catheter | |||
| Formalin glasses in closed system | |||
| NaCl incl. cold NaCl | |||
| Pean for fixating Fogarty balloon | |||
| Sterile disposable cup | |||
| Sterile suction tube | |||
| Sterile tweesers | |||
| Syringe for Fogarty balloon inflation/deflation | |||
| Table bag for flouroscope | |||
| Three way tap for Fogarty balloon syringe | |||
| Tracheal suction | |||
| Ultrasound machine | Erbe | ||
| Valve for biopsy chanel | |||
| Valve to suction duct |
Références
- Travis, W. D., et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine. 188 (6), 733-748 (2013).
- Ruaro, B., et al. Editorial: Pulmonary fibrosis: One manifestation, various diseases. Frontiers in Pharmacology. 13, 1027332 (2022).
- Lamas, D. J., et al. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. American Journal of Respiratory and Critical Care Medicine. 184 (7), 842-847 (2011).
- Tomassetti, S., Piciucchi, S., Tantalocco, P., Dubini, A., Poletti, V. The multidisciplinary approach in the diagnosis of idiopathic pulmonary fibrosis: a patient case-based review. European Respiratory Review. 24 (135), 69-77 (2015).
- Walsh, S. L. F., et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respiratory Medicine. 4 (7), 557-565 (2016).
- Ryerson, C. J., et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 196 (10), 1249-1254 (2017).
- Cottin, V., et al. Integrating clinical probability into the diagnostic approach to idiopathic pulmonary fibrosis: An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 206 (3), 247-259 (2022).
- Rodrigues, I., et al. Diagnostic yield and safety of transbronchial lung cryobiopsy and surgical lung biopsy in interstitial lung diseases: a systematic review and meta-analysis. European Respiratory Review. 31 (166), 210280 (2022).
- Korevaar, D. A., et al. European Respiratory Society guidelines on transbronchial lung cryobiopsy in the diagnosis of interstitial lung diseases. European Respiratory Journal. 60 (5), 2200425 (2022).
- Colella, S., Haentschel, M., Shah, P., Poletti, V., Hetzel, J. Transbronchial lung cryobiopsy in interstitial lung diseases: best practice. Respiration. 95 (6), 383-391 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the Cryobiopsy Working Group on safety and utility and a call for standardization of the procedure. Respiration. 95 (3), 188-200 (2018).
- Ravaglia, C., Poletti, V. Transbronchial lung cryobiopsy for the diagnosis of interstitial lung diseases. Current Opinion in Pulmonary Medicine. 28 (1), 9-16 (2022).
- Troy, L. K., et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respiratory Medicine. 8 (2), 171-181 (2020).
- Ruaro, B., et al. Transbronchial lung cryobiopsy and pulmonary fibrosis: A never-ending story. Heliyon. 9 (4), e14768 (2023).
- Lentz, R. J., Argento, A. C., Colby, T. V., Rickman, O. B., Maldonado, F. Transbronchial cryobiopsy for diffuse parenchymal lung disease: a state-of-the-art review of procedural techniques, current evidence, and future challenges. Journal of Thoracis Disease. 9 (7), 2186-2203 (2017).
- Maldonado, F., et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest. 157 (4), 1030-1042 (2020).
- Avasarala, S. K., Wells, A. U., Colby, T. V., Maldonado, F. Transbronchial cryobiopsy in interstitial lung diseases: State-of-the-art review for the interventional pulmonologist. Journal of Bronchology Interventional Pulmonology. 28 (1), 81-92 (2021).
- Abdelghani, R., Thakore, S., Kaphle, U., Lasky, J. A., Kheir, F. Radial Endobronchial Ultrasound-guided Transbronchial Cryobiopsy. Journal of Bronchology Interventional Pulmonology. 26 (4), 245-249 (2019).
- Inomata, M., et al. Utility of radial endobronchial ultrasonography combined with transbronchial lung cryobiopsy in patients with diffuse parenchymal lung diseases: a multicentre prospective study. BMJ Open Respiratory Research. 8 (1), e000826 (2021).
- Benn, B. S., Gmehlin, C. G., Kurman, J. S., Doan, J. Does transbronchial lung cryobiopsy improve diagnostic yield of digital tomosynthesis-assisted electromagnetic navigation guided bronchoscopic biopsy of pulmonary nodules? A pilot study. Respiratory Medicine. 202, 106966 (2022).
- Ankudavicius, V., Miliauskas, S., Poskiene, L., Vajauskas, D., Zemaitis, M. Diagnostic yield of transbronchial cryobiopsy guided by radial endobronchial ultrasound and fluoroscopy in the radiologically suspected lung cancer: A single institution prospective study. Cancers. 14 (6), 1563 (2022).
- Ravaglia, C., et al. Transbronchial lung cryobiopsy in diffuse parenchymal lung disease: Comparison between biopsy from 1 segment and biopsy from 2 segments - diagnostic yield and complications. Respiration. 93 (4), 285-292 (2017).
- Davidsen, J. R., Skov, I. R., Louw, I. G., Laursen, C. B. Implementation of transbronchial lung cryobiopsy in a tertiary referral center for interstitial lung diseases: a cohort study on diagnostic yield, complications, and learning curves. BMC Pulmonary Medicine. 21 (1), 67 (2021).
- Laursen, C. B., et al. Lung ultrasound assessment for pneumothorax following transbronchial lung cryobiopsy. ERJ Open Research. 7 (3), 00045-2021 (2021).
- Kronborg-White, S., et al. Integration of cryobiopsies for interstitial lung disease diagnosis is a valid and safe diagnostic strategy-experiences based on 250 biopsy procedures. Journal of Thoracic Disease. 13 (3), 1455-1465 (2021).
- Barisione, E., et al. Competence in transbronchial cryobiopsy. Panminerva Medica. 61 (3), 290-297 (2019).
- Raghu, G., et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 205 (9), e18-e47 (2022).
- Ravaglia, C., et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulmonary Medicine. 19 (1), 16 (2019).
- Hernandez-Gonzalez, F., et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: yield and cost-effectiveness analysis. Archivos de Bronconeumología. 51 (6), 261-267 (2015).
- Cooley, J., et al. Safety of performing transbronchial lung cryobiopsy on hospitalized patients with interstitial lung disease. Respiratory Medicine. 140, 71-76 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsy increases diagnostic confidence in interstitial lung disease: a prospective multicenter trial. European Respiratory Journal. 56 (6), 1901520 (2020).
- Kheir, F., et al. Transbronchial lung cryobiopsy in patients with interstitial lung disease: a systematic review. Annals of the American Thoracic Society. 19 (7), 1193-1202 (2022).
- Walscher, J., et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: real-life experience from a tertiary referral center for interstitial lung disease. Respiration. 97 (4), 348-354 (2019).
- Gnass, M., et al. Transbronchial lung cryobiopsy guided by radial mini-probe endobronchial ultrasound in interstitial lung diseases - a multicenter prospective study. Advances in Respiratory Medicine. 88 (2), 123-128 (2020).
- Ma, X., et al. Global and regional burden of interstitial lung disease and pulmonary sarcoidosis from 1990 to 2019: results from the Global Burden of Disease study 2019. Thorax. 77 (6), 596-605 (2022).
- Kronborg-White, S., et al. A pilot study on the use of the super dimension navigation system for optimal cryobiopsy location in interstitial lung disease diagnostics. Pulmonology. 29 (2), 119-123 (2021).
- Wijmans, L., et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder. Respiration. 97 (3), 259-263 (2019).
- Kheir, F., et al. Using bronchoscopic lung cryobiopsy and a genomic classifier in the multidisciplinary diagnosis of diffuse interstitial lung diseases. Chest. 158 (5), 2015-2025 (2020).
- Renzoni, E. A., Poletti, V., Mackintosh, J. A. Disease pathology in fibrotic interstitial lung disease: is it all about usual interstitial pneumonia. Lancet. 398 (10309), 1437-1449 (2021).
- Chaudhary, S., et al. Interstitial lung disease progression after genomic usual interstitial pneumonia testing. European Respiratory Journal. 61 (4), 2201245 (2023).
- Raghu, G., et al. Use of a molecular classifier to identify usual interstitial pneumonia in conventional transbronchial lung biopsy samples: a prospective validation study. Lancet Respiratory Medicine. 7 (6), 487-496 (2019).
- Kheir, F., et al. Use of a genomic classifier in patients with interstitial lung disease: a systematic review and meta-analysis. Annals of American Thoracic Society. 19 (5), 827-832 (2022).
- Glenn, L. M., Troy, L. K., Corte, T. J. Novel diagnostic techniques in interstitial lung disease. Frontiers in Medicine. 10, 1174443 (2023).
- Kim, S. H., et al. The additive impact of transbronchial cryobiopsy using a 1.1-mm diameter cryoprobe on conventional biopsy for peripheral lung nodules. Cancer Research and Treatment. 55 (2), 506-512 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon