Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Transbronchiale Lungenkryobiopsie zur Diagnostik von interstitiellen Lungenerkrankungen und peripheren Lungenläsionen - ein schrittweises Vorgehen
In diesem Artikel
Zusammenfassung
Die transbronchiale Lungenkryobiopsie (TBLC) zur Diagnose von interstitiellen Lungenerkrankungen und peripheren Lungenläsionen ist ein ergiebiges diagnostisches und sicheres Verfahren. Wir beschreiben einen schrittweisen Ansatz zur Durchführung der TBLC für die verschiedenen genannten Indikationen mit einem flexiblen Bronchoskop, der für Bronchoskopik-Anfänger, die TBLC durchführen, hilfreich sein kann.
Zusammenfassung
Die transbronchiale Lungenkryobiopsie (TBLC) ist ein invasives Verfahren, das in den letzten zehn Jahren zunehmend als Alternative zur videoassistierten thorakalen Lungenbiopsie (SLB) zur Diagnose von interstitiellen Lungenerkrankungen (ILDs) eingesetzt wurde. Die Indikation für die TBLC bestand in erster Linie darin, einen bestimmten ILD-Subtyp zu subklassifizieren, wenn dies auf der Grundlage einer vorangegangenen multidisziplinären Teamdiskussion nicht erreicht werden konnte. Obwohl die SLB als Goldstandard für die Etablierung einer histologischen Diagnose gilt, wurde die TBLC nach und nach als histologische Diagnosemethode der ersten Wahl bei Patienten mit nicht klassifizierten ILDs vorgeschlagen, da sie eine vergleichbare diagnostische Ausbeute wie SLB aufweist, aber der SLB in Bezug auf Komplikationen, einschließlich Mortalität, überlegen ist. In den letzten Jahren wurden auch der radiale endobronchiale Ultraschall (R-EBUS) und die durch elektromagnetische Navigationsbronchoskopie (ENB) gesteuerte TBLC bei peripheren Lungenläsionen als sichere Verfahren beschrieben, die die diagnostische Ausbeute im Vergleich zu Zangenbiopsien verbessern können. Dennoch hängen die diagnostischen Eigenschaften der TBLC von der Qualität der Leistung des Verfahrens ab. In diesem Artikel soll der schrittweise Ansatz zur Durchführung der TBLC mit einem flexiblen Bronchoskop für die verschiedenen genannten Indikationen beschrieben werden, der für Bronchoskopik-Anfänger, die TBLC durchführen, hilfreich sein kann.
Einleitung
Interstitielle Lungenerkrankungen (ILDs) stellen eine Gruppe von akuten und chronischen Lungenerkrankungen dar, die eine oder mehrere aller Lungenparenchymkomponenten betreffen, die das Interstitium bilden, wie Bronchien, Lungenbläschen, Bindegewebe sowie Blut- und Lymphgefäße. Obwohl es sich um seltene Erkrankungen handelt, stellen die mehr als 200 verschiedenen Subtypen von ILDs eine heterogene Krankheitskategorie mit unterschiedlichen klinischen, radiologischen und zyto-histologischen Merkmalen dar. ILDs manifestieren sich typischerweise als Entzündung, Fibrose oder eine Kombination aus beidem, die die zugrunde liegenden Ursachen für die üblichen wahrgenommenen Symptome der Patienten wie trockener Husten, Dyspnoe bei Anstrengung und Müdigkeit sind 1,2.
ILDs werden kategorisiert als idiopathische interstitielle Pneumonie (IIP), interstitielle Pneumonie bekannter Ätiologie (z. B. Bindegewebserkrankung, interstitielle Lungenerkrankung, medikamenteninduzierte ILD und arbeitsbedingte Pneumokoniose), granulomatöse interstitielle Affektion (z. B. Sarkoidose und Überempfindlichkeitspneumonie) und ILDs (z. B. multiple zystische Lungenerkrankungen und eosinophile Pneumonie)1. Diese Kategorisierung und weitere diagnostische Subtypisierungen sind grundlegend für die Bestimmung einer optimalen Therapie und Nachsorge und ermöglichen eine Prognose. Da das diagnostische Puzzle jedoch eine Herausforderung darstellen kann, wird die Interpretation der verfügbaren klinischen (einschließlich Anamnese, Disposition und möglicher Expositionen) und paraklinischen Informationen wie hochauflösende Computertomographie (HRCT) des Brustkorbs, Lungenphysiologie und Autoimmunologie, die auf der Grundlage einer multidisziplinären Teamdiskussion (MDD) gewonnen wurden, empfohlen 3,4,5. Wenn eine sichere MDD-Diagnose nicht möglich ist 6,7, ist eine histologische Probenahme angezeigt, um die Wahrscheinlichkeit einer eindeutigen Diagnose des ILD-Subtyps durch den Einsatz einer transbronchialen Lungenkryobiopsie (TBLC) zu erhöhen8,9. Bei gut selektierten Patienten gilt die TBLC als sicheres invasives Verfahren mit einer diagnostischen Genauigkeit, die der der videoassistierten thorakalchirurgischen Lungenbiopsie (SLB) nahe kommt, die nach wie vor als histologischer Goldstandard für die histologische ILD-Diagnostik gilt 10,11,12,13,14. Das TBLC-Verfahren wird als systematische Bronchoskopie durchgeführt, wobei spezielle Kryosonden für die histologische Probenahme und mit empfohlener fluoroskopischer Führung verwendet werden. Es wird empfohlen, dass die TBLC in tertiären ILD-Zentren mit einer MDD-Einstellung und von interventionellen Pneumologen durchgeführt wird, die mit der Behandlung von TBLC-Komplikationen vertraut sind und in einem speziellen Zentrum mit TBLC-Expertise ausgebildet wurden 9,10,11,15,16,17.
In jüngster Zeit hat die TBLC auch als ein Verfahren in Kombination mit dem radialen endobronchialen Ultraschall (R-EBUS) für die ILD-Diagnostik Aufmerksamkeit erregt18,19. Darüber hinaus wurde die TBLC sowohl mit R-EBUS als auch mit der elektromagnetischen Navigationsbronchoskopie (ENB) zur Diagnose peripherer pulmonaler Läsionen (PPL) kombiniert, um die diagnostische Ausbeute im Vergleich zu herkömmlichen transbronchialen Zangenbiopsien zu verbessern20,21. Dieser relativ neue Ansatz für die PPL-Diagnostik wurde jedoch noch nicht als Standardverfahren implementiert und rechtfertigt daher weitere Evidenz in diesem speziellen Bereich. Das Ziel des vorliegenden Berichts ist es, einen schrittweisen Ansatz für die Durchführung der TBLC mit einem flexiblen Bronchoskop im klinischen Umfeld für die genannten Indikationen zu beschreiben.
Protokoll
Die Autoren kommen aus zwei dänischen TBLC-Zentren (Universitätskrankenhaus Odense und Universitätsklinikum Aarhus), die beide nach den Prinzipien der Deklaration von Helsinki forschen. Eine ethische Genehmigung war nicht erforderlich, da es sich um eine Beobachtungsstudie handelte. Alle Patienten, die zu Forschungszwecken einbezogen wurden, gaben eine schriftliche Einverständniserklärung. Es ist wichtig zu betonen, dass sich der beschriebene schrittweise Ansatz für die TBLC-Leitfähigkeit auf die Verwendung eines flexiblen Bronchoskops bezieht und auf einer Kombination von Empfehlungen aus internationalen Leitlinien, Expertenstellungen, aktuellen Überprüfungen und Erfahrungen aus den beiden TBLC-Zentren 9,10,11,15,16,17,22,23,24 basiert ,25.
1. Überlegungen zu PreTBLC
- Sicherstellen, dass eine TBLC indiziert ist, was bei Patienten gerechtfertigt ist, bei denen die Integration von Informationen aus der HRCT, der Biochemie und der Autoimmunologie in eine vorangegangene MDD, an der Pneumologen und Radiologen beteiligt waren, nicht in der Lage war, eine sichere ILD-Diagnose zu stellen.
- Wählen Sie geeignete Patienten aus, indem Sie die in Tabelle 1 beschriebenen Kontraindikationen vermeiden.
| Relative Kontraindikationen | Absolute Kontraindikationen |
| Forcierte Vitalkapazität (FVC) < 50 % des vorhergesagten Wertes | Thrombozytopenie < 50 x 109/L oder INR > 1,5 |
| Diffusionskapazität von Kohlenmonoxid für die Lunge (DLCO) < 35 % des vorhergesagten Wertes | Unkorrigierte Blutungsdiathese |
| Systolischer pulmonalarterieller Druck > 50 mmHg (z. B. Abschätzung anhand einer Echokardiographie) | Fortschreitender und klinischer Rückgang aufgrund eines erhöhten Komplikationsrisikos bei Patienten mit eingeschränkter Lungenfunktion |
| Body-Mass-Index > 35 kg/m2 |
Tabelle 1: Kontraindikationen für TBLC. Relative und absolute Kontraindikationen für die TBLC-Leitfähigkeit. Abkürzung: TBLC = transbronchiale Lungenkryobiopsie.
2. Vorbereitung der PreTBLC
- Überprüfen Sie die HRCT und die Vorschläge des Thoraxradiologen, um zu planen, aus welchen Bronchialsegmenten (BS) histologische Proben je nach radiologischer Krankheitsmanifestation am besten zugänglich sind.
- Testen Sie vor der TBLC-Leistung, ob das System funktioniert.
- Drücken Sie die Taste für das Fassungsvermögen des Gastanks (Kohlendioxid (CO2) oder Distickstoffmonoxid (NO)) auf dem Einstellungsfeld, um das Volumen des Gases in der Flasche zu überprüfen.
- Stellen Sie die Kryosonde auf ein Tablett und beobachten Sie die Sonde, während Sie den Pedalfußschalter 5-10 s lang drücken. Suchen Sie nach einem Eisball an der Spitze der Sonde, der anzeigt, dass sie ordnungsgemäß funktioniert (Abbildung 1).
- Verwenden Sie eine Vollnarkose (GA) oder eine tiefe Sedierung unter TBLC und erwägen Sie eine Prämedikation mit Tranexamsäure von 0,5-1 g, um das Blutungsrisiko zu verringern.
- Platzieren Sie einen speziellen doppelten luminalen Endotrachealtubus (ETT) mit einer Größe von 7,5-8,5 mm in der Luftröhre.
HINWEIS: Der ETT verfügt über einen Hauptkanal, der den Zugang zum Bronchoskop ermöglicht, während der Patient beatmet wird, und einen kleinen Seitenkanal, der als Arbeitskanal für den Bronchialblocker-Katheter dient.- Sprühen Sie kontinuierlich mit örtlicher Betäubung (z. B. Lidocain-Spray 10%), um den Husten zu reduzieren. Siehe auch Schritt 3.5.
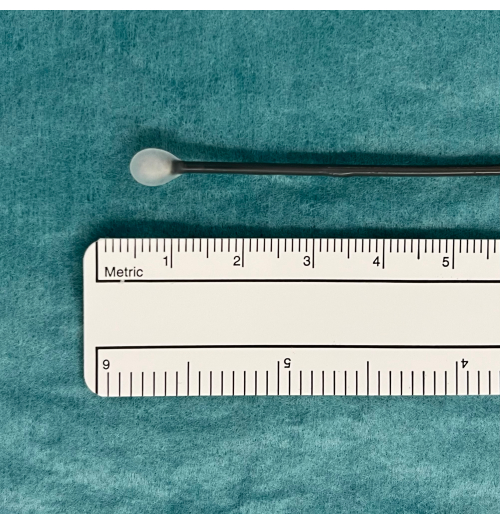
Abbildung 1: Ein Eisball als Hinweis auf verwendbares TBLC-Equipment. Ein Pedal aktiviert die CO2 - Gasdiffusion aus dem Tank und induziert das Einfrieren. Dies wird in Wasser getestet, wo ein Eisball an der Spitze der Kryosonde erscheint, wenn sie ordnungsgemäß funktioniert. Abkürzung: TBLC = transbronchiale Lungenkryobiopsie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. TBLC-Leitwert
- Führen Sie ein flexibles Bronchoskop durch das ETT ein und führen Sie die Bronchoskopie durch.
HINWEIS: In einigen TBLC-Zentren wird ein starres Bronchoskop verwendet, um die Luftröhre zu intubieren. Wenn die Luftröhre mit einem starren Bronchoskop intubiert wird, kann ein flexibles Bronchoskop durch das starre Bronchoskop geführt werden.- Führen Sie die flexible Kryosonde durch den Arbeitskanal des Bronchoskops in den ausgewählten BS ein.
HINWEIS: Die Kryosonden werden sowohl als Einwegsonden (1,1, 1,7 und 2,4 mm) als auch als wiederverwendbare Sonden (1,9 und 2,4 mm) hergestellt. - Verwenden Sie eine Fluoroskopie, um sicherzustellen, dass die Spitze der Kryosonde etwa 10 mm von der Thoraxwand entfernt ist, was dem ausgewählten BS entspricht (Abbildung 2).
- Führen Sie einen Bronchialblocker-Katheter (z. B. einen Fogarty-Ballon) in den Seitenkanal des doppelluminalen ETT ein und platzieren Sie ihn am ausgewählten BS-Ostium (Abbildung 3).
- Pumpen Sie den Bronchialblocker-Katheter auf, um die Angemessenheit der Platzierung und Blockade für mögliche Blutungen zu beurteilen, die distal in Bezug auf den Ballon auftreten (Abbildung 4).
- Entleeren Sie den Bronchialblocker-Katheter, wenn der Ballon gut platziert ist.
- Sichern Sie die Platzierung des Ballons, indem Sie den Bronchialblocker-Katheter mit einer Pean fixieren.
- Verwenden Sie kleine Mengen Lidocain-Spray oder Kochsalzlösung im jeweiligen ETT und seinem Seitenkanal, um die Reibung zu reduzieren, die durch das Einführen der Kryosonde in den ETT und des Ballonkatheters in den Seitenkanal des ETT entsteht.
- Wenn die Schritte 3.1.1 bis 3.1.3 zufriedenstellend ausgeführt wurden, treten Sie je nach Größe der Kryosonde 3-6 s lang auf das Gefrierpedal, um das Joule-Thompsons-Gesetz auszunutzen und das Lungenparenchymgewebe auf etwa -45-79 °C für CO2 und -89 °C für NO einzufrieren.
- Ziehen Sie das flexible Bronchoskop mit der Kryosonde mit einer schnellen Bewegung zurück, während Sie das Gefrierpedal gedrückt halten, um das Einfrieren fortzusetzen und zu verhindern, dass die Biopsie während des Rückzugs herunterfällt.
- Während des in Schritt 3.1.5 beschriebenen Manövers wird der Ballon von einer anderen Person als dem Bronchoskopiker aufgeblasen, um die Biopsiestelle distal des ausgewählten BS-Ostiums zu blockieren und mögliche Blutungen zu kontrollieren.
- Führen Sie die flexible Kryosonde durch den Arbeitskanal des Bronchoskops in den ausgewählten BS ein.
- Fahren Sie mit Schritt 3.1.6 fort, bis mindestens zwei Biopsien von zwei BS aus demselben Lappen gewonnen wurden.
- Legen Sie die Biopsien in Kochsalzlösung und fixieren Sie sie, wenn alle Biopsien entnommen wurden, in Formaldehyd (4%) (Abbildung 5).
- Senden Sie die Biopsien zur pathologischen Untersuchung vor der MDD.
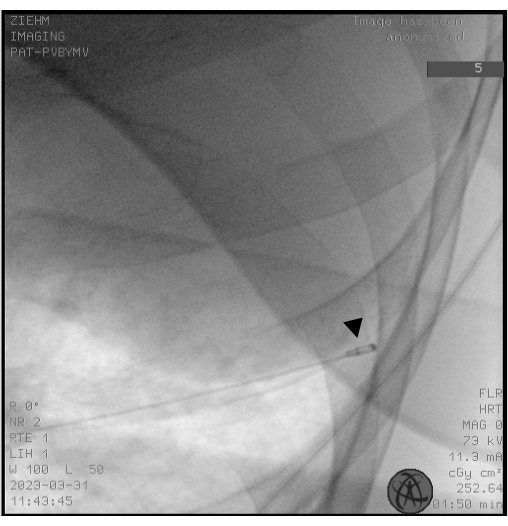
Abbildung 2: Durchleuchtung. Die Fluoroskopie wird verwendet, um die korrekte Platzierung der Kryosonde vor dem Einfrieren sicherzustellen. Die Spitze der Kryosonde erscheint als Kopf eines Trommelstocks (schwarze Pfeilspitze). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
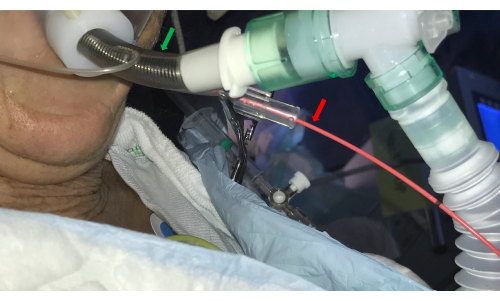
Abbildung 3: Endotrachealtubus. Ein doppelluminaler Endotrachealtubus (grüner Pfeil) ermöglicht den Zugang zu den Atemwegen durch das Bronchoskop und kontrolliert gleichzeitig die Blutung durch das Einführen eines Ballonkatheters in den Seitenkanal (roter Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Aufblasen des Ballonkatheters. Aufblasen des Ballonkatheters, um eine Verstopfung zu gewährleisten und eine mögliche Blutung distal des Ballons zu verhindern, die sich nach Durchführung einer transbronchialen Lungenkryobiopsie auf andere Teile des Lappens ausbreitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
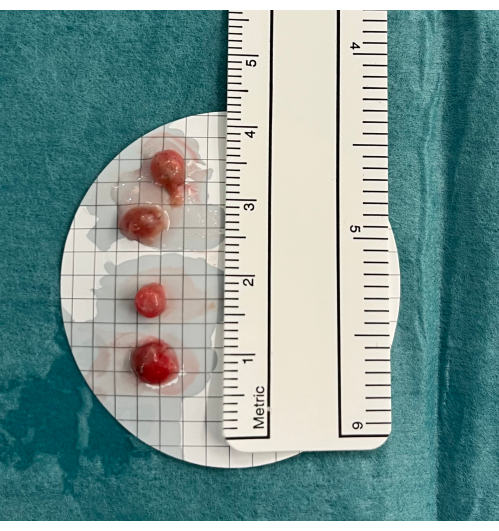
Abbildung 5: Biopsien. Transbronchiale Lungenkryobiopsien werden in kalte Kochsalzlösung gelegt, bevor sie in Formaldehyd fixiert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. PostTBLC-Verfahren
- Führen Sie nach jeder Biopsie das Bronchoskop wieder in das BS ein und entleeren Sie den Ballon, um zu beobachten, ob Blutungen auftreten.
- Blasen Sie den Ballon wieder auf, wenn eine Blutung beobachtet wird (Abbildung 6). Wenn sich der Ballon in der richtigen Position befindet und den BS blockiert, warten Sie einige Minuten, bis die Blutung aufhört, und setzen Sie dann das TBLC-Verfahren fort.
- Wenn nach Schritt 4.1.1. immer noch Blutungen beobachtet werden, installieren Sie eiskalte Kochsalzlösung distal am Ballon.
- Bei anhaltenden Blutungen nach Schritt 4.1.2. oder Ballonversagen, bei dem Blut in andere BSs fließt, verwenden Sie eine Kombination aus Absaugung, endobronchial verabreichter eiskalter Kochsalzlösung mit oder ohne Adrenalin und Tranexamsäure.
- Wenn das geronnene Blut die Atemwege blockiert, verwenden Sie die Kryosonde, um die Atemwege wieder zu öffnen, indem Sie die Spitze der Kryosonde in das Blutgerinnsel einfrieren und sie durch das ETT nach oben zurückziehen.
- Wenn die Blutung unkontrolliert bleibt, ändern Sie die ETT in eine ETT, die sowohl die Beatmung der nicht biopsierten Lunge als auch die Verstopfung des Hauptbronchus an der blutenden Lunge ermöglicht, und verlegen Sie den Patienten auf eine Intensivstation.
- Führen Sie nach TBLC einen fokussierten Lungenultraschall (FLUS) durch, während der Patient noch sediert ist, um die Indikative für einen iatrogenen Pneumothorax (PTX) zu identifizieren.
- Erwägen Sie das Anlegen einer FLUS-gesteuerten Pleuradrainage mit einem Pigtail-Katheter (Fr 7-16), wenn FLUS-Beobachtungen auf eine hohe Wahrscheinlichkeit für PTX hinweisen. Eine Pleuradrainage ist indiziert, wenn FLUS auf eine rasch zunehmende Größe von PTX hinweist, insbesondere wenn sich der klinische Zustand des Patienten verschlechtert.
- Verschieben Sie die Extubation um 5-10 Minuten, wenn FLUS einen kleinen PTX zeigt und der Patient klinisch stabil ist. Wenn die PTX-Größe danach fortschreitet oder der Patient klinisch instabil wird, legen Sie vor der Extubation eine Pleuradrainage an.
- Extubieren Sie den Patienten nach Schritt 4.2 oder Schritt 4.2.2, wenn es keine Anzeichen für PTX oder ein Fortschreiten der PTX-Größe gibt und der Patient klinisch stabil bleibt.
- Beobachten Sie den Patienten nach der TBLC in einem Aufwachraum. Kurz bevor der klinisch stabile Patient nach Hause geht, stellen Sie sicher, dass weder durch wiederholte FLUS noch durch eine Röntgenaufnahme des Brustkorbs ein spät einsetzendes PTX vorhanden ist.
- Besprechen Sie die Darstellung der histologischen Merkmale der Biopsien bei einer anschließenden MDD mit Pneumologen, Radiologen und Pathologen in Verbindung mit anderen Details, um auf einen ILD-Subtyp mit hoher diagnostischer Wahrscheinlichkeit zu schließen.
- Informieren Sie den Patienten in der Ambulanz über die MDD-Schlussfolgerung aus Schritt 4.5 und planen Sie die mögliche Behandlung und Nachsorge.
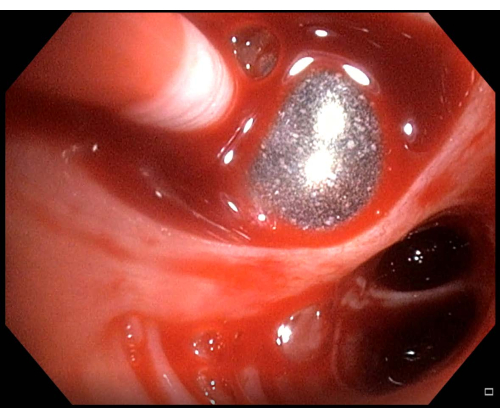
Abbildung 6: Leichte Blutungen. Wenn nach einer transbronchialen Lungenkryobiopsie Blutungen beobachtet werden, in diesem Fall leichte Blutungen, sollte der Ballonkatheter einige Minuten aufgeblasen bleiben, bevor die Entleerung erneut versucht wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. TBLC in Verbindung mit R-EBUS und ENB für die PPL-Diagnose
- Navigieren Sie und bestätigen Sie die Position der peripheren Lungenläsion.
- Führen Sie die 1,1-mm-Kryosonde unter Anleitung der Durchleuchtung in den erweiterten Arbeitskanal ein.
- Passen Sie die Spitze der Gefriersonde an die Position der radialen EBUS-Sonde an.
- Treten Sie für 4-8 s auf das Gefrierpedal.
- Ziehen Sie die Kryosonde mit einer schnellen Bewegung durch den verlängerten Arbeitskanal zurück, während Sie das Gefrierpedal gedrückt halten, um das Einfrieren fortzusetzen und zu verhindern, dass die Biopsie während des Rückzugs herunterfällt.
- Halten Sie das Bronchoskop und den erweiterten Arbeitskanal in Position, während die Kryosonde eingefahren ist.
- Die Schritte 5.2 bis 5.4 werden wiederholt, bis eine ausreichende Anzahl von Biopsien gewonnen wurde.
- Behandeln Sie die Biopsien wie in den Schritten 3.3 und 3.4 beschrieben.
Ergebnisse
Basierend auf den Beobachtungen der Autoren aus zwei TBLC-Zentren ermöglichte das beschriebene schrittweise Verfahren für TBLC mit einem flexiblen Bronchoskop eine histologische Probenahme bei gut ausgewählten dänischen Patienten mit noch nicht diagnostizierten ILD-Subtypen trotz vorangegangener MDD. Detaillierte Beobachtungen aus diesen Kohorten werden in zwei kürzlich veröffentlichten Studienberichtet 23,25 und für das Z...
Diskussion
Unabhängig von der Indikation für TBLC hängen die diagnostischen Eigenschaften von der Qualität der Durchführung des Verfahrens und den ausgewählten Kriterien für die Durchführung des Verfahrens ab. Dies unterstreicht die Empfehlung, ein formelles und zertifiziertes Schulungsprogramm zu implementieren, um die Kompetenzen zu erwerben, die für die Durchführung eines standardisierten TBLC-Verfahrens erforderlich sind. Trotz der Tatsache, dass derzeit keine offizielle TBLC-Ausbildu...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken dem Personal der Abteilungen für Thoraxchirurgie und Anästhesiologie der Bronchoskopie-Abteilung des Universitätskrankenhauses Odense, Dänemark, für ihre Hilfe bei der Erstellung der Zahlen für diesen Artikel.
Materialien
| Name | Company | Catalog Number | Comments |
| "Chimney" for tube | |||
| CO2 gas bottle adapter | |||
| CO2 gas tank | Erbe | ||
| Endoscopy column | |||
| Endotracheal tube, size 7.5-8.5 mm | Erbe | ||
| Erbecryo pedal footswitch | Erbe | ||
| Erbecryo2 workstation | Erbe | ||
| Flexible bronchoscope | |||
| Flexible gas hose | Mediland | ||
| Flexible single use cryoprobe, OD 1.1 mm | Erbe | ||
| Flexible single use cryoprobe, OD 1.7 mm | Erbe | ||
| Flexible single use cryoprobe, OD 2.4 mm | |||
| Fluoroscope | |||
| Fogarty balloon catheter | |||
| Formalin glasses in closed system | |||
| NaCl incl. cold NaCl | |||
| Pean for fixating Fogarty balloon | |||
| Sterile disposable cup | |||
| Sterile suction tube | |||
| Sterile tweesers | |||
| Syringe for Fogarty balloon inflation/deflation | |||
| Table bag for flouroscope | |||
| Three way tap for Fogarty balloon syringe | |||
| Tracheal suction | |||
| Ultrasound machine | Erbe | ||
| Valve for biopsy chanel | |||
| Valve to suction duct |
Referenzen
- Travis, W. D., et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine. 188 (6), 733-748 (2013).
- Ruaro, B., et al. Editorial: Pulmonary fibrosis: One manifestation, various diseases. Frontiers in Pharmacology. 13, 1027332 (2022).
- Lamas, D. J., et al. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. American Journal of Respiratory and Critical Care Medicine. 184 (7), 842-847 (2011).
- Tomassetti, S., Piciucchi, S., Tantalocco, P., Dubini, A., Poletti, V. The multidisciplinary approach in the diagnosis of idiopathic pulmonary fibrosis: a patient case-based review. European Respiratory Review. 24 (135), 69-77 (2015).
- Walsh, S. L. F., et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respiratory Medicine. 4 (7), 557-565 (2016).
- Ryerson, C. J., et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 196 (10), 1249-1254 (2017).
- Cottin, V., et al. Integrating clinical probability into the diagnostic approach to idiopathic pulmonary fibrosis: An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 206 (3), 247-259 (2022).
- Rodrigues, I., et al. Diagnostic yield and safety of transbronchial lung cryobiopsy and surgical lung biopsy in interstitial lung diseases: a systematic review and meta-analysis. European Respiratory Review. 31 (166), 210280 (2022).
- Korevaar, D. A., et al. European Respiratory Society guidelines on transbronchial lung cryobiopsy in the diagnosis of interstitial lung diseases. European Respiratory Journal. 60 (5), 2200425 (2022).
- Colella, S., Haentschel, M., Shah, P., Poletti, V., Hetzel, J. Transbronchial lung cryobiopsy in interstitial lung diseases: best practice. Respiration. 95 (6), 383-391 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the Cryobiopsy Working Group on safety and utility and a call for standardization of the procedure. Respiration. 95 (3), 188-200 (2018).
- Ravaglia, C., Poletti, V. Transbronchial lung cryobiopsy for the diagnosis of interstitial lung diseases. Current Opinion in Pulmonary Medicine. 28 (1), 9-16 (2022).
- Troy, L. K., et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respiratory Medicine. 8 (2), 171-181 (2020).
- Ruaro, B., et al. Transbronchial lung cryobiopsy and pulmonary fibrosis: A never-ending story. Heliyon. 9 (4), e14768 (2023).
- Lentz, R. J., Argento, A. C., Colby, T. V., Rickman, O. B., Maldonado, F. Transbronchial cryobiopsy for diffuse parenchymal lung disease: a state-of-the-art review of procedural techniques, current evidence, and future challenges. Journal of Thoracis Disease. 9 (7), 2186-2203 (2017).
- Maldonado, F., et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest. 157 (4), 1030-1042 (2020).
- Avasarala, S. K., Wells, A. U., Colby, T. V., Maldonado, F. Transbronchial cryobiopsy in interstitial lung diseases: State-of-the-art review for the interventional pulmonologist. Journal of Bronchology Interventional Pulmonology. 28 (1), 81-92 (2021).
- Abdelghani, R., Thakore, S., Kaphle, U., Lasky, J. A., Kheir, F. Radial Endobronchial Ultrasound-guided Transbronchial Cryobiopsy. Journal of Bronchology Interventional Pulmonology. 26 (4), 245-249 (2019).
- Inomata, M., et al. Utility of radial endobronchial ultrasonography combined with transbronchial lung cryobiopsy in patients with diffuse parenchymal lung diseases: a multicentre prospective study. BMJ Open Respiratory Research. 8 (1), e000826 (2021).
- Benn, B. S., Gmehlin, C. G., Kurman, J. S., Doan, J. Does transbronchial lung cryobiopsy improve diagnostic yield of digital tomosynthesis-assisted electromagnetic navigation guided bronchoscopic biopsy of pulmonary nodules? A pilot study. Respiratory Medicine. 202, 106966 (2022).
- Ankudavicius, V., Miliauskas, S., Poskiene, L., Vajauskas, D., Zemaitis, M. Diagnostic yield of transbronchial cryobiopsy guided by radial endobronchial ultrasound and fluoroscopy in the radiologically suspected lung cancer: A single institution prospective study. Cancers. 14 (6), 1563 (2022).
- Ravaglia, C., et al. Transbronchial lung cryobiopsy in diffuse parenchymal lung disease: Comparison between biopsy from 1 segment and biopsy from 2 segments - diagnostic yield and complications. Respiration. 93 (4), 285-292 (2017).
- Davidsen, J. R., Skov, I. R., Louw, I. G., Laursen, C. B. Implementation of transbronchial lung cryobiopsy in a tertiary referral center for interstitial lung diseases: a cohort study on diagnostic yield, complications, and learning curves. BMC Pulmonary Medicine. 21 (1), 67 (2021).
- Laursen, C. B., et al. Lung ultrasound assessment for pneumothorax following transbronchial lung cryobiopsy. ERJ Open Research. 7 (3), 00045-2021 (2021).
- Kronborg-White, S., et al. Integration of cryobiopsies for interstitial lung disease diagnosis is a valid and safe diagnostic strategy-experiences based on 250 biopsy procedures. Journal of Thoracic Disease. 13 (3), 1455-1465 (2021).
- Barisione, E., et al. Competence in transbronchial cryobiopsy. Panminerva Medica. 61 (3), 290-297 (2019).
- Raghu, G., et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 205 (9), e18-e47 (2022).
- Ravaglia, C., et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulmonary Medicine. 19 (1), 16 (2019).
- Hernandez-Gonzalez, F., et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: yield and cost-effectiveness analysis. Archivos de Bronconeumología. 51 (6), 261-267 (2015).
- Cooley, J., et al. Safety of performing transbronchial lung cryobiopsy on hospitalized patients with interstitial lung disease. Respiratory Medicine. 140, 71-76 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsy increases diagnostic confidence in interstitial lung disease: a prospective multicenter trial. European Respiratory Journal. 56 (6), 1901520 (2020).
- Kheir, F., et al. Transbronchial lung cryobiopsy in patients with interstitial lung disease: a systematic review. Annals of the American Thoracic Society. 19 (7), 1193-1202 (2022).
- Walscher, J., et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: real-life experience from a tertiary referral center for interstitial lung disease. Respiration. 97 (4), 348-354 (2019).
- Gnass, M., et al. Transbronchial lung cryobiopsy guided by radial mini-probe endobronchial ultrasound in interstitial lung diseases - a multicenter prospective study. Advances in Respiratory Medicine. 88 (2), 123-128 (2020).
- Ma, X., et al. Global and regional burden of interstitial lung disease and pulmonary sarcoidosis from 1990 to 2019: results from the Global Burden of Disease study 2019. Thorax. 77 (6), 596-605 (2022).
- Kronborg-White, S., et al. A pilot study on the use of the super dimension navigation system for optimal cryobiopsy location in interstitial lung disease diagnostics. Pulmonology. 29 (2), 119-123 (2021).
- Wijmans, L., et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder. Respiration. 97 (3), 259-263 (2019).
- Kheir, F., et al. Using bronchoscopic lung cryobiopsy and a genomic classifier in the multidisciplinary diagnosis of diffuse interstitial lung diseases. Chest. 158 (5), 2015-2025 (2020).
- Renzoni, E. A., Poletti, V., Mackintosh, J. A. Disease pathology in fibrotic interstitial lung disease: is it all about usual interstitial pneumonia. Lancet. 398 (10309), 1437-1449 (2021).
- Chaudhary, S., et al. Interstitial lung disease progression after genomic usual interstitial pneumonia testing. European Respiratory Journal. 61 (4), 2201245 (2023).
- Raghu, G., et al. Use of a molecular classifier to identify usual interstitial pneumonia in conventional transbronchial lung biopsy samples: a prospective validation study. Lancet Respiratory Medicine. 7 (6), 487-496 (2019).
- Kheir, F., et al. Use of a genomic classifier in patients with interstitial lung disease: a systematic review and meta-analysis. Annals of American Thoracic Society. 19 (5), 827-832 (2022).
- Glenn, L. M., Troy, L. K., Corte, T. J. Novel diagnostic techniques in interstitial lung disease. Frontiers in Medicine. 10, 1174443 (2023).
- Kim, S. H., et al. The additive impact of transbronchial cryobiopsy using a 1.1-mm diameter cryoprobe on conventional biopsy for peripheral lung nodules. Cancer Research and Treatment. 55 (2), 506-512 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten