Method Article
تصور مضان أحادي الجزيء لديناميكيات بوليميراز الحمض النووي في G-Quadruplexes
In This Article
Summary
يحدد هذا البروتوكول مقايسة تكرار الحمض النووي أحادي الجزيء القائم على الفحص المجهري الفلوري ، مما يتيح التصور في الوقت الفعلي للتفاعلات بين بوليميرات الحمض النووي والعقبات مثل هياكل G-quadruplex.
Abstract
تعد قدرة البروتينات المشاركة في تكرار الحمض النووي حقيقيات النواة على التغلب على العقبات - مثل "حواجز" البروتين والحمض النووي - أمرا بالغ الأهمية لضمان تكرار الجينوم المخلص. G-quadruplexes هي هياكل حمض نووي عالية الترتيب تتشكل في مناطق غنية بالجوانين من الحمض النووي وقد ثبت أنها تعمل كعقبات ، وتتداخل مع مسارات الصيانة الجينومية. تقدم هذه الدراسة طريقة قائمة على المجهر الفلوري في الوقت الفعلي لمراقبة تفاعلات بوليميراز الحمض النووي مع هياكل G-quadruplex. تم تثبيت قليل النوكليوتيدات القصيرة والجاهزة للحمض النووي التي تحتوي على G-quadruplex على أغطية زجاجية وظيفية داخل خلية تدفق الموائع الدقيقة. تم إدخال بوليميرات الحمض النووي المصنفة بالفلورسنت ، مما يسمح بمراقبة سلوكها وقياسها المتكافئ بمرور الوقت. مكن هذا النهج من مراقبة سلوك البوليميراز حيث تم توقفه بواسطة G-quadruplex. على وجه التحديد ، باستخدام δ بوليميراز الخميرة المسمى بالفلورسنت ، وجد أنه عند مواجهة G-quadruplex ، يخضع البوليميراز لدورة مستمرة من الارتباط والفك المرتبط. يمكن تكييف هذا الاختبار أحادي الجزيء لدراسة التفاعلات بين بروتينات الحفاظ على الحمض النووي المختلفة والعقبات الموجودة على ركيزة الحمض النووي.
Introduction
بوليميرات الحمض النووي هي إنزيمات تحفز دمج ثلاثي الفوسفات النيوكليوزيدي لتكرار الحمض النووي1،2،3،4،5. على هذا النحو ، فإنها تلعب دورا رئيسيا في عمليات صيانة الحمض النووي الأساسية ، بما في ذلك تكرار الحمض النووي6،7،8 وإصلاح9،10،11،12. يجب أن تكرر بوليميرات الحمض النووي الجينوم بدقة وكفاءة لضمان السلامة الجينومية ، مما يمنع تراكم الطفرات في الجينوم. أثناء التوليف ، غالبا ما تواجه البوليميرات "حواجز طرق" مثل البروتينات المرتبطة بالحمض النووي أو هياكل الحمض النووي الثانوية13. يمكن أن تؤدي حواجز الطرق هذه إلى إبطاء أو حتى منع تقدم البوليميراز14. يعد التغلب على هذه الحواجز أمرا مهما لضمان ازدواجية الجينوم المخلصة ، حيث أن عدم القيام بذلك يمكن أن يؤدي إلى عدم الاستقرار الجينومي15،16.
إحدى الفئات الرئيسية من حواجز الطرق هي G-quadruplexes (G4) ، وهي هياكل الحمض النووي الثانوية غير الكنسية التي ثبت أنها تتشكل في تسلسلات غنية بالجوانين داخل الجينوم البشري17. هناك أكثر من 700,000 تسلسل مختلف في الجينوم البشري قادرة على تكوين G4 ، بما في ذلك المناطق داخل التيلوميرات ومحفزات الجينات المسرطنة18. تتبنى هياكل الحمض النووي هذه مطابقات مختلفة اعتمادا على تسلسل النيوكليوتيدات والطول والكاتيون المعدنيالمرتبط 19،20،21. يعني هذا التنوع أن البوليميرات يجب أن تتغلب على مجموعة من طبولوجيا G4 المختلفة ، وربما بدرجات متفاوتة من الكفاءة. ثبت أن فشل البوليميرات في التغلب على هيكل G4 أو تجاوزه يعيق تقدم شوكة النسخ المتماثل في الجسم الحي ، مما يؤدي إلى عدم الاستقرار الجيني22. أظهرت الدراسات المختبرية أن هياكل G4 يمكن أن توقف أو تمنع بوليميرات الخميرةتماما 23،24،25،26،27. تعتمد قدرة هياكل G4 على إيقاف أو منع بوليميرات الحمض النووي كليا على استقرارها الحركي والديناميكي الحراري ، حيث تكون بعض البوليميرات قادرة على الكشف عن بعض G428. في حين أن هذه الدراسات توفر نظرة ثاقبة لقدرة البوليميراز على التغلب على حواجز الطريق G-quadruplex ، إلا أنها تفتقر إلى القدرة على تصور سلوك البوليميراز مباشرة عند مواجهة G4. يحدد مصير البوليميرات - سواء ظلت مرتبطة أو تسقط أو تتبادل ديناميكيا - العمليات النهائية التي يمكن الوصول إليها لحل G4.
في هذه الدراسة ، تم تطوير مقايسة مجهرية أحادية الجزيء القائمة على التألق لتصور ومراقبة ارتباط بوليميراز الحمض النووي مع هياكل G4 في الوقت الفعلي. يتضمن هذا الاختبار ربط قوالب الحمض النووي المكونة ل G4 بغطاء بيوتينيل في خلية تدفق الموائع الدقيقة ، حيث يمكن إدخال بوليميرات الحمض النووي المسماة بالفلورسنت لبدء تخليق الحمض النووي. من خلال قياس تألق البوليميرات بمرور الوقت ، يمكن ملاحظة سلوكها عند مواجهة بنية G4 مباشرة. تم اختيار هيكل G4 الموجود في الجين الورمي للسرطان c-MYC لهذا الاختبار نظرا لمستوى عال من الاستقرار. يمكن الآن تكييف هذا البروتوكول لفهرسة سلوك مجموعة متنوعة من البوليميرات عبر جميع مجالات الحياة المرتبطة بطبولوجيا G4 المختلفة واستقرارها. يقدم هذا الاختبار نهجا مبتكرا وعالي الإنتاجية لتوضيح الآليات التي تتنقل بها بوليميرات الحمض النووي مع عقبات الحمض النووي ، مما يوفر أداة قوية لتعزيز فهم ديناميكيات البوليميراز.
Protocol
تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. التحليل الطيفي لثنائي اللون الدائري
ملاحظة: قبل تطوير الفحص ، كان من الضروري إجراء التحليل الطيفي ثنائي اللون الدائري (CD) على تسلسل G4 المحدد لضمان الطي الصحيح. يشكل تسلسل 22 nt (5′-TGAGGGGGGGGGGGGGGGAA-3′) بنية G4 المشتقة من الجين الورمي للسرطان c-MYC . تم إجراء التحليل الطيفي للقرص المضغوط أيضا على تسلسل تحكم (5 ′- TGAGTGTGAAGACGATGATAGAA -3) الذي يحتوي على نيوكليوتيدات رئيسية متغيرة تمنع تكوين G4.
- لتحضير قوالب الحمض النووي للتحليل الطيفي للقرص المضغوط ، أضف 40 ميكرولتر من 100 ميكرومتر من قوالب 22 nt إلى 360 ميكرولتر من Tris-HCl (درجة الحموضة 8.0) ، حمض الإيثيلين ديامين تترا أسيتيك (EDTA) (TE) مع 200 ملي مولار من كلوريد البوتاسيوم (KCl). مطلوب 10 ميكرومتر من تركيز الحمض النووي النهائي لتجارب التحليل الطيفي للقرص المضغوط.
ملاحظة: يعد وجود أيونات K + ضروريا لتحقيق الاستقرار في هيكل G4 في القالب. - قم بتسخين محاليل الحمض النووي إلى 95 درجة مئوية في حمام جاف رقمي لمدة 15 دقيقة. بمجرد الانتهاء ، قم بتبريد المحاليل ببطء طوال الليل عن طريق وضع كتلة التسخين في البوليسترين. عملية التبريد البطيئة هذه مسؤولة عن طي G4.
- انقل 400 ميكرولتر من محاليل تسلسل التشكيل والتحكم G4 إلى كوفيت كوارتز بطول مسار 0.1 سم باستخدام حقنة محكمة الغلق للغاز. املأ الكوفيت ببطء لتجنب تكون فقاعات الهواء.
- قم بقياس طيف القرص المضغوط بين 200 نانومتر و 400 نانومتر باستخدام مقياس الطيف عند 25 درجة مئوية. تم وصف معلمات وشروط هذا القياس سابقا29. يمكن العثور على النتائج في الشكل التكميلي 1.
ملاحظة: تأكد من تسجيل طيف القرص المضغوط حتى يعمل المخزن المؤقت وحده كفارغ.
2. تحضير قوالب الحمض النووي
ملاحظة: القوالب التي يمكن تكرارها هي قوالب خطية قصيرة ومعدة بحجم 100 nt تم إعدادها باستخدام تقنيات البيولوجيا الجزيئية القياسية. قالب تشكيل G4 (5′-GAATTACATTTAAATTTTACACAGATACAGATCAATGAGAA
CTTCCAGGCGTAACGAGAGCACGGGGTGGGGGGGGGGGGGGGGGGGGGGGGGGGGT
GGGACCTTAGCTTCGAGTTCCGAT-3 ′) يحتوي على التسلسل القادر على تكوين G-quadruplex مشتق من MYC (من الخطوة 1) في مركزه. قالب التحكم (5′-GAATTACATTTAAATTTTACACAGATACAGATCAATGAGA
ACTTCCAGGCGTAACGAGAGCACGATGTAGCAGAACT
GTGACCTTAGCTTCGAGTTCCGAT-3 ′) لها نفس منطقة التحكم (من الخطوة 1) أيضا في مركزها.
- لتلدين التمهيدي إلى قوالب الحمض النووي لتشكيل G4 والتحكم فيها ، امزج 20 ميكرومتر من التمهيدي (5′-Biotin-AF647-TCTTAATGTAAATGTC-3 ′) إلى 20 ميكرومتر من قوالب 100 nt في المخزن المؤقت TE المكمل ب 200 ملي مولار KCl.
- قم بتسخين محاليل قالب الحمض النووي إلى 95 درجة مئوية في حمام رقمي جاف لمدة 15 دقيقة. بمجرد الانتهاء ، قم بتبريد المحاليل ببطء طوال الليل عن طريق وضع كتلة التسخين في البوليسترين للسماح بطي G4 وتلدين الخيطين.
3. وضع العلامات على بوليميراز الحمض النووي باستخدام AF647
- وضع العلامات على البوليميراز بالصبغة
ملاحظة: تم التعبير عن الخميرة Pol δ وتنقيتها كما هو موضح سابقا30. ثم يجب تسمية البوليميراز بصبغة Alexa Fluor NHS ester أحادية التفاعل (AF647) للسماح بالتصور على مستوى الجزيء الفردي. تم الانتهاء من هذا كما هو موضحسابقا 5.- لتسمية الطرف N ، احتضن فائض 3 أضعاف من صبغة AF647 مع 320 ميكرولتر من 58.5 ميكرومتر Pol δ في مخزن مؤقت يحتوي على 30 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 2 ملي مولار من ثنائي ثيوثريتول (DTT) ، 300 ملي مولار من كلوريد الصوديوم (كلوريد الصوديوم) ، 50 ملي مولار من غلوتامات البوتاسيوم ، و 10٪ (حجم / حجم) الجلسرين لمدة 10 دقائق عند 4 درجات مئوية. قم بتدوير المحلول برفق لضمان الخلط الشامل وتحسين كفاءة وضع العلامات.
ملاحظة: قد يحتوي تسلسل البروتين على أمينات أولية إضافية في الأحماض الأمينية ليسين. من خلال ضبط ظروف التفاعل ، مثل الأس الهيدروجيني ، يمكن إرفاق الملصق بشكل تفضيلي بالطرف N بدلا من بقايا اللايسين. قد يتطلب ذلك مزيدا من التحسين لزيادة كفاءة وضع العلامات. - لتحضير أعمدة تحلية المياه بسعة 0.5 مل (قطع الوزن الجزيئي 7 كلفن) ، قم أولا بالطرد المركزي للأعمدة عند 1500 × جم لمدة 1 دقيقة لإزالة محلول التخزين. تخلص من المحاليل المودعة في أنبوب التجميع بعد الطرد المركزي.
ملاحظة: تأكد من فك غطاء أعمدة الدوران أثناء خطوات الطرد المركزي. سيضمن ذلك أن الأعمدة مخففة بشكل صحيح. - قم بموازنة الأعمدة في مخزن مؤقت يحتوي على 30 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، و 300 ملي مولار من كلوريد الصوديوم ، و 3 ملي مولار من DTT ، و 50 ملي مولار من غلوتامات البوتاسيوم ، و 5٪ (v / v) الجلسرين عن طريق إضافة 300 ميكرولتر من المخزن المؤقت إلى أعلى العمود. الطرد المركزي العمود عند 1500 × جم لمدة 1 دقيقة وتخلص من التدفق. كرر هذه العملية مرتين إضافيتين.
- ضع 200 ميكرولتر من كل عينة Pol δ على العمود. قم بالطرد المركزي للأعمدة عند 1500 × جم لمدة دقيقتين وجمع δ Pol المنقى في أنبوب طرد مركزي دقيق سعة 1.5 مل.
- قم بتجميد الأجزاء المنقاة في السائل N2 وتخزين الحصص عند -80 درجة مئوية لمنع تدهور البروتين بمرور الوقت.
- لتسمية الطرف N ، احتضن فائض 3 أضعاف من صبغة AF647 مع 320 ميكرولتر من 58.5 ميكرومتر Pol δ في مخزن مؤقت يحتوي على 30 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 2 ملي مولار من ثنائي ثيوثريتول (DTT) ، 300 ملي مولار من كلوريد الصوديوم (كلوريد الصوديوم) ، 50 ملي مولار من غلوتامات البوتاسيوم ، و 10٪ (حجم / حجم) الجلسرين لمدة 10 دقائق عند 4 درجات مئوية. قم بتدوير المحلول برفق لضمان الخلط الشامل وتحسين كفاءة وضع العلامات.
- تحديد كفاءة وضع العلامات
- قم بتحميل 2 ميكرولتر من عينة Pol δ المسمى الآن AF647 على مقياس الطيف الضوئي للأشعة فوق البنفسجية31.
ملاحظة: تأكد من قياس فراغ المخزن المؤقت Pol δ أولا. - قم بقياس الأطوال الموجية للإثارة البالغة 650 نانومتر لصبغة AF647 و 280 نانومتر لصبغة Pol δ باستخدام مقياس الطيف الضوئي.
- باستخدام قانون Beer-Lambert ومعاملات الانقراض المولية البالغة 270،000 سم -1م -1 لصبغة AF647 و 195،960 سم -1م -1 للبوليميراز ، احسب كفاءة وضع العلامات.
ملاحظة: تم حساب كفاءة وضع العلامات المحددة للخميرة Pol التي تحمل علامة AF647 δ المستخدمة في هذا الاختبار لتكون حوالي 67٪.
- قم بتحميل 2 ميكرولتر من عينة Pol δ المسمى الآن AF647 على مقياس الطيف الضوئي للأشعة فوق البنفسجية31.
4. اختبار تمديد التمهيدي الجماعي
ملاحظة: قبل إجراء تجارب النسخ المتماثل أحادي الجزيء ، من الضروري التأكد من حظر بوليميراز الحمض النووي بواسطة G-quadruplex عبر فحوصات النسخ المتماثل بالجملة.
- اضبط درجة حرارة كتلة التسخين داخل حمام جاف رقمي على 30 درجة مئوية. سيضمن ذلك أقصى نشاط للخميرة Pol δ.
- قم بإعداد "الخلطات الرئيسية" لقوالب التشكيل والتحكم G4 في المخزن المؤقت للنسخ المتماثل (25 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 10 ملي مولار من أسيتات المغنيسيوم ، 50 ملي مولار من غلوتامات البوتاسيوم ، 40 ميكروغرام / مل ألبومين مصل الأبقار (BSA) ، 0.1 ملي مولار من EDTA ، 5 ملي مولار من DTT ، و 0.0025٪ (حجم / حجم) توين -20). استكمل كل مزيج ب 1 ملي مولار من DTT ، و 250 ميكرومتر لكل من dTTP و dCTP و dATP و dGTP (dNTPs) و 10 نانومتر من قالب الحمض النووي المعني (تشكيل G4 أو التحكم). ضعها في كتلة تسخين للتأكد من وصولها إلى 30 درجة مئوية.
- قم بإخماد 12 ميكرولتر من كل مزيج رئيسي مع 12 ميكرولتر من المخزن المؤقت لتحميل الفورماميد (80٪ (وزن / حجم) فورماميد ، 10 ملي مولار من EDTA) ليكون بمثابة عنصر تحكم T = 0 دقيقة.
- لبدء تخليق الحمض النووي ، أضف الخميرة Pol δ المسمى AF647 إلى كل مزيج رئيسي (تركيز نهائي 20 نانومتر). امزج جيدا للتأكد من أن بوليميرات الحمض النووي تكرر القوالب بأقصى قدر من الكفاءة.
ملاحظة: احتفظ بالخميرة δ على الثلج أثناء الاستخدام للحفاظ على نشاط الإنزيم. - بعد 30 ثانية و 60 ثانية و 180 ثانية ، قم بإزالة 12 ميكرولتر من كل مزيج رئيسي وقم بإخمادها ب 12 ميكرولتر من المخزن المؤقت لتحميل الفورماميد. تضمن نسبة 1: 1 للمزيج الرئيسي إلى المخزن المؤقت لتحميل الفورماميد أن تفاعل النسخ المتماثل لا يمكن أن يستمر بمجرد إخماده.
- قم بإزالة المحاليل المروية الآن من كتلة التسخين 30 درجة مئوية وضعها في كتلة تسخين 98 درجة مئوية بدلا من ذلك لتغيير طبيعة dsDNA إلى ssDNA. بمجرد انقضاء 10 دقائق ، أحضر كتلة التسخين بأكملها إلى خزان الجل لتحميل المحاليل في جل 15٪ ثلاثي بورات - EDTA (TBE) - بولي أكريلاميد اليوريا (PAGE)32.
ملاحظة: يجب تسخين هلام PAGE قبل تحميل العينات عن طريق تشغيل الرحلان الكهربائي للهلام عند 180 فولت لمدة 30 دقيقة في 1x TBE عازلة. بمجرد الانتهاء ، اشطف كل بئر لإزالة اليوريا. - قم بتحميل 15 ميكرولتر من كل عينة على الجل جنبا إلى جنب مع سلم يحتوي على 0.02 ميكرومتر من 20 nt و 60 nt و 100 nt قليلة النوكليوتيدات المسماة في المخزن المؤقت لتحميل الفورماميد.
- قم بتشغيل الجل لمدة 60 دقيقة عند 180 فولت في 1x TBE buffer لضمان الفصل الكامل.
- قم بتصوير الجل في قناة Cy5 لجهاز تصوير جزيئي حيوي. سيسمح ذلك بقياس خيط الحمض النووي المكرر الذي يحتوي على ملصق AF-647.
5. الفحص المجهري الفلوري أحادي الجزيء
- وظائف Coverslip
ملاحظة: لإرفاق قوالب الحمض النووي بالغطاء الزجاجي ، يجب أولا تشغيلها باستخدام أمينوسيلان ، متبوعا بربط جزيئات PEG الحيوية. تقلل هذه العملية من التفاعلات غير المحددة بين الحمض النووي و / أو البروتينات والسطح.- نظف الأغطية (24 × 24 مم) عن طريق إدخالها في برطمانات تلطيخ وصب الإيثانول. قم بتقطيع البرطمانات لمدة 30 دقيقة قبل شطف الأغطية بالماء النقي. كرر هذه العملية مع 1 متر هيدروكسيد البوتاسيوم (KOH) قبل الشطف مرة أخرى. كرر خطوات التنظيف هذه مرة أخرى.
- اشطف واملأ برطمانا جديدا بالأسيتون وضع الأغطية بالداخل. انشر 3-أمينوبروبيل ثلاثي إيثوكسيسيلان في البرطمان لتشكيل محلول 2٪ v / v. حرك البرطمان لمدة 3 دقائق قبل إخماد التفاعل بكمية كبيرة من الماء.
- جفف الغطاء باستخدام N2 وضعه بشكل فردي على صندوق رطب مملوء بالماء. سيمنع ذلك الجفاف الأغطية.
- قم بإعداد إستر 1:25 Biotin-PEG-SVA: mPEG-SVA في 100 ملي مولار من NaHCO3 (درجة الحموضة 8.2). دوامة هذا الخليط لمدة 20 ثانية لضمان الخلط الشامل.
- ماصة 40 ميكرولتر من محلول PEG على غطاء جاف. ضع غطاء آخر في الأعلى "لشطيرة" المحلول بين الغطاء. سيؤدي ذلك إلى تشغيل وجوه الغطاء من الداخل. كرر مع جميع أغطية.
- احتضن الغطاء في الظلام لمدة 3 ساعات. بعد الحضانة ، افصل أزواج الغطاء ، واشطفها بالماء الزائد ، وجففها بغاز N2 المضغوط.
- كرر الخطوات 4.1.4-4.1.5 لتطبيق طبقة ثانية من PEG على الغطاء. تأكد من شطيرة الجوانب التي تم تشغيلها مسبقا معا ، لذا احرص على عدم قلبها عن طريق الخطأ أثناء خطوات الغسيل. احتضن المحاليل في الظلام طوال الليل قبل شطفها وتجفيفها.
- قم بتخزين الغطاء في مكنسة كهربائية للحفاظ على وظائفها. تكون أغطية الغطاء الوظيفية مستقرة لمدة شهر عند تخزينها بشكل صحيح.
- تحضير خلايا تدفق الموائع الدقيقة
ملاحظة: تم إنشاء خلية تدفق الموائعالدقيقة 33 لتجارب الجزيء الفردي (انظر الشكل التكميلي 2). سيسمح ذلك للمخازن المؤقتة وقوالب الحمض النووي والبروتينات بالتلامس مع غطاء وظيفي (انظر الخطوة 5.1).- قم بإزالة غطاء وظيفي من المكنسة الكهربائية وضعه على رف أنبوب دقيق مملوء جزئيا بالماء (صندوق رطب). امزج 100 ميكرولتر من المخزن المؤقت المانع (50 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 50 ملي مولار من KCl ، 2٪ (حجم / حجم) Tween-20) مع 25 ميكرولتر من محلول NeutrAvidin 1 مجم / مل (10٪ PBS) ونشره على سطح الغطاء. دع هذا يحتضن لمدة 15 دقيقة في درجة حرارة الغرفة في الصندوق الرطب.
- اغسل الغطاء بالماء وجففه في N2. تذكر أن جانبا واحدا فقط من الغطاء يعمل ، لذا تذكر الجانب الذي هو عليه.
- ضع كتلة polydimethylsiloxane (PDMS) المصنوعةحسب الطلب 34 على الغطاء داخل حامل خلية التدفق. سيؤدي ذلك إلى توليد قناة تدفق بارتفاع 100 ميكرومتر وعرض 1 مم. يمكن بعد ذلك إدخال أنابيب البولي إيثيلين (PE-60: قطر مدخل 0.76 مم وقطر خارجي 1.22 مم) في الفتحات الموجودة في خلية التدفق لتوفير الوصول إلى المخازن المؤقتة والركائز.
- التصوير الفلوري أحادي الجزيء
ملاحظة: يجب إجراء هذه التجارب باستخدام كل من قوالب التشكيل والتحكم G4. سيسمح ذلك بتصور كلا الحالتين (حجب δ Pol بواسطة بنية G4 وعدم الحظر) على مستوى الجزيء الفردي باستخدام الفحص المجهري للانعكاس الداخلي الكلي (TIRF).- تسخين 1 مل من المخزن المؤقت لحجب Tween (50 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 50 ملي مولار من KCl ، 2٪ (حجم / حجم) Tween-20) و 500 ميكرولتر من المخزن المؤقت للغسيل (25 ملي مولار من Tris-HCl (الرقم الهيدروجيني 7.6) ، 10 ملي متر من أسيتات المغنيسيوم ، 250 ملي من غلوتامات البوتاسيوم ، 40 ميكروغرام / مل BSA ، 0.1 ملي مولار من EDTA ، 5 ملي مولار من DTT ، 0.0025٪ (حجم حجم / حجم) Tween-20) ومخزن مؤقت للنسخ المتماثل إلى 40 درجة مئوية لمدة 15 دقيقة. سيؤدي ذلك إلى تحرير الغازات من المحاليل. قم بإزالة الغاز من المحاليل في غرفة مفرغة لمدة 15 دقيقة أخرى عند 800 ملي بار تحت الضغط الجوي.
- خذ خلية التدفق المبنية (انظر الخطوة 4.2) وضعها على مسرح المجهر. بعد وضع قطرة من الزيت على الهدف ، ارفع الهدف لتلبية الغطاء.
ملاحظة: تأكد من أن الهدف وخلية التدفق لديهما الوقت للوصول إلى 31 درجة مئوية. سيؤدي ذلك إلى زيادة نشاط δ الخميرة Pol ويساعد على ضمان البيانات القابلة للتكرار. - أدخل أنبوب المدخل في المخزن المؤقت الذي يتم تفريغ الغاز Tween وقم بتوصيل المخرج بمضخة المحقنة. اسحب المحقنة للخلف لسحب المخزن المؤقت لحجب Tween من خلال الأنبوب في القناة. اسمح لهذا المخزن المؤقت بالاحتضان لمدة 30 دقيقة على الأقل لتقليل التفاعلات غير المحددة.
- يتدفق في 200 ميكرولتر من محلول غسيل منزوع الغاز في القناة بمعدل 100 ميكرولتر / دقيقة. سيؤدي ذلك إلى طرد المخزن المؤقت لحجب Tween.
- قم بتخفيف محاليل قالب الحمض النووي إلى 0.5 جزء في المخزن المؤقت للنسخ المتماثل 500 ميكرولتر. تدفق 150 ميكرولتر في القناة بمعدل 10 ميكرولتر / دقيقة. قم بإضاءة العينة باستخدام ليزر 647 نانومتر عند حوالي 900 ميجاوات سم -2 في مستوى العينة لتصور قوالب الحمض النووي الفردية.
ملاحظة: إذا لم يكن مجال الرؤية (FOV) مع العينة في بؤرة التركيز البؤري بالكامل، فقد لا يكون انزلاق الغطاء ثابتا مقابل الجزء السفلي من خلية التدفق المبنية. قم ببناء خلية تدفق جديدة باستخدام غطاء جديد في حالة حدوث ذلك. - بمجرد ظهور كثافة كافية من البقع (حوالي 1 بقعة لكل 10 ميكرومتر2) ، تتدفق في محلول جديد من المخزن المؤقت للنسخ المتماثل (مكمل ب 1 ملي مولار من DTT) إلى القناة لغسل الحمض النووي الزائد. حجم 250 ميكرولتر يكفي لإزالة كل الحمض النووي غير المرتبط تماما.
- انتقل إلى مجال رؤية جديد والتقط صورة للحمض النووي لتحديد درجة التموضع بين البوليميراز المسمى وركيزة الحمض النووي. بمجرد الانتهاء ، قم بزيادة طاقة الليزر لتبييض البقع المتبقية.
- قم بإعداد محلول بوليميراز يحتوي على 1 ملي مولار من DTT ، و 250 ميكرومتر من dNTPs ، و 20 نانومتر من Pol δ المسمى AF647 في 200 ميكرولتر من المخزن المؤقت للنسخ المتماثل. يتدفق في 100 ميكرولتر من محلول البوليميراز بمعدل 5 ميكرولتر / دقيقة في القناة.
- بمجرد أن تصبح العينة في بؤرة التركيز وضبط زاوية TIRF ، اضبط طاقة الليزر لليزر 647 نانومتر على حوالي 900 ميجاوات سم -2 في مستوى العينة. بعد ذلك ، ابدأ في تصوير مجال الرؤية للمدة الزمنية المطلوبة. احصل على ما بين 1-5 إطارات/ثانية لمدة 10-20 دقيقة لالتقاط جميع أحداث النسخ المتماثل.
- تحليل البيانات
ملاحظة: تم إجراء جميع التحليلات باستخدام Python (v. 3.11.7). الرمز المخصص المستخدم لتحليل البيانات متاح هنا: https://github.com/Single-molecule-Biophysics-UOW/G-quadruplex_binding_analysis.- أولا ، قم بتحديد موقع بقع قالب الحمض النووي مع بقع الفلورسنت للخميرة المسمى Pol δ. تم تحديد قمتين ليتم توضعهما إذا كانت المسافة بعد تصحيح الانجراف ≤ 3 بكسل. يتم تحليل نقاط Pol δ فقط التي تشارك قوالب الحمض النووي من أجل حركية الربط والاتجاهات السلوكية العامة.
- لتحديد بيانات الحدث الملزم، قم بقياس شدة كل بقعة بمرور الوقت لأنها تظهر سلوك "تشغيل/إيقاف" طوال الفيلم. يتيح ذلك تحديد عدد المرات التي يحدث فيها ربط Pol δ على قالب DNA واحد.
ملاحظة: يتم إجراء هذا التحليل لكل من تجارب تشكيل G4 وقوالب التحكم لمقارنة ديناميكيات الربط.
ملاحظة: تم إجراء تجارب التحكم ، والتي تضمن عدم تضمين أحداث الربط غير المحددة ب G-quadruplex أو القالب نفسه (23.2 ثانية ± 4.9 ث) في تحليل أحداث الربط.
النتائج
لهذا الاختبار ، تم تصميم ركيزتين من الحمض النووي مع أساس 20-nt المسمى بالفلورسنت: أحدهما يحتوي على تسلسل تشكيل G4 (الشكل 1 أ ، على اليسار) والآخر يفتقر إلى هذا التسلسل (الشكل 1 أ ، يمين). للتأكد من أن G-quadruplex هو عقبة فعالة أمام نشاط البوليميراز ، تمت مراقبة تخليق الحمض النووي بواسطة Pol δ على هلام PAGE المتغير. تم فحص نشاط δ Pol المنقى المسمى على ركائز الحمض النووي عن طريق الرحلان الكهربائي للهلام. يوضح الشكل 1 ب (يسار) أن Pol δ المسمى فلورية غير قادر على التوليف بعد G-quadruplex. قبل بدء التوليف (t = 0 دقيقة) ، يوجد نطاق يعادل 20 nt ، يمثل التمهيدي المسمى الذي تم تغييره من خيط القالب. بعد 3 دقائق ، تم تحويل هذا النطاق 20 nt إلى نطاق 60 nt ، مما يشير إلى حدوث توليف على كل الحمض النووي ويؤكد أن البوليميراز قد تم حظره تماما بواسطة هيكل G-quadruplex. يشير هذا الحظر إلى أن البوليميراز لا يمكن أن يتكشف أو يتجاوز الهيكل. في المقابل ، أنتج توليف قالب التحكم الذي لا يحتوي على تسلسل تشكيل G-quadruplex (الشكل 1 أ ، على اليمين) نطاقا 100 nt بعد 3 دقائق (الشكل 1 ب ، على اليمين).
بعد تأكيد التوليف على القوالب والحجب الفعال بواسطة G-quadruplex ، تكررت هذه القياسات على مجهر مضان أحادي الجزيء لمراقبة سلوك البوليميراز. تم ربط قوالب الحمض النووي بأغطية وظيفية (الشكل 2 أ) في خلية تدفق الموائع الدقيقة ، وتم تحديد موضع كل ركيزة من خلال تصور التمهيدي المسمى بالفلورسنت. بعد ذلك ، تم تحميل Pol δ المسمى في وجود dNTPs لبدء التوليف. ضمن مجال الرؤية النموذجي ، يتم تتبع البقع الفردية لتحديد عدد المرات التي يرتبط فيها Pol δ وينفصل عن الحمض النووي (الشكل 2 ب ، ج). من خلال قياس الشدة كدالة للوقت في كل ركيزة من ركيزة الحمض النووي ، يمكن إنشاء مسارات أحادية الجزيء (الشكل 2 ج ، الشكل التكميلي 3). يمكن قياس "وقت المكوء" المميز ، أو متوسط المدة التي يظل فيها Pol δ مرتبطا بالقالب. بالنسبة للركيزة G4 ، تم تحديد وقت السكون ليكون 6 ثوان ± 2 ثانية ، بينما بالنسبة لركيزة التحكم ، كان 10 ثوان ± 3 ثوان (الشكل 2D ، الشكل التكميلي 4). بالإضافة إلى ذلك ، لكل مسار ، يمكن تحديد عدد المرات التي يرتبط فيها Pol δ بالقالب. عدد أحداث الربط بركيزة G4 أعلى بكثير مقارنة بقالب التحكم (الشكل 2E). في حين أن هناك حالات لأكثر من حدث ربط واحد في قالب التحكم بسبب الربط المدرسي وفك الربط ، إلا أن هناك زيادة واضحة في عدد أحداث الربط في المتوسط لقالب تشكيل G4. يشير هذا إلى أنه بعد إيقاف التوليف بواسطة G-quadruplex ، ينفصل البوليميراز المرتبط عن الحمض النووي قبل أن تنخرط البوليميرات الجديدة من المحلول في دورة مستمرة من الارتباط وإلغاء الربط. ومن ثم ، فإن هذا الاختبار أحادي الجزيء يوفر نظرة ثاقبة لا مثيل لها حول كيفية استجابة بوليميرات الحمض النووي لحواجز الحمض النووي.

الشكل 1: اختبار تمديد التمهيدي للمجموعة. (أ) التمثيل التخطيطي لركائز الحمض النووي. تحتوي ركيزة G4 (على اليسار) على تسلسل تشكيل G-quadruplex ، في حين أن ركيزة التحكم (اليمين) لا تحتوي على ذلك (ب) اختبار تمديد الحمض النووي الأولي ل G4 الجاهز وركامز الحمض النووي التي تظهر أن الخميرة Pol δ المسمى بالفلورسنت محظورة بالكامل بواسطة G-quadruplex. يظهر جل PAGE تكرار قوالب الحمض النووي بمرور الوقت ، مما يؤدي إلى تحول التمهيدي المسمى 20 nt إلى منتج 60-nt للركيزة G4 (يسار) ، ومنتج 100-nt لقالب التحكم (يمين). يمثل M سلما يحتوي على oligos المسمى 20 nt و 60 nt و 100 nt. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
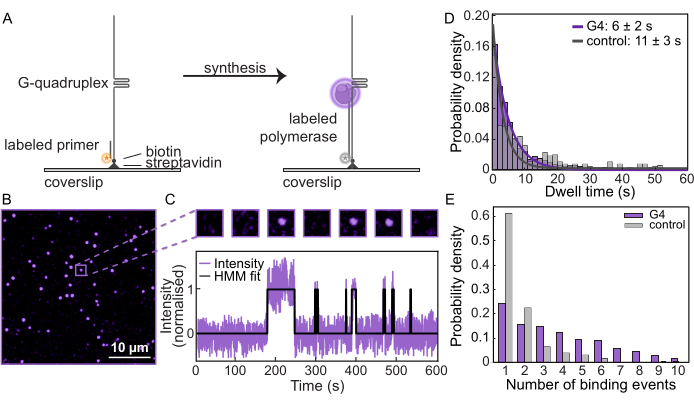
الشكل 2: الفحص المجهري الفلوري أحادي الجزيء. (أ) التمثيل التخطيطي لمقايسة تمديد التمهيدي أحادي الجزيء باستخدام الخميرة المسمى AF647 Pol δ. (ب) مجال الرؤية النموذجي الذي تم الحصول عليه من مقايسة أحادية الجزيء. تمثل كل بقعة Pol δ مصنف بالفلورسنت يرتبط بقالب الحمض النووي. شريط المقياس: 10 ميكرومتر. (C) (أعلى) مثال على الجزيء من اختبار الجزيء الفردي يظهر ربط التشغيل / الإيقاف أثناء تبادل Pol δ. (أسفل) مسار الجزيء الفردي لنفس الجزيء يوضح الشدة على مدار الوقت للتجربة. يمثل الخط الأسود نموذج ماركوف المخفي (HMM) المناسب للبيانات. (د) وقت سكون Pol δ على ركيزة G4 (أرجواني) وركيزة التحكم (رمادي). تمثل الخطوط نوبات أسية ، مما يعطي عمرا من 6 ثوان ± 2 ثانية على ركيزة G4 و 10 ثوان ± 3 ثوان على ركيزة التحكم. (ه) عدد أحداث ربط Pol δ بركائز الحمض النووي الفردية. متوسط عدد أحداث الربط على الركيزة G4 (الأرجواني) هو 3.5 ، مقارنة بركيزة التحكم 1 (رمادي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: التحليل الطيفي للقرص المضغوط. أطياف الأقراص المضغوطة لتسلسل تكوين G4 (الأرجواني) والتحكم (الرمادي) في المخزن المؤقت TE الذي يحتوي على 200 ملي مولار من KCl عند 25 درجة مئوية. الذروة المميزة عند 260 نانومتر ، تليها الذروة السلبية عند 240 نانومتر ، هي سمة من سمات GQ المتوازي داخل الجزيئات. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: بناء خلايا التدفق. (أ) تخطيطي للقطع الفردية لخلية التدفق. تقع كتلة PDMS المربعة أعلى غطاء المجهر. ثم يتم تركيب هذه القطع معا داخل غطاء وأسفل حامل خلية التدفق. (ب) خلية التدفق الكاملة. يمكن إدخال الأنابيب في كل جانب من كتلة PDMS لتشكيل القنوات التي يمكن من خلالها تدفق المخازن المؤقتة عبر الجهاز عبر الموائع الدقيقة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: مسارات الجزيء الواحد. (أ) مثال على مسار جزيء يخضع لحدث ربط واحد خلال الإطار الزمني البالغ 10 دقائق من التجربة. (ب) مثال على مسار جزيء يخضع لأحداث ربط صفرية خلال الإطار الزمني البالغ 10 دقائق من التجربة. يمثل الخط الأسود في (A) و (B) نموذج ماركوف المخفي (HMM) المناسب للبيانات. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: أوقات المكوء. (أ) وقت سكون Pol δ على الركيزة G4. يمثل الخط الملاءمة الأسية ، مما يعطي عمرا 6 ثوان ± 2 ثانية. (ب) وقت سكون Pol δ على ركيزة التحكم. يعطي الملاءمة الأسية عمرا يتراوح بين 10 ثوان ± 3 ثوان الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: التحكم في التبييض الضوئي. توضح المؤامرة متوسط الوقت لخميرة بول δ الفردية المسماة AF647 ليتم تبييضها بواسطة ليزر 647 نانومتر. يمثل الخط الملاءمة الأسية ، مما يعطي عمرا يتراوح من 39 ± 6 ث. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
هنا ، تم وصف اختبار قائم على مضان أحادي الجزيء يوفر نظرة ثاقبة لسلوك بوليميراز الحمض النووي أثناء مواجهته ل G-quadruplex. في حين أن بروتوكولات إنشاء قالب الحمض النووي ، ووضع العلامات على Pol δ ، وفحوصات تكرار الحمض النووي بالجملة كلها واضحة ، فإن تنفيذ فحوصات الفحص المجهري أحادي الجزيء يمثل تحديا أكبر من الناحية الفنية. نظرا لطبيعة تقنيات الجزيء الواحد ، يجب توخي الحذر الشديد لتجنب إدخال الغبار أو التلوث أو فقاعات الهواء ، لأنها ستحجب مجال الرؤية وتعيق جمع البيانات.
أحد قيود تجارب الفحص المجهري أحادي الجزيء TIRF هو التبييض الضوئي للفلوروفورات المقترنة تساهميا بالجزيئات الحيوية ذات الأهمية. التبييض الضوئي هو عملية لا رجعة فيها تؤدي إلى فقدان مضان دائم35. للتخفيف من ذلك أثناء التجارب ، من الضروري الحد من مدة التعرض لليزر وضبط شدة الليزر وتحسين توقيت التصوير. تساعد هذه الاستراتيجيات في الحفاظ على إشارات التألق ، مما يضمن فترات مراقبة أكثر موثوقية وممتدة. من خلال ضبط هذه المعلمات ، تظل إشارة Pol δ طوال مدة القياس. لتحسين طاقة الليزر لمقايسات تخليق المجهر الفلوري أحادي الجزيء ، ينصح بقياس معدل التبييض الضوئي عن طريق تصوير البوليميراز المسمى على غطاء زجاجي نظيف. من خلال تغيير قوة الليزر بشكل منهجي وتقييم معدل التبييض الضوئي عبر مجال الرؤية ، يمكن للمرء تحديد شدة الليزر المثلى التي توازن بين قوة إشارة الفلوروفور ومقاومة التبييض الضوئي (انظر الشكل التكميلي 5).
تتمثل الميزة الرئيسية لهذا النهج أحادي الجزيء على الطرق التقليدية القائمة على المجموعة في قدرته على التصور المباشر عندما يواجه بوليميراز الحمض النووي الفردي بنية G4 ويتفاعل معها. أثبتت الطرق التقليدية القائمة على المجموعة (مثل الرحلان الكهربائي الهلامي) قدرة هياكل G4 على منع بوليميرات الحمض النووي23،36،37. ومع ذلك ، تفشل هذه التقنيات في توفير المعلومات الحركية والميكانيكية في الوقت الفعلي لهذا التفاعل ، وهو أمر ضروري لفك تشابك الخطوات والنتائج الحركية الجزيئية المختلفة. تقدم تقنيات الجزيء الفردي نظرة ثاقبة لا مثيل لها في حركية وآليات وسلوكيات الجزيئات الحيوية التي غالبا ما تكون مخفية بمتوسط38. أصبح من الممكن الآن معرفة كيفية عمل بوليميرات الحمض النووي في الوقت الفعلي - سواء كانت تتبادل أو توقف أو تنفصل أو تتجاوز حواجز الحمض النووي39. مع إنشاء هذا البروتوكول ، يمكن بسهولة تغيير هوية G4 من بنية c-MYC المتوازية المختارة إلى أي طوبولوجيا متوازية أو غير متوازية أو هجينة. سيكشف تطبيق هذا الاختبار أحادي الجزيء عما إذا كانت نفس بوليميرات الحمض النووي تتصرف بشكل مختلف عند مواجهة طبولوجيا G4 البديلة. على هذا النحو ، تعد طرق الجزيء الفردي ضرورية للإجابة على أسئلة محددة تتعلق بكيفية تفاعل بروتينات الجسم والحمض النووي.
من خلال التصور المباشر لتفاعلات بوليميراز الحمض النووي مع G-quadruplexes ، تم تحديد مسار تبادل لم يتم تمييزه سابقا للخميرة Pol δ. يشير هذا الاكتشاف إلى أن البوليميراز ينفصل عند مواجهة G-quadruplex ، في انتظار تدخل بروتين آخر لحل الهيكل قبل إعادة بدء تخليق الحمض النووي. يمكن تكييف هذا البروتوكول للتحقيق في التفاعلات بين بروتينات الحفاظ على الجينوم المختلفة وعوائق الحمض النووي ، مما يوفر رؤى لا مثيل لها حول كيفية تنقل الإنزيمات الخلوية في العوائق الجينومية على سبيل المثال ، يمكن تغيير حاجز هذا الاختبار من بنية G4 إلى ارتباط متشابك بين البروتين والحمض النووي ، وهو نوع من آفات الحمض النووي يرتبط فيه البروتين بشكل تساهمي لا رجعة فيه بالحمض النووي ، ويعمل كعقبة أمام تكرار الحمض النووي40. مثل هذه الفحوصات ضرورية لفهم العمليات الأساسية لتكرار الحمض النووي وإصلاحه وإعادة تركيبه. من خلال تمكين دراسة ديناميكيات بروتين الحمض النووي على المستوى الجزيئي ، يوفر هذا الاختبار أداة قوية لتوضيح الآليات الكامنة وراء السلامة الجينومية.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
ن.ك.-أ. يقر بالتمويل المقدم من منحة برنامج التدريب البحثي التابع للحكومة الأسترالية. LMS ممتنة للتمويل الذي تلقته من المجلس الوطني للصحة والبحوث الطبية (منحة المحققين 2007778). تعرب JSL عن امتنانها لحصولها على جائزة Discovery Early Career Award (DE240100780) و NHMRC Investigator EL1 (2025412) بتمويل من الحكومة الأسترالية. تعرب شركة إس إتش إم عن امتنانها لحصولها على زمالة بروس وارن للآفاق الجزيئية في إيلي المهنية.
Materials
| Name | Company | Catalog Number | Comments |
| 100 nt control DNA template | Integrated DNA Technologies | Primary control template in primer extension assays | |
| 100 nt G4-forming DNA template | Integrated DNA Technologies | Primary G4-forming template in primer extension assays | |
| 15% Mini-PROTEAN TBE-Urea Gel, 12 well, 20 µL | Bio-Rad | 4566055 | Gel electrophoresis |
| 20 nt labelled/biotinylated primer oligonucleotide | Integrated DNA Technologies | Required for primer extension of the 100 nt templates | |
| 22 nt control DNA template | Integrated DNA Technologies | Primary control template in circular dichroism spectroscopy experiments | |
| 22 nt G4-forming DNA template | Integrated DNA Technologies | Primary G4-forming template in circular dichroism spectroscopy experiments | |
| 24 x 24 mm coverslip | Marienfeld Superior | 100062 | Required for TIRF microscopy |
| 3-aminopropyltriethoxysilane | Thermo Fisher Scientific | A10668.22 | Coverslip functionalization |
| 647 nm laser | Coherent | 1196627 | Select wavelength to correspond to stain/dye of choice |
| 670 nm emission filter | Chroma Technology Corp | ET655lp | Ensures only the relevant wavelengths are let through to the detector |
| Amersham Typhoon 5 biomolecular imager | Cytiva | 29187191 | Gel analysis |
| Biotin-PEG-SVA (MW 5000) | Laysan Bio | BIO-PEG-SVA-5K-100MG | Coverslip functionalization |
| Deoxynucleotides triphosphate solution mix | Jena Bioscience | NU-1005L | Replication building blocks |
| Digital dry bath (115V) | Bio-Rad | 1660571 | Heating solutions |
| Dithiothreitol | Sigma-Aldrich | 646563 | Disulfide bond reduction |
| EM-CCD camera | Andor | iXon 897 | Capturing single-molecule movies |
| Formamide | Sigma-Aldrich | F9037 | DNA denaturing during ensemble DNA replication assays |
| Gas tight syringe, 1 mL | SGE | 21964 | Filling cuvette for circular dichroism spectroscopy |
| Inverted microscope with CFI Apo TIRF 100x oil-immersion objective | Nikon | Eclipse Ti-E | Facilitates single-molecule TIRF microscopy |
| J-810 Spectrophotometer | Jasco | J-810 | Measuring circular dichroism spectroscopy |
| mPEG-SVA (MW 5000) | Laysan Bio | MPEG-SVA-5K-100MG | Coverslip functionalization |
| NanoDrop One Spectrophotometer | Thermofisher Scientific | ND-ONE | Measuring protein and label concentrations |
| NeutrAvidin | Thermo Fisher Scientific | 31000 | Tethering DNA templates to the functionalized coverslips during single-molecule experiments |
| Polyethylene tubing | Instech | BTPE-60 | Needed for flow cell construction |
| Quartz cuvette, 10 mm | Starna Scientific | 1/Q/10/CD | Holds sample for circular dichroism spectroscopy |
| Syringe pump | Adelab Scientific | NE-1002X | Used to flow buffers and substrates through a microfluidic flow cell |
| Tris-EDTA buffer | Thermofisher Scientific | 93283 | DNA solution buffer |
| Yeast polymerase δ | Michael O'Donnell Lab | Replicating the DNA templates | |
| Zeba spin desalting column, 7 K MWCO, 0.5 mL | Thermo Fisher Scientific | 89882 | Polymerase purification |
References
- Sutton, M. D. Walker, G. C. Managing DNA polymerases: Coordinating DNA replication, DNA repair, and DNA recombination. Proc Natl Acad Sci U. S. A. 98 (15), 8342-8349 (2001).
- Garg, P. Burgers, P. M. J. DNA polymerases that propagate the eukaryotic DNA replication fork. Crit Rev Biochem Mol Biol. 40 (2), 115-128 (2005).
- Burgers, P. M. J. Eukaryotic DNA polymerases in DNA replication and DNA repair. Chromosoma. 107 (4), 218-227 (1998).
- Tsai, M.-D. How DNA polymerases catalyze DNA replication, repair, and mutation. Biochem. 53 (17), 2749-2751 (2014).
- Lewis, J. S. et al. Tunability of DNA polymerase stability during eukaryotic DNA replication. Mol Cell. 77 (1), 17-25 (2020).
- Chilkova, O. et al. The eukaryotic leading and lagging strand DNA polymerases are loaded onto primer-ends via separate mechanisms but have comparable processivity in the presence of PCNA. Nucleic Acids Res. 35 (19), 6588-6597 (2007).
- Kawasaki, Y. Sugino, A. Yeast replicative DNA polymerases and their role at the replication fork. Mol Cells. 12 (3), 277-285 (2001).
- Stillman, B. DNA polymerases at the replication fork in eukaryotes. Mol Cell. 30 (3), 259-260 (2008).
- Wood, R. D. Shivji, M. K. Which DNA polymerases are used for DNA repair in eukaryotes? Carcinogenesis. 18 (4), 605-610 (1997).
- Budd, M. E. Campbell, J. L. The roles of the eukaryotic DNA polymerases in DNA repair synthesis. Mutat Res DNA Repair. 384 (3), 157-167 (1997).
- Yang, W. Gao, Y. Translesion and repair DNA polymerases: Diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Bridges, B. A. DNA repair: Polymerases for passing lesions. Curr Biol. 9 (13), 475-477 (1999).
- Wilkinson, E. M., Spenkelink, L. M., Van Oijen, A. M. Observing protein dynamics during DNA-lesion bypass by the replisome. Front Mol Biosci. 9, 968424 (2022).
- Mueller, S. H., Spenkelink, L. M., Van Oijen, A. M. When proteins play tag: The dynamic nature of the replisome. Biophys Rev. 11 (4), 641-651 (2019).
- Zybailov, B. L., Sherpa, M. D., Glazko, G. V., Raney, K. D., Glazko, V. I. G4-quadruplexes, and genome instability. Mol Biol. 47 (2), 197-204 (2013).
- Loeb, L. A. Monnat, R. J. DNA polymerases and human disease. Nat Rev Genet. 9 (8), 594-604 (2008).
- Oganesian, L. Bryan, T. M. Physiological relevance of telomeric G-quadruplex formation: A potential drug target. Bioessays. 29 (2), 155-165 (2007).
- Chambers, V. S. et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nat Biotechnol. 33 (8), 877-881 (2015).
- Cheng, Y., Zhang, Y., You, H. Characterization of G-quadruplexes folding/unfolding dynamics and interactions with proteins from single-molecule force spectroscopy. Biomol. 11 (11), 1579 (2021).
- Tippana, R., Xiao, W., Myong, S. G-quadruplex conformation and dynamics are determined by loop length and sequence. Nucleic Acids Res. 42 (12), 8106-8114 (2014).
- Kusi-Appauh, N., Ralph, S. F., Van Oijen, A. M., Spenkelink, L. M. Understanding G-quadruplex biology and stability using single-molecule techniques. J Phys Chem B. 127 (25), 5521-5540 (2023).
- Obi, I. et al. Stabilization of G-quadruplex DNA structures in Schizosaccharomyces pombe causes single-strand DNA lesions and impedes DNA replication. Nucleic Acids Res. 48 (19), 10998-11015 (2020).
- Kamath-Loeb, A. S., Loeb, L. A., Johansson, E., Burgers, P. M., Fry, M. Interactions between the Werner syndrome helicase and DNA polymerase delta specifically facilitate copying of tetraplex and hairpin structures of the d(CGG)n trinucleotide repeat sequence. J Biol Chem. 276 (19), 16439-16446 (2001).
- Kaguni, L. S. Clayton, D. A. Template-directed pausing in in vitro DNA synthesis by DNA polymerase a from Drosophila melanogaster embryos. Proc Natl Acad Sci. 79 (4), 983-987 (1982).
- Sato, K., Martin-Pintado, N., Post, H., Altelaar, M., Knipscheer, P. Multistep mechanism of G-quadruplex resolution during DNA replication. Sci Adv. 7 (39), eabf8653 (2021).
- Castillo Bosch, P. et al. FANCJ promotes DNA synthesis through G-quadruplex structures. EMBO J. 33 (21), 2521-2533 (2014).
- Paeschke, K., Capra, John A., Zakian, Virginia A. DNA replication through G-quadruplex motifs is promoted by the Saccharomyces cerevisiae Pif1 DNA helicase. Cell. 145 (5), 678-691 (2011).
- Guo, L. et al. Joint efforts of replicative helicase and SSB ensure inherent replicative tolerance of G-quadruplex. Adv Sci. (Weinh.). 11 (9), e2307696 (2024).
- Pham, S. Q. T. et al. A new class of quadruplex DNA-binding nickel Schiff base complexes. Dalton Trans. 49 (15), 4843-4860 (2020).
- Georgescu, R. E. et al. Mechanism of asymmetric polymerase assembly at the eukaryotic replication fork. Nat Struct Mol Biol. 21 (8), 664-670 (2014).
- Au - Desjardins, P., Au - Hansen, J. B., Au - Allen, M. Microvolume protein concentration determination using the NanoDrop 2000c spectrophotometer. J Vis Exp. 33, e1610 (2009).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). J Vis Exp. 32, e1485 (2009).
- Geertsema, H. J., Duderstadt, K. E., Van Oijen, A. M. in DNA Replication: Methods and Protocols., eds Vengrova, S., Dalgaard, J.) 219-238, Springer New York, New York, NY (2015).
- Lewis, J. S. et al. Single-molecule visualization of fast polymerase turnover in the bacterial replisome. eLife. 6, e23932 (2017).
- Fish, K. N. Total internal reflection fluorescence (TIRF) microscopy. Curr Protoc Cytom. 12, 12-18 (2009).
- Sommers, J. A., Estep, K. N., Maul, R. W., Brosh, R. M. Biochemical analysis of DNA synthesis blockage by G-quadruplex structure and bypass facilitated by a G4-resolving helicase. Methods. 204, 207-214 (2022).
- Edwards, D. N., Machwe, A., Wang, Z., Orren, D. K. Intramolecular telomeric G-quadruplexes dramatically inhibit DNA synthesis by replicative and translesion polymerases, revealing their potential to lead to genetic change. PLoS One. 9 (1), 80664 (2014).
- Mueller, S. H. et al. Rapid single-molecule characterization of enzymes involved in nucleic-acid metabolism. Nucleic Acids Res. 51 (1), 5 (2022).
- Lewis, J. S., Van Oijen, A. M., Spenkelink, L. M. Embracing heterogeneity: Challenging the paradigm of replisomes as deterministic machines. Chem Rev. 123 (23), 13419-13440 (2023).
- Stingele, J., Bellelli, R., Boulton, S. J. Mechanisms of DNA-protein crosslink repair. Nat Rev Mol Cell Biol. 18 (9), 563-573 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved