A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير نقل طاقة رنين الخلية الحية لديناميكيات تنشيط Akt المنظمة الأيضية في خلايا HepG2
In This Article
Summary
هنا ، نقدم بروتوكولا لتحديد الديناميكيات الزمانية المكانية لتنشيط Akt والفسفرة في خلايا HepG2 الحية. يعد تصوير فورستر لنقل الطاقة بالرنين (FRET) أداة قوية توفر رؤى قيمة حول مسارات إشارات الأنسولين وتنظيم التمثيل الغذائي في الخلايا السرطانية.
Abstract
يعد تنشيط Akt المنظم الأيض عقدة مهمة في سلسلة إشارات الأنسولين ويوفر رؤى قيمة حول العلاقة بين مرض السكري والسرطان. لتحديد نشاط Akt بدقة في خلايا HepG2 ، قمنا بتطوير بروتوكول قوي وقابل للتكرار باستخدام نقل طاقة الرنين Förster (FRET) مع أجهزة استشعار حيوية مشفرة وراثيا خاصة ب Akt. يحدد هذا البروتوكول خطوات مفصلة لزراعة الخلايا ، وإعداد طبق التصوير ، وتعداء خلايا HepG2 للتعبير عن أجهزة الاستشعار الحيوية القائمة على FRET ، جنبا إلى جنب مع إرشادات محددة لتكوين أجهزة وبرامج المجهر متحد البؤر للمسح بالليزر. أظهرت النتائج أنماطا فريدة من إشارات الأنسولين في خلايا HepG2 ، والتي تظهر مفتاحا لا رجعة فيه يتميز بتنشيط Akt التأسيسي مع عتبة تشغيل محددة ولكن بدون عتبة إيقاف التشغيل. في المقابل ، تعرض الأنابيب العضلية مفتاحا قابلا للعكس. يشير تنشيط Akt المستمر في خلايا HepG2 إلى آليات تكمن وراء مقاومة الأنسولين وخلل تنظيم التمثيل الغذائي في الخلايا الكبدية ، مع آثار أوسع لفهم تطور اضطرابات التمثيل الغذائي والسرطان. يوفر هذا البروتوكول إطارا قيما لاستكشاف مسارات الإشارات المتعلقة ب Akt والسلوكيات الخلوية عبر سياقات المرض المختلفة.
Introduction
يشكل داء السكري تحديا صحيا عالميا كبيرا ، يتميز بمقاومة الأنسولين وضعف توازن الجلوكوز1. يعد الفهم الشامل لمسارات إشارات الأنسولين أمرا بالغ الأهمية لتوضيح الفيزيولوجيا المرضية لهذا المرض ، حيث يلعب الأنسولين دورا محوريا في استقلاب الجلوكوز ونمو الخلايا والبقاءعلى قيد الحياة 2. أظهرت العديد من الدراسات أن إشارات الأنسولين تؤثر بشكل كبير على أنواع السرطان المختلفة ، حيث تربط مقاومة الأنسولين بتطور الورم ونتائج المرضىالسيئة 3،4،5،6. تعمل خلايا HepG2 ، وهي خط خلايا شائع الاستخدام لسرطان الخلايا الكبدية ، كنموذج قيم لدراسة مقاومة الأنسولين والتفاعل بين خلل التمثيل الغذائي وتطورالسرطان 7. تقليديا ، نظر الباحثون إلى استجابات الأنسولين على أنها متدرجة. ومع ذلك ، فقد كشفت الدراسات الحديثة أن الخلايا الفردية يمكن أن تظهر استجابات ثنائية الثبات ، مما يعرض انتقالات بارزة بين عدم الاستجابة والاستجابة الكاملة التي تحدث عند عتبات تركيز الأنسولينالمحددة 8،9.
يعد تصوير نقل طاقة الرنين Förster (FRET) أداة قوية لدراسة التوزيع المكاني والزماني للجزيئات الحيوية في الخلاياالحية 10. من خلال استخراج المعلومات من الديناميكيات الجزيئية ، يوفر FRET رؤى حول عمليات مثل تنشيط Akt في الوقت الفعلي ، مما يجعلها تقنية لا تقدر بثمن لدراسة الخلاياالحية 11،12. أثبتت طريقة التصوير هذه أنها ضرورية في دراسة الديناميكيات الخلوية ، لا سيما في أمراض التمثيل الغذائي والسرطان ، حيث تكون التفاعلات الجزيئية الدقيقة حاسمة13. يتيح FRET أيضا المراقبة في الوقت الفعلي للتفاعلات الجزيئية ، مما يلقي الضوء على آليات مثل مقاومة الأنسولين وتطور الورم14،15. تعتبر المستشعرات الحيوية FRET ضرورية في أبحاث السرطان لدراسة البيئات الدقيقة للورم ومقاومة الأدوية واضطراباتالتمثيل الغذائي 16. توفر طرق الكشف عن FRET ، مثل الانبعاث المحسس (SE) ، وتبييض المتقبل (AB) ، والفحص المجهري للتصوير مدى الحياة الفلورية (FLIM) ، والتحليل الطيفي ، مزايا مميزة لتحديد التفاعلات الجزيئية17. يقيس SE نقل الطاقة بين الفلوروفورات المانحة والمستقبلة ، مما يؤدي إلى تحول قابل للقياس في أطياف الانبعاث يرتبط بقرب الجزيئات الحيوية المتفاعلة18. يستخدم AB التبييض الضوئي الانتقائي للفلوروفور المستقبل ويتتبع التغيرات في مضان المتبرع ، مما يسمح للباحثين بتقييم حركية التفاعل والمسافات19. تقوم FLIM بتقييم معدلات اضمحلال التألق للفلوروفور المانح ، والتي تتأثر بشكل مباشر بكفاءة FRET ، لتوفير قياسات نانوية دقيقة للتفاعلات الجزيئية20.
باستخدام تقنيات FRET ، أظهرنا مؤخرا استجابات الأنسولين ثنائية الثبات في الأنابيب العضلية المشتقة من C2C128،9،21،22،23،24. تشير عتبات التشغيل والإيقاف المميزة لتنشيط Akt ، كما اكتشفنا ، إلى أن استجابة جرعة الأنسولين المتدرجة لكامل الجسم تكذب تعقيد سلسلة الإشارات تحت الخلوية بدءا من تحفيز الأنسولين ، والذي يبلغ ذروته في استجابة الكل أو لا شيء على مستوى الخليةالمفردة 21،22،23،24. لاختبار وجود ثنائي الاستقرار في أنواع الخلايا الأخرى ، قمنا بتحفيز خلايا HepG2 بالأنسولين وسجلنا استجابتها باستخدام تصوير FRET أحادي الخلية. قمنا بتحفيز خلايا HepG2 بتركيزات متفاوتة من الأنسولين وراقبنا نشاط Akt على مستوى الخلية المفردة باستخدام مستشعر حيوي Akt. يشتمل المستشعر الحيوي Akt على بروتين الفلورسنت السماوي المعزز (ECFP) 25 باعتباره الفلوروفور المانح وألمع البديل للبروتين الفلوري الأصفر (YPet) 26 باعتباره الفلوروفور المستقبل ، المرتبط برابط Eevee الذي يحتوي على تسلسل الببتيد SGRPRTTTFADSCKP. يعمل هذا الببتيد كركيزة ل Akt الفسفوري (pAkt) ، الأحسن من سينسيز الجليكوجين البشري سينسيز 3β (GSK3β). في حالته غير الفسفرة ، يتجاوز الفصل المكاني بين الفلوروفورات المانحة والمستقبلة نصف قطر فورستر ، مما يمنع نقل الطاقة. عند تحفيز الأنسولين ، تحدث فسفرة Akt وتؤدي إلى فسفرة SGRPRTTTFADSCKP. تؤدي هذه العملية إلى تغيير توافقي يجلب المتبرع والمتلقي داخل دائرة نصف قطرها Förster ، مما يتيح FRET27. نتيجة لذلك ، ترتبط شدة إشارة FRET بكمية جزيئات Akt الفسفرية وتسمح بالقياس الكمي في الوقت الفعلي للاستجابات الخلوية بوساطة الأنسولين.
تم تطبيق هذا البروتوكول ، الذي تم تطويره في البداية لدراسة إشارات الأنسولين في الأنابيب العضلية المشتقة من C2C12 ، بنجاح على خلايا HepG2 واستخدامه عبر منصات الأجهزة والبرامج المختلفة ، مما يدل على قابليته للتطبيق والقدرة على التكيف وتعدد استخداماته. تظهر خلايا HepG2 نشاطا تأسيسيا Akt ، مما يجعلها نموذجا مثاليا في المختبر لدراسة إشارات الأنسولين الخاصة بالكبد وعمليات التمثيل الغذائي. يتم وصف الميزات الرئيسية للبروتوكول خطوة بخطوة في قسم البروتوكول.
Protocol
تظهر نظرة عامة على الخطوات التجريبية المتضمنة في تصوير الخلايا الحية FRET لمراقبة فسفرة Akt في خلايا HepG2 المفردة في الشكل 1.
1. اكتساب البلازميد وانتشاره وتنقيته
ملاحظة: يوضح هذا القسم الخطوات الأساسية للحصول على البلازميد المطلوب لتحليل FRET أحادي الخلية وتضخيمه وتنقيته.
- استخدم بلازميد pEevee-iAkt-NES-YPet (الشكل 2 أ).
ملاحظة: تم توفير البلازميد بسخاء من قبل البروفيسور كازوهيرو أوكي في المعهد الوطني لعلم الأحياء الأساسي (NIBB) ، اليابان ، حيث تم تصوير خرائط البلازميد لأجهزة الاستشعار الحيوية FRET المستخدمة لمراقبة Akt وعناصر التحكم الخاصة بها في الشكل 2. ال pEevee-iAkt-NES-ECFP (مانح; الشكل 2 ب) و pEevee-iAkt-NES-Ypet (متقبل; الشكل 2 ج) تستخدم البلازميدات كعناصر تحكم في المعايرة أثناء تجارب FRET9.
ملاحظة: يوضح الشكل 3 تكوين وآلية المستشعر الحيوي FRET داخل الجزيئات. - لنشر البلازميد ، قم بإجراء التحول البكتيري باستخدام بكتريا قولونية المختصة كيميائيا (انظر جدول المواد). ضع الخلايا المحولة على أجار Luria-Bertani (LB) الذي يحتوي على 100 ميكروغرام / مل أمبيسلين واحتضانه طوال الليل عند 37 درجة مئوية. في اليوم التالي ، اختر مستعمرة مقاومة للأمبيسلين وزرعها في مرق LB مكمل ب 100 ميكروغرام / مل أمبيسلين لتضخيم البلازميد.
- لتنقية الحمض النووي البلازميد ، استخدم مجموعة تنقية الحمض النووي البلازميد المتوفرة تجاريا (انظر جدول المواد) للحصول على نقاء وعائد عاليين. قم بتقييم جودة الحمض النووي عن طريق قياس نسب الامتصاص (A260 / A280 و A260 / A230) باستخدام مقياس الطيف الضوئي (انظر جدول المواد). تعتبر النسب بين 1.8-2.0 و 2.0-2.2 هي النسب المثلى. تحقق من سلامة البلازميد من خلال الرحلان الكهربائي لهلام الاغاروز للتأكد من أنه مناسب للتعداد.
2. إجراء زراعة الخلايا
ملاحظة: قم بإجراء جميع إجراءات زراعة الخلايا داخل غطاء التدفق الصفحي للحفاظ على بيئة معقمة ومنع التلوث. يظهر سير عمل زراعة الخلايا HepG2 في الشكل 4. تتكون الوسائط الكاملة لخلايا HepG2 من الحد الأدنى من الوسط الأساسي (MEM) ، و 10٪ مصل بقري الجنين (FBS) ، و 1٪ من الأحماض الأمينية غير الأساسية (NEAA) ، و 1 ملي مولار بيروفات الصوديوم ، و 2 ملي مولار من مكمل L-glutamine ، و 100 U / مل من البنسلين - الستربتومايسين ، و 2.5 ميكروغرام / مل محلول مضاد للمضادات الحيوية ومضاد للفطريات (انظر جدول المواد ، الجدول 1).
- قم بإذابة خلايا HepG2 المجمدة بسرعة عن طريق وضع القارورة في خلاط حراري أو حمام مائي بدرجة حرارة 37 درجة مئوية حتى تذوب تماما.
- انقل الخلايا المذابة إلى أنبوب مخروطي سعة 15 مل يحتوي على 10 مل من وسط النمو الكامل (انظر جدول المواد).
ملاحظة: قم بتسخين وسط النمو الكامل مسبقا إلى 37 درجة مئوية قبل الاستخدام لتقليل الصدمة الحرارية للخلايا. - الطرد المركزي الأنبوب عند 200 × جم لمدة 5 دقائق لتكسير الخلايا.
- قم بشفط المادة الطافية بعناية باستخدام طرف ماصة عريض التجويف لتجنب إزعاج حبيبات الخلية.
- أعد تعليق الحبيبات في 10 مل من وسط النمو الكامل الطازج.
- انقل معلق الخلية إلى قارورة زراعة الأنسجة بمساحة 75 سم مربع.
- احتضان القارورة عند 37 درجة مئوية في جو رطب مع 5٪ ثاني أكسيد الكربون2
ملاحظة: راقب الخلايا خلال 24-48 ساعة القادمة لتأكيد التعلق وتقييم الشفاء. لا تزعج الخلايا لمدة 4 ساعات على الأقل لضمان التعلق المناسب قبل تغيير الوسط. تجنب فتح الحاضنة بشكل متكرر خلال أول 4 ساعات ، لأن هذا قد يعطل ارتباط الخلية. اتبع بروتوكولات السلامة الحيوية المؤسسية واستخدم معدات الحماية الشخصية المناسبة (PPE) للحفاظ على بيئة عمل آمنة أثناء جميع إجراءات زراعة الخلايا. الخلايا الفرعية لخلايا HepG2 عندما تصل إلى التقاء 70٪ -80٪ للحفاظ على ظروف النمو المثلى ومنع الاكتظاظ ، مما قد يؤثر على بقاء الخلية وإمكانات النمو. - للزراعة الفرعية ، قم بشفط الوسط واشطف الخلايا مرة واحدة باستخدام 5 مل من المحلول الملحي المخزن بالفوسفات (PBS).
- أضف 1 مل من 0.25٪ تريبسين لتغطية طبقة الخلية الأحادية (انظر جدول المواد).
ملاحظة: تأكد من تسخين التربسين مسبقا إلى 37 درجة مئوية للحصول على النشاط الأمثل. لا تفرط في التربسين في الخلايا ، لأن ذلك قد يقلل من قابلية البقاء. راقب الخلايا تحت المجهر للتأكد من الانفصال. - احتضن عند 37 درجة مئوية لمدة 5 دقائق.
- عندما تنفصل الخلايا ، أضف 2 مل من الوسط الكامل لتحييد التربسين وجمع الخلايا عن طريق سحب العينات.
- قم بعمل ماصة معلق الخلية برفق لتفتيت الكتل وتحقيق تعليق أحادي الخلية.
- أضف 3 مل من الوسط الكامل إلى كل قارورة جديدة ، ثم انقل الخلايا بنسبة انقسام 1: 2 لكل قارورة.
ملاحظة: بالنسبة للممرات المبكرة ، قم بتقسيم الخلايا بتخفيف 1: 2. بعد المقاطع 4-5 ، يمكن إجراء تخفيفات 1: 4 أو 1: 5 حسب الاقتضاء. - احتضان الخلايا عند 37 درجة مئوية في جو مرطب مع 5٪ ثاني أكسيد الكربون2.
ملاحظة: افحص الخلايا بعد 24 ساعة لتأكيد التعلق وتقييم التعافي. - للثقافة الروتينية ، استبدل وسط المزرعة كل 2-3 أيام أو قبل ذلك إذا تغير مؤشر الأس الهيدروجيني من اللون الوردي إلى الأصفر ، مما يشير إلى التحمض.
ملاحظة: لا تدع الوسط يصبح حمضيا جدا ، لأن ذلك قد يضر بالخلايا. - تحقق من مورفولوجيا الخلية بانتظام تحت المجهر للتأكد من صحة الخلية.
ملاحظة: للتخزين قصير الأجل ، قم بتجميد خلايا HepG2 عند -80 درجة مئوية ؛ للتخزين طويل الأجل ، قم بتخزينه في النيتروجين السائل. تم توضيح تكوين وسط التجميد المستخدم في هذه التجربة في (الجدول 2).
3. طلاء أطباق التصوير مع بولي ليسين
- استخدم 1 مل من محلول بولي إل ليسين 0.1 ملغم/مل لكل طبق تصوير لتغطية السطح بالكامل (انظر جدول المواد).
ملاحظة: اضبط تركيز Poly-L-Lysine بناء على متطلبات نوع الخلية المحددة. - هز الطبق برفق للحصول على طلاء موحد لسطح الثقافة.
ملاحظة: تأكد من ظروف معقمة طوال العملية لمنع التلوث. - احتضن الأطباق طوال الليل في درجة حرارة الغرفة (RT).
- استنشط محلول Poly-L-Lysine الزائد من الأطباق عن طريق سحب العينات.
- اشطف السطح باستخدام PBS ثلاث مرات ، مع الراحة لمدة 5 دقائق في كل مرة (انظر جدول المواد). إزالة تماما غير المرتبط بولي إل ليسين من طبق التصوير لمنع تثبيط نمو الخلايا. اشطف الألواح برفق لتجنب كشط أو إتلاف قاع الزجاج.
- جفف أطباق التصوير المطلية بالهواء عند 37 درجة مئوية لمدة 3 ساعات على الأقل.
- استخدم أطباق التصوير المطلية على الفور أو قم بتخزينها في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوعين.
4. تعداء خلايا HepG2
ملاحظة: طريقة تعداء HepG2 موضحة في الشكل 5.
- خلايا HepG2 للبذور في أطباق التصوير المطلية مسبقا قبل 24-48 ساعة من التعدي لضمان وصولها إلى 70٪ -90٪ التقاء.
- قم بإذابة الكاشف الشفاف والبلازميد الذي يشفر المستشعر الحيوي FRET على الجليد. قم بتدوير الدوامة جيدا وقم بإجراء دوران قصير (على سبيل المثال ، 5,000 × جم لمدة 5 ثوان) قبل الاستخدام (انظر جدول المواد).
ملاحظة: تأكد من إذابة كاشف الإرسال والبلازميد بالكامل قبل الاستخدام.
تنبيه: تجنب دورات التجميد والذوبان المتكررة ، لأن هذا قد يقلل من كفاءة كاشف التعداد. - أضف 8 ميكروغرام من البلازميد الذي يشفر المستشعر الحيوي FRET مع المخزن المؤقت للتفاعل إلى حجم نهائي قدره 100 ميكرولتر.
ملاحظة: قم دائما بإضافة البلازميد إلى المخزن المؤقت قبل إضافة كاشف الإرسال القائم على البوليمر. يجب أن يتكون ما لا يقل عن 50 ميكرولتر من المحلول من المخزن المؤقت للتفاعل (انظر جدول المواد). - أضف 2.4 ميكرولتر من بوليمر التعدي إلى الأنبوب الذي يحتوي على الحمض النووي البلازميد المخفف. تخلط جيدا عن طريق الدوامة لمدة 15 ثانية بسرعة عالية (حوالي 3,000-5,000 × جم).
ملاحظة: استخدم دائما 0.3 ميكرولتر من بوليمر التعدي لكل 1 ميكروغرام من الحمض النووي.
تنبيه: تأكد من خلط بوليمر التعدي تماما مع الحمض النووي البلازميد لتشكيل مجمعات جسيمات نانوية موحدة. - احتضان المستشعر الحيوي وخليط البوليمر عند 37 درجة مئوية لمدة 15 دقيقة للسماح بتكوين مجمعات الجسيمات النانوية.
ملاحظة: تجنب الاحتفاظ ببوليمر التعدي في المحلول لأكثر من 30 دقيقة ، لأن ذلك قد يقلل من كفاءة التعداد.
تنبيه: راقب وقت الحضانة بعناية لمنع الإفراط في الحضانة ، مما قد يؤدي إلى تقليل كفاءة التعداد. - قم بتدوير الأنبوب لمدة 5 ثوان عند 5,000 × جم لتجميع المحتويات في الأسفل ، ثم أضف 100 ميكرولتر بالكامل من محلول مركب الجسيمات النانوية بالتنقيط إلى وسط زراعة الخلية. هز الطبق برفق ذهابا وإيابا للخلط.
ملاحظة: تأكد من إضافة محلول مركب الجسيمات النانوية بالتنقيط لتوزيعه بالتساوي عبر وسط زراعة الخلية.
تنبيه: تجنب التأرجح القوي ، لأن ذلك قد يؤدي إلى إزاحة الخلايا أو التسبب في توزيع غير متساو للمجمعات. - احتضان اللوحة عند 37 درجة مئوية لمدة 4 ساعات إلى ليلة كاملة.
ملاحظة: يمكن تعديل وقت الحضانة بناء على الاحتياجات التجريبية ، ولكن عادة ما تكون 4 ساعات كافية للتعداء الفعال.
تحذير: تجنب الحضانة لفترات طويلة (>16 ساعة) ، لأن ذلك قد يقلل من صلاحية الخلية. - قم بإزالة مجمعات الجسيمات النانوية من الخلايا عن طريق الشفط ، واستبدلها ب 2 مل من وسط النمو الكامل الطازج ، وأعد اللوحة إلى الحاضنة 37 درجة مئوية حتى وقت التحليل. يصل التعبير الأقصى عادة إلى 48 ساعة بعد التعدين.
- تحليل الخلايا تحت المجهر الفلوري.
ملاحظة: تأكد من معايرة المجهر بشكل صحيح للتصوير الفلوري للحصول على نتائج دقيقة.
تنبيه: قلل من تعرض الخلايا للضوء الشديد أثناء التصوير لمنع السمية الضوئية.
5. تجويع خلايا HepG2
ملاحظة: بعد الانتهاء من خطوة التعدي ، قم بتجويع الخلايا في المصل قبل تحفيز الأنسولين وتصوير FRET. هذا يقلل من تنشيط مسار Akt بسبب الأنسولين الموجود في FBS ويضمن مستويات خط الأساس المتسقة لنشاط Akt. يتم وصف تكوين وسط التجويع المستخدم في هذه التجربة في (الجدول 3). يأتي BSA في شكل مسحوق. لتحضير محلول 0.1٪ (وزن / حجم) ، أعد تكوين 0.1 غرام من BSA في 3 مل من DMEM ، وخلطها جيدا. عقم المحلول باستخدام مرشح 0.45 ميكرومتر واضبط الحجم النهائي على 100 مل عن طريق إضافة DMEM.
- قم بإزالة وسط الثقافة واشطف أطباق التصوير باستخدام 1x PBS مرتين لمدة 5 دقائق لكل منهما.
ملاحظة: يساعد غسلتا PBS على إزالة المصل المتبقي تماما وأي أنسولين أو عوامل نمو قد تتداخل مع التجربة. - أضف 2 مل من وسط الجوع إلى أطباق التصوير (انظر جدول المواد). أضف الوسط برفق حول حافة الطبق لتجنب إزاحة الخلايا من قاع الزجاج. احتضان عند 37 درجة مئوية لمدة 4 ساعات.
ملاحظة: الحضانة لمدة 4 ساعات هي الأمثل لمزامنة التمثيل الغذائي الخلوي. ومع ذلك ، يمكن تمديد المدة حسب الاحتياجات التجريبية.
6. تصوير الخلايا الحية FRET لخلايا HepG2
ملاحظة: يوفر هذا القسم إرشادات لتصوير الخلايا الحية FRET لمراقبة الديناميكيات الزمانية المكانية لفسفرة Akt في خلايا HepG2 المفردة. من الضروري تحسين إعداد المجهر وإجراءات المناولة وظروف التصوير لخلايا HepG2 الحية ، كما هو مفصل أدناه. يعد إعداد المجهر أمرا بالغ الأهمية لتحسين ظروف التصوير لتصوير FRET. اتبع إعداد الفحص المجهري للمسح الضوئي بالليزر متحد البؤر للكمبيوتر الشخصي / متحد البؤر (CLSM) تدريجيا وفقا لتعليمات الشركة المصنعة لضمان التشغيل المستقر. يظهر تكوين CLSM المخصص لتصوير FRET في (الشكل 6).
- قم بتشغيل المفتاح عن بعد لتشغيل المجهر والكمبيوتر والماسح الضوئي وإطلاق الليزر ومرحلة بيزو ومصدر ضوء LED الفائفلوري. تأكد من توصيل جميع المكونات بشكل صحيح قبل التشغيل لتجنب أي ضرر محتمل.
- أدر المفتاح إلى وضع التشغيل عند تشغيل الليزر واضغط على الأزرار لتنشيط كلا الليزران المطلوبين لخطوط الليزر FRET (خطوط ليزر 457 نانومتر و 514 نانومتر).
ملاحظة: تأكد من وجود المرشحات والإعدادات المناسبة للحصول على تصوير FRET الأمثل. يجب أن يعتمد اختيار خط الليزر على ملفات تعريف الإثارة والانبعاث للمستشعر الحيوي. - قم بتشغيل شريط الطاقة لتشغيل الكمبيوتر والشاشة المتصلة بالمجهر.
ملاحظة: تأكد من أن جميع التوصيلات آمنة قبل التشغيل لمنع أي تلف في المعدات. - قم بتسجيل الدخول إلى Windows وقم بتشغيل برنامج الفحص المجهري.
- انقر فوق A1 للاكتساب لبدء إعداد التصوير. حدد التكوينات البصرية المناسبة بناء على متطلبات تجربة FRET.
- اضبط طاقة الليزر وحساسية الكاشف حسب الحاجة لظروف التصوير المثلى. قم بتثبيت الحاضنة العلوية لمرحلة المجهر بعناية وقم بتثبيتها بمسامير.
ملاحظة: لا تفرط في إحكام ربط البراغي لمنع تلف الحاضنة أو مرحلة المجهر. - املأ الحمام المائي الداخلي بالماء المقطر المزدوج المعقم (ddH2O). قم بتثبيت السخان العلوي بإحكام وقم بتشغيل مصدر الطاقة لسخان المسرح وسخان الحمام وسخان العدسة (الشكل 7 أ).
ملاحظة: لا تفرط في الملء لتجنب الانسكاب في النظام. تأكد من أن جميع السخانات تعمل بشكل صحيح للحفاظ على ظروف درجة حرارة ثابتة لتصوير الخلايا الحية. - استخدم عدسة الغمر بالزيت 40x للتصوير (انظر جدول المواد).
ملاحظة: راجع موقع الشركة المصنعة للحصول على المواصفات الفنية. - امسح العدسة الموضوعية بورق عدسة مبلل بنسبة 95٪ من الإيثانول. ضع قطرة صغيرة من زيت الغمر على العدسة الشيئية (الشكل 7 ب). ضع طبق التصوير الذي يحتوي على خلايا HepG2 على مرحلة المجهر وثبته بالحامل (الشكل 7 ج).
ملاحظة: تأكد من محاذاة طبق التصوير وتثبيته بشكل صحيح لمنع أي حركة أثناء التصوير. تجنب الضغط على العدسة لمنع تلف كل من العدسة والقاع الزجاجي للطبق. - أغلق الغرفة واحتضان الخلايا داخل حجرة الخلية الحية لمدة 1-2 ساعة للسماح لها بالتوازن (الشكل 7 د).
- أثناء التصوير بفاصل زمني ، توقف مؤقتا على فترات محددة وقم بإزالة الوسائط برفق (الشكل 7E) ، ثم أضف 1 مل من الوسائط المعدة حديثا بتركيز الأنسولين المحدد (الشكل 7F ، جدول المواد).
ملاحظة: قم بإعداد محلول مخزون الأنسولين 1 مجم / مل عن طريق إذابة 1 مجم من الأنسولين في 1 مل من حمض الخليك 10 مليلار. قم بتصفية المحلول من خلال مرشح حقنة معقمة 0.2 ميكرومتر وقم بتخزين الحصص عند -20 درجة مئوية. - قم بتشغيل نافذة اكتساب ND من قائمة ملف في برنامج الفحص المجهري.
ملاحظة: يظهر إعداد اكتساب ND في (الشكل 8). - حدد علامة التبويب الوقت لتعيين الفاصل الزمني والمدة والحلقات المطلوبة للتصوير بفاصل زمني. بعد ذلك ، انقر فوق علامة التبويب XY واضغط على + إضافة زر لتضمين خلايا HepG2 الفردية للتصوير.
- لإضافة خلايا متعددة، حدد موقع الخلايا المناسبة، وامسح ضوئي للتركيز وضبط التركيز وقفل وظيفة انتشار النقاط (PSF). كرر هذه الخطوة لكل خلية جديدة تمت إضافتها للتصوير. امسح خلايا متعددة في مواقع مختلفة داخل أطباق التصوير لتحديد الخلايا المستهدفة المختلفة لإدراجها.
- انقر فوق أيقونة X الحمراء لإلغاء تحديد الخلايا. حدد المربع "Z" لتعيين الموضع Z. بعد تحديد جميع المعلمات ، أدخل اسم التجربة في مربع "اسم الملف".
- انقر على استعراض لاختيار المجلد الوجهة، ثم حدد المربع حفظ في ملف. اضغط على تشغيل الآن علامة التبويب لبدء الاستحواذ على ND. ستعرض نافذة الاستحواذ على ND التقدم في الوقت الفعلي للتصوير بفاصل زمني ، بما في ذلك الوقت المنقضي والوقت المتبقي.
- سجل قياسات خط الأساس لمدة تصل إلى 30 دقيقة دون تحفيز الخلايا بالأنسولين.
- حدد موقع الخلايا المناسبة ، وتكبير / تصغير لتركيز خلية واحدة ، وحدد الخلايا ذات الكثافة الفلورية العالية. أضف الخلايا واحدة تلو الأخرى ، بحد أقصى 6 خلايا.
ملاحظة: الحد من عدد الخلايا لمنع التأخير في الحصول على الصور وتجميد النوافذ أثناء التصوير. - اضبط الوقت وتردد التصوير للتصوير بفاصل زمني. ابدأ التصوير بفاصل زمني.
ملاحظة: تأكد من تحسين جميع المعلمات، بما في ذلك وقت التعريض الضوئي وطاقة الليزر، قبل بدء جلسة التصوير. - أوقف التصوير مؤقتا على فترات منتظمة ، وقم بإزالة الوسائط برفق من الطبق ذو القاع الزجاجي ، وأضف 1 مل من الوسط المكمل بتركيز الأنسولين المناسب.
- استئناف الحصول على الصورة. كرر الخطوة 6.20 حسب الحاجة.
- في نهاية التجربة، انقر فوق علامة التبويب إنهاء للإغلاق. قم بعمل نسخة احتياطية من الصور المكتسبة وتخزينها بشكل آمن لتحليلها.
7. تحليل البيانات
- قم بتصحيح بيانات تصوير FRET ذات الفاصل الزمني المعالجة مسبقا من عينات التحكم للحديث الطيفي والتألق الذاتي CFP ، مما ينتج عنه قيم FRET المصححة وكفاءة FRET الدقيقة. استخدم برنامج التصوير للحصول على صور FRET ومعالجتها وتحليلها ، باتباع البروتوكولات الموضحة في الدراسات السابقة27،28،29،30 (الشكل 9).
8. حسابات كفاءة FRET
- لتحديد كفاءة FRET ، احصل على سبع صور: الخلية (IDA (D) و IDD (D) و IDA (A) و IAA (A) و IDD و IAA و IDA). احسب كفاءة FRET باستخدام الصيغة التالية:
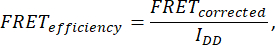
حيث يتم الحصولعلى FRET Corrected من المعادلة:

مع D و A معرف على النحو التالي:
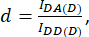
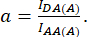
هنا أناDA و IDD و IAA تمثل صورا للخلايا المنقولة باستخدام المستشعر الحيوي. IDA(D) و IDD(D)) هي صور تحكم للمتبرعين فقط، وIDA(A) وIAA(A) هي صور تحكم للمتقبل فقط.
9. الحصول على الصور
- IDA : الحصول على الصورة عن طريق إثارة المتبرع (434 نانومتر) مع انبعاث المستقبل (530 نانومتر).
- IDD : الحصول على الصورة عن طريق إثارة المتبرع (434 نانومتر) مع انبعاث المتبرع (477 نانومتر).
- IAA : احصل على الصورة عن طريق إثارة المستقبل (517 نانومتر) مع انبعاث المستقبل (530 نانومتر).
- IDA (D) و IDA (A) : احصل على الصورة باستخدام نفس الإثارة والانبعاث مثل IDA ولكن من الخلايا التي تعبر عن المتبرع والمتلقي فقط ، على التوالي.
- IDD (D) : احصل على الصورة في ظل نفس الظروف مثل IDD للتحكم المخصص للمتبرع فقط.
- IAA(A) : احصل على الصورة باستخدام نفس شروط IAA ولكنها خاصة بعنصر تحكم المستقبل فقط.
10. تصحيح الخلفية
- افتح برنامج تحليل الصور على الكمبيوتر. من شريط القائمة العلوي ، قم بالوصول إلى قائمة ملف . حدد فتح أو فتح ملف من خيارات القائمة المنسدلة.
- انتقل إلى الدليل الذي يحتوي على بيانات صورة اللقطات المتتابعة. حدد موقع صورة اللقطات المتتابعة التي تتطلب تحليلا (على سبيل المثال ، تنسيق nd2).
- اختر الملف وانقر فوق فتح أو موافق لتحميله في البرنامج لعرضه وتحليله. حدد منطقة الاهتمام (ROI) داخل الخلية (أو استخدم الخلية بأكملها كعائد استثمار) وسجل القيمة الرمادية لكل بكسل داخل هذه المنطقة.
- اختر منطقة خالية من الخلايا كخلفية واحسب متوسط قيمتها الرمادية. قم بإنشاء الصورة المصححة عن طريق طرح متوسط الخلفية هذا من القيمة الرمادية لكل بكسل داخل عائد الاستثمار للخلية.
11. التخلص من نزيف FRET (الحديث المتبادل)
ملاحظة: تم تصوير التداخل الطيفي بين انبعاث المانح وإثارة المتقبل في الشكل 3 ب ، وهو أمر بالغ الأهمية لكفاءة FRET وعملية نقل الطاقة. يعد النزيف في تصوير FRET بفاصل زمني تحديا كبيرا ينشأ من التداخل الطيفي للفلوروفورات المانحة والمستقبلة ، مما يؤدي إلى قياسات غير دقيقة. الحديث المتبادل متأصل لأن أطياف كل من الفلوروفورات المانحة والمتقبلة تتداخل إلى حد ما (الشكل 3 ج ، د). تتفاقم هذه المشكلة بسبب عوامل مثل تركيزات الفلوروفور العالية وتكوينات المرشحات غير السليمة. تعد معالجة النزيف أمرا بالغ الأهمية لضمان موثوقية قياسات FRET.
- راجع دراسة سابقة للحصول على طريقة للتخفيف من آثار النزيف9.
12. القياس الكمي والتحليل الإحصائي
- إجراء التحليل الإحصائي باستخدام برنامج التحليل الإحصائي.
النتائج
للتحقيق في تنشيط Akt في خلايا HepG2 ، تم زرع الخلايا في أطباق تصوير مغلفة مسبقا وتم نقلها باستخدام المستشعر الحيوي القائم على FRET pEevee-iAkt-NES (الشكل 2 أ) ، المصمم لتمكين المراقبة في الوقت الفعلي لفسفرة Akt. بعد التعدي ، خضعت الخلايا لتجويع المصل لمدة 4 ساعات في وسط خا...
Discussion
يتضمن بروتوكول تصوير الخلايا الحية FRET لمراقبة فسفرة Akt في خلايا HepG2 عدة خطوات رئيسية لضمان نتائج موثوقة وقابلة للتكرار. الخطوة الحاسمة الأولى هي زراعة الخلايا ، والتي تشمل الصيانة الروتينية للخلايا ، وطلاء أطباق التصوير ، وبذر الخلايا. يعد الطلاء المناسب ضروريا لربط الخ...
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
تم دعم هذا العمل جزئيا من قبل مؤسسة العلوم الطبيعية في Shenzhen (JCYJ20240813113606009) ، ومنطقة التعاون بين Shenzhen و Hong Kong للتكنولوجيا والابتكار (HZQB-KCZYB-2020056) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (32070681) ، والبرنامج الوطني للبحث والتطوير الرئيسي في الصين (2019YFA0906002) ، وخطة Shenzhen Peacock (KQTD2016053117035204).
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | Cat#25200-056 | Use ice-cold PBS for cell wash |
| 15 mm glass bottom cell culture dish | NEST | Cat#801001 | |
| 2 mL Nalgene cryogenic vials | Thermo Scientific | Cat#5012-0020 | |
| 5 mL Stripette Serological Pipets | Corning | Cat#4487 | |
| 95% Ethanol | Kermel | Cat#C028005 | |
| A1 HD25/A1R HD25 confocal microscope | Nikon | https://www.nikon.com/ | Magnification: 40×, Numerical Aperture (NA): 1.30, Pixel Dwell Time: 2.4 ms, Pixel Size: 1024 |
| Ampicillin | Sigma-Aldrich | Cat#A9393 | |
| Bovine serum albumin (BSA) | VWR Life Science | Cat#N208-10g | |
| Corning 25 cm2 rectangular culture flasks | Corning | Cat#430639 | |
| Countess 3 automated cell counter | Thermo Scientific | http://www.thermofisher.com/#AMQAX2000 | |
| Countess cell counting chamber slides | Thermo Scientific | http://www.thermofisher.com/#C10228 | |
| Digital vortex mixers | Thermo Scientific | https://www.thermofisher.com/ | |
| Dimethyl sulfoxide | Sigma-Aldrich | Cat#D2650 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | Cat#022363204 | |
| EZ-PCR mycoplasma detection kit | Biological Industries | Cat# 20-700-20 | |
| Fetal Bovine Serum, qualified, Australia | Gibco | Cat#10099141 | |
| GlutaMAX Supplement | Gibco | Cat#35050061 | |
| GraphPad Prism 9 | GraphPad Software | https://www.graphpad.com/ | |
| HepG2 | National Collection of Authenticated Cell Cultures | #CSTR:19375.09.3101HUMSCSP510 http://www.cellbank.org.cn/ | |
| Immersion Oil Type 37 | Cargille Laboratories | Cat #16237 | |
| Insulin | Sigma-Aldrich | Cat#I5500-50MG | Warm to 37 °C before use |
| LB Broth (1x) | Invitrogen | Cat#10855001 | |
| Minimum Essential Medium (MEM) | Gibco | Cat#11095080 | Warm to 37 °C before use |
| mySPIN 12 mini centrifuge | Thermo Scientific | https://www.thermofisher.com/ | |
| NanoDrop One | Thermo Scientific | https://www.thermofisher.com | |
| Nikon Plan Fluor 40×/1.30 Oil Lens | Nikon | https://www.nikon.com/ | |
| NIS-Elements-AR | Nikon | https://www.nikon.com/ | |
| Non-Essential Amino Acids (NEAA) (100x) | Gibco | Cat#11140050 | |
| One Shot LB Agar Plates | Invitrogen | Cat#A55802 | |
| One Shot Stbl3 chemically competent E. coli | Invitrogen | Cat#C737303 | |
| Parafilm | PARAFILM | Cat#B8R05606 | |
| PBS (phosphate buffered saline) | Gibco | Cat#10010023 | |
| pEevee-iAkt-NES (7,033 bp) | Miura et al31 | https://benchling.com/s/seq-q46zFYCfl0swLAun0t28/edit | |
| Penicillin-streptomycin | Gibco | Cat#15070063 | |
| Plasmocin prophylactic | InvivoGen | Cat#ant-mpp | |
| Poly-L-Lysine Hydrobromide | Sigma-Aldrich | Cat#P4832 | |
| Precision general purpose baths | Thermo Scientific | https://www.thermofisher.com/ | |
| QIAprep spin miniprep kit | QIAGEN | Cat#27106 | |
| SnapGene | SnapGene by Dotmatics | https://www.snapgene.com | |
| Sodium Pyruvate (100 mM) | Gibco | Cat#11360070 | |
| Syringe filter unit, 0.22 μm | Millipore | Cat#SLGP033RS | |
| Tokai Hit stage top incubator | TOKAI HIT | https://www.tokaihit-livecell.com/stagetopincubator | |
| UltraPure DNase/RNase-free distilled water | Invitrogen | Cat#10977015 | |
| Xfect Transfection Reagent | Takara Bio | Cat#631317 |
References
- GBD 2021 Diabetes Collaborators. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 402 (10397), 203-234 (2023).
- Li, M., et al. Trends in insulin resistance: insights into mechanisms and therapeutic strategy. Signal Transduct Target Ther. 7 (1), 216 (2022).
- Poloz, Y., Stambolic, V. Obesity and cancer, a case for insulin signaling. Cell Death Dis. 6 (12), e2037 (2015).
- Arcidiacono, B., et al. Insulin resistance and cancer risk: an overview of the pathogenetic mechanisms. Exp Diabetes Res. 2012, 789174 (2012).
- Godsland, I. F. Insulin resistance and hyperinsulinaemia in the development and progression of cancer. Clin Sci (Lond). 118 (5), 315-332 (2009).
- Tsugane, S., Inoue, M. Insulin resistance and cancer: epidemiological evidence. Cancer Sci. 101 (5), 1073-1079 (2010).
- Yudhani, R. D., et al. In vitro insulin resistance model: A recent update. J Obes. 2023, 1964732 (2023).
- Akhtar, J., et al. Bistable insulin response: The win-win solution for glycemic control. iScience. 25 (12), 105561 (2022).
- Akhtar, J., Imran, M., Wang, G. Protocol for live-cell Forster resonance energy transfer imaging to reveal the bistable insulin response of single C2C12-derived myotubes. STAR Protoc. 5 (2), 103109 (2024).
- Kamino, K., et al. Optimal inference of molecular interaction dynamics in FRET microscopy. Proc Natl Acad Sci U S A. 120 (15), e2211807120 (2023).
- Kraft, A. E., Nikolaev, V. O. FRET microscopy for real-time visualization of second messengers in living cells. Methods Mol Biol. 1563, 85-90 (2017).
- Veeriah, S., et al. High-throughput time-resolved FRET reveals Akt/PKB activation as a poor prognostic marker in breast cancer. Cancer Res. 74 (18), 4983-4995 (2014).
- Conway, J. R. W., et al. Monitoring AKT activity and targeting in live tissue and disease contexts using a real-time Akt-FRET biosensor mouse. Sci Adv. 9 (17), eadf9063 (2023).
- Chandris, P., Giannouli, C. C., Panayotou, G. Imaging approaches for the study of metabolism in real time using genetically encoded reporters. Front Cell Dev Biol. 9, 725114 (2021).
- Yang, J., et al. Longitudinal FRET imaging of glucose and lactate dynamics and response to therapy in breast cancer cells. Mol Imaging Biol. 24 (1), 144-155 (2022).
- Mandrou, E., et al. A reliable system for quantitative G-protein activation imaging in cancer cells. Cells. 13 (13), 1114 (2024).
- Fang, C., Huang, Y., Zhao, Y. Review of FRET biosensing and its application in biomolecular detection. Am J Transl Res. 15 (2), 694-709 (2023).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Verveer, P. J., Rocks, O., Harpur, A. G., Bastiaens, P. I. Imaging protein interactions by FRET microscopy: FRET measurements by acceptor photobleaching. CSH Protoc. 2006 (6), (2006).
- Vu, C. Q., Arai, S. Quantitative imaging of genetically encoded fluorescence lifetime biosensors. Biosensors (Basel). 13 (10), 939 (2023).
- Wang, G. A more holistic view of the logarithmic dose-response curve offers greater insights into insulin response. J Biol Chem. 301 (1), 108037 (2025).
- Wang, G. Body mass dynamics is determined by the metabolic Ohm's law and adipocyte-autonomous fat mass homeostasis. iScience. 23 (6), 101176 (2020).
- Wang, G. Raison d'être of insulin resistance: the adjustable threshold hypothesis. J R Soc Interface. 11 (101), 20140892 (2014).
- Wang, G. Optimal homeostasis necessitates bistable control. J R Soc Interface. 9, 2723 (2012).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Broussard, J. A., Rappaz, B., Webb, D. J., Brown, C. M. Fluorescence resonance energy transfer microscopy as demonstrated by measuring the activation of the serine/threonine kinase Akt. Nat Protoc. 8 (2), 265-281 (2013).
- Gordon, G. W., Berry, G., Liang, X. H., Levine, B., Herman, B. Quantitative fluorescence resonance energy transfer measurements using fluorescence microscopy. Biophys J. 74 (5), 2702-2713 (1998).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophys J. 45 (5), 939-946 (1984).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy. , (2002).
- Miura, H., Matsuda, M., Aoki, K. Development of a FRET biosensor with high specificity for Akt. Cell Struct Funct. 39 (1), 9-20 (2014).
- Liberio, M. S., Sadowski, M. C., Soekmadji, C., Davis, R. A., Nelson, C. C. Differential effects of tissue culture coating substrates on prostate cancer cell adherence, morphology and behavior. PLoS One. 9 (11), e112122 (2014).
- Rani, K., Sengupta, S. Multi-stimuli programmable FRET based RGB absorbing antennae towards ratiometric temperature, pH and multiple metal ion sensing. Chem Sci. 12 (47), 15533-15542 (2021).
- Betolngar, D. B., et al. pH sensitivity of FRET reporters based on cyan and yellow fluorescent proteins. Anal Bioanal Chem. 407 (14), 4183-4193 (2015).
- Salonikidis, P. S., et al. An ion-insensitive cAMP biosensor for long term quantitative ratiometric fluorescence resonance energy transfer (FRET) measurements under variable physiological conditions. J Biol Chem. 286 (26), 23419-23431 (2011).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy using genetically engineered GFP derivatives on nickel chelating beads. Biotechnol Alia. 3, 1-18 (1997).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry A. 99 (4), 407-416 (2021).
- Batta, A., Hajdu, T., Nagy, P. Improved estimation of the ratio of detection efficiencies of excited acceptors and donors for FRET measurements. Cytometry A. 103 (7), 563-574 (2023).
- Coullomb, A., et al. QuanTI-FRET: a framework for quantitative FRET measurements in living cells. Sci Rep. 10 (1), 6504 (2020).
- Hoppe, A., Christensen, K., Swanson, J. A. Fluorescence resonance energy transfer-based stoichiometry in living cells. Biophys J. 83 (6), 3652-3664 (2002).
- Zal, T., Gascoigne, N. R. Photobleaching-corrected FRET efficiency imaging of live cells. Biophys J. 86 (6), 3923-3939 (2004).
- Hochreiter, B., Kunze, M., Moser, B., Schmid, J. A. Advanced FRET normalization allows quantitative analysis of protein interactions including stoichiometries and relative affinities in living cells. Sci Rep. 9 (1), 8233 (2019).
- Liu, H., Zhang, F., Mishra, S. K., Zhou, S., Zheng, J. Knowledge-guided fuzzy logic modeling to infer cellular signaling networks from proteomic data. Sci Rep. 6, 35652 (2016).
- Garrido-Rodriguez, M., Zirngibl, K., Ivanova, O., Lobentanzer, S., Saez-Rodriguez, J. Integrating knowledge and omics to decipher mechanisms via large-scale models of signaling networks. Mol Syst Biol. 18 (7), e11036 (2022).
- Greenwald, E. C., Polanowska-Grabowska, R. K., Saucerman, J. J. Integrating fluorescent biosensor data using computational models. Methods Mol Biol. 1071, 227-248 (2014).
- Zhao, Z., Xia, J. Computational Approaches for Modeling Signal Transduction Networks. Encyclopedia of Bioinformatics and Computational Biology. , (2019).
- Wang, G., Krueger, G. R. Computational analysis of mTOR signaling pathway: bifurcation, carcinogenesis, and drug discovery. Anticancer Res. 30 (7), 2683-2688 (2010).
- Wang, G. Singularity analysis of the AKT signaling pathway reveals connections between cancer and metabolic diseases. Phys Biol. 7 (4), 046015 (2010).
- Chedere, A., Hari, K., Kumar, S., Rangarajan, A., Jolly, M. K. Multi-stability and consequent phenotypic plasticity in AMPK-Akt double negative feedback loop in cancer cells. J Clin Med. 10 (3), 472 (2021).
- Mosca, E., et al. Computational modeling of the metabolic States regulated by the kinase akt. Front Physiol. 3, 418 (2012).
- Liao, J., Madahar, V., Dang, R., Jiang, L. Quantitative FRET (qFRET) technology for the determination of protein-protein interaction affinity in solution. Molecules. 26 (21), 6339 (2021).
- Verma, A. K., Noumani, A., Yadav, A. K., Solanki, P. R. FRET based biosensor: Principle applications recent advances and challenges. Diagnostics (Basel). 13 (8), 1375 (2023).
- Mattheisen, J. M., et al. Application of bioluminescence resonance energy transfer to quantitate cell-surface expression of membrane proteins. Anal Biochem. 684, 115361 (2024).
- Lionetti, M. C., La Porta, C. A. M. FLIM-FRET investigation of heterogeneous huntingtin aggregation in HeLa cells. Methods Mol Biol. 2551, 595-604 (2023).
- Petutschnig, E. K., Pierdzig, L., Mittendorf, J., Niebisch, J. M., Lipka, V. A novel fluorescent protein pair facilitates FLIM-FRET analysis of plant immune receptor interaction under native conditions. J Exp Bot. 75 (3), 746-759 (2024).
- Sprenger, J. U., Perera, R. K., Gotz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. J Vis Exp. 66, e4081 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved