Method Article
Farelerde Romatoid Artritin Evlat Edinen Bir Transfer Modeli
Bu Makalede
Özet
Burada, SKG farelerinden CD4 + T hücrelerinin evlat edinilmiş transferi yoluyla bir romatoid artrit (RA) fare modeli oluşturan, immünolojik mekanizmaları, patolojik ilerlemeyi ve RA için yeni tedavilerin geliştirilmesini araştırmak için hızlı ve güvenilir bir deneysel araç sağlayan bir protokol sunuyoruz.
Özet
Romatoid artrit (RA), eklem hasarı, deformiteler, sakatlık ve hatta ölümle sonuçlanabilen kronik, sistemik otoimmün inflamatuar bir hastalıktır. Karmaşık etiyolojisi ve heterojen klinik prezentasyonu nedeniyle, mevcut tedavi stratejileri hastalığın ilerlemesini etkin bir şekilde kontrol etmede, özellikle erken tanı sağlamada ve kişiselleştirilmiş tedaviler sağlamada yetersiz kalmaktadır. Bu nedenle, yeni terapötik yaklaşımların geliştirilmesi çok önemlidir. Bunu başarmak için, RA'nın patogenezini araştırmak için güvenilir hayvan modelleri gereklidir. Şu anda, kollajen kaynaklı artrit modeli (CIA), K / BxN modeli ve SKG faresi dahil olmak üzere çeşitli RA hayvan modelleri kullanılmaktadır. Bu modeller RA'nın immün mekanizmalarını ve klinik belirtilerini başarılı bir şekilde taklit edebilse de, her birinin dikkate değer sınırlamaları vardır.
Bu protokolde, SKG farelerinden CD4+ T hücrelerinin evlat edinici transferi yoluyla bir RA fare modeli oluşturma sürecini açıklıyoruz. Geleneksel modellerle karşılaştırıldığında, bu model C57BL/6 farelerde daha kısa bir kuruluş süresi ve daha yüksek bir insidans oranı (%100) sunar. Nispeten uygun maliyetlidir, basit prosedürler içerir ve T hücresi aracılı bağışıklık tepkilerini güvenilir bir şekilde çoğaltarak üstün deneysel kontrol ve tekrarlanabilirlik sağlar. Eklem semptomları gibi klinik fenotipi değerlendirerek modelin kapsamlı bir değerlendirmesini yaptık. Klinik fenotip değerlendirmesi ile belirgin eklem şişmesi ve inflamatuar yanıtlar gözlemledik. Ek olarak, anahtar transkripsiyon faktörlerinin ekspresyon seviyelerini ölçmek için PCR teknolojisini kullanarak, bu modelin T hücresi aracılı immün yanıtları ve RA'nın temel patolojik özelliklerini etkili bir şekilde simüle ettiğini bulduk. Bu model ile araştırmacılar, T hücresi aracılı bağışıklık tepkisini ve RA'nın temel patolojik özelliklerini daha iyi simüle edebilir, böylece bağışıklık mekanizmalarını ve patolojik ilerlemeyi incelemek ve RA için yeni tedaviler geliştirmek için güvenilir ve etkili bir deneysel araç sağlayabilir.
Giriş
RA, dünya popülasyonunun yaklaşık %1'ini etkileyen, yüksek morbidite ve ağır sosyoekonomik yüke neden olan kronik, sistemik otoimmün inflamatuar bir hastalıktır 1,2. Hastalık kalıcı sinovyal inflamasyon, kıkırdak yıkımı ve kemik erozyonu ile karakterizedir ve sonuçta eklem deformitelerine, sakatlıklara ve ciddi vakalarda erken ölüme yol açar 3,4,5. RA'nın patogenezi genetik, çevresel ve immün faktörlerin etkileşimini içerir ve hücresel bağışıklığın anormal aktivasyonu, proinflamatuar sitokinlerin aşırı salınımı ve immün toleransın bozulması gibi temel özellikler 6,7. Bu süreçte, otoreaktif T hücreleri, özellikle CD4 + T hücreleri, immün regülasyonun temel itici güçleri olarak, çoklu mekanizmalar yoluyla RA'nın patolojik ilerlemesini doğrudan teşvik eder.
T yardımcı hücre (Th)1 hücreleri, makrofajları ve sinovyal fibroblastları aktive eden interferon-gama (IFN-γ) üretir, bu da tümör nekroz faktörü (TNF)-α ve interlökin (IL)-6'nın salınmasına neden olur ve sinovite neden olur. Th17 hücreleri, sinovyal hücrelerin ve osteoklastların aktivasyonunu destekleyen, kıkırdak yıkımını ve kemik erozyonunu şiddetlendiren IL-17 salgılar 8,9. Ek olarak, CD4 + T hücreleri, anti-sitrüline protein antikorlarının (ACPA) ve romatoid faktörlerin (RF) üretimini indükleyerek, ko-stimülatör sinyaller yoluyla B hücrelerini aktive ederek inflamatuar yanıtları arttırır10. Bu arada, fonksiyondaki kusurlar ve Treg hücrelerinin sayısındaki azalma, RA'daki bağışıklık dengesizliğinin temel nedenleridir ve kontrolsüz inflamasyona yol açar11,12. Karmaşık etiyoloji ve heterojen klinik tablo nedeniyle erken tanı zordur ve RA'nın mevcut tedavisi tatmin edici değildir. Bu nedenle, yeni terapötik yaklaşımların geliştirilmesi çok önemlidir. Güvenilir hayvan modelleri, RA'nın potansiyel mekanizmalarını daha iyi anlamak ve yeni tedavi stratejilerini keşfetmek için RA'nın patogenezini araştırmak için kritik öneme sahiptir.
CIA ve K/BxN fare modelleri 13,14,15 gibi geleneksel RA modelleri, RA anlayışımızı geliştirmeye katkıda bulunur. Ancak, bu modeller önemli sınırlamalar göstermektedir. Örneğin, C57BL / 6 farelerindeki CIA modeli, düşük bir başarı oranına ve uzun indüksiyon süresine sahiptir, bu da belirli deneysel ortamlarda faydasını azaltır. Benzer şekilde, K/BxN modeli değerli olmasına rağmen, insan RA'sının karmaşık patolojisini, özellikle de bağışıklık hücreleri ve sitokinler arasındaki etkileşimleri oluşturmak maliyetlidir ve çoğaltmada sınırlamaları vardır.
Bu sınırlamaları ele almak için, C57BL / 6 arka planına sahip SKG farelerinden CD4 + T hücrelerini, mannan kaynaklı immün aktivasyon ile kombinasyon halinde immünokompetan C57BL / 6 farelerine aktararak yeni bir RA fare modeli geliştirdik. Bu model, T hücresi aracılı bağışıklık tepkileri ve sinovyal inflamasyon ve eklem erozyonu gibi temel patolojik özellikler dahil olmak üzere RA'nın temel özelliklerini etkili bir şekilde çoğaltırken, tekrarlanabilirlik, basitlik ve maliyet etkinliği açısından avantajlar sunar. Bu modeli oluşturmak için, C57BL / 6 arka planında SKG farelerinin üretilmesini, SKG farelerinden CD4 + T hücrelerinin izolasyonunu, evlat edinme transferlerini ve ardından mannan tarafından indüksiyonu içeren ayrıntılı bir metodolojinin ana hatlarını çizdik. Ek olarak, artritin şiddetini değerlendirmek, güvenilirliğini ve tekrarlanabilirliğini sağlamak için kullanılan klinik ve histolojik kriterleri açıklıyoruz. T hücresi aracılı immün yanıtları ve RA'nın temel patolojik özelliklerini tutarlı bir şekilde taklit eden bu model, immün mekanizmaları, hastalığın ilerlemesini ve RA için yeni tedavilerin geliştirilmesini araştırmak için sağlam ve verimli bir deneysel araç olarak hizmet eder.
Protokol
Bu çalışmadaki tüm deneysel prosedürler, hayvancılık, deneysel operasyonlar ve ötenazi dahil olmak üzere "Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Rehberi" tarafından belirlenen yönergeleri sıkı bir şekilde takip etti ve Tongji Tıp Koleji Hayvan Etik Komitesi tarafından onaylandı.
1. Hayvanlar
- SKG farelerinin nesli (C57BL/6 arka plan)
- Gen düzenleme stratejisi
- ZAP70 genini (gRNA dizisi: 5'-CAGCCCACGAGCGAATGCCCTGG-3') hedefleyen özel bir kılavuz RNA (gRNA) tasarlayın ve CRISPR/Cas9 sistemi ile gen düzenlemesi yapın. Mutasyonun kesin olarak dahil edilmesini sağlamak için ZAP70 (W163C) mutasyonuna sahip bir donör DNA'sı tasarlayın (burada, CAGGCCCCACAGGTGGAGAAGCTCATTG
CTACCACAGCCCACGAGCGAATGCCCTG
CTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCA).
NOT: gRNA, hassas kesim için Cas9 proteinini ZAP70 geninin spesifik bölgesine yönlendirir. Donör DNA dizisindeki altı çizili baz, mutasyona uğramış bazları gösterir. Bu mutasyon, kritik bir fonksiyonel alanda bulunan ZAP70 proteinindeki W163C mutasyonuna (TGG→TGC) karşılık gelir.
- ZAP70 genini (gRNA dizisi: 5'-CAGCCCACGAGCGAATGCCCTGG-3') hedefleyen özel bir kılavuz RNA (gRNA) tasarlayın ve CRISPR/Cas9 sistemi ile gen düzenlemesi yapın. Mutasyonun kesin olarak dahil edilmesini sağlamak için ZAP70 (W163C) mutasyonuna sahip bir donör DNA'sı tasarlayın (burada, CAGGCCCCACAGGTGGAGAAGCTCATTG
- Mikroşırınga enjeksiyonu
- Cas9 mRNA, gRNA ve donör DNA'sını döllenmiş C57BL/6 fare yumurtalarına sokmak için mikroenjeksiyon kullanın. Cas9 proteini ve gRNA'yı birlikte enjekte edin, böylece ZAP70 genini parçalarlar ve homolog rekombinasyon yoluyla ZAP70 (W163C) mutasyonunu eklerler. Enjekte edilen döllenmiş yumurtaları yalancı gebe dişi farelere nakledin, yaklaşık 20 gün bekleyin ve doğan fareleri F0 nesli olarak belirleyin. PCR amplifikasyonu ve dizileme yoluyla genotipleri tanımlayın (bkz. adım 1.1.5.3).
- F0 nesli farelerin genotiplendirilmesi
- ZAP70 (W163C) mutasyonunun edinimini doğrulamak için F0 nesil farelerde PCR ve dizileme yapın (bkz. adım 1.1.5.3).
NOT: F0 nesil fareler, hızlı embriyonik bölünme nedeniyle kimeriktir. Stabil genetik aktarımdan yoksun olabilirler. İstikrarlı hatlar oluşturmak için seri ıslah uygulayın.
- ZAP70 (W163C) mutasyonunun edinimini doğrulamak için F0 nesil farelerde PCR ve dizileme yapın (bkz. adım 1.1.5.3).
- F1 nesil farelerin edinimi ve genotipik tanımlanması
- F1 nesil fareler elde etmek için F0 pozitif fareleri vahşi tip C57BL/6J farelerle çiftleştirin ve SKG fareleri elde etmek için PCR ve dizileme yoluyla genotipleme yapın (C57BL/6 arka planı; bkz. adım 1.1.5.4).
- F0 ve F1 kuşakları için PCR tabanlı genotipleme yöntemleri
- Steril makasla kuyruktan 0,5 cm'lik bir parça çıkarın.
- Bir hayvan genomik DNA ekstraksiyon kiti kullanarak fare DNA'sını çıkarın.
- F0 için aşağıdaki PCR reaksiyon sistemini hazırlayın: 13.2 μL ddH2O, 2 μL PCR tamponu, 2 μL 2.5 mM dNTP, ileri (5'-GATGCCTAGGTGGGGGGTTCC-3') ve geri (5'-ACTTGCCTACGCTACTGCTACTGCTACA-3') primerlerin her birinden 0.5 μL, 0.8 μL DNA polimeraz ve fare kuyruklarından ekstrakte edilen 1 μL genomik DNA (50-100 ng/μL), 20 μL'lik bir son reaksiyon hacmi için. Aşağıdaki PCR programını kullanarak gen amplifikasyonu gerçekleştirin: 3 dakika boyunca 94 °C; 15 saniye boyunca 98 °C, 15 saniye boyunca 58 °C ve 1 dakika boyunca 68 °C, 35 döngü için; esnasında 68 °C 5 dakika; 12 °C'de tutun.
- F1 için aşağıdaki PCR reaksiyon sistemini hazırlayın: 14.9 μL ddH2O, 2 μL 10x Taq PCR tamponu, 1 μL 2.5 mM dNTP, 0.5 μL ileri (5'-GATGCCTAGGTGGGGGGTTCC-3') ve geri (5'-ACTTGCCTACGCTACTGCTCTACA-3') primerleri (10 pmol/μL), 0.1 μL Taq DNA polimeraz ve fare kuyruklarından ekstrakte edilen 1 μL genomik DNA (50-100 ng/μL), 20 μL'lik bir son reaksiyon hacmi için. Aşağıdaki PCR programını kullanarak gen amplifikasyonu gerçekleştirin: 5 dakika boyunca 94 °C; 30 sn boyunca 94 °C, 30 sn için 58 °C, 1 dakika boyunca 72 °C, 35 döngü boyunca tekrarlanır; 5 dakika boyunca 72 °C; 12 °C'de tutun.
- Beklenen boyuttaki ürünleri doğrulamak için elektroforez çalıştırın.
- Hem genotipi hem de spesifik mutasyonu doğrulamak için PCR ürünlerini sıralayın.
- Gen düzenleme stratejisi
- Donör ve alıcı farelerin seçimi
- Donör fareler olarak 6-8 haftalık (erkek veya dişi) SKG farelerini seçin.
- Alıcı fareler olarak 6-8 haftalık (tutarlı deneysel sonuçlar için tercihen dişi) C57BL / 6 fareleri seçin.
- Ev C57BL / 6 ve SKG fareleri (6-8 haftalık) SPF koşulları altında ayrı ayrı havalandırılan kafeslerde. 12 saatlik aydınlık/karanlık döngüsünde SPF sınıfı yemlere ve steril suya ücretsiz erişim sağlayın. Deneylere başlamadan önce fareleri 1 hafta boyunca alıştırın.
2. SKG farelerinden CD4 + T hücrelerinin izolasyonu ve saflaştırılması
- SKG farelerini CO2 boğulması kullanarak steril bir laminer akış başlığı altında ötenazi yapın. Fareleri dezenfekte etmek için 5 dakika boyunca% 75 alkole batırın. Karın boşluğundaki dalağın yanı sıra kasık ve popliteal bölgelerdeki lenf düğümlerini (kasık ve popliteal) bulun. Steril forseps ve makas kullanarak dalak ve lenf düğümlerini dikkatlice inceleyin ve hemen önceden soğutulmuş PBS'ye aktarın.
- Dalak ve lenf düğümlerini ayrı Petri kaplarına yerleştirin. Steril bir şırınganın pistonunu kullanarak dokuları 70 μm'lik bir hücre süzgecinden geçirin ve düzgün bir hücre süspansiyonu oluşturmak için kademeli olarak 10-12 mL önceden soğutulmuş PBS ekleyin. Hücre süspansiyonunu aynı 70 μm hücre süzgecinden 15 mL'lik bir santrifüj tüpüne geçirin, ardından 4 ° C'de 7 dakika boyunca 300 × g'da santrifüjleyin. Süpernatanı atın ve hücre peletini koruyun.
- Hücre canlılığını değerlendirmek için tripan mavisi boyama yapın. Hücreleri sayın ve canlılığın %≥90 olduğunu onaylayın.
- CD4 + T hücre izolasyon kitinde sağlanan tampon ile hücre konsantrasyonunu 1 ×10 8 hücre / mL'ye ayarlayın.
- 100 μL hücre süspansiyonunu (10,7 hücre) yeni bir tüpe aktarın. 10 μL Biotin-Antikor-Kokteyli ekleyin, iyice karıştırın ve 15 dakika buz üzerinde inkübe edin.
- Boncukları maksimum hızda girdaplayarak yeniden askıya alın. 10 μL Streptavidin boncuk süspansiyonu ekleyin, iyice karıştırın ve 15 dakika buz üzerinde inkübe edin.
- CD4 + T hücre izolasyon kitinde sağlanan tamponun 2,5 mL'sini ekleyin ve tüpü 5 dakika boyunca mıknatısın içine yerleştirin.
- Sıvıyı (hedef hücreler) tüpten dikkatlice yeni bir steril tüpe dökün, ardından 4 °C, 300 × g'da 5 dakika santrifüjleyin. Süpernatanı atın ve hücre peletini koruyun.
- Hücre konsantrasyonunu 2 × 106 hücre / mL'ye ayarlamak için yeterli miktarda steril PBS çözeltisi ekleyin ve süspansiyonu daha sonra kullanmak üzere buz üzerinde tutun.
- Sıralanan hücrelerin saflığını değerlendirmek için akış sitometrisi kullanın (Ek Şekil S1). Hücre saflığını şu şekilde hesaplayın: (CD4 + T hücrelerinin sayısı / Toplam hücre sayısı) ×% 100. Saflığın %≥9016 olduğunu onaylayın.
3. CD4 + T hücrelerinin evlat edinici transferi
- C57BL / 6 fareleri% 2 -% 3 izofluran ile uyuşturun, farelerin tüm hareketliliğini kaybettiği ancak normal spontan solunumu koruduğu bir anestezi derinliğine ulaşın.
- Farenin iç kantusunu (gözün köşesi) steril bir pamuklu çubukla nazikçe temizleyin ve salgıları ve tüyleri çıkarın ve damarı açığa çıkarın.
- Fareyi elle hareketsiz hale getirin. 1 mL'lik bir şırıngaya 200 μL CD4 + T hücre süspansiyonu (fare başına 2 ×10 5-5 × 105 hücre) çekin. İğneyi 10-15°'lik bir açıyla iç kantal damara sokun ve doğru yerleştirmeyi sağlayın. Hücre süspansiyonunu 10-15 saniye boyunca yavaş ve eşit bir şekilde enjekte edin.
- İğneyi çektikten sonra, kanamayı önlemek için iç kantal bölgesine steril bir pamuklu çubukla 3-5 saniye boyunca hafifçe bastırın.
- Fareyi, bilinci tamamen geri kazanana, sabit nefes alana ve anormal davranışlar (seğirme veya ani ölüm gibi) olmadan izlemek için sessiz, kuru ve temiz bir kafese yerleştirin. Ameliyat sonrası stabil durumu onayladıktan sonra fareyi standart bir muhafaza kafesine taşıyın.
NOT: İç kantal ven küçük olduğundan, aşırı hızın neden olduğu damar yırtılmasını veya hücre tıkanmasını önlemek için nazik kullanım ve kontrollü infüzyon hızı çok önemlidir. - İnfüzyon ayrıntılarını kaydedin ve sonraki deneylerde karışıklığı önlemek için model ve kontrol grubu farelerini (grup başına dört hayvan) etiketleyin. Fareleri modellemek için CD4 + T hücrelerini uygulayın ve kontrol farelerini tedavi edilmeden bırakın. Tüm farelerin alıcı fare olduğundan emin olun.
4. Mannanın uyarılması ve indüksiyonu
- 4. günde mannan indüksiyonu yapın (CD4 + T hücresi infüzyonundan 72 saat sonra). Aynı indüksiyon koşullarını tüm deney ve kontrol farelerine uygulayın.
- Mannan tozunu tartın ve steril PBS'de 100 mg / mL'lik bir konsantrasyona çözün.
- Karnını ortaya çıkarmak için fareyi doğru tutun. Cildi% 75 alkol ile dezenfekte edin ve enjeksiyon bölgesini belirleyin (karın orta hattının yanına ~ 1 cm).
- Mannan çözeltisini iyice karıştırın ve uygun hacmi (fare başına 20-30 mg) 1 mL'lik bir şırıngaya çekin. İğneyi periton boşluğuna 45°'lik bir açıyla yerleştirin ve eşit dağılımı sağlamak için solüsyonu yavaşça enjekte edin. Sızıntıyı veya enfeksiyonu önlemek için iğneyi yavaşça çekin ve enjeksiyon bölgesine steril bir pamuklu çubukla birkaç saniye hafifçe bastırın.
- Enjekte edilen fareyi sessiz ve temiz bir kafese yerleştirin ve enjeksiyon bölgesinde sızıntı, karın şişkinliği veya anormal solunum olmadığından emin olmak için 5-10 dakika yakından izleyin.
- Her fare için enjeksiyon ayrıntılarını ayrıntılı olarak kaydedin.
5. Ölçümler
- Klinik fenotipin gözlenmesi
- Artrit semptom puanlaması
- Mannan indüksiyonundan sonra her 3 günde bir ortak değerlendirmeler yapın. Diz, ayak bileği, bilek ve parmak/ayak parmağı eklemlerine özellikle dikkat ederek ön ve arka ayaklardaki tüm eklemleri inceleyin. Standart kriterleri kullanarak artrit şiddetini puanlayın (Tablo 1)17. Artritin ilerlemesini değerlendirmek için her bir zaman noktasındaki toplam puanları kaydedin ve karşılaştırın.
- Artrit semptom puanlaması
- Doku patolojik özelliklerinin kaydedilmesi
- Bir aylık mannan indüksiyonundan sonra, fareleri CO2 asfiksiasyonu kullanarak (etik kurul yönergelerine izleyerek) steril bir laminer akış başlığı altında ötenazi yapın, fareyi bir köpük tahta üzerine sabitleyin ve arka bacakları açığa çıkarın. Ayak bileğinden başlayarak cildi kesin ve kasları ve eklemleri ortaya çıkarmak için yukarı doğru soyun. Ayak bileği eklemini (tibia/fibula ve talus arasında) ve metatarsofalangeal eklemleri (metatarsallar ve proksimal falankslar arasında) tanımlayın ve bu eklemleri histolojik analiz için inceleyin ve parafin kesitleri hazırlayın.
- Eksize edilen dokuları 72 saat boyunca% 4 formalin içinde sabitleyin, daha sonra tam dekalsifikasyonu sağlamak için 4 haftalık dekalsifikasyon için% 10 etilendiamintetraasetik aside (EDTA, pH 7.4) aktarın.
- Dekalsifikasyondan sonra, kalan fiksatifleri çıkarmak için dokuları PBS ile yıkayın ve ardından dokuları kademeli bir etanol serisinden (% 75,% 80,% 95,% 100) dehidre edin.
NOT: Formalin gözleri, cildi ve solunum yollarını tahriş edebilir. Çeker ocakta ele alınmalıdır. - Bir parafin gömme makinesi kullanarak dokuyu parafine gömün. Gömülü dokuyu 4 μm kalınlığında dilimler halinde bölmek için bir mikrotom kullanın. Bölümleri damıtılmış su içeren 40 °C'lik bir su banyosunda yüzdürün.
- Bölümleri aktarın ve kurutun. Bölümleri cam slaytların üzerine yerleştirin. Gece boyunca oda sıcaklığında (RT) kurutun. Slaytları boyama için RT'de saklayın.
- Hematoksilen ve Eozin (H & E) boyama
- Parafini çıkarmak için slaytları 60 °C fırında 2 saat pişirin.
- Oda sıcaklığında, slaytları her biri 5 dakika boyunca aşağıdaki sırayla daldırın: ksilen → ksilen → %100 etanol → %100 etanol → %95 etanol → %80 etanol → %75 etanol. Damıtılmış suda 2 dakika durulayın.
- Slaytları hematoksilen çözeltisi içinde sırayla 5 dakika boyayın, deiyonize suda 2 dakika durulayın, daha sonra 1 dakika boyunca% 0.1 amonyak ile muamele edin, deiyonize suda 3 x 2 dakika durulayın, 1 dakika eozin ile boyayın ve son olarak 2 dakika deiyonize suda durulayın.
- Slaytları 5 dakika boyunca %80 etanol → %95 etanol → %100 etanol → ksilen → ksilen içine daldırın.
- Slaytları doğal olarak havayla kurutun ve nötr reçine ile monte edin.
- Safranin O-Fast Yeşil boyama
- Parafin bölümlerini sulamak için deparafinize edin ve bir Van Gieson'ın leke kitini kullanarak lekeleyin. Boyamadan sonra slaytları nötr reçine ile monte edin ve mikroskop altında görüntü yakalayın (adım 5.2.5'te hazırlanmıştır).
- T hücrelerinde ve sitokinlerde değişiklikler
- Steril cerrahi aletler kullanarak dalağı fareden çıkarın.
- Üreticinin talimatlarına göre bir RNA ekstraksiyon kiti kullanarak dalak dokusundan toplam RNA'yı çıkarın. Bir spektrofotometre kullanarak RNA konsantrasyonunu ve saflığını ölçün ve A260/A280 oranının 1.8 ile 2.0 arasında olduğundan emin olun.
- Bir ters transkripsiyon kiti kullanarak ekstrakte edilen RNA'dan cDNA'yı sentezleyin. Reaksiyon kurulumu ve döngü koşulları için üreticinin protokolünü izleyin. Sonraki qPCR analizi için cDNA'yı -20 °C'de saklayın.
- qPCR gerçekleştirin: Dalak dokusundaki Tbx21, Gata3, Il-17 ve Foxp3'ün nispi mRNA ekspresyon seviyelerini ölçün, aşağıdakileri içeren 10 μL'lik reaksiyonlarda SYBR Green bazlı qPCR kullanılarak ölçüldü: 5 μL 2x SYBR Green ana karışımı, 0.2 μL ileri ve geri primerlerin her biri (10 μM; Tablo 2'deki diziler), 0.5-1 μL cDNA (50-100 ng/μL), ve hacimce nükleaz içermeyen su. Aşağıdaki termal döngü koşullarını kullanın: 30 saniye boyunca 95 °C'de ilk denatürasyon, ardından erime eğrisi analizi (65-95 °C) ile 10 saniye boyunca 95 °C'lik 40 döngü ve 30 saniye boyunca 60 °C. 2(-ΔΔCt) yöntemini kullanarak ifade seviyelerini Gapdh olarak normalleştirin.
- Serum izolasyonu ve sitometrik boncuk dizisi (CBA) analizi
- Enükleasyon yöntemi ile orbital kan alımını kullanarak fareden kan alın, kanı antikoagülan kaplı bir toplama tüpüne aktarın ve 30 dakika oda sıcaklığında bekletin. Pıhtılaşmış kanı 4 °C'de, 1.000 × g'da 15 dakika santrifüj edin, süpernatanı (serum) dikkatlice toplayın ve analize kadar -80 °C'de saklayın.
- Üreticinin talimatlarına göre bir CBA kiti kullanarak serumdaki IL-6, IL-10, IL-17, TNF-α ve IFN-γ ekspresyon seviyelerini belirleyin.
- Steril cerrahi aletler kullanarak dalağı fareden çıkarın.
Sonuçlar
Farelerde eklem şişmesi ve insidans oranının klinik skorlaması
Şekil 1, model farelerde eklem şişmesinin klinik skorlamasını ve insidans oranını göstermektedir. Sonuçlar, model grubundaki tüm farelerin hastalığı geliştirdiğini (n = 4) ve insidans oranının %100 olduğunu göstermektedir. Model grubundaki puanlar önemli ölçüde arttı, ikinci haftada kısa bir rahatlama gösterdi ve daha sonra 6 haftalık bir süre boyunca yükseldi.
Farelerde eklem şişmesi tezahürü
Model grubu farelerin eklemleri, ön ayaklarda ve arka ayaklarda da gözle görülür şişlik ve kalınlaşma ile birlikte önemli ölçüde kalınlaşma ve şişlik gösterir (Şekil 2).
Fare ayak bileği eklemlerinin patolojik sonuçları
Patolojik sonuçlar, kontrol grubu ile karşılaştırıldığında, model grup farelerin ayak bileği eklemlerinde sinovyumda belirgin kalınlaşma, kemikte süreksizlik ve inflamatuar hücrelerin belirgin agregasyonunu gösterdiğini göstermektedir (Şekil 3, Şekil 4 ve Şekil 5).
Serum T hücresi ile ilişkili inflamatuar faktörler
Kontrol grubu ile karşılaştırıldığında, model grup fareleri serum IL-10 (7.51'e karşı 2.15 pg / mL), TNF (78.83'e karşı 13.11 pg / mL), IL-17 (101.6'ya karşı 12.64 pg / mL) ve IFN-γ (5.15'e karşı 1.90 pg / mL) (p < 0.05). IL-6 ayrıca kontrol grubuna göre anlamlı olarak artmıştır (15.59'a karşı 6.27 pg/mL) (p = 0.05, Şekil 6).
Dalakta T hücresi alt kümeleri Th1/2/17 ve Tregs değişiklikleri
Dalaktaki T hücresi alt kümelerindeki değişiklikleri değerlendirmek için Tbx21 (Th1), Gata3 (Th2), Il-17 (Th17) ve Foxp3'ün (Tregs) mRNA ekspresyon seviyeleri ölçüldü. Bu genler, ilgili T hücresi alt kümelerinin farklılaşmasını ve işlevini tanımlayan anahtar transkripsiyon faktörlerini ve sitokinleri kodlar. Kontrol grubu ile karşılaştırıldığında, model grup fareleri, referans geni Gapdh'ye göre dalakta Tbx21 (1.68'e karşı 0.61) ve Il-17'nin (26.30'a karşı 0.75) mRNA ekspresyonu < önemli ölçüde artmış mRNA ekspresyonu gösterdi.
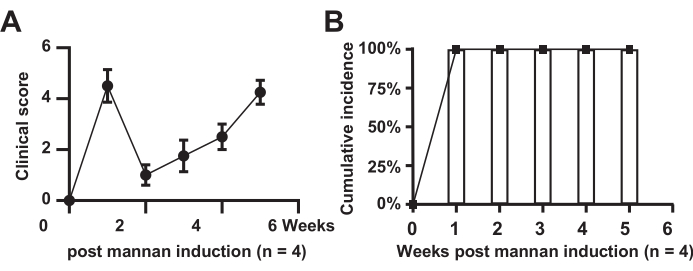
Şekil 1: Eklem şişmesinin klinik skorlaması. (A) Model grubu fareler; (B) Model grubu farelerde kümülatif insidans. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kontrol ve model farelerde eklem şişmesi belirtileri (n = 4). (A-C) Farelerin kontrol ve model gruplarında pençe ve eklem şişme skorlarının (0,2,4) temsili görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Hematoksilen-eozin boyaması ile gözlenen kontrol ve model grubu farelerin ayak bileği eklemlerinde histolojik değişiklikler. (A) Fare ayak bileği eklemini kontrol edin; (B) Model grubu fare ayak bileği ekleminin kemiğinde süreksizlik; (C) Model grubu fare ayak bileği ekleminde sinovyal proliferasyon. Ölçek çubukları = 50 μm (ilk sütun), 100 μm (ikinci ve üçüncü sütunlar). Şekil 3B ve 3C'deki görüntüler aynı fareden alınmıştır ve farklı patolojik fenotipleri göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
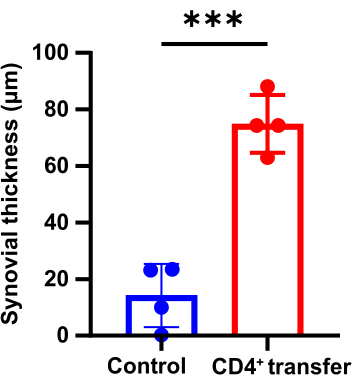
Şekil 4: Kontrol grubu ve model grubu fareler arasındaki ayak bileği eklemlerinin sinovyal kalınlığındaki farklılıklar (p < 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
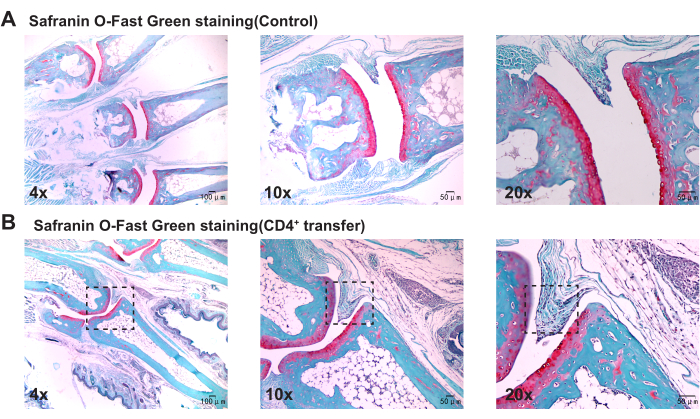
Şekil 5: Safranin O-Fast Green boyaması ile gözlenen kontrol ve model grubu farelerin ayak bileği eklemlerinde histolojik değişiklikler. (A) Kontrol grubu faresinin ayak bileği eklemi; (B) Model grup farenin ayak bileği ekleminde sinovyal proliferasyon. Ölçek çubukları = 50 μm (ilk sütun), 100 μm (ikinci ve üçüncü sütunlar). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
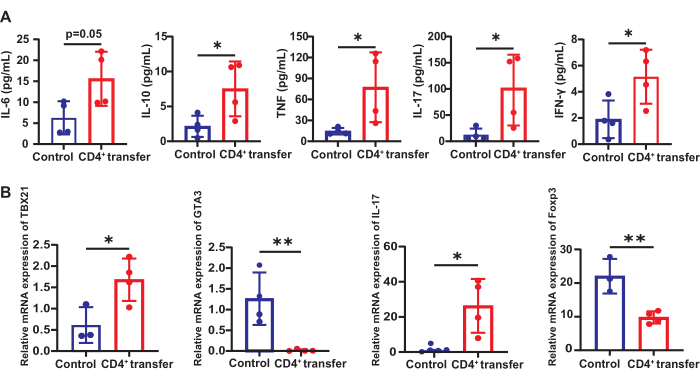
Şekil 6: Kontrol ve model grubu farelerde T hücresi ile ilişkili inflamatuar faktörler ve alt gruplardaki değişiklikler. (A) Kontrol ve model grubu farelerin serumunda T hücresi ile ilişkili enflamatuar faktörlerin ekspresyonu ve (B) dalakta Th1 / 2/17 ve Tregs T hücresi alt kümelerindeki değişiklikler. *p < 0.05, **p < 0.01. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Puan | Şişlik (aralık 0-4) | Eritem (Aralık 0-2) |
| 0 | Hiç kimse | Hiç kimse |
| 1 | Herhangi bir rakam | önemsiz |
| 2 | Pençe | Uç |
| 3 | El bileği/ayak bileği | |
| 4 | Tüm uzuv |
Tablo 1: Artrit skorlama kriterleri. Artriti puanlamak için, her bir uzuv şişlik ve eriteme göre puanlanır ve her bir uzuv için 0-6 arasında bir puan atanır. Dört uzuvun tümü için puanlar, her fare için toplam artrit puanını oluşturmak için toplanır.
| Astar dizileri | |
| Oligo Adı | Sıra 5' ila 3' |
| Tbx21-İleri | AGCAAGGAGCGAATGTT |
| Tbx21-Ters | GGGTGGACATATAAGCGGTTC |
| Gata3-Forvet | CTCGGCCATTCGTACATGGAA |
| Gata3-Ters | GGATACCTCTGCACCGTAGC |
| Il-17A-İleri | TTTAACTCCCTTGGCGCAAAA |
| Il-17A-Ters | CTTTCCCTCCGCATTGACAC |
| Foxp3-İleri | CCCTTGACCTCAAAACAAG |
| Foxp3-Ters | GTGTGACTGCATGACTAACTTTGA |
| Gapdh-İleri | GGTTGTCTCCTGCGACTTCA |
| Gapdh-Ters | TGGTCCAGGGTTTCTTACTCC |
Tablo 2: Primer sıra listesi.
Ek Şekil S1: Akış sitometrisi ile CD4+ T hücresi sıralaması için geçit stratejisi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
RA gelişimi, sinovyal dokudaki anormal bağışıklık hücresi infiltrasyonu ile yakından ilişkilidir, burada bu bağışıklık hücrelerinin düzensiz aktivasyonu, çeşitli pro-inflamatuar sitokinlerin salınmasına yol açar ve bu da sinovyal ve eklem yapılarının hasarına daha fazla katkıda bulunur18,19. CIA modeli, K/BxN modeli ve SKG fareleri 13,20,21 dahil olmak üzere çeşitli RA hayvan modelleri geniş çapta değerlendirilmiştir. Bu modeller RA'nın bağışıklık mekanizmalarını ve klinik belirtilerini başarılı bir şekilde çoğaltırken, hepsinin önemli sınırlamaları vardır. Örneğin, C57BL / 6 farelerindeki CIA modeli daha düşük bir başarı oranına, daha uzun bir başlangıç süresine sahiptir ve çevresel ve deneysel koşullardan önemli ölçüde etkilenir, bu da onu belirli deneysel ortamlarda daha az pratik hale getirir. SKG fareleri, T hücresi reseptörü (TCR) sinyalinde ani bir anomaliye neden olan ve otoimmün artritiindükleyen bir ZAP-70 gen mutasyonuna dayanan bir RA fare modelini temsil eder 22. Bununla birlikte, bu model pahalıdır ve deneysel sonuçların tekrarlanabilirliği, indüksiyon koşullarından kolayca etkilenir. K/BxN, T ve B hücrelerinin işbirlikçi aktivitesi tarafından tetiklenen ve belirgin bir bağışıklık tepkisi sergileyen kalıtsal bir artrit modelidir23. Yine de, bu modeli oluşturmak maliyetlidir ve özgüllüğü sınırlıdır, bu da insan RA'sının çok yönlü patolojik sürecini tamamen yakalayamayan sınırlı bir bağışıklık tepkisine yol açar. Bu nedenle, RA'nın temel patolojik özelliklerini kopyalayabilen, çeşitli deneysel gereksinimleri karşılayabilen ve yüksek tekrarlanabilirlik sağlayabilen bir hayvan modeli geliştirmek büyük önem taşımaktadır.
Bu çalışmada, SKG farelerinden adaptif CD4 + T hücrelerinin evlat edinici transferi yoluyla bir RA modeli oluşturmak için bir yöntem sunuyoruz. Bu modelin yapısı, C57/BL6 arka planına sahip SKG farelerinden CD4+ T hücrelerinin seçilmesine ve modelin başarısını sağlayan bir süreç olan mannanın indüksiyonuna dayanır. BALB/c arka planındaki SKG farelerinin, anormal TCR sinyal seçimine neden olan ve yüksek oranda kendi kendine reaktif T hücrelerine yol açan spontan bir ZAP70 gen mutasyonu (W163C) taşıdığı yaygın olarak bilinmektedir24. Bu, aşırı T hücresi aktivasyonu ve sinovit başlangıcı ve eklem yıkımı ile sonuçlanır, böylece RA'nın sinovyal onarım ve bağışıklık hücresi aktivasyonu gibi temel patolojik süreçlerini taklit eder25,26. SKG farelerinin klinik özellikleri, insan RA hastalarınınkine çok benzer.
Bu mutasyonu C57BL/6 arka planına dahil etmek için, ZAP70 (W163C) mutasyonunu taşıyan bir C57BL/6 arka planlı SKG fare modelini başarıyla oluşturmak için CRISPR/Cas9 teknolojisini kullandık. CRISPR/Cas9, geleneksel rastgele indüksiyon yöntemleriyle ilişkili düşük hedef dışı yerleştirme veya istenmeyen genetik modifikasyon oranını korurken, istenen mutasyonun hedeflenen şekilde tanıtılmasını sağlayan yüksek hassasiyet ve verimlilik sunar, böylece modelin kararlılığını ve benzersizliğini sağlar27,28. Daha da önemlisi, bu teknik aynı zamanda model yapımı için gereken süreyi önemli ölçüde azaltarak model geliştirmenin hem kontrol edilebilirliğini hem de verimliliğini artırır. Bu modeli kullanarak, T hücresi aracılı sinoviti ve RA'nın eklem yıkımını bir C57BL / 6 arka planına karşı hassas bir şekilde çoğaltabiliriz. Geleneksel SKG farelerindeki BALB/C arka planı ile karşılaştırıldığında, C57BL/6 arka planındaki model fareler immünolojik araştırmalarda daha geniş uygulanabilirliğe sahiptir ve diğer transgenik modellerle (örneğin, Rag1-/- veya IL17-/-) daha kolay birleştirilebilir. Bu, onları RA'da ve sistemik lupus, eritematozus veya multipl skleroz gibi diğer otoimmün hastalıklarda ZAP70 mutasyonunun rolünü araştırmak için uygun hale getirir.
CD4+ T hücrelerinin29,30 numaralı RA aktivasyonundaki önemli rolüne dayanarak, onları anahtar mediyatörler olarak seçtik. T hücreleri, RA'daki immün yanıtların birincil itici güçleridir ve IL-6, IL-17 ve TNF-α 32,33 gibi inflamatuar faktörlere bağlı olarak Th1/Th17 efektör alt kümelerini31 aktive ederek doğrudan sinovyal hasarı indükleyebilir. İmmün regülasyonun önemli mediatörleri olarak, CD4 + T hücreleri pro-inflamatuar sitokinler salgılar, inflamatuar kaskadı tetikler ve korur, bu da sinovyal proliferasyona ve eklem hasarına yol açar, böylece RA'nın patolojik ilerlemesini doğrudan teşvik eder. Spesifik antikorların (örneğin, ACPA) üretiminde B hücrelerine yardımcı olmada etkilidirler34. Bu arada, RA sinovyumunun tipik histopatolojik özelliği, CD4 + T hücrelerinin agregasyonudur. Bazı sınıf II majör histokompatibilite kompleksi (MHC) genleri, özellikle İnsan Lökosit Antijeni-DR izotipi (HLA-DR) ile ilişkili "paylaşılan epitoplar", RA35'in patogenezi ile yakından ilişkili olarak kabul edilir. Ayrıca, sitotoksik T-lenfosit ile ilişkili antijen 4 (CTLA4)-Ig ile T hücresi ko-stimülasyonunu bloke etme stratejisi, RA36'da önemli klinik etkinlik göstermiştir. Ek olarak, mannan indüksiyonu, dendritik hücreler ve makrofajlar gibi doğuştan gelen bağışıklık bileşenlerinin aktivasyonunu teşvik ederek model için güçlü bir aktivatör görevi görür37. Bu adım, CD4 + T hücresi aktivasyonunu ve bağışıklık tepkilerini daha da kolaylaştırır, bağışıklık sisteminin kendi dokularına saldırısını önemli ölçüde arttırır, böylece RA'da bağışıklık düzensizliği ve sinovyal hasarın patolojik özelliklerini simüle eder.
Model indüksiyonunu tamamladıktan sonra, eklem şişmesinin klinik skorlaması, patolojik doğrulama (sinovit doku patolojisi ve eklem yıkımının özelliklerini gözlemleme) ve immünolojik doğrulama (serum ve dalakta Th1/2/17 ve Treg hücrelerinin ekspresyonu) dahil olmak üzere çoklu parametreler kullanarak model grubunun sistematik bir doğrulamasını gerçekleştirdik. Sonuçlar, modelimizin RA'da T hücre aracılı sinovit ve eklem yıkımını başarılı bir şekilde replike ettiğini, RA'nın ana patofizyolojik mekanizmalarıyla tutarlı karakteristik immün aktivasyon ve sinovyal patolojik değişiklikleri indüklediğini ve %100 prevalans oranı ile olduğunu gösterdi. Modelimizde, farelerin klinik şişmiş eklem skorunun 1 haftada zirve yapması, ikinci haftada belirgin bir azalma göstermesi ve daha sonraki aşamalarda kademeli olarak tekrar yükselmesi dikkat çekicidir, bu da geleneksel artrit hayvan modellerinde gözlenen tipik hastalık seyri ile tamamen uyumlu değildir38. Bunun nedeni, indüksiyondan 1 hafta sonra, model farelerdeki bağışıklık sisteminin, mannan enjeksiyonu ile yoğun bir şekilde aktive edilmiş bir başlangıç fazında olması ve eklem iltihabının zirvesine neden olması olabilir. İkinci haftada, bağışıklık regülasyonu ve kendini iyileştirme mekanizmaları, klinik semptomların geçici olarak hafiflemesine yol açar. Hastalık ilerledikçe, bağışıklık toleransı yavaş yavaş azalır ve bağışıklık tepkisi yeniden yoğunlaşır, bu da daha sonraki aşamalarda durumun kademeli olarak kötüleşmesiyle kendini gösterir.
Bu model diğer modellere kıyasla nispeten basit olsa da, modelleme sürecinde ele alınması gereken birkaç önemli nokta vardır. İlk olarak, SKG farelerinden elde edilen CD4 + T hücrelerinin aktivitesi ve saflığı, modelin başarısının temelini oluşturur. Deneysel sonuçların tutarlılığını ve güvenilirliğini sağlamak için hücrelerin saflığı% 90'ı aşmalıdır. İkincisi, damar yırtılmasının çok hızlı enjekte edilmesini veya hücre sızıntısının çok yavaş enjekte edilmesini önlemek için medial kantal ven içine enjeksiyon hızı dikkatli bir şekilde kontrol edilmelidir. Ayrıca, hücre dozu seçimi kritiktir. Çok düşük bir doz model başarısızlığına yol açabilirken, çok yüksek bir doz spesifik olmayan enflamatuar yanıtları tetikleyebilir. Bu nedenle, modelleme süreci sırasında, farelerin genel durumu yakından izlenmeli ve deneyin sorunsuz ilerlemesini ve verilerin bilimsel geçerliliğini sağlamak için herhangi bir anormal semptom derhal kaydedilmelidir.
Geleneksel modellerle karşılaştırıldığında, bu model daha kısa bir kuruluş süresine sahiptir, C57BL / 6 farelerinde daha yüksek bir insidans oranına ulaşır ve nispeten uygun maliyetli ve kullanımı kolaydır. Otoreaktif CD4 + T hücrelerinin transferini benimsemek, T hücresi aracılı bağışıklık tepkilerini doğru bir şekilde yeniden üretir ve eklem şişmesi ve hasarı gibi RA'nın temel patolojik özelliklerini yakalar. Ayrıca, klinik belirtileri, RA'nın klinik ve patolojik süreçlerinin daha otantik bir yansımasını sunan, insan RA'nınkilerle iyi uyum sağlar. Ayrıca, medial kantal ven infüzyonu ve mannan indüksiyonunun kombinasyonu, modelin kontrol edilebilirliğini ve deneysel stabilitesini daha da geliştirerek onu yüksek oranda tekrarlanabilir hale getirir ve mükemmel deneysel kontrol sunar. Tabii ki, bu modelin hala sınırlamaları var. Esas olarak T hücresi güdümlü bağışıklık tepkilerine odaklanır; B hücresi aracılı antikor yanıtlarının ve diğer immün hücrelerin (doğal öldürücü (NK) hücreler ve Treg hücreleri gibi) işbirlikçi rollerinin simülasyonu yetersizdir, bu da RA'nın çok hücreli patolojik mekanizmalarını tam olarak temsil etmeyi zorlaştırır. Bununla birlikte, bu RA fare modeli, araştırmacılara T hücresi aracılı bağışıklık tepkilerini ve RA'nın ana patolojik özelliklerini simüle etmek için daha iyi bir platform sağlayan istikrarlı ve güvenilir bir hayvan modeli olmaya devam etmektedir. Bu model, araştırmacıların RA'nın bağışıklık mekanizmalarını ve patolojik ilerlemesini derinlemesine araştırmalarına olanak tanıyarak, özellikle T hücresi güdümlü bağışıklık düzensizliğini anlamada ve terapötik hedefleri belirlemede yeni tedavilerin geliştirilmesi için önemli deneysel kanıtlar ve araçlar sağlar.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82270903, 82401588 ve 81974254) ve Çin Doktora Sonrası Bilim Vakfı (2024M751019) tarafından sağlanan hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
Referanslar
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır