Method Article
マウスにおける関節リウマチの養子移植モデル
要約
ここでは、SKGマウスからのCD4+ T細胞の養子移植により関節リウマチ(RA)マウスモデルを確立するプロトコルを報告し、免疫学的メカニズム、病理学的進行、およびRAの新しい治療法の開発を調査するための迅速で信頼性の高い実験ツールを提供します。
要約
関節リウマチ(RA)は、関節の損傷、変形、障害、さらには死に至る可能性のある慢性の全身性自己免疫性炎症性疾患です。その複雑な病因と不均一な臨床症状のために、現在の治療戦略は、特に早期診断の達成と個別化治療の提供において、疾患の進行を効果的に制御するには不十分なままです。したがって、新しい治療法の開発は非常に重要です。そのためには、RAの病因を調査するために信頼性の高い動物モデルが不可欠です。現在、関節リウマチの動物モデルには、コラーゲン誘発性関節炎モデル(CIA)、K/BxNモデル、SKGマウスなど、いくつかのモデルが用いられています。これらのモデルは、RAの免疫メカニズムと臨床症状をうまく模倣できますが、それぞれに顕著な制限があります。
このプロトコルでは、SKGマウスからのCD4+ T細胞の養子導入を通じてRAマウスモデルを確立するプロセスについて説明します。従来モデルと比較して、このモデルはC57BL/6マウスの確立時間が短く、発生率が高い(100%)。比較的費用対効果が高く、簡単な手順で済み、T細胞を介した免疫応答を確実に再現するため、優れた実験制御と再現性が保証されます。モデルの包括的な評価を行い、関節症状などの臨床表現型を評価しました。臨床表現型評価を通じて、顕著な関節の腫脹と炎症反応が観察されました。さらに、PCR技術を用いて主要な転写因子の発現量を測定した結果、このモデルはT細胞が関与する免疫応答とRAの主要な病理学的特徴を効果的にシミュレートすることを発見しました。このモデルにより、研究者はT細胞が媒介する免疫応答とRAの主要な病理学的特徴をより適切にシミュレートできるため、免疫メカニズムと病理学的進行を研究し、RAの新規治療法を開発するための信頼性が高く効果的な実験ツールが提供されます。
概要
RAは、世界人口の約1%が罹患する慢性の全身性自己免疫性炎症性疾患であり、高い罹患率と重い社会経済的負担を引き起こします1,2。この疾患は、持続的な滑膜の炎症、軟骨の破壊、および骨の侵食を特徴とし、最終的には関節の変形、障害、そして重症の場合は早死ににつながります3,4,5。RAの病因には、細胞性免疫の異常な活性化、炎症誘発性サイトカインの過剰放出、免疫寛容の崩壊などの主要な特徴を持つ、遺伝的、環境的、および免疫因子の相互作用が含まれます6,7。このプロセスでは、自己反応性T細胞、特にCD4+ T細胞が免疫調節の主要なドライバーとして、複数のメカニズムを通じてRAの病理学的進行を直接促進します。
ヘルパーT細胞(Th)1細胞は、マクロファージと滑膜線維芽細胞を活性化するインターフェロンガンマ(IFN-γ)を産生し、腫瘍壊死因子(TNF)-αとインターロイキン(IL)-6を放出し、滑膜炎を引き起こします。Th17細胞はIL-17を分泌し、滑膜細胞と破骨細胞の活性化を促進し、軟骨の破壊と骨の侵食を悪化させます8,9。さらに、CD4+ T細胞は、共刺激シグナルを介してB細胞を活性化することにより炎症反応を増幅し、抗シトルリン化タンパク質抗体(ACPA)およびリウマチ因子(RF)の産生を誘導します10。一方、機能の欠陥とTreg細胞数の減少は、RAの免疫不均衡の主な理由であり、制御不能な炎症を引き起こします11,12。複雑な病因と不均一な臨床症状のため、早期診断は困難であり、現在のRAの治療は不十分です。したがって、新しい治療法の開発は非常に重要です。信頼性の高い動物モデルは、RAの病因を調査し、RAの潜在的なメカニズムをより深く理解し、新しい治療戦略を探求するために重要です。
CIAやK/BxNマウスモデル13、14、15などの従来のRAモデルは、RAの理解を深めるのに貢献しています。ただし、これらのモデルには大きな制限があります。例えば、C57BL/6マウスのCIAモデルは成功率が低く、誘導期間が長いため、特定の実験環境での有用性が低下します。同様に、K/BxNモデルは価値がありますが、ヒトRAの複雑な病理、特に免疫細胞とサイトカイン間の相互作用を再現するには費用がかかり、限界があります。
これらの制限に対処するために、C57BL/6バックグラウンドを持つSKGマウスのCD4+ T細胞を免疫担当C57BL/6マウスに移し、マンナン誘導免疫活性化と組み合わせて、新しいRAマウスモデルを開発しました。このモデルは、T細胞を介した免疫応答や滑膜炎や関節びらんなどの重要な病理学的特性など、RAの主要な特徴を効果的に再現すると同時に、再現性、簡便性、費用対効果の面で利点を提供します。C57BL/6バックグラウンドでのSKGマウスの作製、SKGマウスからのCD4+ T細胞の単離、それらの養子移植、およびその後のマンナンによる誘導を含む、このモデルを確立するための詳細な方法論を概説しました。さらに、関節炎の重症度を評価するために使用される臨床的および組織学的基準について説明し、その信頼性と再現性を確保します。このモデルは、T細胞を介した免疫応答とRAの基本的な病理学的特徴を一貫して模倣することにより、免疫メカニズム、疾患の進行、およびRAの新しい治療法の開発を調査するための堅牢で効率的な実験ツールとして機能します。
プロトコル
この研究のすべての実験手順は、畜産、実験操作、安楽死など、「実験動物の世話と使用に関する国立衛生研究所ガイド」に定められたガイドラインに厳密に従い、華中科技大学同済医科大学の動物倫理委員会によって承認されました。
1. 動物たち
- SKGマウスの作製(C57BL/6バックグラウンド)
- 遺伝子編集戦略
- ZAP70遺伝子(gRNA配列:5'-CAGCCCACGAGCGAATGCCCTGG-3')を標的とする特異的なガイドRNA(gRNA)を設計し、CRISPR/Cas9システムで遺伝子編集を行います。ZAP70(W163C)変異を持つドナーDNAを設計して、突然変異の正確なincorporatio-nを確保します(ここでは、CAGGCCCCACAGGTGGAGAAGCTCATTG
CTACCACAGCCCACGAGCGAATGCCCTGの
CTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCA)。
注:gRNAは、Cas9タンパク質を ZAP70 遺伝子の特定の部位に誘導し、正確な切断を行います。ドナーDNA配列の下線が引かれた 塩基は、変異した塩基を示しています。この変異は、重要な機能ドメインに位置するZAP70タンパク質のW163C変異(TGG→TGC)に対応しています。
- ZAP70遺伝子(gRNA配列:5'-CAGCCCACGAGCGAATGCCCTGG-3')を標的とする特異的なガイドRNA(gRNA)を設計し、CRISPR/Cas9システムで遺伝子編集を行います。ZAP70(W163C)変異を持つドナーDNAを設計して、突然変異の正確なincorporatio-nを確保します(ここでは、CAGGCCCCACAGGTGGAGAAGCTCATTG
- マイクロシリンジ注射
- マイクロインジェクションを使用して、Cas9 mRNA、gRNA、およびドナーDNAを受精したC57BL/6マウス卵に導入します。Cas9タンパク質とgRNAを同時注入して、 ZAP70遺伝子を切断し、相同組換えを介して ZAP70(W163C)変異を挿入します。注射した受精卵を偽妊娠した雌マウスに移植し、約20日待ってから、生まれたマウスをF0世代と命名します。PCR増幅とシーケンシングにより遺伝子型を同定します(ステップ1.1.5.3を参照)。
- F0世代マウスのジェノタイピング
- F0世代のマウスでPCRとシーケンシングを行い、 ZAP70 (W163C)変異の獲得を確認します(ステップ1.1.5.3を参照)。
注:F0世代のマウスは、急速な胚の切断によりキメラです。彼らは安定した遺伝的伝達を欠いているかもしれません。逐次育種を実施し、安定した系統を確立する。
- F0世代のマウスでPCRとシーケンシングを行い、 ZAP70 (W163C)変異の獲得を確認します(ステップ1.1.5.3を参照)。
- F1世代マウスの獲得と遺伝子型同定
- F0陽性マウスを野生型C57BL/6Jマウスと交配してF1世代マウスを取得し、PCRおよびシーケンシングによるジェノタイピングを行ってSKGマウスを取得します(C57BL/6バックグラウンド;ステップ1.1.5.4を参照)。
- F0およびF1世代のためのPCRベースのジェノタイピング法
- 滅菌ハサミで尾から0.5cmのピースを切除します。
- 動物ゲノムDNA抽出キットを用いてマウスDNAを抽出します。
- F0については、以下のPCR反応系を調製します:13.2 μLのddH2O、2 μLのPCRバッファー、2 μLの2.5 mM dNTP、フォワード(5'-GATGCCTAGGTGGGGGGTTCC-3')およびリバース(5'-ACTTGCCTACGCTACTGCTCTACA-3')の各プライマー(10 pmol/μL)、0.8 μLのDNAポリメラーゼ、およびマウステールから抽出したゲノムDNA(50-100 ng/μL)のそれぞれ0.5 μLを調製します。 以下のPCRプログラムを用いて遺伝子増幅を行いましょう:94°Cで3分間;98 °C で 15 秒、58 °C で 15 秒、68 °C で 1 分間、35 サイクル。68°Cで5分間;12°Cで保持します。
- F1については、以下のPCR反応系を調製します:14.9 μLのddH2O、2 μLの10x Taq PCRバッファー、1 μLの2.5 mM dNTP、フォワード(5'-GATGCCTAGGTGGGGGGTTCC-3')およびリバース(5'-ACTTGCCTACGCTACTGCTCTACA-3')の各プライマー(10 pmol/μL)、0.1 μLのTaq DNAポリメラーゼ、およびマウステールから抽出したゲノムDNA(50-100 ng/μL)のそれぞれ0.5 μLを調製します。 最終反応量が20 μLの場合、以下のPCRプログラムを用いて遺伝子増幅を行う:94°Cで5分間;94°Cで30秒、58°Cで30秒、72°Cで1分間、35サイクル繰り返します。72°Cで5分間;12°Cで保持します。
- 電気泳動を実行して、予想されるサイズの製品を確認します。
- PCR産物のシーケンシングを行い、遺伝子型と特異的変異の両方を確認します。
- 遺伝子編集戦略
- ドナーマウスとレシピエントマウスの選択
- 生後6-8週齢(雄または雌)のSKGマウスをドナーマウスとして選択してください。
- レシピエントマウスとして、6〜8週齢のC57BL/6マウス(一貫した実験結果を得るためには雌が望ましい)を選択します。
- ハウスC57BL/6およびSKGマウス(6-8週齢)を、個別に換気されたケージでSPF条件下で投与。SPFグレードの飼料と滅菌水への無料アクセスを12時間の明暗サイクルで提供します。実験を開始する前に、マウスを1週間順応させます。
2. SKGマウスからのCD4+ T細胞の単離と精製
- SKGマウスを無菌の層流フードの下でCO2 窒息を使用して安楽死させます。マウスを75%アルコールに5分間浸して消毒します。腹腔内の脾臓と、鼠径部と膝窩部のリンパ節(鼠径部と膝窩部)を特定します。滅菌鉗子とハサミを使用して脾臓とリンパ節を慎重に解剖し、すぐに予冷したPBSに移します。
- 脾臓とリンパ節を別々のペトリ皿に入れます。滅菌シリンジのプランジャーを使用して70μmの細胞ストレーナーに組織を押し込み、10〜12mLの予冷PBSを徐々に加えて均一な細胞懸濁液を形成します。細胞懸濁液を同じ70 μmの細胞ストレーナーに通して15 mLの遠心チューブに入れ、300 × g で4°Cで7分間遠心分離します。 上清を捨て、細胞ペレットを保持します。
- トリパンブルー染色を行い、細胞の生存率を評価します。細胞を数え、生存率が≥90%であることを確認します。
- CD4+ T細胞単離キットに付属のバッファーを使用して、細胞濃度を1 × 108細胞/mLに調整します。
- 100 μLの細胞懸濁液(107 細胞)を新しいチューブに移します。10 μLのビオチン-抗体-カクテルを加え、よく混ぜて、氷上で15分間インキュベートします。
- 最大速度でボルテックスすることにより、ビーズを再懸濁します。ストレプトアビジンビーズ懸濁液10 μLを加え、よく混合し、氷上で15分間インキュベートします。
- CD4+ T細胞単離キットに付属のバッファー2.5 mLを加え、チューブを磁石に5分間置きます。
- チューブから液体(標的細胞)を新しい滅菌チューブに慎重に注ぎ、4°C、300× g で5分間遠心分離します。上清を捨て、細胞ペレットを保持します。
- 細胞濃度を2 × 106 細胞/mLに調整するために十分な量の滅菌PBS溶液を加え、懸濁液を後で使用するために氷上に保ちます。
- フローサイトメトリーを使用して、選別した細胞の純度を評価します(補足図S1)。細胞純度を次のように計算します:(CD4+ T細胞の数/総細胞数)×100%。純度が≥90%16であることを確認してください。
3. CD4+ T細胞の養子移植
- C57BL/6 マウスに 2%-3% イソフルランを麻酔し、マウスがすべての可動性を失うが正常な自発呼吸を保持する麻酔の深さに達します。
- 滅菌綿棒でマウスの内側の眼角(目の角)をやさしくきれいにして、分泌物と髪の毛を取り除き、静脈を露出させます。
- マウスを手で固定します。200 μLのCD4+ T細胞懸濁液(マウスあたり2 × 105-5 × 105 細胞)を1 mLシリンジに引き込みます。針を10〜15°の角度で内側の眼窩静脈に挿入し、正確な配置を確保します。細胞懸濁液を10〜15秒かけてゆっくりと均一に注入します。
- 針を抜いた後、出血を防ぐために、滅菌綿棒で眼の内側を3〜5秒間静かに押します。
- マウスを完全に意識を取り戻すまで、マウスを静かで乾燥した清潔なケージに入れて監視し、呼吸が安定し、異常な行動(けいれんや突然死など)がなくなります。術後の状態が安定していることを確認した後、マウスを標準的なハウジングケージに移します。
注:内側の眼窩静脈は小さいため、過度の速度による静脈の破裂や細胞の閉塞を避けるためには、穏やかな取り扱いと制御された注入速度が重要です。 - 注入の詳細を記録し、モデル群マウスと対照群マウス(グループあたり4匹)にラベルを付けて、その後の実験での混乱を防ぎます。CD4+ T細胞をモデルマウスに投与し、コントロールマウスを未処理のままにします。すべてのマウスがレシピエントマウスであることを確認してください。
4. マンナンの刺激と誘導
- 4日目(CD4 + T細胞注入の72時間後)にマンナン誘導を行います。すべての実験マウスと対照マウスに同じ導入条件を適用します。
- マンナン粉末を秤量し、滅菌PBSに100 mg / mLの濃度で溶解します。
- マウスを正しく保持して腹部を露出させます。75%アルコールで皮膚を消毒し、注射部位を特定します(腹部の正中線の側面に~1cm)。
- マンナン溶液を完全に混合し、適切な量(マウスあたり20〜30 mg)を1 mLシリンジに引き込みます。.針を腹腔に45°の角度で挿入し、溶液をゆっくりと注入して均一に分布させます。針をゆっくりと引き抜き、滅菌綿棒で注射部位を数秒間優しく押して、漏れや感染を防ぎます。
- 注射したマウスを静かで清潔なケージに入れ、注射部位の漏れ、腹部膨満、または異常な呼吸がないことを確認するために5〜10分間注意深く監視します。
- 各マウスのインジェクション詳細を詳細に記録します。
5. 測定
- 臨床表現型の観察
- 関節炎の症状スコアリング
- マンナン導入後3日ごとに共同評価を実施します。前肢と後肢のすべての関節を検査し、膝、足首、手首、指/つま先の関節に特に注意を払います。標準的な基準を使用して関節炎の重症度を採点します (表 1)17。関節炎の進行を評価するために、各時点での合計スコアを記録して比較します。
- 関節炎の症状スコアリング
- 組織の病理学的特徴の記録
- マンナン導入の1か月後、CO2 窒息を使用して滅菌層流フードの下でマウスを安楽死させ(倫理委員会のガイドラインに従います)、マウスを発泡スチロールボードに固定し、後肢を露出させます。足首から皮膚を切開し、上に向かって剥がして筋肉と関節を露出させます。足首関節(脛骨/腓骨と距骨の間)と中足指節関節(中足骨と近位指骨の間)を特定し、組織学的分析のためにこれらの関節を解剖し、パラフィン切片を準備します。
- 切除した組織を4%ホルマリンで72時間固定し、次にそれらを10%エチレンジアミン四酢酸(EDTA、pH 7.4)に移し、4週間の脱灰を行い、完全な脱灰を確実にします。
- 脱灰後、PBSで組織を洗浄して残留固定剤を取り除き、次に等級付けされたエタノールシリーズ(75%、80%、95%、100%)で組織を脱水します。
注:ホルマリンは、目、皮膚、気道を刺激する可能性があります。ヒュームフードで取り扱ってください。 - パラフィン包埋機を使用して、組織をパラフィンに埋め込みます。ミクロトームを使用して、埋め込まれた組織を厚さ4 μmのスライスに切片化します。蒸留水を含む40°Cのウォーターバスに切片を浮かせます。
- 切片を移し替えて乾燥させます。セクションをスライドガラスの上に置きます。室温(RT)で一晩乾燥させます。スライドをRTで保存して染色してください。
- ヘマトキシリンおよびエオシン(H&E)染色
- スライドを60°Cのオーブンに2時間入れて、パラフィンを取り除きます。
- キシレン→キシレン→100%エタノール → 100%エタノール → 95%エタノール → 80%エタノール → 75%エタノール。蒸留水で2分間すすぎます。
- スライドをヘマトキシリン溶液で5分間順次染色し、脱イオン水で2分間すすぎ、次いで0.1%アンモニアで1分間処理し、脱イオン水で3×2分間すすぎ、エオシンで1分間染色し、最後に脱イオン水で2分間すすぎます。
- スライドを80%エタノール→95%エタノール→100%エタノール→キシレン→キシレンにそれぞれ5分間浸します。
- スライドを自然乾燥させ、中性樹脂でマウントします。
- サフラニンO-Fastグリーン染色
- パラフィン切片を脱パラフィンして水に戻し、Van Giesonの染色キットを使用して染色します。染色後、スライドを中性樹脂でマウントし、顕微鏡で画像を撮影します(ステップ5.2.5で調製)。
- T細胞とサイトカインの変化
- 滅菌手術器具を使用してマウスから脾臓を取り出します。
- 製造元の指示に従って、RNA抽出キットを使用して脾臓組織から全RNAを抽出します。分光光度計を使用してRNAの濃度と純度を定量し、A260/A280の比率が1.8から2.0の間であることを確認します。
- 抽出したRNAから逆転写キットを用いてcDNAを合成します。反応のセットアップとサイクリング条件については、メーカーのプロトコルに従ってください。cDNAを-20°Cで保存し、その後のqPCR分析に使用します。
- qPCRの実施:脾臓組織におけるTbx21、Gata3、Il-17、およびFoxp3の相対mRNA発現レベルを、10 μLの反応でSYBR GreenベースのqPCRを使用して測定しました:5 μLの2x SYBR Greenマスターミックス、0.2 μLのフォワードプライマーとリバースプライマー(10 μM;表2の配列)、0.5-1 μL cDNA(50-100 ng /μL)、 ヌクレアーゼフリーの水は体積に。次の熱サイクル条件を使用します:最初の変性を95°Cで30秒間、続いて95°Cで10秒間、60°Cで30秒間の40サイクルを行い、溶融曲線分析(65-95°C)を行います。2(-ΔΔCt) 法を使用して、式レベルを Gapdh に正規化します。
- 血清単離およびサイトメトリービーズアレイ(CBA)解析
- 眼窩採血法による眼窩採血法を用いてマウスから採血し、抗凝固剤を塗布した採取チューブに血液を移し、室温で30分間静置します。凝固した血液を4°C、1,000× g で15分間遠心分離し、上清(血清)を慎重に回収し、分析まで-80°Cで保存します。
- 製造元の指示に従って、CBAキットを使用して血清中のIL-6、IL-10、IL-17、TNF-α、およびIFN-γの発現レベルを決定します。
- 滅菌手術器具を使用してマウスから脾臓を取り出します。
結果
マウスにおける関節腫脹と発生率の臨床スコアリング
図1は、モデルマウスにおける関節腫脹の臨床スコアリングと発生率を示しています。その結果、モデル群のマウス全員が発症し(n = 4)、発生率は100%であった。モデル群のスコアは有意に増加し、2週目には短期間の緩和を示し、その後6週間にわたって上昇した。
マウスにおける関節腫脹の発現
モデル群マウスの関節は顕著な肥厚と腫脹を示し、前肢と後肢にも顕著な腫脹と肥厚が観察されます(図2)。
マウス足首関節の病理学的結果
病理学的結果から、モデル群マウスは対照群と比較して、足首関節の滑膜の有意な肥厚、骨の不連続性、および炎症細胞の顕著な凝集を示すことが示されています(図3、 図4、 および図5)。
血清T細胞関連炎症因子
対照群と比較して、モデル群マウスは、IL-10(7.51対2.15pg/mL)、TNF(78.83対13.11pg/mL)、IL-17(101.6対12.64pg/mL)、およびIFN-γ(5.15対1.90pg/mL)(p < 0.05)の血清レベルに有意な増加を示しました。IL-6も対照群と比較して有意に増加しました(15.59対6.27pg/mL)(p = 0.05、 図6)。
脾臓のT細胞サブセットTh1/2/17および制御性Tの変化
脾臓のT細胞サブセットの変化を評価するために、Tbx21(Th1)、Gata3(Th2)、Il-17(Th17)、およびFoxp3(Tregs)のmRNA発現レベルを測定しました。これらの遺伝子は、それぞれのT細胞サブセットの分化と機能を定義する主要な転写因子とサイトカインをコードしています。対照群と比較して、モデル群マウスは、参照遺伝子Gapdhと比較して、脾臓(p < 0.05)におけるTbx21(1.68対0.61)およびIl-17(26.30対0.75)のmRNA発現が有意に増加したことを示しました。
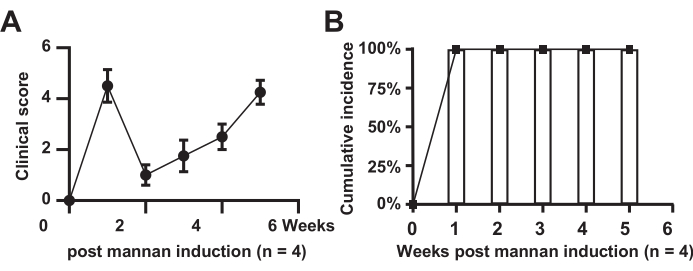
図1:関節腫脹の臨床スコアリング。 (A)モデル群マウス;(B)モデル群マウスの累積発生率。 この図の拡大版を表示するには、ここをクリックしてください。

図2:対照マウスとモデルマウス(n = 4)の関節腫脹症状 。 (A-C)マウスの対照群とモデル群における足と関節の腫脹スコア(0,2,4)の代表的な画像。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ヘマトキシリン-エオシン染色で観察された対照群マウスおよびモデル群マウスの足首関節の組織学的変化。(B)モデルグループマウス足首関節の骨の不連続性。(C)モデルグループマウス足首関節における滑膜増殖。スケールバー = 50 μm(1 列目)、100 μm(2 列目と 3 列目)。図3Bと図3Cの画像は同じマウスからのものであり、異なる病理学的表現型を示しています。この図の拡大版を表示するには、ここをクリックしてください。
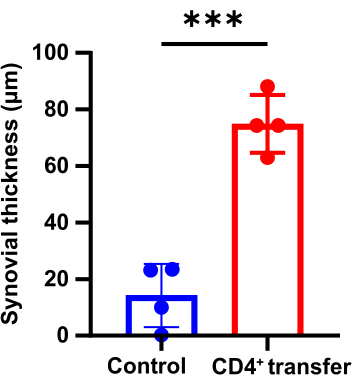
図4:対照群マウスとモデル群マウスの足首関節の滑膜厚さの違い(p < 0.05)。 この図の拡大版を表示するには、ここをクリックしてください。
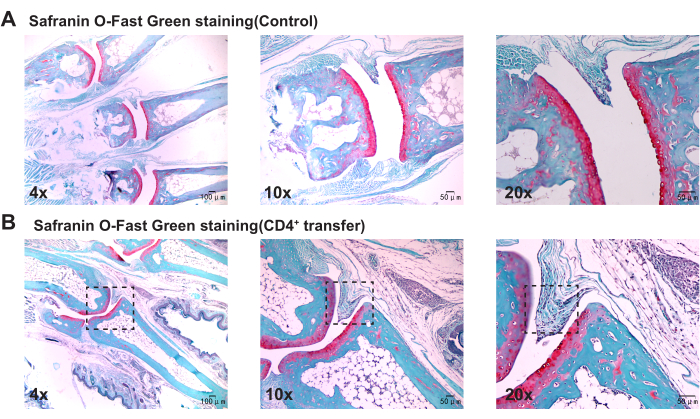
図5:サフラニンO-Fastグリーン染色で観察された対照群マウスおよびモデル群マウスの足首関節の組織学的変化。(B)モデル群マウスの足首関節における滑膜増殖。スケールバー = 50 μm(1 列目)、100 μm(2 列目と 3 列目)。この図の拡大版を表示するには、ここをクリックしてください。
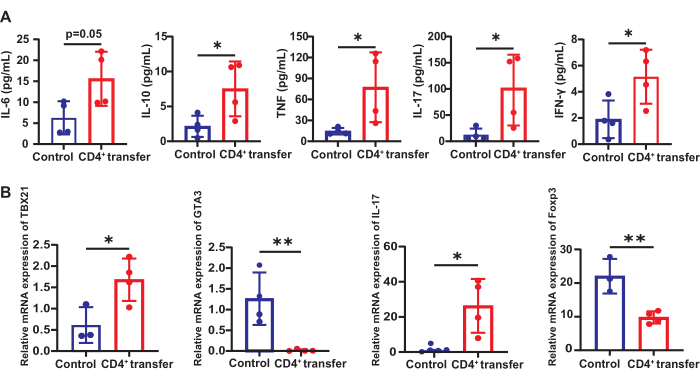
図6:対照群マウスとモデル群マウスにおけるT細胞関連炎症因子とサブセットの変化。 (A)対照群およびモデル群マウスの血清中のT細胞関連炎症因子の発現、および(B)脾臓のT細胞サブセットTh1/2/17およびTregsの変化。*p < 0.05、**p < 0.01. この図の拡大版を表示するには、ここをクリックしてください。
| スコア | 腫れ(範囲0〜4) | 紅斑(範囲0-2) |
| 0 | 何一つ | 何一つ |
| 1 | 任意の桁 | 軽視 |
| 2 | 足 | 極端 |
| 3 | 手首/足首 | |
| 4 | 四肢全体 |
表1:関節炎のスコアリング基準。 関節炎を採点するために、各四肢は腫れと紅斑に応じて採点され、各肢に 0 から 6 のスコアが割り当てられます。4つの手足すべてのスコアを合計して、各マウスの合計関節炎スコアを生成します。
| プライマー配列 | |
| オリゴ名 | シーケンス 5' から 3' |
| TBX21 -フォワード | アグカアッガッガッガート |
| TBX21 -リバース | GGGTGGACATATAAGCGGTTC |
| ガタ3フォワード | CTCGGCCATTCGTACATGGAA |
| Gata3-リバース | GGATACCTCTGCACCGTAGC |
| IL-17A-フォワード | TTTAACTCCCTTGGCGCAAAA |
| IL-17A-リバース | CTTTCCCTCCGCATTGACAC |
| Foxp3-フォワード | CCCTTGACCTCAAAACCAAG |
| Foxp3-リバース | GTGTGACTGCATGACTAACTTTGA |
| ガプドフォワード | GGTTGTCTCCTGCGACTTCA |
| Gapdh-リバース | TGGTCCAGGGTTTCTTACTCC |
表2:プライマー配列リスト。
補足図S1:フローサイトメトリーによるCD4+ T細胞ソーティングのゲーティング戦略。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
RAの発症は、滑膜組織における免疫細胞の異常な浸潤と密接に関連しており、これらの免疫細胞の調節不全の活性化は、さまざまな炎症誘発性サイトカインの放出につながり、それが滑膜および関節構造の損傷にさらに寄与します18,19。CIAモデル、K/BxNモデル、SKGマウス13,20,21など、いくつかのRA動物モデルが広く評価されています。これらのモデルは、RAの免疫メカニズムと臨床症状を成功裏に再現していますが、すべてに重大な制限があります。例えば、C57BL/6マウスのCIAモデルは、成功率が低く、発症期間が長く、環境条件や実験条件の影響を大きく受けるため、特定の実験環境では実用的ではありません。SKGマウスは、ZAP-70遺伝子変異に基づくRAマウスモデルであり、T細胞受容体(TCR)シグナル伝達に急激な異常を引き起こし、自己免疫性関節炎を誘発します22。しかし、このモデルは高価であり、実験結果の再現性は誘導条件によって影響を受けやすいです。K/BxNは、T細胞とB細胞の協調活性によって引き起こされる遺伝性関節炎モデルであり、顕著な免疫応答を示します23。しかし、このモデルの構築には費用がかかり、その特異性には制約があるため、免疫応答が限られており、ヒトのRAの多面的な病理学的プロセスを完全に捉えることはできません。したがって、RAの主要な病理学的特徴を再現し、さまざまな実験的要件を満たし、高い再現性を確保できる動物モデルを開発することは非常に重要です。
本研究では、SKGマウスからの適応CD4+ T細胞の養子導入によるRAモデルを確立する方法を提示する。このモデルの構築は、C57/BL6バックグラウンドを持つSKGマウスからのCD4+ T細胞の選択と、モデルの成功を保証するプロセスであるマンナンの誘導に依存しています。BALB/cバックグラウンドのSKGマウスは、自発的なZAP70遺伝子変異(W163C)を持ち、これが異常なTCRシグナル選択を引き起こし、非常に自己反応性の高いT細胞につながることは広く知られている24。これにより、T細胞が過剰に活性化され、滑膜炎と関節破壊が発症し、滑膜修復や免疫細胞の活性化など、RAの主要な病理学的プロセスを模倣します25,26。SKGマウスの臨床的特徴は、ヒトのRA患者の臨床的特徴と非常によく似ています。
この変異をC57BL/6バックグラウンドに導入するために、CRISPR/Cas9技術を用いて、ZAP70(W163C)変異を持つC57BL/6バックグラウンドSKGマウスモデルを生成することに成功しました。CRISPR/Cas9は、高い精度と効率を提供し、従来のランダム誘導法に関連するオフターゲット挿入または望ましくない遺伝子改変の低率を維持しながら、目的の変異の標的導入を可能にし、それによってモデルの安定性と独自性を確保する27,28。さらに重要なことに、この手法により、モデルの構築に必要な時間も大幅に短縮され、モデル開発の制御性と効率の両方が向上します。このモデルを使用すると、C57BL/6の背景に対して、T細胞媒介性滑膜炎とRAの関節破壊を正確に再現できます。従来のSKGマウスのBALB/Cバックグラウンドと比較して、C57BL/6バックグラウンドのモデルマウスは免疫学的研究への適用性が広く、他のトランスジェニックモデル(Rag1-/-やIL17-/-など)とより簡単に組み合わせることができます。これにより、RAや全身性エリテマトーデス、多発性硬化症などの他の自己免疫疾患におけるZAP70変異の役割を調査するのに適しています。
RA活性化におけるCD4+ T細胞の29,30の重要な役割に基づいて、それらを主要なメディエーターとして選択しました。T細胞は、関節リウマチにおける免疫応答の主要な推進因子であり、IL-6、IL-17、TNF-αなどの炎症因子に応じて、Th1/Th17エフェクターサブセット31を活性化することにより、滑膜損傷を直接誘発することができる32,33。免疫調節の重要なメディエーターとして、CD4+ T細胞は炎症誘発性サイトカインを分泌し、炎症カスケードを誘発および維持し、滑膜増殖と関節損傷を引き起こし、RAの病理学的進行を直接促進します。それらは、B細胞が特異的抗体(例えば、ACPA)34の産生を助けるのに役立っています。一方、RA滑膜の典型的な病理組織学的特徴は、CD4+ T細胞の凝集です。特定のクラスII主要組織適合遺伝子(MHC)遺伝子、特にヒト白血球抗原-DRアイソタイプ(HLA-DR)に関連する「共有エピトープ」は、RA35の病因と密接に関連していると考えられています。さらに、細胞傷害性Tリンパ球関連抗原4(CTLA4)-IgによるT細胞共刺激をブロックする戦略は、RA36で有意な臨床効果を示しています。さらに、マンナン誘導は、樹状細胞やマクロファージなどの自然免疫成分の活性化を促進する、モデルの強力な活性化因子として機能する37。このステップは、CD4+ T細胞の活性化と免疫応答をさらに促進し、免疫系の自己組織への攻撃を大幅に増加させ、RAにおける免疫調節不全と滑膜損傷の病理学的特徴をシミュレートします。
モデル導入完了後、関節腫脹の臨床スコアリング、病理学的検証(滑膜炎組織の病理と関節破壊の特徴の観察)、免疫学的検証(血清および脾臓中のTh1/2/17およびTreg細胞の発現)を含む複数のパラメータを用いてモデル群の系統的検証を行った。その結果、私たちのモデルは、RAにおけるT細胞媒介性滑膜炎と関節破壊を成功裏に再現し、RAの主要な病態生理学的メカニズムと一致する特徴的な免疫活性化と滑膜病理学的変化を誘発し、100%の有病率で示しました。我々のモデルでは、マウスの臨床的な関節腫脹スコアは1週間でピークに達し、2週目に顕著な減少を示し、その後の段階で再び徐々に上昇し、これは従来の関節炎動物モデルで観察される典型的な疾患の経過と完全に一致していないことは注目に値する38。これは、導入後1週間で、モデルマウスの免疫系がマンナンの注入によって激しく活性化された初期段階にあり、関節の炎症がピークに達するためである可能性があります。2週目には、免疫調節と自己回復メカニズムにより、臨床症状が一時的に緩和されます。病気が進行するにつれて、免疫寛容は徐々に衰え、免疫応答は再び強化され、後の段階で状態が徐々に悪化することで現れます。
このモデルは他のモデルに比べて比較的単純ですが、モデリング プロセス中に対処する必要があるいくつかの重要なポイントがあります。まず、SKGマウス由来のCD4+ T細胞の活性と純度が、このモデルの成功の基礎を形成しています。細胞の純度は、実験結果の一貫性と信頼性を確保するために90%を超える必要があります。第二に、内側眼窩への注入速度は、注入が速すぎることによる静脈の破裂や、注入が遅すぎることによる細胞の漏出を避けるために、慎重に制御する必要があります。さらに、細胞用量の選択も重要です。低すぎる用量はモデルの失敗につながる可能性があり、高すぎる用量は非特異的な炎症反応を引き起こす可能性があります。したがって、モデリングプロセスでは、マウスの全体的な状態を注意深く監視し、異常な症状があれば迅速に記録して、実験の円滑な進行とデータの科学的妥当性を確保する必要があります。
従来のモデルと比較して、このモデルは確立期間が短く、C57BL/6マウスでより高い発生率を達成し、比較的費用対効果が高く、操作が容易なままです。自己反応性CD4+ T細胞の転写を採用することで、T細胞を介した免疫応答を正確に再現し、関節の腫脹や損傷など、関節リウマチの主要な病理学的特徴を捕捉します。さらに、その臨床症状はヒトのRAの臨床症状とよく一致しており、RAの臨床的および病理学的プロセスをより忠実に反映しています。さらに、内側眼窩静脈注入とマンナン誘導の組み合わせにより、モデルの制御性と実験安定性がさらに向上し、再現性が高く、優れた実験制御を提供します。もちろん、このモデルにはまだ制限があります。主にT細胞駆動型の免疫応答に焦点を当てています。B細胞媒介性抗体応答と他の免疫細胞(ナチュラルキラー(NK)細胞やTreg細胞など)との協調的な役割のシミュレーションは不十分であり、RAの多細胞病理学的メカニズムを完全に表現することは困難です。それにもかかわらず、このRAマウスモデルは安定性と信頼性のある動物モデルであり続け、T細胞媒介性免疫応答とRAの主要な病理学的特徴をシミュレートするためのより良いプラットフォームを研究者に提供します。このモデルにより、研究者はRAの免疫メカニズムと病理学的進行を深く掘り下げることができ、特にT細胞主導の免疫調節不全の理解と治療標的の特定において、新しい治療法の開発に重要な実験的証拠とツールを提供します。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、中国国家自然科学基金会(82270903、82401588、81974254)および中国ポスドク科学基金会(2024M751019)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
参考文献
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved