Method Article
מודל העברה מאמץ של דלקת מפרקים שגרונית בעכברים
In This Article
Summary
כאן, אנו מדווחים על פרוטוקול המבסס מודל עכבר של דלקת מפרקים שגרונית (RA) באמצעות העברה מאמצת של תאי CD4+ T מעכברי SKG, המספק כלי ניסיוני מהיר ואמין לחקירת המנגנונים החיסוניים, התקדמות פתולוגית ופיתוח טיפולים חדשים לדלקת מפרקים שגרונית.
Abstract
דלקת מפרקים שגרונית (RA) היא הפרעה דלקתית אוטואימונית כרונית מערכתית שעלולה לגרום לנזק למפרקים, עיוותים, נכות ואפילו מוות. בשל האטיולוגיה המורכבת וההצגה הקלינית ההטרוגנית, אסטרטגיות הטיפול הנוכחיות אינן מספקות בשליטה יעילה על התקדמות המחלה, במיוחד בהשגת אבחון מוקדם ומתן טיפולים מותאמים אישית. לכן, פיתוח גישות טיפוליות חדשות הוא קריטי. כדי להשיג זאת, מודלים אמינים של בעלי חיים חיוניים לחקירת הפתוגנזה של דלקת מפרקים שגרונית. כיום משתמשים במספר מודלים של דלקת מפרקים שגרונית בבעלי חיים, כולל מודל דלקת מפרקים הנגרמת על ידי קולגן (CIA), מודל K/BxN ועכבר SKG. למרות שמודלים אלה יכולים לחקות בהצלחה את המנגנונים החיסוניים והביטויים הקליניים של דלקת מפרקים שגרונית, לכל אחד מהם יש מגבלות בולטות.
בפרוטוקול זה, אנו מתארים את תהליך הקמת מודל עכבר RA באמצעות העברה מאמצת של תאי CD4+ T מעכברי SKG. בהשוואה למודלים קונבנציונליים, מודל זה מציע זמן התבססות קצר יותר ושיעור היארעות גבוה יותר (100%) בעכברי C57BL/6. הוא חסכוני יחסית, כרוך בהליכים פשוטים ומשכפל באופן אמין תגובות חיסוניות בתיווך תאי T, מה שמבטיח בקרה ניסויית מעולה ויכולת שחזור. ערכנו הערכה מקיפה של המודל, והערכנו את הפנוטיפ הקליני כגון תסמיני מפרקים. באמצעות הערכת פנוטיפ קלינית, ראינו נפיחות משמעותית במפרקים ותגובות דלקתיות. בנוסף, באמצעות טכנולוגיית PCR למדידת רמות הביטוי של גורמי שעתוק מרכזיים, מצאנו כי מודל זה מדמה ביעילות תגובות חיסוניות בתיווך תאי T ומאפיינים פתולוגיים מרכזיים של RA. בעזרת מודל זה, חוקרים יכולים לדמות טוב יותר את התגובה החיסונית בתיווך תאי T ואת המאפיינים הפתולוגיים העיקריים של RA, ובכך לספק כלי ניסיוני אמין ויעיל לחקר מנגנונים חיסוניים והתקדמות פתולוגית ולפיתוח טיפולים חדשים לדלקת מפרקים שגרונית.
Introduction
דלקת מפרקים שגרונית היא מחלה דלקתית אוטואימונית כרונית מערכתית הפוגעת בכ-1% מאוכלוסיית העולם, וגורמת לתחלואה גבוהה ולנטל סוציו-אקונומי כבד 1,2. המחלה מאופיינת בדלקת סינוביאלית מתמשכת, הרס סחוס ושחיקת עצם, מה שמוביל בסופו של דבר לעיוותים במפרקים, נכויות, ובמקרים חמורים למוות בטרם עת 3,4,5. הפתוגנזה של דלקת מפרקים שגרונית כרוכה באינטראקציה של גורמים גנטיים, סביבתיים וחיסוניים, עם תכונות מפתח הכוללות הפעלה חריגה של חסינות תאית, שחרור מוגזם של ציטוקינים פרו-דלקתיים והפרעה בסבילות החיסונית 6,7. בתהליך זה, תאי T אוטוראקטיביים, במיוחד תאי CD4+ T, כמניעים מרכזיים לוויסות חיסוני, מקדמים ישירות את ההתקדמות הפתולוגית של RA באמצעות מנגנונים מרובים.
תאי T מסייעים (Th)1 מייצרים אינטרפרון-גמא (IFN-γ), המפעיל מקרופאגים ופיברובלסטים סינוביאליים, וכתוצאה מכך שחרור גורם נמק גידול (TNF)-α ואינטרלוקין (IL)-6 וגורם לסינוביטיס. תאי Th17 מפרישים IL-17, המקדם הפעלה של תאים סינוביאלים ואוסטאוקלסטים, ומחמיר את הרס הסחוס ושחיקת העצם 8,9. בנוסף, תאי CD4+ T מגבירים תגובות דלקתיות על ידי הפעלת תאי B באמצעות אותות מעוררים משותפים, הגורמים לייצור נוגדנים לחלבון אנטי-ציטרולין (ACPA) וגורמים שגרוניים (RF)10. בינתיים, פגמים בתפקוד והפחתה במספר תאי Treg הם סיבות מרכזיות לחוסר איזון חיסוני בדלקת מפרקים שגרונית, מה שמוביל לדלקת בלתי מבוקרת11,12. בשל האטיולוגיה המורכבת וההצגה הקלינית ההטרוגנית, אבחון מוקדם קשה, והטיפול הנוכחי בדלקת מפרקים שגרונית אינו מספק. לכן, פיתוח גישות טיפוליות חדשות הוא קריטי. מודלים אמינים של בעלי חיים הם קריטיים לחקירת הפתוגנזה של RA כדי להשיג הבנה מעמיקה יותר של המנגנונים הפוטנציאליים של RA ולחקור אסטרטגיות טיפול חדשות.
מודלים מסורתיים של RA, כגון דגמי העכבר CIA ו-K/BxN 13,14,15, תורמים לשיפור ההבנה שלנו של RA. עם זאת, מודלים אלה מראים מגבלות משמעותיות. לדוגמה, למודל ה-CIA בעכברי C57BL/6 יש שיעור הצלחה נמוך ותקופת אינדוקציה ארוכה, מה שמפחית את התועלת שלו במסגרות ניסוי מסוימות. באופן דומה, למרות שמודל K/BxN הוא בעל ערך, הוא יקר להקמה ויש לו מגבלות בשכפול הפתולוגיה המורכבת של RA אנושי, במיוחד האינטראקציות בין תאי חיסון לציטוקינים.
כדי להתמודד עם מגבלות אלה, פיתחנו מודל עכבר RA חדשני על ידי העברת תאי CD4+ T מעכברי SKG עם רקע C57BL/6 לעכברי C57BL/6 בעלי יכולת חיסונית, בשילוב עם הפעלה חיסונית המושרה על ידי מנאן. מודל זה משכפל ביעילות את המאפיינים העיקריים של RA, כולל תגובות חיסוניות בתיווך תאי T ומאפיינים פתולוגיים חיוניים כגון דלקת סינוביאלית ושחיקת מפרקים, תוך שהוא מציע יתרונות בשחזור, פשטות וחסכוניות. תיארנו מתודולוגיה מפורטת לביסוס מודל זה, הכוללת יצירת עכברי SKG על רקע C57BL/6, בידוד תאי CD4+ T מעכברי SKG, העברתם לאימוץ והשראת השראת המנאן לאחר מכן. בנוסף, אנו מתארים את הקריטריונים הקליניים וההיסטולוגיים המשמשים להערכת חומרת דלקת המפרקים, ומבטיחים את אמינותה ויכולת השחזור שלה. על ידי חיקוי עקבי של תגובות חיסוניות בתיווך תאי T והמאפיינים הפתולוגיים הבסיסיים של RA, מודל זה משמש ככלי ניסיוני חזק ויעיל לחקירת מנגנוני החיסון, התקדמות המחלה ופיתוח טיפולים חדשים לדלקת מפרקים שגרונית.
Protocol
כל הליכי הניסוי במחקר זה עקבו בקפדנות אחר ההנחיות שנקבעו על ידי "המדריך הלאומי לבריאות לטיפול ושימוש בחיות מעבדה", כולל גידול בעלי חיים, פעולות ניסוי והמתת חסד, ואושרו על ידי ועדת האתיקה של בעלי חיים של המכללה הרפואית טונג-ג'י, אוניברסיטת הוא-ג'ונג למדע וטכנולוגיה.
1. בעלי חיים
- דור עכברי SKG (רקע C57BL/6)
- אסטרטגיית עריכת גנים
- תכנן RNA מדריך ספציפי (gRNA) המכוון לגן ZAP70 (רצף gRNA: 5'-CAGCCCACGAGGAATGCCCTGG-3') ובצע עריכת גנים עם מערכת CRISPR/Cas9. תכנן DNA של תורם עם מוטציית ZAP70 (W163C) כדי להבטיח אינטגרציונל מדויק של המוטציה (כאן, CAGGCCCCACAGGTGGAGAAGCTCATTG
CTACCACAGCCCACGAGCGAATGCCCטי.ג'י
גTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCA).
הערה: ה-gRNA מכוון את החלבון Cas9 לאתר הספציפי של הגן ZAP70 לחיתוך מדויק. הבסיס המסומן בקו תחתון ברצף ה-DNA של התורם מצביע על בסיסים שעברו מוטציה. מוטציה זו תואמת את מוטציית W163C (TGG→TGC) בחלבון ZAP70, הממוקם בתחום תפקודי קריטי.
- תכנן RNA מדריך ספציפי (gRNA) המכוון לגן ZAP70 (רצף gRNA: 5'-CAGCCCACGAGGAATGCCCTGG-3') ובצע עריכת גנים עם מערכת CRISPR/Cas9. תכנן DNA של תורם עם מוטציית ZAP70 (W163C) כדי להבטיח אינטגרציונל מדויק של המוטציה (כאן, CAGGCCCCACAGGTGGAGAAGCTCATTG
- הזרקת מיקרו-מזרק
- השתמש במיקרו-הזרקה כדי להחדיר Cas9 mRNA, gRNA ו-DNA של תורם לביצי עכבר C57BL/6 מופרות. הזרקה משותפת של חלבון Cas9 ו-gRNA כך שהם מבקעים את הגן ZAP70 ומכניסים את המוטציה ZAP70 (W163C) באמצעות רקומבינציה הומולוגית. השתיל את הביציות המופרות שהוזרקו בעכברים נקבות פסאודו-בהריון, המתן כ-20 יום והגדר את העכברים שנולדו כדור F0. זיהוי גנוטיפים באמצעות הגברה וריצוף PCR (ראה שלב 1.1.5.3).
- גנוטיפ של עכברים מדור F0
- בצע PCR וריצוף בעכברים מדור F0 כדי לאשר את רכישת המוטציה ZAP70 (W163C) (ראה שלב 1.1.5.3).
הערה: עכברים מדור F0 הם כימריים עקב מחשוף עוברי מהיר. ייתכן שהם חסרי העברה גנטית יציבה. הטמעת גידול סדרתי להקמת קווים יציבים.
- בצע PCR וריצוף בעכברים מדור F0 כדי לאשר את רכישת המוטציה ZAP70 (W163C) (ראה שלב 1.1.5.3).
- רכישה וזיהוי גנוטיפי של עכברים מדור F1
- לגדל עכברים חיוביים ל-F0 עם עכברי C57BL/6J מסוג בר כדי להשיג עכברים מדור F1, ולבצע גנוטיפ באמצעות PCR וריצוף כדי להשיג עכברי SKG (רקע C57BL/6; ראה שלב 1.1.5.4).
- שיטות גנוטיפ מבוססות PCR לדורות F0 ו-F1
- כורים חתיכה של 0.5 ס"מ מהזנב בעזרת מספריים סטריליים.
- חלץ DNA של עכבר באמצעות ערכת מיצוי DNA גנומית של בעלי חיים.
- עבור F0, הכינו את מערכת תגובת ה-PCR הבאה: 13.2 מיקרוליטר של ddH2O, 2 מיקרוליטר של מאגר PCR, 2 מיקרוליטר של 2.5 מ"מ dNTP, 0.5 מיקרוליטר מכל אחד מהראשונים קדימה (5'-GATGCCTAGGTGTGTGGGGGGTTCC-3') והפוך (5'-ACTTGCCTACGCTACTGCTCTACA-3') (10 pmol/μL), 0.8 מיקרוליטר של DNA פולימראז ו-1 מיקרוליטר של DNA גנומי (50-100 ננוגרם/מיקרוליטר) המופק מזנבות עכברים, לנפח תגובה סופי של 20 מיקרוליטר. בצע הגברת גנים באמצעות תוכנית ה-PCR הבאה: 94 מעלות צלזיוס למשך 3 דקות; 98 מעלות צלזיוס למשך 15 שניות, 58 מעלות צלזיוס למשך 15 שניות ו-68 מעלות צלזיוס למשך דקה אחת, למשך 35 מחזורים; 68 מעלות צלזיוס למשך 5 דקות; יש להחזיק בטמפרטורה של 12 מעלות צלזיוס.
- עבור F1, הכינו את מערכת תגובת ה-PCR הבאה: 14.9 מיקרוליטר של ddH2O, 2 מיקרוליטר של מאגר PCR 10x Taq, 1 מיקרוליטר של 2.5 מ"מ dNTP, 0.5 מיקרוליטר של כל אחד מהפריימרים קדימה (5'-GATGCCTAGGTGGGTGGGGGGTTCC-3') והפוך (5'-ACTTGCCTACGCTACTGCTCTACA-3') (10 pmol/μL), 0.1 מיקרוליטר של Taq DNA פולימראז, ו-1 מיקרוליטר של DNA גנומי (50-100 ננוגרם/מיקרוליטר) המופק מזנבות עכברים, לנפח תגובה סופי של 20 מיקרוליטר. בצע הגברת גנים באמצעות תוכנית ה-PCR הבאה: 94 מעלות צלזיוס למשך 5 דקות; 94 מעלות צלזיוס למשך 30 שניות, 58 מעלות צלזיוס למשך 30 שניות, 72 מעלות צלזיוס למשך דקה אחת, חוזר על עצמו במשך 35 מחזורים; 72 מעלות צלזיוס למשך 5 דקות; יש להחזיק בטמפרטורה של 12 מעלות צלזיוס.
- הפעל אלקטרופורזה כדי לאשר מוצרים בגודל הצפוי.
- רצף את תוצרי ה-PCR כדי לאמת הן את הגנוטיפ והן את המוטציה הספציפית.
- אסטרטגיית עריכת גנים
- בחירת עכברים תורמים ונמענים
- בחר עכברי SKG בני 6-8 שבועות (זכר או נקבה) כעכברים תורמים.
- בחר עכברי C57BL/6 בני 6-8 שבועות (רצוי נקבות לתוצאות ניסוי עקביות) כעכברים מקבלים.
- עכברי בית C57BL/6 ו-SKG (בני 6-8 שבועות) בתנאי SPF בכלובים מאווררים בנפרד. ספק גישה חופשית להזנה בדרגת SPF ומים סטריליים במחזור אור/חושך של 12 שעות. אקלום את העכברים במשך שבוע לפני תחילת הניסויים.
2. בידוד וטיהור תאי CD4+ T מעכברי SKG
- המתת חסד של עכברי SKG מתחת למכסה זרימה למינרי סטרילי באמצעות חנק CO2 . טבלו את העכברים באלכוהול 75% למשך 5 דקות לחיטוי. אתר את הטחול בחלל הבטן כמו גם את בלוטות הלימפה (מפשעתיות ופופליטאליות) באזורים המפשעתיים והפופליטאליים. נתחו בזהירות את הטחול ובלוטות הלימפה בעזרת מלקחיים ומספריים סטריליים והעבירו אותם מיד ל-PBS מקורר מראש.
- מניחים את הטחול ובלוטות הלימפה בכלי פטרי נפרדים. לחץ על הרקמות דרך מסננת תאים של 70 מיקרומטר באמצעות בוכנה של מזרק סטרילי, והוסף בהדרגה 10-12 מ"ל של PBS מקורר מראש ליצירת תרחיף תאים אחיד. העבירו את מתלה התא דרך אותה מסננת תאים של 70 מיקרומטר לתוך צינור צנטריפוגה של 15 מ"ל, ולאחר מכן צנטריפוגה ב-300 × גרם למשך 7 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט ושמרו על כדור התא.
- בצע צביעה כחולה טריפאן כדי להעריך את כדאיות התא. ספור את התאים ואשר שהכדאיות היא ≥90%.
- התאם את ריכוז התאים ל-1 ×-108 תאים/מ"ל עם המאגר המסופק בערכת בידוד תאי CD4+ T.
- העבירו 100 מיקרוליטר מתרחיף התא (107 תאים) לצינור חדש. מוסיפים 10 מיקרוליטר ביוטין-נוגדן-קוקטייל, מערבבים היטב ודוגרים על קרח למשך 15 דקות.
- השעו מחדש את החרוזים על ידי מערבולת במהירות מרבית. מוסיפים 10 מיקרוליטר מתרחיף חרוזי סטרפטווידין, מערבבים היטב ודוגרים על קרח למשך 15 דקות.
- הוסף 2.5 מ"ל מהמאגר המסופק בערכת בידוד תאי CD4+ T והנח את הצינור במגנט למשך 5 דקות.
- יוצקים בזהירות את הנוזל (תאי המטרה) מהצינור לצינור סטרילי חדש, ואז צנטריפוגה בטמפרטורה של 4 מעלות צלזיוס, 300 × גרם למשך 5 דקות. השליכו את הסופרנטנט ושמרו על כדור התא.
- הוסף כמות מספקת של תמיסת PBS סטרילית כדי להתאים את ריכוז התאים ל-2 ×-106 תאים/מ"ל ושמור את התרחיף על קרח לשימוש מאוחר יותר.
- השתמש בזרימה ציטומטרית כדי להעריך את טוהר התאים הממוינים (איור משלים S1). חשב את טוהר התאים כ: (מספר תאי CD4+ T / ספירת תאים כוללת) × 100%. ודא שהטוהר הוא ≥90%16.
3. העברה מאמצת של תאי CD4+ T
- להרדים עכברי C57BL/6 עם 2%-3% איזופלורן, ולהגיע לעומק הרדמה שבו העכברים מאבדים כל ניידות אך שומרים על נשימה ספונטנית תקינה.
- נקו בעדינות את הקנתוס הפנימי (זווית העין) של העכבר בעזרת צמר גפן סטרילי כדי להסיר הפרשות ושיער, ולחשוף את הווריד.
- לשתק את העכבר ביד. משוך 200 מיקרוליטר של מתלה תאי CD4+ T (2 × 105-5 × 105 תאים לעכבר) למזרק של 1 מ"ל. הכנס את המחט בזווית של 10-15 מעלות לווריד הקנטלי הפנימי, והבטיח מיקום מדויק. הזרקו את תרחיף התאים לאט ובאופן שווה במשך 10-15 שניות.
- לאחר משיכת המחט, לחץ בעדינות על אזור הקנטל הפנימי בעזרת צמר גפן סטרילי למשך 3-5 שניות כדי למנוע דימום.
- הנח את העכבר בכלוב שקט, יבש ונקי לניטור עד שיחזור להכרה מלאה, עם נשימה יציבה וללא התנהגות חריגה (כגון עוויתות או מוות פתאומי). העבר את העכבר לכלוב דיור סטנדרטי לאחר אישור מצב יציב לאחר הניתוח.
הערה: מכיוון שווריד הקנטלי הפנימי קטן, טיפול עדין ומהירות עירוי מבוקרת הם חיוניים כדי למנוע קרע בווריד או חסימת תאים הנגרמת ממהירות מופרזת. - רשמו את פרטי העירוי ותייגו את המודל ואת עכברי קבוצת הביקורת (ארבעה בעלי חיים בקבוצה) כדי למנוע בלבול בניסויים הבאים. לתת תאי CD4+ T למודל עכברים, ולהשאיר עכברי ביקורת ללא טיפול. ודא שכל העכברים הם עכברים מקבלים.
4. גירוי ואינדוקציה של המן
- בצע אינדוקציה של המן ביום 4 (72 שעות לאחר עירוי תאי CD4+ T). החל את אותם תנאי אינדוקציה על כל עכברי הניסוי והבקרה.
- שוקלים את אבקת המנאן וממיסים אותה ב-PBS סטרילי לריכוז של 100 מ"ג/מ"ל.
- החזק את העכבר בצורה נכונה כדי לחשוף את בטנו. יש לחטא את העור ב-75% אלכוהול ולזהות את מקום ההזרקה (~1 ס"מ לצד קו האמצע של הבטן).
- מערבבים היטב את תמיסת המן ושואבים את הנפח המתאים (20-30 מ"ג לעכבר) למזרק של 1 מ"ל. הכנס את המחט בזווית של 45 מעלות לחלל הצפק והזריק את התמיסה לאט כדי להבטיח פיזור אחיד. משוך את המחט לאט ולחץ בעדינות על מקום ההזרקה בעזרת צמר גפן סטרילי למשך מספר שניות כדי למנוע דליפה או זיהום.
- הנח את העכבר המוזרק בכלוב שקט ונקי, ועקוב מקרוב במשך 5-10 דקות כדי לוודא שאין דליפה במקום ההזרקה, נפיחות בבטן או נשימה חריגה.
- רשום את פרטי ההזרקה עבור כל עכבר בפירוט.
5. מידות
- תצפית על פנוטיפ קליני
- ניקוד תסמיני דלקת פרקים
- בצע הערכות משותפות כל 3 ימים לאחר השראת המנאן. בדוק את כל המפרקים בגפיים הקדמיות ובגפיים האחוריות, תוך שימת לב מיוחדת למפרקי הברך, הקרסול, שורש כף היד והאצבעות/אצבעות. ציין את חומרת דלקת המפרקים באמצעות קריטריונים סטנדרטיים (טבלה 1)17. רשום והשווה את הציונים הכוללים בכל נקודת זמן כדי להעריך את התקדמות דלקת המפרקים.
- ניקוד תסמיני דלקת פרקים
- רישום מאפיינים פתולוגיים של רקמות
- לאחר חודש של השראת המנאן, המתת חסד של העכברים מתחת למכסה זרימה למינרי סטרילי באמצעות חנק CO2 (בהתאם להנחיות ועדת האתיקה), אבטח את העכבר על לוח קצף וחשוף את הגפיים האחוריות. חתכו את העור החל מהקרסול וקילפו כלפי מעלה כדי לחשוף את השרירים והמפרקים. זהה את מפרק הקרסול (בין טיביה/פיבולה לטלוס) ואת המפרקים המטטרסופלנגיאליים (בין מטטרסלים לפלנגות פרוקסימליות) ונתח את המפרקים הללו לניתוח היסטולוגי והכין קטעי פרפין.
- מקבעים את הרקמות שנכרתו בפורמלין 4% למשך 72 שעות, ולאחר מכן מעבירים אותן לחומצה 10% אתילנדיאמינטטראצטית (EDTA, pH 7.4) למשך 4 שבועות של הסרת אבדן כדי להבטיח הסרת אבדן מלאה.
- לאחר הסרת האבנית, שטפו את הרקמות עם PBS כדי להסיר כל קיבוע שנותר ולאחר מכן לייבש את הרקמות באמצעות סדרת אתנול מדורגת (75%, 80%, 95%, 100%).
הערה: פורמלין יכול לגרות את העיניים, העור ודרכי הנשימה. יש לטפל בזה במכסה אדים. - הטמע את הרקמה בפרפין באמצעות מכונת הטמעת פרפין. השתמש במיקרוטום כדי לחתוך את הרקמה המוטבעת לפרוסות בעובי 4 מיקרומטר. יש לצוף את החלקים באמבט מים בטמפרטורה של 40 מעלות צלזיוס המכיל מים מזוקקים.
- מעבירים ומייבשים את החלקים. הניחו את החלקים על שקופיות זכוכית. יבש אותם למשך הלילה בטמפרטורת החדר (RT). אחסן את השקופיות ב-RT לצביעה.
- צביעת המטוקסילין ואאוזין (H&E)
- מכניסים את השקופיות לתנור של 60 מעלות למשך שעתיים כדי להסיר את הפרפין.
- בטמפרטורת החדר, טבלו את השקופיות ברצף הבא למשך 5 דקות כל אחת: קסילן → קסילן → 100% אתנול → 100% אתנול →-95% אתנול →-80% אתנול →-75% אתנול. שוטפים במים מזוקקים למשך 2 דקות.
- מכתימים את השקופיות ברצף בתמיסת המטוקסילין למשך 5 דקות, שוטפים במים נטולי יונים למשך 2 דקות, ואז מטפלים ב-0.1% אמוניה למשך דקה, שוטפים במשך 3X2 דקות במים נטולי יונים, מכתימים באאוזין למשך דקה אחת, ולבסוף שוטפים במים נטולי יונים למשך 2 דקות.
- טבלו את השקופיות למשך 5 דקות כל אחת ב-80% אתנול →-95% אתנול →-100% אתנול → קסילן → קסילן.
- יבש את המגלשות באוויר באופן טבעי והרכיב עם שרף ניטרלי.
- ספרנין צביעה ירוקה O-Fast
- יש להסיר את חלקי הפרפין למים ולהכתים אותם באמצעות ערכת הכתמים של ואן גיסון. הרכיבו את השקופיות עם שרף ניטרלי לאחר הצביעה וצלמו תמונות תחת מיקרוסקופ (הוכן בשלב 5.2.5).
- שינויים בתאי T ובציטוקינים
- הסר את הטחול מהעכבר באמצעות כלי ניתוח סטריליים.
- חלץ את סך ה-RNA מרקמת הטחול באמצעות ערכת מיצוי RNA לפי הוראות היצרן. כמת את ריכוז ה-RNA והטוהר באמצעות ספקטרופוטומטר וודא שיחס A260/A280 הוא בין 1.8 ל-2.0.
- סנתז cDNA מה-RNA המופק באמצעות ערכת שעתוק הפוך. עקוב אחר פרוטוקול היצרן להגדרת התגובה ותנאי הרכיבה. אחסן את ה-cDNA ב-20 מעלות צלזיוס לניתוח qPCR לאחר מכן.
- בצע qPCR: מדידת רמות ביטוי mRNA יחסיות של Tbx21, Gata3, Il-17 ו-Foxp3 ברקמת הטחול נמדדה באמצעות qPCR מבוסס SYBR ירוק בתגובות של 10 מיקרוליטר המכילות: 5 מיקרוליטר של תערובת מאסטר 2x SYBR Green, 0.2 מיקרוליטר כל אחד של פריימרים קדימה ואחורה (10 מיקרומטר; רצפים בטבלה 2), 0.5-1 מיקרוליטר cDNA (50-100 ננוגרם/מיקרוליטר), ומים נטולי נוקלאז לנפח. השתמש בתנאי הרכיבה התרמית הבאים: דנטורציה ראשונית ב-95 מעלות צלזיוס למשך 30 שניות, ואחריה 40 מחזורים של 95 מעלות צלזיוס למשך 10 שניות ו-60 מעלות צלזיוס למשך 30 שניות, עם ניתוח עקומת התכה (65-95 מעלות צלזיוס). נרמל את רמות הביטוי ל- Gapdh באמצעות פעולת השירות 2(-ΔΔCt).
- בידוד סרום וניתוח מערך חרוזים ציטומטרי (CBA)
- אסוף דם מהעכבר באמצעות איסוף הדם המסלולי, העביר את הדם לצינור איסוף מצופה נוגד קרישה, ותן לו לעמוד בטמפרטורת החדר למשך 30 דקות. צנטריפוגה של הדם הקרוש בטמפרטורה של 4 מעלות צלזיוס, 1,000 × גרם למשך 15 דקות, אספו בזהירות את הסופרנטנט (סרום), ואחסנו אותו בטמפרטורה של -80 מעלות צלזיוס עד לניתוח.
- קבע את רמות הביטוי של IL-6, IL-10, IL-17, TNF-α ו-IFN-γ בסרום באמצעות ערכת CBA בהתאם להוראות היצרן.
- הסר את הטחול מהעכבר באמצעות כלי ניתוח סטריליים.
תוצאות
ניקוד קליני של נפיחות במפרקים ושיעור היארעות בעכברים
איור 1 מציג את הניקוד הקליני של נפיחות במפרקים ואת שיעור ההיארעות בעכברי מודל. התוצאות מצביעות על כך שכל העכברים בקבוצת המודל פיתחו את המחלה (n=4), עם שיעור היארעות של 100%. הציונים בקבוצת המודל עלו משמעותית, הראו הקלה קצרה בשבוע השני, ולאחר מכן עלו במהלך תקופה של 6 שבועות.
ביטוי נפיחות במפרקים בעכברים
המפרקים של עכברים מקבוצת המודל מראים עיבוי ונפיחות משמעותיים, כאשר נפיחות ועיבוי ניכרים נצפים גם בגפיים הקדמיות ובגפיים האחוריות (איור 2).
תוצאות פתולוגיות של מפרקי קרסול עכברים
תוצאות פתולוגיות מצביעות על כך שבהשוואה לקבוצת הביקורת, עכברי קבוצת המודל הראו עיבוי משמעותי של הסינוביום במפרקי הקרסול, חוסר המשכיות בעצם והצטברות ניכרת של תאים דלקתיים (איור 3, איור 4 ואיור 5).
גורמים דלקתיים הקשורים לתאי T בסרום
בהשוואה לקבוצת הביקורת, עכברי קבוצת המודל הראו עלייה משמעותית ברמות הסרום של IL-10 (7.51 לעומת 2.15 pg/mL), TNF (78.83 לעומת 13.11 pg/mL), IL-17 (101.6 לעומת 12.64 pg/mL) ו-IFN-γ (5.15 לעומת 1.90 pg/mL) (p < 0.05). IL-6 גם עלה באופן משמעותי בהשוואה לקבוצת הביקורת (15.59 לעומת 6.27 pg/mL) (p = 0.05, איור 6).
שינויים בתת-קבוצות תאי T Th1/2/17 ו-Tregs בטחול
רמות ביטוי ה-mRNA של Tbx21 (Th1), Gata3 (Th2), Il-17 (Th17) ו-Foxp3 (Tregs) נמדדו כדי להעריך שינויים בתת-קבוצות של תאי T בטחול. גנים אלה מקודדים גורמי שעתוק מרכזיים וציטוקינים המגדירים את ההתמיינות והתפקוד של תת-קבוצות תאי ה-T שלהם. בהשוואה לקבוצת הביקורת, עכברי קבוצת המודל הראו ביטוי mRNA מוגבר משמעותית של Tbx21 (1.68 לעומת 0.61) ו-Il-17 (26.30 לעומת 0.75) בטחול (p < 0.05) ביחס לגן הייחוס Gapdh.
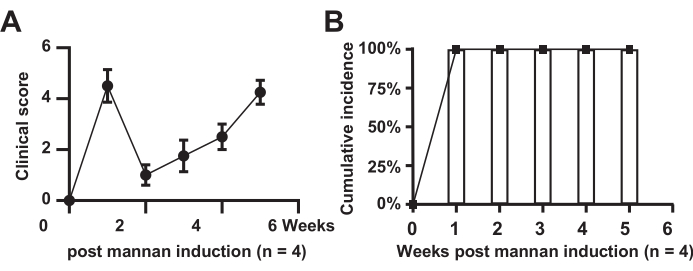
איור 1: ניקוד קליני של נפיחות במפרקים. (A) עכברי קבוצת מודל; (B) שכיחות מצטברת בעכברים מקבוצת המודל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: ביטויי נפיחות מפרקים בעכברי ביקורת ומודל (n = 4). (A-C) תמונות מייצגות של ציוני נפיחות בכפות ובמפרקים (0,2,4) בקבוצות הביקורת והמודל של עכברים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: שינויים היסטולוגיים במפרקי הקרסול של עכברי קבוצת ביקורת וקבוצת מודל שנצפו עם צביעת המטוקסילין-אאוזין. (A) מפרק קרסול עכבר בקרה; (ב) חוסר רציפות בעצם מפרק הקרסול של העכבר מקבוצת המודל; (C) התפשטות סינוביאלית במפרק הקרסול של העכבר בקבוצת המודל. פסי קנה מידה = 50 מיקרומטר (עמודה ראשונה), 100 מיקרומטר (עמודה שנייה ושלישית). התמונות באיור 3B ו-3C הן מאותו עכבר, ומדגימות פנוטיפים פתולוגיים שונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
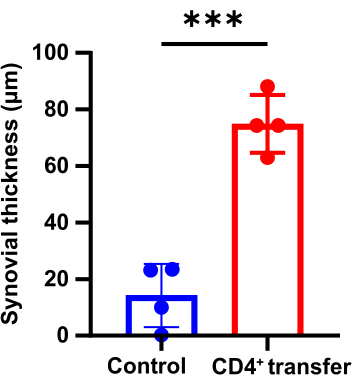
איור 4: הבדלים בעובי הסינוביאלי של מפרקי הקרסול בין קבוצת הביקורת לעכברי קבוצת המודל (p < 0.05). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
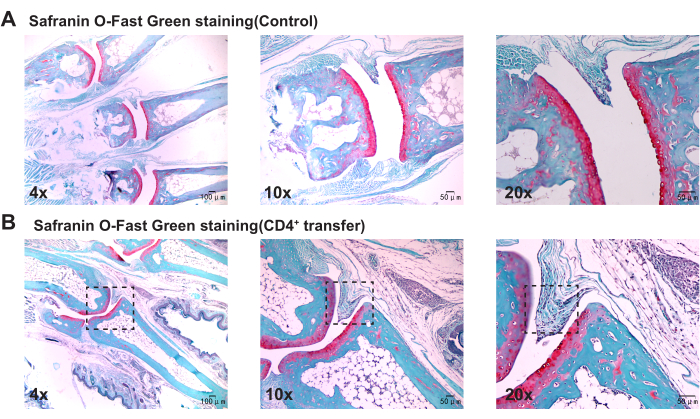
איור 5: שינויים היסטולוגיים במפרקי הקרסול של עכברי קבוצת הביקורת וקבוצת המודל שנצפו עם צביעה ירוקה של ספרנין O-Fast. (A) מפרק הקרסול של עכבר קבוצת הביקורת; (B) התפשטות סינוביאלית במפרק הקרסול של עכבר קבוצת המודל. פסי קנה מידה = 50 מיקרומטר (עמודה ראשונה), 100 מיקרומטר (עמודה שנייה ושלישית). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
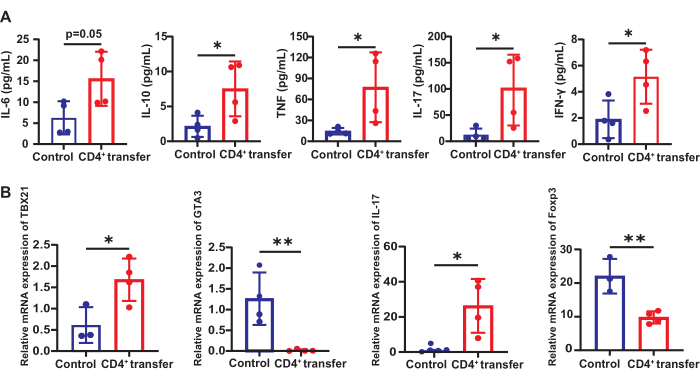
איור 6: שינויים בגורמים דלקתיים ותת-קבוצות הקשורים לתאי T בעכברי קבוצת הביקורת והמודל. (A) ביטוי של גורמים דלקתיים שקשורים לתאי T בסרום של עכברי קבוצת הביקורת והמודל ו-(B) השינויים בתת-קבוצות תאי T Th1/2/17 ו-Tregs בטחול. *עמ' < 0.05, **עמ' < 0.01. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| הציון | נפיחות (טווח 0-4) | אריתמה (טווח 0-2) |
| 0 | ללא | ללא |
| 1 | ספרה כלשהי | קלה |
| 2 | כפה | קיצוני |
| 3 | פרק כף היד/קרסול | |
| 4 | כל הגפה |
טבלה 1: קריטריונים לניקוד דלקת פרקים. כדי לתת ציון לדלקת פרקים, כל איבר מקבל ניקוד לפי נפיחות ואריתמה, עם ציון של 0-6 המוקצה לכל איבר. הציונים עבור כל ארבע הגפיים מסוכמים כדי ליצור את הציון הכולל של דלקת מפרקים עבור כל עכבר.
| רצפי פריימר | |
| שם אוליגו | רצף 5' עד 3' |
| Tbx21-קדימה | AGCAAGGAGCGAATGTT |
| Tbx21-הפוך | GGGTGGACATATAAGCGGTTC |
| גאטה3-פורוורד | CTCGGCCATTCGTACATGGAA |
| Gata3-הפוך | GGATACCTCTGCACCGTAGC |
| Il-17A-קדימה | TTTAACTCCCTTGGCGCAAAA |
| Il-17A-הפוך | CTTTCCCTCCGCATTGACAC |
| Foxp3-פורוורד | CCCTTGACCTCAAAACCAAG |
| Foxp3-הפוך | GTGTGACTGCATAACTTTGA |
| Gapdh-קדימה | GGTTGTCTCCTGCGACTTCA |
| Gapdh-הפוך | TGGTCCAGGGTTTCTTACTCC |
טבלה 2: רשימת רצפי פריימר.
איור משלים S1: אסטרטגיית שער למיון תאי CD4+ T על ידי ציטומטריית זרימה. אנא לחץ כאן להורדת קובץ זה.
Discussion
התפתחות RA קשורה קשר הדוק לחדירה לא תקינה של תאי חיסון ברקמה הסינוביאלית, כאשר הפעלה לא מווסתת של תאי חיסון אלה מובילה לשחרור של ציטוקינים פרו-דלקתיים שונים, התורמים עוד יותר לנזק למבנים סינוביאלים ומפרקים18,19. מספר מודלים של בעלי חיים RA הוערכו באופן נרחב, כולל מודל ה-CIA, מודל K/BxN ועכברי SKG 13,20,21. בעוד שמודלים אלה משכפלים בהצלחה את המנגנונים החיסוניים והביטויים הקליניים של דלקת מפרקים שגרונית, לכולם יש מגבלות משמעותיות. לדוגמה, למודל ה-CIA בעכברי C57BL/6 יש שיעור הצלחה נמוך יותר, תקופת התחלה ארוכה יותר, והוא מושפע באופן משמעותי מתנאי הסביבה והניסוי, מה שהופך אותו לפחות מעשי במסגרות ניסוי מסוימות. עכברי SKG מייצגים מודל עכבר RA המבוסס על מוטציה בגן ZAP-70, הגורמת לאנומליה פתאומית באיתות קולטן תאי T (TCR) וגורמת לדלקת מפרקים אוטואימונית22. עם זאת, מודל זה הוא יקר, ויכולת השחזור של תוצאות הניסוי מושפעת בקלות מתנאי האינדוקציה. K/BxN הוא מודל דלקת מפרקים תורשתית המופעל על ידי פעילות משותפת של תאי T ו-B, המציג תגובה חיסונית בולטת23. עם זאת, בניית מודל זה היא יקרה, והספציפיות שלו מוגבלת, מה שמוביל לתגובה חיסונית מוגבלת שאינה יכולה ללכוד לחלוטין את התהליך הפתולוגי הרב-גוני של דלקת מפרקים שגרונית אנושית. לכן, יש חשיבות רבה לפתח מודל בעלי חיים שיכול לשכפל את המאפיינים הפתולוגיים העיקריים של דלקת מפרקים שגרונית, לעמוד בדרישות ניסוי שונות ולהבטיח שחזור גבוה.
במחקר זה, אנו מציגים שיטה לביסוס מודל RA באמצעות העברה מאמצת של תאי CD4+ T אדפטיביים מעכברי SKG. בניית מודל זה מסתמכת על בחירת תאי CD4+ T מעכברי SKG עם רקע C57/BL6 ואינדוקציה של מנאן, תהליך המבטיח את הצלחת המודל. ידוע כי עכברי SKG על רקע BALB/c נושאים מוטציה ספונטנית בגן ZAP70 (W163C), הגורמת לבחירת איתות TCR חריגה, מה שמוביל לתאי T בעלי תגובתיות עצמית גבוהה24. התוצאה היא הפעלה מוגזמת של תאי T והופעת סינוביטיס והרס מפרקים, ובכך מחקה תהליכים פתולוגיים מרכזיים של RA כגון תיקון סינוביאלי והפעלת תאי חיסון25,26. המאפיינים הקליניים של עכברי SKG דומים מאוד לאלה של חולי RA אנושיים.
כדי להכניס מוטציה זו לרקע C57BL/6, השתמשנו בטכנולוגיית CRISPR/Cas9 כדי ליצור בהצלחה מודל עכבר SKG C57BL/6-background הנושא את מוטציית ZAP70 (W163C). CRISPR/Cas9 מציע דיוק ויעילות גבוהים, המאפשרים החדרה ממוקדת של המוטציה הרצויה תוך שמירה על שיעור נמוך של החדרה מחוץ למטרה או שינויים גנטיים לא רצויים הקשורים לשיטות אינדוקציה אקראיות מסורתיות, ובכך מבטיח את יציבות המודלוייחודיותו 27,28. חשוב מכך, טכניקה זו גם מפחיתה משמעותית את הזמן הנדרש לבניית מודל, ומשפרת הן את יכולת השליטה והן את היעילות של פיתוח המודל. באמצעות מודל זה, אנו יכולים לשכפל במדויק את הסינוביטיס בתיווך תאי T והרס משותף של RA על רקע C57BL/6. בהשוואה לרקע BALB/C בעכברי SKG מסורתיים, לעכברי מודל על רקע C57BL/6 יש ישימות רחבה יותר במחקר אימונולוגי וניתן לשלב אותם ביתר קלות עם מודלים טרנסגניים אחרים (למשל, Rag1-/- או IL17-/-). זה הופך אותם למתאימים לחקירת תפקידה של מוטציית ZAP70 בדלקת מפרקים שגרונית ובמחלות אוטואימוניות אחרות כגון זאבת אדמנתית מערכתית או טרשת נפוצה.
בהתבסס על התפקיד המרכזישל 29,30 של תאי CD4+ T בהפעלת RA, בחרנו אותם כמתווכים מרכזיים. תאי T הם המניעים העיקריים של תגובות חיסוניות ב-RA ויכולים לגרום ישירות לנזק סינוביאלי על ידי הפעלת תת-קבוצות אפקטור Th1/Th1731, בהתאם לגורמים דלקתיים כמו IL-6, IL-17 ו-TNF-α 32,33. כמתווכים מרכזיים של ויסות חיסוני, תאי CD4+ T מפרישים ציטוקינים פרו-דלקתיים, מפעילים ושומרים על המפל הדלקתי, מה שמוביל להתפשטות סינוביאלית ולנזק למפרקים, ובכך מקדמים ישירות את ההתקדמות הפתולוגית של דלקת מפרקים שגרונית. הם חיוניים בסיוע לתאי B בייצור נוגדנים ספציפיים (למשל, ACPA)34. בינתיים, המאפיין ההיסטופתולוגי האופייני של סינוביום RA הוא הצטברות של תאי CD4+ T. גנים מסוימים של קומפלקס תאימות היסטולוגית עיקרי (MHC) מסוג II, במיוחד "האפיטופים המשותפים" הקשורים לאיזוטיפ אנטיגן-DR של לויקוציטים אנושיים (HLA-DR), נחשבים קשורים קשר הדוק לפתוגנזה של RA35. יתר על כן, האסטרטגיה של חסימת גירוי משותף של תאי T עם אנטיגן 4 הקשור ללימפוציטים T ציטוטוקסיים (CTLA4)-Ig הוכיחה יעילות קלינית משמעותית ב-RA36. בנוסף, אינדוקציה של המנאן משמשת כמפעיל חזק למודל, ומקדם את ההפעלה של רכיבים חיסוניים מולדים כגון תאים דנדריטיים ומקרופאגים37. צעד זה מקל עוד יותר על הפעלת תאי CD4+ T ותגובות חיסוניות, מגביר משמעותית את ההתקפה של מערכת החיסון על רקמות עצמיות, ובכך מדמה את המאפיינים הפתולוגיים של חוסר ויסות חיסוני ונזק סינוביאלי בדלקת מפרקים שגרונית.
לאחר השלמת השראת המודל, ביצענו אימות שיטתי של קבוצת המודל באמצעות מספר פרמטרים, כולל ניקוד קליני של נפיחות במפרקים, אימות פתולוגי (התבוננות בפתולוגיה של רקמת סינוביטיס ומאפיינים של הרס מפרקים), ואימות אימונולוגי (ביטוי של תאי Th1/2/17 ו-Treg בסרום ובטחול). התוצאות הראו כי המודל שלנו שכפל בהצלחה סינוביטיס בתיווך תאי T והרס מפרקים ב-RA, וגרם להפעלה חיסונית אופיינית ושינויים פתולוגיים סינוביאלים התואמים את המנגנונים הפתופיזיולוגיים העיקריים של RA, עם שיעור שכיחות של 100%. ראוי לציין כי במודל שלנו, הציון הקליני של מפרקים נפוחים בעכברים מגיע לשיא בשבוע אחד, מראה ירידה ניכרת בשבוע השני, ואז עולה שוב בהדרגה בשלבים מאוחרים יותר, מה שאינו תואם לחלוטין את מהלך המחלה האופייני שנצפה במודלים קונבנציונליים של בעלי חיים לדלקת מפרקים38. ייתכן שהסיבה לכך היא ששבוע לאחר הזירוז, מערכת החיסון בעכברי המודל נמצאת בשלב ראשוני מופעל באופן אינטנסיבי על ידי הזרקת מנאן, וכתוצאה מכך שיא של דלקת במפרקים. בשבוע השני, ויסות חיסוני ומנגנוני התאוששות עצמית מובילים להקלה זמנית בתסמינים הקליניים. ככל שהמחלה מתקדמת, הסבילות החיסונית דועכת בהדרגה, והתגובה החיסונית מתעצמת מחדש, המתבטאת בהחמרה הדרגתית של המצב בשלבים מאוחרים יותר.
למרות שמודל זה פשוט יחסית למודלים אחרים, עדיין יש כמה נקודות מפתח שצריך להתייחס אליהן במהלך תהליך המידול. ראשית, הפעילות והטוהר של תאי CD4+ T מעכברי SKG מהווים את הבסיס להצלחת המודל. טוהר התאים צריך לעלות על 90% כדי להבטיח את העקביות והאמינות של תוצאות הניסוי. שנית, יש לשלוט בקפידה במהירות ההזרקה לווריד הקנטלי המדיאלי כדי למנוע קרע בווריד מהזרקה מהירה מדי או דליפת תאים מהזרקה איטית מדי. יתר על כן, בחירת מינון התאים היא קריטית. מינון נמוך מדי עלול להוביל לכישלון המודל, בעוד שמינון גבוה מדי עלול לעורר תגובות דלקתיות לא ספציפיות. לכן, במהלך תהליך המידול, יש לעקוב מקרוב אחר מצבם הכללי של העכברים, ולתעד מיד כל תסמינים חריגים כדי להבטיח התקדמות חלקה של הניסוי ותוקף מדעי של הנתונים.
בהשוואה למודלים קונבנציונליים, למודל זה תקופת הקמה קצרה יותר, משיג שיעור היארעות גבוה יותר בעכברי C57BL/6, ונשאר חסכוני יחסית וקל לתפעול. אימוץ העברה של תאי CD4+ T אוטוראקטיביים משחזר במדויק תגובות חיסוניות בתיווך תאי T ולוכד מאפיינים פתולוגיים מרכזיים של דלקת מפרקים שגרונית, כגון נפיחות ונזק במפרקים. יתר על כן, הביטויים הקליניים שלו מתיישבים היטב עם אלה של RA אנושי, ומציעים השתקפות אותנטית יותר של התהליכים הקליניים והפתולוגיים של RA יתר על כן, השילוב של עירוי וריד קנטל מדיאלי ואינדוקציה של מנאן משפר עוד יותר את יכולת השליטה והיציבות הניסיונית, מה שהופך אותו לשחזור מאוד ומציע שליטה ניסויית מצוינת. כמובן שלמודל זה עדיין יש מגבלות. הוא מתמקד בעיקר בתגובות חיסוניות המונעות על ידי תאי T; הסימולציה של התפקידים השיתופיים של תגובות נוגדנים בתיווך תאי B ותאי חיסון אחרים (כגון תאי הרג טבעי (NK) ותאי Treg) אינה מספקת, מה שמקשה על ייצוג מלא של המנגנונים הפתולוגיים הרב-תאיים של RA. עם זאת, מודל עכבר RA זה נותר מודל בעלי חיים יציב ואמין, המספק לחוקרים פלטפורמה טובה יותר לדמות תגובות חיסוניות בתיווך תאי T ואת המאפיינים הפתולוגיים העיקריים של RA. מודל זה מאפשר לחוקרים להתעמק במנגנונים החיסוניים ובהתקדמות הפתולוגית של דלקת מפרקים שגרונית, ומספק ראיות ניסיוניות וכלים חשובים לפיתוח טיפולים חדשים, במיוחד בהבנת חוסר ויסות חיסוני מונע על ידי תאי T וזיהוי מטרות טיפוליות.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהקרן הלאומית למדעי הטבע של סין (82270903, 82401588 ו-81974254) וקרן הפוסט-דוקטורט למדע של סין (2024M751019).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
References
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved