Method Article
Önceden İşlem Görmüş Tümör Hücrelerinin Allojenik Ko-Kültür Ortamında İnsan T Hücresi Aktivitesinin Analizi
Bu Makalede
Özet
Mevcut protokol, önceden tedavi edilmiş tümör hücreleri ile allojenik bir ko-kültür sisteminde insan T hücresi stimülasyonunun ex vivo analizine izin veren deneysel bir iş akışını açıklamaktadır.
Özet
Sitotoksik T hücreleri, tümör hücrelerinin eliminasyonunda önemli bir rol oynar ve bu nedenle kanser immünolojisinde yoğun olarak incelenir. Tümörlerdeki sitotoksik T hücrelerinin sıklığı ve aktivitesi ve bunların tümör mikroçevresi (TME) artık çok sayıda tümör tipi için iyi bilinen prognostik ve prediktif biyobelirteçlerdir. Bununla birlikte, radyoterapi, kemoterapi, immünoterapi ve hedefe yönelik tedavi dahil olmak üzere çeşitli tümör tedavi modalitelerinin sadece tümörün immünojenisitesini değil, aynı zamanda bağışıklık sisteminin kendisini de modüle ettiği iyi bilinmektedir. Sonuç olarak, tümör hücreleri ve T hücreleri arasındaki etkileşim, tümör tedavisi sırasında T hücrelerinin karmaşık rolünü tam olarak anlamak için farklı terapötik bağlamlarda daha yoğun bir çalışma gerektirir. Bu ihtiyacı karşılamak için, önceden tedavi edilmiş tümör hücreleri ile ko-kültürde insan sitotoksik (CD8+) T hücrelerinin aktivitesini ve proliferatif kapasitesini analiz etmek için bir protokol geliştirilmiştir. Spesifik olarak, sağlıklı donörlerden alınan CD8 + T hücreleri, toksik olmayan proliferasyon belirteci karboksifloresein diasetat süksinimidil ester (CFSE) ile boyanır ve CD3 / CD28 kaplı plakalar kullanılarak uyarılır. Daha sonra, T hücreleri önceden tedavi edilmiş tümör hücreleri ile birlikte kültürlenir. Bir okuma olarak, T hücresi proliferasyonu, CFSE sinyal dağılımının ölçülmesi ve akış sitometrisi yoluyla yüzey aktivasyon belirteçlerinin ekspresyonunun değerlendirilmesi ile ölçülür. Bu, enzime bağlı immünosorbent testi (ELISA) kullanılarak sitokin salınımının ölçülmesiyle daha da tamamlanabilir. Bu yöntem, tümör hücreleri ve T hücreleri arasındaki etkileşimde tedaviye bağlı değişikliklerin değerlendirilmesini kolaylaştırır ve tümör tedavi modalitelerinin ve bunların immünojenisitelerinin insan ex vivo ortamında daha ayrıntılı analizleri için bir temel sağlar. Ek olarak, klinik öncesi in vivo analizlerin azaltılmasına katkıda bulunur.
Giriş
Günümüzde, tümörlerin büyümesinin ve ilerlemesinin, konakçının bağışıklık sisteminin etkili bir şekilde manipüle edilmesine ve baskılanmasına güçlü bir şekilde bağlı olduğu giderek daha belirgin hale gelmektedir. Transforme olmuş hücreler, sağlıklı bir organizmada bile her gün ortaya çıkar. Bununla birlikte, makroskopik tümörlerin oluşumu oldukça nadir görülen bir olaydır, çünkü ortaya çıkan transforme hücreler organizmadan yüksek bir verimlilikle uzaklaştırılır. Kötü huylu hücrelerin uzaklaştırılması için sitotoksik T hücreleri, doğal öldürücü (NK)T hücreleri, NK hücreleri veya makrofajlar gibi farklı bağışıklık hücresi tipleri devreye girer 1,2,3. Bununla birlikte, bazen, tümör hücresi klonunun4 farklı immünosupresif stratejileri ile karakterize edilen, konakçının bağışıklık sistemi ile denge durumunda hayatta kalan dönüştürülmüş hücre klonları ortaya çıkabilir. Sonunda, bazı dönüştürülmüş hücreler, tümör hücrelerinin bağışıklık tepkisini aktif olarak baskılamasını sağlayan daha ileri işlevler kazanır ve bu da sonuç olarak tümörün büyümesine yol açar. Bu immünosupresyona, tümör hücreleri üzerinde immünosüpresif ligandların ekspresyonunu veya immün regüle edici veya immünosüpresif immün hücre popülasyonlarının aktif olarak işe alınmasını veya hazırlanmasını içeren çok sayıda mekanizma aracılık eder. Bu sözde immün düzenleme kavramı, tümör oluşumu ve büyümesi sırasında immün modülasyonun anahtar rolünü göstermektedir5.
Bu nedenle, bağışıklık sisteminin günümüzde sadece kanser tedavisinde değil, aynı zamanda birçok tümör varlığında ve terapötik ortamda öngörücü ve prognostik bir faktör olarak ana odak noktası olması şaşırtıcı değildir. Son yıllarda, immün kontrol noktası inhibitörleri (ICI'ler), tümör mikroçevresini (TME) daha verimli bir anti-tümör immün yanıtına ve tümör hücrelerinin azalmış immünosupresyonuna doğru modüle etmek amacıyla baş-boyun skuamöz hücreli karsinomu (HNSCC) veya küçük hücreli dışı akciğer kanseri (KHDAK) gibi farklı katı kanser oluşumlarında umut verici terapötik seçenekler olarak ortaya çıkmıştır6. İmmün kontrol noktası inhibitörleri, programlanmış ölüm proteini 1 (PD-1) ve ligand 1 (PD1 / PD-L1) ekseni gibi bağışıklık kontrol noktası moleküllerini hedefleyerek T hücresi aracılı tümör hücresi öldürmesini artırmayı amaçlar. Bu gerçek, T hücrelerinin anti-tümör bağışıklığındaki kilit rolünü vurgulamaktadır. Örneğin HNSCC'de, ICI'ler tekrarlayan ve metastaz yapmış HNSCC'de birinci basamak tedavi olarak başarıyla onaylanmıştır7. Buna paralel olarak, TME'de sitotoksik T hücrelerinin varlığı ve buna bağlı olarak tümör hücreleri üzerinde PD1 ve PD-L1 ekspresyonu ve buna bağlı olarak T hücreleri, HNSCC 8,9,10'da prediktif biyobelirteçler olarak işlev görebilir.
T hücreleri tümör immünolojisi ve tümör tedavisinde çok önemli bir role sahip olsa da, tümör ile etkileşimleri hakkında birçok açık sorunun hala ele alınması gerekmektedir. Günümüzde, tümör immün yanıtının dinamik bir süreç olduğu ve tümörlerin immünojenisitesinin hastalığın ve tedavilerin seyri boyunca değişebileceği iyi bilinmektedir. Kemoterapi (BT), radyasyon tedavisi (RT) veya hedefe yönelik tedavi (TT) gibi farklı tedavi yöntemlerinin tümör hücrelerinin immünolojik fenotipini modüle ettiği özellikle yaygın olarak bilinmektedir. RT, tümör dokusundaki bağışıklık kontrol noktası moleküllerinin yukarı regülasyonunu sağlayabilir ve tümöre sızan hücrelerin sıklığını değiştirebilir11,12. Öte yandan TT, adaptif immün yanıtın 13,14,15,16 doğrudan modülasyonu ile tümör ve TME içindeki olumlu değişiklikleri de destekleyebilir. Bununla birlikte, bu modülasyonların hastalarda incelenmesi zordur, çünkü bu, tedavi süresince tümör dokusunun tekrar tekrar incelenmesini gerektirecektir. Bu nedenle, tümör hücrelerinin ve T hücrelerinin dinamik immünolojik fenotipini ve daha da önemlisi etkileşimlerini incelemek için kesin deneysel model sistemlerine ihtiyaç vardır.
Bu nedenle, T hücresi aktivitesini ve tümör hücreleri ile T hücrelerinin etkileşimlerini analiz etmek amacıyla, basit hücre kültürü çalışmasına ve yaygın olarak kullanılan akış sitometrisi analizlerine dayanan herhangi bir laboratuvarda uygulanması kolay olan kapsamlı bir ex vivo ko-kültür testine ihtiyaç vardır. Mevcut ve mevcut literatüre dayanarak, şu ana kadar T hücreleri ve tümör hücrelerinin ko-kültürü ile ilgili kullanımı kolay ve yaygın olarak kullanılan bir protokol yayınlanmamıştır. Son zamanlarda T hücreleri ve tümör organoidleri için birkaç ko-kültür testi yayınlanmış olsa da, 3D hücre kültürü tekniği günümüzde hala her laboratuvarda standart bir teknik olarak uygulanmamaktadır. Bu nedenle, gelecekte 3D hücre kültürü için de kurulabilecek olan 2D hücre kültüründe kullanım için bir protokol sunuyoruz. Diğer 2D ko-kültür protokolleri, örneğin tümör hücrelerinin lusiferaz17 ile transdüksiyonunu gerektirdiğinden veya sadece hematolojik maligniteler için uygun olduğundan (eşleşmeyen T hücrelerinin lösemi hücreleri ile ko-kültürü) genellikle daha karmaşıktır18. Burada tarif edilen tahlilde, normal sağlıklı donörlerden alınan T hücreleri periferik kandan izole edilir ve anti-CD3 ve anti-CD28 antikorları ile uyarılır. Daha sonra, T hücreleri, T hücrelerinin proliferatif kapasitesini ve akış sitometrisi yoluyla aktivitelerini analiz etmek için (önceden) tedavi edilmiş tümör hücreleri ile birlikte kültürlenir. Bu nedenle, RT, CT veya TT gibi farklı tedavi yöntemlerinin tümör hücresi immün fenotipi üzerindeki etkileri, bu da T hücresi aktivitesini ve proliferasyonunu etkiler, kolayca taranabilir ve daha derin mekanik analizler ve ardışık seçilmiş klinik öncesi in vivo analizler için bir temel olarak kullanılabilir. Burada açıklanan tahlil, geleneksel olmayan cihazlar, teknikler veya malzemeler gerekmediğinden kullanımı kolay bir kurulum sunar. Ek olarak, tahlil, farklı tümör hücresi hatlarına veya spesifik T hücresi alt kümelerine (örneğin, CD4 + T hücreleri) kolayca uyarlanabilir. Bu teknik kullanılarak yüksek standardizasyon ve tekrarlanabilirlik elde edilir.
Protokol
Bu tahlil, kan çekilmesini ve insan birincil hücrelerinin yetiştirilmesini içerir. Bu nedenle, bu analizler için etik bir oylama zorunludur. Bu yazıda sunulan tüm sonuçlar, IMMO-NHD çalışmasının etik onayı kapsamındadır ve tüm bağışçılardan yazılı bilgilendirilmiş onam alınmıştır. Friedrich-Alexander-Universität Erlangen-Nürnberg kurumsal inceleme kurulu tarafından 9 Kasım 2022'de onay verildi (başvuru numarası 21-415-B). Bu çalışmada kullanılan HSC4 tümör hücreleri, ticari olarak temin edilebilen bir hücre hattındandır.
Bu test, radyoterapi (RT) ve iki spesifik kinaz inhibitörü içeren bir tedavi ortamında insan baş ve boyun skuamöz hücreli karsinom (HNSCC) hücre hattı HSC4 kullanılarak T hücresi ve tümör hücresi ko-kültür testinin tüm adımlarını örneklemektedir. Sonuç olarak, hücre sayıları, tripsinasyon süreleri ve tedavi şemaları gibi parametreler bu ko-kültür ortamına özgüdür ve diğer tümör hücre hatları için uyarlanmalıdır (ayrıca Tartışma bölümüne bakınız). Tüm santrifüjleme aşamaları oda sıcaklığında gerçekleştirildi. Bu çalışmada, kinaz inhibitörleri AZD0156 ve VE-822, HSC4 hücrelerinin DNA hasar onarım (DDR) sistemini hedeflemek için kullanıldı. AZD0156 (Selleckchem) ataksi telenjiektazi mutasyona uğramış (ATM) proteinini inhibe ederken, VE-822 (Selleckchem) ataksi telenjiektazi ve Rad3 ile ilişkili (ATR) proteini hedefler. Her iki inhibitör de tümör hücrelerinde radyosensitiviteyi artırmak için potansiyel ajanlar olarak tartışılmıştır. Dimetil sülfoksit (DMSO) içinde çözülürler ve -20 °C'de saklanırlar. Şekil 1 , CD3 / CD28 ile uyarılmış insan CD8 + T hücreleri ile önceden tedavi edilmiş tümör hücrelerinin ko-kültürünü detaylandıran ex vivo testin bir akış şemasını sağlar. Kullanılan reaktifler ve ekipman Malzeme Tablosunda listelenmiştir.
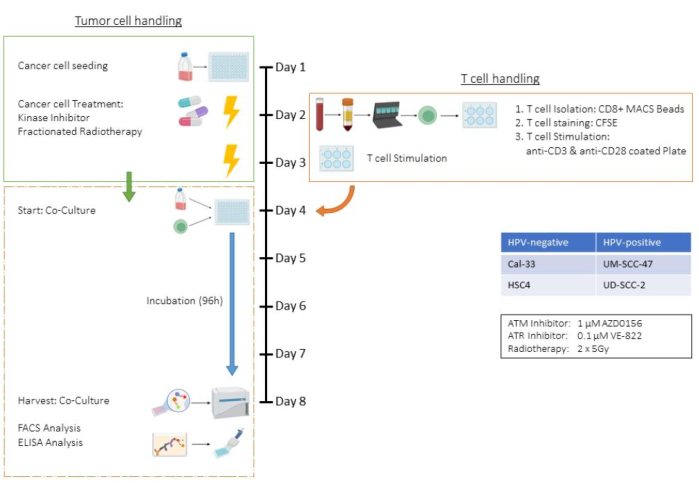
Şekil 1: (CD3/CD28) ile uyarılmış insan CD8+ T hücreleri ile ko-kültürde önceden işlenmiş tümör hücrelerinin ex vivo testinin akış şeması. 1. Gün: HSC4 tümör hücrelerinin tohumlanması. 2. Gün: Tümör hücrelerinin tedavisi ve izolasyonu, CFSE boyama ve insan CD8 + T hücrelerinin CD3 / CD28 kaplı plakalarına tohumlama. 3. Gün: Tümör hücrelerinin tedavisi. 4. Gün: Tümör hücrelerinin temsili kuyularının sayımı. Tüm T hücrelerinin toplanması ve sayımı. T hücrelerinin ve HSC4 tümör hücrelerinin 1:1 oranında birlikte yetiştirilmesi. 5. Gün-8. Gün: Ko-kültür kuluçkası. 8. Gün: Ko-kültürün toplanması, süpernatanların dondurulması, antikor bazlı boyama ve hücrelerin akış sitometrisi ile analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Tümör hücrelerinin tohumlanması (1. Gün)
NOT: Zamanlama: 1 saat. İnsan HSC4 tümör hücreleri, T75 hücre kültürü şişelerinden 96 oyuklu plakalara ekilir.
- Hücre kültürü şişesinin süpernatantını (D10 Medium) atın.
- Tümör hücrelerini 5 mL 37 °C ılık PBS ile yıkayın. PBS'yi atın.
- HSC4 tümör hücreleri, hücre kültürü şişelerine sıkıca yapışma eğiliminde olduğundan, tüm hücrelerin ayrıldığından emin olmak için iki aşamalı tripsinizasyon önerilir. Bunun için 3 mL tripsin ekleyin ve şişeyi 37 °C'de 3 dakika boyunca bir ısıtma plakasına koyun, ardından tripsini bir pipetle atın.
- 3 mL daha tripsin ekleyin, şişeyi ısıtma plakasına yerleştirin ve tek hücreli süspansiyon elde edilene kadar bekleyin. Tek hücreli süspansiyon için mikroskobik olarak kontrol edin.
- Çift hacimli D10 Ortamı (% 10 fetal sığır serumu ve% 1 penisilin-streptomisin ile desteklenmiş DMEM) ekleyerek tripsini durdurun, iyice yeniden askıya alın ve hücreleri 50 mL'lik bir santrifüj tüpüne aktarın.
- Tek hücreli süspansiyonun hücre sayısını belirleyin, ardından toplam hacme göre toplam tümör hücresi miktarını hesaplayın. Hücre sayısının belirlenmesi için bir Neubauer hücre odası önerilir.
- Tümör hücrelerini içeren 50 mL'lik santrifüj tüpünü 300 x g'da oda sıcaklığında 5 dakika santrifüjleyin. Süpernatanı atın.
- 200 μL'lik bir ortamda 15.000 hücre konsantrasyonuna ulaşmak için HSC4 tümör hücrelerini uygun bir D10 Ortamı hacminde yeniden askıya alın.
- Tümör hücrelerinin planlanan tedavilerine göre, her koşul için iki 96 oyuklu plakada 200 μL ortamda 15.000 HSC4 tümör hücresi içeren en az 3 kuyucuklu tohum (1x numune, sadece 1x tümör hücresi kontrolü, ko-kültür günü için 1x hücre sayımı kuyusu).
NOT: Hücre numarası, hücre hattına ve iki katına çıkma süresine bağlıdır. İnkübasyon sırasında% 100 birleşmeyi önlemek için farklı tedaviler için hücre sayısının ön deneylerde incelenmesi gerekir. - Hücreleri 37 ° C ve% 5 CO2 ve doymuş nemde 24 saat inkübe edin.
2. Tümör hücrelerinin tedavisi (2. Gün)
NOT: Zamanlama: 3-5 saat. 24 saatlik bir inkübasyon süresinden sonra, daha önce tohumlanmış HSC4 hücreleri istenen tedavi şemasına göre tedavi edilebilir. Bu örnek durumda, tümör hücreleri bir ATM veya ATR inhibitörü ile tedavi edilir. Burada, ek olarak, iki 96 oyuklu plakadan biri de daha sonra 2x 5 Gy ile ışınlanır.
- Tümör hücrelerini tedavi etmek için 1 μM AZD0156 (ATM inhibitörü) ve 0.1 μM VE-822 (ATR inhibitörü) konsantrasyonu elde etmek için kinaz inhibitörleri hazırlayın.
- Tümör hücrelerini buna göre tedavi edin, örneğin, bir sıra numuneyi 3.1 μL ATM inhibitörü ile ve ikincisini her plakada 3.1 μL ATR inhibitörü ile tedavi edin.
- 37 ° C'de 3-5 saat inkübasyondan sonra, bir plakayı 5 Gy ile ışınlayın.
- 24 saat daha inkübe ettikten sonra, aynı plakayı tekrar 5 Gy ile ışınlayın.
3. T hücre İzolasyonu (2. Gün)
NOT: Zamanlama: 4 saat. CD8 + T hücreleri, sağlıklı yetişkin donörlerden elde edilen periferik kanın (PB) yoğunluk gradyan santrifüjlenmesinden sonra PBMC'lerden anti-CD8 MicroBeads ile manyetik olarak izole edilir. İzole edilen T hücreleri daha sonra CFSE ile boyanır ve stimülasyon için CD3 / CD28 kaplı bir kuyucuk plakasında inkübe edilir. Daha sonraki adımlarda kaynak ve materyal dostu çalışabilmek için, ko-kültür deneyleri için gerekli olan T hücrelerinin miktarını tahmin etmek önemlidir. Vericiye bağlı olarak, yaklaşık 45 ml EDTA kanından 50.000.000 ila 100.000.000 PBMC izole edilebilir. Toplam PBMC'lerin yaklaşık% 10'u CD8 + T hücreleridir.
- Yoğunluk gradyan santrifüjleme
- Sağlıklı bir donörden elde edilen 9 mL'lik 3-5 EDTA'lı kan tüpünü iki adet 50 mL'lik santrifüj tüpüne aktarın.
- Her iki santrifüj tüpünü de PBS +% 2 FBS ile 50 mL'ye kadar doldurun.
- Altı santrifüj tüpü hazırlayın (PBMC'lerin ayrılması için plastik kakma ile) ve her birini 15 mL + 4 °C soğuk yoğunluklu gradyan ortamı ile doldurun.
- Yoğunluk gradyan ortamını, adım 3.1.2'den itibaren 12-15 mL seyreltilmiş kan ile dikkatlice kaplayın.
- 1200 x g'da 10 dakika santrifüjleyin (yavaşlamaya gerek yok).
- T hücresi stimülasyonu için 6 oyuklu bir plakanın hazırlanması
- Antikorları hazırlayın: PBS ile 1 mg / mL'lik bir anti-CD3 (klon OKT3) çözeltisi hazırlayın. PBS ile 0.1 mg / mL'lik bir anti-CD28 (klon 28.2) çözeltisi hazırlayın.
- Öneri: Santrifüjleme sırasındaki süreyi (adım 3.1.5) kaplama çözeltilerinin hazırlanması ve T hücrelerinin uyarılması için kuyucukların kendisinin kaplanması için kullanın.
- 5 μL CD3-antikor çözeltisini 4.995 μL PBS ile ve 50 μL CD28-antikor çözeltisini 4.950 μL PBS ile karıştırın (nihai konsantrasyon: 1 μg / μL).
- 6 oyuklu plakanın her bir oyuğuna her iki antikor çözeltisinden 1.000 μL ekleyin.
- Beklenen T hücresi miktarına bağlı olarak 2 veya 3 oyuklu plakayı kaplayın ve 37 ° C'de en az 2 saat inkübe edin.
- T hücre ortamının hazırlanması
NOT: 100x L-Lizin Hazırlanması: 200 mg L-Lizin hidroklorürü 50 mL'lik bir santrifüj tüpünde 50 mL damıtılmış su içinde çözün. Çözeltiyi 0.2 μm'lik bir şırınga filtresi kullanarak sterilize edin ve 50 mL'lik bir perfüzyon şırıngası kullanarak 50 mL'lik yeni bir tüpe aktarın. Solüsyonu 4-8 ° C'de saklayın ve 3 ay içinde kullanın. 15 mM L-Arginin Hazırlanması: 26 mg L-Arginini 10 mL DPBS'de çözün. Çözeltiyi 0.2 μm'lik bir şırınga filtresi kullanarak sterilize edin ve 10 mL'lik bir şırınga kullanarak yeni bir tüpe aktarın. Solüsyonu 4-8 ° C'de saklayın ve 3 ay içinde kullanın.- T hücresi ortamını hazırlamak için adım 1.5'te belirtildiği gibi santrifüjleme süresini kullanın.
- Beklenen T hücresi miktarına bağlı olarak yaklaşık 10-30 mL T hücresi ortamı hazırlayın.
- L-Arginin ve L-Lizin içermeyen RPMI ortamını %10 ısıyla inaktive edilmiş FBS, %1 penisilin-streptomisin, %1 L-Arginin, %1 L-Lizin ve %1 L-Glutamin ile karıştırın. Örnek: 25.8 mL RPMI ortamı + 3 mL FBS + 0.3 mL Kalem/Strep + 0.3 mL L-Arginin + 0.3 mL L-Lizin + 0.3 mL L-Glutamin.
- Kalan besiyerini 4. günde kullanılmak üzere önümüzdeki iki gün boyunca 4 ° C'de saklayın - Ko-kültür başlangıcı. Tüm deneyin her yeni çalışması için taze bir kültür ortamının hazırlanması önerilir.
- PBMC izolasyonu
- Santrifüjlemeden sonra (adım 3.1.5), süpernatanı dört yeni 50 mL santrifüj tüpüne aktarın ve kullanılmış tüpleri atın.
- Santrifüj tüplerini 50 mL'ye kadar PBS +% 2 FBS ile doldurun.
- Oda sıcaklığında 8 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın, hücre peletini her biri 1 mL PBS +% 2 FBS içinde yeniden süspanse edin ve bunları iki santrifüj tüpünde birleştirin.
- Tüpleri PBS +% 2 FCS ile 50 mL'ye kadar doldurun.
- Oda sıcaklığında 10 dakika boyunca 120 x g'da santrifüjleyin.
- Süpernatanı atın, hücre peletini 1 mL PBS +% 2 FBS'de dikkatlice yeniden süspanse edin ve iki peleti bir şahinde birleştirin.
- Santrifüj tüpünü PBS +% 2 FBS ile 50 mL'ye kadar doldurun.
- Bir Neubauer sayma haznesi kullanarak toplam PBMC sayısını sayın. Öneri: Sayım için hücre süspansiyonunu 1:10 oranında tripan mavisi ile seyreltin.
- CD8+ T hücrelerinin ayrılması
NOT: CD8 + T hücrelerini üreticinin protokolüne göre manyetik olarak ayırmak için manyetik ayırma (MS) sütunları ve manyetik aktif hücre sıralama artı (MACS+) tamponu ile birlikte CD8 MicroBeads insan kullanın (bkz. Malzeme Tablosu).- PBMC'leri (hücre sayımından sonra) 300 x g'da 10 dakika santrifüjleyin.
- Süpernatanı atın ve hücre peletini 107 hücre başına 80 μL MACS+ tamponunda (10 mM EDTA ve% 0.5 BSA ile desteklenmiş 500 mL PBS) yeniden süspanse edin (örneğin, 60.000.000 PBMC, 6 x 80 μL = 480 μL tamponda yeniden süspanse edilir).
NOT: Örnek: 465 mL PBS + 10 mL (0.5 M) EDTA ve 25 mL BSA-Stok çözeltisi. - 107 hücre başına 20 μL CD8 MicroBeads ekleyin ve yukarı ve aşağı pipetleyerek dikkatlice karıştırın. 4 °C'de 15 dakika inkübe edin.
- İnkübasyondan sonra, 107 hücre başına 2 mL MACS+ tamponu ekleyerek hücreleri yıkayın.
- Oda sıcaklığında 10 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı atın ve hücreleri 1.000 μL MACS+ tamponunda yeniden süspanse edin.
- Mıknatısa iki MS sütunu yerleştirin ve altına iki adet 15 mL santrifüj tüpü yerleştirin.
- Sütunları 500 μL MACS+ tamponu ile hazırlayın. Tampon kolonlardan geçer ve altındaki santrifüj tüplerinde toplanabilir. Bu adım, adım 3.5.6'ya paralel olarak da yapılabilir.
- Ardından, hücre süspansiyonunu hazırlanan MS kolonlarına eşit şekilde pipetleyin. Akış, aynı Santrifüj tüplerinde toplanabilir. Artık tüm etiketlenmemiş, CD8 negatif hücreleri içerir.
- 3x 500 μL MACS+ tamponu ekleyerek sütunları temizleyin. Sütunların üzerine yalnızca kuruduktan veya damlaması durduktan hemen sonra yeni bir tampon ekleyin.
- Son toplanan hücreleri "Akış" veya "CD8 negatif" olarak etiketleyin ve bunları tek bir santrifüj tüpünde birleştirin. Bu daha sonra akış sitometrisi yoluyla izolasyonun saflığını ölçmek için kullanılabilir.
- "CD8 + T hücreleri" olarak etiketlenmiş yeni bir 15 mL santrifüj tüpü alın. Kolonlar mıknatıstan çıkarılır ve santrifüj tüpüne yerleştirilir.
- Manyetik olarak etiketlenmiş CD8 pozitif T hücrelerini içeren her iki sütunu da her biri 1.000 μL MACS+ tamponu ile yıkayın. Bu nedenle, tamponu sütunlara pipetleyin ve üretici tarafından sağlanan pistonu kullanarak çözeltiyi hemen sütunlardan dikkatlice dışarı itmeye başlayın.
NOT: Bunu her iki sütun için de yapın, santrifüjlemede 2 mL T hücresi toplam süspansiyonu toplayın. - Bir Neubauer sayma odası kullanarak toplam T hücresi sayısını sayın. Öneri: Tripan mavisi ile 1:4 oranında seyreltme kullanın.
- T hücrelerinin CFSE ile boyanması
- İzole edilmiş T hücrelerini 300 x g'da 5 dakika santrifüjleyin.
- Santrifüjleme sırasında, 1.1 μL CFSE çözeltisini 10 mL PBS içinde karıştırarak CFSE boyama çözeltisini hazırlayın. Nihai konsantrasyonun 1 μM olması gerekir.
- Süpernatanı atın ve hücre peletini 1.000 μL PBS'de yeniden süspanse edin. 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanı atın ve hücre peletini 2000 μL CFSE boyama solüsyonunda (1 μM) yeniden süspanse edin. 37 °C'de 20 dakika inkübe edin.
- Lekeli hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı atın ve hücre peletini 1.000 μL PBS'de yeniden süspanse edin.
- 300 x g'da 5 dakika santrifüjleyin. Süpernatanı atın ve yaklaşık 3-4 mL T hücre ortamında 1.5-2 x 106 T hücre konsantrasyonuna ulaşmak için hücre peletini uygun miktarda T hücresi ortamında yeniden süspanse edin.
- T hücrelerinin 6 oyuklu bir plakaya tohumlanması
- Kaplama çözeltisini 6 oyuklu plakadan atın.
- Tohum: Kuyu başına 3-4 mL T hücre ortamında 1.5-2 milyon izole edilmiş ve boyanmış T hücresi.
- Sonraki 48 saat boyunca T hücrelerini 37 °C'de ve %5CO2'de inkübe edin
NOT: Tohumlama yoğunluğunu her zaman 1,5 Mio hücre / 3 mL'ye ayarlayın. T hücrelerini daha düşük bir yoğunlukta tohumlamaktan kaçının. Daha yüksek bir yoğunluk mümkündür, ancak test edilmesi gerekir.
4. Ko-kültür başlangıcı (4. Gün)
NOT: Zamanlama: 2 saat. HSC4 tümör hücrelerinin hücre sayısı belirlendikten sonra, T hücreleri 96 oyuklu plakalara 1:1 oranında eklenir.
- Temsili bir hücre sayısını belirlemek için koşul başına bir kuyu hasat edilmesi
- Hücre sayısının belirlenmesi için örnek olarak tohumlanan kuyunun süpernatantını atın.
- Önce hücreleri 100 μL PBS ile yıkayın, ardından PBS'yi atın.
- 100 μL tripsin ekleyin ve bir ısıtma plakası üzerinde 5 dakika inkübe edin. Daha sonra tek hücreli süspansiyonu yeniden askıya alın ve mikroskop altında kontrol edin; hücreler ayrılmazsa, 50 μL daha tripsin ekleyin.
- Tüm hücreler ayrılır ayrılmaz, D10 ortamına 100 μL (veya daha önce 50 μL ek tripsin eklenmişse 150 μL) ekleyerek tripsin reaksiyonunu durdurun ve yeniden süspanse edin.
- Kuyucuktan 200 μL'lik tüm hacmi 1.5 mL'lik bir numune tüpüne aktarın ve hücre sayısını ölçmek için 100 μL kullanın. Ölçülen hücre numarasını numune hacmine göre ayarlamayı unutmayın.
- HSC4 tümör hücrelerinin toksik olmayan bir floresan hücre izleme boyası ile boyanması
- 2 μL'yi 20 mL PBS'de (üreticiye göre nihai konsantrasyon 0,1 μM) çözerek hücre izleyiciyi hazırlayın (Malzeme Tablosuna bakın).
- D10 ortamını tümör hücreleri içeren tüm oyuklardan pipetleyin ve atın.
- Tümör hücresi kuyucuklarına 200 μL hücre izleyici solüsyonu ekleyin. 37 °C'de 20 dakika inkübe edin.
- İnkübasyondan sonra, boyama solüsyonunu atın ve 100 μL PBS ekleyerek yıkayın. Daha sonra, PBS'yi de atın.
- 200 μL taze D10 ortamı ekleyin.
- T hücrelerinin toplanması (6 oyuklu plaka)
- T hücrelerini ortamlarında dikkatlice yeniden süspanse edin; çoğu T hücresi süspansiyon halindedir ve sadece kuyularından pipetlenerek hasat edilebilir.
- Kuyuların boş olup olmadığını mikroskobik olarak kontrol edin; değilse, 1.000 μL tripsin kullanarak hasat edin, plakayı T hücreleri ayrılana kadar 37 ° C'de bir ısıtma plakasına yerleştirin, ardından 1.000 μL PBS veya T hücresi ortamı (isteğe bağlı) ekleyerek reaksiyonu durdurun.
- Neubauer sayma odası kullanarak T hücrelerini sayın. Daha sonra T hücrelerini 300 x g'da 5 dakika santrifüjleyin.
- T hücresi ortamındaki T hücrelerini (2. gün T hücresi İzolasyonunda hazırlanan aynı ortamı kullanın) 20 μL'de 10.000 T hücresinin nihai konsantrasyonuna yeniden süspanse edin.
- HSC4 tümör hücrelerine T hücrelerinin eklenmesi (96 oyuklu plaka)
- Daha önce belirlenen tümör hücresi sayısına göre istenilen miktarda T hücresini tümör hücresi kuyucuklarına 1:1 oranında ekleyin.
- "Sadece tümör hücreleri" kontrolü olarak koşul başına bir tümör hücresini T hücrelerinden uzak tutun. Bu "sadece tümör hücresi" kontrolü, akış verilerinin hassas bir şekilde kapılanmasını sağlar.
- Boş bir kuyuya "sadece T hücresi" kontrolüne (200.000 T hücresi) 200 μL T hücresi süspansiyonu ekleyin. Bu "sadece T hücresi" kontrolü, akış verilerinin hassas bir şekilde kapılanmasını sağlar.
- Ko-kültürü 96 saat inkübe edin (37 °C,% 5 CO2)
5. Akış sitometrisi ile T hücresi proliferasyonunun miktarının belirlenmesi (7. Gün)
NOT: Zamanlama: 3 saat. Ko-kültürü 96 saat daha inkübe ettikten sonra, kuyucuklar, araştırma hipotezine bağlı olarak farklı antikorlar içeren bir antikor karışımı ile hasat edilir ve boyanır (örneğin, anti-CD3, CD8, HLA-DR ve CD25-antikorları). Daha sonra, hücreler çok renkli akış sitometrisi ile analiz edilir.
- Hasat edilecek her kuyu için bir grup FACS tüpü ve mikrosantrifüj tüpü hazırlayın ve yazın.
- Hücrelerin toplanması
- Hücreleri ortamlarında yeniden süspanse edin ve bunları FACS tüplerine aktarın.
- Hücreleri 100 μL PBS kullanarak yıkayın, ardından bunu FACS tüplerine aktarın.
- Kuyucuklara 100 μL tripsin ekleyin ve ısıtma plakası (37 °C) üzerinde 5 dakika inkübe edin.
- Hücreleri yeniden askıya alın, ardından tüm hücreler ayrılmışsa mikroskobik olarak kontrol edin. Eğer öyleyse, tripsinasyonlu hücre süspansiyonunu FACS tüplerine aktarın.
- Tüm kuyuların boş olup olmadığını mikroskobik olarak kontrol edin; Aksi takdirde, 5.2.3-5.2.4 adımlarını tekrarlayın.
- Daha fazla deney için ko-kültürün süpernatantının toplanması
- Hücrelerle dolu tüpleri 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanın yaklaşık 300 μL'sini tüplerden ve -20 ° C'de dondurulacak farklı bir mikrosantrifüj tüpü grubuna dikkatlice pipetleyin. Süpernatan daha sonra, salgılanan sitokinleri ölçmek için ELISA tahlilleri yapmak için kullanılabilir.
- Akış sitometrisi yapmak için hücrelerin antikorlarla boyanması
- Antikor karışımı hazırlayın: 5 μL anti-CD3-Krome Orange, 0.5 μL anti-CD8-PerCE-Cyp5.5, 1 μL ANTI-HLA-DR-APCVio770, 2.5 μL anti-CD25-PE-Dazzle'ı 91 μL PBS/FACS tamponuna ekleyin.
- Her tüpe 200 μL FACS tamponu (PBS, %2 FBS ve %2 EDTA ile desteklenmiş) ekleyin ve yeniden süspanse edin.
- 5 dakika boyunca 300 x g'da tekrar santrifüjleyin. Süpernatanı atın ve önceden hazırlanmış antikor karışımının 100 μL'sindeki hücreleri yeniden süspanse edin (adım 5.4.1). Işıktan korunan buzdolabında 4 °C'de 30-45 dakika inkübe edin.
- İnkübasyondan sonra, 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı atın ve hücreleri 100 μL FACS tamponunda yeniden süspanse edin.
- Yukarıda belirtilen tüm floresan antikorları ve CSFE sinyalini ayırt edebilen bir sitometre üzerinde akış sitometrisi gerçekleştirin.
6. Geçit stratejisi ve veri analizi
- İkilileri hariç tutmak ve doğru T hücresi popülasyonunu belirlemek (Şekil 2A).
- Çiftler popülasyonunu ileri vs'ye göre hariç tutun. yan saçılma alanı (FSC-A vs. SSC-A) (Tekli).
- T hücrelerinin ileri vs'ye dayalı olarak tanımlanması için "Singlets" grafiği. yan saçılma alanı (FSC-A vs. SSC-A) (T hücreleri).
NOT: En iyi boyut dışlaması için, "yalnızca T hücreleri" ve "Yalnızca tümör hücreleri" örneklerini paralel olarak ölçün (Şekil 2B). - T hücrelerini ayırt etmek için CD3 ekspresyonunu SSC-A'ya karşı çizin. Ayrıca, CD8 pozitif T hücreleri, CD8 sinyalinin SSC-A'ya karşı çizilmesiyle tanımlanabilir. Tüm T hücreleri CD3+/CD8+ (CD8+ T hücreleri) şeklindedir (Şekil 2A).
- Tüm "CD8+ T hücrelerinin" CFSE sinyalini bir histogram olarak çizin.
NOT: Proliferatif olmayan alt popülasyonun (en yüksek CFSE sinyali), proliferatif alt popülasyonun (CFSE sinyali azalmış tüm T hücreleri) ve yüksek proliferatif alt popülasyonun (4. veya daha az yoğun CFSE zirvesinin tüm T hücreleri) geçitlenmesi.
- T hücresi popülasyonu üzerindeki aktiviteyle ilişkili yüzey belirteçlerinin analizi
- Geçit adımlarını izleyin (adım 6.1) (Şekil 3A).
- Seçenek A: Giriş olarak "CD8+ T hücrelerini" seçin ve SSC-A özelliklerine karşı ilgili yüzey işaretleyici floresansını çizerek CD25 veya HLA-DR ekspresyonları için analiz edin.
NOT: Farklı bir CD25 yüksek alt popülasyonu tespit edilebilirse, CD25 yüksek popülasyon için geçit önerilir. Aynısı, T hücreleri üzerindeki HLA-DR'nin geçitlenmesi/analizi için de geçerlidir (Şekil 3B). - Seçenek B: Giriş olarak "CD8+ T hücrelerini" seçin ve SSC-A özelliklerine karşı ilgili yüzey işaretleyici floresansını çizerek CD25 veya HLA-DR ifadeleri için analiz edin.
NOT: Farklı bir alt popülasyon tespit edilemezse (analiz edilen yüzey işaretleyicisine bağlı olarak), tüm T hücresi popülasyonunun ortalama floresan yoğunluğunun (MFI) kaymasının analizi önerilir (Şekil 3C).
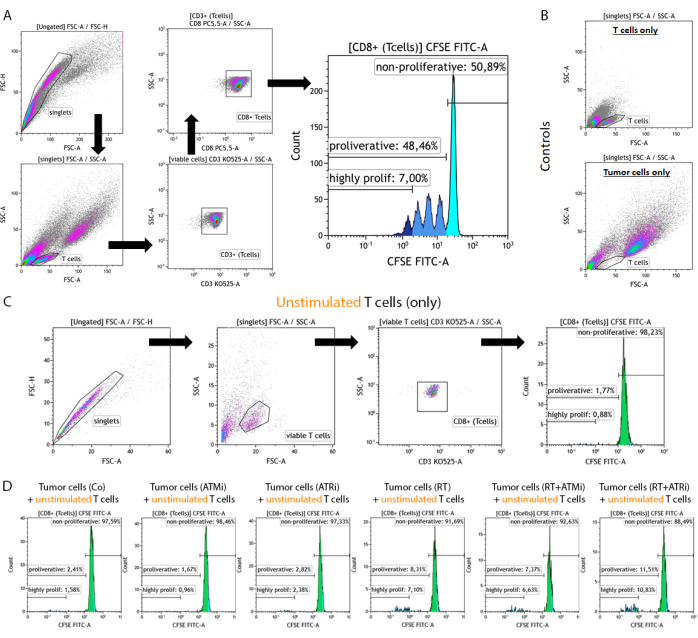
Şekil 2: Önceden tedavi edilmiş HNSCC tümör hücreleri ile 96 saatlik ko-kültür sonrası proliferasyonun analizi için CFSE ile boyanmış, önceden uyarılmış T hücrelerinin geçit stratejisi. T hücreleri ve tümör hücreleri, 96 oyuklu bir plakadan ko-kültürden 96 saat sonra toplanır, T hücresine özgü bir yüzey markörü kullanılarak boyanır ve bir akış sitometri cihazı kullanılarak ölçülür. (A) Çiftler FSC-A/FSC-H'ye göre hariç tutuldu ve T hücreleri önce boyuta göre kapılandı (FSC-A/SSC-A). T hücreleri ayrıca CD3 (anti-CD3 Krome Orange) ve CD8 (anti-CD8 PerCP-Cy5.5) ekspresyonu için analiz edildi. CD3+/CD8+ T hücreleri histogramda çizildi ve CFSE sinyal yoğunluğu analiz edildi. CFSE sinyali, çeşitli proliferasyon davranışına sahip T hücresi alt gruplarını temsil eder. En yüksek CFSE sinyaline sahip T hücreleri "non-proliferatif" olarak tanımlandı. Farklı piklerde sinyalin yarıya inmesine yol açan hücre bölünmesinin neden olduğu CFSE sinyali kaybı gösteren tüm alt popülasyonlar "proliferatif" olarak özetlendi. Üçten fazla kez bölünen T hücreleri (üçten fazla CSFE sinyal zirvesi) "yüksek proliferatif" olarak tanımlandı. (B) Kontrol olarak, sadece önceden uyarılmış T hücrelerinden ve sadece önceden tedavi edilmiş tümör hücrelerinden oluşan numuneler ek olarak ölçülür. T hücreleri ve HSC4 tümör hücreleri, FSC-A ve FSC-A kullanılarak boyuta göre ayırt edilebilir. SCC-A sinyali. Ayrıca, uyarılmamış CD8 + T hücreleri, yalnızca allojenik tümör hücreleri ile birlikte yetiştirmeye dayalı olarak T hücresi aktivasyonunu kontrol etmek için analiz edildi. (C) Kontrol olarak, uyarılmamış CFSE ile boyanmış T hücrelerinin ko-kültüre paralel olarak 96 saat inkübasyonu dahil edildi. (D) Uyarılmamış, CFSE ile boyanmış T hücreleri, önceden tedavi edilmiş tümör hücreleri ile birlikte yetiştirildi. 96 saat sonra hücreler toplandı ve CFSE sinyali standart prosedür kullanılarak ölçüldü. Uyarılmamış T hücreleri, tek başına veya önceden tedavi edilmiş tümör hücreleri ile birlikte yetiştirildikten sonra hiçbir proliferasyon göstermedi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
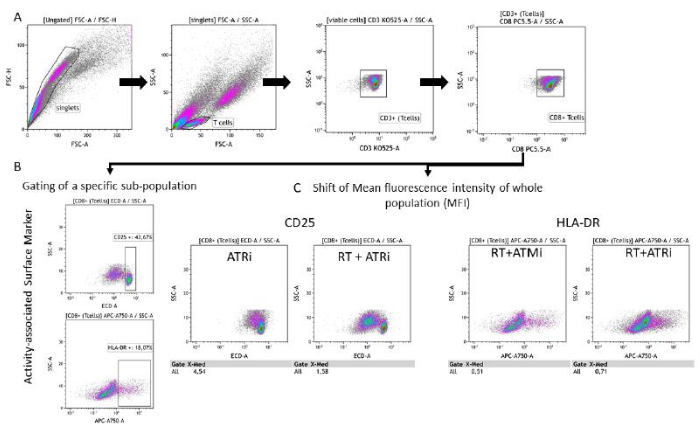
Şekil 3: Ön işlem görmüş HNSCC hücreleri ile 96 saatlik birlikte kültivasyondan sonra T hücresi aktivitesi ile ilişkili yüzey işaretleyici ekspresyonunun (CD25 ve HLA-DR) geçit stratejisi. (A) Çiftler, FSC-A/FSC-H özelliklerine göre dışlandı ve T hücreleri ilk olarak boyuta göre kapılandı (FSC-A/SSC-A). T hücreleri ayrıca CD3 (anti-CD3 Krome Orange) ve CD8 (anti-CD8 PerCP-Cy5.5) ekspresyonu için analiz edildi. CD25 (anti-CD25, PEDazzle594) ve HLA-DR (anti-HLA-DR, APC-Vio770) aktivite belirteçlerinin T hücre yüzeyi üzerine geçitlenmesi iki farklı ortamda gerçekleştirilebilir. (B) Yoğunluk grafiklerine dayalı olarak belirli bir CD25yüksek veya HLA-DRyüksek alt popülasyonunun yüzdesi için tüm CD8 + T hücrelerinin geçitlenmesi. (C) Alternatif olarak, her iki aktivite belirteci için de tüm CD8 + T hücre popülasyonunun MFI kaymasının ölçümü yapılır. HSC4 tümör hücreleri ile birlikte kültürden sonra T hücresi yüzey belirteç ekspresyonunun analizinden elde edilen temsili görüntüler gösterilmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bir HNSCC'den türetilen HSC4 tümör hücreleri tohumlandı ve gece boyunca inkübe edildi. 24 saat sonra, hücreler bir kinaz inhibitörü ile muamele edildi. 3 saat sonra, fraksiyon başına 5 Gy'lik ilk iki doz uygulandı. 24 saat sonra, ikinci doz uygulandı ve hücreler gece boyunca tekrar inkübe edildi. Buna paralel olarak, ko-kültürün başlamasından 48 saat önce, T hücreleri sağlıklı bir donörün kanından izole edildi. İlk olarak, PBMC'ler yoğunluk gradyanlı santrifüj tüpleri ve steril bir ayırma ortamı kullanılarak izole edildi. PBMC'ler bir hücre sayma odası kullanılarak sayıldı ve CD8+ T hücreleri, CD8+ T hücre izolasyon kiti kullanılarak izole edildi. İzole edilen CD8+ T hücreleri daha sonra CFSE (1 μM) ile boyandı ve daha sonra sayıldı. T hücreleri, 1.5 x 106 hücre / 3 mL yoğunluğa sahip CD3 / CD28 önceden kaplanmış kuyu plakalarına ekildi. 48 saatlik stimülasyondan sonra, T hücreleri hasat edildi, sayıldı ve 10.000 hücre / 10 μL yoğunlukta yeniden süspanse edildi. Ek olarak, ekilen tümör hücrelerinin temsili kuyuları hasat edildi ve sayıldı ve ortam, kalan tüm kuyucuklar için değiştirildi. T hücreleri tümör hücrelerine 1:1 oranında eklendi. Ko-kültür 96 saat sonra hasat edildi, süpernatant -20 ° C'de saklandı ve hücreler boyandı ve akış sitometrisi ile ölçüldü (Şekil 1).
T hücreleri boyut dışlanması ve CD3/CD8 pozitifliği ile tanımlandı. CD3 + / CD8 + pozitif hücrelerin CFSE sinyali, proliferatif olmayan T hücrelerinin (yüksek CFSE sinyali) ve çoğalan T hücrelerinin farklı alt popülasyonlarının dağılımını (CFSE sinyal yoğunluğu kaybı) gösterdi. Prolifere olan T hücrelerinin oranı, HSC4 HNSCC hücre hattı için örnek olarak ölçülmüştür (Şekil 4A). En az bir bölünme gösteren tüm T hücreleri "proliferatif" olarak tanımlandı. 3'ten fazla bölünme gösteren T hücreleri "yüksek proliferatif" olarak tanımlandı (Şekil 4B). HPV-negatif hücre hattı HSC4 için, T hücreleri ışınlanmış tümör hücreleri ile birlikte yetiştirildiğinde proliferasyon hızında hafif bir artış tespit edildi. ATR'nin RT ve RT artı inhibisyonu, RT artı ATM inhibisyonu ile tedavi edilen HSC4 hücrelerinin T hücreleri ile ko-kültürlerine kıyasla önemli ölçüde artmış ardışık T hücresi proliferasyonu ile sonuçlandı. T hücrelerinin "yüksek proliferatif" fraksiyonu ile ilgili olarak, HSC4 hücrelerinin RT artı ATR'nin inhibisyonu ile ön muamelesi, T hücresi proliferasyonunu uyarmada en etkili olmuştur (Şekil 4B).

Şekil 4: T hücresi proliferasyonunda HSC4 tedavisine bağlı değişikliklerin analizi için CFSE ile boyanmış T hücrelerinin proliferasyonu. (A) Önceden tedavi edilmiş HPV-negatif HSC4 tümör hücreleri ile 96 saatlik ko-kültürden sonra çoğalan T hücrelerinin oranı. RT + ATMi ile tedavi edilen HSC4 tümör hücreleri ile ko-kültür sonrası T hücresi proliferasyonu, RT veya RT artı ATRi tedavisi ile karşılaştırıldığında anlamlı derecede düşüktü. (B) HSC4 tümör hücrelerinin RT'si, yüksek oranda çoğalan T hücrelerinin daha yüksek bir fraksiyonunu indükledi (üçten fazla hücre bölünmesi. RT + ATRi ön işleme tabi tutulmuş HSC4 tümör hücrelerinin T hücreleri ile ko-kültüründen sonra, yüksek oranda proliferatif T hücrelerinin yüzdesi en yüksekti. Çubuklar, dört bağımsız, sağlıklı donörden alınan T hücreleri ile yapılan dört bağımsız deneyden elde edilen verileri göstermektedir (n = 4; Ortalama ± SD). (*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001; istatistiksel anlamlılık, normal dağılımlı olmayan veriler için iki kuyruklu Mann-Whitney-U kullanılarak tüm deneysel koşulların karşılaştırılmasıyla test edilmiştir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Proliferasyona dayalı CFSE kaybı, T hücresi proliferasyon hızını ölçmek için kullanılabilir. Ayrıca, birkaç hücre yüzeyi markörü, CD25 ve HLADR gibi T hücresi aktivitesi ile ilişkili olarak tanımlanmıştır. Bu nedenle, tüm CD3+ ve CD8+ T hücrelerinin yüzeyindeki CD25 ve HLA-DR'nin akış sitometrisi ile analizi yapıldı (Şekil 5). Farklı CD25yüksek veya HLA-DRyüksek alt popülasyonları tespit edilebiliyorsa ve bu yüksek pozitif hücrelerin geçitlenmesiyle ayırt edilebiliyorsa, ifade ölçülebilir (Şekil 3B). Farklı bir alt popülasyon tespit edilemezse, tüm popülasyonun ortalama floresan yoğunluğu (MFI) ölçülebilir ve MFI'nin duruma dayalı kaymaları ölçülebilir (Şekil 3C).
Örnek olarak, CD25 ve HLA-DR'nin MFI'si tarafından tanımlanan ekspresyon, önceden tedavi edilmiş HSC4 tümör hücreleri ile 96 saatlik ko-kültürden sonra analiz edildi (Şekil 5). T hücrelerinin RT ile muamele edilen HSC4 tümör hücreleri ile ko-kültüründen sonra, T hücreleri üzerindeki CD25 ekspresyonu güçlü bir şekilde aşağı regüle edildi. Özellikle, tümör hücrelerinin sadece ATMi ile ön muamelesi, ATRi ön tedavisine kıyasla önemli ölçüde azalmış bir CD25 ekspresyonu ile sonuçlanmıştır. RT ile kombine ortamda, RT, T hücreleri üzerinde CD25 ekspresyonunun azalmasına neden olsa da, RT'nin ATMi ile kombinasyonu, RT artı ATRi ile karşılaştırıldığında CD25'in artmış ekspresyonu ile sonuçlanmıştır (Şekil 5A). HLA-DR'nin T hücreleri üzerindeki ekspresyonu ile ilgili olarak, RT genellikle HLA-DR'nin yukarı regülasyonuna yol açmıştır, ancak yine ATMi veya ATRi ile kombinasyon halinde farklı bir davranış gözlenmiştir (Şekil 5B). RT + ATRi kombinasyonu ile ön işleme tabi tutulan HSC4 hücreleri ile birlikte kültürlenen T hücreleri, tek başına RT veya RT + ATMi ile karşılaştırıldığında HLA-DR ekspresyonunu arttırdı.
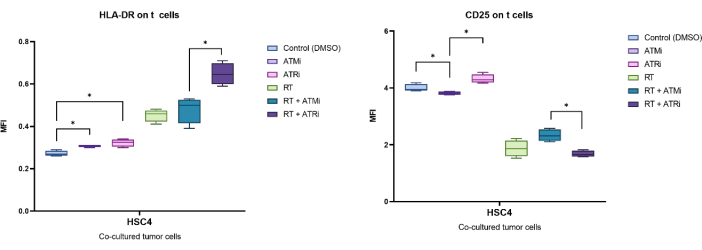
Şekil 5: Ön işlem görmüş HSC4 tümör hücreleri ile 96 saatlik ko-kültürden sonra T hücrelerinin yüzeyinde CD25 ve HLA-DR aktivasyon belirteçlerinin ekspresyonu. CD25 ve HLA-DR ekspresyonu, tüm T hücresi popülasyonunun MFI'sinin kaymasına dayalı olarak analiz edildi. HSC4'ün RT'si, T hücreleri üzerinde CD25 ekspresyonunun azalmasına ve HLA-DR ekspresyonunun artmasına neden oldu. RT'nin ATMi ile kombinasyonu, RT artı ATRi ile karşılaştırıldığında önemli ölçüde farklı ifade modelleriyle sonuçlandı. Kutu grafikleri, dört bağımsız, sağlıklı donörden alınan T hücreleri ile yapılan dört bağımsız deneyden elde edilen verileri göstermektedir (n = 4; Ortalama ± SD). Veriler, normal dağılım göstermeyen veriler için iki kuyruklu Mann-Whitney-U testi kullanılarak tüm deney koşulları birbiriyle karşılaştırılarak analiz edilmiştir (*p≤ 0.050). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu veriler, örnek olarak, tümör hücrelerinin, bu durumda HSC4 HNSCC hücrelerinin tedavisinin, tümör hücrelerinin immünojenisitesini etkilediğini göstermektedir. Bu, tümör hücrelerinin önceden uyarılmış T hücreleri ile birlikte yetiştirilmesiyle izlenebilir, bu da uygulanan tümör hücresi tedavi rejimine dayalı olarak insan T hücreleri üzerinde çeşitli bir proliferasyon davranışına ve aktivasyon belirteçlerinin ekspresyonuna yol açar.
Tartışmalar
Burada sunulan protokol, önceden tedavi edilmiş tümör hücreleri ile bir ko-kültür ortamında T hücrelerinin proliferatif kapasitesini ve aktivasyon durumlarını analiz etmek için hızlı ve kolay bir yöntem sunar. Bu nedenle, RT, CT veya TT gibi farklı tedavi yöntemlerinin T hücre aktivitesi ve proliferasyonu üzerindeki etkileri kolayca taranabilir ve umut verici yaklaşımların daha sonraki daha derin immünolojik analizleri için temel oluşturur. Bu yazıda gösterilen temsili sonuçlar, bu allojenik T hücresi ko-kültür testinin iyi performans gösterdiğini kanıtlamaktadır. Diferansiyel olarak önceden işlenmiş insan HSC4 (HNSCC) hücreleri ile ko-kültür için T hücresi proliferasyonunda ve T hücresi aktivitesinde önemli farklılıklar gözlenmiştir (Şekil 4 ve Şekil 5). HSC4'ün tek başına RT ile veya TT ile kombinasyon halinde tedavisinin, özellikle T hücrelerinin yüksek proliferatif fraksiyonu ile ilgili olarak, T hücrelerinin proliferasyonunun artmasına neden olduğu bulunmuştur (Şekil 4). Proliferasyon hızının ölçülmesine paralel olarak, T hücrelerinin aktivasyon durumu da farklı tedavi rejimlerinden farklı şekilde etkilenmiştir. Özetle, RT uygulaması, T hücreleri üzerindeki CD25 ekspresyonunun güçlü bir şekilde aşağı regülasyonu ile sonuçlanırken, HLA-DR ekspresyonu yukarı regüle edildi. RT, ışınlanmış tümör hücrelerinde DNA hasarına neden olur, bu da stres ve hasarla ilişkili moleküllerin ve sitokinlerin salınmasını ve ayrıca bağışıklık modüle edici hücre yüzeyi ligandlarının19 ekspresyonunu içeren hücresel stres tepkilerine yol açar.
RT'nin DNA onarım inhibitörleri şeklinde TT ile kombinasyonu, tümör hücreleri RT'nin neden olduğu DNA hasarını verimli bir şekilde onaramadığından, bu etkileri daha da arttırır ve sürdürür. Bu, immünojenik faktörlerin salgılanmasını ve immünojenik hücre yüzey ligandlarının20 ekspresyonunu daha da teşvik edebilir ve sürdürebilir. Buna uygun olarak, tümör hücrelerinin (HNSCC) RT ve DNA hasarı inhibitörleri ile tedavisinin tümör hücresi yüzeyindeki immün fenotipi değiştirdiğini daha önce göstermiştik. İmmün fenotipin modülasyonu, bağışıklık uyarıcı molekül ICOS-L'nin yanı sıra bağışıklık baskılayıcı molekül PD-L111'in düzenlenmesini içeriyordu. Tümör hücresi immün fenotipinin bu modülasyonuna yanıt olarak, T hücreleri hücre yüzeylerindeki aktivasyon belirteçlerinin ekspresyonunu da düzenleyebilir. Ayrıca, RT'nin IFNγ veya IL-6 gibi pro-inflamatuar sitokinlerin salınımını uyardığı iyi bilinmektedir, bu da T hücresi proliferasyonunu ve aktivitesinietkiler 21. T hücreleri üzerindeki aktivasyon belirteçlerinin ekspresyonu oldukça dinamik bir süreçtir. Zimmerman ve ark.22'den elde edilen veriler, CD25'in stimülasyondan 24 saat sonra yüksek oranda eksprese edildiğini, ancak stimülasyondan 96 saat sonra tekrar aşağı regüle edildiğini göstermiştir. Bu, bulgularımızla uyumludur. Buna karşılık, HLA-DR bir geç faz aktivasyon belirtecidir ve genellikle CD25 ve CD6923'ün bir artışından önce gelir. Dikkat çekici bir şekilde, RT + ATRi kombinasyonu, RT + ATMi'ye kıyasla T hücreleri üzerinde HLA-DR'nin önemli ölçüde artmasına yol açar. Bu bulgu, ATRi + RT'nin inflamatuar bir TME24'ü indüklemede sinerjik etkilerini gösteren Dillion ve ark.'nın çalışmaları ile uyumludur. T hücresi aktivitesinin ve proliferasyonunun daha az belirgin bir modülasyonu, tek başına kinaz inhibitörleri ile tümör hücresi tedavisi ile elde edildi (Şekil 5). Bunun nedeni, DNA onarım inhibitörleri ATMi ve ATRi'nin, RT'nin neden olduğu DNA hasarının bir arttırıcısı olarak işlev görmesi ve sonuç olarak bir monoterapi olarak uygulandığında çok immünojenik olmaması olabilir. ATMi veya ATRi'nin tek başına minimum toksisitesini zaten gösterdik11. Özetle, sonuçlar RT'nin (ve DNA hasar inhibitörleri ile TT'nin) immünojenik potansiyelini doğrulamakta ve ayrıca bu deneysel sistemin insan baş ve boyun kanseri hücrelerinde farklı tedavi modalitelerinin immünostimülatör kapasitelerini taramak için uygun olduğunu göstermektedir.
Burada sunulan yöntem kolay ve sağlam olsa da, protokolde önceden dikkate alınması gereken bazı kritik adımlar vardır. İzolasyon işlemi sırasında ve ayrıca T hücrelerinin akış sitometrik analizi sırasında yüksek EDTA konsantrasyonlarının varlığı gereklidir. Bu nedenle, donör kanının EDTA kaplı toplama tüplerine toplanması ve verimli T hücresi izolasyonu ve akış sitometrik değerlendirmesi için homojen bir tek hücreli süspansiyonun oluşturulmasını sağlamak için 10 mM EDTA ile desteklenmiş bir MACS tamponu kullanılması önerilir. Ek olarak, T hücresi ortamının bileşimi, T hücrelerinin proliferatif kapasitesi için büyük önem taşır. Farklı kültür ortamı bileşimlerini test ettikten sonra, düşük konsantrasyonlarda L-Arginin ve L-Lizin içeren bir ortam, en iyi T hücresi proliferasyon sinyali ile sonuçlanır, çünkü L-Arginin, T hücresi metabolizması ve sağkalımı için kritik öneme sahiptir ve uygun bir konsantrasyonda sağlanmalıdır25,26. Bununla birlikte, L-Arginin ve L-lizin çözeltilerinin uzun vadede stabil olmadığı ve bu nedenle 3 ay içinde kullanılması gerektiği unutulmamalıdır. Optimal stimülasyon için, amino asitlerle takviye edilmiş T hücresi ortamının her T hücresi yetiştirme deneyi için taze olarak hazırlanması gerekir. Ayrıca, T hücrelerinin hücre sayılarının yanı sıra tümör hücrelerinin hücre sayıları, deneyin okunmasını etkiledikleri için dikkate alınması gereken kritik faktörlerdir.
Tümör hücreleri için, bir yandan, ko-kültür deneyinin sonunda %70 ila %80 arasında hücre birleşmesi arzu edilir. Tümör hücrelerinin aşırı büyümesi, hücre büyümesini inhibe eden faktörlerin salgılanmasına neden olabilir ve daha sonra T hücresi proliferasyon hızını da etkiler. Tümör hücresi büyümesi büyük ölçüde bireysel hücre hattına bağlı olduğundan, ilgili tümör hücresi hattının büyüme davranışının farklı kuyucuk plakalarında ve farklı tedavi rejimleri için kapsamlı bir şekilde test edilmesini öneririz. Ayrıca, tümör hücreleri ve T hücreleri 1: 1 oranında birlikte kültürlenmelidir. Bu nedenle, her tedavi koşulu için, ko-kültürün başladığı gün hücre sayısının belirlenmesi için kullanılabilecek ekstra bir tümör hücresi kuyusu tohumlamak zorunludur. Böylece, farklı tedavi koşulları için uygun sayıda T hücresinin tohumlanacağından emin olunabilir. T hücrelerinin hücre sayısı ile ilgili olarak, sağlıklı bir donörden izole edilebilecek T hücrelerinin miktarının çok bireysel olduğunu göz önünde bulundurmak gerekir. T hücreleri, sağlıklı bir donörün PBMC'lerinin yaklaşık %45 ila %70'ini oluşturur27. Bu nedenle, gerekli T hücresi miktarı, kanın çekilmesi sırasında zaten geniş bir şekilde tahmin edilmelidir. Ayrıca, T hücresi yoğunluğu, T hücresi aktivasyonunun etkinliği ve hayatta kalmaları için önemlidir. Sonuç olarak, T hücreleri, ko-kültür başlangıcından önceki ilk stimülasyon için 3 mL T hücresi ortamında 6 oyuklu bir plakanın oyuğu başına en az 1.5 milyon hücre konsantrasyonunda tohumlanmalıdır. Daha yüksek bir T hücresi yoğunluğu mümkündür, ancak daha düşük bir yoğunluktan kaçınılmalıdır. Aktive edilmiş T hücreleri hücre kümeleri oluşturma eğiliminde olduğundan, T hücrelerinin aktivasyonu mikroskop altında morfolojik olarak da değerlendirilebilir.
Bu yöntem, farklı tümör hücre hatlarının ve tedavi modalitelerinin immünostimülatör kapasitelerini incelemek için basitleştirilmiş bir deneysel sistem olduğundan, dikkate alınması gereken bazı sınırlamaları vardır. İlk olarak, bu test allojenik bir sisteme dayanmaktadır, yani donör T hücrelerinin ilgili tümör hücresi hattı ile HLA eşleşmediği anlamına gelir. Bu nedenle, bu HLA uyumsuzluğu, tümör hücresi tedavisinden daha fazla stimülasyon olmaksızın T hücresi stimülasyonunu ve ardından T hücresi proliferasyonunu zaten indükleyebilir28. Bu istenmeyen etkiyi ölçmek için, izole edilmiş T hücreleri, CD28 ve CD3 antikorları ile önceden uyarılmadan HSC4 hücre hattı ile birlikte kültürlendi. Bu ortamda neredeyse hiç proliferasyonun indüklenmediği bulundu, bu da HLA uyumsuzluğunun bu spesifik deneysel ortamda T hücresi aktivasyonu üzerinde sadece küçük etkileri olduğunu gösteriyor. Ayrıca, allojenik ayara rağmen tümör hücresi tedavisine bağlı olarak T hücre proliferasyonu ve aktivasyonunda anlamlı farklılıklar bulundu. Bununla birlikte, bu testin kurulması için, T hücrelerinin potansiyel allojenik kaynaklı proliferasyonu, deneylerin başında bir kez test edilmeli ve ölçülmelidir. Önerilen "sadece T hücresi" ve "sadece tümör hücresi" kontrolleri, yeterli geçit için gereklidir ve deneylerin her tekrarında zorunludur. Bununla birlikte, allojenik bir ko-kültür sisteminin tümöre özgü antijen tanımadan yoksun olduğu akılda tutulmalıdır. Bu nedenle, bu sistem, hastalarda in vivo olarak ortaya çıkacağı gibi, spesifik anti-tümör yanıtını doğru bir şekilde yansıtmayabilir29,30. Daha fazla iyileştirme için, daha sofistike bir ortam, otolog bir ortak kültür yaklaşımı olacaktır. Bu ortamda, hasta kaynaklı tümör biyopsilerinin ekleştirilmesi ve aynı hastanın periferik kanından izole edilen T hücreleri ile kültüre alınması gerekir28. Bununla birlikte, bu deneysel yaklaşım, yalnızca birincil tümör hücrelerinin kültürlenmesi açısından değil, aynı zamanda hasta kaynaklı biyomateryalin mevcudiyeti açısından da zorlayıcı olabilir. Dikkate alınması gereken bir diğer sınırlama, ko-kültürdeki tümör hücrelerinin ve T hücrelerinin oranıdır. Önerilen hücre oranı 1:1 olduğundan, bu oran hastalarda TME'nin fizyolojik durumunu yansıtmamaktadır31. Bununla birlikte, bu sınırlama kabul edilmelidir, çünkü daha düşük T hücresi sayımlarında olduğu gibi, proliferasyon hızı ve aktivasyon durumundaki değişiklikler ölçülebilir değildir.
Tümör immünolojisi alanında, bu test, farklı tedavi modalitelerinin immünojenisitesini kolay ve hızlı bir deneysel in vitro ortamda tarama fırsatı sunar. Bu nedenle, immünojenisite açısından en umut verici yaklaşımların ön taramasıyla değil, aynı zamanda in vivo deneylerle de zaman kazanılabilir. Hayvan modelleri azaltılabilir, çünkü hayvan modellerinde bir organizmadaki bağışıklık sistemini bir bütün olarak yansıtmak için yalnızca umut verici tedavi şemaları daha fazla takip edilebilir. Ayrıca, bu tahlil insan birincil hücrelerine ve insan kanser hücre hatlarına dayandığından, sonuçlar diğer model sistemlere ve türlere dayanan tahlillerden daha fazla kliniğe çevrilebilir olabilir.
Gelecekte, bu test daha spesifik araştırma sorularını yanıtlamak için modüle edilebilir ve uyarlanabilir. Örneğin, hastalardaki duruma daha yakın bir tedavi senaryosunu yansıtmak için T hücrelerinin bir tedavisi dahil edilebilir. Tümöre duyarlı T hücreleri çoğunlukla TME'de bulunduğundan, RT gibi lokal tedavilerden eşit derecede etkilenirler ve muhtemelen BT veya TT32 gibi sistemik tedavilerden de etkilenirler. Testin daha da geliştirilmesi, T hücrelerinin tümör hücre dizilerinden tümör sferoidleri ile birlikte yetiştirilmesi veya hatta hasta kaynaklı tümör organoidleri ile birlikte yetiştirilmesidir. Bu üç boyutlu kültürler, bir hastadaki bir tümörün yapısına daha çok benzemektedir28. Son olarak, deneyin akış sitometrisi yoluyla okunması, T hücrelerinin yüzeyindeki diğer molekülleri araştırmak veya tümör hücreleri üzerindeki bağışıklık kontrol noktası moleküllerinin ekspresyonunu analiz etmek için kolayca uyarlanabilir. T hücrelerinin immün fenotipinin belirlenmesine ek olarak, T hücresi aktivitesi hakkında daha fazla bilgi edinmek için salgılanan sitokinlerin veya kemokinlerin nicelleştirilmesi için ko-kültür deneylerinden elde edilen hücre kültürü süpernatantları kullanılabilir. Özetle, bu protokol, farklı kanser tedavi modalitelerinin immünojenisitesinin taranmasına izin veren kapsamlı, sağlam ve kolay bir T hücresi ve tümör hücresi ko-kültür testi sunar. Bu test spesifik araştırma sorularına uyarlanabilir olduğundan, geniş tümör immünolojisi alanında uygulama için çok uygundur.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırma kısmen Disiplinlerarası Klinik Araştırma Merkezi Erlangen (IZKF Erlangen) ve Bayerisches Zentrum für Krebsforschung (BZKF) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
Referanslar
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır