Method Article
Análisis de la actividad de las células T humanas en un entorno de cocultivo alogénico de células tumorales pretratadas
En este artículo
Resumen
El presente protocolo describe un flujo de trabajo experimental que permite el análisis ex vivo de la estimulación de células T humanas en un sistema de cocultivo alogénico con células tumorales pretratadas.
Resumen
Las células T citotóxicas desempeñan un papel clave en la eliminación de las células tumorales y, por lo tanto, se estudian intensamente en la inmunología del cáncer. La frecuencia y la actividad de las células T citotóxicas dentro de los tumores y su microambiente tumoral (TME) son ahora biomarcadores pronósticos y predictivos bien establecidos para numerosos tipos de tumores. Sin embargo, es bien sabido que varias modalidades de tratamiento tumoral, como la radioterapia, la quimioterapia, la inmunoterapia y la terapia dirigida, modulan no solo la inmunogenicidad del tumor, sino también el propio sistema inmunitario. En consecuencia, la interacción entre las células tumorales y las células T requiere un estudio más intensivo en diferentes contextos terapéuticos para comprender completamente el complejo papel de las células T durante la terapia tumoral. Para abordar esta necesidad, se desarrolló un protocolo para analizar la actividad y la capacidad proliferativa de las células T citotóxicas humanas (CD8+) en cocultivo con células tumorales pretratadas. En concreto, los linfocitos T CD8+ de donantes sanos se tiñen con el marcador de proliferación no tóxico éster de succinimidilo de diacetato de carboxifluoresceína (CFSE) y se estimulan con placas recubiertas de CD3/CD28. Posteriormente, las células T se cocultivan con células tumorales pretratadas. Como lectura, la proliferación de células T se cuantifica midiendo la distribución de la señal CFSE y evaluando la expresión de marcadores de activación de superficie mediante citometría de flujo. Esto se puede complementar con la cuantificación de la liberación de citocinas mediante un ensayo de inmunoabsorción ligado a enzimas (ELISA). Este método facilita la evaluación de los cambios inducidos por el tratamiento en la interacción entre las células tumorales y las células T, proporcionando una base para análisis más detallados de las modalidades de tratamiento tumoral y su inmunogenicidad en un entorno humano ex vivo . Además, contribuye a la reducción de los análisis preclínicos in vivo .
Introducción
Hoy en día, se hace cada vez más evidente que el crecimiento y el progreso de los tumores dependen en gran medida de la manipulación y supresión efectivas del sistema inmunológico del huésped. Las células transformadas emergen todos los días, incluso en un organismo sano. Sin embargo, la formación de tumores macroscópicos es un evento bastante raro, ya que las células transformadas emergentes se eliminan del organismo con una alta eficiencia. Para la eliminación de células malignas, entran en acción diferentes tipos de células inmunitarias, como las células T citotóxicas, las células T asesinas naturales (NK), las células NK o los macrófagos 1,2,3. Sin embargo, en ocasiones pueden surgir clones de células transformadas que sobreviven en un estado de equilibrio con el sistema inmune del huésped, que se caracteriza por diferentes estrategias inmunosupresoras del clon de células tumorales4. Con el tiempo, algunas células transformadas adquieren funciones adicionales que permiten a las células tumorales suprimir activamente la respuesta inmunitaria, lo que en consecuencia conduce al crecimiento del tumor. Esta inmunosupresión está mediada por numerosos mecanismos, que incluyen la expresión de ligandos inmunosupresores en las células tumorales o el reclutamiento activo o cebado de poblaciones de células inmunitarias inmunorreguladoras o inmunosupresoras. Este concepto de edición inmunitaria demuestra el papel clave de la modulación inmunitaria durante la formación y el crecimientotumoral 5.
Por lo tanto, no es de extrañar que el sistema inmunitario sea hoy en día un foco importante no solo en la terapia del cáncer, sino también como factor predictivo y pronóstico en muchas entidades tumorales y entornos terapéuticos. Durante los últimos años, los inhibidores de puntos de control inmunitario (ICI) se han presentado como opciones terapéuticas prometedoras en diferentes entidades cancerosas sólidas, como el carcinoma de células escamosas de cabeza y cuello (HNSCC) o el cáncer de pulmón de células no pequeñas (CPNM) con el objetivo de modular el microambiente tumoral (TME) hacia una respuesta inmunitaria antitumoral más eficiente y una inmunosupresión disminuida de las células tumorales6. Los inhibidores de puntos de control inmunitario tienen como objetivo estimular la destrucción de células tumorales mediada por células T dirigiéndose a moléculas de puntos de control inmunitario como las de la proteína de muerte programada 1 (PD-1) y su eje ligando 1 (PD1/PD-L1). Este hecho subraya el papel clave de las células T en la inmunidad antitumoral. En el HNSCC, por ejemplo, los ICI han sido aprobados con éxito como tratamiento de primera línea en el HNSCC recurrente y con metástasis7. En línea con esto, la presencia de linfocitos T citotóxicos en el TME, así como la expresión de PD1 y PD-L1 en las células tumorales y, en consecuencia, en los linfocitos T, pueden servir como biomarcadores predictivos en el HNSCC 8,9,10.
A pesar de que las células T tienen un papel crucial en la inmunología tumoral y la terapia tumoral, aún es necesario abordar muchas preguntas abiertas sobre sus interacciones con el tumor. Hoy en día, es bien sabido que la respuesta inmune tumoral es un proceso dinámico y que la inmunogenicidad de los tumores puede cambiar a lo largo del curso de la enfermedad y de los tratamientos. Las diferentes modalidades de tratamiento, como la quimioterapia (TC), la radioterapia (RT) o la terapia dirigida (TT), son especialmente conocidas para modular el fenotipo inmunológico de las células tumorales. La RT puede impulsar la regulación positiva de las moléculas de puntos de control inmunitario en el tejido tumoral y alterar la frecuencia de las células que se infiltran en el tumor11,12. La TT, por otro lado, también puede respaldar cambios favorables dentro del tumor y la EMT mediante la modulación directa de la respuesta inmune adaptativa 13,14,15,16. Sin embargo, estas modulaciones son difíciles de estudiar en los pacientes, ya que esto requeriría el examen repetitivo del tejido tumoral durante el curso del tratamiento. Por lo tanto, se necesitan sistemas modelo experimentales concluyentes para estudiar el fenotipo inmunológico dinámico de las células tumorales y las células T y, lo que es más importante, sus interacciones.
Por lo tanto, con el fin de analizar la actividad de las células T y las interacciones de las células tumorales y las células T, se necesita un ensayo de cocultivo ex vivo completo que sea fácil de implementar en cualquier laboratorio basado en un trabajo de cultivo celular sencillo y análisis de citometría de flujo de uso común. Sobre la base de la bibliografía existente y disponible, hasta el momento no se ha publicado un protocolo fácil de usar y de uso común con respecto al cocultivo de células T y células tumorales. A pesar de que últimamente se han publicado varios ensayos de cocultivo para linfocitos T y organoides tumorales, la técnica de cultivo celular en 3D todavía no se ha implementado como una técnica estándar en todos los laboratorios. Por lo tanto, proporcionamos un protocolo para el uso en el cultivo celular 2D, que bien podría establecerse para el cultivo celular 3D en el futuro. Otros protocolos de cocultivo 2D suelen ser más complejos, ya que requieren, por ejemplo, la transducción de células tumorales con luciferasa17 o solo son adecuados para neoplasias hematológicas (cocultivo de linfocitos T no emparejados con células leucémicas)18. En el ensayo descrito aquí, las células T de donantes sanos normales se aíslan de la sangre periférica y se estimulan con anticuerpos anti-CD3 y anti-CD28. Posteriormente, las células T se cocultivan con células tumorales (pre)tratadas para analizar la capacidad proliferativa de las células T, así como su actividad, mediante citometría de flujo. De este modo, los efectos de las diferentes modalidades de tratamiento sobre el fenotipo inmunitario de las células tumorales, como la RT, la TC o la TT, que a su vez influyen en la actividad y proliferación de las células T, pueden examinarse fácilmente y utilizarse como base para análisis mecanicistas más profundos y análisis preclínicos in vivo seleccionados consecutivamente. El ensayo descrito aquí ofrece una configuración fácil de usar, ya que no se necesitan dispositivos, técnicas o materiales no convencionales. Además, el ensayo se puede adaptar fácilmente a diferentes líneas celulares tumorales o subconjuntos específicos de células T (por ejemplo, células T CD4+). Con esta técnica, se logra una alta estandarización y reproducibilidad.
Protocolo
Este ensayo implica extracciones de sangre y el cultivo de células primarias humanas. Por lo tanto, es obligatorio un voto ético para estos análisis. Todos los resultados presentados en este manuscrito están cubiertos por la aprobación ética del ensayo IMMO-NHD, y se obtuvo el consentimiento informado por escrito de todos los donantes. La aprobación fue otorgada por la junta de revisión institucional de la Friedrich-Alexander-Universität Erlangen-Nürnberg el 9 de noviembre de 2022 (solicitud número 21-415-B). Las células tumorales HSC4 utilizadas en este estudio provienen de una línea celular disponible comercialmente.
Este ensayo ejemplifica todos los pasos del ensayo de cocultivo de células T y células tumorales, utilizando la línea celular HSC4 del carcinoma de células escamosas de cabeza y cuello humano (HNSCC) en un entorno de tratamiento que incluye radioterapia (RT) y dos inhibidores específicos de la cinasa. Por lo tanto, parámetros como el número de células, los tiempos de tripsinización y los esquemas de tratamiento son específicos de este entorno de cocultivo y deben adaptarse para otras líneas celulares tumorales (consulte también la sección Discusión). Todos los pasos de centrifugación se realizaron a temperatura ambiente. En este estudio, los inhibidores de la quinasa AZD0156 y VE-822 se utilizaron para dirigirse al sistema de reparación de daños en el ADN (DDR) de las células HSC4. AZD0156 (Selleckchem) inhibe la proteína mutada de la ataxia telangiectasia (ATM), mientras que VE-822 (Selleckchem) se dirige a la ataxia telangiectasia y a la proteína relacionada con Rad3 (ATR). Ambos inhibidores se han discutido como agentes potenciales para aumentar la radiosensibilidad en las células tumorales. Se disuelven en dimetilsulfóxido (DMSO) y se almacenan a -20 °C. La Figura 1 proporciona un diagrama de flujo del ensayo ex vivo , en el que se detalla el cocultivo de células tumorales pretratadas con células T CD8+ humanas estimuladas por CD3/CD28. Los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
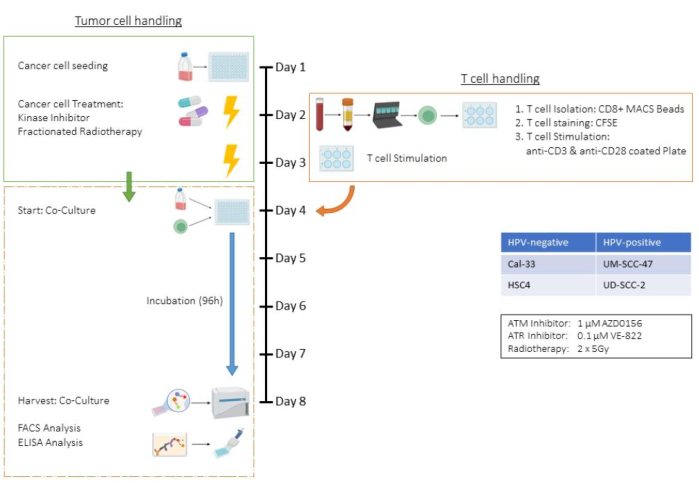
Figura 1: Diagrama de flujo del ensayo ex vivo de células tumorales pretratadas en cocultivo con células T CD8+ humanas estimuladas con (CD3/CD28). Día 1: Siembra de células tumorales HSC4. Día 2: Tratamiento de células tumorales y aislamiento, tinción de CFSE y siembra en placas recubiertas de CD3/CD28 de células T CD8+ humanas. Día 3: Tratamiento de las células tumorales. Día 4: Recuento de pocillos representativos de células tumorales. Recolección y recuento de todas las células T. Cultivo conjunto de células T y células tumorales HSC4 en una proporción de 1:1. Día 5-Día 8: Incubación en cocultivo. Día 8: Cosecha de cocultivo, congelación de sobrenadantes, tinción basada en anticuerpos y análisis de las células por citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
1. Siembra de células tumorales (Día 1)
NOTA: Duración: 1 h. Las células tumorales HSC4 humanas se siembran a partir de frascos de cultivo celular T75 en placas de 96 pocillos.
- Deseche el sobrenadante (medio D10) del frasco de cultivo celular.
- Lave las células tumorales con 5 mL de PBS tibio a 37 °C. Deseche PBS.
- Dado que las células tumorales HSC4 tienden a adherirse firmemente a los matraces de cultivo celular, se recomienda la tripsinización en dos pasos para garantizar que todas las células se desprendan. Para ello, agregue 3 ml de tripsina y coloque el frasco en una placa calefactora a 37 °C durante 3 min, luego deseche la tripsina con una pipeta.
- Agregue otros 3 ml de tripsina, coloque el frasco en la placa calefactora y espere hasta que se logre la suspensión de una sola celda. Compruebe microscópicamente si hay suspensión unicelular.
- Detenga la tripsina añadiendo el doble volumen de D10 Medium (DMEM suplementado con un 10% de suero fetal bovino y un 1% de penicilina-estreptomicina), resuspenda a fondo y transfiera las células a un tubo de centrifugación de 50 mL.
- Determine el número de células de suspensión de una sola célula, luego calcule la cantidad total de células tumorales de acuerdo con el volumen total. Se recomienda una cámara de células de Neubauer para la determinación del recuento de células.
- Centrifugar el tubo de centrifugación de 50 ml que contiene las células tumorales a 300 x g durante 5 min a temperatura ambiente. Deseche el sobrenadante.
- Resuspenda las células tumorales HSC4 en un volumen adecuado de medio D10 para alcanzar una concentración de 15.000 células en un medio de 200 μL.
- De acuerdo con los tratamientos planificados de las células tumorales, siembre para cada condición al menos 3 pocillos que contengan 15.000 células tumorales HSC4 en un medio de 200 μL en dos placas de 96 pocillos (1x muestra, 1x control solo de células tumorales, 1x pozo de recuento de células para el día de cocultivo).
NOTA: El número de celdas depende de la línea celular y del tiempo de duplicación. El número de células para los diferentes tratamientos debe examinarse en los experimentos previos para evitar la confluencia del 100% durante la incubación. - Incubar las células durante 24 h a 37 °C y 5% de CO2 y humedad saturada.
2. Tratamiento de las células tumorales (Día 2)
NOTA: Duración: 3-5 h. Después de un tiempo de incubación de 24 h, las células HSC4 previamente sembradas se pueden tratar de acuerdo con el esquema de tratamiento deseado. En este caso ejemplar, las células tumorales se tratan con un inhibidor de ATM o ATR. Aquí, además, una de las dos placas de 96 pocillos también se irradia con 2 x 5 Gy después.
- Prepare inhibidores de cinasas para obtener una concentración de 1 μM AZD0156 (inhibidor de ATM) y 0,1 μM de VE-822 (inhibidor de ATR) para tratar las células tumorales.
- Trate las células tumorales en consecuencia, por ejemplo, tratando una fila de muestras con 3,1 μL del inhibidor de ATM y una segunda con 3,1 μL del inhibidor de ATR en cada placa.
- Después de 3-5 h de incubación a 37 °C, irradiar una placa con 5 Gy.
- Después de incubar durante otras 24 h, vuelva a irradiar la misma placa con 5 Gy.
3. Aislamiento de células T (día 2)
NOTA: Tiempo: 4 h. Las células T CD8+ se aíslan magnéticamente con MicroBeads anti-CD8 de PBMC después de la centrifugación en gradiente de densidad de sangre periférica (PB) derivada de donantes adultos sanos. A continuación, las células T aisladas se tiñen con CFSE y se incuban en una placa de pocillos recubierta de CD3/CD28 para su estimulación. Para poder trabajar de forma respetuosa con los recursos y el material en los pasos posteriores, es importante estimar la cantidad de células T que se necesitan para los experimentos de cocultivo. Dependiendo del donante, se pueden aislar entre 50.000.000 y 100.000.000 de PBMC de unos 45 ml de sangre con EDTA. Alrededor del 10% del total de PBMC son células T CD8+.
- Centrifugación en gradiente de densidad
- Transfiera 3-5 tubos de sangre con EDTA de 9 mL derivados de un donante sano a dos tubos de centrifugación de 50 mL.
- Llene ambos tubos de centrifugación hasta 50 mL con PBS + 2% FBS.
- Prepare seis tubos de centrifugación (con incrustación de plástico para la separación de PBMC) y llene cada uno con 15 mL de medio de gradiente de densidad fría de + 4 °C.
- Cubra cuidadosamente el medio de gradiente de densidad con 12-15 mL de la sangre diluida del paso 3.1.2.
- Centrifugar a 1200 x g durante 10 min (no es necesario desacelerar).
- Preparación de una placa de 6 pocillos para la estimulación de células T
- Preparar anticuerpos: Prepare una solución anti-CD3 (clon OKT3) de 1 mg/mL con PBS. Prepare una solución anti-CD28 (clon 28.2) de 0,1 mg/mL con PBS.
- Recomendación: utilizar el tiempo durante la centrifugación (paso 3.1.5) para la preparación de soluciones de recubrimiento y el recubrimiento de los pocillos en sí para la estimulación de las células T.
- Mezclar 5 μL de solución de anticuerpos CD3 con 4,995 μL de PBS y 50 μL de solución de anticuerpos CD28 con 4,950 μL de PBS (concentración final: 1 μg/μL).
- Agregue 1.000 μL de ambas soluciones de anticuerpos a cada pocillo de la placa de 6 pocillos.
- Cubrir 2 o 3 pocillos, dependiendo de la cantidad esperada de células T, de la placa de 6 pocillos e incubar durante al menos 2 h a 37 °C.
- Preparación del medio de células T
NOTA: Preparación de 100x L-Lisina: Disuelva 200 mg de clorhidrato de L-Lisina en 50 mL de agua destilada en un tubo de centrífuga de 50 mL. Esterilice la solución con un filtro de jeringa de 0,2 μm y transfiérala a un nuevo tubo de 50 ml con una jeringa de perfusión de 50 mL. Almacene la solución a 4-8 °C y utilícela en un plazo de 3 meses. Preparación de 15 mM de L-Arginina: Disolver 26 mg de L-Arginina en 10 mL de DPBS. Esterilice la solución con un filtro de jeringa de 0,2 μm y transfiérala a un nuevo tubo con una jeringa de 10 ml. Almacene la solución a 4-8 °C y utilícela en un plazo de 3 meses.- Utilice el tiempo de centrifugación como se menciona en el paso 1.5 para preparar el medio de células T.
- Prepare alrededor de 10-30 mL de medio de células T, dependiendo de la cantidad esperada de células T.
- Mezcle el medio RPMI libre de L-arginina y L-lisina con un 10% de FBS inactivado por calor, un 1% de penicilina-estreptomicina, un 1% de L-arginina, un 1% de L-lisina y un 1% de L-glutamina. Ejemplo: 25,8 mL de medio RPMI + 3 mL de FBS + 0,3 mL de Pen/Strep + 0,3 mL de L-Arginina + 0,3 mL de L-lisina + 0,3 mL de L-Glutamina.
- Almacene el medio restante a 4 °C durante los dos días siguientes para utilizarlo el día 4 - Inicio del cocultivo. Para cada nueva ejecución de todo el experimento, se recomienda que se prepare un medio de cultivo nuevo.
- Aislamiento de PBMC
- Después de la centrifugación (paso 3.1.5), transfiera el sobrenadante a cuatro nuevos tubos de centrifugación de 50 mL y deseche los tubos usados.
- Llene los tubos de centrifugación hasta 50 mL con PBS + 2% FBS.
- Centrifugar a 300 x g durante 8 min a temperatura ambiente.
- Deseche el sobrenadante, vuelva a suspender el pellet celular en 1 mL de PBS + 2% FBS cada uno y combínelos en dos tubos de centrifugación.
- Vuelva a llenar los tubos a 50 mL con PBS + 2% FCS.
- Centrifugar a 120 x g durante 10 min a temperatura ambiente.
- Deseche el sobrenadante, vuelva a suspender con cuidado el pellet de la celda en 1 mL de PBS +2% FBS y combine los dos pellets en un halcón.
- Llene el tubo de centrifugación hasta 50 mL con PBS + 2% FBS.
- Cuente el número total de PBMC utilizando una cámara de recuento de Neubauer. Recomendación: diluir la suspensión celular 1:10 con azul de tripán para el conteo.
- Separación de linfocitos T CD8+
NOTA: Utilice CD8 MicroBeads humano junto con columnas de separación magnética (MS) y tampón de clasificación de células activadas magnéticamente plus (MACS+) para separar magnéticamente las células T CD8+ de acuerdo con el protocolo del fabricante (consulte la Tabla de materiales).- Centrifugar las PBMC (después del recuento de células) a 300 x g durante 10 min.
- Deseche el sobrenadante y vuelva a suspender el pellet celular en 80 μL de tampón MACS+ (500 mL de PBS suplementado con 10 mM de EDTA y 0,5% de BSA) por cada 107 células (por ejemplo, se resuspenden 60.000.000 de PBMC en 6 x 80 μL = 480 μL de tampón).
NOTA: Ejemplo: 465 mL de PBS + 10 mL (0,5 M) de EDTA y 25 mL de solución BSA-Stock. - Agregue 20 μL de CD8 MicroBeads por cada 107 celdas y mezcle cuidadosamente pipeteando hacia arriba y hacia abajo. Incubar durante 15 min a 4 °C.
- Después de la incubación, lave las células añadiendo 2 ml de tampón MACS+ por cada 107 células.
- Centrifugar a 300 x g durante 10 min a temperatura ambiente. Deseche el sobrenadante y vuelva a suspender las células en 1.000 μL de tampón MACS+.
- Coloque dos columnas MS en el imán y coloque dos tubos de centrifugación de 15 mL debajo.
- Prepare las columnas con un tampón MACS+ de 500 μL. El tampón corre a través de las columnas y se puede recoger en los tubos de centrifugación que se encuentran debajo. Este paso también se puede realizar en paralelo al paso 3.5.6.
- A continuación, pipetee la suspensión de la célula por igual en las columnas de MS preparadas. El flujo se puede recoger en los mismos tubos de centrifugación. Ahora contiene todas las células CD8 negativas sin etiquetar.
- Enjuague las columnas añadiendo 3 x 500 μL de tampón MACS+. Solo agregue un nuevo tampón en la parte superior de las columnas tan pronto como se hayan secado o hayan dejado de gotear.
- Etiquete las células finales recolectadas como "Flow-through" o "CD8 negativo" y combínelas en un solo tubo de centrifugación. Esto se puede utilizar posteriormente para medir la pureza del aislamiento mediante citometría de flujo.
- Tome un nuevo tubo de centrifugación de 15 mL etiquetado como "Células T CD8+". Las columnas se retiran del imán y se colocan en el tubo de centrifugación.
- Enjuague ambas columnas que contienen las células T CD8 positivas marcadas magnéticamente con 1.000 μL de tampón MACS+ cada una. Por lo tanto, pipetee el tampón en las columnas e inmediatamente comience a empujar con cuidado la solución fuera de las columnas utilizando el émbolo proporcionado por el fabricante.
NOTA: Haga esto para ambas columnas, recolectando 2 mL de suspensión total de células T en centrifugación. - Cuente el número total de linfocitos T utilizando una cámara de recuento de Neubauer. Recomendación: Utilizar una dilución 1:4 con azul de tripano.
- Tinción de linfocitos T con CFSE
- Centrifugar los linfocitos T aislados a 300 x g durante 5 min.
- Durante la centrifugación, prepare la solución de tinción de CFSE mezclando 1,1 μl de solución de CFSE en 10 ml de PBS. La concentración final debe ser de 1 μM.
- Deseche el sobrenadante y vuelva a suspender el pellet celular en 1.000 μL de PBS. Centrifugar a 300 x g durante 5 min.
- Deseche el sobrenadante y vuelva a suspender el pellet celular en 2000 μL de solución de tinción CFSE (1 μM). Incubar durante 20 min a 37 °C.
- Centrifugar las células teñidas a 300 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender el pellet celular en 1.000 μL de PBS.
- Centrifugar a 300 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender el gránulo de células en la cantidad adecuada de medio de células T para alcanzar una concentración de 1,5-2 x 106 células T en aproximadamente 3-4 ml de medio de células T.
- Siembra de células T en una placa de 6 pocillos
- Deseche la solución de recubrimiento de la placa de 6 pocillos.
- Siembre 1,5-2 millones de células T aisladas y teñidas en 3-4 mL de medio de células T por pocillo.
- Incubar las células T a 37 °C y 5% de CO2 durante las siguientes 48 h
NOTA: Ajustar la densidad de siembra siempre a 1,5 Mio celdas / 3 mL. Evite sembrar células T en una densidad más baja. Es posible una densidad mayor, pero hay que probarla.
4. Inicio del cocultivo (día 4)
NOTA: Duración: 2 h. Después de determinar el recuento de células de las células tumorales HSC4, las células T se agregan a las placas de 96 pocillos en una proporción de 1:1.
- Recolección de un pocillo por condición para determinar un recuento de células representativo
- Deseche el sobrenadante del pocillo que se sembró ejemplarmente para la determinación del recuento de células.
- Primero, lave las células con 100 μL de PBS, luego deseche el PBS.
- Añadir 100 μL de tripsina e incubar durante 5 min en una placa calefactora. A continuación, vuelva a suspender y compruebe la suspensión unicelular al microscopio; si las células no se desprenden, añadir otros 50 μL de tripsina.
- Tan pronto como todas las células se hayan desprendido, detenga la reacción de tripsina agregando 100 μL (o 150 μL si se agregaron 50 μL adicionales de tripsina antes) del medio D10 y vuelva a suspender.
- Transfiera el volumen total de 200 μL del pocillo a un tubo de muestra de 1,5 mL y use 100 μL para medir el recuento de células. Recuerde ajustar el número de celda medido al volumen de la muestra.
- Tinción de células tumorales HSC4 con un tinte fluorescente no tóxico para el seguimiento de células
- Prepare el seguidor celular (ver Tabla de Materiales) disolviendo 2 μL en 20 mL de PBS (concentración final 0,1 μM según el fabricante).
- Pipetear el medio D10 de todos los pocillos que contengan células tumorales y desecharlo.
- Agregue 200 μL de la solución de rastreo celular a los pocillos de células tumorales. Incubar durante 20 min a 37 °C.
- Después de la incubación, deseche la solución de tinción y lávela agregando 100 μL de PBS. Posteriormente, también descarte el PBS.
- Añadir 200 μL de medio D10 fresco.
- Recolección de células T (placa de 6 pocillos)
- Vuelva a suspender cuidadosamente las células T en su medio; la mayoría de las células T están en suspensión y se pueden recolectar simplemente pipeteándolas de su pozo.
- Comprobar microscópicamente si los pozos están vacíos; de lo contrario, coseche usando 1,000 μL de tripsina, coloque la placa en una placa calefactora a 37 °C hasta que las células T se hayan desprendido, luego detenga la reacción agregando 1,000 μL de PBS o medio de células T (opcional).
- Cuente las células T utilizando una cámara de recuento de Neubauer. A continuación, centrifugar las células T a 300 x g durante 5 min.
- Vuelva a suspender las células T en medio de células T (utilice el mismo medio preparado el día 2 de aislamiento de células T) hasta una concentración final de 10.000 células T por 20 μL.
- Adición de linfocitos T a linfocitos tumorales HSC4 (placa de 96 pocillos)
- Agregue la cantidad deseada de células T a los pocillos de células tumorales de acuerdo con el recuento de células tumorales determinado previamente en una proporción de 1:1.
- Mantener una célula tumoral por afección libre de células T como control de "solo células tumorales". Este control de "solo células tumorales" permite la compuerta precisa de los datos de flujo.
- Agregue 200 μL de la suspensión de células T a un pocillo vacío como un control de "solo células T" (200.000 células T). Este control de "solo celda T" permite la compuerta precisa de los datos de flujo.
- Incubación del cocultivo durante 96 h (37 °C, 5% CO2)
5. Cuantificación de la proliferación de linfocitos T por citometría de flujo (Día 7)
NOTA: Duración: 3h. Después de incubar el cocultivo durante otras 96 h, los pocillos se cosechan y se tiñen con una mezcla de anticuerpos que contiene diferentes anticuerpos según la hipótesis de investigación (por ejemplo, anticuerpos anti-CD3, CD8, HLA-DR y CD25). Luego, las células se analizan mediante citometría de flujo multicolor.
- Prepare e inscriba un lote de tubos FACS y tubos de microcentrífuga para cada pozo que se vaya a cosechar.
- Recolección de células
- Resuspenda las células en su medio y transfiéralas a los tubos FACS.
- Lave las células con 100 μL de PBS, luego transfiéralo a los tubos FACS.
- Añadir 100 μL de tripsina a los pocillos e incubar en la placa calefactora (37 °C) durante 5 min.
- Vuelva a suspender las células, luego controle microscópicamente si todas las células están separadas. Si es así, transfiera la suspensión de células tripsinadas a los tubos FACS.
- Verifique microscópicamente si todos los pozos están vacíos; Si no es así, repita los pasos 5.2.3-5.2.4.
- Recolección del sobrenadante del cocultivo para experimentos posteriores
- Centrifugar los tubos llenos de celdas a 300 x g durante 5 min.
- Pipetear con cuidado alrededor de 300 μL del sobrenadante fuera de los tubos y en un lote diferente de tubos de microcentrífuga para congelarlos a -20 ° C. El sobrenadante se puede utilizar posteriormente para realizar, por ejemplo, ensayos ELISA con el fin de cuantificar las citocinas secretadas.
- Tinción de las células con anticuerpos para realizar citometría de flujo
- Prepare la mezcla de anticuerpos: Añadir 5 μL de anti-CD3-Krome Orange, 0,5 μL de anti-CD8-PerCE-Cyp5.5, 1 μL de anti-HLA-DR-APCVio770, 2,5 μL de anti-CD25-PE-Dazzle a 91 μL de tampón PBS/FACS.
- Añada 200 μL de tampón FACS (PBS suplementado con 2% de FBS y 2% de EDTA) a cada tubo y vuelva a suspender.
- Vuelva a centrifugar a 300 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender las células en 100 μL de la mezcla de anticuerpos previamente preparada (paso 5.4.1). Incubar durante 30-45 min a 4 °C en el frigorífico protegido de la luz.
- Después de la incubación, centrifugar a 300 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender las células en 100 μL de tampón FACS.
- Realizar citometría de flujo sobre un citómetro capaz de discriminar todos los anticuerpos fluorescentes antes mencionados y la señal CSFE.
6. Estrategia de compuerta y análisis de datos
- Excluyendo dobletes e identificando la población correcta de linfocitos T (Figura 2A).
- Excluir la población de dobletes en función de avance vs. área de dispersión lateral (FSC-A vs. SSC-A) (Singletes).
- Gráfico "Singletes" para la identificación de linfocitos T en función de la función directa vs. área de dispersión lateral (FSC-A vs. SSC-A) (células T).
NOTA: Para obtener la mejor exclusión de tamaño, mida las muestras de "Solo células T" y "Solo células tumorales" en paralelo (Figura 2B). - Represente la expresión de CD3 frente a la SSC-A para discriminar las células T. Además, las células T CD8 positivas se pueden identificar trazando la señal CD8 contra la SSC-A. Todos los linfocitos T son CD3+/CD8+ (linfocitos T CD8+) (Figura 2A).
- Represente la señal CFSE de todas las "células T CD8+" como un histograma.
NOTA: Activación de la subpoblación no proliferativa (señal más alta de CFSE), la subpoblación proliferativa (todos los linfocitos T con señal reducida de CFSE) y la subpoblación altamente proliferativa (todos los linfocitos T del4º pico de CFSE o menos intensivo).
- Análisis de marcadores de superficie asociados a la actividad en la población de células T
- Siga los pasos de compuerta (paso 6.1) (Figura 3A).
- Opción A: Elija las "células T CD8+" como entrada y analícelas para determinar su expresión de CD25 o HLA-DR trazando la fluorescencia del marcador de superficie respectivo con las características de SSC-A.
NOTA: Si se detecta una subpoblación distinta de CD25 alto, se recomienda la activación de la población de CD25 alto. Lo mismo se aplica a la compuerta/análisis de HLA-DR en células T (Figura 3B). - Opción B: Elija las "células T CD8+" como entrada y analícelas para determinar su expresión de CD25 o HLA-DR trazando la fluorescencia del marcador de superficie respectivo con las características de SSC-A.
NOTA: Si no se detecta ninguna subpoblación distinta (dependiendo del marcador de superficie analizado), se recomienda el análisis del cambio de la intensidad de fluorescencia media (MFI) de toda la población de células T (Figura 3C).
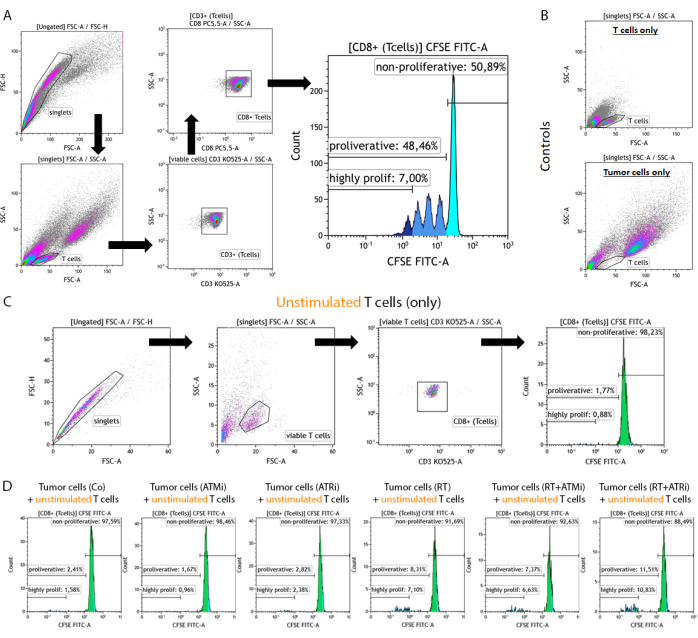
Figura 2: Estrategia de activación de células T preestimuladas teñidas con CFSE para el análisis de la proliferación después de 96 h de cocultivo con células tumorales HNSCC pretratadas. Las células T y las células tumorales se recolectan 96 h después del cocultivo en una placa de 96 pocillos, se tiñen con un marcador de superficie específico de células T y se miden con un dispositivo de citometría de flujo. (A) Los dobletes se excluyeron en función de FSC-A/FSC-H, y las células T se comprimieron por tamaño (FSC-A/SSC-A). Las células T se analizaron más a fondo para determinar su expresión de CD3 (anti-CD3 Krome Orange) y CD8 (anti-CD8 PerCP-Cy5.5). Los linfocitos T CD3+/CD8+ se trazaron en un histograma y se analizó la intensidad de la señal CFSE. La señal CFSE representa subgrupos de linfocitos T con un comportamiento de proliferación diverso. Los linfocitos T con la señal más alta de CFSE se definieron como "no proliferativos". Todas las subpoblaciones que mostraron una pérdida de la señal de CFSE, causada por la división celular que conduce a la mitad de la señal, en distintos picos se resumieron como "proliferativas". Las células T que se dividieron más de tres veces (más de tres picos de señal CSFE) se definieron como "altamente proliferativas". (B) Como control, se miden adicionalmente muestras que consisten solo en células T preestimuladas y solo células tumorales pretratadas. Las células T y las células tumorales HSC4 se pueden discriminar por tamaño mediante FSC-A vs. Señal SCC-A. Además, se analizaron las células T CD8+ no estimuladas para comprobar la activación de las células T basándose en el cultivo conjunto con células tumorales alogénicas solas. (C) Como control, se incluyó la incubación de células T no estimuladas teñidas con CFSE durante 96 h en paralelo al cocultivo. (D) Las células T no estimuladas teñidas con CFSE se cultivaron conjuntamente con células tumorales pretratadas. Después de 96 h, se recolectaron las células y se midió la señal CFSE utilizando el procedimiento estándar. Los linfocitos T no estimulados no mostraron proliferación, ni solos ni después del cocultivo con células tumorales pretratadas. Haga clic aquí para ver una versión más grande de esta figura.
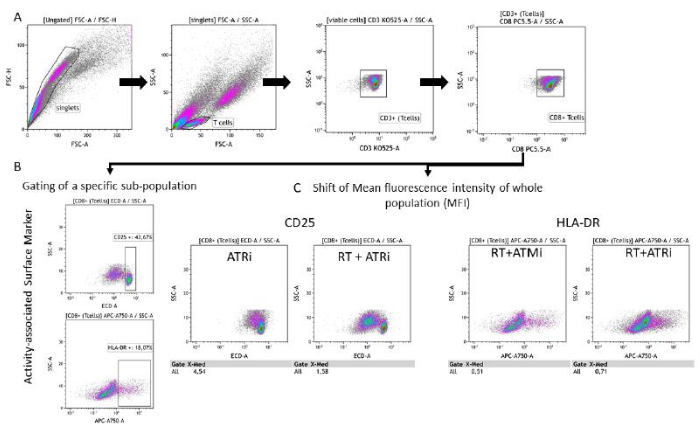
Figura 3: Estrategia de activación de la expresión de marcadores de superficie (CD25 y HLA-DR) asociada con la actividad de los linfocitos T después de 96 h de cocultivo con células HNSCC pretratadas. (A) Los dobletes se excluyeron en función de sus características FSC-A/FSC-H, y las células T se clasificaron primero por tamaño (FSC-A/SSC-A). Las células T se analizaron más a fondo para determinar su expresión de CD3 (anti-CD3 Krome Orange) y CD8 (anti-CD8 PerCP-Cy5.5). La activación de los marcadores de actividad CD25 (anti-CD25, PEDazzle594) y HLA-DR (anti-HLA-DR, APC-Vio770) en la superficie de las células T se puede realizar en dos entornos diferentes. (B) Activación de todas las células T CD8+ para el porcentaje de una subpoblación específica de CD25alto o HLA-DRalta sobre la base de parcelas de densidad. (C) Alternativamente, se realiza la medición de un desplazamiento de MFI de toda la población de células T CD8+ para ambos marcadores de actividad. Se muestran imágenes representativas del análisis de la expresión de marcadores de superficie de células T después del cocultivo con células tumorales HSC4. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Las células tumorales HSC4 derivadas de un HNSCC se sembraron e incubaron durante la noche. Después de 24 h, las células fueron tratadas con un inhibidor de la quinasa. A las 3 h se aplicaron las dos primeras dosis de 5 Gy por fracción. Después de 24 h, se aplicó la segunda dosis y las células se incubaron nuevamente durante la noche. Paralelamente, 48 h antes del inicio del cocultivo, se aislaron células T de la sangre de un donante sano. En primer lugar, se aislaron las PBMC utilizando tubos de centrifugación en gradiente de densidad y un medio de separación estéril. Las PBMC se contaron utilizando una cámara de recuento de células, y las células T CD8+ se aislaron utilizando el kit de aislamiento de células T CD8+. A continuación, los linfocitos T CD8+ aislados se tiñeron con CFSE (1 μM) y posteriormente se contaron. Las células T se sembraron en placas de pocillos prerrevestidas CD3/CD28 con una densidad de 1,5 x 106 células/3 mL. Después de 48 h de estimulación, las células T se recolectaron, contaron y resuspendieron en una densidad de 10.000 células/10 μL. Además, se recolectaron y contaron pocillos representativos de las células tumorales sembradas, y el medio se intercambió por todos los pocillos restantes. Las células T se agregaron a las células tumorales en una proporción de 1:1. El cocultivo se cosechó después de 96 h, el sobrenadante se almacenó a -20 °C y las células se tiñeron y midieron por citometría de flujo (Figura 1).
Los linfocitos T se identificaron por exclusión de tamaño y positividad para CD3/CD8. La señal CFSE de las células CD3+/CD8+ positivas mostró la distribución de las células T no proliferativas (alta señal de CFSE) y distintas subpoblaciones de células T en proliferación (pérdida de la intensidad de la señal CFSE). La proporción de linfocitos T en proliferación se midió de forma ejemplar para la línea celular HSC4 HNSCC (Figura 4A). Todos los linfocitos T que mostraron al menos una división se definieron como "proliferativos". Los linfocitos T que mostraron más de 3 divisiones se definieron como "altamente proliferativos" (Figura 4B). En el caso de la línea celular HSC4 negativa para el VPH, se detectó un ligero aumento en la tasa de proliferación cuando las células T se cultivaron conjuntamente con células tumorales irradiadas. La inhibición de RT y RT más ATR dio lugar a un aumento significativo de la proliferación consecutiva de células T en comparación con los cocultivos de células HSC4 tratadas con inhibición de RT más ATM con células T. Con respecto a la fracción "altamente proliferativa" de las células T, el pretratamiento de las células HSC4 con RT más inhibición de ATR fue más eficaz para estimular la proliferación de células T (Figura 4B).

Figura 4: Proliferación de linfocitos T teñidos con CFSE para análisis de cambios dependientes del tratamiento de HSC4 en la proliferación de linfocitos T. (A) Proporción de linfocitos T en proliferación después de 96 h de cocultivo con linfocitos tumorales HSC4 negativos para el VPH pretratados. La proliferación de linfocitos T fue significativamente menor después del cocultivo con células tumorales HSC4 tratadas con RT+ATMi en comparación con el tratamiento con RT o RT más ATRi. (B) La RT de las células tumorales HSC4 indujo una fracción más alta de células T altamente proliferantes (más de tres divisiones celulares. Después del cocultivo de células tumorales HSC4 pretratadas con RT+ATRi con células T, el porcentaje de células T altamente proliferativas fue el más alto. Las barras muestran datos de cuatro experimentos independientes con las células T de cuatro donantes independientes y sanos (n = 4; Media ± DE). (*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001; significación estadística probada comparando todas las condiciones experimentales con cada una utilizando Mann-Whitney-U de dos colas para datos no distribuidos normalmente). Haga clic aquí para ver una versión más grande de esta figura.
La pérdida de CFSE basada en la proliferación se puede utilizar para cuantificar la tasa de proliferación de células T. Además, se describen varios marcadores de superficie celular asociados con la actividad de las células T, como CD25 y HLADR. Por lo tanto, se realizó el análisis de CD25 y HLA-DR en la superficie de todos los linfocitos T CD3+ y CD8+ mediante citometría de flujo (Figura 5). La expresión se puede cuantificar si se detectan subpoblaciones distintas de CD25alto o HLA-DRalto y se puede discriminar mediante la activación de estas células altamente positivas (Figura 3B). Si no se detectan subpoblaciones distintas, se puede medir la intensidad media de fluorescencia (MFI) de toda la población y se pueden cuantificar los cambios basados en la condición del MFI (Figura 3C).
De manera ejemplar, la expresión identificada por el MFI de CD25 y HLA-DR se analizó después de 96 h de cocultivo con células tumorales HSC4 pretratadas (Figura 5). Después del cocultivo de células T con células tumorales HSC4 tratadas con RT, la expresión de CD25 en las células T se reguló fuertemente a la baja. En particular, el pretratamiento de las células tumorales solo con ATMi resultó en una disminución significativa de la expresión de CD25 en comparación con el pretratamiento con ATRi. En el entorno combinado con RT, aunque la RT dio lugar a una disminución de la expresión de CD25 en las células T, la combinación de RT con ATMi dio lugar a un aumento de la expresión de CD25 en comparación con RT más ATRi (Figura 5A). Con respecto a la expresión de HLA-DR en las células T, la RT generalmente condujo a una regulación positiva de HLA-DR, pero nuevamente, en combinación con ATMi o ATRi, se observó un comportamiento diferente (Figura 5B). Los linfocitos T cocultivados con linfocitos HSC4 que fueron pretratados con una combinación de RT+ATRi aumentaron la expresión de HLA-DR en comparación con RT solo o RT+ATMi.
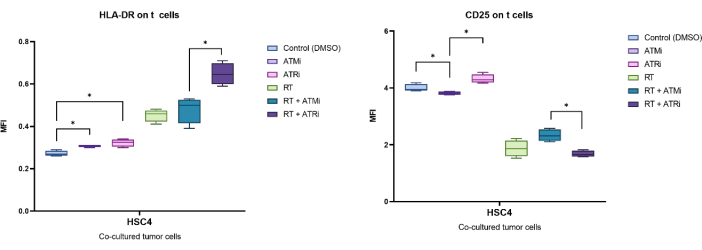
Figura 5: Expresión de los marcadores de activación CD25 y HLA-DR en la superficie de los linfocitos T tras 96 h de cocultivo con células tumorales HSC4 pretratadas. La expresión de CD25 y HLA-DR se analizó a partir del desplazamiento del MFI de toda la población de linfocitos T. La RT de HSC4 resultó en una disminución de la expresión de CD25 en las células T y un aumento de la expresión de HLA-DR. La combinación de RT con ATMi dio lugar a patrones de expresión significativamente diferentes en comparación con RT más ATRi. Los diagramas de caja muestran datos de cuatro experimentos independientes con las células T de cuatro donantes independientes y sanos (n = 4; Media ± DE). Los datos se analizaron comparando todas las condiciones experimentales entre sí utilizando una prueba de Mann-Whitney-U de dos colas para datos no distribuidos normalmente (*p≤ 0,050). Haga clic aquí para ver una versión más grande de esta figura.
Estos datos indican de manera ejemplar que el tratamiento de las células tumorales, en este caso de las células HSC4 HNSCC, afecta la inmunogenicidad de las células tumorales. Esto se puede monitorear mediante el cultivo conjunto de las células tumorales con células T preestimuladas, lo que conduce a un comportamiento de proliferación diverso y expresión de marcadores de activación en las células T humanas según el régimen de tratamiento de células tumorales aplicado.
Discusión
El protocolo presentado aquí ofrece un método rápido y sencillo para analizar la capacidad proliferativa de las células T junto con su estado de activación en un entorno de cocultivo con células tumorales pretratadas. De este modo, los efectos de las diferentes modalidades de tratamiento, como la RT, la TC o la TT, sobre la actividad y la proliferación de las células T pueden examinarse fácilmente, sentando las bases para posteriores análisis inmunológicos más profundos de enfoques prometedores. Los resultados representativos mostrados en este manuscrito demuestran que este ensayo de cocultivo de células T alogénicas está funcionando bien. Se observaron diferencias significativas en la proliferación de linfocitos T, así como en la actividad de los linfocitos T, para el cocultivo con células HSC4 humanas pretratadas diferencialmente (HNSCC) (Figura 4 y Figura 5). Se encontró que el tratamiento de la HSC4 con RT sola o en combinación con TT resultó en un aumento de la proliferación de las células T, en particular con respecto a la fracción altamente proliferativa de las células T (Figura 4). De acuerdo con la cuantificación de la tasa de proliferación, el estado de activación de las células T también se vio afectado de manera diferencial por los diferentes regímenes de tratamiento. En resumen, la aplicación de RT resultó en una fuerte regulación a la baja de la expresión de CD25 en las células T, mientras que la expresión de HLA-DR se reguló al alza. La RT induce daño en el ADN de las células tumorales irradiadas, lo que a su vez conduce a respuestas de estrés celular que incluyen la liberación de moléculas y citocinas asociadas al estrés y al daño, así como la expresión de ligandos de la superficie celular inmunomoduladores19.
La combinación de RT con TT en forma de inhibidores de la reparación del ADN está mejorando y manteniendo aún más esos efectos, ya que las células tumorales no pueden reparar eficazmente el daño del ADN inducido por la RT. Esto podría promover y mantener aún más la secreción de factores inmunogénicos y la expresión de ligandos inmunogénicos de superficie celular20. De acuerdo con esto, hemos demostrado previamente que el tratamiento de las células tumorales (HNSCC) con RT e inhibidores del daño en el ADN altera el fenotipo inmune en la superficie de la célula tumoral. La modulación del fenotipo inmune incluyó la regulación de la molécula inmunoestimuladora ICOS-L, así como de la molécula inmunosupresora PD-L111. En respuesta a esta modulación del fenotipo inmunitario de las células tumorales, las células T también podrían regular la expresión de marcadores de activación en su superficie celular. Además, se sabe que la RT estimula la liberación de citocinas proinflamatorias, como el IFNγ o la IL-6, que a su vez influyen en la proliferación y la actividad de las células T21. La expresión de marcadores de activación en las células T es un proceso altamente dinámico. Los datos de Zimmerman et al.22 mostraron que el CD25 se expresa en gran medida 24 h después de la estimulación, pero vuelve a estar regulado a la baja después de 96 h después de la estimulación. Esto está en línea con nuestros hallazgos. Por el contrario, el HLA-DR es un marcador de activación de fase tardía y generalmente está precedido por un aumento de CD25 y CD6923. Notablemente, la combinación de RT + ATRi conduce a una regulación positiva significativa de HLA-DR en las células T en comparación con RT + ATMi. Este hallazgo está en línea con el trabajo de Dillion et al. quienes demostraron efectos sinérgicos de ATRi + RT en la inducción de un TME inflamatorio24. Se logró una modulación menos pronunciada de la actividad y proliferación de las células T mediante el tratamiento de las células tumorales con los inhibidores de la cinasa solos (Figura 5). Esto podría deberse al hecho de que los inhibidores de la reparación del ADN ATMi y ATRi funcionan como un potenciador del daño del ADN inducido por RT y, en consecuencia, no son muy inmunogénicos cuando se aplican como monoterapia. Ya hemos demostrado la toxicidad mínima de ATMi o ATRi solo11. En resumen, los resultados confirman el potencial inmunogénico de la RT (y la TT con inhibidores del daño en el ADN) e indican además que este sistema experimental es adecuado para el cribado de las capacidades inmunoestimuladoras de distintas modalidades de tratamiento en células humanas de cáncer de cabeza y cuello.
A pesar de que el método presentado aquí es fácil y robusto, hay algunos pasos críticos en el protocolo que deben considerarse de antemano. Es necesaria la presencia de altas concentraciones de EDTA durante el proceso de aislamiento, así como durante el análisis citométrico de flujo de las células T. Por lo tanto, se recomienda recolectar la sangre del donante en tubos de recolección recubiertos de EDTA y utilizar un tampón MACS suplementado con 10 mM de EDTA para garantizar un aislamiento eficiente de las células T y la generación de una suspensión homogénea de una sola célula para la evaluación por citometría de flujo. Además, la composición del medio de las células T es de gran importancia para la capacidad proliferativa de las células T. Después de probar diferentes composiciones de medios de cultivo, un medio con bajas concentraciones de L-Arginina y L-Lisina da como resultado la mejor señal de proliferación de células T, ya que la L-Arginina es crítica para el metabolismo y la supervivencia de las células T y debe suministrarse en una concentración adecuada25,26. No obstante, hay que tener en cuenta que las soluciones de L-arginina y L-lisina no son estables a largo plazo y, por lo tanto, deben utilizarse en un plazo de 3 meses. Para una estimulación óptima, el medio de células T suplementado con los aminoácidos debe prepararse frescamente para cada experimento de cultivo de células T. Además, el número de células de las células T, así como el de las células tumorales, son factores críticos que deben tenerse en cuenta, ya que influyen en la lectura del experimento.
Para las células tumorales, por un lado, se desea una confluencia celular del 70% al 80% al final del experimento de cocultivo. Un crecimiento excesivo de las células tumorales podría dar lugar a la secreción de factores que inhiben el crecimiento celular y, posteriormente, también afectaría la tasa de proliferación de células T. Dado que el crecimiento de las células tumorales depende en gran medida de la línea celular individual, recomendamos probar exhaustivamente el comportamiento de crecimiento de la línea celular tumoral respectiva en diferentes placas de pocillos y para los diferentes regímenes de tratamiento. Además, las células tumorales y las células T deben cultivarse conjuntamente en una proporción de 1:1. Por lo tanto, es obligatorio sembrar un pocillo adicional de células tumorales para cada condición de tratamiento, que se puede utilizar para la determinación del recuento de células el día del inicio del cocultivo. De este modo, se puede asegurar que se sembrará un número adecuado de células T para las diferentes condiciones de tratamiento. En cuanto al número de células de los linfocitos T, hay que tener en cuenta que la cantidad de linfocitos T que se pueden aislar de un donante sano es muy individual. Las células T representan entre el 45% y el 70% de las PBMC de un donante sano27. Por lo tanto, la cantidad requerida de células T ya debería estimarse ampliamente en el momento de la extracción de sangre. Además, la densidad de células T es importante para la eficiencia de la activación de las células T y su supervivencia. En consecuencia, las células T deben sembrarse en una concentración de al menos 1,5 millones de células por pocillo de una placa de 6 pocillos en 3 mL de medio de células T para la estimulación inicial antes del inicio del cocultivo. Es posible una mayor densidad de células T, pero se debe evitar una densidad más baja. La activación de las células T también se puede evaluar morfológicamente bajo el microscopio, ya que las células T activadas tienden a formar grupos de células.
Dado que este método es un sistema experimental simplificado para estudiar las capacidades inmunoestimuladoras de diferentes líneas celulares tumorales y modalidades de tratamiento, tiene algunas limitaciones que deben tenerse en cuenta. En primer lugar, este ensayo se basa en un sistema alogénico, lo que significa que las células T del donante no son compatibles con el HLA de la línea celular tumoral respectiva. Por lo tanto, este desajuste de HLA ya podría inducir la estimulación de las células T y, posteriormente, la proliferación de las células T sin una mayor estimulación del tratamiento con las células tumorales28. Para cuantificar este efecto no deseado, los linfocitos T aislados se cocultivaron con la línea celular HSC4 sin estimulación previa con anticuerpos CD28 y CD3. Se encontró que casi no se indujo proliferación en este entorno, lo que indica que el desajuste de HLA solo tiene efectos menores en la activación de las células T en este entorno experimental específico. Además, se encontraron diferencias significativas en la proliferación y activación de las células T en función del tratamiento con las células tumorales a pesar del entorno alogénico. Sin embargo, para el establecimiento de este ensayo, la posible proliferación alogénica inducida de células T debe probarse y cuantificarse una vez al comienzo de los experimentos. Los controles recomendados de "solo células T" y "solo células tumorales" son necesarios para una activación suficiente y son obligatorios en cada repetición de los experimentos. No obstante, hay que tener en cuenta que un sistema de cocultivo alogénico carece de reconocimiento de antígenos específicos del tumor. Por lo tanto, este sistema puede no reflejar con precisión la respuesta antitumoral específica, ya que ocurriría in vivo en pacientes29,30. Para mejorar aún más, un entorno más sofisticado sería un enfoque de cocultivo autólogo. En este contexto, las biopsias tumorales derivadas del paciente deben cultivarse y cultivarse con células T aisladas de la sangre periférica del mismo paciente28. Sin embargo, este enfoque experimental podría ser un desafío no solo en términos de cultivo de células tumorales primarias, sino también en términos de disponibilidad de biomaterial derivado del paciente. Otra limitación que hay que tener en cuenta es la proporción de células tumorales y células T en el cocultivo. Dado que la proporción recomendada de las células es de 1:1, la relación no refleja la situación fisiológica de la EMT en los pacientes31. Sin embargo, hay que aceptar esta limitación, ya que con recuentos más bajos de células T, los cambios en la tasa de proliferación y el estado de activación no son cuantificables.
En el campo de la inmunología tumoral, este ensayo ofrece la oportunidad de detectar la inmunogenicidad de diferentes modalidades de tratamiento en un entorno experimental in vitro fácil y rápido. Por lo tanto, no solo se puede ahorrar tiempo mediante la preselección de los enfoques más prometedores en términos de inmunogenicidad, sino también mediante experimentos in vivo . Los modelos animales pueden reducirse, ya que solo se podrían seguir desarrollando esquemas de tratamiento prometedores en modelos animales para reflejar el sistema inmunitario en su conjunto en un organismo. Además, dado que este ensayo se basa en células primarias humanas y líneas celulares de cáncer humano, los resultados podrían ser más traducibles a la clínica que los ensayos que se basan en otros sistemas y especies modelo.
En el futuro, este ensayo podría modularse y adaptarse para responder a preguntas de investigación más específicas. Por ejemplo, se podría incluir un tratamiento de las células T para reflejar un escenario de tratamiento que esté más cerca de la situación de los pacientes. Dado que las células T reactivas a los tumores se encuentran principalmente en el TME, se ven igualmente afectadas por las terapias locales, como la RT, y probablemente también por las terapias sistémicas, como la TC o la TT32. Una mejora adicional del ensayo es el cultivo conjunto de células T con esferoides tumorales de líneas celulares tumorales o incluso el cultivo conjunto con organoides tumorales derivados de pacientes. Estos cultivos tridimensionales son más comparables a la estructura de un tumor en un paciente28. Por último, también la lectura del experimento a través de citometría de flujo se puede adaptar fácilmente para investigar más moléculas en la superficie de las células T o mediante el análisis de la expresión de las moléculas de punto de control inmunitario en las células tumorales. Además de la determinación del fenotipo inmunitario de las células T, se podrían utilizar los sobrenadantes de cultivo celular de los experimentos de cocultivo para la cuantificación de las citocinas o quimiocinas secretadas para obtener más información sobre la actividad de las células T. En resumen, este protocolo ofrece un ensayo de cocultivo de células T y células tumorales completo, robusto y fácil que permite la detección de la inmunogenicidad de diferentes modalidades de tratamiento del cáncer. Dado que este ensayo es adaptable a preguntas de investigación específicas, es adecuado para su aplicación en el amplio campo de la inmunología tumoral.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Esta investigación fue financiada en parte por el Centro Interdisciplinario de Investigación Clínica de Erlangen (IZKF Erlangen) y el Bayerisches Zentrum für Krebsforschung (BZKF).
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
Referencias
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados