Method Article
前処理腫瘍細胞の同種共培養環境におけるヒトT細胞活性の解析
要約
本プロトコルは、前処理された腫瘍細胞との同種共培養システムにおけるヒトT細胞刺激の ex vivo 分析を可能にする実験ワークフローを説明しています。
要約
細胞傷害性T細胞は、腫瘍細胞の排除に重要な役割を果たしているため、がん免疫学で集中的に研究されています。腫瘍内の細胞傷害性T細胞の頻度と活性、およびその腫瘍微小環境(TME)は、現在、多くの腫瘍タイプの予後および予測バイオマーカーとして確立されています。しかし、放射線療法、化学療法、免疫療法、標的療法など、さまざまな腫瘍治療法が腫瘍の免疫原性だけでなく、免疫系自体をも調節することはよく知られています。その結果、腫瘍細胞とT細胞との間の相互作用は、腫瘍治療中のT細胞の複雑な役割を完全に理解するために、さまざまな治療状況でより集中的な研究を必要とします。このニーズに対処するために、前処理された腫瘍細胞との共培養におけるヒト細胞傷害性(CD8+)T細胞の活性と増殖能を分析するためのプロトコルが開発されました。具体的には、健康なドナー由来のCD8+ T細胞を非毒性増殖マーカーであるカルボキシフルオレセインジアセテートスクシンイミジルエステル(CFSE)で染色し、CD3/CD28コーティングプレートを用いて刺激します。続いて、T細胞を前処理した腫瘍細胞と共培養します。読み出しとして、T細胞の増殖は、CFSEシグナル分布を測定し、フローサイトメトリー を介して 表面活性化マーカーの発現を評価することにより定量化されます。これは、酵素結合免疫吸着アッセイ(ELISA)を使用してサイトカイン放出を定量化することでさらに補完できます。この方法は、腫瘍細胞とT細胞との間の相互作用における治療誘発性の変化の評価を容易にし、ヒト のex vivo 環境における腫瘍治療モダリティとその免疫原性に関するより詳細な解析の基礎を提供します。さらに、前臨床 のin vivo 解析の削減にも貢献します。
概要
今日、腫瘍の成長と進行は、宿主の免疫系の効果的な操作と抑制に強く依存していることがますます明らかになっています。形質転換された細胞は、健康な生物であっても毎日出現します。しかしながら、巨視的腫瘍の形成は、出現した形質転換細胞が高効率で生物から除去されるので、かなりまれな事象である。悪性細胞の除去には、細胞傷害性T細胞、ナチュラルキラー(NK)T細胞、NK細胞、マクロファージなど、さまざまな種類の免疫細胞が作用します1,2,3。それにもかかわらず、時には形質転換された細胞クローンが出現し、それらは宿主の免疫系と平衡状態で生存することがあり、これは腫瘍細胞クローンの異なる免疫抑制戦略によって特徴付けられる4。最終的に、一部の形質転換細胞は、腫瘍細胞が免疫応答を積極的に抑制することを可能にするさらなる機能を獲得し、その結果、腫瘍の増殖につながります。この免疫抑制は、腫瘍細胞上の免疫抑制リガンドの発現や、免疫調節性または免疫抑制性免疫細胞集団の積極的な動員またはプライミングなど、多数のメカニズムによって媒介されます。このいわゆる免疫編集の概念は、腫瘍の形成および成長における免疫調節の重要な役割を示しています5。
したがって、免疫系が今日、がん治療だけでなく、多くの腫瘍実体や治療環境における予測および予後因子としても主要な焦点となっていることは驚くべきことではありません。ここ数年、免疫チェックポイント阻害剤(ICI)は、頭頸部扁平上皮がん(HNSCC)や非小細胞肺がん(NSCLC)など、さまざまな固形がんにおける有望な治療選択肢として登場し、腫瘍微小環境(TME)をより効率的な抗腫瘍免疫応答と腫瘍細胞の免疫抑制の減少に向けて調整することを目的としていました6.免疫チェックポイント阻害剤は、プログラム死タンパク質1(PD-1)とそのリガンド1(PD1/PD-L1)軸などの免疫チェックポイント分子を標的とすることにより、T細胞媒介性腫瘍細胞の死滅を促進することを目的としています。この事実は、抗腫瘍免疫におけるT細胞の重要な役割を強調しています。例えば、HNSCCでは、ICIは再発性および転移性HNSCCの第一選択治療薬として承認されています7。それに伴い、TMEにおける細胞傷害性T細胞の存在、ならびに腫瘍細胞およびそれに応じた腫瘍細胞およびT細胞に対するPD1およびPD-L1の発現は、HNSCC8,9,10の予測バイオマーカーとして役立つことができる。
T細胞は腫瘍免疫学および腫瘍治療において重要な役割を果たしていますが、T細胞と腫瘍との相互作用に関する多くの未解決の問題にまだ対処する必要があります。今日では、腫瘍の免疫応答が動的なプロセスであり、腫瘍の免疫原性が疾患の経過と治療の過程で変化する可能性があることはよく知られています。化学療法(CT)、放射線療法(RT)、標的療法(TT)などのさまざまな治療法が、腫瘍細胞の免疫学的表現型を調節することが特に広く知られています。RTは、腫瘍組織における免疫チェックポイント分子のアップレギュレーションを促進し、腫瘍浸潤細胞の頻度を変化させることができる11,12。一方、TTは、適応免疫応答13,14,15,16の直接調節により、腫瘍およびTME内の好ましい変化を支持することもできる。ただし、これらの調節は、治療の過程で腫瘍組織の反復検査が必要になるため、患者で研究することは困難です。したがって、腫瘍細胞とT細胞の動的免疫学的表現型、そしてさらに重要なことに、それらの相互作用を研究するためには、決定的な実験モデルシステムが必要です。
したがって、T細胞の活性および腫瘍細胞とT細胞の相互作用を解析する目的では、簡単な細胞培養作業と一般的に使用されるフローサイトメトリー分析に基づいて、どの研究室でも簡単に実施できる包括的な ex vivo 共培養アッセイが必要です。既存の入手可能な文献に基づくと、T細胞と腫瘍細胞の共培養に関する使いやすく一般的に使用されるプロトコルは、これまで発表されていません。最近、T細胞と腫瘍オルガノイドの共培養アッセイがいくつか発表されていますが、3D細胞培養技術は、今日でもすべての研究室で標準的な技術として実装されているわけではありません。したがって、私たちは2D細胞培養で使用するためのプロトコルを提供し、将来的には3D細胞培養にも確立される可能性があります。他の2D共培養プロトコルは、例えば、腫瘍細胞のルシフェラーゼ17 による形質導入を必要とするか、または血液悪性腫瘍(不適合T細胞と白血病細胞との共培養)にのみ適しているため、しばしばより複雑である18。ここで説明するアッセイでは、正常な健康なドナー由来のT細胞を末梢血から単離し、抗CD3抗体および抗CD28抗体で刺激します。その後、T細胞を(前)処理した腫瘍細胞と共培養し、T細胞の増殖能およびフローサイトメトリー による T細胞の活性を解析します。これにより、RT、CT、TTなどの腫瘍細胞免疫表現型に対するさまざまな治療法の影響を容易にスクリーニングし、より深いメカニズム解析や連続した前臨床 in vivo 解析の基礎として使用することができます。ここで説明するアッセイは、型破りなデバイス、技術、または材料を必要としないため、使いやすいセットアップを提供します。さらに、このアッセイは、さまざまな腫瘍細胞株または特定のT細胞サブセット(CD4+ T細胞など)に容易に適応させることができます。この技術により、高い標準化と再現性が達成されます。
プロトコル
このアッセイには、採血とヒト初代細胞の培養が含まれます。したがって、これらの分析には倫理的な投票が必須です。この原稿で提示されたすべての結果は、IMMO-NHD試験の倫理的承認によってカバーされており、すべてのドナーから書面によるインフォームドコンセントが得られました。2022年11月9日、エアランゲン・ニュルンベルク大学の機関審査委員会により承認が下されました(出願番号21-415-B)。この研究で使用されたHSC4腫瘍細胞は、市販の細胞株に由来します。
このアッセイは、放射線療法(RT)と2つの特異的キナーゼ阻害剤を含む治療環境でヒト頭頸部扁平上皮がん(HNSCC)細胞株HSC4を使用したT細胞および腫瘍細胞共培養アッセイのすべてのステップを例示しています。したがって、細胞数、トリプシン化時間、治療スキームなどのパラメータは、この共培養環境に固有であり、他の腫瘍細胞株にも適合させる必要があります(「ディスカッション」セクションも参照)。すべての遠心分離ステップを室温で行いました。本研究では、キナーゼ阻害剤であるAZD0156とVE-822を用いて、HSC4細胞のDNA損傷修復(DDR)系を標的とした。AZD0156(Selleckchem)は毛細血管拡張性運動失調症変異(ATM)タンパク質を阻害し、VE-822(Selleckchem)は毛細血管拡張性運動失調症およびRad3関連(ATR)タンパク質を標的とします。両方の阻害剤は、腫瘍細胞の放射線感受性を高めるための潜在的な薬剤として議論されています。 図1 は、 ex vivo アッセイのフローチャートを示しており、前処理した腫瘍細胞とCD3/CD28刺激ヒトCD8+ T細胞との共培養について詳しく説明しています。使用した試薬や機器は 、材料表に記載されています。
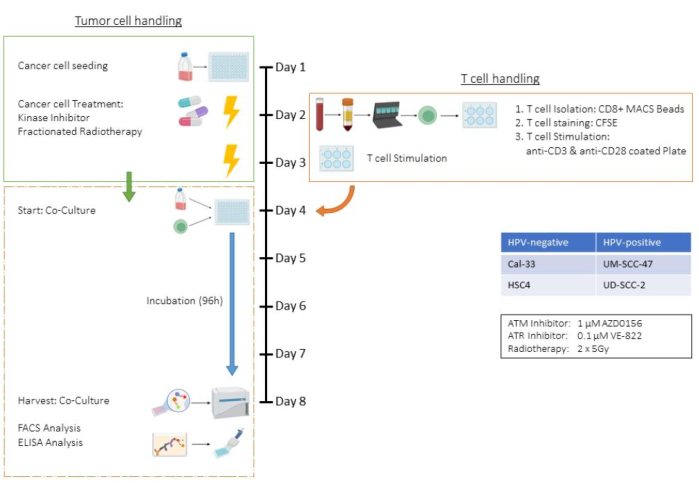
図1:(CD3/CD28)刺激ヒトCD8+ T細胞との共培養における前処理腫瘍細胞の ex vivo アッセイのフローチャート。 1日目:HSC4腫瘍細胞の播種。2日目:腫瘍細胞の処理と単離、CFSE染色、およびヒトCD8 + T細胞のCD3 / CD28コーティングプレートへの播種。3日目:腫瘍細胞の治療。4日目:腫瘍細胞の代表的なウェルのカウント。すべてのT細胞の採取とカウント。T細胞とHSC4腫瘍細胞を1:1の比率で共培養します。5日目-8日目:共培養インキュベーション。8日目:共培養の収穫、上清の凍結、抗体ベースの染色、およびフローサイトメトリーによる細胞の分析。 この図の拡大版を表示するには、ここをクリックしてください。
1. 腫瘍細胞の播種(1日目)
注:タイミング:1時間。ヒトHSC4腫瘍細胞は、T75細胞培養ボトルから96ウェルプレートに播種されます。
- 細胞培養ボトルの上清(D10培地)を捨ててください。
- 腫瘍細胞を5 mLの37°C温PBSで洗浄します。PBS を破棄します。
- HSC4腫瘍細胞は細胞培養フラスコにしっかりと接着する傾向があるため、すべての細胞を確実に剥離させるために2段階のトリプシン処理が推奨されます。このためには、3mLのトリプシンを加え、ボトルを37°Cの加熱プレートに3分間置き、ピペットでトリプシンを捨てます。
- さらに3 mLのトリプシンを加え、ボトルを加熱プレートにセットし、単一細胞懸 ?? 液が得られるまで待ちます。.顕微鏡で単一細胞懸濁液を確認します。
- D10 Medium(10%ウシ胎児血清と1%ペニシリン-ストレプトマイシンを添加したDMEM)の2倍容量を添加してトリプシンを停止し、完全に再懸濁し、細胞を50 mLの遠心分離チューブに移します。
- 単一細胞懸濁液の細胞数を決定し、総量に応じて腫瘍細胞の総量を計算します。ノイバウアー細胞チャンバーは、細胞数の測定に推奨されます。
- 腫瘍細胞を含む50 mLの遠心分離チューブを300 x g で室温で5分間遠心分離します。上清を捨てます。
- HSC4腫瘍細胞を適切な容量のD10培地に再懸濁して、200 μL培地中の15,000細胞の濃度に到達させます。
- 腫瘍細胞の計画された処理に従って、2つの96ウェルプレート(1xサンプル、1x腫瘍細胞のみコントロール、1x細胞カウントウェル)の200μL培地に15,000個のHSC4腫瘍細胞を含む少なくとも3つのウェルを各条件で播種します。
注:セル番号は、細胞株と倍加時間によって異なります。インキュベーション中に100%のコンフルエントを避けるために、さまざまな処理の細胞数を実験前に調べる必要があります。 - 細胞を37°C、5%CO2 、飽和湿度で24時間インキュベートします。
2. 腫瘍細胞の治療(2日目)
注:タイミング:3〜5時間。24時間のインキュベーション時間後、以前に播種したHSC4細胞を所望の処理スキームに従って処理することができる。この例示的なケースでは、腫瘍細胞はATM阻害剤またはATR阻害剤で治療される。本明細書では、さらに、2つの96ウェルプレートのうちの1つも、その後に2×5Gyを照射する。
- 腫瘍細胞を治療するために、1 μM AZD0156 (ATM阻害剤)および0.1 μM VE-822(ATR阻害剤)の濃度を得るためのキナーゼ阻害剤を調製します。
- それに応じて腫瘍細胞を治療します、例えば、各プレートで1列のサンプルを3.1μLのATM阻害剤で処理し、2列目のサンプルを3.1μLのATR阻害剤で処理します。
- 37°Cで3-5時間のインキュベーション後、1枚のプレートに5Gyを照射する。
- さらに24時間インキュベートした後、同じプレートに再び5Gyを照射します。
3. T細胞の単離(2日目)
注:タイミング:4時間CD8 + T細胞は、健康な成人ドナーに由来する末梢血(PB)の密度勾配遠心分離後、PBMCから抗CD8マイクロビーズで磁気的に単離されます。次に、単離されたT細胞をCFSEで染色し、CD3/CD28でコーティングしたウェルプレートでインキュベートして刺激します。後のステップでリソースと材料に配慮した作業を可能にするには、共培養実験に必要なT細胞の量を推定することが重要です。ドナーに依存して、約 45 ml の EDTA 血液から 50,000,000 から 100,000,000 の PBMC を分離できます。PBMC全体の約10%はCD8+ T細胞です。
- 密度勾配遠心分離
- 健康なドナーから得られた9mLのEDTA血液チューブ3〜5本を2本の50mL遠心分離チューブに移します。
- 両方の遠心分離チューブをPBS + 2% FBSで50 mLに充填します。
- 6本の遠心分離チューブ(PBMCの分離用のプラスチックインレイ付き)を準備し、それぞれに15 mLの+ 4°C冷密度グラジエント培地を充填します。
- 密度勾配培地に、ステップ3.1.2で希釈した血液12〜15mLを慎重に重ねます。
- 1200 x g で10分間遠心分離します(減速は不要)。
- T細胞刺激用の6ウェルプレートの調製
- 抗体の調製:1 mg / mLの抗CD3(クローンOKT3)溶液をPBSで調製します。0.1 mg/mL の抗 CD28(クローン 28.2)溶液を PBS で調製します。
- 推奨事項:遠心分離中(ステップ3.1.5)は、コーティング溶液の調製に、ウェル自体のコーティングにはT細胞の刺激に使用します。
- 5 μL の CD3-抗体溶液を 4.995 μL の PBS と、50 μL の CD28-抗体溶液と 4.950 μL の PBS を混合します (最終濃度: 1 μg/μL)。
- 1.000 μLの両抗体溶液を6ウェルプレートの各ウェルに添加します。
- 予想されるT細胞の量に応じて、6ウェルプレートの2ウェルまたは3ウェルをコーティングし、37°Cで少なくとも2時間インキュベートします。
- T細胞培地の調製
注:100x L-リジンの調製:200 mgのL-リジン塩酸塩を50 mLの蒸留水に50 mLの遠心分離チューブで溶解します。0.2 μmシリンジフィルターを使用して溶液を滅菌し、50 mL灌流シリンジを使用して新しい50 mLチューブに移します。溶液を4〜8°Cで保存し、3か月以内に使用してください。15 mM L-アルギニンの調製:26 mgのL-アルギニンを10 mLのDPBSに溶解します。0.2 μmシリンジフィルターを使用して溶液を滅菌し、10 mLシリンジを使用して新しいチューブに移します。溶液を4〜8°Cで保存し、3か月以内に使用してください。- ステップ1.5で述べた遠心分離時間を使用して、T細胞培地を調製します。
- 予想されるT細胞の量に応じて、約10〜30mLのT細胞培地を調製します。
- L-アルギニンおよびL-リジンを含まないRPMI培地を、10%熱不活化FBS、1%ペニシリン-ストレプトマイシン、1%L-アルギニン、1%L-リジン、1%L-グルタミンと混合します。例:RPMI培地25.8mL+FBS3mL+ペン/連鎖球菌0.3mL+L-アルギニン0.3mL+L-リジン0.3mL+L-グルタミン0.3mL。
- 残りの培地を次の2日間4°Cで保存し、4日目(共培養開始)に使用します。実験全体の新しい実行ごとに、新鮮な培地を調製することをお勧めします。
- PBMCアイソレーション
- 遠心分離後(ステップ3.1.5)、上清を4つの新しい50 mL遠心分離チューブに移し、使用済みのチューブを廃棄します。
- 遠心分離チューブを最大50mLにPBS + 2% FBSで満たします。
- 300 x g で8分間、室温で遠心分離します。
- 上清を捨て、細胞ペレットをPBS+各2%FBSの1mLに再懸濁し、2本の遠心チューブに結合します。
- チューブをPBS + 2%FCSで50mLに詰め替えます。
- 120 x g で室温で10分間遠心分離します。
- 上清を捨て、細胞ペレットをPBS +2% FBSの1 mLに慎重に再懸濁し、2つのペレットを1つのハヤブサに混ぜ合わせます。
- 遠心分離チューブをPBS + 2% FBSで50 mLまで満たします。
- ノイバウアー計数チャンバーを使用してPBMCの総数をカウントします。推奨事項:カウントのために細胞懸濁液をトリパンブルーで1:10に希釈します。
- CD8+ T細胞の分離
注:CD8 MicroBeads humanを磁気分離(MS)カラムおよび磁気活性化細胞ソーティングプラス(MACS+)バッファーとともに使用して、メーカーのプロトコルに従ってCD8+ T細胞を磁気的に分離します( 材料の表を参照)。- PBMC(細胞計数後)を300 x g で10分間遠心分離します。
- 上清を廃棄し、細胞ペレットを107細胞あたり 80 μLのMACS+バッファー(10 mM EDTAおよび0.5% BSAを添加した500 mL PBS)に再懸濁します(たとえば、60,000,000 PBMCを6 x 80 μL = 480 μLバッファーに再懸濁します)。
注:例:465 mL PBS + 10 mL(0.5 M)EDTAおよび25 mL BSAストック溶液。 - 107 細胞あたり20 μLのCD8 MicroBeadsを加え、ピペッティングで上下に慎重に混合します。4°Cで15分間インキュベートします。
- インキュベーション後、107 細胞あたり2 mLのMACS+バッファーを加えて細胞を洗浄します。
- 300 x g で室温で10分間遠心分離します。上清を捨て、細胞を1,000 μLのMACS+バッファーに再懸濁します。
- 2本のMSカラムをマグネットにセットし、その下に2本の15 mL遠心分離チューブを置きます。
- カラムを 500 μL MACS+ バッファーで調製します。バッファーはカラムを通過し、その下の遠心分離チューブに収集できます。この手順は、手順 3.5.6 と並行して実行することもできます。
- 次に、調製したMSカラムに細胞懸濁液を均等にピペットで移します。フロースルーは、同じ遠心分離チューブに集めることができます。現在、すべての非標識CD8陰性細胞が含まれています。
- 500 μL の MACS+ バッファーを 3x 添加してカラムをフラッシュします。新しいバッファーをカラムの上に追加するのは、カラムが枯渇するか、滴りが止まったらすぐに行ってください。
- 最終的に採取した細胞を「Flow-through」または「CD8 negative」とラベル付けし、1本の遠心分離チューブに結合します。これは、後でフローサイトメトリー による 単離の純度を測定するために使用できます。
- 「CD8+ T cells」とラベル付けされた新しい15 mL遠心チューブを服用します。カラムを磁石から取り外し、遠心分離チューブに置きます。
- 磁気標識されたCD8陽性T細胞を含む両方のカラムを、それぞれ1,000 μLのMACS+バッファーでフラッシュします。したがって、バッファーをカラムにピペットで移し、すぐにメーカーが提供するプランジャーを使用して溶液をカラムから慎重に押し出し始めます。
注:これを両方のカラムで行い、遠心分離で2 mLのT細胞全懸濁液を回収します。 - ノイバウアーカウントチャンバーを使用してT細胞の総数をカウントします。推奨事項:トリパンブルーで1:4に希釈します。
- CFSEによるT細胞の染色
- 単離したT細胞を300 x g で5分間遠心分離します。
- 遠心分離中に、1.1 μL の CFSE 溶液を 10 mL の PBS に混合して、CFSE 染色溶液を調製します。最終濃度は1μMである必要があります。
- 上清を捨て、細胞ペレットを1,000 μLのPBSに再懸濁します。300 x g で5分間遠心分離します。
- 上清を捨て、細胞ペレットを2000 μL CFSE染色溶液(1 μM)に再懸濁します。37°Cで20分間インキュベートします。
- 染色した細胞を300 x g で5分間遠心分離します。上清を捨て、細胞ペレットを1,000 μLのPBSに再懸濁します。
- 300 x g で5分間遠心分離します。上清を捨て、細胞ペレットを適切な量のT細胞培地に再懸濁して、約3〜4mLのT細胞培地中の1.5〜2×106T 細胞の濃度に達する。
- T細胞の6ウェルプレートへの播種
- コーティング液を6ウェルプレートから廃棄します。
- 1ウェルあたり3〜4 mLのT細胞培地に150万〜200万個の単離および染色T細胞を播種します。
- T細胞を37°Cおよび5%CO2 で次の48時間インキュベートします
注:播種密度は常に1.5 Mio細胞/ 3 mLに調整してください。低密度でのT細胞の播種は避けてください。密度を高くすることは可能ですが、テストが必要です。
4. 共培養開始(4日目)
注:タイミング:2時間。HSC4腫瘍細胞の細胞数を決定した後、T細胞を1:1の比率で96ウェルプレートに添加します。
- 条件ごとに1つのウェルを回収して、代表的な細胞数を決定
- 細胞数を決定するために模範的に播種された井戸の上清を捨てます。
- まず、100 μL PBSで細胞を洗浄し、PBSを廃棄します。
- 100 μLのトリプシンを加え、加熱プレート上で5分間インキュベートします。次に、顕微鏡下で単一細胞懸濁液を再懸濁して確認します。細胞が剥離しない場合は、さらに50μLのトリプシンを追加します。
- すべての細胞が分離したらすぐに、D10培地に100μL(または、以前にトリプシンを50μL追加した場合は150μL)を加えてトリプシン反応を停止し、再懸濁します。
- ウェルから全容量200μLを1.5mLサンプルチューブに移し、100μLを使用して細胞数を測定します。測定されたセル番号をサンプル量に合わせて調整することを忘れないでください。
- 非毒性蛍光細胞追跡色素によるHSC4腫瘍細胞の染色
- 2 μL を 20 mL PBS (メーカーによる最終濃度 0.1 μM) に溶解して、セルトラッカー ( 材料の表を参照) を調製します。
- 腫瘍細胞を含むすべてのウェルからD10培地をピペットで取り出し、廃棄します。
- 200 μLのセルトラッカー溶液を腫瘍細胞ウェルに加えます。37°Cで20分間インキュベートします。
- インキュベーション後、染色液を廃棄し、PBS100μLを加えて洗浄してください。その後、PBSも廃棄します。
- 200 μLの新鮮なD10培地を加えます。
- T細胞の回収(6ウェルプレート)
- T細胞を培地に慎重に再懸濁します。ほとんどのT細胞は懸濁状態にあり、ウェルからピペッティングするだけで回収できます。
- ウェルが空であるかどうかを顕微鏡で確認します。そうでない場合は、1,000 μLのトリプシンを使用して収穫し、T細胞が剥離するまでプレートを37°Cの加熱プレートに置き、その後、1,000 μLのPBSまたはT細胞培地(オプション)を追加して反応を停止します。
- ノイバウアーカウンティングチャンバーを使用してT細胞をカウントします。次に、T細胞を300 x g で5分間遠心分離します。
- T細胞をT細胞培地に再懸濁し(2日目のT細胞単離で調製したのと同じ培地を使用)、最終濃度が20 μLあたり10,000 T細胞になるまでです。
- HSC4腫瘍細胞へのT細胞の添加(96ウェルプレート)
- 所望量のT細胞を、以前に決定された腫瘍細胞数に従って、1:1の比率で腫瘍細胞ウェルに添加する。
- 「腫瘍細胞のみ」のコントロールとして、T細胞のない状態ごとに1つの腫瘍細胞を良好に保ちます。この「腫瘍細胞のみ」のコントロールにより、フローデータの正確なゲーティングが可能になります。
- 200 μLのT細胞懸濁液を「T細胞のみ」のコントロール(200,000 T細胞)として空のウェルに加えます。この「T細胞のみ」の制御により、フローデータの正確なゲーティングが可能になります。
- 共培養物を96時間(37°C、5%CO2)インキュベートします。
5. フローサイトメトリーによるT細胞増殖の定量(7日目)
注:タイミング:3時間。共培養物をさらに96時間インキュベートした後、ウェルを回収し、研究仮説に応じて異なる抗体(例えば、抗CD3、CD8、HLA-DR、CD25抗体)を含む抗体混合物で染色します。次に、細胞をマルチカラーフローサイトメトリーで解析します。
- 回収する各ウェルについて、FACSチューブとマイクロ遠心チューブのバッチを準備し、刻印します。
- 細胞の収穫
- 細胞を培地に再懸濁し、FACSチューブに移します。
- 100μLのPBSを使用して細胞を洗浄し、これをFACSチューブに移します。
- 100 μLのトリプシンをウェルに加え、加熱プレート(37 °C)で5分間インキュベートします。
- 細胞を再懸濁し、すべての細胞が剥離している場合は顕微鏡で制御します。その場合は、トリプシン処理された細胞懸濁液をFACSチューブに移します。
- すべてのウェルが空であるかどうかを顕微鏡で確認します。そうでない場合は、手順5.2.3〜5.2.4を繰り返します。
- さらなる実験のために共培養の上清を収集
- 細胞を充填したチューブを300 x g で5分間遠心分離します。
- 約300 μLの上清をチューブから取り出し、別のバッチの微量遠心チューブに慎重にピペッティングして、-20°Cで凍結します。上清は、後で、例えば、分泌されたサイトカインを定量するためのELISAアッセイを実施するために使用することができます。
- 抗体による細胞の染色によるフローサイトメトリーの実施
- 抗体ミックスを調製する:5 μLの抗CD3-Krome Orange、0.5 μLの抗CD8-PerCE-Cyp5.5、1 μLの抗HLA-DR-APCVio770、2.5 μLの抗CD25-PE-Dazzleを91 μLのPBS/FACSバッファーに加えます。
- 200 μLのFACSバッファー(PBSに2% FBSと2% EDTAを添加)を各チューブに加え、再懸濁します。
- 再度300 x g で5分間遠心分離します。上清を捨て、事前に調製した抗体混合物100 μLに細胞を再懸濁します(ステップ5.4.1)。遮光された冷蔵庫で4°Cで30〜45分間インキュベートします。
- インキュベーション後、300 x g で5分間遠心分離します。上清を捨て、細胞を100μLのFACSバッファーに再懸濁します。
- 前述のすべての蛍光抗体とCSFEシグナルを識別できるサイトメーターでフローサイトメトリーを実施します。
6. ゲーティング戦略とデータ分析
- ダブレットを除外し、正しいT細胞集団を特定します(図2A)。
- 前方 対に基づくダブレット母集団を除外します。側方散乱領域(FSC-A 対。SSC-A) (シングレット)。
- 前方 対T細胞に基づくT細胞の同定のための「シングレット」をプロットします。側方散乱領域(FSC-A 対。SSC-A)(T細胞)。
注:最適なサイズ除外のために、「T細胞のみ」と「腫瘍細胞のみ」のサンプルを並行して測定します(図2B)。 - SSC-Aに対するCD3発現をプロットして、T細胞を識別します。さらに、CD8陽性T細胞は、SSC-Aに対してCD8シグナルをプロットすることにより同定することができる。すべてのT細胞はCD3+/CD8+(CD8+ T細胞)です(図2A)。
- すべての「CD8+ T細胞」のCFSEシグナルをヒストグラムとしてプロットします。
注:非増殖性亜集団(最も高いCFSEシグナル)、増殖性亜集団(CFSEシグナルが減少したすべてのT細胞)、および増殖性の高い亜集団(4番目 以下の集中CFSEピークのすべてのT細胞)のゲーティング。
- T細胞集団上の活性関連表面マーカーの解析
- ゲート手順(手順6.1)に従います(図3A)。
- オプションA:「CD8+ T細胞」をインプットとして選択し、SSC-A特性に対するそれぞれの表面マーカー蛍光をプロットすることにより、CD25またはHLA-DRの発現について分析します。
注: 明確な CD25-high サブポピュレーションが検出される場合は、CD25-high ポピュレーションのゲーティングが推奨される。同じことが、T細胞上のHLA-DRのゲーティング/解析にも当てはまります(図3B)。 - オプションB:「CD8+ T細胞」をインプットとして選択し、SSC-A特性に対するそれぞれの表面マーカー蛍光をプロットすることにより、CD25またはHLA-DRの発現について分析します。
注:明確な亜集団が検出されない場合(分析された表面マーカーに依存)、T細胞集団全体の平均蛍光強度(MFI)のシフトの分析が推奨されます(図3C)。
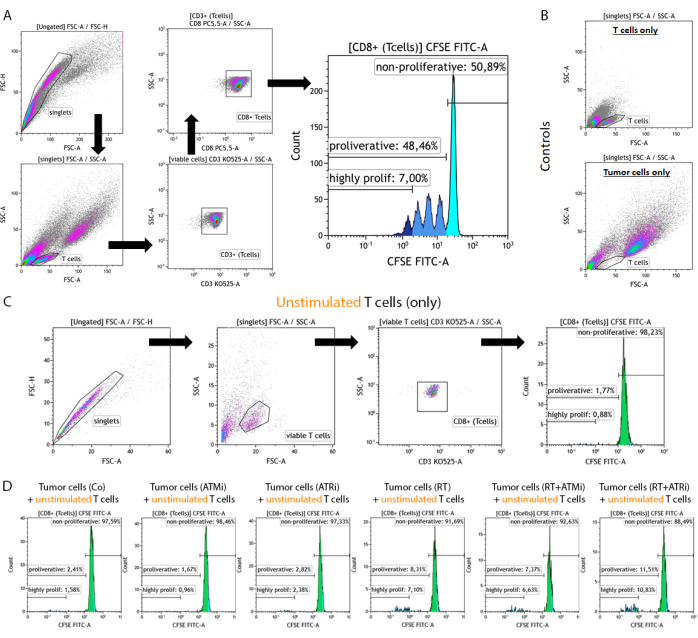
図2:前処理したHNSCC腫瘍細胞との共培養96時間後の増殖を分析するための、CFSE染色した事前刺激T細胞のゲーティング戦略。 T細胞および腫瘍細胞は、共培養の96時間後に96ウェルプレートから採取し、T細胞特異的表面マーカーを用いて染色し、フローサイトメトリーデバイスを用いて測定します。(A)ダブレットはFSC-A/FSC-Hに基づいて除外し、T細胞は最初にサイズ(FSC-A/SSC-A)でゲーティングしました。T細胞は、CD3(抗CD3 Krome Orange)およびCD8(抗CD8 PerCP-Cy5.5)の発現についてさらに分析されました。CD3+/CD8+ T細胞をヒストグラムにプロットし、CFSEシグナル強度を解析しました。CFSEシグナルは、多様な増殖挙動を持つT細胞サブグループを表しています。CFSEシグナルが最も高いT細胞を「非増殖性」と定義しました。細胞分裂によってシグナルが半減したことにより、CFSE シグナルの喪失を示すすべての亜集団が明確なピークで「増殖性」と要約されました。3回以上分裂したT細胞(CSFEシグナルピークが3回以上)を「高増殖性」と定義しました。(B)対照として、前刺激T細胞のみおよび前処理腫瘍細胞のみからなるサンプルを追加測定する。T細胞とHSC4腫瘍細胞は、FSC-AとFSC-A を使用してサイズで識別できます。SCC-A信号。さらに、非刺激CD8+ T細胞を分析して、同種腫瘍細胞単独との共培養に基づくT細胞の活性化を確認しました。(C)コントロールとして、共培養と並行して、刺激されていないCFSE染色T細胞の96時間インキュベーションが含まれた。(D)刺激を受けていないCFSE染色T細胞を、前処理した腫瘍細胞と共培養した。96時間後、細胞を回収し、標準的な手順を用いてCFSEシグナルを測定しました。刺激を受けていないT細胞は、単独でも、前処理した腫瘍細胞との共培養後も増殖を示さなかった。 この図の拡大版を表示するには、ここをクリックしてください。
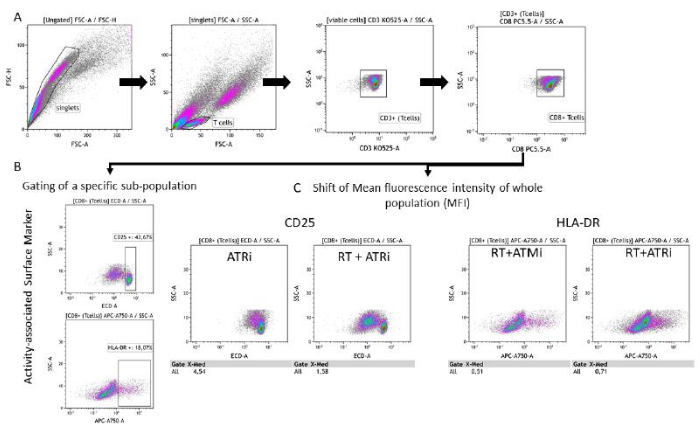
図3:前処理したHNSCC細胞との共培養96時間後のT細胞活性に関連する表面マーカー発現(CD25およびHLA-DR)のゲーティング戦略。 (A)ダブレットはFSC-A/FSC-Hの特性に基づいて除外し、T細胞は最初にサイズ(FSC-A/SSC-A)でゲート化しました。T細胞は、CD3(抗CD3 Krome Orange)およびCD8(抗CD8 PerCP-Cy5.5)の発現についてさらに分析されました。T細胞表面上の活性マーカーCD25(抗CD25 PEDazzle594)およびHLA-DR(抗HLA-DR APC-Vio770)のゲーティングは、2つの異なる設定で行うことができます。(B)密度プロットに基づく、特定のCD25高 亜集団またはHLA-DR高 亜集団の割合に対するすべてのCD8+ T細胞のゲーティング。(C)あるいは、両方の活性マーカーについて、全CD8+ T細胞集団のMFIシフトの測定を行う。HSC4腫瘍細胞との共培養後のT細胞表面マーカー発現の解析から得られた代表的な画像を示します。 この図の拡大版を表示するには、ここをクリックしてください。
結果
HNSCCに由来するHSC4腫瘍細胞を播種し、一晩インキュベートしました。24時間後、細胞をキナーゼ阻害剤で処理した。3時間後、画分あたり5Gyの最初の2回の投与を適用した。24時間後、2回目の投与を適用し、細胞を再び一晩インキュベートした。並行して、共培養開始の48時間前に、健康なドナーの血液からT細胞を単離した。まず、密度勾配遠心分離チューブと滅菌分離培地を使用してPBMCを単離しました。PBMCは細胞計数チャンバーを使用してカウントし、CD8+ T細胞はCD8+ T細胞単離キットを使用して単離しました。次に、単離されたCD8+ T細胞をCFSE(1 μM)で染色し、その後カウントしました。T細胞は、密度1.5 x 106 細胞/3 mLのCD3/CD28プレコートウェルプレートに播種しました。48時間の刺激後、T細胞を回収し、カウントし、10,000細胞/10μLの密度で再懸濁した。T細胞を腫瘍細胞に1:1の比率で添加した。共培養物を96時間後に回収し、上清を-20°Cで保存し、細胞を染色し、フローサイトメトリーで測定しました(図1)。
T細胞は、サイズ排除およびCD3/CD8陽性によって同定された。CD3+/CD8+陽性細胞のCFSEシグナルは、非増殖性T細胞の分布(高CFSEシグナル)と増殖性T細胞の異なる亜集団(CFSEシグナル強度の喪失)を示しました。増殖するT細胞の割合を、HSC4 HNSCC細胞株について例示的に測定しました(図4A)。少なくとも1つの分裂を示したすべてのT細胞を「増殖性」と定義しました。3回以上の分裂を示したT細胞は、「高増殖性」と定義されました(図4B)。HPV陰性細胞株HSC4については、T細胞を照射した腫瘍細胞と共培養すると、増殖速度のわずかな増加が認められました。RTおよびRTとATRの阻害の併用は、T細胞とRTとATMの阻害を併用したHSC4細胞の共培養と比較して、連続的なT細胞増殖を有意に増加させました。T細胞の「増殖性の高い」画分に関しては、HSC4細胞をRTで前処理し、さらにATRを阻害することが、T細胞の増殖を刺激するのに最も効果的でした(図4B)。

図4:HSC4治療依存性T細胞増殖の変化を解析するためのCFSE染色T細胞の増殖(A)前処理済みHPV陰性HSC4腫瘍細胞との共培養96時間後の増殖T細胞の割合。RT+ATMi処理HSC4腫瘍細胞との共培養後のT細胞増殖は、RTまたはRTとATRiの併用療法と比較して有意に低かった。(B)HSC4腫瘍細胞のRTは、高増殖性T細胞のより高い割合(3つ以上の細胞分裂)を誘導した。RT+ATRi前処理したHSC4腫瘍細胞をT細胞と共培養したところ、増殖性の高いT細胞の割合が最も高かった。バーは、4人の独立した健康なドナー(n = 4;平均±SD)。(*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001; 統計的有意性は、正規分布していないデータに対して両側のマンホイットニーUを使用して、すべての実験条件をそれぞれと比較することによって検定されました。この図の拡大版を表示するには、ここをクリックしてください。
増殖ベースのCFSE損失は、T細胞の増殖速度を定量化するために使用できます。さらに、CD25およびHLADRなど、いくつかの細胞表面マーカーがT細胞活性と関連していると記載されている。そこで、すべてのCD3+およびCD8+ T細胞の表面上のCD25およびHLA-DRをフローサイトメトリーで解析しました(図5)。この発現は、異なるCD25高 またはHLA-DR高 亜集団が検出され、これらの高陽性細胞をゲーティングすることで識別できる場合に定量化できます(図3B)。明確な部分集団が検出されない場合は、全集団の平均蛍光強度(MFI)を測定し、MFIの状態ベースのシフトを定量化できます(図3C)。
例示的に、CD25およびHLA−DRのMFIによって同定された発現を、前処理したHSC4腫瘍細胞との共培養の96時間後に分析した(図5)。T細胞とRT処理HSC4腫瘍細胞を共培養した後、T細胞上のCD25の発現は強くダウンレギュレーションされました。特に、ATMiのみによる腫瘍細胞の前処理は、ATRiの前処理と比較して、CD25の発現を有意に減少させる結果となりました。RTとの組み合わせでは、RTはT細胞上のCD25の発現を減少させるが、RTとATMiの組み合わせは、RTとATRiの併用と比較してCD25の発現を増加させる結果となった(図5A)。T細胞上でのHLA-DRの発現に関しては、RTは一般にHLA-DRのアップレギュレーションをもたらしましたが、ここでもATMiまたはATRiのいずれかとの組み合わせでは、異なる挙動が観察されました(図5B)。RT+ATRiの組み合わせで前処理したHSC4細胞と共培養したT細胞は、RT単独またはRT+ATMiと比較してHLA-DRの発現を増加させました。
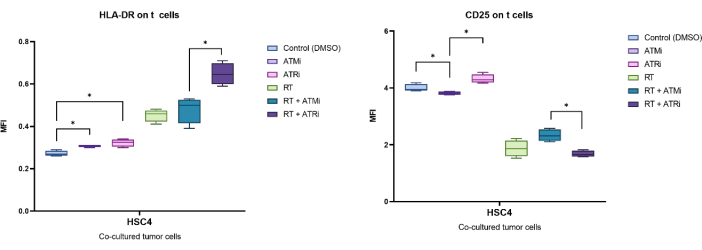
図5:前処理したHSC4腫瘍細胞との共培養96時間後のT細胞表面での活性化マーカーCD25およびHLA-DRの発現。 CD25とHLA-DRの発現は、T細胞集団全体のMFIのシフトに基づいて解析されました。HSC4のRTは、T細胞上のCD25の発現減少とHLA-DRの発現増加をもたらしました。RTとATMiの組み合わせは、RTとATRiの併用と比較して、発現パターンが大きく異なる結果となりました。箱ひげ図は、4人の独立した健康なドナー(n = 4;平均±SD)。データは、正規分布していないデータ(*p≤ 0.050)に対して両側のMann-Whitney-U検定を使用して、すべての実験条件を相互に比較することによって分析されました。 この図の拡大版を表示するには、ここをクリックしてください。
これらのデータは、腫瘍細胞、この場合はHSC4 HNSCC細胞の治療が腫瘍細胞の免疫原性に影響を与えることを例示しています。これは、腫瘍細胞と事前に刺激されたT細胞との共培養によって監視でき、これにより、適用された腫瘍細胞治療レジームに基づいて、ヒトT細胞に対する多様な増殖挙動と活性化マーカーの発現がもたらされます。
ディスカッション
ここで紹介するプロトコールは、前処理済みの腫瘍細胞との共培養環境で、T細胞の増殖能とその活性化状態を迅速かつ容易に分析する方法を提供します。これにより、RT、CT、TT などのさまざまな治療法が T 細胞の活性と増殖に及ぼす影響を簡単にスクリーニングでき、その後の有望なアプローチのより深い免疫学的解析の基盤を構築できます。この原稿に示されている代表的な結果は、この同種T細胞共培養アッセイが良好に機能していることを証明しています。T細胞の増殖およびT細胞活性に有意差が認められました。この 共培養では、分別前処理したヒトHSC4(HNSCC)細胞との共培養で、T細胞の増殖およびT細胞活性に有意差が認められました(図4および 図5)。HSC4をRT単独またはTTと併用して処理すると、特に増殖性の高いT細胞画分に関して、T細胞の増殖が増加することがわかりました(図4)。増殖速度の定量化に沿って、T細胞の活性化状態も異なる治療体制によって異なる影響を受けました。要約すると、RTの適用は、T細胞上のCD25の発現の強力なダウンレギュレーションをもたらしましたが、HLA-DRの発現はアップレギュレーションされました。RTは、照射された腫瘍細胞にDNA損傷を誘導し、その結果、ストレスおよび損傷関連分子およびサイトカインの放出、ならびに免疫調節細胞表面リガンドの発現を含む細胞ストレス応答を引き起こす19。
RTとTTをDNA修復阻害剤の形で組み合わせると、腫瘍細胞はRTによって誘発されたDNA損傷を効率的に修復できないため、これらの効果をさらに強化および維持します。これは、免疫原性因子の分泌および免疫原性細胞表面リガンドの発現をさらに促進し維持し得る20。これに従って、RTおよびDNA損傷阻害剤による腫瘍細胞(HNSCC)の治療が腫瘍細胞表面の免疫表現型を変化させることを以前に実証しました。免疫表現型の調節には、免疫刺激分子ICOS-Lおよび免疫抑制分子PD-L1の制御が含まれていました11。この腫瘍細胞免疫表現型の調節に応答して、T細胞は細胞表面の活性化マーカーの発現も調節する可能性があります。さらに、RTは、IFNγやIL-6などの炎症誘発性サイトカインの放出を刺激することがよく知られており、これがT細胞の増殖と活性に影響を与える21。T細胞上の活性化マーカーの発現は、非常に動的なプロセスです。Zimmermanらの データは、CD25が刺激の24時間後に高発現するが、刺激の96時間後に再びダウンレギュレーションされることを示しました。これは、私たちの調査結果と一致しています。対照的に、HLA-DRは後期の活性化マーカーであり、一般にCD25およびCD69の増加が先行する23。注目すべきは、RT + ATRiの組み合わせは、RT + ATMiと比較して、T細胞上のHLA-DRの有意なアップレギュレーションをもたらすことです。この知見は、炎症性TME24の誘導におけるATRi + RTの相乗効果を実証したDillionらの研究と一致しています。T細胞の活性と増殖のあまり目立たない調節は、キナーゼ阻害剤単独による腫瘍細胞治療によって達成されました(図5)。これは、DNA修復阻害剤であるATMiおよびATRiがRT誘発性DNA損傷の増強剤として機能しているため、単剤療法として適用すると免疫原性があまりないことが原因である可能性があります。ATMiまたはATRi単独の毒性が最小限であることをすでに実証しています11。要約すると、この結果はRT(およびDNA損傷阻害剤を含むTT)の免疫原性の可能性を確認し、さらに、この実験システムがヒト頭頸部がん細胞における異なる治療法の免疫刺激能力のスクリーニングに適していることを示しています。
ここで紹介する方法は簡単で堅牢ですが、プロトコルには事前に考慮しなければならない重要なステップがいくつかあります。単離プロセス中、およびT細胞のフローサイトメトリー分析中に高濃度のEDTAが存在する必要があります。したがって、ドナーの血液をEDTAコーティングされた収集チューブに収集し、10 mM EDTAを添加したMACSバッファーを使用して、効率的なT細胞の単離とフローサイトメトリー評価のための均質な単一細胞懸濁液の生成を確保することをお勧めします。さらに、T細胞培地の組成は、T細胞の増殖能力にとって非常に重要です。L-アルギニンはT細胞の代謝と生存に重要であり、適切な濃度で供給する必要があるため、異なる培地組成物をテストした後、低濃度のL-アルギニンとL-リジンを含む培地は最高のT細胞増殖シグナルをもたらします25,26。それにもかかわらず、L-アルギニンおよびL-リジン溶液は長期的に安定していないため、3か月以内に使用する必要があることに留意する必要があります。最適な刺激を得るためには、アミノ酸を添加したT細胞培地は、T細胞培養実験ごとに新たに調製する必要があります。さらに、T細胞の細胞数と腫瘍細胞の細胞数は、実験の読み出しに影響を与えるため、考慮する必要がある重要な要素です。
腫瘍細胞については、一方では、共培養実験の終了時に70%から80%の細胞密度が望まれます。腫瘍細胞の過剰増殖は、細胞増殖を阻害する因子の分泌をもたらす可能性があり、その後、T細胞の増殖速度にも影響を与える可能性があります。腫瘍細胞の増殖は個々の細胞株に大きく依存するため、それぞれの腫瘍細胞株の増殖挙動を、異なるウェルプレートおよび異なる治療体制で徹底的に試験することをお勧めします。さらに、腫瘍細胞とT細胞は1:1の比率で共培養する必要があります。したがって、各治療条件に対して腫瘍細胞の追加のウェルを播種することが義務付けられており、これは共培養の開始日に細胞数を決定するために使用できます。これにより、さまざまな治療条件に適した数のT細胞が播種されることを確認できます。T細胞の細胞数に関しては、健康なドナーから単離できるT細胞の量は非常に個人的であることを考慮する必要があります。T細胞は、健康なドナーのPBMCの約45%から70%を占める27。したがって、必要なT細胞の量は、採血時にすでに広く推定されているはずです。さらに、T細胞密度は、T細胞の活性化の効率とその生存にとって重要です。したがって、T細胞は、共培養開始前の初期刺激のために、6ウェルプレートのウェルあたり少なくとも150万個の細胞を3mLのT細胞培地に播種する必要があります。T細胞密度を高くすることは可能ですが、密度を低くすることは避けるべきです。活性化されたT細胞は細胞クラスターを形成する傾向があるため、T細胞の活性化は顕微鏡下で形態学的に評価することもできます。
この方法は、さまざまな腫瘍細胞株や治療法の免疫賦活能力を研究するための簡略化された実験システムであるため、考慮すべきいくつかの制限があります。まず、このアッセイは同種異系に基づいているため、ドナーT細胞はそれぞれの腫瘍細胞株とHLAが一致していません。したがって、このHLAミスマッチは、腫瘍細胞治療28からのさらなる刺激なしに、すでにT細胞刺激を誘発し、続いてT細胞増殖を誘導している可能性がある。この望ましくない影響を定量化するために、単離されたT細胞を、CD28およびCD3抗体による事前の刺激なしにHSC4細胞株と共培養しました。この設定では増殖がほとんど誘導されないことがわかったため、この特定の実験環境では、HLAミスマッチがT細胞の活性化にわずかな影響を与えるだけであることを示しています。さらに、同種環境にもかかわらず、腫瘍細胞治療に基づくT細胞の増殖と活性化に有意差が見られました。それにもかかわらず、このアッセイを確立するためには、実験の開始時にT細胞の潜在的な同種異系誘導増殖を一度試験し、定量する必要があります。推奨される「T細胞のみ」および「腫瘍細胞のみ」のコントロールは、十分なゲーティングに必要であり、実験のすべての再現に必須です。それにもかかわらず、同種共培養システムには腫瘍特異的抗原認識が欠けていることに留意する必要があります。したがって、このシステムは、患者29,30においてin vivoで起こるような特異的抗腫瘍応答を正確に反映していない可能性がある。さらなる改善のためには、より洗練された環境が自己の共培養アプローチです。この設定では、患者由来の腫瘍生検を培養し、同じ患者の末梢血から単離されたT細胞を用いて培養する必要がある28。しかし、この実験的アプローチは、原発腫瘍細胞の培養だけでなく、患者由来の生体材料の入手可能性という点でも困難になる可能性があります。考慮する必要があるさらなる制限は、共培養中の腫瘍細胞とT細胞の比率です。細胞の推奨比率は1:1であるため、この比率は患者31におけるTMEの生理学的状況を反映していない。ただし、T細胞数が少ないほど、増殖速度と活性化状態の変化は定量化できないため、この制限を受け入れる必要があります。
腫瘍免疫学の分野では、このアッセイは、簡単かつ迅速な実験 in vitro 設定で、さまざまな治療法の免疫原性をスクリーニングする機会を提供します。したがって、免疫原性の観点から最も有望なアプローチを事前にスクリーニングするだけでなく、 in vivo 実験も行うことで時間を節約できます。動物モデルでは、生物の免疫系全体を反映させるために、有望な治療スキームのみがさらに追求される可能性があるため、動物モデルを減らすことができます。さらに、このアッセイはヒト初代細胞およびヒトがん細胞株に基づいているため、他のモデルシステムや分子種に基づくアッセイよりも、結果を臨床に翻訳しやすい可能性があります。
将来的には、このアッセイは、より具体的な研究課題に答えるために調整され、適応される可能性があります。例えば、患者の状況により近い治療シナリオを反映するために、T細胞の治療を含めることができる。腫瘍反応性T細胞は主にTMEに見られるため、RTなどの局所療法の影響を等しく受け、CTやTTなどの全身療法の影響も受ける可能性があります32。このアッセイのさらなる強化は、腫瘍細胞株からの腫瘍スフェロイドとT細胞の共培養、または患者由来の腫瘍オルガノイドとの共培養です。これらの三次元培養物は、患者の腫瘍の構造により匹敵します28。最後に、フローサイトメトリー による 実験の読み出しも、T細胞の表面上のさらなる分子を調査するため、または腫瘍細胞上の免疫チェックポイント分子の発現を分析するために容易に適応させることができます。T細胞の免疫表現型の決定に加えて、共培養実験で得られた細胞培養上清を使用して、分泌されたサイトカインまたはケモカインを定量化することで、T細胞の活性についてより深い洞察を得ることができます。要約すると、このプロトコルは、包括的で堅牢、かつ容易なT細胞および腫瘍細胞共培養アッセイを提供し、さまざまながん治療法の免疫原性のスクリーニングを可能にします。このアッセイは特定の研究課題に適応できるため、腫瘍免疫学の幅広い分野での応用に適しています。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、エアランゲン臨床研究学際センター(IZKF Erlangen)とバイエルン中央センター(BZKF)から一部資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
参考文献
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved