Method Article
Sıçanlarda Subretinal Enjeksiyon ve Retina Dekolmanı İntraoperatif Görselleştirmesi
Bu Makalede
Özet
Bu makale, hem enjeksiyon bölgesini hem de retina dekolmanı alanını kontrol etmek için intraoperatif görselleştirmeyi kullanan sıçanlarda subretinal enjeksiyon yöntemlerini açıklamaktadır.
Özet
Subretinal enjeksiyon, fotoreseptörler ve retina pigment epiteli (RPE) arasında bir çözeltinin verilmesi, bileşenlerin fotoreseptörler ve RPE hücreleri ile doğrudan temas halinde olduğu bir subretinal boşluk oluşturur. Bu dağıtım yöntemi, bu hücrelerin hedefe yönelik tedavisine izin verir. Subretinal enjeksiyon için terapötikler, özellikle kalıtsal retina hastalıkları için geliştirilmiş ve onaylanmıştır. Hayvanlarda, özellikle kemirgenlerde, lens boyutu nedeniyle subretinal enjeksiyon prosedürleri zor olabilir. Bu makale, sıçanlarda subretinal enjeksiyon yöntemlerini, insanlarda olduğu gibi hem enjeksiyon bölgesinin hem de dekolman alanın boyutunun intraoperatif görselleştirmesini ve kontrolünü sağlar. İşlem genel ve lokal anestezi altında yapılır ve göz bebeği genişlemesi gerektirir. Bir oftalmik mikroskop kullanılarak, subretinal enjeksiyon, bir retinotomi oluşturmak için kanül ucu retinaya nazikçe uygulanarak 30 G'lik bir skleral kanaldan gerçekleştirilir. 10-25 μL arasında değişen hacimler, sıçan retinasının beşte ikisi ila yarısına karşılık gelir. Fundus fotoğrafçılığı ve optik koherens tomografi kullanılarak yapılan hemen postoperatif muayeneler, görünür subretinal sıvı ile subretinal boşluğa başarılı bir şekilde doğumu doğrular. Bu işlemin başlıca riskleri arasında lens hasarı (katarakt), dekolman yetmezliği, intravitreal kanama, subretinal kanama ve ameliyat sonrası keratit yer alır. Terapötiklerin subretinal boşluğa verilmesine ek olarak, bu teknik, sırasıyla sulu veya viskoz ürünler kullanılarak kısa süreli veya uzun süreli retina dekolmanı indüklemek için kullanılır. Transskleral yaklaşımdan farklı olarak, bu yöntem retina dekolmanı için hassas intraoperatif pozisyonizasyon sağlar.
Giriş
Retina, göz küresinin iç ve arka kısmında yer alan ışığa duyarlı bir nöronal dokudur. Nöroretinanın dış tabakası, ışığı elektrokimyasal sinyallere dönüştürmeye adanmış özel nöronlar olan ve bu nedenle görme için gerekli olan fotoreseptörler içerir. Nöroretinanın altında bulunan retina pigment epiteli (RPE), fotoreseptörlere geniş metabolik destek sağlayarak görsel pigment rejenerasyonunu ve dış segmentlerinin düzenli olarak yenilenmesini kolaylaştırır1.
Fotoreseptör dejenerasyonu, geri dönüşü olmayan görme kaybının en yaygın nedenidir ve yaşa bağlı makula dejenerasyonu, retinitis pigmentosa, diyabetik retinopati ve retina dekolmanı gibi çeşitli retina hastalıklarında ortaya çıkar 1,2,3,4. Bu koşulların çoğu, genellikle RPE kaybına veya disfonksiyonuna ikincil olan birincil veya ikincil fotoreseptör kaybından kaynaklanır. Bu nedenle, dejenerasyonlarını önlemek için fotoreseptörleri ve RPE hücrelerini in vivo olarak incelemek özellikle önemlidir. Bugüne kadar, retina distrofileri (retinitis pigmentosa dahil) veya makula dejenerasyonu (yaşa bağlı makula dejenerasyonu dahil) gibi çok sayıda retina hastalığı için etkili bir tedavi mevcut değildir.
Fotoreseptörler ve RPE arasında bir çözeltinin verilmesi olan subretinal enjeksiyon, bileşenlerin fotoreseptörler ve RPE hücreleri ile doğrudan temas halinde olduğu bir subretinal boşluk yaratır. Bu dağıtım yöntemi, çeşitli retinal veya vasküler engelleri atlayarak bu hücrelerin hedefe yönelik tedavisine izin verir. Özellikle kalıtsal retina hastalıkları için subretinal uygulama için çeşitli terapötikler geliştirilmiş ve onaylanmıştır 5,6.
Subretinal doğum için cerrahi uygulamaların uyumlu hale getirilmesi önemlidir. İnsanlarda standart prosedür, lensin tüm göze oranla küçük olması nedeniyle gözün arka segmentine nispeten kolay erişim sağlayan 25 G pars plana vitrektomiyi içerir. Subretinal uygulama, 38 G veya 41 G silikon uçlu biyouyumlu kanül kullanılarak 25 G'lik bir trokar aracılığıyla gerçekleştirilir ve düzgün transretinal akışa izin verir5.
Hayvanlarda, lens boyutu nedeniyle subretinal enjeksiyon prosedürleri zor olabilir. Örneğin, kemirgenlerde lens, vitreus boşluğunun %90'ını kaplar. Sıçanlarda, lens farelere göre daha az yer kaplar, ancak önemli kalır (bkz. Şekil 1A). Ek olarak, subretinal enjeksiyonlar, RPE hücreleri tarafından subretinal sıvı klerensini önlemek için viskoz solüsyonlar kullanarak retina dekolmanı (RD) modellemek için kullanılabilir 7,8. Bu modeller öncelikle retina hastalıkları için terapötiklerin geliştirilmesinde kullanılmaktadır.
Bu makale, sıçanlarda subretinal uygulama veya indüklenmiş RD yöntemlerini açıklar ve enjeksiyon bölgesinin ve dekolman retina alanının toplam intraoperatif kontrolünü sağlar.
Protokol
Deneyler ve prosedürler Yerel Hayvan Etik Kurulu tarafından onaylandı ve yerel mevzuata uygun olarak laboratuvara bağlı tesislerde gerçekleştirildi. Tüm deneysel çalışmalar, biyogüvenlik ve güvenlik prosedürlerine ilişkin kurumsal politikalara (Yerel Hayvan Etik Komitesi, Charles Darwin, CEEACD #5) bağlı kaldı ve 2010/63/EU sayılı Avrupa Direktifini takip etti. Bu çalışmada sekiz haftalık vahşi tip dişi Long Evans sıçanları (Rattus norvegicus) kullanıldı. P23H ve RCS gibi sıçanların çeşitli retinal dejenerasyon modelleri, ilaçlar ve gen terapileri dahil olmak üzere farklı terapötiklerin subretinal iletimini test etmek için kullanılabilir. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda verilmiştir.
1. Çözeltilerin hazırlanması
- Subretinal dağıtım: Sulu subretinal dağıtım için molekülleri PBS veya dimetil sülfoksit içinde seyreltin.
- RD İndüksiyonu: Uzun süreli RD'yi indüklemek için% 2 hidroksipropil metilselüloz veya% 1 -% 5 sodyum hyaluronat kullanın.
2. Deney düzeneği
- 10 μL veya 25 μL'lik bir şırınga üzerine yapıştırılmış, eğimsiz 10 mm 30 G kanül metal ucunu bir mikroenjektöre monte edin.
- Hazırlanan çözeltiyi şırıngaya yükleyin.
3. Hayvan hazırlama
- Anestezi
- Genel anestezi: Sıçanları intraperitoneal 40 mg / kg ketamin ve 0.14 mg / kg medetomidin enjeksiyonu ile uyuşturun.
NOT: Bu anestezi, işlem süresince ve hemen ameliyat sonrası eksplorasyonlar için yeterince uzun sürer. - Göz bebeği genişlemesi: Bir gözde midriyazis elde etmek için bir damla% 0.5 tropikalamid koyun.
NOT: Sağ elini kullanan cerrahlar için işlem sol gözde daha kolay olacaktır ve bunun tersi de geçerlidir. - Lokal anestezi ( Şekil 2B): Ameliyat edilecek göze bir damla oksibuprokain koyun.
- Genel anestezi: Sıçanları intraperitoneal 40 mg / kg ketamin ve 0.14 mg / kg medetomidin enjeksiyonu ile uyuşturun.
4. Mikroskop altında cerrahi
- İntraoperatif görselleştirme: Ameliyatı gerçekleştirmek için ayak pedalına bağlı bir oftalmik mikroskop kullanın.
- Skleral maruziyet (Şekil 2C,D)
- Üst ve alt göz kapaklarında palpebral kenarın dış çeyreğine sabitlenmiş iki göz kapağı çekme dikişi (5-0 veya 6-0) kullanın.
- Gözün hafifçe şişmesini sağlamak için dikişleri çekin.
- Skleral kanal (Şekil 2E,F): Kornea limbustan yaklaşık 1-2 mm uzakta, temporal bulbar konjonktiva boyunca bir skleral kanal oluşturmak için 30 G'lık bir iğne kullanın.
NOT: Lense dokunma ve ardından katarakt riskini önlemek için eğimli iğne ucunu daha fazla itmeden zar zor sokun. Bu aşamada onlarca saniye boyunca konjonktival kanama olup olmadığını gözlemleyin. Kanamayı tamponlamaktan kaçının, çünkü bu vitreusta kan birikmesine neden olabilir ve prosedürü tehlikeye atabilir. Kanal bölgesindeki veya görselleştirmeyi engelleyen kanı pamuklu çubuk kullanarak nazikçe silin. - Kornea koruması (Şekil 2G): İşlem boyunca lens-göz arayüzü olarak gözyaşı jeli kullanın.
- Retina düzleminin görselleştirilmesi (Şekil 2G)
- Retina düzlemini uygun büyütme ile görselleştirmek için göz yüzeyine düz bir kontakt lens (8 mm çapında) yerleştirin.
- Retina düzlemine odaklanmak için mikroskobun ayak pedalını kullanın.
- Subretinal enjeksiyon (Şekil 2H - M)
- Kanülü önceden oluşturulmuş skleral kanaldan dikey olarak yerleştirin (Şekil 2H).
- Kanülü dikey tutarak lense dokunmaktan kaçının.
- Yavaşça retinaya yaklaşın ve retina beyazlaması görülene kadar hafifçe bastırın ( Şekil 2I'deki oklar).
- Enjeksiyon akışı tarafından oluşturulan retinotomi yoluyla enjekte ederken ucun stabilitesini koruyun (Şekil 2J). Ucu retinotomiden çok erken çekmekten kaçının, çünkü bu ürünün vitreusa enjekte edilmesine neden olur.
- Enjeksiyondan sonra, ucu retinotomiden çıkarın ve ardından lense dokunulmadığından emin olarak tüm kanülü vitreus boşluğundan nazikçe çekin (Şekil 2K).
NOT: Şırınga boşaldığında bleb yeterince gelişmemişse veya dekolman retina alanı çok kısıtlıysa, aynı skleral kanalı kullanarak ve ucu daha önce oluşturulmuş retinotomiye sokarak bir reenjeksiyon gerçekleştirin. - Vitreus boşluğu içindeki kan akışını gözlemlemeden pupiller kırmızı refleksin retina dekolmanı tarafından değiştirildiğinden emin olun (Şekil 2L,M).
- Ameliyatın sonu (Şekil 2N,O)
- Göz kapağı dikişlerini çıkarın ve herhangi bir kanamayı dikkatlice sürün.
- Göz içi basıncını kısaca manuel olarak değerlendirin.
NOT: Subkonjonktival boşluğa az miktarda vitreus sıvısı ortaya çıkabilir, ancak aktif sızıntı olmamalıdır (Şekil 2O).
5. Ameliyat sonrası bakım ve uyanış
- Ameliyat edilen göze kloramfenikol-retinol göz merhemi sürün.
- İntraperitoneal olarak 1 mL% 5 glikoz monohidrat uygulayın.
- Deri altına 0.9 mg / kg atipamezol enjekte edin.
- Hayvanı sıcaklık kontrollü bir odaya yerleştirin ve uyanana kadar izleyin.
Sonuçlar
Bir subretinal enjeksiyonun başarısı, kan fotoreseptörler ve RPE hücreleri için toksik olduğundan, subretinal kanamayı önleyerek, retinotomi yoluyla subretinal boşluğa (yani fotoreseptörler ve RPE katmanları arasında) kesin ve özel olarak verilmesine dayanır. Başarılı doğum, intraoperatif görselleştirme (Şekil 2L), hemen postoperatif fundus fotoğrafçılığı ve optik koherens tomografi (OCT) ile doğrulanır. Fundus fotoğrafçılığı subretinal kanamayı dışlarken, OCT B taramaları berrak subretinal sıvı ile retina dekolmanını (RD) doğrular (Şekil 1 ve Şekil 3). Ek olarak, fundus fotoğrafçılığı, işlem sırasında fark edilmeyebilecek lens dokunuşunu veya indüklenmiş kataraktları tanımlayabilir (Şekil 3C,D). Hem fotoğraf hem de OCT taramaları, ayrılmış alanın veya blebin boyutunu tahmin edebilir (Şekil 1B-E).
Blebun boyutunu etkileyen birkaç faktör vardır: (1) Enjeksiyon bölgesi konumu: Enjeksiyon bölgesi optik diskten ne kadar uzaksa, ayrılan alan o kadar küçük olur; (2) Enjekte edilen hacim: 20-25 μL'lik bir enjeksiyon hacmi, sıçanlarda retinanın yaklaşık yarısını ayırabilir; (3) Retina dekolmanı kalitesi: Retina dejenerasyon modellerinde (ör., P23H, RCS), gliozis ve subretinal materyal birikimi gibi dejeneratif süreçlerin neden olduğu fotoreseptörler ve RPE hücreleri arasındaki artan direnç nedeniyle dekolman zor olabilir. Bu gibi durumlarda, indüklenmiş retina dekolmanları tipik olarak düzdür ve OCT taramaları, deklooklu alanı net bir şekilde tanımlamak için çok önemlidir.
Retinal mikrodamarlar her zaman tamamen önlenemediği için enjeksiyon bölgesinde minör bir intravitreal kanama meydana gelebilir (Şekil 3E). Bununla birlikte, bu tür kanamalar tipik olarak subretinal boşluğa uzanmaz.
Yetersiz dekolman vakalarında, sorun intraoperatif olarak tanınmalı ve önceden oluşturulmuş retinotomi yoluyla derhal reenjeksiyon yapılmalıdır. 20 sıçanla yapılan deneysel bir seans sırasında, iki cerrah (biri deneyimli ve biri acemi) adım adım yöntemi uyguladı. Deneyimli cerrah 10 işlemden 9'unda başarı elde ederken, başlangıç seviyesindeki kişi 10 işlemden 6'sında başarılı oldu.
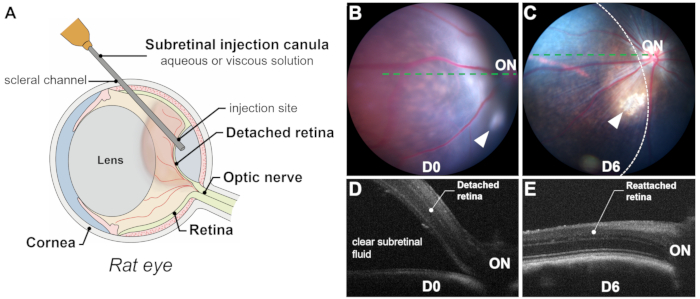
Şekil 1: Sürece ve sonuçlara genel bakış. (A) Bir sıçan gözünde subretinal enjeksiyon işleminin, lensin önemli hacmini gösteren şematik gösterimi. (B,C) Enjeksiyondan hemen sonra (B) ve enjeksiyondan 6 gün sonra (C) fundus fotoğrafçılığı. Ok uçları enjeksiyon bölgesini gösterir. Retina dekolmanı alanı kesikli bir çizgi ile özetlenmiştir. (D,E) Optik koherens tomografi B, enjeksiyondan hemen sonra (D) ve enjeksiyondan 6 gün sonra (E) tarar. AÇIK: optik sinir. Büyütme: 1x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
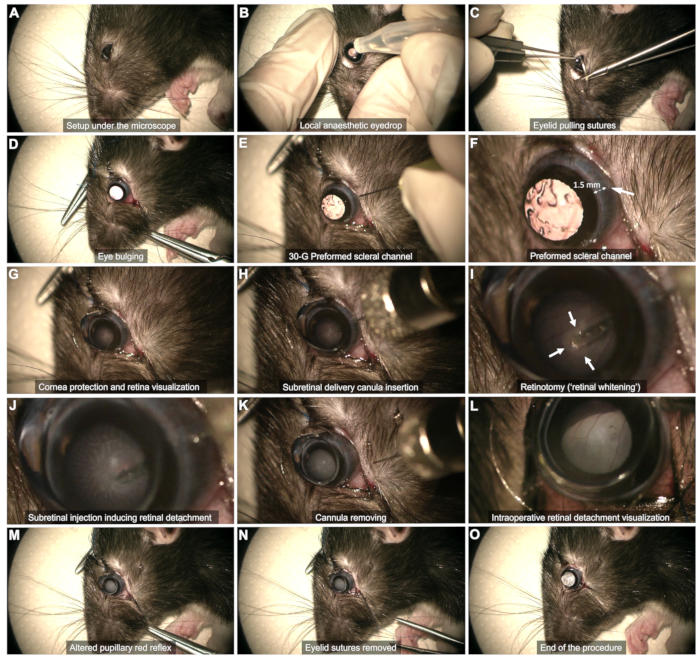
Şekil 2: Subretinal enjeksiyon protokolünün adımları. Protokol, genel anestezi altında 8 haftalık bir Long Evans sıçanında gösterilmiştir. Her adımın ayrıntılı bir açıklaması için videoya veya metindeki "Protokol" bölümüne bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Çeşitli postoperatif fundus fotoğrafçılığı sonuçlarına örnekler. (A) Enjeksiyon bölgesinde minör pigment dağılımı ile normal postoperatif görünüm (ok). (B) Enjeksiyon bölgesinde küçük bir intravitreal hava kabarcığı ile normal postoperatif görünüm. Bu küçük hava kabarcıkları şırıngadan kaynaklanır ve retina altı boşlukta bile zararsızdır. (C,D) Minör (C) veya önemli (D) lens opaklaşması (katarakt) ile sonuçlanan lens dokunuşu. (E,F) Minör (E) veya daha geniş (F) intravitreal kanama, enjeksiyon bölgesinin yakınında lokalize, subretinal boşluğa yayılmaz. (G) Enjeksiyon bölgesi kanaması ağırlıklı olarak subretinal boşluğa yayılıyor. Bu durumda, retinotomi bir retinal kan damarının yaralanmasına neden oldu. (H) Skleral penetrasyondan kaynaklanan geniş intravitreal kanama. Büyütme: 1x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makalede, hem enjeksiyon bölgesinin hem de ayrılmış alanın intraoperatif görselleştirmesi ve kontrolü ile sıçanlarda transvitreal subretinal uygulama yöntemleri anlatılmaktadır.
Bu protokolde iki kritik adım vardır: skleral maruziyet ve retinotomi. Uygun konumlandırma, maruz kalma ve erişim, herhangi bir cerrahi prosedür için temel ön koşullardır. Bu durumda, sklera ve enjeksiyon bölgesine optimum erişimi sağlamak çok önemlidir. Yetersiz skleral maruziyet, sonraki adımlarda önlenebilir zorluklara yol açabilir. Ek olarak, retinotominin kalitesi kanama riskini belirler. Mümkün olduğunca nazik bir şekilde ve herhangi bir retina damarından mümkün olduğunca uzakta yapılmalıdır. Doğru yapılırsa, önemli intravitreal veya subretinal kanama riski çok düşüktür.
Subretinal enjeksiyon için bu yaklaşımı kullanırken, retina dekolmanı (RD) indüksiyonu çeşitli nedenlerle başarısız olabilir. Öğrenme sürecindeki en zorlu adım enjeksiyonun kendisidir. Enjeksiyon bölgesi, sıvının retinotomi yoluyla retina boyunca akmasına izin vermek için dikkatlice seçilmelidir. Kemirgenlerde yoğun arka vitreus gövdesi nedeniyle, transretinal akışa fiziksel bir bariyer görevi görebilir. Deneyimlerimize göre, kanül ucu retinaya yaklaşık 90° açıyla yerleştirildiğinde transretinal penetrasyon sorunsuz bir şekilde gerçekleşir. Özellikle başlangıçta, enjekte edilen çözeltinin sadece subretinal boşluğa aktığını doğrulamak için floresein gibi renkli solüsyonlar kullanarak pratik yapılması şiddetle tavsiye edilir.
Bu tekniğin iki sınırlaması tanımlanabilir. İlk olarak, transvitreal pasaj lense dokunma riski altındadır. Arka lens kapsülü korunursa, katarakt oluşumuna yol açmaması gerektiği için lens dokunuşu zararsız olabilir. Bununla birlikte, arka lens kapsülü hasar görürse, katarakt oluşumu riski yüksektir ve özellikle retina takip muayeneleri gerekiyorsa, hayvan artık deneysel proje için uygun olmayabilir. İkincisi, bu teknik birkaç aşamada kanamaya yol açabilir ve bu da deney sürecini engelleyebilir. Konjonktival kanama göz kapağı dikişlerinden kaynaklanabilir, ancak bu genellikle bir sorun değildir ve pamuklu çubukla temizlenebilir. Ek olarak, işlem sırasında her ikisi de kanama riski taşıyan iki retinotomi yapılır. İlk retinotomi, deneyci retinaya kör iken (skleral kanal yoluyla) gerçekleştirilir, bu da skleral perforasyon sırasında intravitreal kanamaya yol açabilir ve prosedürü daha da karmaşık hale getirebilir. Nadiren subretinal veya koroid kanaması olabilir. Bu 'giriş retinotomisi' kornea9 yoluyla enjekte edilerek önlenebilir, ancak bu yaklaşım olası enjeksiyon bölgelerinin aralığını önemli ölçüde sınırlar. İkinci retinotomi, kanül ucu ile retina damarlarına dokunulduğunda kanama riski daha yüksektir. Kan bileşenleri fotoreseptörler için toksik olduğundan subretinal kanamadan kesinlikle kaçınılmalıdır10. Bu riskler nedeniyle, acemi deneyciler 5'te 1 ila 10 enjeksiyonda 1 arasında bir başarısızlık oranı beklemelidir. Deneyimlerimize göre, koroid dekolmanı, endoftalmi veya hipertoniye bağlı retina hasarı vakasına rastlanmamıştır.
Alternatif olarak, transvitreus pasajı önleyen subretinal uygulama için transskleral yaklaşımları kullanan yöntemler tanımlanmıştır 8,11. Bununla birlikte, deneyimlerimize göre, bu prosedürler doğru veya tekrarlanabilir enjeksiyon bölgelerine veya bleblere izin vermez ve yalnızca fareler kullanılırken yapılmalıdır. Ek olarak, bu prosedürler, RD'nin bulunduğu yerde koroid ve retina pigment epitelini (RPE) geçen bir iğne ile kendi kendine kapanan bir skleral insizyon gerektirir. Bu, enflamatuar sonuçlara yol açabilen ve RD modelini bozabilen subretinal pigment göçü riski oluşturur11. Ayrıca, enjeksiyon, şırınga ucu görünmeden gerçekleştirilir ve RD'den ziyade supra veya subkoroidal dekolman riskini artırır. Ayrıca, özellikle daha ince ve daha kırılgan retinalara sahip retina dejenerasyonu modelleriyle çalışırken, sonraki intravitreal doğuma yol açan istenmeyen retinotomi riski de vardır.
Subretinal doğum veya indüklenmiş RD uygulamaları, retinal dejenerasyon modellerinde veya RD 8,11,12,13,14 vakalarında çeşitli terapötiklerin test edilmesini içerir. Her iki durumda da, prosedürün amacı, sonuçta insanlarda meydana gelen süreçleri taklit etmektir. Hem transskleral hem de transvitreöz yaklaşımlar, RD'nin yüksekliği ve süresi yeterli olduğu sürece RD'yi modelleyebilir15. Subretinal doğum söz konusu olduğunda, mevcut yöntemler insan olmayan primatlarda16 ve insanlarda5 kullanılanları daha yakından kopyalamakta ve böylece verilerin çevrilebilirliğini arttırmaktadır.
Açıklamalar
S.P: Danışman ve kişisel finansal çıkarlar -Pixium Vision, GenSight Biologics (bu faaliyetlerin hiçbiri burada sunulan verilerle ilgili değildir).
Teşekkürler
Bu çalışma IHU FOReSIGHT (Paris), Fondation Voir & Entendre (Paris), UNADEV/Aviesan ("koni fotoreseptör nöroproteksiyonu" projesi kapsamında, Paris), HyVIS (GA 964468), Körlükle Mücadele Vakfı (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). A.D.'nin maaşları, Fondation pour la Recherche Médicale (hibe numarası M2R202106013349, Paris), Fondation de France (hibe numarası WB-2023-49302, Paris) ve Fransız Oftalmoloji Derneği'nden alınan hibelerle sağlandı. Sponsor veya fon sağlayan kuruluşların bu araştırmanın tasarımında veya yürütülmesinde hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Referanslar
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır