Method Article
쥐의 망막하 주사 및 망막 박리에 대한 수술 중 시각화
요약
이 논문은 쥐의 망막하 주사 방법을 설명하며, 주사 부위와 망막 박리 부위를 모두 제어하기 위해 수술 중 시각화를 활용합니다.
초록
광수용체와 망막 색소 상피(RPE) 사이에 용액을 전달하는 망막하 주사는 구성 요소가 광수용체 및 RPE 세포와 직접 접촉하는 망막하 공간을 만듭니다. 이 전달 방법은 이러한 세포의 표적 처리를 가능하게 합니다. 망막하 주사를 위한 치료제는 특히 유전성 망막 질환에 대해 개발되고 승인되었습니다. 동물의 경우, 특히 설치류의 경우 수정체 크기로 인해 망막하 주사 절차가 까다로울 수 있습니다. 이 논문은 쥐에서 망막하 주사를 주사하는 방법을 설명하여 인간에서 수행되는 것처럼 주사 부위와 분리된 영역의 크기를 모두 수술 중 시각화하고 제어할 수 있도록 합니다. 이 절차는 전신 및 국소 마취 하에 진행되며 동공 확장이 필요합니다. 안과 현미경을 사용하여 30G의 공막 채널을 통해 망막하 주사를 수행하며, 캐뉼라 팁을 망막에 부드럽게 적용하여 망막 절제술을 만듭니다. 10-25 μL 범위의 부피를 전달할 수 있으며, 이는 쥐 망막의 2/5에서 절반에 해당합니다. 안저 사진 및 광간섭 단층촬영을 사용한 수술 직후 검사는 가시적인 망막하액이 있는 망막하 공간으로의 성공적인 전달을 확인합니다. 이 절차의 주요 위험에는 수정체 손상(백내장), 박리 실패, 유리체강 내 출혈, 망막하 출혈 및 수술 후 각막염이 포함됩니다. 치료제를 망막하 공간으로 전달하는 것 외에도, 이 기술은 각각 수성 또는 점성 산물을 사용하여 단기 또는 장기 망막 박리를 유도하는 데 사용됩니다. 경공막 접근법과 달리, 이 방법은 망막 박리의 정확한 수술 중 위치 지정을 가능하게 합니다.
서문
망막은 안구의 안쪽과 뒤쪽에 위치한 빛에 민감한 신경 조직입니다. 신경망막의 외부층에는 광수용체(photoreceptor)가 있는데, 광수용체는 빛을 전기화학적 신호로 변환하는 데 전념하는 특수 뉴런이므로 시력에 필수적입니다. 신경망막 아래에 위치한 망막 색소 상피(RPE)는 광수용체에 광범위한 대사 지원을 제공하여 시각적 색소 재생과 외부 분절의 정기적인 재생을 촉진합니다1.
광수용체 변성은 돌이킬 수 없는 시력 상실의 가장 흔한 원인이며 노화 관련 황반변성, 색소성 망막염, 당뇨병성 망막병증, 망막 박리와 같은 다양한 망막 질환에서 발생합니다 1,2,3,4. 이러한 상태의 대부분은 광수용체의 1차 또는 2차 손실로 인해 발생하며, 종종 RPE 손실 또는 기능 장애에 이차적으로 발생합니다. 따라서 광수용체와 RPE 세포의 변성을 방지하기 위해 생체 내에서 연구하는 것이 특히 중요합니다. 현재까지 망막 이영양증(색소성 망막염 포함) 또는 황반 변성(노화 관련 황반 변성 포함)과 같은 수많은 망막 질환에 대한 효과적인 치료법은 없습니다.
광수용체와 RPE 사이에 용액을 전달하는 망막하 주사는 구성 요소가 광수용체 및 RPE 세포와 직접 접촉하는 망막하 공간을 만듭니다. 이 전달 방법은 다양한 망막 또는 혈관 장벽을 우회하여 이러한 세포의 표적 치료를 가능하게 합니다. 망막하 분만을 위한 여러 치료법이 개발되어 승인되었으며, 특히 유전성 망막 질환에 대한 치료법이 승인되었다 5,6.
망막하 분만을 위한 수술 방법을 조화시키는 것이 중요합니다. 인간의 경우 표준 절차에는 25G pars plana vitrectomy가 포함되며, 수정체가 전체 눈에 비해 작기 때문에 눈의 뒤쪽 부분에 비교적 쉽게 접근할 수 있습니다. 망막하 전달은 38G 또는 41G 실리콘 팁 생체적합성 캐뉼라를 사용하여 25G 투관침을 통해 수행되어 원활한 경망막 흐름을 허용합니다5.
동물의 경우 렌즈 크기 때문에 망막하 주사 절차가 어려울 수 있습니다. 예를 들어, 설치류의 경우 수정체는 유리체강의 최대 90%를 차지합니다. 쥐의 경우 수정체가 생쥐보다 공간을 덜 차지하지만 여전히 중요합니다(그림 1A 참조). 또한, 망막하 주사는 RPE 세포에 의한 망막하액 청소를 방지하기 위해 점성 용액을 사용하여 망막하 박리(RD)를 모델링하는 데 사용할 수 있습니다 7,8. 이러한 모델은 주로 망막 질환에 대한 치료제 개발에 사용됩니다.
이 논문은 쥐에서 망막하 전달 또는 유도 RD를 사용하여 주사 부위와 분리된 망막 영역의 수술 중 전체 제어를 가능하게 하는 방법을 설명합니다.
프로토콜
실험 및 절차는 지역 동물 윤리 위원회의 승인을 받았으며 현지 법률에 따라 실험실과 관련된 시설에서 수행되었습니다. 모든 실험 작업은 생물 보안 및 안전 절차에 대한 제도적 정책(지역 동물 윤리 위원회 Charles Darwin CEEACD #5)을 준수했으며 유럽 지침 2010/63/EU를 따랐습니다. 이 연구에는 8주 된 야생형 암컷 Long Evans 쥐(Rattus norvegicus)가 사용되었습니다. P23H 및 RCS와 같은 쥐의 다양한 망막 변성 모델을 사용하여 약물 및 유전자 치료를 포함한 다양한 치료제의 망막하 전달을 테스트할 수 있습니다. 이 연구에 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나와 있습니다.
1. 솔루션 준비
- 망막하 전달: 수성 망막하 전달을 위해 PBS 또는 디메틸 설폭사이드로 분자를 희석합니다.
- RD 유도 : 2 % 하이드 록시 프로필 메틸 셀룰로오스 또는 1 % -5 % 히알루 론산 나트륨을 사용하여 장기 RD를 유도합니다.
2. 실험 설정
- 10 μL 또는 25 μL 주사기에 접합된 비베벨 10mm, 30G 캐뉼러 금속 팁을 마이크로 인젝터에 장착합니다.
- 준비된 용액을 주사기에 넣습니다.
3. 동물 준비
- 마취
- 전신 마취: 40mg/kg 케타민과 0.14mg/kg 메데토미딘의 복강 내 주사로 쥐를 마취합니다.
참고: 이 마취는 시술 기간 동안 그리고 수술 직후 탐색을 할 수 있을 만큼 충분히 오래 지속됩니다. - 동공 확장: 0.5% 트로피카마이드 한 방울을 떨어뜨려 한쪽 눈의 산동을 얻습니다.
참고: 오른손잡이 외과 의사의 경우 왼쪽 눈에서 시술이 더 쉬울 것이며 그 반대의 경우도 마찬가지입니다. - 국소 마취( 그림 2B): 옥시부프로카인 안약 하나를 눈에 넣어 수술합니다.
- 전신 마취: 40mg/kg 케타민과 0.14mg/kg 메데토미딘의 복강 내 주사로 쥐를 마취합니다.
4. 현미경으로 수술
- 수술 중 시각화: 발 스위치에 연결된 안과 현미경을 사용하여 수술을 수행합니다.
- 공막 노출(그림 2C,D)
- 위 눈꺼풀과 아래 눈꺼풀의 안구 가장자리 바깥쪽에 고정된 두 개의 눈꺼풀 당기는 봉합사(5-0 또는 6-0)를 사용합니다.
- 봉합사를 당겨 눈이 부드럽게 튀어나오도록 합니다.
- 공막 채널(그림 2E,F): 30G 바늘을 사용하여 각막 가장자리에서 약 1-2mm 떨어진 측두구결막을 통해 공막 채널을 만듭니다.
알림: 렌즈 접촉 및 후속 백내장의 위험을 피하기 위해 더 이상 밀지 않고 경사진 바늘 끝을 간신히 삽입하십시오. 이 단계에서 수십 초 동안 결막출혈을 관찰하십시오. 출혈을 밟으면 유리체에 혈액이 고여 시술이 위태로워질 수 있으므로 피하십시오. 채널 영역에 있거나 면봉을 사용하여 시각화를 방해하는 혈액을 부드럽게 닦아냅니다. - 각막 보호(그림 2G): 시술 전반에 걸쳐 눈물 젤을 렌즈-눈 인터페이스로 사용합니다.
- 망막 평면의 시각화(그림 2G)
- 눈 표면에 편평한 콘택트렌즈(직경 8mm)를 놓아 적절한 배율로 망막 평면을 시각화합니다.
- 현미경의 풋스위치를 사용하여 망막 평면에 초점을 맞춥니다.
- 망막하 주사(그림 2H - M)
- 미리 형성된 공막 채널을 통해 캐뉼러를 수직으로 삽입합니다(그림 2H).
- 캐뉼러를 수직으로 유지하여 렌즈를 만지지 마십시오.
- 천천히 망막에 접근하여 망막이 하얗게 될 때까지 부드럽게 누릅니다( 그림 2I의 화살표).
- 주입 흐름에 의해 형성된 망막 절개술을 통해 주입하는 동안 팁의 안정성을 유지합니다(그림 2J). 망막 절개술에서 팁을 너무 빨리 빼면 제품이 유리체에 주입될 수 있으므로 피하십시오.
- 주사 후 망막 절개술에서 팁을 제거한 다음 유리체강에서 캐뉼라 전체를 부드럽게 빼내고 렌즈가 닿지 않도록 합니다(그림 2K).
참고: 주사기가 비었을 때 기포가 충분히 발달하지 않았거나 분리된 망막 영역이 너무 제한되는 경우, 동일한 공막 채널을 사용하여 이전에 형성된 망막 절제술에 팁을 삽입하여 재주입을 수행합니다. - 유리체 강 내의 혈류를 관찰하지 않고 망막 박리에 의해 동공 적색 반사가 변경되는지 확인합니다(그림 2L, M).
- 수술 종료(그림 2N,O)
- 눈꺼풀 봉합사를 제거하고 출혈을 조심스럽게 면봉으로 닦습니다(그림 2N).
- 안압을 수동으로 간단히 평가합니다.
참고: 소량의 유리체액이 결막하 공간으로 나올 수 있지만 활성 누출이 발생하지 않아야 합니다(그림 2O).
5. 수술 후 관리 및 각성
- 수술한 눈에 클로람페니콜-레티놀 안연고를 바릅니다.
- 5% 포도당 일수화물 1mL를 복강내 투여합니다.
- 0.9 mg/kg 아티파메졸을 피하주사합니다.
- 동물을 온도 조절이 가능한 방에 넣고 깨어날 때까지 모니터링하십시오.
결과
망막하 주사의 성공 여부는 혈액이 광수용체와 RPE 세포에 유독하기 때문에 망막하 출혈을 피하고 망막절개술을 통해 망막하 공간(즉, 광수용체와 RPE 층 사이)으로 정확하고 독점적인 전달에 달려 있습니다. 성공적인 분만은 수술 중 시각화(그림 2L), 수술 직후 안저 사진 촬영 및 광간섭 단층촬영(OCT)을 통해 확인할 수 있습니다. 안저 촬영은 망막하 출혈을 배제하는 반면, OCT B 스캔은 투명한 망막하액으로 망막 박리(RD)를 확인합니다(그림 1 및 그림 3). 또한 안저 사진 촬영은 시술 중에 눈에 띄지 않을 수 있는 렌즈 터치 또는 유도 백내장을 식별할 수 있습니다(그림 3C, D). 사진 및 OCT 스캔은 모두 분리된 영역 또는 블렙의 크기를 추정할 수 있습니다(그림 1B-E).
몇 가지 요인이 블렙의 크기에 영향을 미칩니다. (1) 주입 부위 위치: 주입 부위가 시신경 디스크에서 멀어질수록 분리된 영역이 작아집니다. (2) 주입량: 20-25μL의 주입량은 쥐에서 망막의 약 절반을 분리할 수 있습니다. (3) 박리된 망막의 질: 망막 변성 모델(예: P23H, RCS)에서는 신경교증 및 망막하 물질 축적과 같은 퇴행성 과정으로 인한 광수용체와 RPE 세포 사이의 저항 증가로 인해 박리가 어려울 수 있습니다. 이러한 경우, 유도된 망막 박리는 일반적으로 편평하며, OCT 스캔은 박리된 부위를 명확하게 묘사하는 데 중요합니다.
주사 부위에서 경미한 유리체강내 출혈이 발생할 수 있는데, 이는 망막 미세혈관을 항상 완전히 피할 수 있는 것은 아니기 때문입니다(그림 3E). 그러나, 이러한 출혈은 전형적으로 망막하 공간으로 확장되지 않는다.
박리가 불충분한 경우, 수술 중 문제를 인식해야 하며, 미리 형성된 망막 절제술을 통해 즉시 재주입해야 합니다. 20마리의 쥐를 대상으로 한 실험 세션에서 두 명의 외과의(숙련된 의사 1명과 초보자 1명)가 단계별 방법을 수행했습니다. 경험 많은 외과의는 10번의 수술 중 9번에서 성공을 거두었고, 초보자는 10번 중 6번에서 성공했습니다.
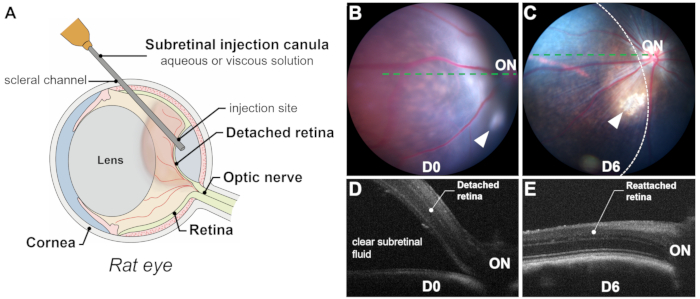
그림 1: 과정 및 결과 개요. (A) 쥐의 눈에서 망막하 주입 과정의 개략도, 렌즈의 상당한 부피를 보여줍니다. (B,C) 주사 직후(B) 및 주사 후 6일(C) 안저 촬영. 화살촉은 주입 부위를 나타냅니다. 망막 박리 영역은 점선으로 윤곽이 그려져 있습니다. (디,이) 광간섭 단층 촬영: 주사 직후(D) 및 주사 후 6일(E) B-스캔. ON: 시신경. 배율: 1x. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
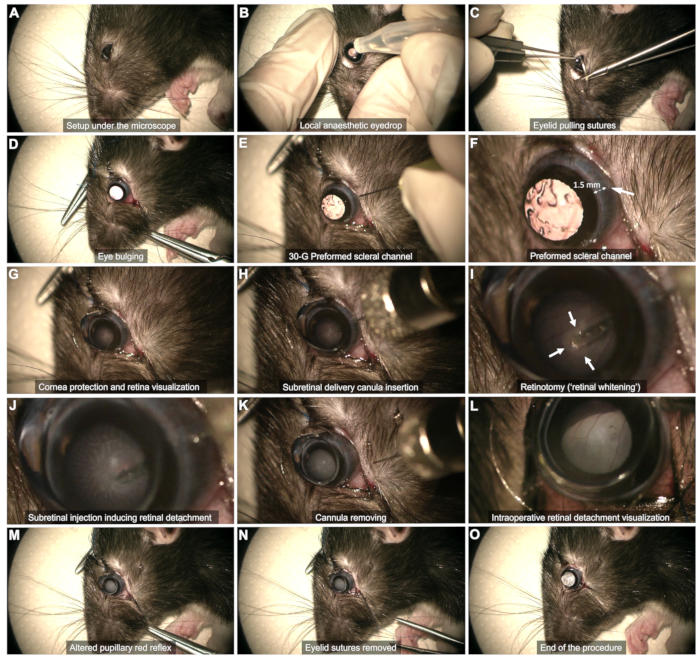
그림 2: 망막하 주사 프로토콜의 단계. 이 프로토콜은 전신 마취 하에 8주 된 Long Evans 쥐에서 입증되었습니다. 각 단계에 대한 자세한 설명은 비디오 또는 텍스트의 "프로토콜" 섹션을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 다양한 수술 후 안저 촬영 결과의 예. (A) 주사 부위에 약간의 색소 분산이 있는 정상적인 수술 후 모습(화살표). (B) 주사 부위에 작은 유리체강내 기포가 있는 정상적인 수술 후 모습. 이 작은 기포는 주사기에서 발생하며 망막 아래 공간에서도 무해합니다. (씨,디) 경미한(C) 또는 유의한(D) 렌즈 혼탁(백내장)을 초래하는 렌즈 접촉. (E,F) 경미한(E) 또는 더 광범위한(F) 유리체강내 출혈이 주사 부위 근처에 국한되며 망막하 공간으로 퍼지지 않습니다. (G) 주사 부위 출혈이 주로 망막하 공간으로 퍼짐. 이 경우 망막 절제술은 망막 혈관의 손상을 일으켰습니다. (H) 공막 침투로 인한 광범위한 유리체강 내 출혈. 배율: 1x. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 논문은 주사 부위와 분리된 부위 모두에 대한 수술 중 시각화 및 제어를 통해 쥐에서 경유리체 망막하 전달을 위한 방법을 설명합니다.
이 프로토콜에는 공막 노출과 망막 절개술의 두 가지 중요한 단계가 있습니다. 적절한 위치 지정, 노출 및 접근은 모든 수술 절차의 기본 전제 조건입니다. 이 경우 공막과 주사 부위에 대한 최적의 접근을 보장하는 것이 중요합니다. 공막 노출이 충분하지 않으면 후속 단계에서 피할 수 있는 어려움이 발생할 수 있습니다. 또한 망막 절개술의 질은 출혈의 위험을 결정합니다. 가능한 한 부드럽게 그리고 망막 혈관에서 가능한 한 멀리 떨어뜨려 수행해야 합니다. 올바르게 수행되면 상당한 유리체강 내 또는 망막하 출혈의 위험은 매우 낮습니다.
망막하 주사를 위해 이 접근법을 사용할 때 망막 박리(RD) 유도는 여러 가지 이유로 실패할 수 있습니다. 학습 과정에서 가장 어려운 단계는 주사 자체입니다. 액체가 망막 절개술을 통해 망막을 가로질러 흐를 수 있도록 주사 부위를 신중하게 선택해야 합니다. 설치류의 조밀한 후방 유리체로 인해 경망막 흐름에 대한 물리적 장벽으로 작용할 수 있습니다. 우리의 경험에 따르면, 경망막 침투는 캐뉼라 팁이 망막에 대해 약 90°에 위치할 때 부드럽게 발생합니다. 특히 초기에는 플루오레세인(fluorescein)과 같은 착색 용액을 사용하여 주입된 용액이 망막하 공간으로만 흐르는지 확인하는 연습을 하는 것이 좋습니다.
이 기술의 두 가지 한계를 확인할 수 있습니다. 첫째, transvitreal passage가 렌즈에 닿을 위험이 있습니다. 렌즈 터치는 후방 수정체 캡슐이 보존되어 있으면 백내장 형성으로 이어지지 않기 때문에 무해할 수 있습니다. 그러나 수정체 캡슐이 손상되면 백내장 형성의 위험이 높아지고 특히 망막 추적 검사가 필요한 경우 동물이 더 이상 실험 프로젝트에 적합하지 않을 수 있습니다. 둘째, 이 기술은 여러 단계에서 출혈을 일으켜 실험 과정을 방해할 수 있습니다. 결막 출혈은 눈꺼풀 봉합사로 인해 발생할 수 있지만 일반적으로 문제가 되지 않으며 면봉으로 세척할 수 있습니다. 또한 시술 중에 두 번의 망막 절제술이 시행되며 둘 다 출혈의 위험이 있습니다. 첫 번째 망막 절개술은 실험자가 공막 채널을 통해 망막을 볼 수 없는 상태에서 수행되며, 이는 공막 천공 중 유리체강내 출혈을 유발하여 절차를 더욱 복잡하게 만들 수 있습니다. 드물게 망막하 또는 맥락막 출혈이 발생할 수 있습니다. 이 '진입 망막 절제술'은 각막9를 통해 주입함으로써 피할 수 있지만, 이 방법은 가능한 주입 부위의 범위를 크게 제한합니다. 두 번째 망막 절제술은 망막 혈관이 캐뉼라 팁에 닿을 경우 출혈 위험이 더 높습니다. 망막하 출혈은 혈액 성분이 광수용체에 독성이 있으므로 엄격히 피해야 한다10. 이러한 위험 때문에 초보 실험자는 5회 중 1회에서 10회 주입 중 1회의 실패율을 예상해야 합니다. 우리의 경험에 비추어 볼 때, 맥락막 박리, 안구내염 또는 긴장항진증으로 인한 망막 손상은 발생하지 않았습니다.
대안적으로, 경유리체 통로를 피하는 망막하 전달을 위한 경공막 접근법을 사용하는 방법이 설명되었습니다 8,11. 그러나 우리의 경험에 따르면 이러한 절차는 정확하거나 재현 가능한 주입 부위 또는 블립을 허용하지 않으며 마우스를 사용할 때만 수행해야 합니다. 또한 이러한 절차에는 RD 위치에서 맥락막과 망막 색소 상피(RPE)를 교차하는 바늘로 자가 밀봉 공막 절개가 필요합니다. 이는 염증성 결과를 초래할 수 있고 RD 모델을 왜곡시킬 수 있는 망막하 색소 이동의 위험을 제기합니다11. 또한, 주사기 팁이 보이지 않는 곳에서 주사가 수행되어 RD가 아닌 상부 또는 맥락하 박리의 위험이 증가합니다. 또한 의도하지 않은 망막 절제술의 위험이 있으며, 특히 더 얇고 연약한 망막을 가진 망막 변성 모델로 작업할 때 후속 유리체강내 분만으로 이어질 위험이 있습니다.
망막하 전달 또는 유도 RD의 응용에는 망막 변성 모델 또는 RD 8,11,12,13,14의 경우 다양한 치료법을 테스트하는 것이 포함됩니다. 두 조건 모두에서 절차의 목표는 궁극적으로 인간에게 발생하는 과정을 모방하는 것입니다. 경공막(transscleral)과 경유리체(transvitreous) 접근법 모두 RD의 높이와 지속시간이 충분한 한 RD를 모델링할 수 있다15. 망막하 분만의 경우, 현재의 방법은 비인간 영장류16 및 인간5 에 사용된 방법을 더 밀접하게 복제하여 데이터의 번역 가능성을 향상시킵니다.
공개
S.P: 컨설턴트 및 개인 금융 이익 - Pixium Vision, GenSight Biologics(이러한 활동 중 어느 것도 여기에 제시된 데이터와 관련이 없습니다).
감사의 말
이 연구는 IHU FOReSIGHT(파리), Fondation Voir & Entendre(파리), UNADEV/Aviesan(파리의 "원뿔 광수용체 신경 보호" 프로젝트), HyVIS(GA 964468), Fighting Blindness Foundation(FFB PPA 시력 복원: PPA-0919-0772-INSERM; FFB PPA 어셔 1B: PPA-0922-0840-INSERM). A.D.의 급여는 Fondation pour la Recherche Médicale(보조금 번호 M2R202106013349, 파리), Fondation de France(보조금 번호 WB-2023-49302, 파리) 및 프랑스 안과학회(French Society of Ophthalmology)의 보조금으로 제공되었습니다. 의뢰자 또는 자금 지원 기관은 이 연구의 설계나 수행에 어떠한 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
참고문헌
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유