Method Article
הדמיה תוך ניתוחית של הזרקה תת-רשתית והיפרדות רשתית בחולדות
In This Article
Summary
מאמר זה מתאר שיטות להזרקה תת-רשתית בחולדות, תוך שימוש בהדמיה תוך ניתוחית כדי לשלוט הן באתר ההזרקה והן באזור היפרדות הרשתית.
Abstract
הזרקה תת-רשתית, אספקת תמיסה בין קולטני האור לאפיתל הפיגמנט ברשתית (RPE), יוצרת חלל תת-רשתית שבו הרכיבים נמצאים במגע ישיר עם קולטני אור ותאי RPE. שיטת אספקה זו מאפשרת טיפול ממוקד בתאים אלה. טיפולים להזרקה תת-רשתית פותחו ואושרו, במיוחד למחלות רשתית תורשתיות. בבעלי חיים, הליכי הזרקה תת-רשתית יכולים להיות מאתגרים בשל גודל העדשה, במיוחד במכרסמים. מאמר זה מתאר שיטות להזרקה תת-רשתית בחולדות, המאפשרות הדמיה תוך ניתוחית ובקרה הן על מקום ההזרקה והן על גודל האזור המנותק, כפי שמבוצע בבני אדם. ההליך מבוצע בהרדמה כללית ומקומית ודורש הרחבת אישון. באמצעות מיקרוסקופ עיניים, ההזרקה התת-רשתית מתבצעת דרך תעלה סקלרלית של 30 גרם, כאשר קצה הצינורית מונח בעדינות על הרשתית ליצירת רטינוטומיה. ניתן לספק נפחים הנעים בין 10-25 מיקרוליטר, המתאימים לשתי חמישיות למחצית רשתית החולדה. בדיקות מיידיות לאחר הניתוח באמצעות צילום פונדוס וטומוגרפיה קוהרנטית אופטית מאשרות אספקה מוצלחת לחלל התת-רשתית עם נוזל תת-רשתית גלוי. הסיכונים העיקריים בהליך זה כוללים נזק לעדשות (קטרקט), כשל בניתוק, דימום תוך זגוגי, דימום תת-רשתית וקרטיטיס לאחר הניתוח. בנוסף להעברת טיפולים לחלל התת-רשתית, טכניקה זו משמשת לגרימת היפרדות רשתית לטווח קצר או ארוך באמצעות מוצרים מימיים או צמיגים, בהתאמה. בניגוד לגישה הטרנססקלרלית, שיטה זו מאפשרת מיקום מדויק תוך ניתוחי של היפרדות הרשתית.
Introduction
הרשתית היא רקמה עצבית רגישה לאור הממוקמת בחלק הפנימי והאחורי של גלגל העין. השכבה החיצונית של הנוירורטינה מכילה קולטני אור, שהם נוירונים מיוחדים המוקדשים להמרת אור לאותות אלקטרוכימיים ולכן חיוניים לראייה. אפיתל הפיגמנט ברשתית (RPE), הממוקם מתחת לנויררטינה, מספק תמיכה מטבולית נרחבת לקולטני האור, ומקל על התחדשות פיגמנט חזותי וחידוש קבוע של המקטעים החיצוניים שלהם1.
ניוון קולטני אור הוא הגורם השכיח ביותר לאובדן ראייה בלתי הפיך ומתרחש במחלות רשתית שונות, כגון ניוון מקולרי הקשור לגיל, רטיניטיס פיגמנטוזה, רטינופתיה סוכרתית והיפרדות רשתית 1,2,3,4. רוב המצבים הללו נובעים מאובדן ראשוני או משני של קולטני אור, לעתים קרובות משני לאובדן RPE או תפקוד לקוי. לכן, חשוב במיוחד לחקור קולטני אור ותאי RPE in vivo כדי למנוע את התנוונותם. נכון להיום, לא קיימים טיפולים יעילים למחלות רשתית רבות, כגון ניוון רשתית (כולל רטיניטיס פיגמנטוזה) או ניוון מקולרי (כולל ניוון מקולרי הקשור לגיל).
הזרקה תת-רשתית, אספקת תמיסה בין קולטני האור ל-RPE, יוצרת חלל תת-רשתית שבו הרכיבים נמצאים במגע ישיר עם קולטני אור ותאי RPE. שיטת אספקה זו מאפשרת טיפול ממוקד בתאים אלה, תוך עקיפת מחסומי רשתית או כלי דם שונים. מספר טיפולים ללידה תת-רשתית פותחו ואושרו, במיוחד למחלות רשתית תורשתיות 5,6.
חשוב ליצור הרמוניה בין פרקטיקות כירורגיות ללידה תת-רשתית. בבני אדם, ההליך הסטנדרטי כולל כריתת ויטרקטומיה של 25 G pars plana, המספקת גישה קלה יחסית לחלק האחורי של העין מכיוון שהעדשה קטנה ביחס לעין כולה. אספקה תת-רשתית מתבצעת דרך טרוקר 25 גרם באמצעות צינורית ביולוגית תואמת סיליקון 38 G או 41 G, המאפשרת זרימה חלקה דרך הרשתית5.
בבעלי חיים, הליכי הזרקה תת-רשתית יכולים להיות מאתגרים בשל גודל העדשה. לדוגמה, במכרסמים, העדשה תופסת עד 90% מחלל הזגוגית. בחולדות, העדשה תופסת פחות מקום מאשר בעכברים, אך נשארת משמעותית (ראו איור 1A). בנוסף, ניתן להשתמש בהזרקות תת-רשתית למודל היפרדות רשתית (RD) על ידי שימוש בתמיסות צמיגות למניעת פינוי נוזל תת-רשתית על ידי תאי RPE 7,8. מודלים אלה משמשים בעיקר בפיתוח טיפולים למחלות רשתית.
מאמר זה מתאר שיטות לאספקה תת-רשתית או RD מושרה בחולדות, המאפשרות שליטה תוך ניתוחית מלאה על אתר ההזרקה ואזור הרשתית המנותק.
Protocol
הניסויים והנהלים אושרו על ידי ועדת האתיקה המקומית לבעלי חיים ונערכו במתקנים הקשורים למעבדה, בהתאם לחקיקה המקומית. כל העבודה הניסויית דבקה במדיניות המוסדית בנושא נהלי אבטחה ביולוגית ובטיחות (ועדת האתיקה המקומית של בעלי חיים צ'ארלס דרווין CEEACD #5) ועקבה אחר ההנחיה האירופית 2010/63/EU. במחקר זה נעשה שימוש בחולדות לונג אוונס נקבות בנות שמונה שבועות (Rattus norvegicus). ניתן להשתמש במודלים שונים של ניוון רשתית של חולדות, כגון P23H ו-RCS, כדי לבדוק את האספקה התת-רשתית של טיפולים שונים, כולל תרופות וטיפולים גנטיים. פרטי הריאגנטים והציוד המשמשים במחקר זה מסופקים בטבלת החומרים.
1. הכנת פתרונות
- אספקה תת-רשתית: דילול מולקולות ב-PBS או דימתיל סולפוקסיד לאספקה תת-רשתית מימית.
- אינדוקציה של RD: השתמש ב-2% הידרוקסיפרופיל מתיל צלולוז או 1%-5% נתרן היאלורונאט כדי לגרום ל-RD לטווח ארוך.
2. מערך ניסוי
- הרכיב קצה מתכת צינורית 10 מ"מ 30 גרם לא משופע המודבק על מזרק של 10 מיקרוליטר או 25 מיקרוליטר על מיקרו-מזרק.
- טען את התמיסה המוכנה למזרק.
3. הכנת בעלי חיים
- הרדמה
- הרדמה כללית: להרדים את החולדות בהזרקה תוך-צפקית של 40 מ"ג/ק"ג קטמין ו-0.14 מ"ג/ק"ג מדטומידין.
הערה: הרדמה זו נמשכת מספיק זמן למשך ההליך ולבירורים מיידיים לאחר הניתוח. - הרחבת אישונים: שים טיפה אחת של 0.5% טרופיקמיד כדי לקבל מידריאזיס בעין אחת.
הערה: עבור מנתחים ימניים, ההליך יהיה קל יותר בעין שמאל, ולהיפך. - הרדמה מקומית ( איור 2B): שימו טיפה אחת של אוקסיבופרוקאין בעין כדי לנתח.
- הרדמה כללית: להרדים את החולדות בהזרקה תוך-צפקית של 40 מ"ג/ק"ג קטמין ו-0.14 מ"ג/ק"ג מדטומידין.
4. ניתוח תחת מיקרוסקופ
- הדמיה תוך ניתוחית: השתמש במיקרוסקופ עיניים המחובר למתג כף הרגל כדי לבצע את הניתוח.
- חשיפה סקלרלית (איור 2C,D)
- השתמש בשני תפרים למשיכת עפעפיים (5-0 או 6-0) המעוגנים ברבע החיצוני של שולי הפלפברל בעפעפיים העליונים והתחתונים.
- יש למשוך את התפרים כדי להשיג בליטה עדינה של העין.
- תעלה סקלרלית (איור 2E,F): השתמש במחט של 30 G כדי ליצור תעלה סקלרלית דרך הלחמית הבולברית הטמפורלית, כ-1-2 מ"מ מהלימבוס של הקרנית.
הערה: בקושי הכנס את קצה המחט המשופע מבלי לדחוף אותו הלאה כדי למנוע את הסיכון למגע בעדשה ולקטרקט שלאחר מכן. שימו לב לדימום בלחמית במשך עשרות שניות בשלב זה. הימנע מהטמפונדה של הדימום, מכיוון שהדבר עלול לגרום לדם להצטבר בזגוגית ולסכן את ההליך. נגב בעדינות כל דם באזור התעלה או שמפריע להדמיה באמצעות צמר גפן. - הגנה מפני הקרנית (איור 2G): השתמש בג'ל דמעות כממשק עדשה-עין לאורך כל ההליך.
- הדמיה של מישור הרשתית (איור 2G)
- הניחו עדשת מגע שטוחה (קוטר 8 מ"מ) על פני העין כדי לדמיין את מישור הרשתית בהגדלה מתאימה.
- השתמש במתג הרגל של המיקרוסקופ כדי להתמקד במישור הרשתית.
- הזרקה תת-רשתית (איור 2H - M)
- הכנס את הצינורית אנכית דרך תעלת הסקלר המוכנה מראש (איור 2H).
- הימנע מלגעת בעדשה על ידי שמירה על הצינורית אנכית.
- התקרב לאט לרשתית ולחץ עליה בעדינות עד שנצפתה הלבנת רשתית (חיצים באיור 2I).
- שמרו על יציבות הקצה תוך כדי הזרקה דרך הרטינוטומיה שנוצרה על ידי זרימת ההזרקה (איור 2J). הימנע ממשיכת הקצה מוקדם מדי מהרטינוטומיה, מכיוון שהדבר יגרום להזרקת המוצר לזגוגית.
- לאחר ההזרקה, הסירו את הקצה מהרטינוטומיה, ואז משכו בעדינות את כל הצינורית מחלל הזגוגית, כדי לוודא שהעדשה לא נוגעת (איור 2K).
הערה: אם הכתם אינו מפותח מספיק או שאזור הרשתית המנותק מוגבל מדי ברגע שהמזרק ריק, בצע הזרקה חוזרת באמצעות אותה תעלה סקלרלית והכנסת הקצה לרטינוטומיה שנוצרה קודם לכן. - ודא שהרפלקס האדום של האישון משתנה על ידי היפרדות הרשתית מבלי להתבונן בזרימת הדם בתוך חלל הזגוגית (איור 2L,M).
- סיום הניתוח (איור 2N,O)
- הסר את תפרי העפעפיים וספוג בזהירות כל דימום (איור 2N).
- הערך בקצרה את הלחץ התוך עיני באופן ידני.
הערה: כמות קטנה של נוזל זגוגית עשויה להופיע לתוך החלל התת-לחמית, אך אסור שתתרחש דליפה פעילה (איור 2O).
5. טיפול והתעוררות לאחר הניתוח
- יש למרוח משחת עיניים כלורמפניקול-רטינול על העין המנותחת.
- יש לתת 1 מ"ל של 5% גלוקוז מונוהידרט תוך צפק.
- יש להזריק 0.9 מ"ג/ק"ג אטיפמזול תת עורית.
- הנח את החיה בתא מבוקר טמפרטורה ועקוב אחריה עד שהיא מתעוררת.
תוצאות
הצלחת הזרקה תת-רשתית מסתמכת על אספקה מדויקת ובלעדית לחלל התת-רשתית (כלומר, בין קולטני האור לשכבות ה-RPE) דרך הרטינוטומיה, תוך הימנעות מדימום תת-רשתית, שכן הדם רעיל לקולטני האור ולתאי RPE. לידה מוצלחת מאושרת על ידי הדמיה תוך ניתוחית (איור 2L), צילום פונדוס מיידי לאחר הניתוח וטומוגרפיה קוהרנטית אופטית (OCT). צילום פונדוס שולל דימום תת-רשתית, בעוד שסריקות OCT B מאשרות היפרדות רשתית (RD) עם נוזל תת-רשתית שקוף (איור 1 ואיור 3). נוסף על כך, צילום פונדוס יכול לזהות מגע בעדשה או קטרקט מושרה שעשוי להיות בלתי מורגש במהלך ההליך (איור 3C,D). גם צילום וגם סריקת OCT יכולים להעריך את גודל האזור המנותק (איור 1B-E).
מספר גורמים משפיעים על גודל הבלב: (1) מיקום אתר ההזרקה: ככל שאתר ההזרקה רחוק יותר מהדיסק האופטי, כך האזור המנותק קטן יותר; (2) נפח מוזרק: נפח הזרקה של 20-25 מיקרוליטר יכול לנתק כמחצית מהרשתית בחולדות; (3) איכות הרשתית המנותקת: במודלים של ניוון רשתית (למשל, P23H, RCS), היפרדות עשויה להיות מאתגרת עקב עמידות מוגברת בין קולטני אור לתאי RPE הנגרמת על ידי תהליכים ניווניים, כגון גליוזיס והצטברות חומר תת-רשתית. במקרים כאלה, היפרדות רשתית מושרית היא בדרך כלל שטוחה, וסריקות OCT חיוניות לתיחום ברור של האזור המנותק.
דימום תוך-זגוגי קל עשוי להתרחש באתר ההזרקה מכיוון שלא תמיד ניתן להימנע לחלוטין מכלי דם זעירים ברשתית (איור 3E). עם זאת, דימומים כאלה בדרך כלל אינם מתפשטים לחלל התת-רשתית.
במקרים של ניתוק לא מספיק, יש להכיר בבעיה תוך ניתוחית, מה שמחייב הזרקה חוזרת מיידית דרך הרטינוטומיה המוכנה מראש. במהלך מפגש ניסיוני עם 20 חולדות, שני מנתחים (אחד מנוסה ואחד מתחיל) ביצעו את השיטה שלב אחר שלב. המנתח המנוסה השיג הצלחה ב-9 מתוך 10 פרוצדורות, בעוד שהמתחיל הצליח ב-6 מתוך 10.
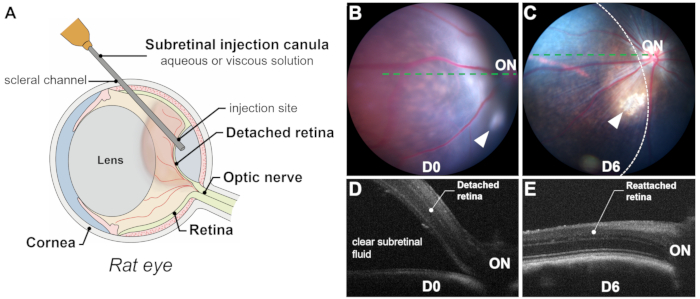
איור 1: סקירה כללית של התהליך והתוצאות. (A) ייצוג סכמטי של תהליך ההזרקה התת-רשתית בעין חולדה, המראה את הנפח המשמעותי של העדשה. (ב,ג) צילום פונדוס מיד לאחר ההזרקה (B) ו-6 ימים לאחר ההזרקה (C). ראשי חצים מציינים את מקום ההזרקה. אזור ניתוק הרשתית מסומן בקו מקווקו. (ד,ה) טומוגרפיה קוהרנטית אופטית סריקות B מיד לאחר ההזרקה (D) ו-6 ימים לאחר ההזרקה (E). ON: עצב הראייה. הגדלה: פי 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
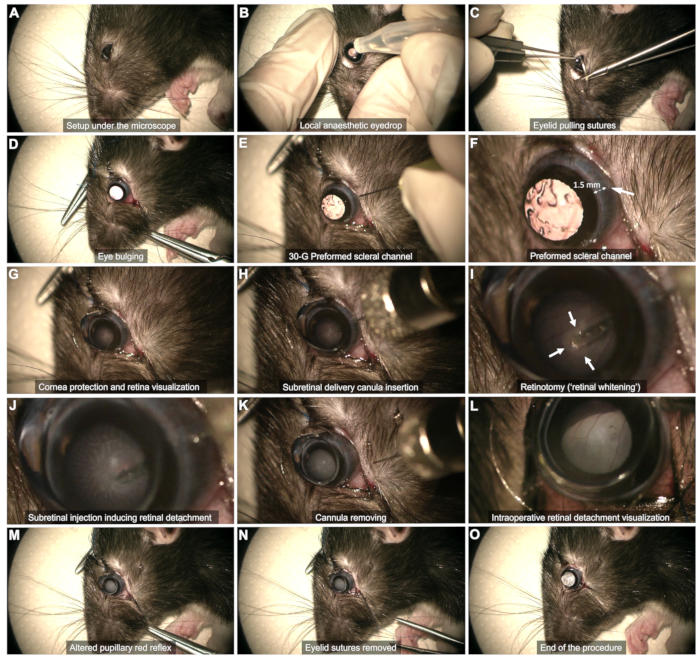
איור 2: השלבים של פרוטוקול ההזרקה התת-רשתית. הפרוטוקול מודגם בחולדת לונג אוונס בת 8 שבועות בהרדמה כללית. לתיאור מפורט של כל שלב, עיין בסרטון או בסעיף "פרוטוקול" בטקסט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: דוגמאות לתוצאות שונות של צילום פונדוס לאחר הניתוח. (A) מראה נורמלי לאחר הניתוח עם פיזור פיגמנט קל באתר ההזרקה (חץ). (B) מראה נורמלי לאחר הניתוח עם בועת אוויר תוך-זגוגית קטנה במקום ההזרקה. בועות אוויר קטנות אלו מקורן במזרק ואינן מזיקות, אפילו בחלל התת-רשתית. (ג,ד) מגע עדשה הגורם לאטימות עדשה קלה (C) או משמעותית (D) (קטרקט). (ה,ו) דימום תוך-זגוגי קל (E) או נרחב יותר (F) הממוקם בסמוך למקום ההזרקה, ללא התפשטות לחלל התת-רשתית. (G) דימום במקום ההזרקה מתפשט בעיקר לתוך החלל התת-רשתית. במקרה זה, רטינוטומיה גרמה לפגיעה בכלי דם ברשתית. (H) דימום תוך זגוגי נרחב שנובע מחדירה סקלרלית. הגדלה: פי 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מאמר זה מתאר שיטות לאספקה תת-רשתית טרנס-ויטריאלית בחולדות עם הדמיה תוך ניתוחית ובקרה הן על אתר ההזרקה והן על האזור המנותק.
ישנם שני שלבים קריטיים בפרוטוקול זה: חשיפה סקלרלית ורטינוטומיה. מיקום נכון, חשיפה וגישה הם תנאים מוקדמים בסיסיים לכל הליך כירורגי. במקרה זה, חיוני להבטיח גישה אופטימלית לסקלרה ולאתר ההזרקה. חשיפה סקלרלית לא מספקת עלולה להוביל לקשיים הניתנים למניעה בשלבים הבאים. בנוסף, איכות הרטינוטומיה קובעת את הסיכון לדימום. יש לבצע אותו בעדינות ככל האפשר ורחוק ככל האפשר מכל כלי הרשתית. אם נעשה נכון, הסיכון לדימום תוך-זגוגי או תת-רשתית משמעותי נמוך מאוד.
כאשר משתמשים בגישה זו להזרקה תת-רשתית, אינדוקציה של היפרדות רשתית (RD) עלולה להיכשל מכמה סיבות. השלב המאתגר ביותר בתהליך הלמידה הוא ההזרקה עצמה. יש לבחור בקפידה את מקום ההזרקה כדי לאפשר לנוזל לזרום על פני הרשתית דרך הרטינוטומיה. בשל גוף הזגוגית האחורי הצפוף במכרסמים, הוא יכול לשמש כמחסום פיזי לזרימה הטרנס-רשתית. מניסיוננו, חדירה דרך הרשתית מתרחשת בצורה חלקה כאשר קצה הצינורית ממוקם בערך ב-90 מעלות לרשתית. מומלץ מאוד, במיוחד בהתחלה, לתרגל שימוש בתמיסות צבעוניות, כגון פלואורסצאין, כדי לוודא שהתמיסה המוזרקת זורמת רק לחלל התת-רשתית.
ניתן לזהות שתי מגבלות של טכניקה זו. ראשית, המעבר הטרנס-ויטריאלי נמצא בסיכון לגעת בעדשה. מגע בעדשה עשוי להיות לא מזיק אם קפסולת העדשה האחורית נשמרת, מכיוון שהוא לא אמור להוביל להיווצרות קטרקט. עם זאת, אם קפסולת העדשה האחורית ניזוקה, הסיכון להיווצרות קטרקט גבוה, וייתכן שהחיה לא תתאים עוד לפרויקט הניסוי, במיוחד אם נדרשות בדיקות מעקב רשתית. שנית, טכניקה זו עלולה להוביל לדימום בכמה שלבים, מה שעלול לעכב את תהליך הניסוי. דימום בלחמית עלול לנבוע מתפרי העפעפיים, אם כי בדרך כלל זו אינה בעיה וניתן לנקות אותה בעזרת צמר גפן. בנוסף, מבוצעות שתי רטינוטומיות במהלך ההליך, שתיהן טומנות בחובן סיכון לדימום. הרטינוטומיה הראשונה מבוצעת כאשר הנסיין עיוור לרשתית (דרך התעלה הסקלרלית), מה שעלול להוביל לדימום תוך זגוגי במהלך ניקוב סקלרלי, מה שמסבך עוד יותר את ההליך. לעיתים נדירות, עלול להתרחש דימום תת-רשתית או כורואידלי. ניתן להימנע מ'רטינוטומיית כניסה' זו על ידי הזרקה דרך הקרנית9, אם כי גישה זו מגבילה משמעותית את מגוון אתרי ההזרקה האפשריים. הרטינוטומיה השנייה נמצאת בסיכון גבוה יותר לדימום אם קצה הצינורית נוגע בכלי הרשתית. יש להימנע לחלוטין מדימום תת-רשתית, מכיוון שרכיבי הדם רעילים לקולטני אור10. בגלל הסיכונים הללו, נסיינים מתחילים צריכים לצפות לשיעור כישלון של 1 ל-5 עד 1 ל-10 זריקות. מניסיוננו, לא נתקלו במקרים של היפרדות כורואידלית, אנדופתלמיטיס או נזק לרשתית הנגרם על ידי היפרטוניה.
לחלופין, תוארו שיטות המשתמשות בגישות טרנססקלרליות למסירה תת-רשתית, המונעות מעבר טרנס-ויטראלי, 8,11. עם זאת, מניסיוננו, הליכים אלה אינם מאפשרים אתרי הזרקה או בלבים מדויקים או ניתנים לשחזור ויש לבצע אותם רק בעת שימוש בעכברים. בנוסף, הליכים אלה דורשים חתך סקלרלי אוטם עצמי עם מחט החוצה את הכורואיד ואת אפיתל הפיגמנט ברשתית (RPE) במיקום ה-RD. זה מהווה סיכון לנדידת פיגמנט תת-רשתית, מה שעלול להוביל לתוצאות דלקתיות ועלול לעוות את מודל RD11. יתר על כן, ההזרקה מתבצעת ללא נראות של קצה המזרק, מה שמגדיל את הסיכון לניתוק סופרה או תת-כורואידלי ולא RD. קיים גם סיכון לרטינוטומיה לא מכוונת, מה שמוביל לאספקה תוך זגוגית לאחר מכן, במיוחד כאשר עובדים עם מודלים של ניוון רשתית שיש להם רשתית דקה ושברירית יותר.
יישומים של אספקה תת-רשתית או RD מושרה כוללים בדיקת טיפולים שונים על מודלים של ניוון רשתית או במקרים של RD 8,11,12,13,14. בשני המצבים, מטרת ההליך היא לחקות תהליכים המתרחשים בסופו של דבר בבני אדם. גם גישות טרנססקלרליות וגם טרנס-ויטריות יכולות לעצב RD, כל עוד הגובה ומשך הזמן של ה-RD מספיקים15. במקרה של אספקה תת-רשתית, השיטות הנוכחיות משכפלות יותר את אלה המשמשות בפרימטים לא אנושיים16 ובבני אדם5, ובכך משפרות את יכולת התרגום של הנתונים.
Disclosures
S.P: יועץ ואינטרסים פיננסיים אישיים - Pixium Vision, GenSight Biologics (אף אחת מהפעילויות הללו אינה רלוונטית לנתונים המוצגים כאן).
Acknowledgements
מחקר זה נתמך על ידי IHU FOReSIGHT (פריז), Fondation Voir & Entendre (פריז), UNADEV/Aviesan (במסגרת פרויקט "הגנה עצבית של קולטני אור חרוטים", פריז), HyVIS (GA 964468), הקרן למלחמה בעיוורון (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA סדרן 1B: PPA-0922-0840-INSERM). המשכורות של A.D. ניתנו על ידי מענקים מהקרן למחקר רפואי (מענק מספר M2R202106013349, פריז), הקרן הצרפתית (מספר מענק WB-2023-49302, פריז) והאגודה הצרפתית לרפואת עיניים. לנותן החסות או לארגונים המממנים לא היה תפקיד בתכנון או בביצוע מחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
References
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved