Method Article
Проектирование твердофазных ферментационных систем для получения полимерных гидролитических внеклеточных ферментов нитчатыми грибами
В этой статье
Резюме
В соответствии с этим протоколом пшеничные отруби используются во вращающейся твердофазной ферментационной системе для увеличения производства ферментов. Субстрат, дополненный индукторами, такими как хитин, поддерживает рост грибков в контролируемых условиях. Результаты демонстрируют выход фермента в 4-6 раз выше по сравнению с ферментацией в погружении, что демонстрирует адаптивность и эффективность метода для различных биотехнологических применений.
Аннотация
Твердофазная ферментация (SSF) — это процесс биоконверсии, в котором используется твердый субстрат, который не растворяется в водной среде. Микроорганизмы растут на поверхности субстрата и проникают в его твердую матрицу для извлечения необходимых питательных веществ для своего развития. SSF характеризуется минимальным количеством свободной воды, содержание влаги в субстрате поддерживается выше 70% и включает в себя три взаимосвязанные фазы - газообразную, жидкую и твердую. В этом протоколе описывается использование пшеничных отрубей, побочного продукта агропромышленности, в качестве базового субстрата для производства ферментов в ротационной системе. Субстрат дополняется индуктором, таким как хитин, хитозан, крахмал или целлюлоза, чтобы способствовать синтезу гидролитических белков. Система обладает высокой адаптивностью, что позволяет использовать различные формы грибов, включая мицелий, споры или гранулы. В описанной методике индуктор и субстрат смешивают в соотношении 1:100 (масса/масса), стерилизуют с помощью автоклавирования и доводят до нужного уровня влажности стерильной водой. Затем добавляется грибковый инокулюм, и роторная система работает со скоростью 10 об/мин, обеспечивая адекватное перемешивание и насыщение кислородом. Система инкубируется в течение 6-8 дней при оптимальных условиях роста мезофильных или термофильных/термотолерантных грибов, что повышает ее универсальность. После инкубации фермент легко экстрагируется с использованием соответствующего холодного буфера (например, ацетата, цитрата или фосфата), в зависимости от типа фермента. Экстракт осветляют с помощью центрифугирования и фильтрации с получением бесклеточного надосадочной жидкости. Затем фермент может быть дополнительно концентрирован или очищен по мере необходимости. Результаты продемонстрировали увеличение активности фермента в 4-6 раз по сравнению с ферментацией под водой (SmF), что подчеркивает эффективность системы. Его приспособляемость к различным субстратам, индукторам и видам грибов делает его ценным инструментом для различных биотехнологических применений.
Введение
Твердофазная ферментация (SSF) стала перспективной и устойчивой технологией биоконверсии для производства высокоценных ферментов, биологически активных соединений и вторичных метаболитов. Этот метод включает в себя выращивание микроорганизмов на твердых субстратах с минимальным количеством свободной воды, имитируя их естественную среду и обеспечивая эффективную метаболическую активность1. Основной целью этого протокола является оптимизация производства ферментов с помощью вращающейся системы SSF, которая обеспечивает улучшенное использование субстрата, диффузию кислорода и масштабируемость процесса. Использование пшеничных отрубей, обильного побочного продукта агропромышленности, в качестве базового субстрата способствует повышению ценности сельскохозяйственных отходов и способствует внедрению методов биоэкономики замкнутого цикла2.
SSF имеет значительные преимущества по сравнению с ферментацией под водой (SmF), включая более низкое потребление энергии и воды, более высокую концентрацию продукта и совместимость с широким спектром недорогих сельскохозяйственных отходов, таких как пшеничные отруби, рисовая шелуха и жмых сахарного тростника3. В отличие от SmF, для которого требуются большие объемы воды и дорогостоящие питательные среды, в системах SSF используются твердые матрицы, которые не только служат поверхностями для роста микроорганизмов, но и обеспечивают питательные вещества, необходимые для микробной активности. Кроме того, ограниченное количество свободной воды в SSF сводит к минимуму риск загрязнения, что делает его более надежным вариантом для производства ферментов в промышленных условиях4. В дополнение к своим эксплуатационным преимуществам, SSF имеет значительные экологические и экономические преимущества по сравнению с ферментацией под водой (SmF). Исследования показали, что SSF снижает потребление воды на 50-70% и снижает затраты на электроэнергию более чем на 30% благодаря отсутствию больших объемов воды, требующих постоянного перемешивания и аэрации. Кроме того, использование отходов агропромышленного производства в качестве субстрата сводит к минимуму затраты на сырье и способствует внедрению методов экономики замкнутого цикла за счет повторного использования побочных продуктов сельского хозяйства 2,4.
SSF прошел тщательную проверку на эффективность и масштабируемость. Например, в исследованиях сообщалось о 4-6-кратном увеличении активности фермента при использовании SSF по сравнению с SmF, что подчеркивает экономические и экологические преимущества этой методикив 2,5 раза. Кроме того, упрощается процесс на последующих этапах, так как экстракция ферментов обычно требует меньше воды и меньше этапов очистки. Это делает SSF особенно привлекательным для отраслей, стремящихся снизить эксплуатационные расходы и воздействие на окружающую среду6.
Роторная система SSF, описанная в этом протоколе, предлагает несколько улучшений по сравнению с традиционными статическими методами SSF. В то время как статические системы часто сталкиваются с такими проблемами, как неравномерная колонизация субстрата и ограничение кислорода, вращающаяся конфигурация обеспечивает тщательное перемешивание и аэрацию, способствуя равномерному росту микроорганизмов 7,8,9. Например, эта система была успешно использована для производства гидролитических ферментов, таких как хитиназы, амилазы и протеазы, с использованием таких видов грибов, как Aspergillus и Trichoderma2.
Ключевой особенностью этой системы SSF является ее адаптивность. Использование пшеничных отрубей в качестве базового субстрата демонстрирует потенциал агропромышленных отходов для экономически эффективной биоконверсии3. Кроме того, добавление в субстрат индукторов, таких как хитин, хитозан и крахмал, еще больше усиливает синтез ферментов, стимулируя специфические метаболические пути 2,10. Система также совместима с различными формами грибов, включая споры, мицелий и гранулы, что позволяет пользователям адаптировать процесс к своим конкретным требованиям2.
SSF предлагает широкий потенциал для применения в различных областях, таких как пищевая биотехнология, производство биотоплива и восстановление окружающей среды. Интеграция экономичных субстратов, исключительный выход ферментов и высокая гибкость процесса делают SSF важным подходом к биотехнологическим инновациям в промышленных масштабах.
протокол
Реагенты и оборудование, использованные в данном исследовании, перечислены в Таблице материалов.
1. Подготовка основания
ПРИМЕЧАНИЕ: Используйте коммерческую марку пшеничных отрубей, чтобы свести к минимуму значительные изменения в характеристиках субстрата. Каждая партия пшеничных отрубей варьируется из-за множества факторов, что делает их неоднородным материалом, который трудно стандартизировать, что приводит к колебаниям его состава. Если требуется стандартизированный материал, выберите альтернативную матрицу или проведите предварительный химический анализ каждой партии пшеничных отрубей, чтобы скорректировать ее в соответствии с потребностями.
- Трижды промойте пшеничные отруби стерильной дистиллированной водой, чтобы удалить остатки органических веществ, мусор и пыль. При этом также удаляются простые сахара, которые могут помешать брожению.
- Выложите промытые отруби на алюминиевый противень и высушите в духовке при температуре 60 °C в течение 24 часов.
- После высыхания поместите пшеничные отруби в стерильную коническую пробирку объемом 50 мл.
2. Приготовление посевного материала
ПРИМЕЧАНИЕ: Этот протокол описывает три метода получения инокулята: споровая суспензия, прямой посев мицелиевыми дисками и клеточная суспензия. Установите начальную концентрацию инокулята и количественно оцените уровень белка для точного расчета урожайности.
- Приготовление споровой суспензии
- Перенесите агаровый диск диаметром 5 мм, насыщенный мицелием, на тарелку агара декстрозы для свежего картофеля. Инкубируйте тарелку при температуре 28 °C в течение 5-7 дней, или пока мицелий не насытит среду. Некоторым грибам может потребоваться более длительное время инкубации.
- Добавьте в тарелку 5 мл стерильной дистиллированной воды и механически отделите споры с помощью стерильной петли.
- Приготовьте разведение споровой суспензии в соотношении 1:100. Поместите 10 μL в центр камеры Нейбауэра и подсчитайте споры под микроскопом. Рассчитайте концентрацию спор (спор/мл) на основе коэффициента камеры и разведения.
- Выращивание мицелия в жидкой среде
- Перенесите 5 мм агаровый диск, насыщенный мицелием, на свежую картофельно-декстрозно-агаровую пластину и инкубируйте при 28 °C до насыщения.
- Приготовьте 25 мл картофельно-декстрозного отвара в стерильной колбе объемом 125 мл и автоклаве.
- Переложите 5 мм мицелиевый диск из насыщенной пластины в стерильный бульон.
- Инкубируйте колбу в шейкере при 125 об/мин в течение 24-48 ч, в зависимости от штамма гриба. Продлите время инкубации для медленно растущих грибов.
- Соберите 2 мл для посевного материала и 2 мл для определения сухой массы.
- Прямой посев дисков мицелия
- Поместите 5 мм агаровый диск, насыщенный мицелием, на свежую картофельно-декстрозно-агаровую пластину. Инкубировать при 28 °C до насыщения.
- Используйте один диск мицелия в качестве инокулята, а другой — для определения сухого веса.
3. Подготовка системы SSF
ПРИМЕЧАНИЕ: Индукторы могут быть натуральными или коммерческими. Очищенные коммерческие индукторы предпочтительны для минимизации примесей, которые могут повлиять на эффективность ферментации. Отрегулируйте добавление воды, чтобы поддерживать относительную влажность не менее 90%.
- Соедините в стерильной конической пробирке объемом 50 мл следующие компоненты: 5 г сухих пшеничных отрубей; 0,2 г индуктора (например, коммерческого хитина); 5,5 мл воды (регулируется в зависимости от водопоглощающей способности индуктора); 5 мл стерильного раствора соли, содержащего 16 г/л одноосновного фосфата калия, 4 г/л сульфата натрия, 2 г/л хлорида калия, 1 г/л хлорида кальция, 400 мг/л хлорида цинка, 60 мг/л борной кислоты, 40 мг/л молибдата натрия, 150 мг/л хлорида магния, 100 мг/л хлорида железа и 400 мг/л сульфата меди.
- Измерьте относительную влажность с помощью гигрометра на основе электрода, обеспечив минимум 90% влажности. Вставьте электродный зонд непосредственно в реактор на различную глубину, чтобы получить репрезентативное измерение распределения влаги.
- Следуйте инструкциям, чтобы отрегулировать влажность, если она ниже 90%:
- Постепенно добавляйте стерильную дистиллированную воду с шагом 1 мл на 10 г субстрата. После каждого добавления тщательно перемешивайте, чтобы обеспечить равномерное распределение влаги.
- Дайте субстрату сбалансироваться в течение 10-15 минут. Повторно измерьте уровень влажности.
- Повторяйте вышеуказанные действия до тех пор, пока не будет достигнута целевая влажность 90%. Избегайте чрезмерного увлажнения субстрата на протяжении всего процесса.
- Следуйте инструкциям, чтобы отрегулировать влажность, если она выше 90%:
- Разложите субстрат тонким слоем в стерильной среде. Удалите лишнюю влагу, (1) подвергнув основание воздействию ламинарного потока воздуха или (2) поместив его в сушильную камеру при температуре 30 °C на 10-15 минут.
- В качестве альтернативы аккуратно перемешайте основание, чтобы обеспечить равномерное перераспределение влаги. После обработки повторно оцените уровень влажности.
- При необходимости повторяйте этап сушки или смешивания, пока влажность не достигнет 90%. Приступайте к ферментации только после достижения целевой влажности.
- Следуйте инструкциям, чтобы отрегулировать влажность, если она ниже 90%:
- Автоклавируйте трубку при давлении 15 фунтов на квадратный дюйм в течение 15 минут.
- После охлаждения инокулируйте субстрат одним из следующих веществ: 1 мл споровой суспензии (1 x 106-1 x 107 спор/мл), 2 мл клеточной суспензии или одним 5 мм мицелиевым диском.
4. Процедура твердофазного брожения (SSF)
ПРИМЕЧАНИЕ: Для кинетических исследований или оценки параметров в разное время подготовьте отдельные пробирки для каждой временной точки, чтобы обеспечить репрезентативность.
- Избегайте образования комков субстрата, переворачивая пробирки с максимальной скоростью в течение 5 минут циклами по 1 минуте.
- Поместите трубки во вращающийся миксер с горизонтальной осью. Убедитесь, что субстрат свободно перемещается внутри трубок. Установите смеситель на 10 об/мин.
- Инкубируйте смеситель в инкубаторе при оптимальной для микроорганизма температуре роста. Поддерживайте указанную температуру для оптимальной ферментативной активности при использовании термочувствительных индукторов.
5. Экстракция ферментов
ПРИМЕЧАНИЕ: Основы экстракции основаны на растворимости и максимальной активности внеклеточного фермента. Поскольку SSF избегает водной среды, внеклеточный фермент участвует в воде, окружающей твердый матрикс, что означает, что его концентрация выше, чем в SmF. В этом контексте выбор наилучшего буфера для добычи зависит от знания желаемой деятельности. Оптимизация экстракции зависит от конечной концентрации фермента и типа используемого буфера для экстракции.
- После желаемого периода брожения повторно суспендируйте субстрат в 20 мл предварительно охлажденного буфера. Примеры включают: 0,1 М ацетатный буфер, pH 5,6, для экстракции хитиназы; 0,02 М фосфатный буфер, pH 6,9, для экстракции амилазы.
- Вихревые трубки циклы: 1 мин на максимальной скорости, затем 1 мин на льду. Повторите 10 раз.
- Отфильтруйте суспензию с помощью бумажных фильтров и механически извлеките надосадочную жидкость путем прессования.
- Осветите надосадочную жидкость центрифугированием при 3000 x g в течение 15 мин при 4 °C.
- Используйте сырой экстракт непосредственно или дополнительно очистите фермент с помощью колоночной хроматографии или центробежных фильтров. Также рекомендуются кинетические исследования для определения постоянной Михаэлиса (Км) и максимальной скорости ферментативного превращения (Vmax)12.
6. Процесс оптимизации
ПРИМЕЧАНИЕ: Оптимизируйте этот протокол, оценив и отрегулировав качество и концентрацию индукторов, а также тип и концентрацию инокулята.
- Определите идеальное время ферментации и уточните этапы экстракции для повышения эффективности.
- Контролируйте и точно настраивайте условия окружающей среды, включая температуру, pH и аэрацию.
- Тестируйте различные буферы и условия экстракции для повышения выхода ферментов и стабильности.
- Выполняйте статистический анализ, такой как методология поверхности отклика, чтобы определить наиболее влиятельные переменные и достичь оптимальной выработки ферментов.
Результаты
На рисунке 1А представлено схематическое изображение вращающегося смесителя, используемого в данной системе, который имеет емкость для шести конических пробирок объемом 50 мл. На рисунке 2В показаны изменения, происходящие в пшеничных отрубях во время кондиционирования перед началом процесса твердофазной ферментации. Как видно, существенных структурных изменений не наблюдалось.
На рисунке 2 показано насыщение пшеничных отрубей после 6 дней твердофазной ферментации для производства хитиназы грибом Trichoderma harzianum в этой системе с использованием коммерческого хитина в качестве индуктора. На рисунке 2А показан исходный материал до процесса ферментации. Микрофотографии подтверждают использование субстрата грибом, что также отражается на модификациях, которые он претерпевает, теряя свою фрактальную структуру из-за взаимодействия с грибом.
Результаты, представленные на рисунке 3, свидетельствуют о значительном увеличении активности хитиназы (рисунок 3A) и активности амилазы (рисунок 3B), полученных от T. harzianum и Aspergillus lentulus, соответственно, при сравнении систем твердофазной ферментации (SSF) и ферментации под водой (SmF). Данные были проверены с помощью одностороннего теста ANOVA и теста Тьюки с p < 0,05 с использованием программного обеспечения SigmaPlot. В этом контексте было замечено, что данная система применима к различным ферментативным активностям и грибам. A. lentulus был охарактеризован как термотолерантный гриб, инкубированный при 40 °C, демонстрирующий значительное увеличение его амилазной активности. Результаты хитиназной активности T. harzianum как в жидкой, так и в твердой ферментации ранее были отдельно описаны нашей исследовательской группой 2,5, причем эта работа подтверждает и сравнивает значительное увеличение SSF по сравнению с SmF, аналогичное активности амилазы. Наша группа работала с более чем 50 штаммами грибов для производства протеаз и амилаз в мезофильных и термофильных условиях, и результаты стабильны.
Результаты подтверждают успех протокола, демонстрируя значительное увеличение активности ферментов, при этом твердофазная ферментация дает более высокую производительность по сравнению с ферментацией под водой. Это указывает на эффективность SSF в усилении выработки хитиназы и амилазы. Ранее опубликованные рисунки были повторно использованы с соответствующим разрешением на перепечатку.
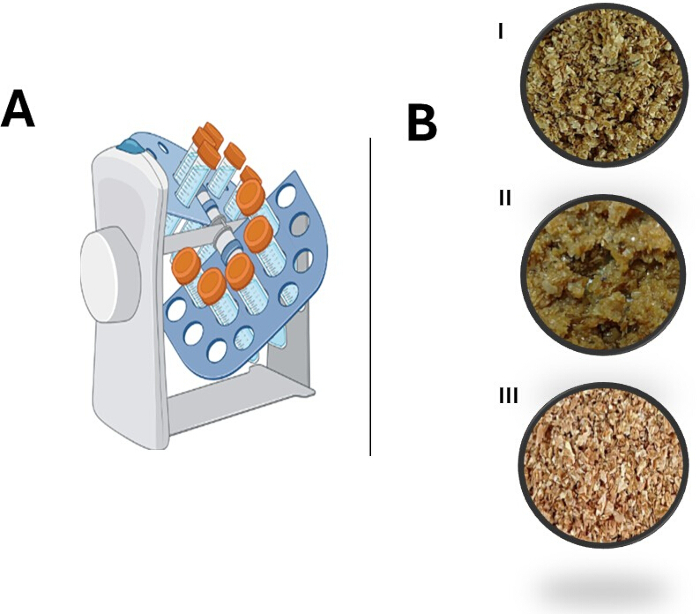
Рисунок 1: Обзор ротационной системы твердофазной ферментации (SSF) и процесса предварительной обработки пшеничных отрубей. (A) Схематическое изображение роторной системы SSF. (B) Изменения в процессе предварительной обработки пшеничных отрубей: (I) Исходное сырье, (II) Влажные пшеничные отруби после стадии промывки, (III) Сушеные пшеничные отруби. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
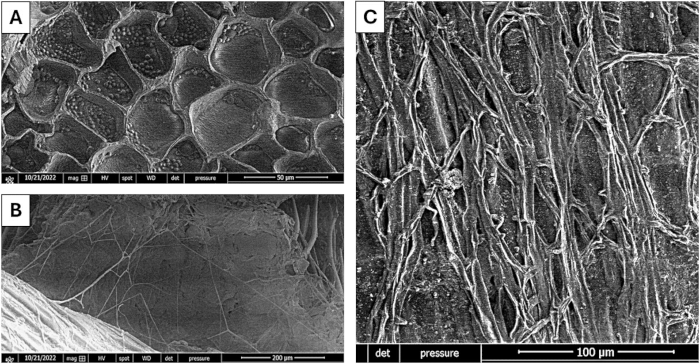
Рисунок 2: Насыщение субстрата Trichoderma harzianum. (А) Субстрат перед ССП. (В,В) Субстрат насыщен грибным мицелием при разных увеличениях. Масштабные линейки: (А), 50 μм; (В), 200 мкм; (C), 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
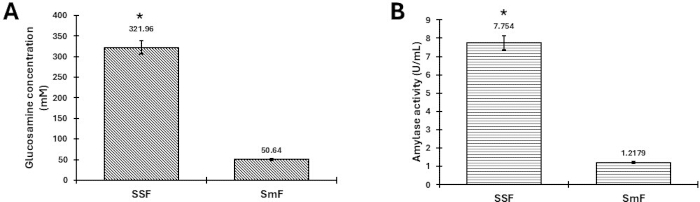
Рисунок 3: Ферментативная активность в SSF и погружной ферментации (SmF) T. harzianum и A. lentulus. Сравнение (А) образования глюкозамина в результате гидролиза хитозана ферментами, продуцируемыми Trichoderma harzianum в SSF и SmF, и (B) активности амилазы Aspergillus lentulus , полученной в SSF и SmF. Погрешности представляют собой стандартное отклонение трех репликатов. Звездочками (*) обозначена статистически значимая разница между данными. Обратите внимание, что статистическая вариация специфична для каждого типа фермента и не применима к сравнениям между (А) и (В). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом исследовании изложен соответствующий протокол для оптимизации производства ферментов с помощью систем твердофазной ферментации (SSF), специально разработанных для нитчатых грибов. Ниже обсуждаются важнейшие аспекты методологии, а также ее значение, ограничения и потенциальное применение.
Успех протокола в значительной степени зависит от ключевых этапов, таких как подготовка субстрата и инокулята. Правильная промывка и сушка пшеничных отрубей необходимы для устранения примесей, которые могут препятствовать росту грибков или выработке ферментов. Кроме того, тщательная регулировка влажности субстрата для поддержания относительной влажности выше 90% обеспечивает оптимальную колонизацию и активность грибов13. Работа роторной системы при 10 об/мин является еще одним важным параметром, так как она способствует равномерному перемешиванию и насыщению кислородом, предотвращая комкование субстрата и обеспечивая равномерный рост грибков14.
Адаптивность этого протокола заключается в его совместимости с различными видами грибов и индукторами. Например, в то время как коммерческий хитин и крахмал использовались в качестве индукторов в этом исследовании, другие субстраты, такие как лигнин, целлюлоза или хитозан, могут быть заменены в зависимости от целевого фермента. Устранение распространенных проблем, таких как неравномерная колонизация субстрата, включает в себя уточнение параметров смешивания или регулировку концентрации инокулята2. Кроме того, обеспечение стерильности во время подготовки субстрата и модифицирования имеет решающее значение для предотвращения загрязнения, особенно в промышленных масштабах15.
Несмотря на то, что SSF имеет ряд преимуществ по сравнению с ферментацией под водой (SmF), она не лишена ограничений16. Одной из основных проблем является масштабирование роторной системы SSF без ущерба для смешивания субстрата, диффузии кислорода или точного определения биомассы, что является еще одной распространенной проблемой в SSF17,18. Кроме того, зависимость протокола от агропромышленных отходов, таких как пшеничные отруби, может привести к вариативности результатов из-за различий в составе субстрата между партиями. Эти ограничения подчеркивают необходимость дальнейшей оптимизации при переходе к крупносерийному производству19,20.
Описанная роторная система SSF демонстрирует значительные преимущества по сравнению с традиционными статическими методами SSF и SmF. По сравнению со статическим SSF, роторная система обеспечивает более равномерный рост микроорганизмов, уменьшая проблемы, связанные с ограничением кислорода. Кроме того, адаптивность системы позволяет применять ее к различным формам грибов и типам ферментов, что делает ее очень универсальной18. Системы SSF могут иметь различные конфигурации для повышения продуктивности метаболитов. Каждый тип системы имеет преимущества и недостатки, которые необходимо глубоко проанализировать, чтобы определить наилучшую конфигурацию. Роторная система SSF имеет ряд преимуществ по сравнению с традиционными статическими SSF и SmF; однако он сталкивается с проблемами по сравнению с другими системами SSF, такими как тарелочные биореакторы и биореакторы с насадочным слоем. Тарелочные биореакторы, обычно используемые для крупномасштабного SSF, отличаются простотой и низким энергопотреблением, но сталкиваются с проблемами, связанными с ограниченным переносом кислорода и распределением влаги, что приводит к неравномерному росту микроорганизмов и снижению выхода ферментов. Биореакторы с насадочным слоем, с другой стороны, улучшают аэрацию за счет принудительного потока воздуха, но могут сталкиваться с проблемами перепадов давления и неравномерного распределения температуры, особенно в высоких колоннах. В отличие от этого, роторная система SSF способствует непрерывному перемешиванию и однородным условиям, уменьшая анаэробные зоны и повышая продуктивность ферментов. Тем не менее, потребление энергии и механический износ из-за непрерывного вращения могут привести к увеличению эксплуатационных расходов21.
Статические твердотельные ферментационные системы, такие как тарелочные биореакторы, ограничены ограниченным тепло- и массообменом, что часто приводит к внутренним температурным градиентам более 30 °C, что приводит к неоптимальным микробиологическим характеристикам. Эти системы обычно работают в небольших объемах (0,15-0,25 м³) и страдают от гетерогенной микробной колонизации, при этом исследования показывают, что только около 34% пор субстрата эффективно используются. В отличие от них, вращающиеся биореакторы обеспечивают механическое перемешивание, которое улучшает распределение кислорода и однородность субстрата, поддерживая при этом большие рабочие объемы до 13 м³ и нагрузку на субстрат до 40% (вт/об.). Примечательным примером является производство целлюлазы компанией Thermoascus aurantiacus, где вращающийся реактор SSF, поддерживаемый при 49°C и проветриваемый со скоростью 5 л/мин·кг, дал 14098 МЕ/г активности фермента, что более чем в три раза выше, чем 4212 МЕ/г, полученных в статическихусловиях22.
Масштабирование твердофазной ферментации требует тонкого баланса между поддержанием кинетики микробов и обеспечением эффективной массо- и теплопередачи в все более крупных системах. Традиционный ступенчатый подход включает лабораторную (5-20 кг), пилотную (50-5000 кг) и промышленную (25-1000 тонн) стадии. Одной из основных проблем при масштабировании является рассеивание метаболического тепла, которое может достигать до 3 200 ккал/кг сухого материала, что особенно проблематично в статических или плохо вентилируемых системах. Чтобы решить эту проблему, стратегии масштабирования часто опираются на контроль безразмерных параметров конструкции и применение подходов к математическому моделированию, включая уравнения массы и энергетического баланса, для сохранения ключевых переменных, таких как доступность кислорода и удержание влаги в подложке в различных масштабах. В пилотных системах (например, объемом 150 л и 6 м³) успешно реализованы такие инженерные особенности, как водяные рубашки, изогнутые лопасти для перемешивания и контролируемая влажность для улучшения воспроизводимости процесса и обеспечения стабильного выхода продукта 18,21,22.
Представленный протокол продемонстрировал эффективность для производства ферментов в небольших лабораторных масштабах. Тем не менее, масштабирование процесса для промышленного применения сопряжено со значительными проблемами, в первую очередь связанными с поддержанием эффективного смешивания и аэрации в больших объемах. Одним из перспективных подходов к устранению этих ограничений является использование винтового реактора непрерывного действия, который имитирует функцию вертикального смесителя, способствуя непрерывному перемешиванию и улучшенному насыщению кислородом по всему твердому основанию. Такая конструкция уменьшает образование анаэробных зон и усиливает массообмен, которые являются критическими факторами для успеха твердофазной ферментации в промышленных масштабах 2,15. Тем не менее, потенциальные проблемы включают в себя поддержание структурной целостности твердой матрицы и предотвращение образования градиентов температуры вдоль реактора. Дальнейшие исследования должны быть сосредоточены на оптимизации эксплуатационных параметров и валидации выходов ферментов в условиях масштабирования, чтобы обеспечить осуществимость и эффективность процесса.
Потенциальное применение этого протокола распространяется на множество секторов, включая пищевую биотехнологию, биоэнергетику и восстановление окружающей среды. Например, усиленное производство гидролитических ферментов, таких как хитиназы и амилазы, может поддерживать процессы биоконверсии в сельском хозяйстве и промышленности. Кроме того, использование побочных продуктов агропромышленного производства, таких как пшеничные отруби, согласуется с устойчивыми практиками, способствуя повышению ценности отходов и внося вклад в биоэкономику замкнутогоцикла20.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа была поддержана Секретариатом исследований и посградо Национального политехнического института (SIP-IPN) посредством грантов/проектов под номерами 20220487, 20230676, 20240793 и 20251269, присужденных GGS, и 20220492, 20230427, 20240335 и 20251139 присуждены DROH. Авторы выражают благодарность ENCB-IPN, Секретариату науки, гуманизации, технологии и инноваций Мексики (Secihti), ранее известному как Consejo Nacional de Ciencia, Humanidades y Tecnología (CONAHCyT) и программе BEIFI, а также Центру нанонаук и микротехнологий и нанотехнологий Национального института политехнического искусства за их неоценимую поддержку. Лопес-Гарсия благодарит Сесихти (ранее CONAHCyT) за стипендию магистра, а также IPN за стипендию SIP-BEIFI. Легоррета-Кастаньеда является получателем постдокторской стипендии в рамках программы "Estancias Posdoctorales por México" компании Secihti, ранее известной как CONAHCyT.
Материалы
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS431684 | For culturing mycelium in liquid medium. |
| 50 mL conical tube | Sigma-Aldrich | CLS430921 | For storing and preparing substrates and inoculum. |
| Acetate buffer, pH 5.6 | Sigma-Aldrich | 320866 | For chitinase extraction. |
| Centricon filters | Millipore | UFC905024 | For further purification of enzymes. |
| Counting cells chamber | Sigma-Aldrich | Z359629 | Used to count spores under a microscope. |
| Filter paper | Whatman | 1001-110 | For filtering the enzyme extract. |
| Hygrometer | Todomicro | - | To measure relative humidity of the substrate. |
| Inducer (e.g., commercial chitin) | Sigma-Aldrich | C9752 | Used to enhance enzyme production during fermentation. |
| Phosphate buffer, pH 6.9 | Sigma-Aldrich | P5379 | For amylase extraction. |
| Potato-dextrose agar | Sigma-Aldrich | P2182 | Culture medium for growing fungal mycelium. |
| Potato-dextrose broth | Sigma-Aldrich | P6685 | Liquid culture medium for growing fungal mycelium. |
| Rotary mixer | Thermo-Fisher Scientific | 88-861-051 | To keep substrate moving during fermentation. |
| Salt solution components (e.g., KH2PO4, Na2SO4, KCl, etc.) | Sigma-Aldrich | Multiple | For preparing sterile salt solution, see detailed recipe in the protocol. |
| Wheat bran | Comercial market | - | Substrate for solid-state fermentation. |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены