Method Article
丝状真菌生产聚合物水解细胞外酶的固态发酵系统设计
摘要
该方案在旋转固态发酵系统中利用麦麸来提高酶的产生。该底物补充有几丁质等诱导剂,可在受控条件下支持真菌生长。结果表明,与深层发酵相比,酶的产量高 4-6 倍,展示了该方法对各种生物技术应用的适应性和有效性。
摘要
固态发酵 (SSF) 是一种生物转化过程,它利用不溶于水性介质的固体基质。微生物生长在基质表面并渗透其固体基质以提取其发育所需的营养物质。SSF 的特点是游离水最少,基材水分含量保持在 70% 以上,涉及三个相互连接的相 - 气相、液相和固相。该协议描述了使用麦麸(一种农工副产品)作为旋转系统中酶生产的基础底物。底物补充有诱导剂,如几丁质、壳聚糖、淀粉或纤维素,以促进水解蛋白的合成。该系统具有很强的适应性,允许使用不同的真菌形式,包括菌丝体、孢子或颗粒。在所描述的方法中,诱导剂和底物以 1:100 (w/w) 的比例混合, 通过 高压灭菌灭菌,并用无菌水调节至所需的水分含量。然后加入真菌接种物,旋转系统以 10 rpm 的速度运行,以确保充分混合和充氧。该系统在嗜温或嗜热/耐热真菌的最佳生长条件下孵育 6-8 天,增强了其多功能性。孵育后,根据酶的类型,使用适当的冷缓冲液(例如乙酸盐、柠檬酸盐或磷酸盐)很容易提取酶。通过离心和过滤澄清提取物以获得无细胞上清液。然后可以根据需要进一步浓缩或纯化酶。结果表明,与浸没式发酵 (SmF) 相比,酶活性增加了 4-6 倍,突出了该系统的有效性。它对不同底物、诱导剂和真菌种类的适应性使其成为各种生物技术应用的宝贵工具。
引言
固态发酵 (SSF) 已成为一种有前途且可持续的生物转化技术,用于生产高价值酶、生物活性化合物和次生代谢物。该技术涉及微生物在固体基质上以最少的游离水生长,模拟其自然环境并实现高效的代谢活动1。该方案的主要目标是通过旋转 SSF 系统优化酶生产,确保提高底物利用率、氧扩散和工艺可扩展性。使用麦麸(一种丰富的农工副产品)作为基础基质,有助于农业废弃物的价值化并促进循环生物经济实践2。
与深层发酵 (SmF) 相比,SSF 具有显著优势,包括能耗和水消耗更低、产品浓度更高,以及与各种廉价农业残留物(如麦麸、稻壳和甘蔗渣3)的相容性。与需要大量水和昂贵营养介质的 SmF 不同,SSF 系统利用固体基质,这些基质不仅用作微生物生长表面,还提供微生物活性所必需的营养物质。此外,SSF 中有限的游离水可最大限度地降低污染风险,使其成为工业环境中酶生产的更稳健的选择4。除了作优势外,与浸式发酵 (SmF) 相比,SSF 还具有显着的环境和经济效益。研究报告称,SSF 减少了 50%-70% 的用水量,并将能源成本降低了 30% 以上,因为没有需要不断搅拌和曝气的大水量。此外,使用农工废弃物作为基材可以最大限度地降低原材料成本,并通过重新利用农业副产品来促进循环经济实践 2,4。
SSF 的效率和可扩展性已得到广泛验证。例如,研究报告称,与 SmF 相比,使用 SSF 的酶活性增加了 4-6 倍,突出了该技术的经济和环境优势 2,5。此外,下游工艺也得到了简化,因为酶提取通常需要更少的水和更少的纯化步骤。这使得 SSF 对旨在降低运营成本和环境影响的行业特别有吸引力6。
该协议中描述的旋转 SSF 系统与传统的静态 SSF 方法相比提供了多项改进。虽然静态系统经常面临底物定植不均匀和氧气限制等挑战,但旋转配置可确保充分混合和曝气,促进微生物均匀生长 7,8,9。例如,该系统已成功用于使用曲霉菌和木霉菌 2 等真菌物种生产几丁质酶、淀粉酶和蛋白酶等水解酶。
这种 SSF 系统的一个关键特点是它的适应性。使用麦麸作为基础基质证明了农工残留物在具有成本效益的生物转化方面的潜力3。此外,在底物中补充几丁质、壳聚糖和淀粉等诱导剂,通过刺激特定的代谢途径进一步增强酶合成 2,10。该系统还兼容不同的真菌形式,包括孢子、菌丝体和颗粒,允许用户根据其特定要求定制工艺2。
SSF 在食品生物技术、生物燃料生产和环境修复等各个领域具有广泛的应用潜力11。它整合了具有成本效益的底物、卓越的酶产量和高工艺灵活性,使 SSF 成为工业规模生物技术创新的重要方法。
研究方案
本研究中使用的试剂和设备列在 材料表中。
1. 基材制备
注意:使用商业品牌的麦麸,以尽量减少基质特性的显着变化。每批麦麸因多种因素而变化,使其成为难以标准化的异质材料,导致其成分含量波动。如果需要标准化材料,请选择替代基质或对每批麦麸进行近似化学分析,以根据需要进行调整。
- 用无菌蒸馏水将麦麸清洗 3 次,以去除有机物残留物、碎屑和灰尘。这还可以去除可能干扰发酵的单糖。
- 将洗净的麸皮铺在铝托盘上,并在 60 °C 的烤箱中干燥 24 小时。
- 干燥后,将麦麸放入无菌 50 mL 锥形管中。
2. 接种物的制备
注意:该方案描述了接种物制备的三种方法:孢子悬浮液、菌丝体盘直接接种和细胞悬浮液。确定初始接种物浓度并量化蛋白质水平,以便准确计算产量。
- 孢子悬浮液的制备
- 将直径为 5 mm 的浸有菌丝体的琼脂盘转移到新鲜的马铃薯葡萄糖琼脂平板上。将板在 28 °C 下孵育 5-7 天,或直到菌丝体使培养基饱和。一些真菌可能需要更长的孵育时间。
- 向板中加入 5 mL 无菌蒸馏水,并使用无菌定量环机械分离孢子。
- 准备 1:100 稀释的孢子悬浮液。将 10 μL 置于 Neubauer 腔室的中心,并在显微镜下计数孢子。根据腔室的因子和稀释度计算孢子浓度(孢子/mL)。
- 在液体培养基中培养菌丝体
- 将用菌丝体饱和的 5 mm 琼脂盘转移到新鲜的马铃薯-葡萄糖-琼脂平板上,并在 28 °C 下孵育直至饱和。
- 在无菌 125 mL 烧瓶中制备 25 mL 马铃薯-葡萄糖肉汤,然后高压灭菌。
- 将 5 mm 菌丝体圆盘从饱和板转移到无菌肉汤中。
- 将培养瓶在摇床上以 125 rpm 孵育 24-48 小时,具体取决于真菌菌株。延长生长缓慢的真菌的孵育时间。
- 收集 2 mL 用于接种物,收集 2 mL 用于干重测定。
- 菌丝体盘的直接接种
- 将浸有菌丝体的 5 mm 琼脂盘放在新鲜的马铃薯-葡萄糖-琼脂平板上。在 28 °C 下孵育直至饱和。
- 使用一个菌丝体圆盘作为接种物,使用另一个菌丝体圆盘来确定干重。
3. SSF 系统的准备
注意:诱导剂可以是天然的或商业的。纯化的商业诱导剂是首选,以最大限度地减少可能改变发酵效率的杂质。调整加水量以保持至少 90% 的相对湿度。
- 将以下组分混合在无菌 50 mL 锥形管中:5 g 干麦麸;0.2 g 诱导剂(例如,商业几丁质);5.5 mL 水(根据诱导剂的吸水能力进行调整);5 mL 无菌盐溶液,含有 16 g/L 磷酸二氢钾、4 g/L 硫酸钠、2 g/L 氯化钾、1 g/L 氯化钙、400 mg/L 氯化锌、60 mg/L 硼酸、40 mg/L 钼酸钠、150 mg/L 氯化镁、100 mg/L 氯化铁和 400 mg/L 硫酸铜。
- 使用基于电极的湿度计测量相对湿度,确保最低 90% 的湿度。将电极探针直接插入反应器中不同深度,以获得水分分布的代表性测量值。
- 如果低于 90%,请按照以下步骤调整湿度:
- 以每 10 g 底物 1 mL 的增量逐渐加入无菌蒸馏水。每次添加后,充分混合以确保水分均匀分布。
- 让底物平衡 10-15 分钟。重新测量湿度水平。
- 重复上述步骤,直到达到 90% 的目标湿度。在整个过程中避免过度润湿基材。
- 如果湿度高于 90%,请按照以下步骤调整湿度:
- 在无菌环境中将底物薄薄铺开。通过以下方式去除多余的水分:(1) 将基材暴露在层流中,或 (2) 将其放入 30 °C 的干燥室中 10-15 分钟。
- 或者,轻轻混合基材以促进水分均匀重新分布。处理后,重新评估湿度水平。
- 根据需要重复干燥或混合步骤,直到湿度达到 90%。只有在达到目标湿度后才进行发酵。
- 如果低于 90%,请按照以下步骤调整湿度:
- 在 15 psi 下高压灭菌管 15 分钟。
- 冷却后,用以下物质之一接种基质:1 mL 孢子悬液(1 x 106-1 x 107 个孢子/mL)、2 mL 细胞悬液或一个 5 mm 菌丝体盘。
4. 固态发酵 (SSF) 程序
注意:对于不同时间的动力学研究或参数评估,请为每个时间点准备单独的试管以确保代表性。
- 通过在 1 分钟的周期中以最大速度涡旋试管 5 分钟来避免底物结块。
- 将试管放入具有水平轴的旋转混合器中。确保基材在管内自由移动。将混合器设置为以 10 rpm 的速度运行。
- 在培养箱中以微生物的最佳生长温度孵育混合器。使用热敏诱导剂时,保持报告的温度以实现最佳酶活性。
5. 酶的提取
注:提取基本原理基于细胞外酶的溶解度和 pH 最大活性。由于 SSF 避开了水介质,细胞外酶参与固体基质周围的水中,这意味着浓度高于 SmF。在这种情况下,最佳提取缓冲液的选择取决于对所需活性的了解。提取的优化取决于最终的酶浓度和所用提取缓冲液的类型。
- 在所需的发酵期后,将底物重悬于 20 mL 预冷缓冲液中。示例包括:0.1 M 乙酸盐缓冲液,pH 5.6,用于几丁质酶提取;0.02 M 磷酸盐缓冲液,pH 6.9,用于淀粉酶提取。
- 循环涡旋试管:以最大速度涡旋 1 分钟,然后在冰上 1 分钟。重复 10 次。
- 使用纸质过滤器过滤悬浮液,并通过按压机械提取上清液。
- 通过在 4 °C 下以 3000 x g 离心 15 分钟来澄清上清液。
- 直接使用粗提取物 或通过柱层 析或离心过滤器进一步纯化酶。还建议进行动力学研究以确定 Michaelis 常数 (Km) 和最大酶转化速率 (Vmax)12。
6. 优化流程
注意:通过评估和调整诱导剂的质量和浓度,以及接种物的类型和浓度来优化此方案。
- 确定理想的发酵时间并改进提取步骤以提高效率。
- 控制和微调环境条件,包括温度、pH 值和通气性。
- 测试各种缓冲液和提取条件,以提高酶的产量和稳定性。
- 执行统计分析,例如响应面法,以确定最具影响力的变量并实现最佳酶生产。
结果
图 1A 显示了该系统中使用的旋转混合器的示意图,其容量为 6 个 50 mL 锥形管。 图 2B 说明了在进入固态发酵过程之前,麦麸在调节过程中发生的变化。如所见,未观察到明显的结构变化。
图 2 显示了在该系统中使用商业甲壳素作为诱导剂,哈 茨木霉 菌为生产几丁质酶而进行固态发酵 6 天后麦麸的饱和。 图 2A 显示了发酵过程之前的原始材料。显微照片证实了真菌对基质的利用,这也反映在它所经历的修饰中,由于与真菌的相互作用而失去了其分形状结构。
图 3 中的结果显示,在比较固态发酵 (SSF) 和浸没发酵 (SmF) 系统时,分别从 T. harzianum 和 Aspergillus lentulus 获得的几丁质酶活性(图 3A)和淀粉酶活性(图 3B)显着增加。使用 SigmaPlot 软件通过单因素方差分析和 Tukey 检验验证数据,p < 0.05。在这种情况下,观察到该系统适用于不同的酶活性和真菌。A. lentulus 被表征为一种耐热真菌,在 40 °C 下孵育,其淀粉酶活性显着增加。我们的研究小组之前已经分别报道了 T. harzianum 在液体和固体发酵中的几丁质酶活性结果 2,5,这项工作证实并比较了与 SmF 相比 SSF 的显着增加,类似于淀粉酶活性。我们小组已经研究了 50 多种真菌菌株,在嗜温和嗜热条件下生产蛋白酶和淀粉酶,结果一致。
结果通过证明酶活性的显着增加证实了该方案的成功,与浸入式发酵相比,固态发酵产生更高的产量。这表明 SSF 在增强几丁质酶和淀粉酶产生方面的有效性。以前发布的图表已在获得适当的转载许可后被重复使用。
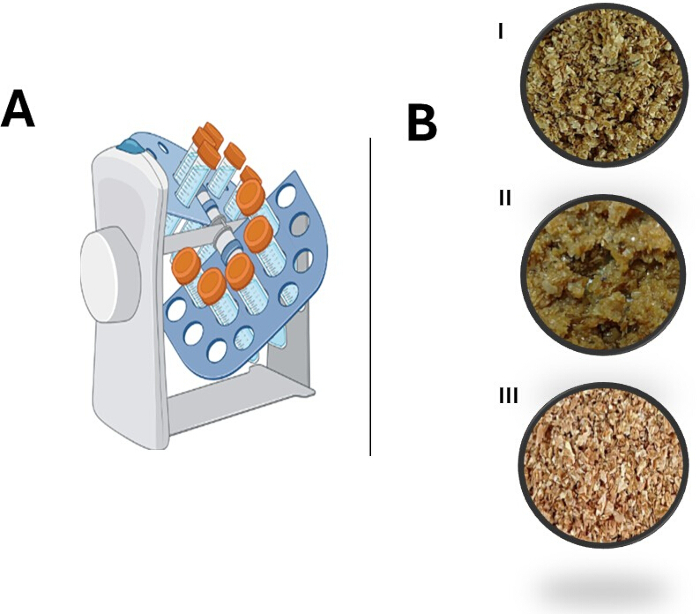
图 1:旋转固态发酵 (SSF) 系统和麦麸预处理过程的概述。 (A) 旋转式 SSF 系统的示意图。(B) 麦麸预处理过程的修改: (I) 初始原料,(II) 洗涤步骤后的湿麦麸,(III) 干麦麸。 请单击此处查看此图的较大版本。
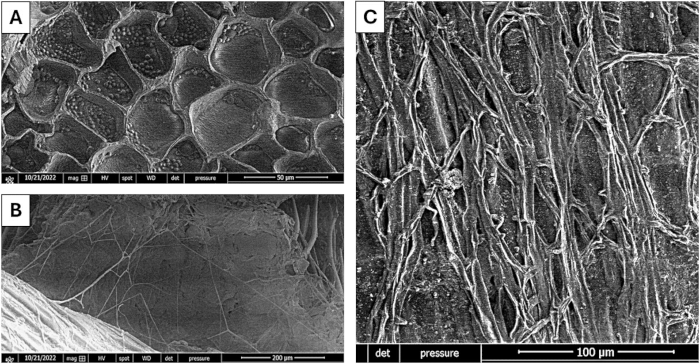
图 2: Harzianum 木霉的底物饱和度。 (A) SSF 之前的基材。(B,C)底物在不同放大倍数下充满真菌菌丝体。比例尺:(A),50 μm;(B),200 μm;(C),100 μm。 请单击此处查看此图的较大版本。
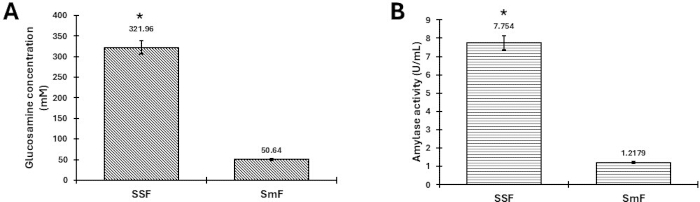
图 3: T. harzianum 和 A. lentulus 在 SSF 和浸没发酵 (SmF) 中的酶活性。 比较 (A) 在 SSF 和 SmF 中, 哈茨木霉 产生的酶水解壳聚糖形成葡萄糖胺,以及 (B) 在 SSF 和 SmF 中获得的 曲霉 淀粉酶活性。误差线表示三个重复的标准差。星号 (*) 表示数据之间的统计显著性差异。请注意,统计变化特定于每种类型的酶,不适用于 (A) 和 (B) 之间的比较。 请单击此处查看此图的较大版本。
讨论
本研究概述了通过固态发酵 (SSF) 系统优化酶生产的相关方案,该系统专为丝状真菌设计。下面讨论了该方法的关键方面,以及其重要性、局限性和潜在应用。
该方案的成功在很大程度上取决于关键步骤,例如底物和接种物的制备。正确清洗和干燥麦麸对于去除可能干扰真菌生长或酶产生的杂质至关重要。此外,仔细调整基质水分以保持相对湿度高于 90% 可确保最佳的真菌定植和活性13。旋转系统以 10 rpm 的速度运行是另一个关键参数,因为它促进均匀混合和氧化,防止基质结块并确保真菌均匀生长14。
该方案的适应性在于它与各种真菌物种和诱导剂的兼容性。例如,虽然在本研究中使用商业甲壳素和淀粉作为诱导剂,但其他底物,如木质素、纤维素或壳聚糖,可以根据目标酶进行替代。解决常见挑战(例如底物定植不均匀)涉及优化混合参数或调整接种物浓度2。此外,确保底物制备和接种过程中的无菌性对于防止污染至关重要,尤其是在工业规模应用中15。
虽然 SSF 与浸没式发酵 (SmF) 相比具有多项优势,但它并非没有限制16。一个主要挑战是在不影响基材混合、氧气扩散或准确生物量测定的情况下扩大旋转 SSF 系统的规模,这是 SSF17,18 的另一个常见问题。此外,由于不同批次的底物成分不同,该方案对麦麸等农工残留物的依赖可能会导致结果发生变化。这些限制突出了在过渡到大规模生产时需要进一步优化19,20。
所描述的旋转 SSF 系统与传统的静态 SSF 和 SmF 方法相比具有显着优势。与静态 SSF 相比,旋转系统可确保更均匀的微生物生长,从而减少与氧气限制相关的问题。此外,该系统的适应性使其能够应用于各种真菌形式和酶类型,使其具有高度的通用性18。SSF 系统可以具有多种配置,以提高代谢物的生产率。每种类型的系统都有优点和缺点,必须深入分析这些优点和缺点以确定最佳配置。与传统的静态 SSF 和 SmF 相比,旋转 SSF 系统具有多项优势;然而,与其他 SSF 系统(如托盘和填充床生物反应器)相比,它面临着挑战。托盘式生物反应器通常用于大规模 SSF,简单且能耗低,但面临与有限的氧气转移和水分分布相关的挑战,导致微生物生长不均匀和酶产量降低。另一方面,填充床生物反应器通过强制气流改善通气,但可能会遇到压降和温度分布不均匀的问题,尤其是在高塔中。相比之下,旋转 SSF 系统促进了连续混合和均匀条件,减少了厌氧区,提高了酶的生产率。尽管如此,连续旋转造成的能源消耗和机械磨损可能会增加运营成本21。
静态固态发酵系统(如托盘式生物反应器)受传热和传质受限,通常会导致内部温度梯度超过 30 °C,从而导致微生物性能欠佳。这些系统通常以小体积 (0.15-0.25 m³) 运行,并且存在异质微生物定植,研究表明只有大约 34% 的基质孔得到有效利用。相比之下,旋转生物反应器提供机械搅拌,可增强氧气分布和基质均匀性,同时支持高达 13 m³ 的更大作体积和高达 40% (w/v) 的基质负载。一个值得注意的例子是 Thermoascus aurantiacus 的纤维素酶生产,其中保持在 49 °C 并以 5 L/min·kg 通风的旋转 SSF 反应器产生了 14,098 IU/g 的酶活性,比在静态条件下获得的 4,212 IU/g 高出三倍多 22。
扩大固态发酵的规模需要在维持微生物动力学和确保在逐渐变大的系统中进行有效的质量和热传递之间取得微妙的平衡。传统的逐步方法包括实验室 (5-20 kg)、中试 (50-5,000 kg) 和工业 (25-1,000 t) 阶段。放大生产过程中的主要挑战之一是代谢热的耗散,代谢热的耗散可能高达 3,200 kcal/kg 的干材料,这在静态或通风不良的系统中尤其成问题。为了解决这个问题,放大策略通常依赖于无量纲设计参数的控制和数学建模方法(包括质量和能量平衡方程)的应用,以保留关键变量,例如不同尺度下的氧气可用性和基材水分保持率。中试规模系统(例如 150 L 和 6 m³)已成功整合了水套、弯曲搅拌叶片和受控湿度等工程功能,以提高工艺可重复性并确保一致的产品产量 18,21,22。
提出的方案证明了在小实验室规模上生产酶的有效性。然而,扩大工业应用的工艺规模带来了重大挑战,主要与保持大批量的高效混合和曝气有关。解决这些限制的一种有前途的方法是使用连续螺杆反应器,它通过促进连续混合和改善整个固体基质的氧合作用来模拟立式混合器的功能。这种设计减少了厌氧区的形成并增强了传质,这是工业规模固态发酵成功的关键因素 2,15。然而,潜在的挑战包括保持固体基质的结构完整性和防止沿反应器形成温度梯度。进一步的研究应侧重于优化作参数和验证放大条件下的酶产量,以确保工艺的可行性和效率。
该协议的潜在应用延伸到多个领域,包括食品生物技术、生物能源和环境修复。例如,几丁质酶和淀粉酶等水解酶的增强生产可以支持农业和工业的生物转化过程。此外,使用麦麸等农工副产品符合可持续实践,促进废物的价值化,并有助于循环生物经济20。
披露声明
作者声明他们没有利益冲突。
致谢
这项工作得到了国家政治研究所 (SIP-IPN) 调查和波斯格拉多秘书的支持,通过授予 GGS 的赠款/项目编号 20220487、20230676、20240793 和 20251269,以及授予 DROH 的 20220492、20230427、20240335 和 20251139。作者要感谢 ENCB-IPN、Secretaría de Ciencia、Humanidades、Tecnología e Innovación de México (Secihti)(前身为 Consejo Nacional de Ciencia)、Humanidades y Tecnología (CONAHCyT) 和 BEIFI 计划以及 Instituto Politécnico Nacional 的 Centro de Nanociencias y Micro y Nanotecnologías 的宝贵支持。López-García 感谢 Secihti(前身为 CONAHCyT)获得硕士奖学金,并感谢 IPN 获得 SIP-BEIFI 奖学金。Legorreta-Castañeda 是 Secihti(以前称为 CONAHCyT)的“Estancias Posdoctorales por México”计划的博士后奖学金获得者。
材料
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS431684 | For culturing mycelium in liquid medium. |
| 50 mL conical tube | Sigma-Aldrich | CLS430921 | For storing and preparing substrates and inoculum. |
| Acetate buffer, pH 5.6 | Sigma-Aldrich | 320866 | For chitinase extraction. |
| Centricon filters | Millipore | UFC905024 | For further purification of enzymes. |
| Counting cells chamber | Sigma-Aldrich | Z359629 | Used to count spores under a microscope. |
| Filter paper | Whatman | 1001-110 | For filtering the enzyme extract. |
| Hygrometer | Todomicro | - | To measure relative humidity of the substrate. |
| Inducer (e.g., commercial chitin) | Sigma-Aldrich | C9752 | Used to enhance enzyme production during fermentation. |
| Phosphate buffer, pH 6.9 | Sigma-Aldrich | P5379 | For amylase extraction. |
| Potato-dextrose agar | Sigma-Aldrich | P2182 | Culture medium for growing fungal mycelium. |
| Potato-dextrose broth | Sigma-Aldrich | P6685 | Liquid culture medium for growing fungal mycelium. |
| Rotary mixer | Thermo-Fisher Scientific | 88-861-051 | To keep substrate moving during fermentation. |
| Salt solution components (e.g., KH2PO4, Na2SO4, KCl, etc.) | Sigma-Aldrich | Multiple | For preparing sterile salt solution, see detailed recipe in the protocol. |
| Wheat bran | Comercial market | - | Substrate for solid-state fermentation. |
参考文献
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。