Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизация методов фотонейромодуляции для оценки роли зеленых светоизлучающих диодов в лечении боли
* Эти авторы внесли равный вклад
В этой статье
Резюме
Последние разработки в области исследований боли подчеркивают потенциал фотонейромодуляции с использованием зеленых светоизлучающих диодов (GLED) в качестве немедикаментозного лечения. GLED модулирует болевые пути, обеспечивая эффективное обезболивание. Данная статья направлена на стандартизацию и уточнение протоколов воздействия GLED, повышение согласованности между исследованиями и продвижение клинического применения этой терапии.
Аннотация
Несмотря на обширные исследования и выявление многочисленных анальгетических мишеней, спектр доступных фармакологических методов лечения боли остается ограниченным. Тем не менее, потенциальный сдвиг парадигмы может привести к появлению новой волны немедикаментозных методов лечения боли с замечательной безопасностью, эффективностью и переносимостью. Одной из перспективных областей исследований является фотонейромодуляция с использованием зеленых светоизлучающих диодов (GLED, 525 нм), которые показали потенциал в облегчении боли как при острых, так и при хронических состояниях, что привело к многочисленным доклиническим и клиническим исследованиям, изучающим эффективность этой терапии. Эти исследовательские проекты продемонстрировали, как воздействие GLED усиливает активность эндогенной опиоидной системы в головном и спинном мозге после активации М-колбочек в сетчатке. Полученные данные свидетельствуют о том, что GLED может облегчить боль за счет модуляции нисходящего пути боли. В свете убедительных эффектов GLED распространение исследований фотонейромодуляции подчеркивает важность установления согласованности в четко определенных и стандартизированных протоколах воздействия для доклинических и клинических испытаний. В доклинических исследованиях положительные эффекты наблюдались как минимум через 2 дня воздействия, при этом протоколы включали 8 часов света при 100 люкс в течение 12-часовой световой фазы. В клинических испытаниях протоколы воздействия адаптируются к конкретной исследуемой патологии. Экспозиция в течение 15 мин оказалась благоприятной в модуляции острой послеоперационной боли. Для модуляции хронической боли пациентам рекомендуется использовать GLED в домашних условиях в течение 1-2 часов в день в течение 10 недель. В этой статье подробно описаны доклинические и клинические протоколы для улучшения воспроизводимости и согласованности в различных исследованиях, оценивающих преимущества фотонейромодуляции. Путем создания этих стандартизированных протоколов эта работа направлена на продвижение клинического перевода фототерапии GLED в качестве жизнеспособного нефармакологического лечения боли.
Введение
Фармакологические методы лечения, особенно опиоиды, по-прежнему в значительной степени используются для лечения как острых, так и хронических болевых состояний1. На эффективность обезболивания может значительно влиять частота и тяжесть побочных эффектов, связанных с употреблением опиоидов2. По этой причине значительное количество пациентов, получающих опиоидную терапию, не достигают успешного обезболивания3. Следовательно, специалисты по лечению боли и пациентское сообщество все чаще ищут немедикаментозные методы лечения, которые позволяют избежать побочных эффектов, связанных с традиционными обезболивающими препаратами. Фотонейромодуляция стала многообещающим решением и безопасной терапией для снятия боли.
Фотонейромодуляция (ПНМ) — это неинвазивный метод, в котором используются светоизлучающие диоды (LED) для регуляции биологических процессов4. Фототерапия была создана тысячи лет назад с использованием солнечного света, или гелиотерапии, длялечения кожных заболеваний. Впоследствии понятие о влиянии света на биологические ткани расширилось, что привело к разработке термина фотонейромодуляция. Исследования PNM в настоящее время расширяются во всем мире и показали свою эффективность в различных клинических приложениях, включая лечение боли 6,7,8,9, улучшение качества сна у пациентов с болезнью Альцгеймера 10 и контроль депрессии11.
Все большее внимание уделяется доклиническим исследованиям и клиническим испытаниям, направленным на изучение механизмов и терапевтического потенциала фотонейромодуляции для лечения боли. Среди этих подходов терапия зеленым светом на диодах (GLED) с использованием стимуляции длиной волны 525 нм показала многообещающую эффективность в уменьшении различных видов боли, включая мигрень, фибромиалгию и послеоперационную боль 12,13,14,15,16. Клинические испытания показали, что терапия зеленым светом неизменно приносит пользу пациентам, страдающим мигренью, в многочисленных исследованиях 12,17,18, уменьшая как головную боль, так и интенсивность светобоязни во время активных приступов мигрени19, а также уменьшая частоту и продолжительность эпизодов мигрени 12. Доклинические исследования также показали, что воздействие GLED может обратить вспять термическую и механическую гиперчувствительность в модели нейропатическойболи при повреждении нерва. Кроме того, в доклинических исследованиях изучались механизмы, с помощью которых GLED влияет на восприятие боли и сенсорные пороги 13,21,22,23,24. Эти исследования подчеркивают участие М-колбочек и последующую модуляцию вентрального латерального коленчатого ядра (vLGN), что увеличивает активность энкефалингических нейронов, проецирующихся на дорсальное ядро рафа (DRN)22. Дополнительные исследования также подчеркивают критическую роль рострального вентромедиального мозгового вещества (РВМ)21, ключевого регулятора нисходящей модуляции боли. В совокупности эти результаты свидетельствуют о том, что GLED изменяет восприятие боли путем модуляции зрительных цепей, которые воздействуют на нисходящие пути боли20,25. Тем не менее, необходимы дальнейшие исследования, чтобы облегчить его внедрение в клиническое использование.
В этой статье мы подробно описываем комплексную методологию реализации PNM на основе GLED, направленную на обеспечение воспроизводимой основы как для экспериментального, так и для клинического использования. Мы описываем конструкцию и работу GLED-экспонирования, описываем стандартизированные протоколы применения и обсуждаем ключевые соображения для обеспечения эффективности и воспроизводимости. Кроме того, мы предоставляем подробный протокол для оценки активности как восходящих, так и нисходящих болевых путей, что позволяет глубже изучить их роль в модуляции анальгезии, вызванной GLED. Разделяя этот подход, мы стремимся продвигать исследования в области нефармакологического лечения боли и вносить свой вклад в разработку доступных, эффективных и безопасных методов лечения.
протокол
Все процедуры для животных были одобрены Комитетом по уходу за животными и их использованию Университета Аризоны и соответствуют рекомендациям по использованию лабораторных животных Национальных институтов здравоохранения. Взрослых крыс породы Спрэг Доули без патогенов (вес при тестировании: 275-330 г) размещали в стандартных клетках для крыс вивария (по 3 крысы в клетке) в помещениях с климат-контролем в течение 12-часового цикла свет/темнота и разрешали свободный доступ к пище и воде. Все поведенческие эксперименты проводились экспериментаторами, не обращающими внимания на условия лечения. Все процедуры с участием человека получили одобрение Институционального наблюдательного совета (IRB) Университета Аризоны под номером протокола (STUDY00000370). Данное исследование зарегистрировано у ClinicalTrials.gov младше NCT05295225.
1. Протокол воздействия света на животных
- Оптимизация воздействия света и подготовка содержания животных
- Получение гибких лент на светодиодах (LED) видимого спектра со следующими характеристиками: (i) зеленые светодиоды (таблица материалов), длина волны 525 нм, мощность 8 Вт, напряжение 120 В и угол луча 120°. (ii) Белые светодиоды (Таблица материалов), мощность 9,6 Вт, напряжение 120 В и угол луча 120°.
- Обеспечить точность светового спектра с помощью спектрометра (для этого исследования мы воспользовались услугой прототипирования биомедицинских устройств от Института BIO5 Университета Аризоны).
ПРИМЕЧАНИЕ: Зеленый светодиод должен иметь центральную длину волны 525 ± 10 нм (самая яркая точка излучения), полную ширину полумаксимума (FWHM), которая охватывает менее 40 нм, и рекордное падение интенсивности (когда интенсивность света падает до 50% от максимума), которое должно быть на 500 ± 5 нм и 530 ± 5 нм21. Белый светодиод FWHM должен охватывать более 90 нм. Можно использовать несколько источников белого света. Экспериментаторы должны обеспечить низкую интенсивность волны 525 нм и большой диапазон спектра, охватывающий несколько длин волн21. - Используйте люксметр (таблицу материалов) для измерения и оптимизации интенсивности света. При необходимости накройте светодиоды черной лентой (Table of Materials) для получения желаемой интенсивности.
ПРИМЕЧАНИЕ: Крайне важно измерять и проверять интенсивность света, так как различная интенсивность может по-разному влиять на сенсорные пороги (Рисунок 1). Если интенсивность неточна, закройте или откройте некоторые светодиоды до тех пор, пока не будет достигнута желаемая интенсивность. - Закрепите светодиодные ленты на верхних краях проволочных полок в темной комнате (Table of Materials), чтобы убедиться, что каждая полка оснащена специальным источником света. Разместите таймеры (таблицу материалов) на светодиодных лентах, чтобы экспонировать клетки на 8 часов в день с 6 утра до 2 часов дня.
- Установите на полки прозрачные статические клетки. Полностью закройте полки темными листами со всех сторон (Таблица материалов) для оптимизации воздействия и минимизации световых помех.
- Используйте люксметр для окончательной оптимизации интенсивности света внутри клетки, закрыв или обнажив некоторые светодиоды (100 люкс в центре каждой клетки) (дополнительный рисунок 1).
- Фиксация исходного сенсорного поведения и начало воздействия
- По прибытии дайте крысам акклиматизироваться в помещении для животных в течение 1 недели. После этого периода акклиматизации приучайте крыс к работе экспериментатора в течение не менее 7 дней.
- Разделите животных на три экспериментальные группы в зависимости от условий их лечения: (1) воздействие зеленого света (GLED) в сочетании с хирургическим вмешательством, (2) воздействие белого света (WLED) в сочетании с хирургическим вмешательством и (3) контрольная группа WLED с имитацией операции.
- Акклиматизируйте крыс в прозрачных коробках из плексигласа на проволочной сетке (Таблица материалов) за 1 ч до тестирования, в той же комнате, что и испытательная зона, желательно в присутствии экспериментатора.
- Чтобы оценить предоперационные пороги, измерьте пороги отхождения лапы с помощью метода Диксона вверх и вниз с нитями фон Фрея26 на левой задней лапе (Таблица материалов), начиная с нити 4,31 (19,6 мН), чтобы установить исходный порог отведения лапы.
ПРИМЕЧАНИЕ: Механическую чувствительность следует оценивать с помощью метода «вверх-вниз» путем определения порога вывода. Если животное не реагирует на нить 4,31 (19,6 мН), используйте более толстую нить 4,56 (39,2 мН) (реакция визуально отмечается как оттягивание, дрожание или облизывание пораженной лапы). Если животное реагирует на филамент 4,31, используйте более тонкий филамент 4,08 (9,8 мН).- Нанесите каждую нить перпендикулярно подошвенной поверхности задней лапы, в то время как животные находятся в подвешенных клетках из проволочной сетки.
- Отрегулируйте давление нити накала, увеличивая или уменьшая, в зависимости от предыдущего размера нити.
- Продолжайте использовать либо все более толстые, либо более тонкие нити, в зависимости от того, были ли у животного положительные или отрицательные последующие реакции, соответственно.
- Запишите как отрицательные, так и положительные ответы в таблицу данных, приведенную в дополнительной таблице 1.
ПРИМЕЧАНИЕ: Каждая нить накала должна наноситься по одной за раз последовательным образом. После первого положительного ответа протестируйте ту же лапу еще 4 раза разными нитями. Чтобы обеспечить надежные результаты на всех животных, экспериментатор должен избегать нанесения нити на подушечки лап.
- Акклиматизируйте крыс в прозрачных коробках из плексигласа на аппарате Харгривза (Таблица материалов) в течение 1 часа перед испытанием в том же помещении, что и испытательная зона, для измерения базовой тепловой чувствительности с помощью теста Харгривза.
ПРИМЕЧАНИЕ: Тест Харгривза требует, чтобы крысы оставались неподвижными в течение нескольких секунд. Если крысы все еще чрезмерно активны после начального периода привыкания в течение 1 часа, при необходимости продлите время акклиматизации. Убедитесь, что крысы спокойны и неподвижны, но достаточно бдительны, чтобы не заснуть. Перед проведением теста Харгривза (Таблица материалов) крайне важно установить интенсивность инфракрасного света, чтобы установить базовый уровень для измерения болевой чувствительности. Цель состоит в том, чтобы задержка абстиненции составляла в среднем около 20 с для исходного уровня, что обеспечивает достаточную чувствительность для обнаружения изменений в реакции на боль, таких как гипер/гипоалгезия. При отдергивании лапы датчик движения останавливает и стимул, и таймер. Для предотвращения повреждения тканей применяется максимальный порог 33,5 с. - Чтобы оценить предоперационные поведенческие пороги, поместите инфракрасный лазер под центр левой задней лапы животного (используя направляющие линии инфракрасного излучателя).
- Запустите тепловой стимул, чтобы измерить время, необходимое животному для того, чтобы отдернуть лапу в ответ на тепло (латентность оттягивания).
ПРИМЕЧАНИЕ: Если средняя задержка вывода средств не приближается к 20 с, отрегулируйте интенсивность и повторяйте тест до тех пор, пока не будет определено желаемое среднее значение. Затем интенсивность поддерживается постоянной до конца эксперимента. В этом исследовании мы использовали интенсивность стимула 30 (50 Вт). Если тест необходимо повторить, подождите 5-минутные интервалы, прежде чем повторять тест на том же животном. - Запишите задержку вывода средств в таблице, приведенной в дополнительной таблице 2.
ПРИМЕЧАНИЕ: Чтобы не влиять на температуру теплового стимула, очищайте мочу во время испытаний.
- Запустите тепловой стимул, чтобы измерить время, необходимое животному для того, чтобы отдернуть лапу в ответ на тепло (латентность оттягивания).
- После приобретения исходного сенсорного поведения поместите животных в статические клетки для воздействия света с постоянным доступом к пище и воде в течение 4 дней до операции (8 часов в день, с 6 утра до 2 часов дня).
- Индукционная модель боли и послеоперационная оценка сенсорных порогов
- После завершения экспозиции в 14:00 на 4-й день проведите операцию по разрезу по модели Бреннана на левой задней лапе, чтобы вызвать послеоперационную боль 27,28.
- Продолжайте экспозицию на 5 день. После того, как воздействие завершится в 14:00 на 5-й день, проведите тесты фон Фрея и Харгривза, как описано ранее, для оценки термической и механической гиперчувствительности через 1 день после операции.
- Продолжайте экспозицию на 6 день. После того, как экспозиция завершится в 14:00 на 6-й день, проведите тесты фон Фрея и Харгривза, как описано ранее, для оценки термической и механической гиперчувствительности через 2 дня после операции.
ПРИМЕЧАНИЕ: Исключите любое животное из исследования, если оно достигает критериев конечной точки, установленных Комитетом по институциональному уходу за животными и их использованию. - Проведите эвтаназию животных в соответствии с протоколами, изложенными Комитетом по уходу за животными и их использованию после завершения поведенческого тестирования.
- Анализ данных о животных
- Введите шаблоны механического вывода ответов в программное обеспечение Allodynia (National Instruments, LabView 2015) для оценки механических сенсорных порогов29.
ПРИМЕЧАНИЕ: Программное обеспечение использует непараметрический метод Диксона, подробно описанный в Chaplan et al.30. - Сообщайте о задержках вывода в электронной таблице для последующего статистического анализа тепловой аллодинии.
- Сгенерируйте график, отображающий среднюю чувствительность (пороговые значения или задержки) в зависимости от времени.
- Введите шаблоны механического вывода ответов в программное обеспечение Allodynia (National Instruments, LabView 2015) для оценки механических сенсорных порогов29.
2. Протокол воздействия света на человека
- Настройка экспозиционной комнаты для оценки объекта исследования человеком
- Начните с подготовки помещения для экспозиции, убедившись, что в нем полностью отсутствуют какие-либо внешние источники света, чтобы устранить потенциальные помехи.
ПРИМЕЧАНИЕ: Этот шаг необходим для изоляции воздействия светодиодных ламп. - Расположите светодиодные лампы на расстоянии 3-6 футов от стула испытуемых.
ПРИМЕЧАНИЕ: Этот диапазон основан на предыдущих клинических испытаниях для обеспечения постоянной интенсивности света и эффективного воздействия. - Установите светодиодные ленты длиной 2 м, обеспечив желаемый диапазон интенсивности света 90-100 люкс с помощью люксметра (Таблица материалов и дополнительный рисунок 2).
- Оптимизируйте интенсивность света, изменив положение световых полос или закрыв некоторые светодиоды, чтобы объекты получали 90-100 люкс в основной зоне, где они сидят.
- Начните с подготовки помещения для экспозиции, убедившись, что в нем полностью отсутствуют какие-либо внешние источники света, чтобы устранить потенциальные помехи.
- Ознакомительные шаги для проверки оценки механического временного суммирования
- Перед проведением любой оценки убедитесь в надлежащей гигиене рук, тщательно вымыв руки, а затем наденьте перчатки.
- Перед оценкой механической чувствительности очистите и продезинфицируйте откалиброванную нить фон Фрея (6,65 мН, что эквивалентно 300 g силы) для обеспечения стерильности.
- Запросите разрешение на обнажение трапециевидной мышцы для предстоящего обследования.
- Сообщите пациенту, что филамент фон Фрея будет наноситься на недоминантную сторону трапециевидной мышцы до тех пор, пока нить не согнется.
- Попросите пациента оценить свою боль по шкале от 0 до 10, где 0 означает отсутствие боли, а 10 представляет самую сильную боль, которую только можно представить, сразу после того, как оператор скажет «Сейчас».
ПРИМЕЧАНИЕ: Убедитесь, что пациент дает быстрый и точный ответ, когда оператор говорит «сейчас». - Нанесите нить 3 раза в трех разных точках (на расстоянии 1 дюйма друг от друга) на недоминантную трапециевидную мышцу, с интервалом в 5 секунд между каждым применением.
- Сообщите испытуемому, что нить фон Фрея будет наноситься 10 раз в одно и то же место один раз в 1 с, и попросите испытуемого оценить боль от последнего применения.
ПРИМЕЧАНИЕ: Используйте одно и то же место на трапециевидной мышце для всех 10 применений. - Измерьте эффект временного суммирования, приложив нить 10 раз к недоминантной трапеции, и попросите испытуемого оценить боль в конце стимулов.
- Тестирование на механическое временное суммирование
- После ознакомительных шагов сделайте 3-минутный перерыв и сообщите пациенту, что нить фон Фрея будет применена к доминирующей стороне трапециевидной мышцы.
- Очистите и продезинфицируйте откалиброванную нить фон Фрея.
- Проинструктируйте пациента оценить свою боль по шкале от 0 до 10 сразу после того, как оператор скажет «Сейчас».
- Нанесите нить 3 раза в 3 разных точках (на расстоянии 1 дюйма друг от друга) на доминирующую трапециевидную мышцу, с интервалом в 5 секунд между каждым применением. Запишите реакцию пациента на листе регистрации (Дополнительная таблица 3).
- Сообщите испытуемому, что нить фон Фрея будет наноситься 10 раз на одно и то же место один раз в 1 с, и попросите испытуемого оценить боль от последнего применения.
- Измерьте эффект временного суммирования, приложив нить 10 раз к доминирующей трапеции. Запишите ответ испытуемого на листе регистрации (Дополнительная таблица 3).
- Повторите этот процесс два раза с интервалом в 3 минуты и запишите ответы испытуемых на листе регистрации (Дополнительная таблица 3).
- Ознакомительные шаги для оценки условной модуляции боли
- Приготовьте ванну с холодной водой при температуре 12 °C (дополнительный рисунок 3).
ПРИМЕЧАНИЕ: Проверьте температуру перед испытанием с помощью термометра (Таблица материалов). При необходимости приготовьте дополнительный лед, чтобы отрегулировать температуру во время периода тестирования. - Очистите и продезинфицируйте алгометр.
- Используйте программное обеспечение Medoc для оценки CPM (Table of Materials).
- Выберите опцию AlgoMed (дополнительный рисунок 4). На главном экране найдите и нажмите на устройство «Алгометр», чтобы активировать его.
- Выберите нужного пациента из списка и выберите программу тестирования.
- Выберите площадку для применения прибора. Для этого ознакомительного шага выберите недоминантную трапециевидную мышцу на диаграмме тела (дополнительный рисунок 5).
ПРИМЕЧАНИЕ: После нажатия кнопки «Перейти к тесту» вы будете перенаправлены на экран тестирования. Перед применением какого-либо давления программное обеспечение потребует проведения предварительного теста, в котором устройство еще не оказывает давление. Этот предварительный тест должен быть завершен каждый раз при запуске нового теста. - Запустите тест и 5 с таймаута.
- Сообщите пациенту, что устройство измеряет величину приложенного давления, и оно будет использоваться для приложения давления на недоминирующую сторону трапециевидной мышцы. Попросите пациента сказать «стоп», как только он начнет чувствовать боль.
- Нажмите «Начать». Система наложит 5 секунд на ожидание перед началом применения устройства.
- Приложите альгометр к трапеции, увеличивая усилие со скоростью 30 кПа/с (дополнительный рисунок 6).
- Запишите реакцию пациента на листе регистрации (Дополнительная таблица 3).
ПРИМЕЧАНИЕ: Для данного исследования максимальное прикладываемое давление составляет 650 кПа. В этом исследовании конкретно оценивается начало боли, а не толерантность к боли. - Сообщите участникам, что для оценки они будут использовать ванну с ледяной водой.
- Проверьте температуру воды с помощью термометра (Таблица материалов) на отметке около 12 °C. Установите таймер на 10 с.
- Попросите участника погрузить доминирующую руку в воду до запястья, убедившись, что рука расслаблена, а пальцы растопырены.
- Попросите участника оценить свою боль по шкале от 0 до 10, когда оператор скажет «сейчас» к концу 10 с.
- Попросите оценить боль в конце 10 с и запишите реакцию пациента на листе регистрации (Дополнительная таблица 3).
- Приготовьте ванну с холодной водой при температуре 12 °C (дополнительный рисунок 3).
- Тестирование условной модуляции боли
- Проверьте температуру воды с помощью термометра (Таблица материалов).
- Очистите и продезинфицируйте алгометр.
- После 3-минутного перерыва начните оценку условной модуляции боли (CPM), запросив разрешение обнажить доминирующую трапециевидную мышцу для предстоящей оценки.
- Попросите пациента сказать «стоп», как только он начнет чувствовать боль. Нажмите кнопку «Пуск» в программном обеспечении.
- Приложите альгометр к трапеции, увеличивая усилие со скоростью 30 кПа/с, и запишите реакцию пациента на листе регистрации (дополнительная таблица 3).
- Повторите применение еще 2 раза на разных участках доминантной трапециевидной мышцы, с интервалом в 3 минуты между каждым.
- Убедитесь, что алгометр тщательно очищен и продезинфицирован перед каждым применением, чтобы предотвратить скольжение, вызванное накоплением кожного жира от предметов.
- Запишите реакцию пациента на листе регистрации (Дополнительная таблица 3). Подождите 5 минут, прежде чем переходить к условному стимульному тестированию.
- Нажмите «Начать». Система наложит 5 секунд на ожидание перед началом применения устройства.
- Очистите и продезинфицируйте алгометр.
- Проинструктируйте пациента погрузить недоминантную руку до запястья в ванну с ледяной водой.
- Приложите альгометр к трапеции, увеличивая усилие со скоростью 30 кПа/с, и запишите реакцию пациента на листе регистрации (дополнительная таблица 3).
- Повторите применение еще два раза на разных участках трапециевидной мышцы, с интервалом в 5 минут между каждым.
Примечание: Прекратите исследование, если после первоначального скрининга выявлено ранее не обнаруженное заболевание, особенно если это состояние потенциально может помешать исследованию. - После получения исходных предэкспозиционных значений начните подвергать пациента воздействию назначенных ему световых условий.
- Проинструктируйте добровольцев не смотреть прямо на источник света.
ПРИМЕЧАНИЕ: Вместо этого они должны позволить свету проникать в их периферийное зрение, как если бы они использовали любой источник окружающего света в своем доме (дополнительный рисунок 7). - Подвергайте объекты воздействию светодиодного света в течение 1,5 часов.
ПРИМЕЧАНИЕ: При длительном лечении светом субъекты самостоятельно подвергают воздействию света дома в течение 10 недель. Для мониторинга эффектов лечения с течением времени можно использовать такие опросники, как Опросник влияния фибромиалгии (FIQ), HIT-6 (Тест на влияние головной боли), PSQI (Питтсбургский индекс качества сна) и EQ-5D-5L (для оценки общего состояния здоровья), наряду с опросниками боли. - Во время экспозиции поощряйте добровольцев заниматься деятельностью, не требующей дополнительных источников света, например, чтением или письмом.
ПРИМЕЧАНИЕ: Интенсивность 4-100 люкс обеспечивает достаточную освещенность. - Не поощряйте сон в период контакта, чтобы обеспечить полное соблюдение протокола.
- После светоэкспозиционной терапии повторите все измерения, выполненные на исходном уровне.
- Анализ данных о человеке
- Для механического временного суммирования рассчитайте среднее значение 3 исходных измерений и среднее значение 3 повторяющихся стимулов.
- Рассчитайте процент механического временного суммирования, разделив среднюю оценку боли после повторяющихся стимулов на среднюю исходную оценку боли и умножив результат на 100, чтобы выразить его в процентах.
ПРИМЕЧАНИЕ: Процент более 100% указывает на увеличение восприятия боли при повторных стимулах, что предполагает наличие временного суммирования. - Для механической условной модуляции боли (CPM) рассчитайте среднее из последних 2 базовых болевых порогов (в кПа), полученных при безусловных раздражителях (без холодной ванны).
- Рассчитайте среднее из последних 2 значений болевого порога (в кПа) во время обусловливающего стимула.
- Используйте следующее уравнение для расчета CPM:
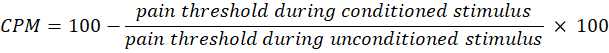
ПРИМЕЧАНИЕ: Значение CPM, равное 0, указывает на отсутствие изменений в восприятии боли, отрицательное значение указывает на сенсорное торможение боли во время условного стимула, а положительное значение указывает на облегчение боли во время условного стимула. - Оцените изменения как во временном суммировании, так и в CPM до и после воздействия света, чтобы оценить, как терапия влияет на активность восходящих и нисходящих болевых путей соответственно.
Результаты
Воздействие зеленого света увеличивает задержку отведения лапы дозозависимым образом
На рисунке 1A показано, что воздействие зеленых светоизлучающих диодов (GLED) различной интенсивности (4, 50, 100 и 200 люкс) значительно увелич...
Обсуждение
В недавних исследованиях были изучены механизмы, лежащие в основе анальгезии зеленым светом (GLED) 13,21,22,23,24. Тем не менее, необходима дальнейшая стандартизация методологии для улуч?...
Раскрытие информации
Доктор Ибрагим сообщил о внешнем интересе к Luxxon Therapeutics Университету Аризоны. Конфликты интересов, возникающие в результате этой заинтересованности, регулируются Университетом Аризоны в соответствии с его политикой. У всех остальных авторов нет конфликта интересов. Ни один из авторов рукописи не получил никакого вознаграждения, компенсации или гонорара каким-либо иным образом. Авторы не связаны с какими-либо поставщиками или фармацевтическими компаниями, связанными с этим исследованием. Ни одно из этих исследований, рукописей или рефератов ранее не было представлено и не рассматривается для публикации в каком-либо другом журнале.
Благодарности
Это исследование было поддержано Комплексным центром боли и зависимости Университета Аризоны (M.M.I., L.F.M.), Отделением анестезиологии Университета Аризоны (L.F.M.) и Программой подготовки ученых-медиков (MSTP) в Университете Аризоны, Медицинский колледж, Тусон.
Материалы
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Ссылки
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены