È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ottimizzazione delle tecniche di fotoneuromodulazione per valutare il ruolo dei diodi emettitori di luce verde nella gestione del dolore
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I recenti sviluppi nella ricerca sul dolore evidenziano il potenziale della fotoneuromodulazione utilizzando diodi emettitori di luce verde (GLED) come trattamento non farmacologico. GLED modula le vie del dolore, offrendo un efficace sollievo dal dolore. Questo articolo mira a standardizzare e perfezionare i protocolli di esposizione GLED, migliorando la coerenza tra gli studi e facendo progredire l'applicazione clinica di questa terapia.
Abstract
Nonostante l'ampia ricerca e l'identificazione di numerosi bersagli analgesici, la gamma di trattamenti farmacologici disponibili per il dolore rimane limitata. Tuttavia, un potenziale cambiamento di paradigma potrebbe introdurre una nuova ondata di trattamenti del dolore non farmacologici con notevole sicurezza, efficacia e tollerabilità. Un'area di ricerca promettente è la fotoneuromodulazione mediante diodi emettitori di luce verde (GLED, 525 nm), che hanno dimostrato il potenziale nell'alleviare il dolore sia in condizioni acute che croniche, portando a numerosi studi preclinici e clinici che esplorano l'efficacia di questa terapia. Questi progetti di ricerca hanno dimostrato come l'esposizione a GLED migliori l'attività del sistema oppioide endogeno nel cervello e nel midollo spinale dopo l'attivazione del cono M nella retina. I risultati suggeriscono che GLED può alleviare il dolore modulando la via discendente del dolore. Alla luce degli effetti convincenti della GLED, la proliferazione delle indagini di fotoneuromodulazione sottolinea l'importanza di stabilire la coerenza in protocolli di esposizione ben definiti e standardizzati per gli studi preclinici e clinici. Negli studi preclinici, sono stati osservati effetti benefici dopo un minimo di 2 giorni di esposizione, con protocolli che prevedevano 8 ore di luce a 100 lux durante la fase di luce di 12 ore. Negli studi clinici, i protocolli di esposizione sono adattati alla specifica patologia in esame. L'esposizione per 15 minuti si è dimostrata favorevole nella modulazione del dolore acuto post-chirurgico. Per la modulazione del dolore cronico, i pazienti vengono istruiti a utilizzare GLED a casa per 1 o 2 ore al giorno per 10 settimane. Questo articolo descrive in dettaglio i protocolli preclinici e clinici per migliorare la riproducibilità e la coerenza nei diversi studi che valutano i benefici della fotoneuromodulazione. Stabilendo questi protocolli standardizzati, questo lavoro mira a far progredire la traduzione clinica della fototerapia GLED come trattamento non farmacologico praticabile per il dolore.
Introduzione
I trattamenti farmacologici, in particolare gli oppioidi, continuano a essere fortemente utilizzati per la gestione delle condizioni di dolore acuto e cronico1. L'efficacia della gestione del dolore può essere influenzata in modo significativo dalla frequenza e dalla gravità degli effetti collaterali associati all'uso di oppioidi2. Per questo motivo, un numero considerevole di pazienti in trattamento con oppioidi non raggiunge una gestione efficace del dolore3. Pertanto, i medici del dolore e la comunità dei pazienti sono sempre più alla ricerca di trattamenti non farmacologici che evitino gli effetti collaterali associati ai farmaci antidolorifici tradizionali. La fotoneuromodulazione è emersa come una soluzione promettente e una terapia sicura per la gestione del dolore.
La fotoneuromodulazione (PNM) è una tecnica non invasiva che utilizza diodi emettitori di luce (LED) per regolare i processi biologici4. La fototerapia è stata istituita migliaia di anni fa utilizzando la luce solare, o elioterapia, per trattare le condizioni della pelle5. Successivamente, il concetto di luce che influenza i tessuti biologici si è ampliato, portando allo sviluppo del termine fotoneuromodulazione. La ricerca PNM si sta espandendo in tutto il mondo e ha dimostrato la sua efficacia in una varietà di applicazioni cliniche, tra cui la gestione del dolore 6,7,8,9, il miglioramento della qualità del sonno nei pazienti con malattia di Alzheimer 10 e il controllo della depressione11.
C'è una crescente enfasi sulla ricerca preclinica e sugli studi clinici volti a studiare i meccanismi e il potenziale terapeutico della fotoneuromodulazione per la gestione del dolore. Tra questi approcci, la terapia a diodi a emissione di luce verde (GLED), che utilizza una stimolazione a lunghezza d'onda di 525 nm, ha dimostrato un'efficacia promettente nel ridurre vari tipi di dolore, tra cui emicrania, fibromialgia e dolore post-chirurgico 12,13,14,15,16. Gli studi clinici hanno dimostrato che la terapia con luce verde avvantaggia costantemente i pazienti che soffrono di emicrania in diversi studi 12,17,18, riducendo sia il dolore del mal di testa che l'intensità della fotofobia durante gli attacchi di emicrania attiva 19, oltre a diminuire la frequenza e la durata degli episodi di emicrania12. Studi preclinici hanno anche dimostrato che l'esposizione a GLED può invertire l'ipersensibilità termica e meccanica in un modello di lesione nervosa del dolore neuropatico20. Inoltre, studi preclinici hanno esplorato i meccanismi attraverso i quali GLED influenza la percezione del dolore e le soglie sensoriali 13,21,22,23,24. Questi studi evidenziano il coinvolgimento dei coni M e la successiva modulazione del nucleo genicolato laterale ventrale (vLGN), che aumenta l'attività dei neuroni encefalinergici proiettati al nucleo del rafe dorsale (DRN)22. Ulteriori ricerche hanno anche sottolineato il ruolo critico del midollo ventromediale rostrale (RVM)21, un regolatore chiave della modulazione del dolore discendente. Collettivamente, questi risultati suggeriscono che GLED altera la percezione del dolore modulando i circuiti visivi che agiscono sulle vie discendenti del dolore20,25. Tuttavia, sono necessarie ulteriori ricerche per facilitarne la traduzione nell'uso clinico.
In questo articolo, descriviamo in dettaglio una metodologia completa per l'implementazione della PNM basata su GLED, con l'obiettivo di fornire un quadro riproducibile sia per l'uso sperimentale che clinico. Descriviamo la progettazione e il funzionamento dell'esposizione GLED, delineiamo protocolli applicativi standardizzati e discutiamo le considerazioni chiave per garantire l'efficacia e la riproducibilità. Inoltre, forniamo un protocollo dettagliato per valutare l'attività delle vie del dolore sia ascendenti che discendenti, consentendo un'indagine più approfondita sul loro ruolo nella modulazione dell'analgesia indotta da GLED. Condividendo questo approccio, miriamo a far progredire la ricerca nella gestione non farmacologica del dolore e a contribuire allo sviluppo di terapie accessibili, efficaci e più sicure.
Protocollo
Tutte le procedure sugli animali sono state approvate dall'Institutional Animal Care and Use Committee dell'Università dell'Arizona e sono conformi alle linee guida per l'utilizzo di animali da laboratorio del National Institutes of Health. I ratti Sprague Dawley adulti privi di agenti patogeni (peso al test: 275-330 g) sono stati alloggiati in gabbie per ratti standard (3 ratti per gabbia) in stanze climatizzate con un ciclo luce/buio di 12 ore e hanno avuto accesso a cibo e acqua. Tutti gli esperimenti comportamentali sono stati condotti da sperimentatori all'oscuro delle condizioni di trattamento. Tutte le procedure umane hanno ricevuto l'approvazione dall'Institutional Review Board (IRB) dell'Università dell'Arizona con il numero di protocollo (STUDY00000370). Questo studio è registrato presso ClinicalTrials.gov sotto NCT05295225.
1. Protocollo di esposizione alla luce negli animali
- Ottimizzazione dell'esposizione alla luce e preparazione della stabulazione degli animali
- Ottenere strisce flessibili a diodi emettitori di luce (LED) a spettro visibile con le seguenti caratteristiche: (i) LED verdi (Tabella dei materiali), lunghezza d'onda di 525 nm, potenza di 8 W, tensione di 120 V e angolo del fascio di 120°. (ii) LED bianchi (Tabella dei materiali), potenza di 9,6 W, tensione di 120 V e angolo del fascio di 120°.
- Garantire l'accuratezza dello spettro luminoso con uno spettrometro (per questo studio, abbiamo utilizzato il servizio di prototipazione di dispositivi biomedici dell'Istituto BIO5 dell'Università dell'Arizona).
NOTA: Il LED verde dovrebbe avere una lunghezza d'onda centrale di 525 ± 10 nm (il punto di emissione più luminoso), un FWHM (Full-Width Half Maximum) che si estende meno di 40 nm e una caduta di intensità record (in cui l'intensità della luce scende al 50% del massimo) che dovrebbe essere compresa tra 500 ± 5 nm e 530 ± 5 nm21. Il LED bianco FWHM dovrebbe estendersi per più di 90 nm. È possibile utilizzare più fonti di luce bianca. Gli sperimentatori devono garantire la bassa intensità della lunghezza d'onda di 525 nm e un'ampia estensione dello spettro, che copra più lunghezze d'onda21. - Utilizzare un luxmetro (Tabella dei materiali) per misurare e ottimizzare l'intensità della luce. Coprire i LED con nastro adesivo nero (Tabella dei materiali) secondo necessità per ottenere l'intensità desiderata.
NOTA: È fondamentale misurare e convalidare l'intensità della luce, poiché intensità diverse possono influenzare le soglie sensoriali in modi diversi (Figura 1). Se l'intensità non è accurata, coprire o scoprire alcuni LED fino a raggiungere l'intensità desiderata. - Fissare le strisce LED ai bordi superiori dei ripiani in filo metallico in una stanza buia (Tabella dei materiali) per assicurarsi che ogni ripiano sia dotato di una fonte di esposizione alla luce dedicata. Posizionare dei timer (Tabella dei materiali) sulle strisce LED per esporre le gabbie per 8 ore al giorno dalle 6 alle 14.
- Installare gabbie statiche trasparenti sugli scaffali. Racchiudere completamente i ripiani con fogli scuri su tutti i lati (Tabella dei materiali) per ottimizzare l'esposizione riducendo al minimo l'interferenza della luce.
- Utilizzare un luxmetro per ottenere l'ottimizzazione finale dell'intensità luminosa all'interno della gabbia coprendo o scoprendo alcuni dei LED (100 lux al centro di ogni gabbia) (Figura supplementare 1).
- Ottenimento del comportamento sensoriale di base e inizio dell'esposizione
- All'arrivo, lascia che i ratti si acclimatino alla struttura per animali per 1 settimana. Dopo questo periodo di acclimatazione, abituare i ratti alla manipolazione dello sperimentatore per almeno 7 giorni.
- Classificare gli animali in tre gruppi sperimentali in base alle loro condizioni di trattamento: (1) esposizione alla luce verde (GLED) combinata con l'intervento chirurgico, (2) esposizione alla luce bianca (WLED) combinata con l'intervento chirurgico e (3) gruppo di controllo WLED con chirurgia fittizia.
- Acclimatare i ratti in scatole di plexiglass trasparente su una rete metallica (Tabella dei materiali) per 1 ora prima del test, nella stessa stanza dell'area di test, con lo sperimentatore preferibilmente presente.
- Per valutare le soglie preoperatorie, misurare le soglie di ritiro della zampa utilizzando il metodo Dixon su e giù con i filamenti di von Frey26 sulla zampa posteriore sinistra (Tabella dei materiali), iniziando con il filamento 4,31 (19,6 mN) per stabilire la soglia di ritiro della zampa di base.
NOTA: La sensibilità meccanica deve essere valutata utilizzando il metodo "su e giù" determinando la soglia di prelievo. Se l'animale non risponde al filamento 4,31 (19,6 mN), utilizzare il filamento 4,56 più spesso (39,2 mN) (una risposta si nota visivamente come ritiro, scuotimento o leccamento della zampa interessata). Se l'animale risponde al filamento 4.31, utilizzare il filamento 4.08 (9.8 mN) più sottile.- Applicare ogni filamento perpendicolarmente alla superficie plantare della zampa posteriore mentre gli animali sono posizionati in gabbie di rete metallica sospese.
- Regola la pressione del filamento, aumentando o diminuendo, in base alla dimensione del filamento precedente.
- Continuare a utilizzare filamenti progressivamente più spessi o più sottili, a seconda che l'animale abbia avuto risposte successive positive o negative, rispettivamente.
- Registrare sia le risposte negative che quelle positive sulla scheda tecnica fornita nella Tabella supplementare 1.
NOTA: Ogni filamento deve essere applicato uno alla volta in modo sequenziale. Dopo la prima risposta positiva, testare la stessa zampa altre 4 volte con filamenti diversi. Per garantire risultati affidabili su tutti gli animali, lo sperimentatore deve evitare di applicare il filamento ai poggiapiedi.
- Acclimatare i ratti in scatole di plexiglass trasparente sull'apparecchio di Hargreaves (Tabella dei materiali) per 1 ora prima del test nella stessa stanza dell'area di prova per misurare la sensibilità termica di base utilizzando il test di Hargreaves.
NOTA: Il test di Hargreaves richiede che i ratti rimangano fermi per alcuni secondi. Se i ratti sono ancora eccessivamente attivi dopo il periodo iniziale di assuefazione di 1 ora, prolungare il tempo di acclimatazione secondo necessità. Assicurati che i ratti siano calmi e fermi, ma abbastanza vigili da evitare di addormentarsi. Prima di eseguire il test di Hargreaves (Tabella dei materiali), è fondamentale impostare l'intensità della luce infrarossa per stabilire una linea di base per misurare la sensibilità al dolore. L'obiettivo è che la latenza di astinenza sia in media di circa 20 s per il basale, il che fornisce una sensibilità sufficiente per rilevare i cambiamenti nella risposta al dolore, come l'iper/ipoalgesia. Al momento del ritiro della zampa, un rilevatore di movimento interrompe sia lo stimolo che il timer. Per prevenire danni ai tessuti, viene applicato un cutoff massimo di 33,5 s. - Per valutare le soglie comportamentali preoperatorie, posizionare il laser a infrarossi sotto il centro della zampa posteriore sinistra dell'animale (utilizzando le linee guida dell'emettitore a infrarossi).
- Avvia lo stimolo termico per misurare il tempo impiegato dall'animale per ritirare la zampa in risposta al calore (latenza di ritiro).
NOTA: Se la latenza media di prelievo non è vicina a 20 s, regolare l'intensità e ripetere il test fino a determinare la media desiderata. L'intensità viene quindi mantenuta costante per il resto dell'esperimento. In questo studio, abbiamo utilizzato un'intensità di stimolo di 30 (50 W). Se il test deve essere ripetuto, attendere intervalli di 5 minuti prima di ripetere il test sullo stesso animale. - Registrare la latenza di prelievo sulla scheda tecnica fornita nella Tabella supplementare 2.
NOTA: Per evitare di influenzare la temperatura dello stimolo termico, pulire l'urina durante le prove.
- Avvia lo stimolo termico per misurare il tempo impiegato dall'animale per ritirare la zampa in risposta al calore (latenza di ritiro).
- Dopo l'acquisizione dei comportamenti sensoriali di base, alloggiare gli animali in gabbie statiche per l'esposizione alla luce con accesso continuo a cibo e acqua per 4 giorni prima dell'intervento (8 ore al giorno, dalle 6 alle 14).
- Induzione del modello del dolore e valutazione post-chirurgica delle soglie sensoriali
- Dopo che l'esposizione si è conclusa alle 14:00 del giorno 4, eseguire un intervento chirurgico di incisione seguendo il modello di Brennan sulla zampa posteriore sinistra per indurre dolore postoperatorio27,28.
- Continuare l'esposizione il giorno 5. Dopo che l'esposizione si è conclusa alle 14:00 del 5° giorno, eseguire i test di von Frey e Hargreaves, come descritto in precedenza, per valutare l'ipersensibilità termica e meccanica 1 giorno dopo l'intervento.
- Continuare l'esposizione il giorno 6. Dopo che l'esposizione si è conclusa alle 14:00 del giorno 6, condurre i test di von Frey e Hargreaves, come descritto in precedenza, per valutare l'ipersensibilità termica e meccanica 2 giorni dopo l'intervento.
NOTA: Escludere qualsiasi animale dallo studio se raggiunge i criteri di endpoint stabiliti dal Comitato istituzionale per la cura e l'uso degli animali. - Eseguire l'eutanasia sugli animali seguendo i protocolli delineati dal Comitato Istituzionale per la Cura e l'Uso degli Animali dopo aver completato i test comportamentali.
- Analisi dei dati degli animali
- Inserire i modelli di ritiro meccanico delle risposte nel software Allodynia (National Instruments, LabView 2015) per valutare le soglie sensoriali meccaniche29.
NOTA: Il software utilizza il metodo Dixon non parametrico, come descritto da Chaplan et al.30. - Riportare le latenze di prelievo in un foglio di calcolo per la successiva analisi statistica dell'allodinia termica.
- Genera un grafico che mostra la sensibilità media (soglie o latenze) in funzione del tempo.
- Inserire i modelli di ritiro meccanico delle risposte nel software Allodynia (National Instruments, LabView 2015) per valutare le soglie sensoriali meccaniche29.
2. Protocollo di esposizione alla luce nell'uomo
- Allestimento della sala di esposizione per la valutazione dei soggetti umani
- Inizia con la preparazione della stanza di esposizione, assicurandoti che sia completamente priva di fonti di luce esterne per eliminare potenziali interferenze.
NOTA: Questo passaggio è essenziale per isolare gli effetti delle luci a LED. - Posizionare le luci a LED a una distanza di 3-6 piedi dalla sedia dei soggetti.
NOTA: Questo intervallo si basa su precedenti studi clinici per garantire un'intensità luminosa costante e un'esposizione efficace. - Installare le strisce LED da 2 m, garantendo l'intervallo di intensità luminosa desiderato di 90-100 lux utilizzando un luxmetro (Tabella dei materiali e Figura supplementare 2).
- Ottimizza l'intensità della luce riposizionando le strisce luminose o coprendo alcuni dei LED, assicurandoti che i soggetti ricevano 90-100 lux nell'area primaria in cui sono seduti.
- Inizia con la preparazione della stanza di esposizione, assicurandoti che sia completamente priva di fonti di luce esterne per eliminare potenziali interferenze.
- Passaggi di familiarizzazione per il test della valutazione meccanica della sommatoria temporale
- Prima di effettuare qualsiasi valutazione, assicurarsi di una corretta igiene delle mani lavandosi accuratamente le mani, quindi indossando i guanti.
- Pulire e igienizzare il filamento von Frey calibrato (6,65 mN, equivalente a 300 g di forza) per garantire la sterilità prima di valutare la sensibilità meccanica.
- Richiedi l'autorizzazione a esporre il muscolo trapezio per la valutazione imminente.
- Informare il paziente che il filamento di von Frey verrà applicato sul lato non dominante del muscolo trapezio fino a quando il filamento non si piega.
- Istruire il paziente a valutare il proprio dolore su una scala da 0 a 10, dove 0 rappresenta nessun dolore e 10 rappresenta il peggior dolore immaginabile immediatamente dopo che l'operatore ha detto "Ora".
NOTA: Assicurarsi che il paziente fornisca una risposta rapida e accurata quando l'operatore dice "ora". - Applicare il filamento 3 volte in tre punti diversi (a 1 pollice di distanza) sul muscolo trapezio non dominante, lasciando un intervallo di 5 s tra ogni applicazione.
- Informare il soggetto che il filamento von Frey verrà applicato 10 volte sullo stesso punto una volta ogni 1 s e chiedere al soggetto di valutare il dolore dell'ultima applicazione.
NOTA: Utilizzare lo stesso punto sul muscolo trapezio per tutte e 10 le applicazioni. - Misurare l'effetto della sommatoria temporale applicando il filamento 10 volte sul trapezio non dominante e chiedere al soggetto di valutare il dolore alla fine degli stimoli.
- Prove per la sommatoria temporale meccanica
- Dopo le fasi di familiarizzazione, consentire una pausa di 3 minuti e informare il paziente che il filamento di von Frey verrà applicato sul lato dominante del muscolo trapezio.
- Pulire e igienizzare il filamento von Frey calibrato.
- Istruire il paziente a valutare il proprio dolore su una scala da 0 a 10 subito dopo che l'operatore ha detto "Ora".
- Applicare il filamento 3 volte in 3 punti diversi (a 1 pollice di distanza) sul muscolo trapezio dominante, lasciando un intervallo di 5 secondi tra ogni applicazione. Registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3).
- Informare il soggetto che il filamento von Frey verrà applicato 10 volte sullo stesso punto una volta ogni 1 s e chiedere al soggetto di valutare il dolore dell'ultima applicazione.
- Misurare l'effetto della somma temporale applicando il filamento 10 volte sul trapezio dominante. Registrare la risposta del soggetto sul foglio di registrazione (Tabella supplementare 3).
- Ripetere il processo due volte a intervalli di 3 minuti e registrare le risposte dei soggetti sul foglio di registrazione (Tabella supplementare 3).
- Fasi di familiarizzazione per la valutazione della modulazione del dolore condizionato
- Preparare un bagno di acqua fredda a 12 °C (Figura supplementare 3).
NOTA: Verificare la temperatura prima del test utilizzando il termometro (Tabella dei materiali). Se necessario, avere del ghiaccio extra per regolare la temperatura durante il periodo di test. - Pulisci e igienizza l'algometro.
- Utilizzare il software Medoc per la valutazione del CPM (Table of Materials).
- Selezionare l'opzione AlgoMed (Figura 4 supplementare). Nella schermata principale, trova e fai clic sul dispositivo algometro per attivarlo.
- Seleziona il paziente corretto dall'elenco e scegli il programma di test.
- Selezionare il sito per l'applicazione del dispositivo. Per questa fase di familiarizzazione, scegli il muscolo trapezio non dominante dal diagramma corporeo (Figura supplementare 5).
NOTA: Dopo aver fatto clic su vai al test, si verrà indirizzati alla schermata di test. Prima di applicare qualsiasi pressione, il software richiederà di eseguire un pretest, in cui il dispositivo non sta ancora applicando pressione. Questo test preliminare deve essere completato ogni volta che viene avviato un nuovo test. - Avvia un test e timeout di 5 secondi.
- Informare il paziente che il dispositivo misura la quantità di pressione applicata e verrà utilizzato per applicare pressione sul lato non dominante del muscolo trapezio. Chiedi al paziente di dire "stop" non appena inizia a sentire dolore.
- Fare clic su Start. Il sistema imporrà un'attesa di 5 s prima di iniziare ad applicare il dispositivo.
- Applicare l'algometro sul trapezio aumentando la forza a una velocità di 30 kPa/s (Figura 6 supplementare).
- Registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3).
NOTA: Per questo studio, la pressione massima applicata è di 650 kPa. Questo studio valuta specificamente l'insorgenza del dolore, non valuta la tolleranza al dolore. - Informare i partecipanti che utilizzeranno un bagno di acqua ghiacciata per la valutazione.
- Controllare che la temperatura dell'acqua sia di circa 12 °C utilizzando il termometro (Tabella dei materiali). Imposta un timer per 10 s.
- Chiedi al partecipante di immergere la mano dominante nell'acqua fino al polso, assicurandoti che la mano sia rilassata e che le dita siano divaricate.
- Chiedi al partecipante di valutare il proprio dolore su una scala da 0 a 10 quando l'operatore dice "ora" entro la fine di 10 s.
- Chiedere la valutazione del dolore al termine dei 10 s e registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3).
- Preparare un bagno di acqua fredda a 12 °C (Figura supplementare 3).
- Test della modulazione del dolore condizionato
- Controllare la temperatura dell'acqua utilizzando il termometro (Tabella dei materiali).
- Pulisci e igienizza l'algometro.
- Dopo una pausa di 3 minuti, iniziare la valutazione della modulazione del dolore condizionato (CPM) richiedendo il permesso di esporre il muscolo trapezio dominante per la valutazione imminente.
- Chiedi al paziente di dire "stop" non appena inizia a sentire dolore. Fare clic su Avvia sul software.
- Applicare l'algometro sul trapezio aumentando la forza ad una velocità di 30 kPa/s e registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3).
- Ripetere l'applicazione altre 2 volte su diversi siti del muscolo trapezio dominante, con un intervallo di 3 minuti tra ciascuno.
- Assicurarsi che l'algometro sia accuratamente pulito e igienizzato prima di ogni applicazione per evitare scivolamenti causati dall'accumulo di oli cutanei dai soggetti.
- Registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3). Attendere 5 minuti prima di passare al test dello stimolo condizionato.
- Fare clic su Start. Il sistema imporrà un'attesa di 5 s prima di iniziare ad applicare il dispositivo.
- Pulisci e igienizza l'algometro.
- Istruire il paziente a immergere la mano non dominante fino al polso nel bagno di acqua ghiacciata.
- Applicare l'algometro sul trapezio aumentando la forza ad una velocità di 30 kPa/s e registrare la risposta del paziente sul foglio di registrazione (Tabella supplementare 3).
- Ripetere l'applicazione altre due volte su diversi siti del muscolo trapezio, con un intervallo di 5 minuti tra ciascuno.
NOTA: Interrompere lo studio se dopo lo screening iniziale viene identificata una condizione medica precedentemente non scoperta, in particolare se la condizione ha il potenziale per interferire con lo studio. - Dopo l'acquisizione dei valori basali di pre-esposizione, iniziare a esporre il paziente alla condizione di luce assegnatagli.
- Istruisci i volontari a evitare di fissare direttamente la fonte di luce.
NOTA: Invece, dovrebbero consentire alla luce di entrare nella loro visione periferica come farebbero con qualsiasi fonte di luce ambientale nella loro casa (Figura 7 supplementare). - Esporre i soggetti alla luce LED per 1,5 ore.
NOTA: Per un trattamento con luce prolungato, i soggetti si autosomministrano l'esposizione a casa per un massimo di 10 settimane. Indagini, come il Fibromyalgia Impact Questionnaire (FIQ), l'HIT-6 (Headache Impact Test), il PSQI (Pittsburgh Sleep Quality Index) e l'EQ-5D-5L (per valutare la salute generale), insieme ai questionari sul dolore, possono essere utilizzati per monitorare gli effetti del trattamento nel tempo. - Durante l'esposizione, incoraggia i volontari a impegnarsi in attività che non richiedono fonti di luce aggiuntive, come leggere o scrivere.
NOTA: Intensità di 4-100 lux forniscono un'illuminazione sufficiente. - Scoraggiare il sonno durante il periodo di esposizione per garantire la piena aderenza al protocollo.
- Dopo la terapia di esposizione alla luce, ripetere tutte le misurazioni completate al basale.
- Analisi dei dati umani
- Per la sommatoria temporale meccanica, calcolare la media delle 3 misure di base e la media dei 3 stimoli ripetuti.
- Calcola la percentuale di sommatoria temporale meccanica dividendo la valutazione media del dolore dopo gli stimoli ripetitivi per la valutazione media del dolore al basale e moltiplicando il risultato per 100 per esprimerlo in percentuale.
NOTA: Una percentuale superiore al 100% indica un aumento della percezione del dolore con stimoli ripetuti, suggerendo la presenza di sommatoria temporale. - Per la modulazione meccanica del dolore condizionato (CPM), calcolare la media delle ultime 2 soglie del dolore al basale (in kPa) ottenute durante gli stimoli incondizionati (senza bagno freddo).
- Calcolare la media degli ultimi 2 valori di soglia del dolore (in kPa) durante lo stimolo di condizionamento.
- Usa la seguente equazione per calcolare il CPM:
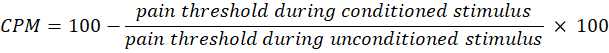
NOTA: Un valore CPM pari a 0 indica che non c'è alcun cambiamento nella percezione del dolore, un valore negativo indica l'inibizione sensoriale del dolore durante lo stimolo condizionato e un valore positivo indica la facilitazione del dolore durante lo stimolo condizionato. - Valutare i cambiamenti sia nella sommatoria temporale che nel CPM prima e dopo l'esposizione alla luce per valutare come la terapia influisce rispettivamente sull'attività delle vie del dolore ascendente e discendente.
Risultati
L'esposizione alla luce verde aumenta le latenze di astinenza della zampa in modo dose-dipendente
La Figura 1A dimostra che l'esposizione a diodi emettitori di luce verde (GLED) a varie intensità (4, 50, 100 e 200 lux) ha aumentato significativamente le latenze di ritiro delle zampe in un modello di ratto naïve per un periodo di esposizione di 7 giorni, indicando un effetto antinocicettivo del GLED. Le ...
Discussione
Studi recenti hanno esplorato i meccanismi alla base dell'analgesia con luce verde (GLED) 13,21,22,23,24. Tuttavia, è necessaria un'ulteriore standardizzazione della metodologia per migliorarne la traduzione nella pratica clinica. Gli effetti antinocicettivi dose-dipendenti osservati nei modelli preclinici evidenziano l'impor...
Divulgazioni
Il Dr. Ibrahim ha rivelato un interesse esterno per Luxxon Therapeutics all'Università dell'Arizona. I conflitti di interesse derivanti da questo interesse sono gestiti dall'Università dell'Arizona in conformità con le sue politiche. Tutti gli altri autori non hanno conflitti di interesse da segnalare. Nessuno degli autori del manoscritto ha ricevuto alcuna remunerazione, rimborso o onorario in alcun altro modo. Gli autori non sono affiliati ad alcun fornitore o azienda farmaceutica associata a questo studio. Nessuna di queste ricerche, manoscritti o abstract è stato presentato in precedenza e non è stato preso in considerazione per la pubblicazione da nessun'altra rivista.
Riconoscimenti
Questa ricerca è stata supportata dal Comprehensive Center for Pain and Addiction-University of Arizona (M.M.I., L.F.M.), dal Dipartimento di Anestesiologia dell'Università dell'Arizona (LFM) e dal Medical Scientist Training Program (MSTP) presso l'Università dell'Arizona, College of Medicine, Tucson.
Materiali
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
Riferimenti
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon