JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
통증 관리에서 녹색 발광 다이오드의 역할을 평가하기 위한 광신경조절 기법 최적화
* 이 저자들은 동등하게 기여했습니다
요약
최근 통증 연구의 발전은 녹색 발광 다이오드(GLED)를 비약물적 치료법으로 사용하는 광신경조절의 잠재력을 강조합니다. GLED는 통증 경로를 조절하여 효과적인 통증 완화를 제공합니다. 이 논문은 GLED 노출 프로토콜을 표준화 및 개선하여 연구 전반에 걸쳐 일관성을 개선하고 이 요법의 임상 적용을 발전시키는 것을 목표로 합니다.
초록
광범위한 연구와 수많은 진통제 표적의 확인에도 불구하고 통증에 사용할 수 있는 약물 치료의 범위는 여전히 제한적입니다. 그러나 잠재적인 패러다임 전환은 놀라운 안전성, 효능 및 내약성을 갖춘 비약물적 통증 치료의 새로운 물결을 도입할 수 있습니다. 한 가지 유망한 연구 분야는 녹색 발광 다이오드(GLED, 525nm)를 사용한 광신경조절법으로, 이는 급성 및 만성 질환 모두에서 통증을 완화할 수 있는 잠재력을 보여주었으며, 이 요법의 효능을 탐구하는 수많은 전임상 및 임상 연구로 이어졌습니다. 이러한 연구 프로젝트는 GLED에 대한 노출이 망막에서 M-원뿔이 활성화된 후 뇌와 척수에서 내인성 오피오이드 시스템의 활동을 향상시키는 방법을 보여주었습니다. 연구 결과는 GLED가 하행 통증 경로를 조절하여 통증을 완화할 수 있음을 시사합니다. GLED의 강력한 효과에 비추어 볼 때, 광신경조절 연구의 확산은 전임상 및 임상 시험을 위해 잘 정의되고 표준화된 노출 프로토콜에서 일관성을 확립하는 것의 중요성을 강조합니다. 전임상 연구에서는 최소 2일 노출 후 유익한 효과가 관찰되었으며, 12시간 광기 동안 100lux에서 8시간의 광을 포함하는 프로토콜이 있습니다. 임상시험에서 노출 프로토콜은 조사 중인 특정 병리학에 맞게 조정됩니다. 15분 동안 노출되면 급성 수술 후 통증의 조절에 유리한 것으로 입증되었습니다. 만성 통증의 조절을 위해 환자는 10주 동안 하루에 1-2시간 동안 집에서 GLED를 사용하도록 지시받습니다. 이 논문은 광신경조절의 이점을 평가하는 다양한 연구에서 재현성과 일관성을 개선하기 위한 전임상 및 임상 프로토콜에 대해 자세히 설명합니다. 이러한 표준화된 프로토콜을 수립함으로써 이 연구는 통증에 대한 실행 가능한 비약리학적 치료법으로서 GLED 광선 요법의 임상 번역을 발전시키는 것을 목표로 합니다.
서문
약물 치료, 특히 오피오이드는 급성 및 만성 통증 질환을 관리하기 위해 여전히 크게 의존하고 있다1. 통증 관리의 효과는 오피오이드 사용과 관련된 부작용의 빈도와 심각성에 의해 크게 영향을 받을 수 있다2. 이러한 이유로, 오피오이드 치료를 받고 있는 상당수의 환자들이 성공적인 통증 관리를 이루지 못하고 있다3. 따라서 통증 의사와 환자 커뮤니티는 기존 진통제와 관련된 부작용을 피하는 비약물적 치료법을 점점 더 많이 찾고 있습니다. 광신경조절법은 통증 관리를 위한 유망한 해결책이자 안전한 치료법으로 부상했습니다.
광신경조절(PNM)은 발광 다이오드(LED)를 사용하여 생물학적 과정을 조절하는 비침습적 기법입니다4. 광선 요법은 수천 년 전에 피부 질환을 치료하기 위해 햇빛 또는 헬리오 요법을 사용하여 확립되었습니다5. 그 후, 빛이 생물학적 조직에 영향을 미친다는 개념이 확대되어 광신경조절(photoneuromodulation) 용어가 개발되었습니다. PNM 연구는 현재 전 세계적으로 확장되고 있으며 통증 관리 6,7,8,9, 알츠하이머병 환자의 수면의 질 개선 10 및 우울증 조절 11 등 다양한 임상 응용 분야에서 그 효과를 보여주었습니다.
통증 관리를 위한 광신경조절의 메커니즘과 치료 잠재력을 조사하기 위한 전임상 연구 및 임상 시험에 대한 강조가 증가하고 있습니다. 이러한 접근법 중 525nm 파장 자극을 사용하는 녹색 발광 다이오드 요법(GLED)은 편두통, 섬유근육통 및 수술 후 통증을 포함한 다양한 유형의 통증을 줄이는 데 유망한 효능을 보여주었습니다 12,13,14,15,16. 임상시험에 따르면 여러 연구에서 녹색 광선 요법이 편두통 발작 시 두통과 광선 공포증의 강도를 모두 감소시킴으로써 편두통을 앓고 있는 환자에게 지속적으로 도움이 된다는 것을 입증했다19 편두통 발병의 빈도와 지속 기간을 줄임으로써12. 또한 전임상 연구에서는 GLED에 노출되면 신경병성 통증의 신경 손상 모델에서 열 및 기계적 과민증을 역전시킬 수 있음을 입증했다20. 또한, 전임상 연구에서는 GLED가 통증 지각과 감각 역치에 영향을 미치는 메커니즘을 조사했습니다 13,21,22,23,24. 이러한 연구는 M-원뿔의 관여와 배측 외측 생식기 핵(vLGN)의 후속 조절을 강조하며, 이는 배쪽 강지 핵(DRN)으로 돌출된 엔케팔린성 뉴런의 활동을 증가시킵니다22. 추가 연구에서는 하행 통증 조절의 핵심 조절자인 배내측 수질(RVM)21)의 중요한 역할을 강조하고 있습니다. 종합적으로, 이러한 연구 결과는 GLED가 하행 통증 경로에 작용하는 시각 회로를 조절하여 통증 인식을 변화시킨다는 것을 시사한다20,25. 그러나 임상적 사용을 용이하게 하기 위해서는 추가 연구가 필요합니다.
이 기사에서는 실험 및 임상 사용 모두에 재현 가능한 프레임워크를 제공하는 것을 목표로 GLED 기반 PNM을 구현하기 위한 포괄적인 방법론에 대해 자세히 설명합니다. GLED 노출의 설계 및 작동을 설명하고, 표준화된 애플리케이션 프로토콜을 간략하게 설명하며, 효능 및 재현성을 보장하기 위한 주요 고려 사항에 대해 논의합니다. 또한, 상승 및 하행 통증 경로의 활동을 평가하기 위한 상세한 프로토콜을 제공하여 GLED 유도 진통제를 조절하는 데 있어 통증 경로의 역할에 대한 심층 조사를 가능하게 합니다. 이러한 접근 방식을 공유함으로써 비약물학적 통증 관리에 대한 연구를 진전시키고 접근 가능하고 효과적이며 안전한 치료법을 개발하는 데 기여하는 것을 목표로 합니다.
프로토콜
모든 동물 절차는 애리조나 대학의 기관 동물 관리 및 사용 위원회의 승인을 받았으며 미국 국립보건원(National Institutes of Health)의 실험동물 사용 지침을 준수합니다. 병원균이 없는 성체 Sprague Dawley 쥐(테스트 시 체중: 275-330g)는 12시간 명암 주기로 기후 조절실의 표준 사슴 쥐 우리(우리당 3마리)에 수용되었으며 음식과 물에 대한 즉석 접근이 허용되었습니다. 모든 행동 실험은 치료 조건에 눈이 먼 실험자에 의해 수행되었습니다. 모든 인체 시술은 프로토콜 번호(STUDY00000370)에 따라 University of Arizona Institutional Review Board(IRB)의 승인을 받았습니다. 이 연구는 NCT05295225 미만의 ClinicalTrials.gov 에 등록되어 있습니다.
1. 동물의 빛 노출 프로토콜
- 빛 노출을 최적화하고 동물 사육을 준비합니다.
- (i) 녹색 LED(Table of Materials), 525nm의 파장, 8W의 전력, 120V의 전압 및 120° 빔 각도와 같은 특성을 가진 가시광선 스펙트럼 발광 다이오드(LED) 플렉스 스트립을 얻습니다. (ii) 백색 LED(재료 표), 9.6W의 전력, 120V의 전압 및 120° 빔 각도.
- 분광계로 광 스펙트럼의 정확도를 확인합니다(이 연구에서는 애리조나 대학의 BIO5 연구소의 생체 의료 장치 프로토타이핑 서비스를 사용했습니다).
알림: 녹색 LED는 525 ± 10nm(가장 밝은 방출 지점)의 중심 파장, 40nm 미만에 걸친 FWHM(Full-Width Half Maximum), 500 ± 5nm 및 530 ±5nm이어야 하는 Record Intensity Drop(광도가 최대 50%로 떨어지는 위치)을 가져야 합니다. 백색 LED FWHM은 90nm 이상에 걸쳐 있어야 합니다. 여러 백색광 소스를 사용할 수 있습니다. 실험자는 525nm 파장의 낮은 강도와 여러 파장을 포괄하는 스펙트럼의 넓은 범위를 보장해야 합니다21. - 조도계(Table of Materials)를 사용하여 광도를 측정하고 최적화합니다. 원하는 강도를 얻기 위해 필요에 따라 검은색 테이프(Table of Materials)로 LED를 덮습니다.
참고: 다양한 강도가 다양한 방식으로 감각 역치에 영향을 미칠 수 있으므로 빛의 강도를 측정하고 검증하는 것이 중요합니다(그림 1). 강도가 정확하지 않으면 원하는 강도에 도달할 때까지 일부 LED를 덮거나 드러냅니다. - 어두운 방(재료 표)에서 와이어 선반의 상단 가장자리에 LED 스트립을 고정하여 각 선반에 전용 노출 소스가 장착되어 있는지 확인합니다. LED 스트립에 타이머(재료 표)를 배치하여 오전 8시부터 오후 6시까지 하루 2시간 동안 케이지를 노출시킵니다.
- 선반에 투명 정적 케이지를 설치하십시오. 모든 면에 어두운 시트로 선반을 완전히 둘러싸면(Table of Materials) 빛 간섭을 최소화하면서 노출을 최적화합니다.
- 럭스 미터를 사용하여 일부 LED(각 케이지 중앙에서 100lux)를 덮거나 열어 케이지 내부의 광 강도를 최종적으로 최적화합니다(보충 그림 1).
- 기준선 감각 행동의 관찰과 노출 시작
- 도착하면 쥐가 1 주일 동안 동물 시설에 적응하도록합니다. 이 적응 기간이 지나면 최소 7일 동안 쥐를 실험자의 취급에 익숙화시킵니다.
- 동물을 치료 조건에 따라 (1) 외과적 개입과 결합된 녹색 광 노출(GLED), (2) 외과적 개입과 결합된 백색광 노출(WLED), (3) 가짜 수술과 결합된 WLED 대조군의 세 가지 실험 그룹으로 분류합니다.
- 실험 전에 실험 구역과 같은 방에서 실험자가 있는 상태에서 테스트 전에 1시간 동안 철망(Table of Materials)의 투명한 플렉시글라스 상자에 쥐를 적응시킵니다.
- 수술 전 역치를 평가하기 위해 왼쪽 뒷발에 폰 프레이 필라멘트26 (표 참조)을 사용하여 Dixon up-and-down 방법을 사용하여 4.31 필라멘트(19.6mN)부터 시작하여 발 철수 임계값을 측정합니다.
알림: 기계적 감도는 인출 임계값을 결정하여 "up-and-down" 방법을 사용하여 평가해야 합니다. 동물이 4.31 필라멘트(19.6mN)에 반응하지 않으면 더 두꺼운 4.56 필라멘트(39.2mN)를 사용하십시오(반응은 영향을 받은 발을 빼거나, 흔들거나, 핥는 것으로 시각적으로 표시됩니다). 동물이 4.31 필라멘트에 반응하면 더 얇은 4.08(9.8mN) 필라멘트를 사용합니다.- 각 필라멘트를 뒷발의 발바닥 표면에 수직으로 바르고 동물은 매달린 철망 케이지에 배치합니다.
- 이전 필라멘트 크기를 기준으로 증가 또는 감소하는 필라멘트 압력을 조정합니다.
- 동물이 각각 긍정적 또는 부정적 반응을 보였는지 여부에 따라 점진적으로 더 두껍거나 더 얇은 필라멘트를 계속 사용하십시오.
- 부정적 응답과 긍정적 응답을 모두 보충 표 1에 제공된 데이터시트에 기록하십시오.
알림: 각 필라멘트는 순차적으로 한 번에 하나씩 적용해야 합니다. 첫 번째 양성 반응 후 다른 필라멘트로 같은 발을 4번 더 테스트합니다. 모든 동물에서 신뢰할 수 있는 결과를 보장하기 위해 실험자는 필라멘트를 발판에 적용하지 않아야 합니다.
- Hargreaves 테스트를 사용하여 열 감도 기준선을 측정하기 위해 테스트 영역과 같은 방에서 테스트하기 전에 1시간 동안 Hargreaves 장치(Table of Materials)의 투명한 플렉시 유리 상자에 쥐를 적응시킵니다.
참고: Hargreaves 테스트는 쥐가 몇 초 동안 가만히 있어야 합니다. 쥐가 초기 1시간의 습관화 기간 후에도 여전히 과도하게 활동적이면 필요에 따라 적응 시간을 연장합니다. 쥐가 침착하고 움직이지 않지만 잠들지 않을 만큼 충분히 경계하고 있는지 확인하십시오. Hargreaves 테스트(Table of Materials)를 수행하기 전에 통증 민감도를 측정하기 위한 기준선을 설정하기 위해 적외선 강도를 설정하는 것이 중요합니다. 목표는 금단 잠복기가 기준선에 대해 평균 약 20초가 되는 것이며, 이는 과민증/통각저하증과 같은 통증 반응의 변화를 감지할 수 있는 충분한 민감도를 제공합니다. 발을 빼면 동작 감지기가 자극과 타이머를 모두 멈춥니다. 조직 손상을 방지하기 위해 최대 33.5초의 컷오프가 적용됩니다. - 수술 전 행동 역치를 평가하려면 적외선 레이저를 동물의 왼쪽 뒷발 중앙 아래에 배치합니다(적외선 방출기의 안내선 사용).
- 열 자극을 시작하여 동물이 열에 반응하여 발을 빼는 데 걸리는 시간(철수 잠복기)을 측정합니다.
참고: 평균 인출 대기 시간이 20초에 가깝지 않으면 강도를 조정하고 원하는 평균이 결정될 때까지 테스트를 반복합니다. 그런 다음 나머지 실험 동안 강도를 일정하게 유지합니다. 이 연구에서는 30(50W)의 자극 강도를 사용했습니다. 실험을 반복해야 하는 경우, 동일한 동물에 대해 실험을 반복하기 전에 5분 간격을 두십시오. - 보충 표 2에 제공된 데이터시트에 인출 대기 시간을 기록하십시오.
참고: 열 자극의 온도에 영향을 주지 않으려면 시험 중에 소변을 청소하십시오.
- 열 자극을 시작하여 동물이 열에 반응하여 발을 빼는 데 걸리는 시간(철수 잠복기)을 측정합니다.
- 기본 감각 행동을 습득한 후, 수술 전 4일 동안(하루 8시간, 오전 6시부터 오후 2시까지) 음식과 물을 지속적으로 이용할 수 있도록 동물을 정적 케이지에 수용하여 빛에 노출시킵니다.
- 통증 모델의 유도 및 감각 역치의 수술 후 평가
- 4일째 오후 2시에 노출이 종료된 후, 수술 후 통증을 유발하기 위해 왼쪽 뒷발에 브레넌 모델에 따라 절개 수술을 시행합니다27,28.
- 5일째에도 노출을 계속합니다. 5일째 오후 2시에 노출이 끝난 후, 앞서 설명한 대로 von Frey 및 Hargreaves 검사를 수행하여 수술 1일 후 열 및 기계적 과민증을 평가합니다.
- 6일째에도 노출을 계속합니다. 6일째 오후 2시에 노출이 끝난 후, 앞서 설명한 대로 von Frey 및 Hargreaves 검사를 수행하여 수술 2일 후 열 및 기계적 과민성을 평가합니다.
참고: 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)에서 정한 종점 기준에 도달하는 동물은 연구에서 제외합니다. - 행동 테스트를 완료한 후 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)에서 설명한 프로토콜에 따라 동물에 대한 안락사를 수행합니다.
- 동물 데이터 분석
- 기계적 감각 역치를 평가하기 위해 답의 기계적 인출 패턴을 Allodynia Software(National Instruments, LabView 2015)에 입력합니다29.
참고: 이 소프트웨어는 Chaplan et al.30에 자세히 설명된 대로 비파라메트릭 Dixon 방법을 사용합니다. - 열성 이질통에 대한 후속 통계 분석을 위해 스프레드시트에 인출 대기 시간을 보고합니다.
- 평균 민감도(임계값 또는 지연 시간)를 시간 함수로 표시하는 플롯을 생성합니다.
- 기계적 감각 역치를 평가하기 위해 답의 기계적 인출 패턴을 Allodynia Software(National Instruments, LabView 2015)에 입력합니다29.
2. 인간의 빛 노출 프로토콜
- 인간 피험자 평가를 위한 노출실 설정
- 노출실을 준비하는 것부터 시작하여 잠재적인 간섭을 제거하기 위해 외부 광원이 완전히 없는지 확인하십시오.
알림: 이 단계는 LED 조명의 효과를 격리하는 데 필수적입니다. - 피험자의 의자에서 3-6피트 떨어진 곳에 LED 조명을 배치합니다.
참고: 이 범위는 일관된 광 강도와 효과적인 노출을 보장하기 위한 이전 임상 시험을 기반으로 합니다. - 조도계를 사용하여 원하는 광도 범위가 90-100lux가 되도록 2m LED 스트립을 설치합니다(재료 표 및 보충 그림 2).
- 라이트 스트립의 위치를 변경하거나 일부 LED를 덮어 광도를 최적화하여 피험자가 앉아 있는 기본 영역에서 90-100lux를 받을 수 있도록 합니다.
- 노출실을 준비하는 것부터 시작하여 잠재적인 간섭을 제거하기 위해 외부 광원이 완전히 없는지 확인하십시오.
- 기계적 시간 합계 평가 테스트를 위한 숙지 단계
- 평가를 수행하기 전에 손을 철저히 씻은 다음 장갑을 착용하여 적절한 손 위생을 확인하십시오.
- 기계적 감도를 평가하기 전에 무균 상태를 보장하기 위해 보정된 von Frey 필라멘트(6.65mN, 300g의 힘에 해당)를 청소하고 살균합니다.
- 다가오는 평가를 위해 승모근을 노출시킬 수 있는 허가를 요청하십시오.
- 환자에게 폰 프레이 필라멘트는 필라멘트가 구부러질 때까지 승모근의 우세하지 않은 쪽에 적용될 것이라고 알립니다.
- 환자에게 0에서 10까지의 척도로 통증을 평가하도록 지시하며, 여기서 0은 통증이 없음을 나타내고 10은 조작자가 "지금"이라고 말한 직후 상상할 수 있는 최악의 통증을 나타냅니다.
알림: 교환원이 "지금"이라고 말할 때 환자가 신속하고 정확한 응답을 제공하도록 합니다. - 우세하지 않은 승모근의 세 가지 다른 지점(1인치 간격)에서 필라멘트를 3번 적용하여 각 적용 사이에 5초 간격을 둡니다.
- 피험자에게 폰 프레이 필라멘트가 1초에 한 번씩 같은 부위에 10번 도포될 것이라고 알리고 피험자에게 마지막 도포의 통증을 평가하도록 요청합니다.
알림: 10가지 용도 모두에 승모근의 동일한 지점을 사용하십시오. - 비우성 승모근에 필라멘트를 10회 적용하여 시간적 합계 효과를 측정하고 피험자에게 자극이 끝날 때의 통증을 평가하도록 요청합니다.
- 기계적 시간 합계 테스트
- 익숙해지기 단계가 끝나면 3분간 휴식을 취하고 환자에게 폰 프레이 필라멘트가 승모근의 우세한 쪽에 적용될 것임을 알립니다.
- 보정된 폰 프레이 필라멘트를 청소하고 소독합니다.
- 작업자가 "Now"라고 말한 직후 환자에게 0에서 10까지의 척도로 통증을 평가하도록 지시합니다.
- 우세한 승모근의 3개의 다른 지점(1인치 간격)에서 필라멘트를 3회 적용하여 각 적용 사이에 5초 간격을 둡니다. 환자의 반응을 기록지에 기록한다(보충 표 3).
- 피험자에게 폰 프레이 필라멘트가 1초에 한 번씩 같은 부위에 10번 도포될 것이라고 알리고, 피험자에게 마지막 도포의 통증을 평가하도록 요청한다.
- 우세한 승모근에 필라멘트를 10회 적용하여 시간적 합계 효과를 측정합니다. 피험자의 대답을 기록지에 기록한다(보충표 3).
- 이 과정을 3분 간격으로 두 번 반복하고 피험자의 응답을 기록 시트에 기록합니다(보충 표 3).
- 조건화된 통증 조절 평가를 위한 숙지 단계
- 12°C 냉수 수조를 준비합니다(보충 그림 3).
알림: 온도계(Table of Materials)를 사용하여 테스트 전에 온도를 확인하십시오. 테스트 기간 동안 온도를 조정하기 위해 필요한 경우 여분의 얼음을 준비하십시오. - 알고미터를 청소하고 소독하십시오.
- CPM(Table of Materials) 평가를 위해 Medoc 소프트웨어를 사용합니다.
- AlgoMed 옵션을 선택합니다(보충 그림 4). 홈 화면에서 Algometer Device를 찾아 클릭하여 활성화합니다.
- 목록에서 올바른 환자를 선택하고 테스트 프로그램을 선택합니다.
- 장치를 적용할 사이트를 선택합니다. 이 익숙화 단계를 위해 신체 다이어그램에서 우세하지 않은 승모근을 선택합니다(보충 그림 5).
알림: 테스트로 이동을 클릭하면 테스트 화면으로 이동합니다. 압력을 가하기 전에 소프트웨어는 장치가 아직 압력을 가하지 않는 경우 사전 테스트를 수행하도록 요구합니다. 이 사전 테스트는 새 테스트를 시작할 때마다 완료해야 합니다. - 테스트를 시작하고 5초 시간 초과를 시작합니다.
- 이 장치는 가해지는 압력의 양을 측정하며 승모근의 우세하지 않은 쪽에 압력을 가하는 데 사용될 것임을 환자에게 알립니다. 환자에게 통증이 느껴지기 시작하는 즉시 "멈춰"라고 말하도록 요청하십시오.
- 시작을 클릭합니다. 시스템은 장치 적용을 시작하기 전에 5초 동안 대기합니다.
- 30kPa/s의 속도로 힘을 증가시켜 승모근에 알고미터를 적용합니다(보충 그림 6).
- 환자의 반응을 기록지에 기록한다(보충 표 3).
참고: 이 연구의 경우 적용되는 최대 압력은 650kPa입니다. 이 연구는 통증 내성을 평가하는 것이 아니라 통증의 시작을 구체적으로 평가합니다. - 참가자들에게 평가를 위해 얼음물 욕조를 사용할 것이라고 알립니다.
- 온도계(Table of Materials)를 사용하여 수온이 약 12°C인지 확인하십시오. 타이머를 10초로 설정합니다.
- 참가자에게 주로 사용하는 손을 손목까지 물에 담그도록 지시하여 손의 긴장을 풀고 손가락을 벌리십시오.
- 참가자에게 교환자가 10초가 끝날 때까지 "지금"이라고 말할 때 0에서 10까지의 척도로 통증을 평가하도록 요청합니다.
- 10초가 끝날 때 통증 등급을 요청하고 환자의 반응을 기록 시트에 기록합니다(보충 표 3).
- 12°C 냉수 수조를 준비합니다(보충 그림 3).
- 조건화된 통증 조절 테스트
- 온도계를 사용하여 수온을 확인하십시오(재료표).
- 알고미터를 청소하고 소독하십시오.
- 3분의 휴식 후, 다가오는 평가를 위해 우세한 승모근을 노출시킬 수 있는 허가를 요청하여 조건화된 통증 조절(CPM) 평가를 시작합니다.
- 환자에게 통증이 느껴지기 시작하는 즉시 "멈춰"라고 말하도록 요청하십시오. 소프트웨어에서 시작을 클릭합니다.
- 30kPa/s의 속도로 힘을 증가시켜 승모근에 고도계를 적용하고 기록 시트에 환자 반응을 기록합니다(보충 표 3).
- 우세한 승모근의 다른 부위에 각각 3분 간격으로 2회 더 적용을 반복합니다.
- 피험자의 피부 기름 축적으로 인한 미끄러짐을 방지하기 위해 각 적용 전에 고도계를 철저히 청소하고 소독했는지 확인하십시오.
- 환자의 반응을 기록지에 기록한다(보충 표 3). 조건화된 자극 테스트로 이동하기 전에 5분 동안 기다립니다.
- 시작을 클릭합니다. 시스템은 장치 적용을 시작하기 전에 5초 동안 대기합니다.
- 알고미터를 청소하고 소독하십시오.
- 환자에게 주로 사용하지 않는 손을 손목까지 얼음물 욕조에 담그도록 지시합니다.
- 30kPa/s의 속도로 힘을 증가시켜 승모근에 고도계를 적용하고 기록 시트에 환자 반응을 기록합니다(보충 표 3).
- 승모근의 다른 부위에 각각 5분 간격으로 두 번 더 적용을 반복합니다.
참고: 초기 선별 검사 후 이전에 발견되지 않은 의학적 상태가 확인되는 경우, 특히 해당 상태가 연구를 방해할 가능성이 있는 경우 연구를 중단합니다. - 기준선 사전 노출 값을 획득한 후 환자를 할당된 조명 조건에 노출시키기 시작합니다.
- 자원자들에게 광원을 직접 쳐다보지 않도록 지시합니다.
참고: 대신, 집에 있는 주변 광원과 마찬가지로 빛이 주변 시야에 들어오도록 해야 합니다(보충 그림 7). - 피사체를 LED 조명에 1.5시간 동안 노출시킵니다.
참고: 장시간의 광선 치료를 위해 피험자는 최대 10주 동안 집에서 노출을 자가 투여합니다. 통증 설문지와 함께 FIQ(Fibromyalgia Impact Questionnaire), HIT-6(Headache Impact Test), PSQI(Pittsburgh Sleep Quality Index) 및 EQ-5D-5L(전반적인 건강 평가)과 같은 설문 조사를 사용하여 시간 경과에 따른 치료 효과를 모니터링할 수 있습니다. - 노출되는 동안, 자원봉사자들이 읽기나 쓰기와 같이 추가적인 광원이 필요하지 않은 활동에 참여하도록 격려한다.
참고: 4-100lux의 강도는 충분한 조명을 제공합니다. - 프로토콜을 완전히 준수하기 위해 노출 기간 동안 수면을 마십시오.
- 광 노출 요법 후 기준선에서 완료된 모든 측정을 반복합니다.
- 인적 데이터 분석
- 기계적 시간 합계의 경우 3개의 기준선 측정값의 평균과 3개의 반복된 자극의 평균을 계산합니다.
- 반복적인 자극 후 평균 통증 등급을 평균 기준선 통증 등급으로 나누고 결과에 100을 곱하여 백분율로 표현하여 기계적 시간 합계 백분율을 계산합니다.
참고: 100%보다 큰 백분율은 반복적인 자극으로 인한 통증 인식의 증가를 나타내며, 이는 시간적 합계의 존재를 암시합니다. - 기계적 조건화 통증 조절(CPM)의 경우, 무조건 자극(냉수 목욕 없이) 동안 얻은 마지막 2개의 기준선 통증 역치(kPa)의 평균을 계산합니다.
- 조건화 자극 중 마지막 2개의 통증 임계값(kPa)의 평균을 계산합니다.
- 다음 방정식을 사용하여 CPM을 계산합니다.
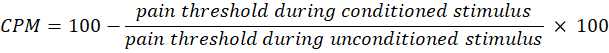
참고: CPM 값이 0이면 통증 인식에 변화가 없음을 나타내고, 음수 값은 조건화된 자극 중 통증 감각 억제를 나타내고, 양수 값은 조건화된 자극 동안 통증 촉진을 나타냅니다. - 빛에 노출되기 전과 후에 시간적 합계와 CPM의 변화를 평가하여 치료가 각각 상승 및 하행 통증 경로의 활동에 어떤 영향을 미치는지 평가합니다.
결과
그린라이트 노출은 용량에 의존하는 방식으로 발 철회 대기 시간을 증가시킵니다.
그림 1A 는 다양한 강도(4, 50, 100 및 200lux)에서 녹색 발광 다이오드(GLED)에 노출되면 7일의 노출 기간 동안 미성숙한 쥐 모델에서 발 철회 대기 시간이 크게 증가했음을 보여주며, 이는 GLED의 항통각 효과를 나타냅니다. 빛에 노출...
토론
최근 연구에서는 녹색광(GLED) 진통제의 기전을 탐구했습니다 13,21,22,23,24. 그러나 임상 실습으로의 전환을 향상시키기 위해 방법론의 추가 표준화가 필요합니다. 전임상 모델에서 관찰된 용량 의존적 항통각(antinociceptive) 효과는 치료 결과를 극대화?...
공개
이브라힘 박사는 애리조나 대학교(University of Arizona)에 Luxxon Therapeutics에 대한 외부 관심을 밝혔습니다. 이러한 이해관계로 인한 이해 상충은 University of Arizona의 정책에 따라 관리되고 있습니다. 다른 모든 저자는 보고할 이해 상충이 없습니다. 원고의 저자 중 누구도 다른 방식으로 보수, 상환 또는 사례금을 받지 않았습니다. 저자는 이 연구와 관련된 공급업체 또는 제약 회사와 관련이 없습니다. 이러한 연구, 원고 또는 초록 중 어느 것도 이전에 발표된 적이 없으며 다른 저널에 게재하는 것을 고려하지 않고 있습니다.
감사의 말
이 연구는 애리조나 대학교 통증 및 중독 종합 센터(M.M.I., L.F.M.), 애리조나 대학교 마취학과(L.F.M.) 및 애리조나 대학교 의과대학 투손 의과대학의 의학 과학자 교육 프로그램(MSTP)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
참고문헌
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유