Method Article
Анализ стабильности плазмид с помощью микрофлюидики капель с открытым исходным кодом
В этой статье
Резюме
Представлен доступный микрофлюидный рабочий процесс с открытым исходным кодом для параллельного анализа удержания плазмид у бактерий. Используя флуоресцентную микроскопию для количественной оценки присутствия плазмид в микроколониях одиночных клеток в гелевых микрокаплях, этот метод обеспечивает точную, доступную и масштабируемую альтернативу традиционному подсчету планшетов.
Аннотация
Плазмиды играют жизненно важную роль в синтетической биологии, позволяя внедрять и экспрессировать чужеродные гены в различных организмах, тем самым облегчая построение биологических цепей и путей внутри и между клеточными популяциями. Во многих случаях поддержание функциональных плазмид без выбора антибиотиков имеет решающее значение. В этом исследовании представлен открытый аппаратный микрофлюидный рабочий процесс для анализа удержания плазмид путем культивирования одиночных клеток в гелевых микрокаплях и количественного определения микроколоний с помощью флуоресцентной микроскопии. Такой подход позволяет проводить параллельный анализ многочисленных капель и микроколоний, обеспечивая большую статистическую мощность по сравнению с традиционным подсчетом на планшетах и позволяя интегрировать анализ в другие микрофлюидные рабочие процессы с каплями. Используя плазмиды, экспрессирующие флуоресцентные белки наряду с неспецифическим флуоресцентным окрашиванием ДНК, можно идентифицировать и дифференцировать отдельные колонии на основе потери плазмид или экспрессии флуоресцентных маркеров. Примечательно, что этот усовершенствованный рабочий процесс, реализованный с помощью аппаратного обеспечения с открытым исходным кодом, обеспечивает точный контроль потока и управление температурой как образца, так и микрофлюидного чипа. Эти функции повышают простоту использования, надежность и доступность рабочего процесса. В то время как исследование сосредоточено на Escherichia coli в качестве экспериментальной модели, истинный потенциал метода заключается в его универсальности. Он может быть адаптирован для различных исследований, требующих количественного определения флуоресцентного сигнала от плазмид или красителей, а также для других применений. Внедрение аппаратного обеспечения с открытым исходным кодом расширяет возможности проведения высокопроизводительных биоанализов с использованием доступных технологий в различных исследовательских условиях.
Введение
Плазмиды являются важными генетическими элементами в прокариотических клетках, внося значительный вклад в эволюцию микроорганизмов за счет латерального переноса ДНК и быстрой адаптациик изменениям окружающей среды. Эти внехромосомные молекулы ДНК несут гены, которые обеспечивают полезные черты, такие как устойчивость к антибиотикам, метаболические функции и факторы вирулентности, что делает их ценными для исследований в области микробиологии, синтетической биологии и эволюции. Тем не менее, поддержание плазмид в клеточных популяциях является сложной задачей из-за метаболической нагрузки репликации и сегрегации, что часто приводит к потере плазмидбез давления отбора. Кроме того, стабильное наследование требует таких механизмов, как токсин-антитоксин и системы разделения, что усложняет поддержание плазмид. Оценка стабильности плазмид в изменяющихся условиях имеет решающее значение как для фундаментальных исследований, так и для практических применений, в которых плазмиды используются в качестве основного исследовательского элемента 4,5. Большинство современных методов оценки стабильности плазмид имеют существенные ограничения: методы, основанные на проточной цитометрии, предоставляют косвенные данные на уровне популяции, требуют дорогостоящего оборудования и не имеют прямой визуализацииколоний. Методы объемной транскриптомики и протеомики являются дорогостоящими, обеспечивают только средние клеточные реакции и не могут напрямую количественно оценить удержание плазмид в отдельных колониях6. Традиционные методы, такие как серийное разведение и пассирование, просты, но отнимают много времени и им не хватает точности и репрезентативности. В целом, количественный вывод или прогнозирование количества колоний, которые сохраняют определенную функциональную плазмиду с течением времени или селективного давления, остается сложной задачей.
Для решения этих проблем представлен новый микрофлюидный рабочий процесс с использованием открытых аппаратных исследовательских инструментов для количественной оценки флуоресцентных сигналов в нескольких изолированных колониях бактерий с использованием Escherichia coli в качестве модели. Этот метод позволяет проводить высокопроизводительный и точный анализ удержания плазмид в различных условиях или при селективном давлении. Анализ разрешения одиночных клеток обеспечивает точный метод манипулирования изолированными колониями, получая чувствительные данные о количественном определении плазмид, которые могут помочь оценить скорость удержания и потери4.
Микрофлюидика, особенно капельная микрофлюидика, стала мощным инструментом для инкапсуляции и манипулирования отдельными клетками в контролируемыхусловиях. В частности, капли микрогеля могут инкапсулировать отдельные клетки для высокопроизводительного и точного анализа без необходимости поддержания капель во взвешенном состояниив масле9, что позволяет проводить контролируемое исследование динамики плазмид в определенном микроокружении. После инкапсуляции клеточных суспензий непосредственно с наконечника пипетки10 можно использовать флуоресцентные методы для мониторинга роста микроколоний в каплях, что позволяет проводить детальный анализ удержания и сегрегации плазмид при различных давлениях отбора3.
Преимущества этого метода по сравнению с традиционными методами массового культивирования включают повышенную точность, меньшую изменчивость и возможность проведения высокопроизводительных анализов. Технология микрофлюидики с открытым исходным кодом преодолевает ограничения дорогостоящих проприетарных систем, такие как проблемы доступности, адаптируемости и обслуживания, которые частопрепятствуют прогрессу в исследованиях. Демонстрируя применение передового экспериментального рабочего процесса анализа удержания плазмид в микрогелях с помощью инструментов с открытым исходным кодом, предоставляется доступный и надежный метод для исследований в области биологии плазмид, применения синтетической биологии и методов анализа микрофлюидных капель.
Подводя итог, можно сказать, что в данной статье представлен доступный метод количественной оценки удержания плазмид в E. coli с высокой статистической мощностью. Возможности этого метода делают его ценным инструментом для углубления понимания биологии плазмид и улучшения приложений синтетической биологии.
протокол
На рисунке 1представлен схематический обзор для оценки стабильности плазмид E. coli. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов. Исходные данные и сценарии визуализации доступны по адресу https://doi.org/10.17605/OSF.IO/6YWJK.
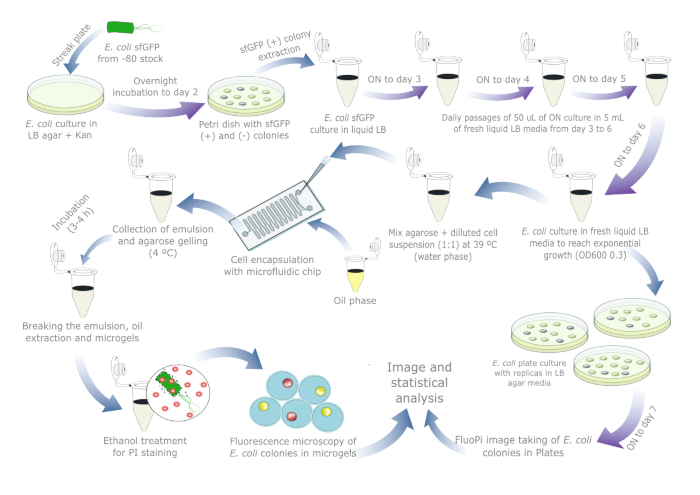
Рисунок 1: Ежедневный протокол оценки стабильности плазмид у E. coli. Синими стрелками обозначены шаги в течение дня, а фиолетовыми стрелками — ночная инкубация. Каждую инкубацию жидкости и агара проводили при температуре 37 °C вместе с отдельной отрицательной контрольной трубкой/планшетом. Обратите внимание, что подготовка и пассажи клеточной культуры не требуются для реальных образцов, в которых потеря плазмид уже могла произойти, поэтому протокол должен быть сокращен до одного или двух дней, если включена культура с планшетом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Микрофлюидная подготовка чипа
ПРИМЕЧАНИЕ: В этом протоколе могут использоваться различные коммерческие или пользовательские конструкции чипов для инкапсуляции ячеек, которые способны генерировать капли воды в масле диаметром менее 100 мкм в режиме капель. Для данного исследования чип был спроектирован и изготовлен (см. данные статьи https://doi.org/10.17605/OSF.IO/6YWJK) с использованием того же метода проектирования и изготовления, о котором сообщалось в ранее опубликованном отчете14.
- Получите или подготовьте микрофлюидный чип PDMS-on-glass с помощью мастер-формы, предназначенной для генерации гелевых микрокапель.
- Введите водоотталкивающий раствор (фторалкилсилан) в чип, чтобы сделать внутренние микроканалы гидрофобными. Влейте раствор во входные отверстия и убедитесь, что все каналы заполнены жидкостью. Оставьте заполненные каналы на 30–60 секунд.
- Удалите раствор из устройства, выдавливая воздух во внутренние микроканалы. Используйте пустой воздушный шприц для промывки воздуха и абсорбирующую салфетку для других портов, чтобы предотвратить разбрызгивание.
- Выпекать обработанное устройство при температуре 65 °C в течение 15 минут на конфорке для испарения излишков раствора. В качестве альтернативы можно хранить устройство в холодильнике (4 °C) в течение ночи.
ПРИМЕЧАНИЕ: Микрофлюидный чип готов к использованию. Протокол можно поставить на паузу здесь.
2. Подготовка образцов
- Забор клеток
Примечание: Культура клеток в каплях может предоставить соответствующие данные о динамике плазмид. В качестве экспериментальной модели бактерий используется штамм E. coli TOP10 с плазмидным pCA_Odd1 (см. https://doi.org/10.17605/OSF.IO/6YWJK депонированных данных), который кодирует зеленый флуоресцентный белок (sfGFP) и резистентность к канамицину15. Бактерии, плазмиды и питательные среды могут различаться в зависимости от экспериментальной системы.- Приготовьте агар Luria Bertoni (LB), растворив 25 г предварительно смешанного LB и 12 г агара в 800 мл дистиллированной воды (dH2O). Кроме того, приготовьте жидкую среду LB, растворив 25 г предварительно смешанного LB в 800 мл dH2O. Автоклавируйте растворы и дайте им остыть примерно до 60 °C. Перейдите в стерильную среду, например, в вытяжку для следующих шагов.
ПРИМЕЧАНИЕ: Предварительно смешанный порошок LB содержит 10 г триптона, 5 г дрожжевого экстракта и 10 г NaCl. Также можно использовать самостоятельно смешиваемые LB-агаровые среды. - Добавьте 50 мкл канамицина (приготовленного в концентрации 100 мг/мл) в 50 мл жидкого LB-агара (конечная концентрация: 100 мкг/мл). Перемешайте раствор, несколько раз перевернув трубку.
- Налейте около 15 мл жидкого LB-агара на чашку Петри (90 мм x 15 мм). Подготовьте две пластины: одну для негативного контроля (мониторинга загрязнения) и одну для экспериментальной культуры. Дайте раствору LB-агара остыть и застыть, пока цвет не изменится с темного на прозрачный на обеих пластинах.
- Используйте стерильную петлю для распределения штамма кишечной палочки по культуральной пластине с помощью техники полосовой пластины. Сразу после использования поместите глицериновый бульон E. coli обратно в температуру –80 °C. Закройте обе пластины и инкубируйте их в течение ночи при температуре 37 °C (день 1).
- На 2 день проверьте отрицательную контрольную пластину для любой колонии как сигнал о заражении (если это так, повторите действия из. 2.1.4.). Определите одиночные флуоресцентные колонии на планшете E. coli с помощью трансиллюминатора синего света для приготовления жидкого культурного запаса.
- В стерильных условиях откройте планшет и с помощью стерильной петли или наконечника пипетки объемом 200 мкл выберите выбранную колонию и перенесите ее в культуральную пробирку с 5 мл свежей жидкой среды LB и 5 мкл канамицина (приготовленного в концентрации 100 мг/мл). Подготовьте отрицательную контрольную трубку без инокуляции для контроля загрязнения. Инкубируйте пробирки с культуральными культурами при температуре 37 °C в течение ночи, встряхивая со скоростью 220 об/мин.
- Пропустите образец в течение 3 дополнительных дней в среде без антибиотиков, чтобы смоделировать условия, при которых может произойти потеря плазмид. На 3, 4 и 5 день перенесите 50 мкл ночной культуры в новую культуральную пробирку, содержащую 5 мл жидкой LB без антибиотиков. Инкубировать при 37 °C в течение ночи с встряхиванием при 220 об/мин. Повторяйте этот шаг до 6-го дня, получая окончательную культуру в 5 мл после четырех полных проходов.
- Перенесите 50 μL из последней ночной культуры в новую культуральную пробирку, содержащую 2 мл жидкого LB. Дайте культуре достичь оптической плотности (OD600) 0,3 с помощью спектрофотометра (примерно 3–4 часа).
ПРИМЕЧАНИЕ: Свежую культуру следует использовать до увеличения OD600, чтобы убедиться, что бактерии находятся в логарифмической фазе роста. Если желаемая концентрация не достигнута, повторите шаг с пункта 2.1.8.
- Приготовьте агар Luria Bertoni (LB), растворив 25 г предварительно смешанного LB и 12 г агара в 800 мл дистиллированной воды (dH2O). Кроме того, приготовьте жидкую среду LB, растворив 25 г предварительно смешанного LB в 800 мл dH2O. Автоклавируйте растворы и дайте им остыть примерно до 60 °C. Перейдите в стерильную среду, например, в вытяжку для следующих шагов.
- Клеточно-агарозная смесь для инкапсуляции
ПРИМЕЧАНИЕ: Контроль концентрации необходим для обеспечения инкапсуляции капель одной клетки. Требуемая концентрация клеток может быть рассчитана для целевой скорости инкапсуляции и удельного объема капель, как показано в следующем примере:
Объем капель (V капля): при образовании капель размером 50 мкм
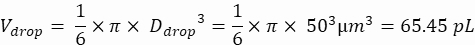
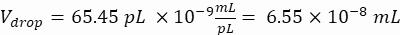
Желаемые клетки на каплю (Cpd): в среднем одна клетка на пять капель (0,2 клетки/капля)

Фактор разбавления: Начальная концентрация клеток получена на этапе 2.1.8
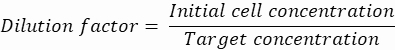
Здесь образуются капли размером 50 мкм или 100 мкм (без расщепления капель) (65–520 пл), в которых инкапсулируется примерно одна клетка на пять капель, или 1,6 ячейки на каплю без расщепления. Для E. coli используйте коэффициент пересчета 1 OD600 единица ≈ 7,8 x 108 клеток/мл16. Умножьте значение OD600 из шага 2.1.8 на коэффициент пересчета, чтобы получить начальную концентрацию (клетки/мл) культуры.- Повторно суспендировать E. coli из приготовленного культурального сырья в жидком LB без канамицина в концентрации 6,2e+6 клеток/мл (целевая концентрация для капель диаметром 50 мкм). Выдерживайте бактериальную суспензию при комнатной температуре до смешивания с агарозой.
ПРИМЕЧАНИЕ: Антибиотики подавляют негативное образование микроколоний, поэтому важно исключить их из среды для экспериментов по потере плазмид. - Приготовьте агарозу со сверхнизкой температурой желирования, нагревая ее до 90 °C в жидкой LB концентрации 2% (w/v). Взбалтывайте смесь в течение 10 минут в шейкере с регулируемой температурой.
- Снизьте температуру термошейкера до 39 °C, чтобы охладить раствор агарозы. Параллельно поместите трубку с бактериальной суспензией в термошейкер на 4 минуты, чтобы нагреть ее до 39 °C.
- Смешайте бактерии и агарозные суспензии в соотношении 1:1 до получения концентрации агарозы 1% (w/v) с клеточной суспензией в соотношении 3,1e + 6 клеток/мл. Приготовьте отрицательный контрольный раствор (контроль загрязнения) с той же концентрацией агарозы, используя жидкую LB вместо бактериальной суспензии.
ПРИМЕЧАНИЕ: Суспензию агарозных клеток следует применять быстро, чтобы избежать изменения концентрации из-за роста бактерий. Поддерживайте температуру термошейкера при температуре 39 °C, чтобы сохранить агарозную жидкость до загрузки в нагреватель наконечника для образования капель.
- Повторно суспендировать E. coli из приготовленного культурального сырья в жидком LB без канамицина в концентрации 6,2e+6 клеток/мл (целевая концентрация для капель диаметром 50 мкм). Выдерживайте бактериальную суспензию при комнатной температуре до смешивания с агарозой.
3. Высокопроизводительное выращивание одной колонией
- Экспериментальная установка
- Создайте или приобретите полную платформу с открытым исходным кодом (см. https://doi.org/10.17605/OSF.IO/6YWJK), включая драйверы давления газа и датчики расхода. В качестве альтернативы можно создать более простую стадию микроскопии с открытым исходным кодом и аппаратным стробоскопом (см. инструкции по сборке https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ и репозиторий проекта https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
ПРИМЕЧАНИЕ: Можно также использовать традиционную микрофлюидную установку с коммерческим микроскопом, высокоскоростной камерой и возможностями нагрева образцов. - Интегрируйте систему регуляторов давления и расхода с открытым исходным кодом на базе Raspberry Pi, как описано в назначенном репозитории (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller).
ПРИМЕЧАНИЕ: Управление модулем проиллюстрировано и сохранено в репозитории данных (https://doi.org/10.17605/OSF.IO/6YWJK. В качестве альтернативы можно использовать традиционные регуляторы давления или шприцевые насосы с высоким крутящим моментом. - Включите в установку нагреватели предметного стекла и наконечника пипетки (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring) для контроля температуры образца агарозной ячейки при его поступлении в чип.
ПРИМЕЧАНИЕ: Эти нагреватели, проиллюстрированные в репозитории данных (https://github.com/wenzel-lab/flow-microscopy-platform и https://doi.org/10.17605/OSF.IO/6YWJK), являются важной особенностью системы контроллеров с открытым исходным кодом, которая позволяет работать с агарозой и может быть недоступна в других коммерческих системах.
- Создайте или приобретите полную платформу с открытым исходным кодом (см. https://doi.org/10.17605/OSF.IO/6YWJK), включая драйверы давления газа и датчики расхода. В качестве альтернативы можно создать более простую стадию микроскопии с открытым исходным кодом и аппаратным стробоскопом (см. инструкции по сборке https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ и репозиторий проекта https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
- Инкапсуляция в одну ячейку
- Расположите микрофлюидный чип на предметном столике микроскопии, усиленном стробоскопией, чтобы было видно место соединения генерации капель (пересечение водной и масляной фаз).
- Установите нагреватель наконечников пипеток и нагреватель стеклянных стекол на 40 °C с помощью интерфейса управляющего программного обеспечения.
- С помощью шприца с трубкой и пробкой PDMS загрузите 1%-ную агарозную смесь с клеточной суспензией в наконечник пипетки объемом 200 мкл. Вставьте наконечник в нагреватель наконечников и поместите его на входе водной фазы в микрофлюидном чипе. Замените уплотнение PDMS наконечника на уплотнение, подключенное к трубке системы регулирования потока, и начните инфузию клеточной суспензии.
- Вставьте конец выпускной трубки в сточную трубку и установите скорость потока или давление в двух фазах на пользовательском интерфейсе, чтобы медленно подавать жидкость в микрофлюидный канал. Используйте 200 мкл/ч (180 мбар) для водной фазы и 1700 мкл/ч (320 мбар) для масляной фазы. Подождите 1 минуту для стабилизации образования капель.
ПРИМЕЧАНИЕ: Значения давления зависят от размеров каналов в конструкции микросхемы, и значения потока могут потребоваться для различных конструкций переходов генерации капель. - Как только образование капель стабилизируется, перенесите отходы и сборные трубки в сборную трубку. Продолжайте собирать капли до тех пор, пока резервуар для образца не опустеет. Повторите шаги с 3.2.3 по 3.2.5 для инкапсуляции отрицательного контрольного раствора из шага 2.2.4.
ПРИМЕЧАНИЕ: Сбор образцов должен быть завершен в течение 15 минут. - Храните пробирки для сбора на льду во время генерации капель или поместите их при температуре 4 °C после эксперимента на 1 ч, чтобы агароза образовала гель внутри капель.
ПРИМЕЧАНИЕ: Микрофлюидный чип можно использовать повторно, если микроканалы остаются незабитыми и загружена та же суспензия. Утилизируйте наконечник пипетки после завершения генерации эмульсии (шаги 3.2.3–3.2.5).
- Рост колонии и высвобождение из эмульсии
- Перенесите микрокапли геля, содержащие бактерии, и отрицательный контроль капель в инкубационную камеру, установленную на 37 °C.
- Инкубируйте микрокапли не менее 4 часов или в течение ночи, чтобы обеспечить достаточный рост колонии. Убедитесь, что отрицательный контроль не показывает признаков загрязнения с помощью микроскопии в светлом поле.
- Чтобы освободить колонии от эмульсии, удалите как можно больше масла из-под микрокапельной эмульсии геля с помощью пипетки или шприца с иглой (здесь использовалась игла размера 21 G).
- Перенесите 50 μL микрокапель геля в новую микропробирку и храните ее при температуре 4 °C для дальнейшего анализа капель. К оставшейся эмульсии добавить смесь фторированного масла в соотношении 1:1 с 1Н,1Н,2Н,2Н-перфтор-1-октанолом (ПФО) в объеме, равном эмульсии.
- Добавьте примерно 200 мкл фосфатно-солевого буфера (PBS) или 0,9% w/v буфера NaCl поверх эмульсии. Сделайте смесь вихревой и кратковременно раскрутите ее в центрифуге с фиксированной частотой вращения.
- Осторожно удалите масляную фазу из нижней части раздела жидкости и слейте 100 мкл PBS сверху. Повторите шаги 3.3.4–3.3.5 для получения промытых микрогелей в буфере PBS с минимальным остатком масла или без него.
ПРИМЕЧАНИЕ: Микрогели оседают на границе раздела жидкости; Избегайте их удаления вместе с масляной фазой.
4. Анализ одиночных колоний
- Окрашивание клеток
ПРИМЕЧАНИЕ: Для этого протокола работает множество различных комбинаций морилки. По сути, следует выбрать ДНК или окрашивание клеточной стенки, которое имеет цвет, отличный от флуоресцентного белка, кодируемого плазмидой, и которое может быть проанализировано с использованием доступных комбинаций фильтров на флуоресцентном микроскопе. Здесь ДНК клеток окрашивали йодидом пропидия (PI), чтобы отличить его флуоресценцию от зеленого флуоресцентного белка, закодированного на плазмидах, но можно использовать и многие другие красители ДНК.
ВНИМАНИЕ: ПИ является потенциальным канцерогеном, и с ним следует обращаться с соответствующими средствами индивидуальной защиты. Утилизируйте краситель безопасно и в соответствии с местными нормами.- Центрифугируйте промытые микрогели при температуре около 80 x g в течение 5 минут при комнатной температуре. Выбросьте надосадочную жидкость с помощью пипетки.
- Перенесите 50 мкл микрогелей в новую микропробирку, чтобы она служила отрицательным контролем для обработки этанолом.
ПРИМЕЧАНИЕ: PI-окрашивание проникает только в клетки с поврежденными мембранами, например, пораженные обработкой этанолом. - Добавьте равный объем 70% этанола к оставшимся микрогелям и кратко перемешайте вихрем. Инкубировать при комнатной температуре в течение 15 минут для проникновения бактериальных мембран для окрашивания ПИ. Повторите шаг 4.1.1.
- Добавьте равный объем 0,9% w/v NaCl к микрогелям и кратковременно сделайте вихрь. Повторите шаг 4.1.1.
- Добавьте 2 мкл PI (1 мг/мл) в оба образца микропробирок. Тщательно перемешать и выдерживать в темноте при комнатной температуре в течение 15 минут.
Примечание: Если отрицательный контроль показывает какой-либо красный флуоресцентный сигнал с помощью флуоресцентной микроскопии, целостность колоний может быть нарушена во время их воздействия других растворов на предыдущих этапах.
- Микроскопия
ПРИМЕЧАНИЕ: Капли и микрогели визуализируются с помощью инвертированного эпифлуоресцентного микроскопа для получения распределения капель по размерам и флуоресценции колоний бактерий в микрогелях (Рисунок 2). Здесь используется платформа инвертированной микроскопии с открытым исходным кодом (https://github.com/wenzel-lab/SQUID-bioimaging-platform)17 с объективом 10x 0,3 NA, белой светодиодной матрицей для яркопольного освещения и светодиодом с длиной волны 470 нм для возбуждения. Коммерческие эпифлуоресцентные микроскопы могут использоваться для получения изображений капель и микрогелей. Калибровка необходима, поскольку подсветка и фильтры различаются в зависимости от модели, марки и используемых флуоресцентных белков.- Перенесите 2 мкл гелевых микрокапель в предметное стекло камеры для визуализации и добавьте 5 мкл фторированного масла, чтобы сформировать монослой капель для оптимальной визуализации.
ПРИМЕЧАНИЕ: Камеры для подсчета клеток или простые микрофлюидные камеры могут помочь распределить эмульсию тонким слоем и замедлить процесс сушки. - На микроскопе активируйте белую светодиодную подсветку сверху для получения изображений в светлом поле. Установите подготовленное предметное стекло, сосредоточьтесь на образце и найдите монослой капель. Сделайте светлопольное изображение.
- Не перемещая образец, получите флуоресцентное изображение колоний, переключившись на светодиод с длиной волны 470 нм для возбуждения. Отрегулируйте колесо фильтров так, чтобы оно совпало с зеленым фильтром длины волны для визуализации sfGFP. Отсканируйте все области, содержащие монослои капель, и повторите шаги 4.2.2–4.2.3, чтобы обеспечить статистическую надежность анализа капель.
- Перенесите 2 мкл окрашенных микрогелей в чип камеры визуализации и 5 мкл 0,9% v/v NaCl, чтобы помочь сформировать монослой микрогелей. Загерметизируйте входное и выходное отверстия чипа, чтобы предотвратить испарение во время визуализации.
ПРИМЕЧАНИЕ: Испарение может повлиять на колокализацию флуоресцентных этикеток. Для длительной визуализации рекомендуются микрофлюидные камеры. - Повторите шаги 4.2.2–4.2.3. Настройте фильтр красного интервала длин волн для PI-изображений и захватите соответствующие изображения.
- После завершения визуализации в одном месте найдите следующую подходящую область на предметном стекле с помощью монослоя микрогелей и повторите процесс визуализации, чтобы обеспечить статистическую надежность и всесторонний анализ образца.
- Перенесите 2 мкл гелевых микрокапель в предметное стекло камеры для визуализации и добавьте 5 мкл фторированного масла, чтобы сформировать монослой капель для оптимальной визуализации.
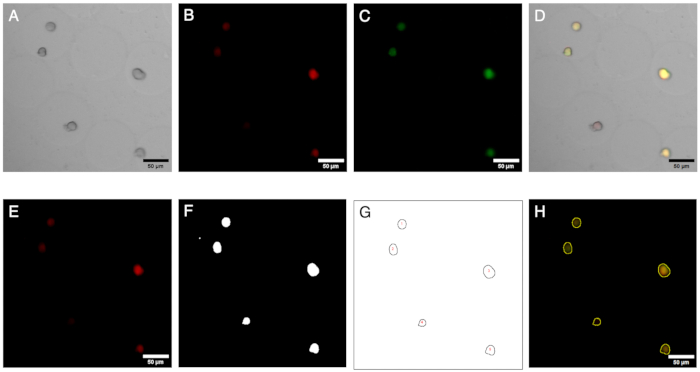
Рисунок 2: Микроскопические изображения и их анализ. Флуоресцентная визуализация и анализ колоний в микрогелях. (А–В) Каналы изображения получены с помощью светлопольной и флуоресцентной микроскопии с помощью инвертированного микроскопа. Составное изображение (D) показывает наличие отрицательной колонии (только красная флуоресценция) внутри микрогелей. (Э–Н) Результаты рабочего процесса анализа изображений. Генерируя ROI, колонии могут быть идентифицированы в красном и зеленом каналах, а сигналы могут быть количественно оценены для определения наличия отрицательных колоний. Масштабные линейки: 50 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Анализ изображений
ПРИМЕЧАНИЕ: Для анализа сигналов флуоресценции от инкапсулированных колоний и выявления редких событий изображения со светлым полем и флуоресцентной визуализацией могут быть обработаны с помощью Fiji/ImageJ (Рисунок 3). Эти шаги могут быть реализованы в макроскрипте, а значения параметров могут меняться в зависимости от оптической конфигурации.- Откройте изображения из зеленого и красного каналов. Определите прямоугольную область интереса (ROI), начиная с координат (500, 500) с шириной и высотой 2000 пикселей каждая.
ПРИМЕЧАНИЕ: Эти параметры применяются к изображениям с разрешением 3000 x 3000 пикселей, а ROI определяет область с лучшим освещением. - Обрежьте изображение до заданного прямоугольного ROI. Вычтите постоянное значение 10 из интенсивности каждого пикселя и примените к изображению фильтр сглаживания, чтобы уменьшить фоновый шум и сделать интересующие объекты более различимыми.
ПРИМЕЧАНИЕ: Для дальнейшего анализа будет использоваться только эта область. - Дублируйте изображение из красного канала и преобразуйте его в двоичную маску, чтобы идентифицировать редкие события, связанные с плазмидой. Установите пороговые значения в диапазоне от 10 до 255. Пиксели в этом диапазоне будут считаться передним планом (объектами интереса), в то время как другие будут рассматриваться как фон.
- Выполняйте морфологические операции для закрытия небольших зазоров и заполнения любых отверстий внутри интересующих объектов. Примените алгоритм водораздела для разделения перекрывающихся объектов в двоичной маске.
- Проанализируйте частицы в бинарной маске. Учитывайте только частицы размером более 30 пикселей и круговой величиной от 0,50 до 1,00. Результаты суммируются и добавляются в таблицу результатов. Сохраните набор ROI, обнаруженных в результате анализа частиц, для дальнейшей визуализации.
- Отображение сохраненных ROI на изображениях из зеленого и красного каналов. Измерьте интенсивность или другие свойства ROI на этих изображениях. Записывайте измерения в таблицу результатов и сохраняйте результаты в отдельных файлах CSV для дальнейшего статистического анализа.
- Откройте изображения из зеленого и красного каналов. Определите прямоугольную область интереса (ROI), начиная с координат (500, 500) с шириной и высотой 2000 пикселей каждая.
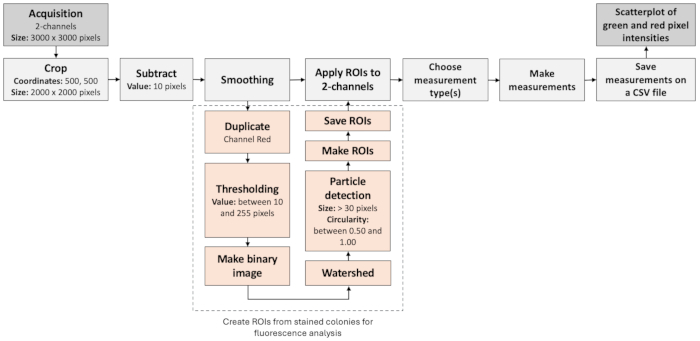
Рисунок 3: Рабочий процесс анализа изображений для выявления негативных колоний. На рисунке показан пошаговый рабочий процесс для автоматической обработки и оценки флуоресцентных изображений. Рабочий процесс основан на колокализации флуоресцентных меток, а также на анализе частиц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Сравнительный анализ агаровых пластин
ПРИМЕЧАНИЕ: Для сравнения капельного метода с традиционным планшетным анализом на шаге 2.1.8 была получена количественная оценка флуоресцентных колоний того же штамма E. coli . исполнялся с использованием чашек Петри. Это послужило аналоговым методом управления для измерения стабильности плазмид sfGFP. Смотрите также иллюстрацию метода на рисунке 1.
- Приготовьте LB-агар (без антибиотика), как описано в шаге 2.1.1 из раздела «Забор клеток». Охладите агар до 60 °C и гомогенизируйте.
- В стерильной среде насыпьте по 15 мл агаровой среды в каждую чашку Петри. Дайте пластинам застыть, частично открыв крышки, пока они не будут готовы к использованию.
- Инокулируйте три планшета по 10 мкл культуры E. coli в среду LB с OD600 0,007 ± 0,002. Равномерно распределите с помощью L-образного разбрасывателя. Инкубируйте планшеты при температуре 37 °C, закрытые и перевернутые. Подготовьте контрольную пластину без бактерий в тех же условиях.
- Через 24 часа сделайте флуоресцентные изображения пластин с помощью FluoPi, системы флуоресцентной визуализации с открытым исходным кодом (https://github.com/RudgeLab/FluoPi)15.
ПРИМЕЧАНИЕ: FluoPi состоит из камеры Raspberry Pi с синим возбуждением на длине волны 470 нм и акриловыми фильтрами возбуждения и излучения. - Вручную подсчитайте флуоресцентные и нефлуоресцентные колонии в каждой пластине, используя полученные изображения.
Результаты
Валидация инкапсуляции клеток и образования микроколоний
Инкапсуляцию клеток можно визуально подтвердить путем проведения светлопольной микроскопии микрокапель геля перед разрушением эмульсии и промывкой микрогелей. Репрезентативный результат применения эмульсии на этом этапе показан на рисунке 4.
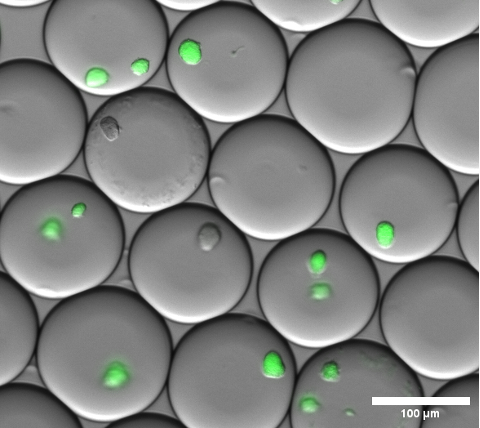
Рисунок 4: Разрез наложенного изображения флуоресцентной микроскопии. После ночной инкубации репрезентативные микроколонии sfGFP экспрессируют колонии E. coli внутри гелевых микрокапель. Использовался объектив микроскопа с 10-кратным увеличением и 0,30 НК. Масштабная линейка: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты анализа изображений
После окрашивания микрогелей и получения светлых каналов, а также флуоресцентных каналов в нескольких положениях можно визуализировать колонии, идентифицированные как негативные на исходных изображениях (см. рис. 5A). Данные, извлеченные из всех изображений одного эксперимента, могут быть построены на графике, чтобы показать соотношение флуоресценции различных колоний, выделив те, которые потеряли закодированную плазмидой флуоресценцию (см. рисунок 5B). Результаты показывают, что 100 колоний утратили свою плазмидную или плазмидную функциональность из 2785 проанализированных микроколоний, что соответствует 3,6%.
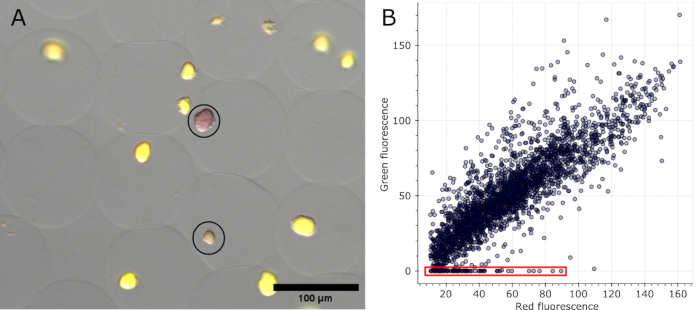
Рисунок 5: Количественная оценка отрицательных микроколоний. (A) Срез наложенного изображения флуоресцентной микроскопии. После удаления масла и окрашивания репрезентативные колонии в микрогелях, экспрессирующих sfGFP, и две отрицательные колонии показали красную флуоресценцию окрашивания ДНК (обведена черным цветом). Масштабная линейка: 100 мкм. (B) Диаграмма рассеяния значений флуоресценции отдельных микроколоний, извлеченных из 16 изображений многоканальной микроскопии. Колонии без какой-либо зеленой флуоресценции были подсчитаны как отрицательные, как указано красным цветом на графике. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Количественное определение агаровой пластины
Изображения тройных пластин показаны на рисунке 6, а нефлуоресцентные колонии обозначены белыми стрелками. На первой пластине (рисунок 6А) было показано в общей сложности 213 колоний, из которых 1 не была флуоресцентной. На второй пластине (рисунок 6B) было в общей сложности 49 колоний, без нефлуоресцентных колоний. На третьей пластине (рисунок 6C) было показано в общей сложности 252 колонии, 6 из которых не были флуоресцентными. Эти результаты соответствуют среднему коэффициенту потери колоний в плазмидах 2,3% с большим стандартным отклонением 3,2.
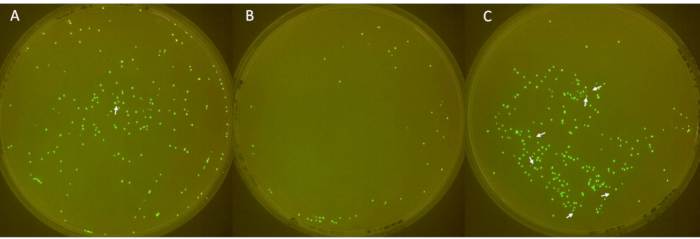
Рисунок 6: Идентификация отрицательных колоний на пластинах. (А–В) Флуоресцентные и нефлуоресцентные колонии кишечной палочки на пластинах LB-агара (диаметр: 90 мм, высота: 15 мм). Посевной материал, полученный из E. coli с sfGFP из исходного материала при температуре -80 °C, был прорезан полосами в 1-й день, культивирован антибиотиком на 2-й день и разбавлен в соотношении 1:100 ежедневно с 3-го по 6-й день для обеспечения потери плазмид. Колонии инкубировали при 37 °C в течение 24 ч и визуализировали в камере FluoPi. Нефлуоресцентные колонии были усилены с помощью GIMP и обозначены белыми стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Продемонстрирован метод на основе гелевых микрокапель для эффективной идентификации и количественного определения колоний с и без кодируемой плазмидой генетической экспрессии флуоресцентных белков, таких как sfGFP. Колонии, которые недостаточно экспрессируют плазмидный продукт, идентифицируются с помощью флуоресцентного окрашивания ДНК (в данном случае йодида пропидия), которое окрашивает все колонии и имеет различную длину волны излучения. Такая интеграция капельной микрофлюидики, гелеобразования и флуоресцентной микроскопии с использованием технологии с открытым исходным кодом позволяет выполнять расширенный рабочий процесс во многих исследовательских условиях11,13. Успешная генерация гелевых микрокапель позволяет использовать передовые рабочие процессы молекулярной биологии для отдельных клеток, включая лизис клеток, амплификацию одного генома, скрининг метаболических взаимодействий клеток, обмен средами и многое другое 8,9. Эти преимущества используются в данном протоколе для выращивания, окрашивания и анализа микроколоний более масштабируемым образом, чем в традиционных анализах на основе планшетов.
Критические шаги
Процесс инкапсуляции является важной и деликатной частью протокола. Точный контроль концентрации ингредиентов, скорости потока и давления необходим для получения однородных микрогелей в определенном диапазоне размеров и контроля среднего количества клеток в капле. Кроме того, поддержание концентрации и температуры клеточно-агарозной смеси предотвращает образование комков или преждевременное гелеобразование. Контроль температуры жидкой суспензии агарозных клеток в наконечнике для пипетки является особенно выгодной реализацией нашей аппаратной микрофлюидной рабочей станции с открытым исходным кодом, которая обеспечивает гораздо более простое и надежное генерирование микрогеля по сравнению с усилиями по контролю температуры шприцевых насосов и трубок. Поскольку клетки смешиваются с агарозной средой для выращивания перед инкапсуляцией и культивированием, микрогели агарозы должны быть получены быстро, чтобы избежать значительных изменений концентрации клеток. С этой целью была оптимизирована конструкция микрофлюидного чипа, расщепляющего капли, вдохновленная Abate et al.18.
Модификации и устранение неполадок
Для доработки исходного протокола потребовалось несколько калибровок и модификаций. Инкапсуляция агарозы является гораздо более сложной задачей, чем при использовании обычных капель типа «вода в масле», что требует разработки системы для поддержания агарозы в жидком состоянии при одновременном обеспечении однородного диапазона размеров частиц в водной фазе. Изменения вязкости агарозы из-за гелеобразования влияют на скорость потока, что приводит к увеличению размера частиц. Микроскопия требует тщательного выбора фильтров и источников света, чтобы обеспечить неперекрывающиеся сигналы возбуждения и излучения для четкой дифференциации. Первоначально DAPI был выбран для окрашивания бактерий, но его сигнал излучения перекрывался с sfGFP, в результате чего sfGFP был обнаружен в синем канале обнаружения. Мы перешли на PI, потому что его излучение хорошо отделено от sfGFP на длинных волнах (красный свет).
В то время как потеря плазмид была количественно определена с помощью предложенного метода, используемая плазмида sfGFP оказалась неожиданно стабильной, практически не демонстрируя случаев потери плазмид в первом поколении клеток, культивируемых без антибиотиков, даже в условиях стресса, таких как среда pH9 и инкубация при 40 °C. Это наблюдение согласуется с выводами других исследовательских групп 1,19. Стабильность плазмид ограничила демонстрацию полных возможностей метода по количественной оценке для начальных поколений клеточных культур, но она продемонстрировала, что метод достаточно чувствителен для обнаружения даже небольших различий в удержании плазмид. Наблюдение за высокой стабильностью плазмид в ранних поколениях имеет важное значение для капельного микрофлюидного скрининга с использованием анализа отрицательного отбора, такого как ингибирование бактерий-мишеней. Это означает, что потеря плазмидами мишеней отбора является низким источником ложноположительных результатов отбора. Поскольку капельные микрофлюидные экраны обычно на порядки превосходят другие высокопроизводительные экраны, такие как роботизированные процессы пипетирования, на порядки производительности, эти редкие события необходимо оценивать и учитывать.
Ограничения
Несмотря на свои преимущества, у представленного метода есть и ограничения. Производство микрофлюидных устройств требует опыта и тщательного внимания к деталям, а также тщательного экспериментального контроля скорости потока для обеспечения детерминированной эффективности инкапсуляции. Эти аспекты могут потребовать оптимизации для различных экспериментальных установок. В то время как этот метод основан на флуоресцентной микроскопии для обнаружения сигнала, что требует доступа к подходящему оборудованию для визуализации, это оборудование может быть изготовлено с использованием оборудования с открытым исходным кодом, что делает его более доступным. Кроме того, микрогели можно обрабатывать в коммерческой проточной цитометрии с большими форсунками, что еще больше улучшает доступность и экспериментальную производительность. Для этого цитометрического анализа также можно использовать капельные сортировщики.
Более того, хотя метод предназначен для обнаружения флуоресцентных сигналов от плазмид, красителей или других маркеров, он ограничен клетками, которые могут быть флуоресцентно мечены, что может не относиться ко всем бактериальным штаммам или экспериментальным условиям. Тем не менее, метод может быть адаптирован для использования в других типах микроскопии, таких как фазово-контрастная или светлопольная микроскопия, что позволяет использовать фенотипирование за пределами флуоресценции. Кроме того, его можно комбинировать со спектроскопическими методами, такими как ИК-Фурье или рамановская спектроскопия, расширяя его возможности по анализу химического состава и структурной информации инкапсулированных клеток. Эти адаптации расширяют диапазон его применения, делая его универсальным инструментом для различных исследовательских условий.
Значение и применение
Традиционные анализы на потерю плазмиды19 не позволяют провести точную количественную оценку соотношения клеток, потерявших свою экспрессию, информацию, которая может быть очень важна при разработке экспериментальных методов и различных биологических приложениях. Как правило, типы колоний перечисляются в анализах в агаровых пластинах, где можно получить четко определенные изолированные колонии, как показано на рисунке 4. Тем не менее, перекрывающиеся колонии трудно идентифицировать с уверенностью; В наших руках мы не всегда получаем оптимальную плотность колоний, и для получения хорошей статистики низкочастотных событий потери плазмид необходимо много планшетов. Предложенный метод предлагает более надежный подход к точному количественному определению флуоресцентных сигналов, поступающих от изолированных колоний с большим числом колоний, чем аналоговые методы с агаровой пластиной, поскольку в микрокаплях колонии развиваются отдельно, имеют меньшие размеры и легко загружаются в камеры визуализации, что позволяет проводить количественную оценку больших колоний на основе микроскопии или проточной цитометрии. Это может значительно улучшить статистическое представление метода и обеспечить интеграцию в другие рабочие процессы гелевых микрокапель.
Использование аппаратного обеспечения с открытым исходным кодом11,20 позволяет исследователям настраивать конструкцию микрофлюидной рабочей станции и точно регулировать расход; Таким образом, размер частиц подходит для различных типов клеток и экспериментальных условий. Эта гибкость распространяется на потенциальное включение других типов микроскопии, таких как фазово-контрастная или спектроскопия, что расширяет применимость метода. Способность метода оценивать стабильность плазмид в различных условиях имеет решающее значение для применений, требующих удержания плазмид без выбора антибиотиков, в определенных стрессовых условиях или при различных поколениях культур. Универсальность и адаптивность представленного метода делают его ценным для различных исследовательских приложений в таких областях, как синтетическая биология, мониторинг окружающей среды и клиническая диагностика.
Раскрытие информации
Авторы заявляют, что никакие конкурирующие финансовые интересы или личные отношения не могли повлиять на работу, представленную в этой статье.
Благодарности
Эта работа является частью финансируемых проектов, предоставленных T.W. от ANID FONDECYT Regular 1241621 и проекта Chang Zuckerberg Initiative «Латиноамериканский хаб для биовизуализации с помощью открытого оборудования». Т.В. также благодарен за финансирование со стороны CIFAR в качестве глобального стипендиата Азриэли в программе CIFAR MacMillan Multiscale Human.
Материалы
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 370533-25G | For breaking emulsion |
| 70% ethanol | For cell permeabilization | ||
| Agar-Agar | Winkler | 9002-18-0 | |
| Biopsy Punch | 0.75 mm and 1.8 mm | ||
| Blue LED transilluminator | IO Rodeo | ||
| Culture tube | 15 mL | ||
| Desiccator | With vacuum pump | ||
| Disposable cup | For mixing PDMS | ||
| Disposable fork | For mixing PDMS | ||
| E. coli TOP10 strain | |||
| FluoPi microscope | https://github.com/wenzel-lab/FluoPi | Green fluorescence imaging system for analyzing plates | |
| Fluorinated Oil | 3M | Novec 7500 | |
| Glass slide heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of microfluidic chip | |
| Glass Slides | |||
| Hotplate | Mechanic | For evaporating Aquapel | |
| Image analysis software | Fiji/ImageJ | 2.14.0/1.54f | |
| Incubator | Mundo Lab | MLAB Scientific / For incubation of plates and microgels | |
| Isopropanol | For cleaning glass slides | ||
| Kanamycin | 100 ug/mL concentration | ||
| L-shaped spreader | For spreading bacteria on agar plates | ||
| Master mold | Chip design on silicone or glass wafer | ||
| Microtubes | 2 mL | ||
| NaCl solution | Sodium chloride 0.9% w/v | ||
| Open-source hardware strobe-enhanced microscopy stage | https://github.com/wenzel-lab/flow-microscopy-platform | For bright-field microscopy | |
| Petri dish | Citotest | 2303-1090 | 90 x 15 mm |
| Pipette tip heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of pipette tip | |
| Plasma Cleaner | Diener Electronic | 117056 | For bonding PDMS with a glass slide |
| Plasmid pCA_Odd1 | Encodes sfGFP and kanamycin resistance | ||
| Polytetrafluoroethylene (PTFE) tubing | Adtech Polymer Engineering Ltd | ||
| Pre-mixed Luria Bertoni medium | US Biological Life Science | L1520 | |
| Propidium iodide (PI) | For staining | ||
| Raspberry Pi-based pressure and flow controller system | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller | For controlling pressure and flow rates | |
| Silicone elastomer base | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Silicone elastomer curing agent | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Spectrophotometer | For measuring absorbance | ||
| SQUID microscope | https://github.com/wenzel-lab/SQUID-bioimaging-platform | Multi-fluorescence imaging system for analyzing stained cells | |
| Sterile loop | For picking a colony and streaking plating | ||
| Surfactant | Sphere Fluidics | Pico-Surf | |
| Syringes | NIPRO | With filters and tubing | |
| Temperature-controlled shaker | Mundo Lab | DLAB HCM100-Pro | |
| Tweezer | |||
| Ultra-low gelling temperature agarose | Sigma-Aldrich | A2576-5G | For generating hydrogel beads |
| Water repelent solution (fluoroalkyl silane) | Aquapel | For treating microchannels of PDMS device |
Ссылки
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under non-selective conditions maintains antibiotic resistance. Nat Commun. 10 (1), 2595 (2019).
- Rodríguez-Beltrán, J., DelaFuente, J., León-Sampedro, R., MacLean, R. C., Millán, &. #. 1. 9. 3. ;. S. Beyond horizontal gene transfer: The role of plasmids in bacterial evolution. Nat Rev Microbiol. 19 (6), 347 (2021).
- Wein, T., Dagan, T. Plasmid evolution. Curr Biol. 30 (19), R1158-R1163 (2020).
- Chen, S., Larsson, M., Robinson, R. C., Chen, S. L. Direct and convenient measurement of plasmid stability in lab and clinical isolates of E. coli. Sci Rep. 7 (1), 4788 (2017).
- Rouches, M. V., Xu, Y., Cortes, L. B. G., Lambert, G. A plasmid system with tunable copy number. Nat Commun. 13 (1), 3908 (2022).
- Silva, F., Queiroz, J. A., Domingues, F. C. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli. Biotechnol Adv. 30 (3), 691-708 (2012).
- Wang, R., et al. Construction of novel pJRD215-derived plasmids using chloramphenicol acetyltransferase (cat) gene as a selection marker for Acidithiobacillus caldus. PLoS ONE. 12 (8), e0183307 (2017).
- Moragues, T., et al. Droplet-based microfluidics. Nat Rev Methods Primers. 3 (1), 32 (2023).
- Vitalis, C., Wenzel, T. Leveraging interactions in microfluidic droplets for enhanced biotechnology screens. Current Opinion in Biotechnology. 82, 102966 (2023).
- Sinha, N., Subedi, N., Wimmers, F., Soennichsen, M., Tel, J. A pipette-tip based method for seeding cells to droplet microfluidic platforms. J Vis Exp. (144), e57848 (2019).
- Wenzel, T. Open hardware: From DIY trend to global transformation in access to laboratory equipment. PLOS Biol. 21 (1), e3001931 (2023).
- Murillo, L. F. R., Wenzel, T. Welcome to the journal of open hardware. J Open Hardware. 1 (1), (2017).
- Shin, J. H., Choi, S. Open-source and do-it-yourself microfluidics. Sens Actuators B Chem. 347, 130624 (2021).
- Pryszlak, A., et al. Enrichment of gut microbiome strains for cultivation-free genome sequencing using droplet microfluidics. Cell Rep Methods. 2 (1), 100137 (2021).
- Pollak, B., et al. Universal loop assembly: open, efficient and cross-kingdom DNA fabrication. Biology. 5 (1), (2020).
- Volkmer, B., Heinemann, M. Condition-dependent cell volume and concentration of Escherichia coli to facilitate data conversion for systems biology modeling. PLoS ONE. 6 (7), e23126 (2011).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , (2020).
- Abate, A. R., Weitz, D. A. Faster multiple emulsification with drop splitting. Lab Chip. 11 (11), 1911-1915 (2011).
- Lau, B. T. C., Malkus, P., Paulsson, J. New quantitative methods for measuring plasmid loss rates reveal unexpected stability. Plasmid. 70 (3), 353-361 (2013).
- Oellermann, M., et al. Open hardware in science: The benefits of open electronics. Integr Comp Biol. 62 (4), 1061-1075 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены