Method Article
使用开源液滴微流控进行质粒稳定性分析
摘要
提出了一种可访问的开源微流控工作流程,用于细菌中质粒保留的并行分析。通过使用荧光显微镜来定量凝胶微滴内单细胞微菌落中质粒的存在,该方法为传统平板计数提供了一种精确、可访问且可扩展的替代方案。
摘要
质粒通过能够在各种生物体中引入和表达外源基因,从而促进细胞群内和细胞群之间的生物回路和通路的构建,在合成生物学中发挥着至关重要的作用。对于许多应用,在没有抗生素选择的情况下保持功能性质粒至关重要。本研究引入了一种基于开放硬件的微流控工作流程,通过在凝胶微滴中培养单细胞并使用荧光显微镜定量微菌落来分析质粒保留。这种方法允许对大量液滴和微菌落进行平行分析,与传统的微孔板计数相比,具有更强的统计能力,并能够将分析整合到其他液滴微流体工作流程中。通过使用表达荧光蛋白的质粒和非特异性荧光 DNA 染色剂,可以根据质粒丢失或荧光标记物表达来鉴定和区分单个集落。值得注意的是,这种通过开源硬件实现的先进工作流程为样品和微流控芯片提供了精确的流量控制和温度管理。这些功能增强了工作流程的易用性、稳健性和可访问性。虽然该研究侧重于将 大肠杆菌 作为实验模型,但该方法的真正潜力在于其多功能性。它适用于需要从质粒或染色剂中定量荧光信号的各种研究,以及其他应用。开源硬件的采用拓宽了在各种研究环境中使用可访问技术进行高通量生物分析的潜力。
引言
质粒是原核细胞中必不可少的遗传元件,通过横向 DNA 转移和快速适应环境变化为微生物进化做出重大贡献 1,2。这些染色体外 DNA 分子携带的基因可提供有利的特性,例如抗生素耐药性、代谢功能和毒力因子,使其在微生物学研究、合成生物学和进化研究中具有价值2。然而,由于复制和分离的代谢负担,细胞群中的质粒维持具有挑战性,通常会导致质粒丢失而没有选择压力3。此外,稳定遗传需要毒素-抗毒素和分配系统等机制,这增加了质粒维持的复杂性。评估质粒在不同条件下的稳定性对于以质粒作为主要研究元素的基础研究和实际应用都至关重要 4,5。目前大多数评估质粒稳定性的方法都有很大的局限性:基于流式细胞术的方法提供间接的群体水平数据,需要昂贵的设备,并且缺乏菌落的直接可视化6。大量转录组学和蛋白质组学方法成本高昂,仅提供平均细胞反应,并且不能直接定量单个菌落中的质粒保留6。连续稀释和传代等传统方法简单但耗时,并且缺乏精度和可代表性7。总体而言,定量推断或预测随时间或选择压力保留特定功能质粒的菌落数量仍然具有挑战性。
为了应对这些挑战,提出了一种利用开放式硬件研究仪器的新型微流体工作流程,以大 肠杆菌 为模型来量化多个分离的细菌菌落中的荧光信号。该方法允许在各种条件或选择压力下对质粒保留进行高通量和精确分析。单细胞分离分析提供了一种精确的方法来作分离的菌落,产生有关质粒定量的敏感数据,有助于评估保留率和丢失率4。
微流体,尤其是液滴微流体,已成为在受控环境中封装和作单个细胞的强大工具8。具体来说,微凝胶液滴可以封装单细胞,用于高通量和精确分析,而无需保持液滴悬浮在油中 9,从而允许在确定的微环境中对质粒动力学进行受控研究。直接从移液器吸头10 封装细胞悬液后,可以使用荧光技术监测液滴内微菌落的生长,从而能够详细分析不同选择压力下的质粒保留和分离3。
与传统的批量培养技术相比,该方法的优势包括提高精度、减少变异性以及能够进行高通量分析。开源微流体技术克服了昂贵的专有系统的局限性,例如可访问性、适应性和维护问题,这些问题通常会阻碍研究进展 11,12,13。通过演示如何使用开源仪器在微凝胶中应用质粒截留分析的先进实验工作流程,为质粒生物学、合成生物学应用和微流体液滴分析技术的研究提供了一种可访问且可靠的方法。
总之,本文提出了一种可访问的方法,用于定量评估大 肠杆菌 中质粒的保留,具有高统计功效。该方法的功能使其成为促进对质粒生物学的理解和改进合成生物学应用的宝贵工具。
研究方案
图 1提供了评估 大肠 杆菌质粒稳定性的示意图概述。材料 表中列出了所用试剂和所用设备的详细信息。原始数据和可视化脚本可在 https://doi.org/10.17605/OSF.IO/6YWJK 获取。
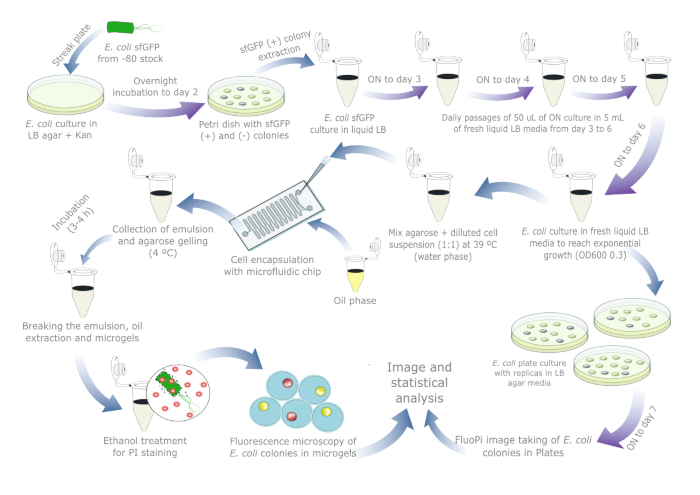
图 1:评估大肠杆菌质粒稳定性的每日方案。蓝色箭头表示白天的步骤,紫色箭头表示过夜孵化。每种液体和琼脂孵育均在 37 °C 下与单独的阴性对照管/板一起进行。请注意,对于可能已经发生质粒丢失的真实世界样品,不需要细胞培养制备和传代,因此如果包括板参考培养,则应将方案减少到一两天。请单击此处查看此图的较大版本。
1. 微流控芯片制备
注意:在该协议中,不同的商业或定制芯片设计可用于细胞封装,其能够在滴落状态下产生直径小于 100 μm 的油包水液滴。在本研究中,芯片的设计和制造方法与之前发布的报告14 中报告的设计和制造方法相同(参见文章数据 https://doi.org/10.17605/OSF.IO/6YWJK)。
- 使用专为凝胶微滴生成而设计的母模获取或制备 PDMS-on-glass 微流控芯片。
- 将防水溶液(氟烷基硅烷)注入芯片中,使内部微通道具有疏水性。将溶液注入进样口,并确保所有通道都充满液体。让充满的通道静置约 30-60 秒。
- 通过将空气排入内部微通道,从设备中取出溶液。使用空空气注射器冲洗空气,并在其他端口上使用吸水剂擦拭以防止飞溅。
- 将处理过的装置在 65 °C 下在热板上烘烤 15 分钟以蒸发多余的溶液。或者,将设备存放在冰箱 (4 °C) 中过夜。
注意:微流控芯片已准备就绪。该协议可以在此处暂停。
2. 样品制备
- 细胞收获
注:液滴中的细胞培养可以提供有关质粒动力学的相关数据。作为实验细菌模型, 大肠 杆菌 TOP10 菌株与编码超级折叠绿色荧光蛋白 (sfGFP) 和卡那霉素抗性15 的质粒pCA_Odd1(参见沉积数据 https://doi.org/10.17605/OSF.IO/6YWJK)一起使用。细菌、质粒和生长培养基可能因实验系统而异。- 通过将 25 g 预混 LB 和 12 g 琼脂溶解在 800 mL 蒸馏水 (dH2O) 中来制备 Luria Bertoni (LB)-琼脂。此外,通过将 25 g 预混 LB 溶解在 800 mL dH2O 中来制备液体 LB 培养基。高压灭菌溶液并让它们冷却至 60 °C 左右。 移至无菌环境,例如流动罩以进行下一步。
注:预混的 LB 粉末含有 10 g 胰蛋白胨、5 g 酵母提取物和 10 g NaCl。也可以使用自混合的 LB 琼脂培养基。 - 将 50 μL 卡那霉素(制备浓度为 100 mg/mL)添加到 50 mL 液体 LB-琼脂(终浓度:100 μg/mL)中。通过将试管倒置几次来混合溶液。
- 每个培养皿 (90 mm x 15 mm) 倒入约 15 mL 液体 LB-琼脂。准备两个板:一个用于阴性对照(污染监测),一个用于实验培养。让 LB 琼脂溶液冷却并固化,直到两个板上的颜色从深色变为透明。
- 使用无菌定量环,使用条纹板技术将 大肠杆菌 菌株铺布在培养板上。使用后立即将甘 油原液 放回 –80 °C 中。关闭两个板并在 37 °C 下孵育过夜(第 1 天)。
- 第 2 天,检查阴性对照板中是否有任何菌落作为污染信号(如果是,请重复 2.1.4 中的步骤)。使用蓝光透射仪鉴定 大肠杆菌 板上的单个荧光菌落,以制备液体培养液。
- 在无菌条件下,打开板,使用无菌定量环或 200 μL 移液器吸头挑选选定的菌落,并将其转移到装有 5 mL 新鲜液体 LB 培养基和 5 μL 卡那霉素(制备为 100 mg/mL)的培养管中。准备一个没有接种物的阴性对照管用于污染监测。将培养管在 37 °C 下孵育过夜,同时以 220 rpm 振荡。
- 在不含抗生素的培养基中将样品再传代 3 天,以模拟可能发生质粒丢失的条件。在第 3 天、第 4 天和第 5 天,将 50 μL 过夜培养物转移到含有 5 mL 不含抗生素的液体 LB 的新培养管中。在 37 °C 下孵育过夜,并以 220 rpm 振荡。重复此步骤直至第 6 天,在总共 4 次传代后获得最终的 5 mL 培养物。
- 将 50 μL 从最终过夜培养物转移到装有 2 mL 液体 LB 的新培养管中。使用分光光度计(大约 3-4 小时),让培养物达到 0.3 的光密度 (OD 600)。
注意:应在 OD 600 增加之前使用新鲜培养物,以确保细菌处于对数生长期。如果未达到所需的浓度,请从步骤 2.1.8 开始重复。
- 通过将 25 g 预混 LB 和 12 g 琼脂溶解在 800 mL 蒸馏水 (dH2O) 中来制备 Luria Bertoni (LB)-琼脂。此外,通过将 25 g 预混 LB 溶解在 800 mL dH2O 中来制备液体 LB 培养基。高压灭菌溶液并让它们冷却至 60 °C 左右。 移至无菌环境,例如流动罩以进行下一步。
- 用于包埋的细胞-琼脂糖混合物
注:浓度控制对于确保单细胞液滴包埋至关重要。可以根据目标包埋速率和特定液滴体积计算所需的细胞浓度,如以下示例所示:
液滴体积(V降):如果产生 50 μm 液滴
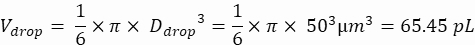
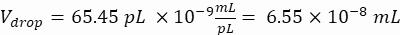
每个液滴所需的细胞数 (Cpd):平均每 5 个液滴 1 个细胞(0.2 个细胞/液滴)

稀释因子:初始细胞浓度在步骤 2.1.8 中获得
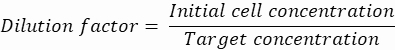
在这里,产生 50 μm 或 100 μm(无液滴分裂)液滴 (65–520 pL),其中每 5 个液滴中约有 1 个细胞被封装,或每个液滴中约有 1.6 个细胞而不被分裂。对于 大肠杆菌,使用 1 OD600 单位的转换因子≈ 7.8 x 108 个细胞/mL16。将步骤 2.1.8 中的 OD 600 值乘以转换因子,以获得培养物的初始浓度(细胞/mL)。- 将制备好的培养原液中的大 肠杆菌 重悬于不含卡那霉素的液体 LB 中,浓度为 6.2e+6 个细胞/mL(直径为 50 μm 液滴的目标浓度)。将细菌悬浮液保持在室温下,直到与琼脂糖混合。
注:抗生素会抑制阴性微菌落形成,因此必须将其从培养基中排除以进行质粒丢失实验。 - 通过在浓度为 2% (w/v) 的液体 LB 中将其加热至 90 °C 来制备超低胶凝温度琼脂糖。在温控摇床中摇动混合物 10 分钟。
- 将恒温摇床的温度降低至39°C以冷却琼脂糖溶液。同时,将细菌悬浮管放入恒温摇床中 4 分钟以将其加热至 39 °C。
- 将细菌和琼脂糖悬浮液以 1:1 的比例混合,以获得 1% (w/v) 的琼脂糖浓度,细胞悬液为 3.1e+6 个细胞/mL。使用液体 LB 代替细菌悬浮液制备具有相同琼脂糖浓度的阴性对照溶液(污染监测)。
注:琼脂糖细胞悬液应快速使用,以避免由于细菌生长而引起的浓度变化。将热振荡器保持在 39 °C 以保持琼脂糖液体,直到加载到吸头加热器中以产生液滴。
- 将制备好的培养原液中的大 肠杆菌 重悬于不含卡那霉素的液体 LB 中,浓度为 6.2e+6 个细胞/mL(直径为 50 μm 液滴的目标浓度)。将细菌悬浮液保持在室温下,直到与琼脂糖混合。
3. 高通量单菌落培养
- 实验装置
- 构建或获取完整的开源流量平台(参见 https://doi.org/10.17605/OSF.IO/6YWJK),包括气体压力驱动器和流量传感器。或者,构建更简单的开源硬件频闪增强显微镜载物台(参见构建说明 https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ 和项目存储库 https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage)。
注意:也可以使用带有商用显微镜、高速相机和样品加热功能的传统微流体装置。 - 集成基于 Raspberry Pi 的开源压力和流量控制器系统,如指定存储库 (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller) 中所述。
注意:模块控件图示并备份到数据存储库 (https://doi.org/10.17605/OSF.IO/6YWJK.作为替代方案,可以采用传统的压力控制器或高扭矩注射泵。 - 在设置中包括载玻片和移液器吸头加热器 (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring),以控制琼脂糖细胞样品进入芯片时的温度。
注:数据存储库(https://github.com/wenzel-lab/flow-microscopy-platform 和 https://doi.org/10.17605/OSF.IO/6YWJK)上所示的这些加热器是开源控制器系统的一个重要功能,可实现琼脂糖的工作,在其他商业系统中可能不可用。
- 构建或获取完整的开源流量平台(参见 https://doi.org/10.17605/OSF.IO/6YWJK),包括气体压力驱动器和流量传感器。或者,构建更简单的开源硬件频闪增强显微镜载物台(参见构建说明 https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ 和项目存储库 https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage)。
- 单细胞封装
- 将微流控芯片放置在频闪增强显微镜载物台上,确保液滴生成连接(水相和油相的交点)可见。
- 使用控制软件界面将移液器吸头加热器和载玻片加热器设置为 40 °C。
- 使用带有管道和 PDMS 塞的注射器将 1% 琼脂糖混合物和细胞悬液加载到 200 μL 移液器吸头中。将尖端插入尖端加热器,并将其放在微流体芯片中水相的入口处。将吸头的 PDMS 密封件更换为连接到流量控制系统管路的 PDMS 密封件,并开始输注细胞悬液。
- 将出口管端插入废液管中,并在用户界面上设置两相的流速或压力,以将流体缓慢输送到微流体通道。水相使用 200 μL/h (180 mbar),油相使用 1700 μL/h (320 mbar)。等待 1 分钟以稳定液滴的产生。
注:压力值取决于芯片设计的通道大小,并且可能必须针对不同的液滴发生液络部设计调整流量值。 - 液滴生成稳定后,将废液和收集管转移到收集管中。继续收集液滴,直到样品储液槽为空。重复步骤 3.2.3 至 3.2.5 以封装步骤 2.2.4 中的阴性对照溶液。
注意:样品采集应在 15 分钟内完成。 - 在液滴产生过程中将收集管储存在冰上,或在实验后将它们置于 4 °C 下 1 小时,以使琼脂糖在液滴内凝胶化。
注意:如果微通道保持畅通并且加载了相同的悬浮液,则可以重复使用微流控芯片。完成乳剂生成后丢弃移液器吸头(步骤 3.2.3-3.2.5)。
- 菌落生长和乳化释放
- 将含有细菌的凝胶微滴和液滴中的阴性对照转移到设定为37°C的孵育室中。
- 将微滴孵育至少 4 小时或过夜,以允许足够的菌落生长。 通过 明场显微镜确认阴性对照没有污染迹象。
- 为了从乳剂中释放菌落,使用移液管或带针头的注射器(此处使用 21 G 号针头)从凝胶微滴乳液下方去除尽可能多的油。
- 将 50 μL 凝胶微滴转移到新的微管中,并将其储存在 4 °C 以用于进一步的液滴分析。向剩余的乳剂中加入氟化油与 1H、1H、2H、2H-全氟-1-辛醇 (PFO) 的 1:1 混合物,其体积等于乳剂。
- 在乳液顶部添加约 200 μL 磷酸盐缓冲盐水 (PBS) 缓冲液或 0.9% w/v NaCl 缓冲液。涡旋混合物,并在定速离心机中短暂旋转。
- 小心地从液体界面底部去除油相,并从顶部丢弃 100 μL PBS。重复步骤 3.3.4–3.3.5,在 PBS 缓冲液中获得洗涤的微凝胶,油残留最少或无油残留。
注意:微凝胶沉淀在液体界面处;避免将它们与油相一起去除。
4. 单菌落分析
- 细胞染色
注:许多不同的染色剂组合适用于此方案。从本质上讲,应选择颜色与质粒编码的荧光蛋白不同的 DNA 或细胞壁染色剂,并且可以使用荧光显微镜上可用的滤光片组合进行分析。在这里,用碘化丙啶 (PI) 对细胞的 DNA 进行染色,以区分其荧光与质粒上编码的绿色荧光蛋白,但可以使用许多其他 DNA 染料。
注意:PI 是一种潜在的致癌物,必须使用适当的个人防护设备进行处理。按照当地法规安全处置染料。- 在室温下以约 80 x g 的速度离心洗涤的微凝胶 5 分钟。使用移液管弃去上清液。
- 将 50 μL 微凝胶转移到新的微管中,作为乙醇处理的阴性对照。
注:PI 染色仅进入膜受损的细胞,例如受乙醇处理影响的细胞。 - 向剩余的微凝胶中加入等体积的 70% 乙醇,并与涡旋短暂混合。在室温下孵育 15 分钟以透化细菌膜以进行 PI 染色。重复步骤 4.1.1。
- 向微凝胶中加入等体积的 0.9% w/v NaCl 并短暂涡旋。重复步骤 4.1.1。
- 向两个微管样品中加入 2 μL PI (1 mg/mL)。充分混合并在室温下避光孵育 15 分钟。
注:如果阴性对照 通过 荧光显微镜显示任何红色荧光信号,则菌落的完整性可能在前面的步骤中暴露于其他溶液时受到损害。
- 显微术
注意:用倒置落射荧光显微镜对液滴和微凝胶进行成像,以获得微凝胶中液滴大小分布和细菌菌落的荧光(图 2)。在这里,开源倒置显微镜平台 (https://github.com/wenzel-lab/SQUID-bioimaging-platform)17 与 10x 0.3NA 物镜、用于明场照明的白色 LED 阵列和用于激发的 470nm LED 一起使用。商用落射荧光显微镜可用于对液滴和微凝胶进行成像。需要校准,因为照明和滤光片因型号、品牌和使用的荧光蛋白而异。- 将 2 μL 凝胶微滴转移到成像室载玻片中,并添加 5 μL 氟化油以帮助形成单层液滴以实现最佳成像。
注:细胞计数室或简单的微流体室有助于将乳液薄薄地扩散并减慢干燥过程。 - 在显微镜上,从顶部激活白色 LED 矩阵照明以进行明场成像。安装准备好的载玻片,聚焦在样品上,并找到单层液滴。捕获明场图像。
- 在不移动样品的情况下,通过切换到 470 nm LED 进行激发来捕获菌落的荧光图像。调整滤光片转盘,使其与用于 sfGFP 成像的绿色波长滤光片对齐。扫描包含单层液滴的所有区域并重复步骤 4.2.2-4.2.3 以确保液滴分析的统计稳定性。
- 将 2 μL 染色的微凝胶转移到成像室芯片中,并将 5 μL 的 0.9% w/v NaCl 转移到成像室芯片中,以帮助形成单层微凝胶。密封芯片的入口和出口,以防止成像过程中蒸发。
注:蒸发会影响荧光标记的共定位。建议使用微流体室进行长时间成像。 - 重复步骤 4.2.2–4.2.3。调整用于 PI 成像的红色波长间隔滤光片并捕获相应的图像。
- 在一个位置完成成像后,在载玻片上找到带有单层微凝胶的下一个合适区域,并重复成像过程,以确保样品的统计稳健性和全面分析。
- 将 2 μL 凝胶微滴转移到成像室载玻片中,并添加 5 μL 氟化油以帮助形成单层液滴以实现最佳成像。
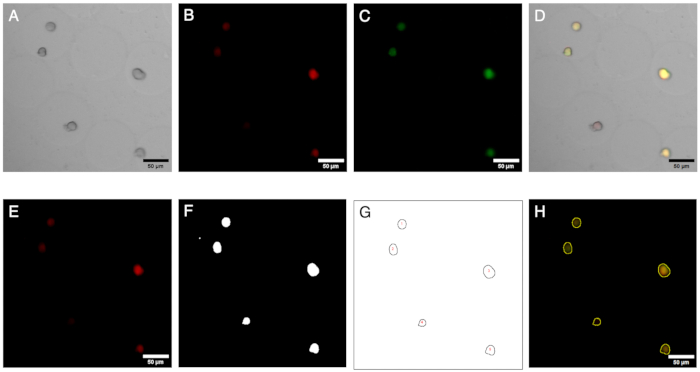
图 2:显微镜图像及其分析。微凝胶中菌落的荧光成像和分析。(A-C)使用倒置显微镜 通过 明场和荧光显微镜获取的图像通道。合成图像 (D) 显示微凝胶内存在阴性菌落(仅红色荧光)。(东至半)图像分析工作流程的结果。通过生成 ROI,可以在红色和绿色通道上识别菌落,并且可以量化信号以定义负菌落的存在。比例尺:50 μm。 请点击此处查看此图的较大版本。
- 图像分析
注:为了分析来自包封菌落的荧光信号并识别罕见事件,可以使用 Fiji/ImageJ 处理来自明场和荧光成像的图像(图 3)。这些步骤可以在宏脚本中实现,并且参数值可能会因光学配置而异。- 打开来自绿色和红色通道的图像。定义一个从坐标 (500, 500) 开始的矩形感兴趣区域 (ROI),宽度和高度各为 2000 像素。
注意:这些参数适用于 3000 x 3000 像素图像,ROI 定义具有更好照明的区域。 - 将图像裁剪为定义的矩形 ROI。从每个像素的强度中减去一个常数值 10,然后对图像应用平滑滤镜,以减少背景杂色并使感兴趣的对象更加清晰。
注意:只有此区域将用于进一步分析。 - 从红色通道复制图像并将其转换为二进制掩码,以识别与质粒相关的罕见事件。将阈值设置在 10 到 255 之间。此范围内的像素将被视为前景(感兴趣的对象),而其他像素将被视为背景。
- 执行形态学作以闭合小间隙并填充感兴趣对象内的任何孔。应用分水岭算法来分隔二进制掩码内的重叠对象。
- 分析二进制掩码中的粒子。仅考虑大小大于 30 像素且圆度在 0.50 到 1.00 之间的颗粒。结果被汇总并添加到结果表中。保存颗粒分析检测到的 ROI 集,以便进一步可视化。
- 在来自绿色和红色通道的图像上显示保存的 ROI。测量这些图像中 ROI 的强度或其他属性。在结果表中记录测量结果,并将结果保存在单独的 CSV 文件中,以便进一步进行统计分析。
- 打开来自绿色和红色通道的图像。定义一个从坐标 (500, 500) 开始的矩形感兴趣区域 (ROI),宽度和高度各为 2000 像素。
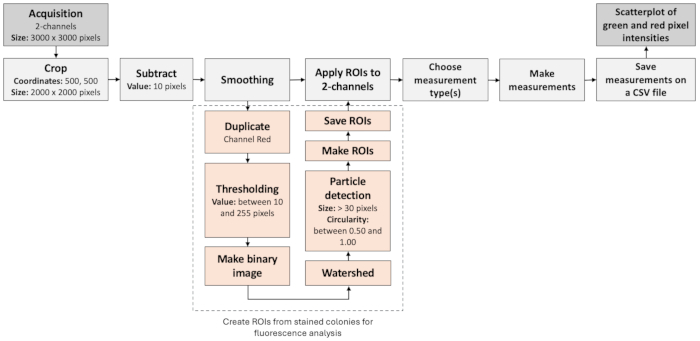
图 3:用于识别阴性菌落的图像分析工作流程。该图说明了自动处理和评估荧光图像的分步工作流程。该工作流程基于荧光标记的共定位以及颗粒分析。 请单击此处查看此图的较大版本。
5. 琼脂板比较测定
注:为了将液滴法与传统平板测定法进行比较,在步骤 2.1.8 中获得相同 大肠杆菌 菌株的荧光菌落的定量。使用培养皿进行。这用作测量 sfGFP 质粒稳定性的模拟对照方法。另请参见 图 1 中的方法图示。
- 按照细胞收获部分的步骤 2.1.1 中的说明制备 LB 琼脂(不含抗生素)。将琼脂冷却到 60 °C 以下并匀浆。
- 在无菌环境中,将 15 mL 琼脂培养基倒入每个培养皿中。让板部分打开盖子凝固,直到它们准备好使用。
- 在 LB 培养基中接种三个板,每个板 10 μL 大 肠杆菌 培养物,OD 600 为 0.007 ± 0.002。使用 L 形撒布机均匀涂抹。将板在 37 °C 下孵育,关闭并倒置。在相同条件下准备无细菌的对照板。
- 24 小时后,使用开源荧光成像系统 FluoPi (https://github.com/RudgeLab/FluoPi)15 捕获板的荧光图像。
注意:FluoPi 由一个 Raspberry Pi 相机组成,该相机具有波长为 470 nm 的蓝色激发光以及丙烯酸激发和发射滤光片。 - 使用捕获的图像手动计数每个板中的荧光和非荧光菌落。
结果
细胞包封和微集落形成的验证
在打破乳液并洗涤微凝胶之前,可以通过对凝胶微滴进行明场显微镜检查来目视确认细胞包埋。该步骤中乳剂的代表性结果如图 4 所示。
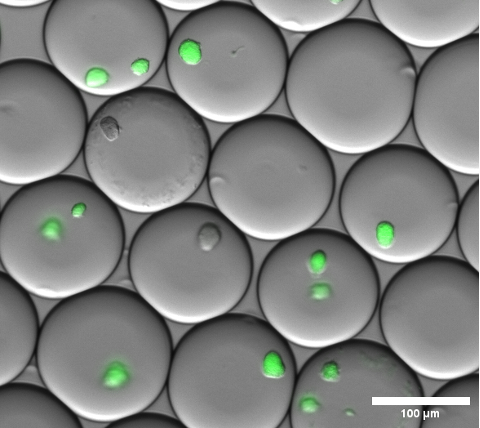
图 4:荧光显微镜叠加图像的截面。孵育过夜后,凝胶微滴内表达 大肠杆菌 菌落的 sfGFP 的代表性微菌落。使用放大倍率为 10 倍且 NA 为 0.30 的显微镜物镜。比例尺:100 μm。 请单击此处查看此图的较大版本。
图像分析结果
一旦微凝胶被染色和明场,以及在多个位置获取的荧光通道,就可以可视化在原始图像中被识别为阴性的菌落(参见 图 5A)。可以从一个实验的所有图像中提取的数据绘制出来,以显示各种菌落的荧光比率,突出显示那些丢失质粒编码荧光的菌落(参见 图 5B)。结果表明,在总共 2785 个分析的微菌落中,有 100 个菌落失去了质粒或质粒功能,相当于 3.6%。
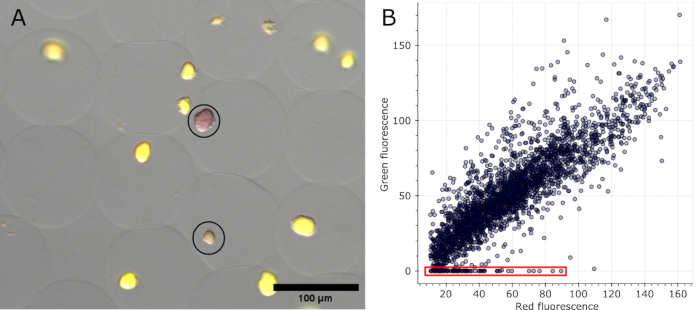
图 5:阴性微菌落的定量。(A) 荧光显微镜叠加图像的切片。除油和染色后,表达 sfGFP 的微凝胶中的代表性菌落和两个阴性菌落显示出 DNA 染色的红色荧光(黑色圆圈)。比例尺:100 μm。(B) 从 16 张多通道显微镜图像中提取的单个微菌落的荧光值散点图。没有任何绿色荧光的菌落被计为阴性,如图中的红色所示。 请单击此处查看此图的较大版本。
琼脂板定量
一式三份板的图像如图 6 所示,非荧光菌落由白色箭头表示。第一个板(图 6A)总共显示 213 个菌落,其中 1 个没有荧光。第二个板(图 6B)共有 49 个菌落,没有非荧光菌落。第三个板(图 6C)显示总共 252 个菌落,其中 6 个没有荧光。这些结果对应于 2.3% 的平均菌落质粒丢失率,大标准差为 3.2。
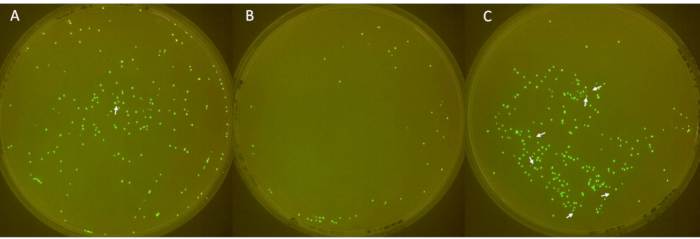
图 6:平板上阴性菌落的鉴定。(A-C)LB 琼脂平板上的荧光和非荧光大肠杆菌菌落(直径:90 mm,高度:15 mm)。接种物来源于大肠杆菌和 -80 °C 原液的 sfGFP,第 1 天划线,第 2 天用抗生素培养,并从第 3 天至第 6 天每天以 1:100 稀释以允许质粒损失。将菌落在 37 °C 下孵育 24 小时,并在 FluoPi 室中成像。用 GIMP 增强非荧光菌落,并用白色箭头表示。请单击此处查看此图的较大版本。
讨论
基于凝胶微滴的方法被证明可以有效地识别和定量有和没有质粒编码的荧光蛋白(如 sfGFP)基因表达的菌落。使用荧光 DNA 染色剂(此处为 Propidium Iodide)鉴定不充分表达质粒产物的菌落,该染色剂对所有菌落进行染色,并具有不同的发射波长。液滴微流体、胶凝和荧光显微镜的这种集成,利用开源技术,可以在许多研究环境中执行先进的工作流程11,13。成功制备凝胶微滴可实现先进的分子生物学单细胞工作流程,包括细胞裂解、单基因组扩增、代谢细胞相互作用筛选、培养基更换等 8,9。这些优势在该方案中用于以比传统基于板的检测更具可扩展性的方式生长、染色和分析微菌落。
关键步骤
封装过程是协议中关键而微妙的部分。需要精确控制成分浓度、流速和压力,以在特定尺寸范围内产生均匀的微凝胶,并控制每个液滴的平均细胞数。此外,保持细胞-琼脂糖混合物的浓度和温度可防止结块或过早凝胶化。移液器吸头中液体琼脂糖细胞悬液的温度控制是我们开源硬件微流体工作站的一个特别有利的实现方式,与控制注射泵和管道的温度相比,它可以提供更简单、更稳定的微凝胶生成。由于细胞在封装和培养前与琼脂糖生长培养基混合,因此必须快速生成琼脂糖微凝胶,以避免细胞浓度的主要变化。为此,受 Abate 等人启发的液滴分裂微流体芯片设计进行了优化18。
修改和故障排除
需要进行多次校准和修改以改进原始方案。琼脂糖的包埋比常规的油包水液滴更具挑战性,需要设计一个系统,将琼脂糖保持在液态,同时确保水相流达到均匀的粒径范围。凝胶化引起的琼脂糖粘度变化会影响流速,从而导致颗粒尺寸变大。显微镜需要仔细选择滤光片和光源,以确保激发和发射信号不重叠,从而实现清晰的区分。最初选择 DAPI 对细菌进行染色,但其发射信号与 sfGFP 重叠,导致 sfGFP 在蓝色检测通道中被检测到。我们改用 PI,因为它的发射与长波长(红光)的 sfGFP 分离良好。
虽然使用所提出的方法量化了质粒损失,但所使用的 sfGFP 质粒出乎意料地稳定,即使在 pH9 培养基和 40 °C 孵育等应激条件下,在没有抗生素培养的第一代细胞中也几乎没有显示任何质粒丢失实例。 这一观察结果与其他研究小组的发现一致 1,19。质粒稳定性限制了该方法对初始细胞培养物世代的完全定量能力的证明,但它确实表明该方法足够灵敏,可以检测到质粒保留的微小差异。在早期世代中观察高质粒稳定性对于使用负选择测定法(例如靶细菌抑制)的液滴微流控筛选具有重要意义。这意味着选择靶标的质粒损失是假阳性选择结果的低来源。由于液滴微流控筛选的通量通常比其他高通量筛选(例如移液机器人工作流程)高出几个数量级,因此需要评估和考虑这些罕见事件。
局限性
尽管有其优点,但所提出的方法存在局限性。微流体器件制造需要专业知识和对细节的一丝不苟的关注,以及对流速的严格实验控制,以确保确定性的封装效率。这些方面可能需要针对不同的实验设置进行优化。虽然这种方法依赖于荧光显微镜进行信号检测,需要使用合适的成像设备,但这种设备可以使用开源硬件制造,使其更易于访问。此外,微凝胶可以在具有大喷嘴的商用流式细胞术中进行处理,从而进一步提高可及性和实验通量。液滴分选仪也可用于这种流式细胞分析。
此外,虽然该方法旨在检测来自质粒、染色剂或其他标志物的荧光信号,但它仅限于可以荧光标记的细胞,这可能不适用于所有细菌菌株或实验条件。然而,该方法可以适应结合其他类型的显微镜,例如相差或明场显微镜,从而允许荧光以外的表型应用。此外,它还可以与 FTIR 或拉曼光谱等光谱技术相结合,扩展其分析封装细胞的化学成分和结构信息的能力。这些调整拓宽了其适用范围,使其成为适用于各种研究环境的多功能工具。
意义和应用
传统的质粒丢失19 检测方法无法很好地定量表达缺失的细胞比例,而这些信息在实验方法设计和各种生物学应用中可能非常重要。通常,在琼脂平板测定中列举菌落类型,其中可以获得明确定义的分离菌落,如图 4 所示。然而,重叠的菌落很难可靠地识别;在我们手中,我们并不总是获得最佳的菌落密度,并且需要许多板才能获得低频质粒丢失事件的良好统计数据。与琼脂板模拟方法相比,所提出的方法提供了一种更可靠的方法来准确量化来自具有更多菌落的孤立菌落的荧光信号,因为在微滴中,菌落单独形成,更小,并且易于加载到成像室中,从而能够基于显微镜或流式细胞术量化大菌落数量。这可以显著改善方法的统计表示,并允许集成到其他凝胶-微滴工作流程中。
开源硬件11,20 的使用允许研究人员定制微流控工作站设计并精确调整 flow rat;因此,粒径支持各种细胞类型和实验条件。这种灵活性扩展到可能结合其他显微镜类型,例如相差或光谱,从而扩大了该方法的适用性。该方法在各种条件下评估质粒稳定性的能力对于需要保留质粒而无需选择抗生素、在特定应激条件下或各种培养物代的应用至关重要。所提出的方法的多功能性和适应性使其对于合成生物学、环境监测和临床诊断等领域的各种研究应用很有价值2。
披露声明
作者声明,任何相互竞争的经济利益或个人关系都不会影响本文报告的工作。
致谢
这项工作是 ANID FONDECYT Regular 1241621 和 Chang Zuckerberg Initiative 项目“通过开放硬件进行拉丁美洲生物成像中心”授予 TW 的资助项目的一部分。T.W. 还感谢 CIFAR 的资助,作为 CIFAR MacMillan Multiscale Human 计划的 Azrieli 全球学者。
材料
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 370533-25G | For breaking emulsion |
| 70% ethanol | For cell permeabilization | ||
| Agar-Agar | Winkler | 9002-18-0 | |
| Biopsy Punch | 0.75 mm and 1.8 mm | ||
| Blue LED transilluminator | IO Rodeo | ||
| Culture tube | 15 mL | ||
| Desiccator | With vacuum pump | ||
| Disposable cup | For mixing PDMS | ||
| Disposable fork | For mixing PDMS | ||
| E. coli TOP10 strain | |||
| FluoPi microscope | https://github.com/wenzel-lab/FluoPi | Green fluorescence imaging system for analyzing plates | |
| Fluorinated Oil | 3M | Novec 7500 | |
| Glass slide heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of microfluidic chip | |
| Glass Slides | |||
| Hotplate | Mechanic | For evaporating Aquapel | |
| Image analysis software | Fiji/ImageJ | 2.14.0/1.54f | |
| Incubator | Mundo Lab | MLAB Scientific / For incubation of plates and microgels | |
| Isopropanol | For cleaning glass slides | ||
| Kanamycin | 100 ug/mL concentration | ||
| L-shaped spreader | For spreading bacteria on agar plates | ||
| Master mold | Chip design on silicone or glass wafer | ||
| Microtubes | 2 mL | ||
| NaCl solution | Sodium chloride 0.9% w/v | ||
| Open-source hardware strobe-enhanced microscopy stage | https://github.com/wenzel-lab/flow-microscopy-platform | For bright-field microscopy | |
| Petri dish | Citotest | 2303-1090 | 90 x 15 mm |
| Pipette tip heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of pipette tip | |
| Plasma Cleaner | Diener Electronic | 117056 | For bonding PDMS with a glass slide |
| Plasmid pCA_Odd1 | Encodes sfGFP and kanamycin resistance | ||
| Polytetrafluoroethylene (PTFE) tubing | Adtech Polymer Engineering Ltd | ||
| Pre-mixed Luria Bertoni medium | US Biological Life Science | L1520 | |
| Propidium iodide (PI) | For staining | ||
| Raspberry Pi-based pressure and flow controller system | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller | For controlling pressure and flow rates | |
| Silicone elastomer base | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Silicone elastomer curing agent | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Spectrophotometer | For measuring absorbance | ||
| SQUID microscope | https://github.com/wenzel-lab/SQUID-bioimaging-platform | Multi-fluorescence imaging system for analyzing stained cells | |
| Sterile loop | For picking a colony and streaking plating | ||
| Surfactant | Sphere Fluidics | Pico-Surf | |
| Syringes | NIPRO | With filters and tubing | |
| Temperature-controlled shaker | Mundo Lab | DLAB HCM100-Pro | |
| Tweezer | |||
| Ultra-low gelling temperature agarose | Sigma-Aldrich | A2576-5G | For generating hydrogel beads |
| Water repelent solution (fluoroalkyl silane) | Aquapel | For treating microchannels of PDMS device |
参考文献
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under non-selective conditions maintains antibiotic resistance. Nat Commun. 10 (1), 2595 (2019).
- Rodríguez-Beltrán, J., DelaFuente, J., León-Sampedro, R., MacLean, R. C., Millán, &. #. 1. 9. 3. ;. S. Beyond horizontal gene transfer: The role of plasmids in bacterial evolution. Nat Rev Microbiol. 19 (6), 347 (2021).
- Wein, T., Dagan, T. Plasmid evolution. Curr Biol. 30 (19), R1158-R1163 (2020).
- Chen, S., Larsson, M., Robinson, R. C., Chen, S. L. Direct and convenient measurement of plasmid stability in lab and clinical isolates of E. coli. Sci Rep. 7 (1), 4788 (2017).
- Rouches, M. V., Xu, Y., Cortes, L. B. G., Lambert, G. A plasmid system with tunable copy number. Nat Commun. 13 (1), 3908 (2022).
- Silva, F., Queiroz, J. A., Domingues, F. C. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli. Biotechnol Adv. 30 (3), 691-708 (2012).
- Wang, R., et al. Construction of novel pJRD215-derived plasmids using chloramphenicol acetyltransferase (cat) gene as a selection marker for Acidithiobacillus caldus. PLoS ONE. 12 (8), e0183307 (2017).
- Moragues, T., et al. Droplet-based microfluidics. Nat Rev Methods Primers. 3 (1), 32 (2023).
- Vitalis, C., Wenzel, T. Leveraging interactions in microfluidic droplets for enhanced biotechnology screens. Current Opinion in Biotechnology. 82, 102966 (2023).
- Sinha, N., Subedi, N., Wimmers, F., Soennichsen, M., Tel, J. A pipette-tip based method for seeding cells to droplet microfluidic platforms. J Vis Exp. (144), e57848 (2019).
- Wenzel, T. Open hardware: From DIY trend to global transformation in access to laboratory equipment. PLOS Biol. 21 (1), e3001931 (2023).
- Murillo, L. F. R., Wenzel, T. Welcome to the journal of open hardware. J Open Hardware. 1 (1), (2017).
- Shin, J. H., Choi, S. Open-source and do-it-yourself microfluidics. Sens Actuators B Chem. 347, 130624 (2021).
- Pryszlak, A., et al. Enrichment of gut microbiome strains for cultivation-free genome sequencing using droplet microfluidics. Cell Rep Methods. 2 (1), 100137 (2021).
- Pollak, B., et al. Universal loop assembly: open, efficient and cross-kingdom DNA fabrication. Biology. 5 (1), (2020).
- Volkmer, B., Heinemann, M. Condition-dependent cell volume and concentration of Escherichia coli to facilitate data conversion for systems biology modeling. PLoS ONE. 6 (7), e23126 (2011).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , (2020).
- Abate, A. R., Weitz, D. A. Faster multiple emulsification with drop splitting. Lab Chip. 11 (11), 1911-1915 (2011).
- Lau, B. T. C., Malkus, P., Paulsson, J. New quantitative methods for measuring plasmid loss rates reveal unexpected stability. Plasmid. 70 (3), 353-361 (2013).
- Oellermann, M., et al. Open hardware in science: The benefits of open electronics. Integr Comp Biol. 62 (4), 1061-1075 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。