Method Article
Быстрое прогнозирование лекарственного ответа in vivo с использованием клеточных трансплантатов лейкемии у эмбрионов рыбок данио
В этой статье
Резюме
Этот протокол содержит пошаговые инструкции по получению и устранению неполадок ксенотрансплантатов острого лимфобластного лейкоза человека (ОЛЛ) из клеточных линий и свежего материала пациента в эмбрионах данио-рерио с временно иммуносупрессированным иммунитетом, а также рекомендации по оценке лекарственного ответа с помощью проточной цитометрии. Экспериментальный конвейер также может быть адаптирован для солидных опухолей.
Аннотация
Ксенотрансплантация рыбок данио является ключевым методом исследования патогенеза рака человека и прогнозирования индивидуальных реакций на лекарства. В этом документе представлен оптимизированный протокол (ZefiX) для расширения образцов пациентов с первичным предшественником B-клеток острого лимфобластного лейкоза (BCP-ALL) или иммортализованных клеточных линий в эмбрионах рыбок данио-рерио с временной иммуносупрессией, используя проточную цитометрию для анализа ответов на лечение с высоким разрешением. По сравнению с приживлениями солидных опухолей, клетки лейкемии значительно выигрывают от подавления макрофагов и дифференцировочных факторов нейтрофилов на основе морфолиноантисмысловых олигонуклеотидов во время анализа. Анализ диссоциированных клеток трансплантата позволяет точно оценить количество клеток, скорость пролиферации и жизнеспособность после лечения в расчете на одну клетку. Этот подход был валидирован с использованием таргетных терапевтических средств, таких как венетоклакс и дазатиниб, при этом результаты лечения сравнивались с клиническими записями соответствующих образцов пациентов и традиционным контролем 2D-культур. Примечательно, что протокол завершается в течение 7 дней, что соответствует срокам принятия клинических решений. Методология может быть адаптирована для тестирования выбранных препаратов при различных типах рака, включая солидные опухоли, тем самым поддерживая персонализированные терапевтические стратегии. Тем не менее, следует учитывать ограничения на количество препаратов, которые могут быть оценены, вероятно, из-за фармакокинетических ограничений у эмбрионов рыбок данио.
Введение
Ксенотрансплантация рыбок данио стала важнейшей моделью in vivo для понимания патогенеза рака и прогнозирования реакции на лекарства 1,2,3,4,5. Животные модели по-прежнему имеют решающее значение для доклинических испытаний лекарств, и модель рыбок данио предлагает значительные преимущества по сравнению с другими системами in vivo, включая высокую пропускную способность иэкономическую эффективность. Эта модель также может помочь в прогнозировании персонализированного ответа на лечение, включая молекулярную таргетную терапию и терапию CAR-T-клетками 9,10,11,12.
BCP-ALL может быть особенно полезен от ксенотрансплантации рыбок данио, поскольку увеличение первичных клеток пациента в культуре остается сложной задачей13. Существует неоспоримая потребность в новых подходах к лечению при ОЛЛ. Несмотря на высокий уровень ремиссии 80%-85% у детей с BCP-ОЛЛ, долгосрочные показатели выживаемости пациентов с рецидивирующим или рефрактерным заболеванием колеблются всего в пределах примерно 30%-60%14,15,16. В таких случаях тестирование лекарственных препаратов с использованием предложенного конвейера может быть интегрировано в клинические условия для определения оптимальной терапии, специфичной для пациента14,15. Такой персонализированный подход может иметь решающее значение при борьбе с множественной лекарственной устойчивостью, значительно снижая бремя лечения пациентов за счет отказа от неэффективных или неоптимальных препаратов с серьезными побочными эффектами.
Несколько особенностей делают ксеноприсадку эмбриона данио-рерио подходящей моделью. Генетическое сходство между человеком и рыбками данио (70% генетической гомологии и 84% общих генов, связанных с заболеванием) поддерживает исследования взаимодействия генов и лекарств17. Таким образом, использование трансгенного эмбриона-хозяина может выявить генетическую предрасположенность, влияющую на чувствительность к лекарственным препаратам18. В качестве альтернативы могут быть трансплантированы клетки со специфическими генетическими модификациями, чтобы оценить, соответствует ли чувствительность или резистентность к препарату результатам in vitro. Ксенотрансплантаты эмбрионов рыбок данио также дают представление о потенциальных системных эффектах лекарств. Хотя развитие органов у 2-3-дневных эмбрионов еще не полностью созрело, органы правильно локализованы и частично разделяют клеточный состав со своими взрослыми собратьями.
Другие преимущества этой модели заключаются в том, что для приживления требуется всего несколько раковых клеток, сохранение эмбрионов-хозяев является простым, так как кормление не требуется в течение первых 5 дней жизни, а успех инъекции может быть быстро оценен благодаря прозрачности и размеру эмбрионов. Уникальной особенностью является то, что на этой стадии развития активен только врожденный иммунитет, способствующий эффективному приживлению. В описанном здесь протоколе ZefiX (см. резюме на рисунке 1) иммунодефицит дополнительно усиливается за счет подавления врожденной иммунной системы в течение первых 4 дней жизни с использованием стабильных антисмысловых олигонуклеотидов Morpholino, нацеленных на spi1 и csf3r, которые блокируют дифференцировку макрофагов и нейтрофилов 21,22,23.
Этот протокол также отличается от предыдущих протоколов ксенотрансплантации рыбок данио, которые были разработаны в первую очередь для трансплантатов солидных опухолей и обычно используют методы оценки лекарственного ответа, основанные на визуализации. ZefiX оптимизирован для жидких раковых клеток, таких как клетки BCP-ALL, и был успешно использован для расширения свежего или свежезамороженного материала пациента21. ZefiX также может быть адаптирован для адгезивных раковых клеток путем выбора соответствующих ферментов для диссоциации тканей.
Еще одним важным преимуществом является последующий анализ с использованием проточной цитометрии, который имеет ряд преимуществ: (i) большое количество трансплантатных клеток может быть быстро обработано, что позволяет проводить надежный статистический анализ на уровне отдельных клеток, (ii) скорость пролиферации и жизнеспособность могут быть оценены одновременно в отдельных клетках, и (iii) проточные цитометры обычно доступны в условиях клинических исследований; Это позволяет оценить лекарственный ответ клеток трансплантата на уровне одной клетки в течение нескольких часов. Чтобы обеспечить воспроизводимость, этот протокол обеспечивает стандартизированный конвейер от подготовки через трансплантацию до анализа проточной цитометрии, что позволяет прогнозировать ответ на лекарственное средство во ВСЕХ клетках в течение недели.
протокол
Все эксперименты с рыбками данио соответствуют рекомендациям и официальным органам Университетской клиники Шарите, Берлина, Научно-исследовательских институтов экспериментальной медицины. Во всех исследованиях участвовали эмбрионы данио-рерио < 6 дней после оплодотворения (dpf), что освобождало их от действия Закона о защите животных. Данио рерио (Danio rerio) выращивались и содержались в животноводческом центре Charité-Universitätsmedizin в Берлине, Берлин, Германия, в соответствии со стандартными протоколами. Они были размещены при температуре 28 °C с 14-часовым световым и 10-часовым темновым циклом. Для всех экспериментов использовались рыбы дикого типа штаммов AB или TüLF.
ПРИМЕЧАНИЕ: Установление оптимальных условий лечения для каждого желаемого препарата перед его применением ZefiX включает в себя несколько необходимых этапов. Во-первых, определите полумаксимальную ингибиторную концентрацию (IC50) каждого препарата с использованием подходящей клеточной линии в рамках обычной системы 2D-культивирования. Исходя из предыдущего опыта, эффективные концентрации препарата для лечения ZefiX могут быть в 5 - 50 раз выше, чем те, которые используются в типичных условиях культивирования клеток21,24. Перед лечением привитых эмбрионов важно оценить токсичность в нетрансплантированных эмбрионах-хозяевах с использованием установленного диапазона концентраций. После оценки токсичности подвергните эмбрионы, приживленные клеточной линией, воздействию различных концентраций препарата, примерно в 50 раз превышающих значение IC50, ранее определенное в 2D-культуре. Если привитые клетки не проявляют ответа на дозы до 100x от IC50, препарат может быть признан неэффективным для ZefiX. Для потенциального повышения эффективности одним из вариантов является предварительная подготовка клеток трансплантата препаратом незадолго до их трансплантации эмбрионам25. В таблице 1 приведены все используемые здесь решения.
1. День 1: Подготовка к эксперименту
- Подготовка среды Е3: Приготовьте 2 л автоклавной среды Е3 для использования для поддержания эмбрионов.
- Получение антисмысловых олигонуклеотидов (МО) морфолино: Приготовьте стоковый раствор 50 мкМ, содержащий оба МО, в микроцентрифужной пробирке объемом 1,5 мл с использованием воды, не содержащей нуклеаз. Храните исходный раствор при комнатной температуре (RT). Подготовьте МО к инъекции, инкубируя раствор на нагревательном блоке при 65 °С в течение 10 минут.
ПРИМЕЧАНИЕ: MO направлены против spi1 и csf3r для ингибирования дифференцировки макрофагов и нейтрофильных клеток, как описано в ссылках 22,23,26. - Подготовка инжекционных пластин
- Для приготовления 4-5 планшетов растворите 1% агарозу в среде Е3 до получения раствора объемом 100 мл. Для планшетов для трансплантации налейте ~20 мл раствора в каждую чашку Петри диаметром 10 см, убедившись, что они заполнены наполовину. Взболтайте, чтобы равномерно распределить жидкость.
- Для инъекционных пластин Morpholino поместите форму для литья под давлением на жидкую агарозу в двух чашках Петри, следя за тем, чтобы не образовывались пузырьки. Накройте посуду, наклонив крышки, и оставьте ее в режиме RT, пока агароза не застынет. После застывания снимите форму и храните пластины вверх дном при температуре 4 °C в герметичном пластиковом пакете.
- Подготовка инъекционных игл
- Для инъекций морфолино: Сгенерируйте иглы из капилляров длиной 10 см с помощью иглосъемника и отломайте кончики до достижения предполагаемого диаметра 10 мкм (как описано впункте 27).
- Для трансплантации клеток: Используйте имеющиеся в продаже предварительно вытащенные инъекционные иглы с тупым концом и внешним диаметром 20 мкм.
- Культура трансплантатных клеток: Разделенные клетки (например, Nalm6) с целью достижения целевой плотности 70%-80% на 4-й день в колбе для клеточной культуры T175 со средой RPMI с добавлением 10% FCS и 1% P/S (RPMI-complete). Разделите клетки 3-4 раза перед использованием, чтобы обеспечить надлежащую скорость пролиферации.
ПРИМЕЧАНИЕ: Инструкции по подготовке свежего или свежего/замороженного материала пациента к трансплантации можно найти в шаге 4.3. Затем клетки подготавливаются в день трансплантации. - Разведение рыбок данио: Во второй половине дня заводите диких рыбок данио в аквариумах для разведения, держа самцов и самок отдельно.
ПРИМЕЧАНИЕ: Данио-рерио были выращены и поставлены так, как описано в ссылке28. Временные ссылки (hpf или dpf) обозначают часы или дни после оплодотворения.
2. День 2: Инъекция Морфолино
- Добавьте 500 мл автоклавированной среды Е3 с 1% пенициллином/стрептомицином (Е3//С) и заполните две 10-сантиметровые чашки Петри. Достаньте инъекционную пластину из холодильника для предварительного нагрева в режиме RT.
- Ступенчатое открытие затворов в резервуарах для разведения таким образом, чтобы оплодотворение могло происходить только в нескольких резервуарах одновременно (в зависимости от скорости введения) для обеспечения своевременных микроинъекций раствора Морфолино в эмбрионы рыбок данио-рерио на одноклеточной стадии28,29. Начните с открытия одного или двух ворот в зависимости от скорости инжектора, когда одна партия яиц будет легко введена, откройте еще одну или две калитки и так далее.
- Оплодотворенные яйца перекладывайте партиями по 100 штук с как можно меньшим количеством жидкости в ранее изготовленную инъекционную пластину. Выровняйте зародыши в бороздках пластины.
- Введите 1 нл 50 мкМ смеси обоих морфолино в клетку или желточный мешок, расположенный непосредственно под клеткой, во время одноклеточной стадии29. Введите достаточное количество яйцеклеток для последующих процедур (например, для одного 96-луночного планшета введите до 200 яйцеклеток, чтобы иметь достаточный запас на случай потенциального выбывания перед трансплантацией).
- Переложите введенные яйца в чашки Петри, содержащие E3/P/S. Инкубируйте введенные яйца при температуре 28 °C. Неинъецированные яйца оставьте в качестве контрольной рыбы для анализа проточной цитометрии при давлении 5 д/ч. Оставшуюся среду E3/P/S храните при температуре 4 °C.
3. День 3: Дехорионация
- Дехорионация эмбрионов рыбок данио-рерио: Ручная дехорионация эмбрионов, когда они старше 24 hpf, с помощью двух прецизионных щипцов29.
- Удалите все мертвые эмбрионы, которые не показывают сердцебиения или движения и выглядят непрозрачными, или эмбрионы с неправильной формой из посуды с помощью пипетки Пастера.
- Зажмите хорион прецизионными щипцами, чтобы удержать его на месте. Зажмите рядом с кончиком прецизионных щипцов, удерживая эмбрион на месте с помощью вторых щипцов, и осторожно раздвиньте хорион, чтобы освободить эмбрион
ПРИМЕЧАНИЕ: Для дехорионации эмбрионов моложе 24 HPF их следует хранить на посуде, покрытой агарозой, чтобы предотвратить их прилипание к пластику. Ручная дехорионация предпочтительнее, так как она более щадящая для эмбрионов. Альтернативный способ ферментативной дехорионации описан в другом месте30.
- Инкубируйте дехорионированные эмбрионы при температуре 28 °C в течение ночи.
4. День 4: Ксенотрансплантация и медикаментозное лечение
- Подготовка эмбрионов-хозяев: Достаньте подготовленные агарозные пластины и E3/P/S из холодильника и дайте им достичь RT. Проверьте эмбрионы на соответствующую стадию развития при 48 hpf с помощью стереомикроскопа. Включайте в рабочий процесс только правильно этапированные и морфологически типичные эмбрионы, как описано в другом месте29. Подсчитайте все здоровые эмбрионы и спланируйте дальнейшее лечение. На 10 см чашки Петри следует хранить не более 100 эмбрионов при температуре 28 °C, чтобы избежать неравномерных скоростей развития, вызванных нехваткой кислорода.
ПРИМЕЧАНИЕ: Следуйте шагу 4.2. для клеточных линий. Для свежих/замороженных материалов перейдите непосредственно к шагу 4.3. - Подготовка клеточных линий
- Чтобы получить флуоресцентно меченые клетки BCP-ALL для проточной цитометрии и трансплантации, промойте клетки (начиная с шага 1.5.) 1x PBS: центрифугируйте при 350 x g в течение 5 минут и повторно суспендируйте в 20 мл PBS.
- Подсчитайте клетки и перенесите 3 x 105 неокрашенных клеток в пробирку FACS для анализа проточной цитометрии в день 0 (0 дней после инъекции, dpi). Хранить на льду.
- Планшет 3 x 105 ячеек по 3 мл RPMI-комплекта в одну лунку 6-луночного планшета и поддерживать при 37 °C для контроля 3 dpi.
- Перенесите 1 x 107 клеток в центрифужную пробирку объемом 15 мл для маркировки CTV. Центрифугируйте при 350 x g в течение 5 мин при RT, вылейте надосадочную жидкость (для остального используйте пипетку) и повторно суспендируйте гранулу в 2,5 мл PBS (RT) с 1 μл стокового раствора CTV.
- Инкубировать в течение 5 минут в темноте при 37 °C, остановить реакцию 12,5 мл RPMI-complete, затем инкубировать в течение 10 минут в темноте при 37 °C.
- Центрифугируйте при 350 x g в течение 5 минут при RT и промойте один раз 10 мл RPMI-complete. Снова центрифугируйте и снова суспендируйте в 10 мл RPMI-complete.
- Фильтруйте ячейки с помощью фильтра 10 мкм путем центрифугирования при 350 x g в течение 5 минут. Повторно суспендируйте гранулу, подсчитайте клетки и перенесите 3 x 105 меченых CTV клеток в трубку FACS. Планшет 3x 10^5 ячеек с 3 мл RPMI-complete в одной лунке 6-луночного планшета и поддерживать при температуре 37°C для контроля пролиферации 3 dpi. Храните оставшиеся клетки в 1 мл PBS на льду до трансплантации.
- Подготовка свежего/замороженного материала для пациента
- Предварительно нагрейте две центрифужные пробирки объемом 15 мл с 10 мл RPMI-complete каждая при температуре 37 °C. Разморозьте флакон, содержащий 5-10 x 106 клеток, на водяной бане при температуре 37 °C.
- Как только останется лишь небольшое количество льда, перенесите ячейки в центрифужную трубку с предварительно подогретой средой. Центрифугируйте при 350 x g в течение 5 мин при RT, выбросьте надосадочную жидкость и повторно суспендируйте гранулу во второй пробирке предварительно подогретого RPMI-complete.
- Подсчитайте жизнеспособные клетки с помощью трипанового синего цвета. Аликвот 1x 10^5 клеток в центрифужную пробирку объемом 1,5 мл и центрифугируйте эту аликвоту клеток в пробирке FACS при давлении 350 x g в течение 5 мин при RT, выбросьте надосадочную жидкость и повторно суспендируйте гранулу в 300 мкл PBS.
- Храните ресуспендированную аликвоту на льду в качестве необработанного контроля для анализа проточной цитометрии.
ПРИМЕЧАНИЕ: Если позволяет достаточный размер образца, сохраняйте необработанный контроль в культуре для измерения проточной цитометрии на 7-й день. - Добавьте 1 мкл стокового раствора CTV к 2,5 мл PBS (RT) на каждые 1 x 106 клеток. Отрегулируйте объем стандартного решения CTV, если доступно меньше ячеек.
- Инкубировать клетки с CTV в течение 5 мин при 37 °C в темноте, остановить реакцию, добавив 12,5 мл предварительно подогретого (37 °C) RPMI-complete, и инкубировать в течение 10 мин в темноте при 37 °C.
- Центрифугируйте клетки при 350 x g в течение 5 минут при RT и промойте клетки один раз 10 мл RPMI-complete. Снова центрифугируйте при 350 x g в течение 5 мин при RT и повторно суспендируйте клетки в 10 мл RPMI-complete.
- Отфильтруйте клеточную суспензию в свежую центрифужную пробирку объемом 50 мл с помощью фильтра 10 мкм и центрифугируйте при 350 x g в течение 5 минут.
- Не выбрасывайте надосадочную жидкость. Снова суспензируйте гранулу и подсчитайте ячейки. Перенесите 3 x 105 меченых CTV клеток в одну пробирку FACS.
- Центрифугируйте оставшиеся клетки при 350 x g в течение 5 минут при RT и выбросьте надосадочную жидкость. Ресуспендируйте оставшиеся клетки в 1 мл PBS и храните на льду до использования при трансплантации.
Примечание: Если остается достаточное количество CTV-положительных клеток, их можно поддерживать в 2D-культуре параллельно ксенотрансплантатам для сравнения скорости пролифератов.
- Измерение проточной цитометрии
ПРИМЕЧАНИЕ: Проточная цитометрия с разрешением 0 dpi должна выполняться вторым человеком, чтобы свести к минимуму время, в течение которого клетки остаются на льду перед трансплантацией. Перед первым измерением проточной цитометрии с использованием назначенной окрашивающей панели (CTV, CD19-Alexa488, APC-Annexin V и 7AAD) проведите компенсационное испытание в соответствии с инструкциями производителя.- Подготовьте две пробирки FACS следующим образом: Пробирка 1: Неокрашенные контрольные ячейки; Пробирка 2: Клетки, окрашенные CTV, CD19, 7AAD и аннексином.
ПРИМЕЧАНИЕ: Окрашивание и метки: CellTrace Violet (CTV) идентифицирует меченые клетки трансплантата в сравнении с клетками рыбы-хозяина и оценивает скорость пролиферации через 3 дня. Антитело к CD19, маркер клеточной поверхности, служит дополнительным маркером для идентификации клеток трансплантата BCP-ALL человека. Для других типов рака могут потребоваться альтернативные маркерные антитела. Аннексин V обозначает раннюю стадию апоптоза для оценки жизнеспособности клеток. 7AAD отмечает позднюю стадию апоптоза или некроза для оценки жизнеспособности клеток. - Центрифужные пробирки (одну из которых содержат клетки, окрашенные CTV, а другую — неокрашенные) при 350 x g в течение 5 мин при RT и отбрасывают надосадочную жидкость из пробирки 1. Ресуспендируйте гранулу в 310 μл буфера-связующего аннексина (ABB).
- Пробирка 2: Выполните окрашивание антителами и жизнеспособностью, как описано ниже.
ПРИМЕЧАНИЕ: Этот протокол окрашивания оптимизирован для окрашивания CD19 B-клеток. Для других человеческих антител, используемых для мечения различных типов клеток, протокол может нуждаться в адаптации.- Добавьте 98 мкл ABB в пробирку 2 (содержащую клетки, меченные CTV). Добавьте 2 мкл антитела CD19-Alexa488 (разведение 1:50) к 98 мкл добавленного ABB. Хорошо перемешайте.
- Инкубируйте смесь при температуре 4 °C в течение 30 минут и добавьте 500 μL ABB, чтобы остановить реакцию. Центрифугируйте пробирку при 350 x g в течение 5 минут при 4 °C. Удалите надосадочную жидкость и повторите промывку.
- Повторно суспендируйте клеточную гранулу в 100 мкл ABB и приступайте к окрашиванию 7AAD и APC-Annexin V. Выполните окрашивание 7AAD и APC Annexin V и измерение проточной цитометрии, как описано ниже.
- Добавьте 5 μL 7AAD и 5 μL APC-Annexin V в ресуспендированные элементы. Вихрем аккуратно перемешать. Инкубируйте пробирку в течение 15 минут в темноте при RT. Добавьте 200 μL ABB до конечного объема 310 μL.
- Во избежание перекрестной контаминации в день трансплантации проводите анализ проточной цитометрии в следующих условиях: неокрашенные контрольные клетки (пробирка 1), меченые CTV клетки, окрашенные Alexa488-CD19, APC-аннексин V и 7AAD (пробирка 2). Запишите не менее 10 000 событий на образец для достаточного анализа.
- Подготовьте две пробирки FACS следующим образом: Пробирка 1: Неокрашенные контрольные ячейки; Пробирка 2: Клетки, окрашенные CTV, CD19, 7AAD и аннексином.
5. Трансплантация
- Пластина для трансплантации: Приготовьте две чашки Петри по 10 см, наполненные E3/P/S, и поместите в инкубатор при температуре 28 °C не менее чем на 30 минут для предварительного нагрева.
- Подготовка клеток: Центрифугируйте клетки при 350 x g в течение 5 минут при RT, выбросьте надосадочную жидкость и удалите остатки жидкости с помощью микропипетки. Добавьте PBS для достижения конечного объема 20 μл. Держите концентрированную клеточную суспензию на льду.
ПРИМЕЧАНИЕ: Клетки не должны оставаться на льду более 2 часов во время процедуры трансплантации. - Трансплантационная игла и подготовка эмбриона хозяина
- Перенесите 25-30 эмбрионов в одну из предварительно подогретых чашек Петри, содержащую E3/P/S, используя стеклянную пипетку Пастера в качестве контрольной. Загрузите 4 мкл клеточной суспензии в иглу для трансплантации с помощью наконечника микрозагрузчика.
ПРИМЕЧАНИЕ: Загрузка должна происходить плавно в течение 1-2 минут. Если это не так, осторожно добавьте в клеточную суспензию больше PBS. - Откалибруйте давление впрыска и длину импульса, отрегулировав микроинжектор. Корректируйте до тех пор, пока за одну инъекцию не будет выведено примерно 1 000 ВСЕХ клеток или 2 нл клеточной суспензии (для 1x 107 клеток в 20 мкл). Чтобы оценить 1000 клеток, изгоните объем суспензии на агарозную поверхность, покрытую средой. Подсчитайте 100 клеток на небольшой площади, экстраполируйте их распределение на общую популяцию клеток и оцените общее количество.
- Приготовьте 50 мл Е3, содержащего трикаин (конечная концентрация: 80 мг/л). Перенесите эмбрионы хозяина в раствор трикаина и инкубируйте не менее 2 минут, чтобы обеспечить надлежащую анестезию. Эмбрион подвергается надлежащей анестезии, когда двигательная реакция не наблюдается
ПРИМЕЧАНИЕ: Наконечник микрозагрузчика или щипцы могут быть использованы для осторожного приближения и/или прикосновения к эмбриону. - Перенесите 15-20 дехорионированных эмбрионов в форму для инъекций, покрытую агарозой (см. предыдущие инструкции по приготовлению), используя как можно меньше жидкости, чтобы предотвратить соскальзывание эмбрионов.
- Расположите эмбрионы, как показано на рисунке 2А. Введите около 1000 CTV-положительных клеток BCP-ALL в полость перикарда. Введите иглу под углом 45° от дорсо-каудального направления, как показано на рисунке 2В , для введения клеток.
ПРИМЕЧАНИЕ: Используйте имеющиеся в продаже предварительно вытянутые иглы с тупым концом и диаметром отверстия 20 мкм, специально предназначенные для небольших клеток лейкемии (см. список материалов). Если игла заблокирована, при необходимости обрежьте ее, но после этого повторно откалибруйте объем инъекции и количество клеток. - После того, как все 15-20 эмбрионов будут введены, перенесите их в предварительно подогретую чашку Петри, наполненную E3/P/S, и поддерживайте при температуре 28 °C.
- Повторяйте эти шаги до тех пор, пока не будет пересажено примерно 100 - 150 эмбрионов для одного анализа лечения лекарственным препаратом, который должен включать три концентрации препарата и одну контрольную дозу.
- Инкубируйте как трансплантированные, так и нетрансплантированные контрольные эмбрионы при температуре 28 °C в течение 1-3 ч перед началом лечения препаратом.
- Перенесите 25-30 эмбрионов в одну из предварительно подогретых чашек Петри, содержащую E3/P/S, используя стеклянную пипетку Пастера в качестве контрольной. Загрузите 4 мкл клеточной суспензии в иглу для трансплантации с помощью наконечника микрозагрузчика.
- Медикаментозное лечение in vivo (96-луночный планшет)
- С помощью флуоресцентной стереомикроскопии провести скрининг эмбрионов для подтверждения успешного приживления (Рисунок 2C). Убедитесь, что желток не поврежден, так как среда желтка может быть токсичной для клетоктрансплантата 21. Отбраковывайте эмбрионы с клетками в желтке.
- Приготовьте 2,5 мл концентрированного раствора 2x для каждого тестируемого лекарственного препарата в E3/P/S с 0,5% ДМСО. Кроме того, приготовьте раствор для управления транспортным средством объемом 5 мл, содержащий 0,5% ДМСО в E3/P/S.
- Добавьте 100 мкл E3/P/S + 0,5% ДМСО в каждую лунку 96-луночного планшета. Этот шаг предотвращает непреднамеренную перекачку минимальных количеств препарата между скважинами.
- Аккуратно перенесите по одному прижившемуся эмбриону в каждую лунку. Используйте стеклянную дозатор Пастера, чтобы собрать каждый эмбрион в среде с минимальным содержанием Е3.
- Дайте зародышу опуститься на дно наконечника пипетки, осторожно наклонив пипетку, и выпустите его в лунку с помощью капиллярных сил. Избегайте прикосновения к среде в лунке во время перекачки.
- Добавьте лекарственные растворы в планшет: Заполните 24 лунки (2 ряда) из 96-луночного планшета 100 μЛ либо раствора для контроля транспортного средства, либо одного из трех концентрированных растворов 2-кратного увеличения.
ПРИМЕЧАНИЕ: Эффективные концентрации препарата должны быть определены в предварительных экспериментах, специфичных для каждого тестируемого препарата. - Поддерживайте эмбрионы при температуре 35 °C в течение 72 ч, включая нетрансплантированные эмбрионы, которые будут служить контрольными для анализа проточной цитометрии на 7-й день.
6. День 7
- Диссоциация эмбриона/трансплантата
- Проведите скрининг 96-луночного планшета с помощью стереомикроскопии, чтобы идентифицировать и отобрать здоровые эмбрионы рыбок данио. Случайным образом объедините 10 здоровых эмбрионов хозяина из каждого состояния в микроцентрифужную пробирку объемом 1,5 мл (в идеале получается 2 пробирки на одно состояние).
- Удалите как можно больше жидкости из каждой пробирки, содержащей эмбрионы, и принесите эмбрионы в жертву гипотермическим шоком, инкубируя пробирки на льду в течение 1 ч.
- Добавьте в каждую пробирку по 500 мкл сбалансированного раствора соли Хэнка (HBSS), не содержащего кальция и магния. Механически диссоциируйте эмбрионы и клетки трансплантата путем растирания с помощью наконечника микропипетки объемом 200 мкл, пипетируя вверх и вниз примерно в 15 раз.
- Гранулируйте фрагменты ткани центрифугированием при 350 x g в течение 5 мин при RT. В то же время подготовьте пробирки FACS с мелкоячеистым фильтрующим фильтром длиной 35 мкм, содержащим 2 мл PBS на одно условие (всего 4 пробирки).
- Ресуспендируйте каждую гранулу в 500 мкл ферментной смеси (0,01% папаина, 0,1% диспазы II, 0,01% дезоксирибонуклеазы I и 12,4 мМ MgSO4 в HBSS, не содержащем кальция и магния) для ферментативной диссоциации. Инкубировать при RT в течение 15 минут.
- Во время инкубации пипетку подавайте смесь вверх и вниз каждые 5 минут, используя один и тот же наконечник пипетки для каждой отдельной пробирки, чтобы избежать потери тканей.
- Измерение проточной цитометрии
- Перенесите диссоциированные клетки в мелкоячеистый фильтрующий колпачок 35 мкм пробирок FACS и центрифугируйте при давлении 350 x g в течение 5 минут.
- Во время центрифугирования приготовьте мастер-смесь для окрашивания поверхности CD19 B-клеток. Смешайте 98 мкл ABB с 2 мкл антител Alexa Fluor 488 против человеческого CD19 для каждого состояния.
- Выбросьте надосадочную жидкость из диссоциированной клеточной гранулы и повторно суспендируйте гранулу в 100 мкл мастер-смеси для окрашивания CD19.
- Выполните протокол окрашивания CD19, 7AAD и APC Annexin V для всех образцов ZefiX, включая 3 x 105 CTV-положительных клеток из параллельной клеточной культуры, если таковая имеется.
- Проведите анализ проточной цитометрии в соответствии с порядком и запишите количество событий, указанное в таблице 2. Проверьте все образцы, содержащие клетки-хозяина и трансплантаты, как можно полнее, чтобы оценить общее количество клеток трансплантата.
- Анализ результатов с помощью коммерческого программного обеспечения.
- Стратегия гейтирования для образца клеточной культуры: Откройте программное обеспечение и загрузите файлы FCS в рабочую область. Создайте точечную диаграмму с CD19 и CTV, чтобы убедиться в наложении сигнала и подтвердить наличие раковых клеток. Затем создайте точечную диаграмму с FSC-A (ось x) и SSC-A (ось y), чтобы отличить неповрежденные клетки (Q2) от мусора (Q4; Рисунок 3А').
- Используйте популяцию Intact Cells для создания нового графика с SSC-H (ось x) и SSC-A (ось y) для идентификации одиночных клеток (рис. 3A'').
- Создайте еще одну точечную диаграмму с помощью Annexin V (ось x) и 7AAD (ось y) с использованием популяции одиночных клеток (рисунок 3A'''). Различайте клетки на четыре популяции: Жизнеспособные клетки: аннексин V отрицательный, 7AAD отрицательный (Q4); Ранние апоптотические клетки: аннексин V положительный, 7AAD отрицательный (Q3); Поздние апоптотические/некротические клетки: аннексин V положительный, 7AAD положительный (Q2); Некротические клетки: аннексин V отрицательный, 7AAD положительный (Q1).
- Повторите эти шаги для образцов с разрешением 3 dpi (рисунок 3B).
- Стратегия стробирования для клеток трансплантата и эмбриона хозяина
- Отделите человеческие трансплантаты от клеток хозяина с помощью точечной диаграммы с CTV (ось x) и CD19 (ось y). Идентификация и выделение клеток трансплантата CTV/CD19 с двойным положительным результатом (рис. 3C).
- Примените ту же стратегию гейтирования, которая описана для культуральных клеток с разрешением 3 dpi (рис. 3B' - B''') к популяции клеток трансплантата. Скопируйте стратегию стробирования для обеспечения согласованности.
- Объедините все популяции Аннексина V- и 7AAD-отрицательных клеток в гистограмму со значениями CTV по оси x (Рисунок 3D). Рассчитайте среднее геометрическое для всех пяти образцов, чтобы определить темпы распространения.
- Расчеты для оценки реакции на лечение
- Чтобы определить количество делений клеток через 3 дня, воспользуйтесь формулой:
n = log2 (I0/I)
где, I0 = Начальная интенсивность флуоресценции CTV (среднее геометрическое, 0 dpi), I = интенсивность флуоресценции CTV при 72 ч, n = Количество делений клеток.
Пример: Свежезамороженные клетки пациента делились в 2,6 раза в ZefiX log2 (88317/14644) = 2,6
и в 2,8x в 2D log2(88317/12992) = 2,8 - Чтобы определить общее количество клеток трансплантата на одну рыбу через 3 дня, разделите общее количество раковых клеток (включая апоптотические клетки, но исключая мусор) на количество рыб, собранных в образце (обычно n = 10).
- Чтобы определить жизнеспособность CTV-положительных клеток трансплантата через 3 дня, используют формулу:
V = (C/100) x A
Где: V = жизнеспособность, C = фракция неповрежденных одиночных клеток без мусора (в процентах), A = фракция аннексина V- и 7AAD-отрицательных клеток (в процентах).
- Чтобы определить количество делений клеток через 3 дня, воспользуйтесь формулой:
Результаты
Для получения подробной научной оценки протокола ZefiX, включая ксенотрансплантат и медикаментозную обработку свежезамороженных первичных образцов клеток BCP-ALL, пожалуйста, обратитесь к ранее опубликованной рукописи21. Одобрение на использование образцов пациентов в исследованиях для доклинических испытаний лекарственных средств было получено в рамках дополнительных исследований в исследовании ALL-REZ BFM 2002 (NCT00114348) и реестре и биобанке ALL-REZ BFM (EA2/055/12) местными комитетами по этике медицинских исследований, а также в международном исследовании IntReALL SR 2010 (NCT01802814) национальным органом. Информированное согласие пациентов и/или их опекунов было получено в рамках соответствующего исследования или регистра, в который они были включены.
На рисунке 2 показан пример выравнивания эмбрионов в агарозной чашке перед инъекцией, что помогает оптимизировать процесс инъекции. Инъекция должна выполняться под показанным углом, чтобы точно нацелиться на полость, окружающую развивающееся сердце. Кроме того, на рисунке 2C представлена информация об успешно введенных 2 эмбрионах dpf, содержащих человеческие трансплантаты (синие), которые были помечены CTV перед инъекцией. Эмбрионы с результатами инъекции, отличающимися от показанных на рисунке 2C , были исключены, при этом особое внимание уделялось предотвращению перфорации желточного мешка для обеспечения жизнеспособности клеток трансплантата во время последующей трехдневной инкубации.
После трехдневного инкубационного периода эмбрионы хозяина обрабатываются в пулах по 10 штук для анализа проточной цитометрии. После ферментативной диссоциации клеточные суспензии окрашивают антителом против человеческого CD19 и двумя маркерами жизнеспособности: аннексином V для ранних апоптотических клеток и 7AAD для поздних апоптотических и некротических клеток.
На рисунке 3 представлены данные проточной цитометрии расширенных ZefiX-клеток BCP-ALL от пациента с BCP-ОЛЛ. На панелях A, A', A'' и A''' показаны данные, собранные при 0 dpi в день трансплантации. На рисунке 3A показаны значения флуоресценции CTV и CD19 для 10 000 клеток в качестве ориентира для стратегии гейтирования, применяемой к суспензиям клеток хозяина-трансплантата с разрешением 3 dpi (рисунок 3C). На рисунке 3А мусор исключен путем регулярного стробирования ячеек с использованием области прямого рассеяния (FSC-A) и области бокового рассеяния (SSC-A). На рисунке 3А одиночные ячейки отделены от дублетов с помощью графика высоты SSC (SSC-H) в зависимости от SSC-A. Эта популяция одиночных клеток используется для оценки жизнеспособности на рисунке 3A''', где жизнеспособные клетки (Q4) отличаются от ранних апоптотических клеток (Q3, более высокие значения аннексина V) и поздних апоптотических или некротических клеток (Q2, более высокие уровни 7AAD).
Для сравнения, клетки пациента, культивируемые в обычных 2D-условиях, также анализируются с помощью проточной цитометрии через три дня (рис. 3B,B',B'',B'''), следуя той же стратегии стробирования. Жизнеспособность клеток пациента через 72 ч в 2D-культуре рассчитывается по Q2 на рисунке 2B' и Q4 на рисунке 2B''': (95,0%/100)*61,9% = 58,8%.
На рисунке 3С исходным материалом является клеточная суспензия из эмбрионов хозяина, содержащих трансплантатные клетки. В отличие от измерений in vitro, все клетки в пробирке анализируются с помощью проточной цитометрии. CD19 и CTV-положительные клетки трансплантата гейтируют, чтобы отделить их от CD19 и CTV-отрицательных клеток рыб. Популяция интактных клеток трансплантата дополнительно анализируется на рисунке 3C', где мусор исключен. Жизнеспособность одиночных клеток трансплантата затем оценивают с использованием той же стратегии стробирования, что и на рисунках 3B.
Результаты показывают, что процент жизнеспособных одиночных клеток, выращенных в эмбрионах, составляет 95,2%, что в 1,6 раза выше, чем жизнеспособность клеток, культивируемых в чашке (рис. Скорость деления клеток рассчитывали in vivo и in vitro путем анализа снижения интенсивности флуоресценции CTV в каждой популяции от 0 до 3 точек на дюйм (рис. 3D). Число делений клеток определяли с помощью формулы в разделе 6.4.1 и среднего геометрического каждой кривой CTV (рисунок 3D). Рассчитанная скорость деления (2,59 деления in vivo и 2,77 деления in vitro) позволяет предположить, что жизнеспособные клетки делятся с одинаковой скоростью при обоих условиях в течение трех дней.
Наконец, среднее количество интактных клеток трансплантата на эмбрион через три дня определяли путем деления числа интактных клеток трансплантата (исключая мусор, рисунок 3C') на количество эмбрионов, объединенных в пробирку21.
В заключение следует отметить, что свежие образцы BCP-ALL, привитые эмбрионам рыбок данио, демонстрируют более высокую жизнеспособность через три дня по сравнению с обычной культурой в чашке, а жизнеспособные клетки делятся с сопоставимой скоростью в обоих условиях.
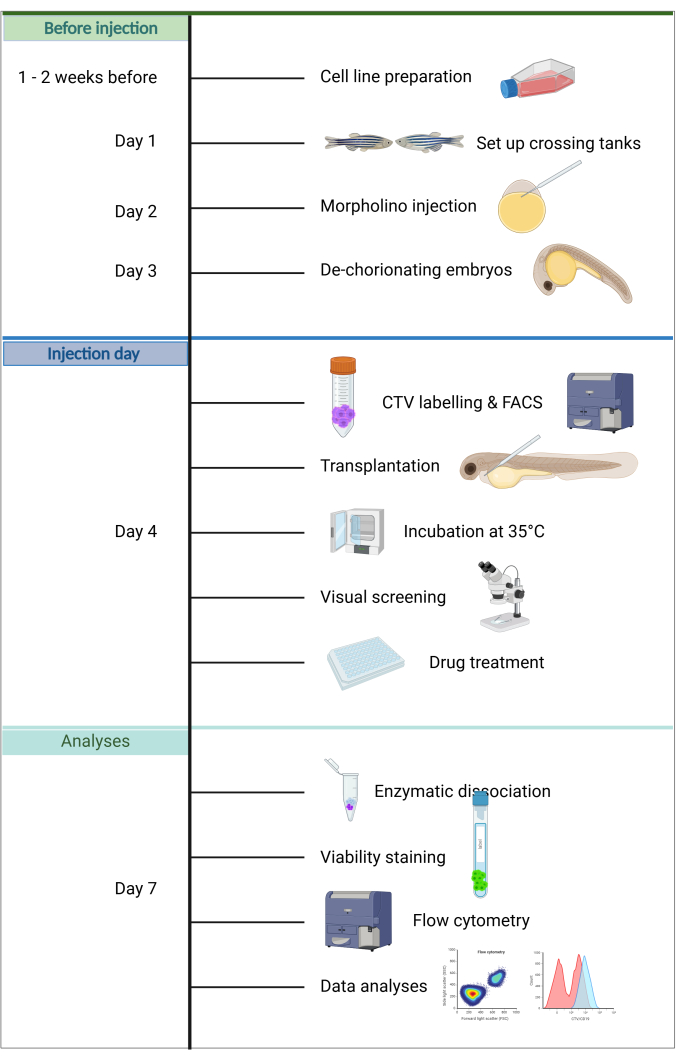
Рисунок 1. Рабочий процесс конвейера ALL-ZefiX. Создано в https://BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
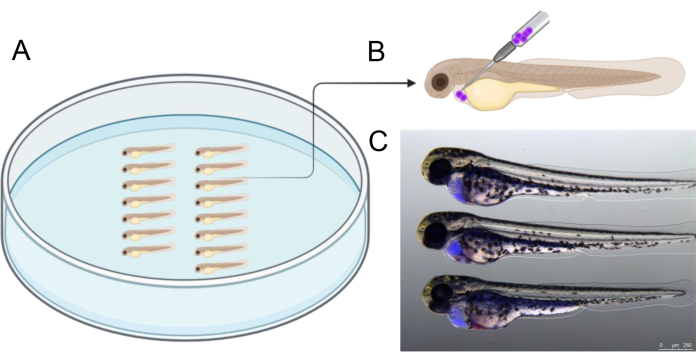
Рисунок 2: Схема инъекции. (А) Расположение эмбрионов, как показано на рисунке, облегчает инъекцию. Эмбрионы могут быть размещены с помощью щипцов или с помощью наконечника микрозагрузчика объемом 20 мкл, который был обрезан до кончика длиной 2,5 - 3 см. (B) Схематическое изображение рекомендуемого угла инъекции клеток для трансплантата клеток в перикард 2 эмбрионов dpf. (В) Наглядные пособия для правильной оценки количества трансплантированных раковых клеток. На этом снимке показан эмбрион 48 hpf через 3 ч после инъекции с раковыми клетками человека, ранее помеченными CellTrace Violet). Создано в https://BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
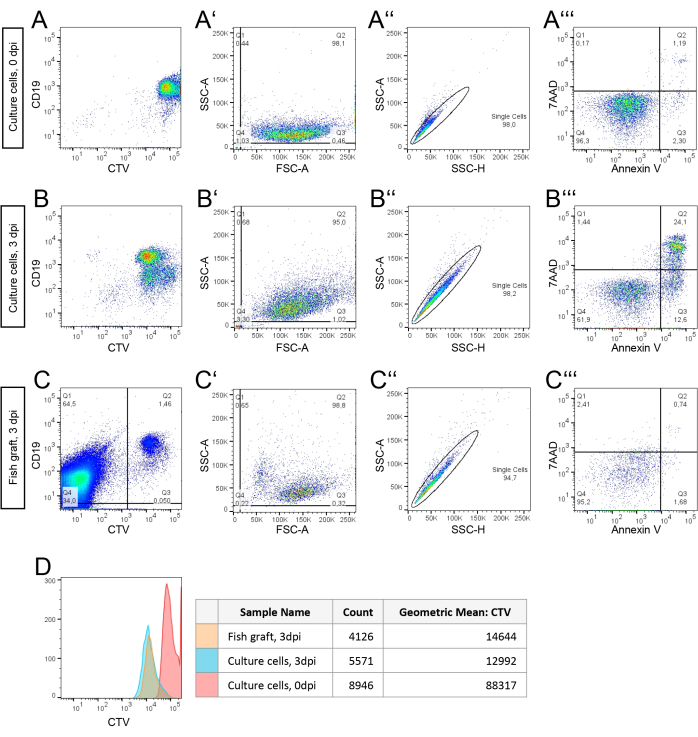
Рисунок 3: Стратегия гейтирования и анализ проточной цитометрии свежезамороженного образца выделенных бластных клеток BCP-ALL, полученного пациентом, после 2D-культивирования приживления эмбрионов рыбок данио .(А, Б) Перед посевом клетки пациента были помечены с помощью CellTrace Violet (CTV). Клетки культивировали на пластической ткани при 37 °С в течение 0 ч (А) или 72 ч (В) перед анализом проточной цитометрии. (C) Клетки пациента, помеченные CTV и выращенные при 35 °C в течение 72 ч в качестве трансплантатов в эмбрионах данио-рерио. Группа из 10 эмбрионов была объединена перед диссоциацией одиночных клеток для анализа проточной цитометрии. Была применена стратегия гейтирования, описанная в пункте (B), а также была определена и количественно определена жизнеспособная фракция клеток трансплантата. Для этого CTV-положительные клетки трансплантата (Q2) были отделены от аутофлуоресцентных клеток данио-рерио (Q1/4), чтобы отсортировать популяцию клеток трансплантата для анализа. Проанализирована интенсивность мечения CTV в этой популяции клеток трансплантата. (D) Количество клеток и средняя интенсивность меток CTV только по выбору жизнеспособных клеток. Обратите внимание на изменение интенсивности CTV через 3 дня (3 dpi). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Таблица используемых решений. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Образцы, измеренные с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Эмбрионы рыбок данио становятся все более популярной моделью ксенотрансплантата для скрининга лекарств и исследований рака из-за их высокой пропускной способности и экономической эффективности. Эти ксенотрансплантаты являются многообещающими в качестве важнейшей опоры трансляционной медицины, помогая доклиническим исследованиями принятию решений. Тем не менее, модели ксенотрансплантатов рыбок данио для экспансии и лечения клеток лейкемии человека остаются недостаточно представленными по сравнению с обширным объемом работ по трансплантатам солидных опухолей. Этот протокол предлагает подробное руководство по использованию ксенотрансплантатов рыбок данио в исследованиях лейкемии, оставаясь при этом адаптируемым для использования при солидных опухолях.
Достижение последовательной трансплантации раковых клеток может быть сложной задачей, что подчеркивает необходимость стандартизированного анализа и более высокой статистической надежности. Данный протокол решает эти проблемы, представляя комплексный конвейер для подготовки, трансплантации и анализа проточной цитометрии, а также рекомендации по устранению неполадок.
Инъекции Морфолино для временного подавления иммунитета
Эмбрионы рыбок данио полагаются на свою врожденную иммунную систему в первые дни развития, что определяет временные рамки для этогоэкспериментального конвейера. Примитивные макрофаги возникают около 12 hpf, а некоторые дифференцируются в нейтрофилы на 33 hpf 20,31,32. Т-клетки вступают в кровоток примерно через 8 дней после оплодотворения20,33. Макрофаги и нейтрофилы, как часть врожденного иммунного ответа, были вовлечены в снижение выживаемости клеток BCP-ALL, наблюдаемое через три дня после трансплантации впредыдущих исследованиях.
Морфолино-опосредованная временная иммунная супрессия, нацеленная на spi1 и csf3r, эффективно ингибирует дифференцировку макрофагов и нейтрофилов, что приводит к улучшению приживления клеток BCP-ALL без влияния на жизнеспособность эмбриона21. Хотя этот метод не может привести к окончательному истощению, так как полный нокаут spi1 и csf3r смертелен, он остается лучшим подходом для этого конвейера.
Калибровка объемов инъекций с помощью градусной сетки и точная доставка в желточный мешок на одноклеточной стадии обеспечивает стабильные инъекции Морфолино с высокими показателями выживаемости. Альтернативы, такие как инъекции липосомального клодроната (Clodrosome) для истощения макрофагов, показали многообещающие результаты, но требуют дальнейшей проверки для этого конвейера34,35.
Подготовка клеток
Достаточно плотная и жизнеспособная популяция клеток имеет решающее значение для успешной экспансии BCP-ALL в этом протоколе. CellTrace Violet (CTV) используется для флуоресцентного мечения для оценки успешности имплантации при 0 dpi и отслеживания скорости пролиферации на протяжении всего эксперимента. В отличие от других меток, CTV не изменяет поведение клеток, что позволяет проводить точный анализ пролиферации на уровне отдельных клеток. Это дает преимущества по сравнению с окрашиванием антителами Ki-67, которое захватывает только клетки во время пролиферации, но не делит клетки, которые уже вышли из клеточного цикла.
CTV также превосходит CellTracker CM-DiI (DiI) по отражению жизнеспособности клеток. DiI и его производные являются более стабильными флуорофорами, часто сохраняющимися после клеточной смерти, что может исказитьэкспериментальные результаты. Кроме того, включение специфичного для BCP-ALL антитела против CD19 в проточную цитометрию позволяет точно идентифицировать клетки трансплантата. Специфические для человека антитела, такие как анти-HLA, могут служить альтернативой для других типов раковых клеток36.
Трансплантация раковых клеток
Последовательное приживление требует оптимального разведения и концентрации клеточной суспензии. Суспензия должна сохранять достаточную плотность, избегая при этом вязкости, ухудшающей впрыскивание. В этом протоколе предпочтение отдается инъекции в перикардиальную полость или перивителлиновое пространство (ПВС), а не в желточный мешок, поскольку эти участки обеспечивают лучшую васкуляризацию и меньшую гипоксию37. Трансплантация желточного мешка, хотя и доступна, часто приводит к высоким показателям смертности и низкой жизнеспособности клеток21.
Закупорка иглы микрочастицами остается процедурной проблемой. Фильтрация клеточной суспензии и повторная калибровка объемов инъекций после обрезки заблокированных игл являются важными этапами. Для последующего лечения препаратами следует использовать только эмбрионы с плотно наполненной перикардией21,36.
Рекомендуемая температура инкубации в 35 °C уравновешивает естественную температуру раковых клеток человека (37 °C) и стандартную температуру содержания рыбок данио (28 °C)21. Эмбрионы рыбок данио приспосабливаются к этой температуре с минимальными деформациями развития, а окружающая среда способствует пролиферации и выживанию свежих клеток, полученных от пациента38.
Медикаментозное лечение
Модели ксенотрансплантатов рыбок данио были разработаны для облегчения высокопроизводительного скрининга лекарственных средств. Тем не менее, медикаментозное лечение остается одним из самых сложных аспектов анализа ZefiX. Многие стандартные препараты и таргетная терапия не эффективно достигают трансплантатов in vivo. Это также может потребовать тестирования большей панели концентраций наркотиков. Успешные примеры, такие как венетоклакс и дазатиниб, требуют значительно более высоких концентраций, чем в обычных анализах 2D-культур21.
В качестве альтернативы, предварительная обработка клеток in vitro перед трансплантацией также позволяет изучить определенные системные и локализованные эффекты. Например, этот подход может быть подходящим для лечения на основе аденоассоциированного вируса (AAV) при глиобластоме39.
Если эффекты медикаментозного лечения наблюдаются in vitro, но не in vivo с использованием этого конвейера, альтернативой может быть, например, трансплантация в стадию 1k-клеток (3 hpf) или стадию бластулы и начало медикаментозного лечения при 24 hpf40,41. Это может позволить препаратам достигать клеток трансплантата, которые не увенчались успехом у эмбрионов в возрасте 48 часов, или к одновременной инъекции клеток и лекарств в течение25 часов.
Диссоциация и анализ проточной цитометрии
Диссоциация тканей имеет решающее значение для анализа общего количества клеток трансплантата и надежной интерпретации экспериментальных результатов. Комбинация механической и ферментативной диссоциации обеспечивает высококачественную суспензию одиночных клеток, сохраняя при этом целостность белка на клеточной поверхности. Корректировка условий диссоциации (например, с помощью ферментного состава, пипетирования или использования гомогенизатора Dounce) может потребоваться для различных типов рака.
Образцы должны быть отфильтрованы, чтобы предотвратить засорение проточного цитометра, а липкие белки или липиды могут быть смягчены с помощью ЭДТА или дейолкинга эмбрионов перед диссоциацией.
Сводка
Протокол ZefiX обеспечивает быстрый и экономически эффективный экспериментальный конвейер для доклинических исследований рака, исследований лекарственной устойчивости и персонализированной оценки лечения. В то время как модели ксенотрансплантатов рыбок данио имеют ограничения и не могут вместить все типы лекарств, этот стандартизированный протокол позволяет in vivo расширять новые клетки и клеточные линии пациента с лейкемией. Адаптируемый к другим типам рака, он предлагает многообещающий инструмент для быстрого, персонализированного прогнозирования ответа на лекарственные препараты в рамках принятия клинических решений.
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Немецким исследовательским обществом (DFG, Немецкое научно-исследовательское общество) в рамках Центра совместных исследований CRC1588, проект No 493872418 и Фондом доктора Клейста, Берлин, а также Фондом Deutsche José Carreras Leukämie Stiftung (R03/2016), Берлинским Krebsgesellschaft (HEFF201633KK) и Немецким онкологическим консорциумом (DKTK, Joint Funding Call 2016). Мы благодарим Юлию Кёппке и Марейке Вольф за критическое прочтение рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
Ссылки
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены