Method Article
Prédiction rapide de la réponse médicamenteuse in vivo à l’aide de greffes de cellules leucémiques dans des embryons de poisson-zèbre
Dans cet article
Résumé
Ce protocole fournit des instructions étape par étape pour la génération et le dépannage de xénogreffes de leucémie lymphoblastique aiguë (LAL) humaine à partir de lignées cellulaires et de matériel de patient frais dans des embryons de poisson-zèbre immunodéprimés transitoirement, ainsi que des directives pour l’évaluation de la réponse médicamenteuse à l’aide de la cytométrie en flux. Le pipeline expérimental peut également être adapté aux tumeurs solides.
Résumé
La xénotransplantation de poisson-zèbre est une technique essentielle pour étudier la pathogenèse du cancer humain et prédire les réponses individuelles aux médicaments. Ce document présente un protocole simplifié (ZefiX) pour l’expansion d’échantillons de patients atteints de leucémie aiguë lymphoblastique à précurseurs de cellules B primaires (BCP-ALL) ou de lignées cellulaires immortalisées dans des embryons de poisson-zèbre immunodéprimés transitoirement, en utilisant la cytométrie en flux pour l’analyse unicellulaire à haute résolution des réponses au traitement. Par rapport aux greffes de tumeurs solides, les cellules leucémiques bénéficient considérablement de la suppression des facteurs de différenciation des macrophages et des neutrophiles à base d’oligonucléotides antisens morpholino au cours du test. L’analyse par cytométrie en flux des cellules greffées dissociées permet une évaluation précise du nombre de cellules, du taux de prolifération et de la vitalité après le traitement sur une base par cellule. Cette approche a été validée à l’aide de traitements ciblés tels que le vénétoclax et le dasatinib, avec des résultats de traitement comparés aux dossiers cliniques d’échantillons de patients associés et aux contrôles de culture 2D traditionnels. Notamment, le protocole est terminé en 7 jours, ce qui correspond aux délais de prise de décision clinique. La méthodologie est adaptable pour tester des médicaments sélectionnés dans divers types de cancer, y compris les tumeurs solides, soutenant ainsi des stratégies thérapeutiques personnalisées. Cependant, il faut tenir compte des limites sur le nombre de médicaments pouvant être évalués, probablement en raison de contraintes pharmacocinétiques chez les embryons de poisson-zèbre.
Introduction
La xénotransplantation de poisson-zèbre est devenue un modèle in vivo crucial pour comprendre la pathogenèse du cancer et prédire les réponses aux médicaments 1,2,3,4,5. Les modèles animaux restent essentiels pour les tests précliniques de médicaments, et le modèle du poisson-zèbre offre des avantages significatifs par rapport aux autres systèmes in vivo, notamment un débit élevé et une rentabilité 6,7,8. Ce modèle pourrait également aider à prédire la réponse au traitement personnalisée, y compris les thérapies moléculaires ciblées et la thérapie cellulaire CAR-T 9,10,11,12.
La LAL-BCP peut particulièrement bénéficier de la xénogreffe de poisson-zèbre, car l’expansion des cellules primaires des patients en culture reste difficile13. Il existe un besoin indéniable de nouvelles approches thérapeutiques dans la LAL. Malgré un taux de rémission élevé de 80 % à 85 % chez les enfants atteints de LAL à PCB, les taux de survie à long terme des patients atteints d’une maladie récidivante ou réfractaire ne varient qu’entre environ 30 % et 60 %14,15,16. Dans de tels cas, les tests de médicaments utilisant le pipeline proposé pourraient être intégrés dans le cadre clinique afin de déterminer le traitement optimal spécifique au patient14,15. Cette approche personnalisée peut être cruciale lorsqu’il s’agit de faire face à de multiples résistances aux médicaments, réduisant considérablement le fardeau du traitement pour les patients en évitant les médicaments inefficaces ou sous-optimaux aux effets secondaires graves.
Plusieurs caractéristiques font de la xénogreffe d’embryon de poisson-zèbre un modèle approprié. Les similitudes génétiques entre les humains et le poisson-zèbre - 70 % d’homologie génétique et 84 % de gènes liés à la maladie partagés - soutiennent les études d’interaction gène-médicament17. L’utilisation d’un embryon hôte transgénique peut ainsi révéler des prédispositions génétiques affectant la sensibilité aux médicaments18. Alternativement, des cellules avec des modifications génétiques spécifiques peuvent être transplantées pour évaluer si la sensibilité ou la résistance au médicament s’aligne sur les résultats in vitro . Les xénogreffes d’embryons de poisson-zèbre donnent également un aperçu des effets systémiques potentiels des médicaments. Bien que le développement des organes chez les embryons âgés de 2 à 3 jours ne soit pas complètement mature, les organes sont correctement localisés et partagent en partie la composition cellulaire avec leurs homologues adultes19.
Parmi les autres avantages de ce modèle, citons le fait que seules quelques cellules cancéreuses sont nécessaires pour la greffe, que le maintien des embryons hôtes est simple, car aucune alimentation n’est nécessaire dans les 5 premiers jours de vie, et que le succès de l’injection peut être rapidement évalué en raison de la transparence et de la taille des embryons. Une caractéristique unique est que seule l’immunité innée est active à ce stade de développement, ce qui facilite une greffe efficace20. Dans le protocole ZefiX décrit ici (voir résumé sur la figure 1), l’immunodéficience est encore renforcée par la suppression du système immunitaire inné pendant les 4 premiers jours de la vie à l’aide d’oligonucléotides antisens Morpholino stables ciblant spi1 et csf3r, qui bloquent la différenciation des macrophages et des neutrophiles 21,22,23.
Ce protocole diffère également des précédents protocoles de xénotransplantation de poisson-zèbre, qui ont été principalement développés pour les greffes de tumeurs solides et utilisent généralement des méthodes d’évaluation de la réponse aux médicaments basées sur l’imagerie globale. ZefiX est optimisé pour les cellules cancéreuses liquides, telles que les cellules BCP-ALL, et a été utilisé avec succès pour étendre du matériel patient frais ou fraîchement congelé21. ZefiX peut également être adapté aux cellules cancéreuses adhérentes en sélectionnant les enzymes appropriées pour la dissociation des tissus.
Un autre avantage majeur est l’analyse en aval par cytométrie en flux, qui offre plusieurs avantages : (i) un grand nombre de cellules greffées peuvent être traitées rapidement, ce qui permet une analyse statistique robuste au niveau de la cellule unique, (ii) le taux de prolifération et la viabilité peuvent être évalués simultanément dans des cellules individuelles, et (iii) les cytomètres en flux sont couramment disponibles dans les contextes de recherche clinique, permettant l’évaluation de la réponse médicamenteuse des cellules greffées à un seul niveau cellulaire en quelques heures. Pour garantir la reproductibilité, ce protocole fournit un pipeline standardisé de la préparation à l’analyse par cytométrie en flux, en passant par la transplantation, permettant de prédire la réponse aux médicaments dans les cellules LAL en une semaine.
Protocole
Toutes les expériences sur le poisson-zèbre sont conformes aux directives de la Charité-Universitätsmedizin Berlin, aux instituts de recherche en médecine expérimentale et aux autorités officielles. Toutes les études ont porté sur des embryons de poisson-zèbre < 6 jours après la fécondation (dpf), ce qui les exempte de la loi sur la protection des animaux. Les poissons-zèbres (Danio rerio) ont été élevés et maintenus dans l’animalerie de la Charité-Universitätsmedizin Berlin, à Berlin, en Allemagne, selon des protocoles standard. Ils ont été logés à 28 °C avec un cycle de 14 h de lumière et 10 h d’obscurité. Des poissons sauvages de souches AB ou TüLF ont été utilisés pour toutes les expériences.
REMARQUE : L’établissement de conditions de traitement optimales pour chaque médicament souhaité avant son application de ZefiX comprend plusieurs étapes nécessaires. Tout d’abord, déterminez la concentration inhibitrice demi-maximale (CI50) de chaque médicament à l’aide d’une lignée cellulaire appropriée dans un système de culture 2D conventionnel. Sur la base de l’expérience antérieure, les concentrations efficaces de médicament pour le traitement ZefiX peuvent être 5 à 50 fois supérieures à celles utilisées dans des conditions de culture cellulaire typiques21,24. Avant de traiter les embryons greffés, il est essentiel d’évaluer la toxicité dans les embryons hôtes non transplantés en utilisant la plage de concentration établie. Après avoir évalué la toxicité, exposez les embryons greffés dans des lignées cellulaires à diverses concentrations de médicament environ 50 fois la valeur IC50 précédemment déterminée en culture 2D. Si les cellules greffées ne montrent aucune réponse à des doses allant jusqu’à 100 fois l’IC50, le médicament peut être considéré comme inefficace pour ZefiX. Pour potentiellement améliorer l’efficacité, une option consiste à préconditionner les cellules greffées avec le médicament peu de temps avant leur transplantation dans des embryons25. Voir le tableau 1 pour toutes les solutions utilisées ici.
1. Jour 1 : Préparation de l’expérience
- Préparation du milieu E3 : Préparez 2 L de milieu E3 autoclavé à utiliser pour l’entretien des embryons.
- Préparation des oligonucléotides antisens (MO) morpholino : Préparez une solution mère de 50 μM contenant les deux MO dans un tube de microcentrifugation de 1,5 mL en utilisant de l’eau sans nucléases. Conservez la solution mère à température ambiante (RT). Préparez les MO pour l’injection en incubant la solution sur un bloc chauffant à 65 °C pendant 10 min.
REMARQUE : Les MO sont dirigés contre spi1 et csf3r pour inhiber la différenciation des macrophages et des cellules neutrophiles, comme décrit dans les références 22,23,26. - Préparation des plaques d’injection
- Pour préparer 4 à 5 plaques, dissoudre 1 % d’agarose dans un milieu E3 pour créer une solution de 100 ml. Pour les plaques de transplantation, versez ~20 ml de la solution dans chaque boîte de Pétri de 10 cm, en vous assurant qu’elles sont à moitié remplies. Agitez pour répartir uniformément le liquide.
- Pour les plaques d’injection Morpholino, placez le moule d’injection sur l’agarose liquide dans deux boîtes de Pétri, en veillant à ce qu’aucune bulle ne se forme. Couvrez les plats en inclinant les couvercles et laissez-les à RT jusqu’à ce que l’agarose se soit solidifié. Une fois solidifié, retirez le moule et conservez les plaques à l’envers à 4 °C dans un sac en plastique scellé.
- Préparation des aiguilles d’injection
- Pour les injections de Morpholino : Générer des aiguilles à partir de capillaires de 10 cm à l’aide d’un extracteur d’aiguille et casser les pointes pour atteindre un diamètre estimé à 10 μm (comme décrit en27).
- Pour la greffe de cellules : Utilisez des aiguilles d’injection à bout émoussé pré-tirées disponibles dans le commerce avec un diamètre extérieur de 20 μm.
- Culture de cellules greffées : Cellules divisées (p. ex., Nalm6) visant une densité cible de 70 % à 80 % au jour 4 dans un flacon de culture cellulaire T175 avec un milieu RPMI complété par 10 % de FCS et 1 % de P/S (RPMI-complet). Divisez les cellules 3 à 4 fois avant utilisation pour assurer un bon taux de prolifération.
REMARQUE : Pour la préparation de matériel de patient frais ou frais/congelé pour la transplantation, les instructions se trouvent à l’étape 4.3. Les cellules sont ensuite préparées le jour de la transplantation. - Reproduction du poisson-zèbre : Installez des poissons-zèbres de type sauvage dans des bassins de reproduction l’après-midi, en gardant les mâles et les femelles séparés.
REMARQUE : Les poissons-zèbres ont été élevés et stadifiés comme décrit dans la référence28. Les références temporelles (hpf ou dpf) indiquent les heures ou les jours après la fécondation.
2. Jour 2 : Injection de Morpholino
- Compléter 500 mL de milieu E3 autoclavé avec 1 % de pénicilline/streptomycine (E3/P/S) et remplir deux boîtes de Pétri de 10 cm. Sortez la plaque d’injection du réfrigérateur pour la préchauffer à RT.
- Ouverture échelonnée de la porte des réservoirs d’élevage de sorte que la fécondation ne puisse avoir lieu que dans une fraction des réservoirs à la fois (en fonction de la vitesse d’injection) pour assurer des micro-injections rapides de la solution Morpholino dans les embryons de poisson-zèbre au stade unicellulaire28,29. Commencez par ouvrir une ou deux portes en fonction de la vitesse de l’injecteur, lorsque le lot d’œufs est facilement injecté, ouvrez une autre porte ou deux portes et ainsi de suite.
- Transférez les ovules fécondés par lots de 100 avec le moins de liquide possible dans la plaque d’injection préalablement préparée. Alignez les embryons dans les rainures de la plaque.
- Injectez 1 nL d’un mélange de 50 μM des deux Morpholinos dans la cellule ou le sac vitellin juste en dessous de la cellule pendant le stade29 d’une cellule. Injectez suffisamment d’ovules pour les procédures ultérieures (par exemple, pour une plaque de 96 puits, injectez jusqu’à 200 ovules pour avoir suffisamment de sauvegarde pour un abandon potentiel avant la transplantation).
- Transférez les œufs injectés dans des boîtes de Pétri contenant E3/P/S. Incuber les œufs injectés à 28 °C. Conserver les œufs non injectés comme poissons témoins pour l’analyse par cytométrie en flux à 5 dpf. Stockez le reste du fluide E3/P/S à 4 °C.
3. Jour 3 : Déchorionnation
- Déchorionnement des embryons de poisson-zèbre : Déchorionner manuellement les embryons lorsqu’ils ont plus de 24 hpf à l’aide de deux pinces de précision29.
- À l’aide d’une pipette Pasteur, retirez des boîtes tous les embryons morts qui ne montrent ni battements cardiaques ni mouvement et qui semblent opaques ou les embryons de forme irrégulière.
- Pincez le chorion avec une pince de précision pour le maintenir en place. Pincez juste à côté de l’extrémité de la pince de précision, en maintenant l’embryon en place avec la deuxième pince, et écartez soigneusement le chorion pour libérer l’embryon
REMARQUE : Pour déchorionner les embryons de moins de 24 hpf, ils doivent être conservés sur une boîte recouverte d’agarose pour éviter qu’ils ne collent au plastique. La déchorionnation manuelle est préférée car elle est plus douce pour les embryons. Une autre méthode de déchorionation enzymatique est décrite ailleurs30.
- Incuber les embryons déchoionnés à 28 °C pendant la nuit.
4. Jour 4 : Xénotransplantation et traitement médicamenteux
- Préparation des embryons hôtes : Sortez les plaques d’agarose préparées et E3/P/S du réfrigérateur et laissez-les atteindre RT. Dépister les embryons pour le stade de développement approprié à 48 hpf à l’aide d’un stéréomicroscope. N’inclure dans le flux de travail que des embryons correctement stadifiés et morphologiquement typiques, comme décrit ailleurs29. Comptez tous les embryons sains et planifiez d’autres traitements. Ne conservez pas plus de 100 embryons par boîte de Pétri de 10 cm à 28 °C pour éviter les vitesses de développement inégales causées par le manque d’oxygène.
REMARQUE : Suivez l’étape 4.2. pour les lignées cellulaires. Pour les matières fraîches/congelées, passez directement à l’étape 4.3. - Préparation de lignées cellulaires
- Pour préparer des cellules BCP-ALL marquées par fluorescence pour la cytométrie en flux et la transplantation, laver les cellules (à partir de l’étape 1.5) avec 1x PBS : centrifuger à 350 x g pendant 5 min, et remettre en suspension dans 20 mL de PBS.
- Comptez les cellules et transférez 3 x 105 cellules non colorées dans un tube FACS pour l’analyse par cytométrie en flux du jour 0 (0 jours après l’injection, dpi). Conserver sur de la glace.
- Plaque 3 x 105 cellules dans 3 mL de RPMI-compléter dans un puits d’une plaque de 6 puits et maintenir à 37 °C pour un contrôle de 3 dpi.
- Transférez 1 x 107 cellules dans un tube à centrifuger de 15 ml pour l’étiquetage CTV. Centrifuger à 350 x g pendant 5 min à RT, verser le surnageant (utiliser une pipette pour le reste) et remettre la pastille en suspension dans 2,5 mL de PBS (RT) avec 1 μL de solution mère CTV.
- Incuber pendant 5 min dans l’obscurité à 37 °C, arrêter la réaction avec 12,5 mL de RPMI-complete, puis incuber pendant 10 min dans l’obscurité à 37 °C.
- Centrifuger à 350 x g pendant 5 min à RT et laver une fois avec 10 mL de RPMI-complete. Centrifuger à nouveau et remettre en suspension dans 10 mL de RPMI-complete.
- Filtrer les cellules à l’aide d’un filtre de 10 μm par centrifugation à 350 x g pendant 5 min. Remettez la pastille en suspension, comptez les cellules et transférez 3 x 105 cellules marquées CTV dans un tube FACS. Plaque 3x 10^5 cellules avec 3 mL de RPMI-complet dans un puits d’une plaque de 6 puits et maintenir à 37°C pour un contrôle de la prolifération de 3 dpi. Conservez les cellules restantes dans 1 mL de PBS sur de la glace jusqu’à la transplantation.
- Préparation de matériel patient frais/congelé
- Préchauffez deux tubes à centrifuger de 15 mL avec 10 mL de RPMI-complete chacun à 37 °C. Décongeler un flacon contenant 5-10 x 106 cellules dans un bain-marie à 37 °C.
- Une fois qu’il ne reste qu’une petite quantité de glace, transférez les cellules dans le tube de centrifugation avec le milieu préchauffé. Centrifuger à 350 x g pendant 5 min à RT, jeter le surnageant et remettre la pastille en suspension dans le deuxième tube de RPMI-complete préchauffé.
- Comptez les cellules viables à l’aide du bleu trypan. Aliquote 1x 10^5 cellules dans un tube à centrifuger de 1,5 mL et centrifuger cette aliquote de cellules dans un tube FACS à 350 x g pendant 5 min à RT, jeter le surnageant et remettre la pastille en suspension dans 300 μL de PBS.
- Stocker l’aliquote remise en suspension sur de la glace comme témoin non traité pour l’analyse par cytométrie en flux.
REMARQUE : Si la taille de l’échantillon est suffisante, maintenir un témoin non traité en culture pour la mesure par cytométrie en flux le jour 7. - Ajouter 1 μL de la solution mère CTV à 2,5 mL de PBS (RT) pour 1 x 106 cellules. Ajustez le volume de la solution mère CTV si moins de cellules sont disponibles.
- Incuber les cellules avec CTV pendant 5 min à 37 °C dans l’obscurité, arrêter la réaction en ajoutant 12,5 mL de RPMI-complete préchauffé (37 °C) et incuber pendant 10 min dans l’obscurité à 37 °C.
- Centrifugez les cellules à 350 x g pendant 5 min à RT et lavez les cellules une fois avec 10 mL de RPMI-complete. Centrifuger à nouveau à 350 x g pendant 5 min à RT et remettre les cellules en suspension dans 10 mL de RPMI-complete.
- Filtrer la suspension cellulaire dans un tube à centrifuger frais de 50 mL à l’aide d’un filtre de 10 μm et centrifuger à 350 x g pendant 5 min.
- Ne jetez pas le surnageant. Remettez la pastille en suspension et comptez les cellules. Transférez 3 x 105 cellules marquées CTV dans un tube FACS.
- Centrifuger les cellules restantes à 350 x g pendant 5 min à RT et jeter le surnageant. Remettre en suspension les cellules restantes dans 1 mL de PBS et les conserver sur de la glace jusqu’à ce qu’elles soient utilisées en transplantation.
REMARQUE : S’il reste suffisamment de cellules CTV positives, elles peuvent être maintenues en culture 2D parallèlement aux xénogreffes pour la comparaison du taux de prolifération.
- Mesure par cytométrie en flux
REMARQUE : La cytométrie en flux à 0 dpi doit être effectuée par une deuxième personne afin de minimiser le temps pendant lequel les cellules restent sur la glace avant la transplantation. Avant la première mesure par cytométrie en flux à l’aide du panel de coloration désigné (CTV, CD19-Alexa488, APC-Annexin V et 7AAD), effectuez un test de compensation en suivant les instructions du fabricant.- Préparez deux tubes FACS comme suit : Tube 1 : Cellules de contrôle non colorées ; Tube 2 : Cellules colorées avec CTV, CD19, 7AAD et Annexine.
REMARQUE : Coloration et marquages : CellTrace Violet (CTV) identifie les cellules greffées marquées par rapport aux cellules de poisson hôte et évalue le taux de prolifération après 3 jours. L’anticorps CD19, un marqueur de surface cellulaire, sert de marqueur supplémentaire pour l’identification des cellules greffées humaines BCP-ALL. Pour d’autres types de cancer, d’autres anticorps marqueurs peuvent être nécessaires. L’annexine V marque l’apoptose à un stade précoce pour l’évaluation de la viabilité cellulaire. 7AAD marque l’apoptose ou la nécrose à un stade avancé pour l’évaluation de la viabilité cellulaire. - Tubes à centrifuger (l’un contenant des cellules colorées au CTV et l’autre des cellules non colorées) à 350 x g pendant 5 min à RT et jeter le surnageant du tube 1. Remettez la pastille en suspension dans 310 μL de tampon de liaison à l’annexine (ABB).
- Tube 2 : Effectuez la coloration des anticorps et de la viabilité comme décrit ci-dessous.
REMARQUE : Ce protocole de coloration est optimisé pour la coloration des cellules B CD19. Pour d’autres anticorps humains utilisés pour le marquage de différents types de cellules, le protocole peut nécessiter une adaptation.- Ajouter 98 μL d’ABB dans le tube 2 (contenant des cellules marquées CTV). Ajouter 2 μL d’anticorps CD19-Alexa488 (dilution 1:50) aux 98 μL d’ABB ajoutés. Bien mélanger.
- Incuber le mélange à 4 °C pendant 30 min et ajouter 500 μL d’ABB pour arrêter la réaction. Centrifuger le tube à 350 x g pendant 5 min à 4 °C. Retirez le surnageant et répétez l’étape de lavage.
- Remettre la pastille en suspension dans 100 μL d’ABB et procéder à la coloration 7AAD et APC-Annexine V. Effectuez la coloration 7AAD et l’APC Annexine V et la mesure par cytométrie en flux comme décrit ci-dessous.
- Ajouter 5 μL de 7AAD et 5 μL d’APC-Annexine V dans les cellules remises en suspension. Agiter doucement pour mélanger. Incuber le tube pendant 15 minutes dans l’obscurité à RT. Ajouter 200 μL d’ABB pour atteindre un volume final de 310 μL.
- Effectuez l’analyse par cytométrie en flux le jour de la transplantation dans l’ordre suivant pour éviter la contamination croisée : cellules de contrôle non colorées (tube 1), cellules marquées au CTV colorées avec Alexa488-CD19, APC-Annexine V et 7AAD (tube 2). Enregistrez au moins 10 000 événements par échantillon pour une analyse suffisante.
- Préparez deux tubes FACS comme suit : Tube 1 : Cellules de contrôle non colorées ; Tube 2 : Cellules colorées avec CTV, CD19, 7AAD et Annexine.
5. Transplantation
- Plaque de transplantation : Préparez deux boîtes de Pétri de 10 cm remplies de E3/P/S et placez-les dans l’incubateur à 28 °C pendant au moins 30 minutes pour préchauffer.
- Préparation des cellules : Centrifuger les cellules à 350 x g pendant 5 min à RT, jeter le surnageant et prélever tout liquide restant à l’aide d’une micro-pipette. Ajouter du PBS pour obtenir un volume final de 20 μL. Maintenir la suspension cellulaire concentrée sur de la glace.
REMARQUE : Les cellules ne doivent pas rester sur la glace plus de 2 h pendant la procédure de transplantation. - Aiguille de transplantation et préparation de l’embryon hôte
- Transférez 25 à 30 embryons dans l’une des boîtes de Pétri préchauffées contenant E3/P/S à l’aide d’une pipette Pasteur en verre pour servir de contrôle. Chargez 4 μL de la suspension cellulaire dans l’aiguille de transplantation à l’aide d’une pointe de micro-chargeur.
REMARQUE : Le chargement doit se dérouler sans problème en 1 à 2 minutes. Si ce n’est pas le cas, ajoutez soigneusement plus de PBS à la suspension cellulaire. - Calibrez la pression d’injection et la longueur d’impulsion en ajustant le micro-injecteur. Ajuster jusqu’à ce qu’une injection expulse environ 1 000 cellules LAL ou 2 nL de suspension cellulaire (pour 1x 107 cellules dans 20 μL). Pour estimer 1 000 cellules, il faut expulser un volume de la suspension sur une surface d’agarose recouverte d’un fluide. Comptez 100 cellules dans une petite zone, extrapolez leur distribution à la population cellulaire totale et estimez le nombre total.
- Préparez 50 mL d’E3 contenant de la tricaïne (concentration finale : 80 mg/L). Transférez les embryons hôtes dans la solution de tricaïne et incubez pendant au moins 2 minutes pour assurer une anesthésie correcte. L’embryon est correctement anesthésié lorsqu’aucune réponse motrice n’est observable
REMARQUE : Une pointe de micro-chargeur ou une pince peut être utilisée pour approcher et/ou toucher soigneusement l’embryon. - Transférez 15 à 20 embryons déchorionnés dans une boîte d’injection enrobée d’agarose (voir les instructions de préparation précédentes) en utilisant le moins de liquide possible pour éviter que les embryons ne glissent.
- Disposez les embryons comme illustré à la figure 2A. Injecter environ 1 000 cellules BCP-ALL CTV-positives dans la cavité péricardique. Introduisez l’aiguille à un angle de 45° par rapport à la direction dorso-caudale, comme le montre la figure 2B pour injecter les cellules.
REMARQUE : Utilisez des aiguilles pré-tirées, à extrémité émoussée, d’un diamètre d’ouverture de 20 μm, spécialement conçues pour les petites cellules leucémiques (voir la liste des matériaux). Si l’aiguille se bloque, coupez-la si nécessaire, mais recalibrez le volume d’injection et le nombre de cellules par la suite. - Une fois que les 15 à 20 embryons sont injectés, transférez-les dans la boîte de Pétri préchauffée remplie d’E3/P/S et maintenez-la à 28 °C.
- Répétez les étapes jusqu’à ce qu’environ 100 à 150 embryons soient transplantés pour un test de traitement médicamenteux, qui devrait inclure trois concentrations de médicament et un contrôle.
- Incuber les embryons transplantés et les témoins non transplantés à 28 °C pendant 1 à 3 h avant de commencer le traitement médicamenteux.
- Transférez 25 à 30 embryons dans l’une des boîtes de Pétri préchauffées contenant E3/P/S à l’aide d’une pipette Pasteur en verre pour servir de contrôle. Chargez 4 μL de la suspension cellulaire dans l’aiguille de transplantation à l’aide d’une pointe de micro-chargeur.
- Traitement médicamenteux in vivo (plaque de 96 puits)
- À l’aide d’une stéréomicroscopie à fluorescence, dépister les embryons pour confirmer la réussite de la greffe (figure 2C). Assurez-vous que le jaune est intact, car l’environnement du vitellin peut être toxique pour les cellules greffées21. Jetez les embryons avec des cellules dans le jaune.
- Préparez 2,5 mL d’une solution concentrée 2x pour chaque condition médicamenteuse à tester dans E3/P/S avec 0,5 % de DMSO. De plus, préparer une solution de contrôle de véhicule de 5 mL contenant 0,5 % de DMSO dans E3/P/S.
- Ajouter 100 μL de E3/P/S + 0,5 % de DMSO dans chaque puits d’une plaque de 96 puits. Cette étape empêche le transfert involontaire de quantités minimales de médicament entre les puits.
- Transférez soigneusement un embryon greffé dans chaque puits. À l’aide d’une pipette Pasteur en verre, prélevez chaque embryon dans le moins de milieu E3 possible.
- Laissez l’embryon couler au fond de la pointe de la pipette en inclinant doucement la pipette et relâchez-le dans le puits en utilisant les forces capillaires. Évitez de toucher le fluide dans le puits pendant le transfert.
- Ajouter des solutions médicamenteuses à la plaque : Remplissez 24 puits (2 rangées) de la plaque de 96 puits avec 100 μL de la solution de contrôle du véhicule ou l’une des trois solutions médicamenteuses concentrées 2x.
REMARQUE : Les concentrations efficaces du médicament doivent être déterminées lors d’expériences préalables spécifiques à chaque médicament testé. - Maintenir les embryons à 35 °C pendant 72 h, y compris les embryons non transplantés, qui serviront de témoins pour l’analyse par cytométrie en flux le jour 7.
6. Jour 7
- Dissociation embryonnaire/greffon
- Criblez la plaque de 96 puits à l’aide de la stéréomicroscopie pour identifier et sélectionner des embryons de poisson-zèbre sains. Regroupez au hasard 10 embryons hôtes sains de chaque condition dans un tube de microcentrifugation de 1,5 mL (idéalement, ce qui donne 2 tubes par condition).
- Retirez autant de liquide que possible de chaque tube contenant un embryon et sacrifiez les embryons par choc hypothermique en incubant les tubes sur de la glace pendant 1 h.
- Ajouter 500 μL de solution saline équilibrée de Hank’s (HBSS) sans calcium ni magnésium dans chaque tube. Dissocier mécaniquement les embryons et les cellules greffées par trituration à l’aide d’une pointe de micropipette de 200 μL, en pipetant de haut en bas environ 15 fois.
- Granuler les fragments de tissu par centrifugation à 350 x g pendant 5 min à RT. Pendant ce temps, préparez des tubes FACS avec un capuchon de filtre à mailles fines de 35 μm contenant 2 ml de PBS par condition (4 tubes au total).
- Remettre en suspension chaque pastille dans 500 μL de mélange d’enzymes (0,01 % de papaïne, 0,1 % de dispase II, 0,01 % de désoxyribonucléase I et 12,4 mM de MgSO4 dans un HBSS sans calcium ni magnésium) pour la dissociation enzymatique. Incuber à RT pendant 15 min.
- Pendant l’incubation, pipetez le mélange de haut en bas toutes les 5 minutes à plusieurs reprises en utilisant la même pointe de pipette pour chaque tube individuel afin d’éviter la perte de tissu.
- Mesure par cytométrie en flux
- Transférez les cellules dissociées dans le capuchon de filtre à mailles fines de 35 μm des tubes FACS et centrifugez à 350 x g pendant 5 min.
- Pendant la centrifugation, préparez un mélange maître pour la coloration de surface des cellules B CD19. Combinez 98 μL d’ABB avec 2 μL d’anticorps anti-CD19 humain Alexa Fluor 488 pour chaque condition.
- Jetez le surnageant de la pastille cellulaire dissociée et remettez la pastille en suspension dans 100 μL du mélange maître de coloration CD19.
- Effectuez le protocole de coloration CD19, 7AAD et APC Annexin V pour tous les échantillons ZefiX, y compris 3 x 10cellules 5 CTV positives issues de cultures cellulaires parallèles si disponibles.
- Effectuer une analyse par cytométrie en flux conformément à l’ordonnance et consigner le nombre d’événements indiqué au tableau 2. Analysez tous les échantillons contenant des cellules hôtes et des cellules greffées aussi complètement que possible pour évaluer le nombre total de cellules greffées.
- Analyse des résultats à l’aide d’un logiciel commercial.
- Stratégie de contrôle pour l’échantillon de culture cellulaire : ouvrez le logiciel et chargez les fichiers FCS dans l’espace de travail. Créez un diagramme à points avec CD19 et CTV pour vous assurer que le signal se chevauche et pour confirmer la présence des cellules cancéreuses. Ensuite, créez un graphique à points avec FSC-A (axe x) et SSC-A (axe y) pour distinguer les cellules intactes (Q2) des débris (Q4 ; Figure 3A').
- Utilisez la population de cellules intactes pour créer un nouveau graphique avec SSC-H (axe des x) et SSC-A (axe des y) pour identifier les cellules individuelles (figure 3A'').
- Créez un autre diagramme à points avec Annexin V (axe x) et 7AAD (axe y) en utilisant la population Single Cells (Figure 3A'''). Distinguer les cellules en quatre populations : Cellules viables : Annexine V négative, 7AAD négative (Q4) ; Cellules apoptotiques précoces : Annexine V positive, 7AAD négative (Q3) ; Cellules apoptotiques/nécrotiques tardives : Annexine V positive, 7AAD positive (Q2) ; Cellules nécrotiques : Annexine V négative, 7AAD positive (Q1).
- Répétez ces étapes pour des échantillons de 3 ppp (Figure 3B).
- Stratégie de contrôle pour les cellules du greffon et de l’embryon hôte
- Séparez les cellules greffées humaines des cellules hôtes à l’aide d’un graphique à points avec CTV (axe x) et CD19 (axe y). Identifier et isoler les cellules greffées doublement positives CTV/CD19 (Figure 3C).
- Appliquer la même stratégie de contrôle décrite pour les cellules de culture 3 dpi (Figure 3B' - B''') à la population de cellules greffées. Copiez la stratégie de contrôle pour plus de cohérence.
- Fusionnez toutes les populations de cellules Annexine V et 7AAD négatives dans un histogramme avec des valeurs CTV sur l’axe des x (Figure 3D). Calculez la moyenne géométrique des cinq échantillons pour déterminer les taux de prolifération.
- Calculs pour l’évaluation de la réponse au traitement
- Pour déterminer le nombre de divisions cellulaires après 3 jours, utilisez la formule :
n = log2 (I0/I)
Où, I0 = Intensité de fluorescence CTV initiale (moyenne géométrique, 0 dpi), I = Intensité de fluorescence CTV à 72 h, n = Nombre de divisions cellulaires.
Exemple : Cellules de patients fraîchement congelées divisées 2,6 fois dans le log ZefiX2(88317/14644) = 2,6
et 2,8x dans le log de culture 2D2(88317/12992) = 2,8 - Pour déterminer le nombre total de cellules greffées par poisson après 3 jours, divisez le nombre total de cellules cancéreuses (y compris les cellules apoptotiques mais à l’exclusion des débris) par le nombre de poissons regroupés dans l’échantillon (généralement n = 10).
- Pour déterminer la viabilité des cellules greffées CTV-positives après 3 jours, utilisez la formule :
V = (C/100) x A
Où : V = Viabilité, C = fraction de cellules individuelles intactes sans débris (en pourcentage), A = fraction de cellules négatives en annexe V et 7AAD (en pourcentage).
- Pour déterminer le nombre de divisions cellulaires après 3 jours, utilisez la formule :
Résultats
Pour une évaluation scientifique détaillée du protocole ZefiX, y compris la xénogreffe et le traitement médicamenteux d’échantillons de cellules primaires BCP-ALL fraîchement congelés, veuillez vous référer au manuscrit21 précédemment publié. L’autorisation d’utiliser des échantillons de patients dans la recherche pour des tests précliniques de médicaments a été accordée dans le cadre d’études complémentaires à l’essai ALL-REZ BFM 2002 (NCT00114348) et au registre et biobanque ALL-REZ BFM (EA2/055/12) par les comités locaux d’éthique de la recherche médicale, ainsi qu’à l’essai international IntReALL SR 2010 (NCT01802814) par l’autorité nationale. Le consentement éclairé a été obtenu des patients et/ou de leurs tuteurs par le biais de l’essai ou du registre respectif auquel ils ont été inscrits.
La figure 2 illustre un exemple d’alignement d’embryons dans une boîte d’agarose avant l’injection, ce qui permet de rationaliser le processus d’injection. L’injection doit être effectuée à l’angle décrit pour cibler précisément la cavité entourant le cœur en développement. De plus, la figure 2C fournit une référence d’embryons de 2 dpf injectés avec succès contenant des cellules greffées humaines (en bleu), qui ont été marqués avec CTV avant l’injection. Les embryons dont les résultats de l’injection différaient de ceux présentés à la figure 2C ont été exclus, en mettant l’accent sur la prévention de la perforation du sac vitellin pour assurer la viabilité des cellules du greffon pendant l’incubation subséquente de trois jours.
Après la période d’incubation de trois jours, les embryons de l’hôte sont traités par groupes de 10 pour une analyse par cytométrie en flux. Après dissociation enzymatique, les suspensions cellulaires sont colorées avec un anticorps anti-CD19 humain et deux marqueurs de viabilité : l’annexine V pour les cellules apoptotiques précoces et la 7AAD pour les cellules apoptotiques et nécrotiques tardives.
La figure 3 présente les données de cytométrie en flux des cellules BCP-ALL expansées par ZefiX provenant d’un patient atteint de BCP-ALL. Les panneaux A, A', A'' et A'''' montrent les données collectées à 0 dpi le jour de la transplantation. La figure 3A affiche les valeurs de fluorescence CTV et CD19 pour un total de 10 000 cellules comme référence pour la stratégie de déclenchement appliquée aux suspensions de cellules hôte-greffon à 3 dpi (Figure 3C). Dans la figure 3A, les débris sont exclus par un marquage régulier des cellules à l’aide de la zone de diffusion vers l’avant (FSC-A) et de la zone de diffusion latérale (SSC-A). Dans la figure 3A'', les cellules simples sont séparées des doublets à l’aide d’un graphique de la hauteur du SSC (SSC-H) par rapport au SSC-A. Cette population unicellulaire est utilisée pour l’évaluation de la viabilité dans la figure 3A''', où les cellules viables (Q4) sont distinguées des cellules apoptotiques précoces (Q3, valeurs plus élevées d’Annexine V) et des cellules apoptotiques ou nécrotiques tardives (Q2, niveaux plus élevés de 7AAD).
À titre de comparaison, des cellules de patients cultivées dans des conditions 2D conventionnelles sont également analysées par cytométrie en flux après trois jours (Figures 3B,B',B'',B''), suivant la même stratégie de gating. La viabilité des cellules du patient après 72h en culture 2D est calculée à partir de Q2 dans la figure 2B' et Q4 dans la figure 2B''' : (95,0 %/100)*61,9 % = 58,8 %.
Sur la figure 3C, le matériau de départ est la suspension cellulaire d’embryons hôtes contenant des cellules greffées. Contrairement aux mesures in vitro, toutes les cellules du tube sont analysées par cytométrie en flux. Les cellules greffées CD19 et CTV positives sont contrôlées pour les séparer des cellules de poisson CD19 et CTV négatives. La population de cellules greffées intactes est analysée plus en détail dans la figure 3C, où les débris sont exclus. La viabilité des cellules greffées uniques est ensuite évaluée à l’aide de la même stratégie de contrôle que dans les figures 3B.
Les résultats indiquent que le pourcentage de cellules uniques viables développées dans les embryons est de 95,2 %, ce qui est 1,6 fois plus élevé que la viabilité des cellules cultivées dans une boîte (Figure 3B'''). Les taux de division cellulaire ont été calculés in vivo et in vitro en analysant la diminution de l’intensité de fluorescence du CTV dans chaque population de 0 dpi à 3 dpi (Figure 3D). Le nombre de divisions cellulaires a été déterminé à l’aide de la formule de la section 6.4.1 et de la moyenne géométrique de chaque courbe CTV (figure 3D). Les taux de division calculés (2,59 divisions in vivo et 2,77 divisions in vitro) suggèrent que les cellules viables se divisent à un rythme similaire dans les deux conditions sur trois jours.
Enfin, le nombre moyen de cellules greffées intactes par embryon après trois jours a été déterminé en divisant le nombre de cellules greffées intactes (hors débris, Figure 3C') par le nombre d’embryons regroupés dans un tube21.
En conclusion, les échantillons frais de BCP-ALL greffés dans des embryons de poisson-zèbre présentent une viabilité plus élevée après trois jours par rapport à la culture conventionnelle dans une boîte et les cellules viables se divisent à un rythme comparable dans les deux conditions.
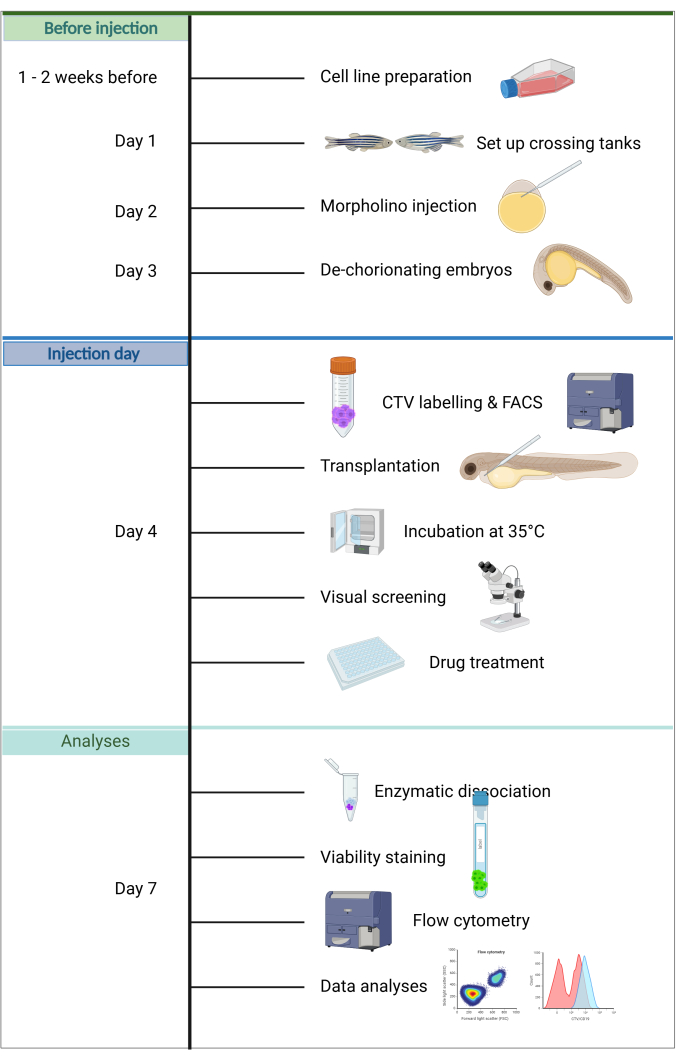
Graphique 1. Flux de travail du pipeline ALL-ZefiX. Créé en https://BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
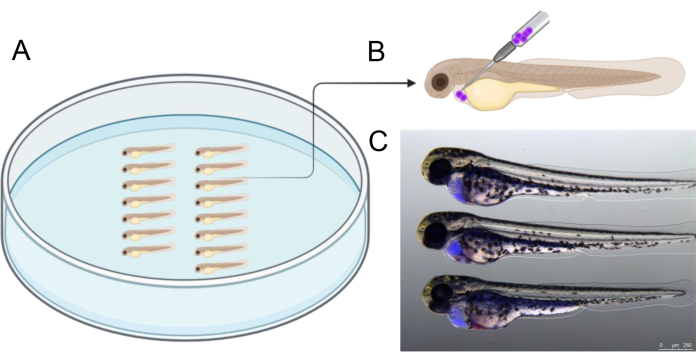
Figure 2 : Disposition des embryons telle qu’elle est illustrée facilite l’injection. Les embryons peuvent être disposés à l’aide d’une pince ou d’une pointe de pipette à microchargeur de 20 μL qui a été coupée pour avoir une pointe de 2,5 à 3 cm de longueur. (B) Représentation schématique de l’angle d’injection recommandé pour greffer des cellules dans le péricarde d’embryons de 2 dpf. (C) Des aides visuelles pour estimer correctement la quantité de cellules cancéreuses transplantées. Cette photo montre un embryon de 48 hpf à 3 h après l’injection avec des cellules cancéreuses humaines préalablement marquées avec CellTrace Violet). Créé en https://BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
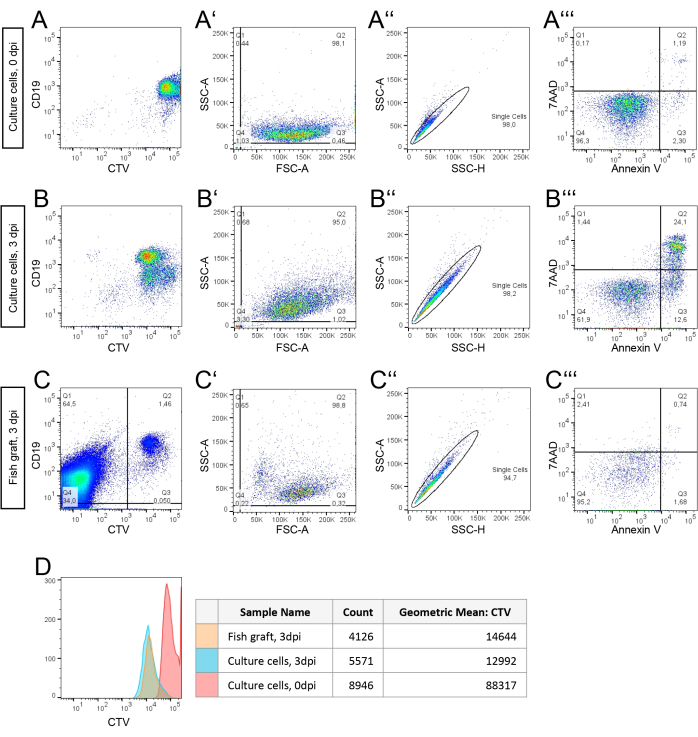
Figure 3 : Stratégie de contrôle et analyse par cytométrie en flux d’un échantillon frais congelé dérivé d’un patient de cellules blastiques BCP-ALL isolées après culture 2D d’une greffe dans des embryons de poisson-zèbre. (A, B) Les cellules des patients ont été marquées avec CellTrace Violet (CTV) avant la culture. Les cellules ont été cultivées sur du plastique de culture tissulaire à 37 °C pendant 0h (A) ou 72 h (B) avant l’analyse par cytométrie en flux. (C) Cellules de patients marquées avec CTV et cultivées à 35 °C pendant 72 h sous forme de greffons dans des embryons de poisson-zèbre hôte. Un groupe de 10 embryons a été regroupé avant la dissociation unicellulaire pour une analyse par cytométrie en flux. La stratégie de contrôle en (B) a été appliquée, et la fraction viable de cellules greffées a été identifiée et quantifiée. Pour ce faire, les cellules greffées CTV positives (Q2) ont été séparées des cellules de poisson-zèbre auto-fluorescentes (Q1/4) afin de trier la population de cellules greffées à analyser. L’intensité du marquage CTV a été analysée dans cette population de cellules greffées. (D) Nombre de cellules et intensité moyenne des marqueurs CTV à partir de la sélection de cellules viables uniquement. Notez le décalage de l’intensité de la CTV après 3 jours (3 dpi). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Tableau des solutions utilisées. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Échantillons mesurés par cytométrie en flux. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les embryons de poisson-zèbre sont devenus un modèle de xénogreffe de plus en plus populaire pour le dépistage des médicaments et la recherche sur le cancer en raison de leur capacité de débit élevée et de leur rentabilité. Ces xénogreffes sont prometteuses en tant que pilier essentiel de la médecine translationnelle, aidant à la recherche préclinique et à la prise de décision 9,21. Cependant, les modèles de xénogreffes de poisson-zèbre pour l’expansion cellulaire et le traitement de la leucémie humaine restent sous-représentés par rapport au vaste corpus de travaux sur les greffes de tumeurs solides. Ce protocole offre des conseils détaillés pour tirer parti des xénogreffes de poisson-zèbre dans la recherche sur la leucémie tout en restant adaptable pour une utilisation dans les tumeurs solides.
Il peut être difficile d’obtenir une greffe de cellules cancéreuses cohérente, ce qui souligne la nécessité d’une analyse standardisée et d’une fiabilité statistique plus élevée. Ce protocole résout ces problèmes en présentant un pipeline complet pour la préparation, la transplantation et l’analyse de cytométrie en flux en aval, ainsi que des recommandations de dépannage.
Injection de Morpholino pour l’immunosuppression transitoire
Les embryons de poisson-zèbre dépendent de leur système immunitaire inné pendant les premiers jours de développement, ce qui définit le calendrier de ce pipeline expérimental20. Les macrophages primitifs émergent autour de 12 hpf, certains se différenciant en neutrophiles par 33 hpf 20,31,32. Les lymphocytes T entrent en circulation environ 8 jours après la fécondation 20,33. Les macrophages et les neutrophiles, dans le cadre de la réponse immunitaire innée, ont été impliqués dans la survie réduite des cellules BCP-ALL observée trois jours après la transplantation dans des études antérieures21.
L’immunosuppression temporale médiée par la morpholino, ciblant spi1 et csf3r, inhibe efficacement la différenciation des macrophages et des neutrophiles, conduisant à une meilleure greffe de cellules BCP-ALL sans affecter la viabilité embryonnaire21. Bien que cette méthode ne puisse pas aboutir à un épuisement permanent, car l’élimination complète de spi1 et csf3r est mortelle, elle reste la meilleure approche pour ce pipeline.
L’étalonnage des volumes d’injection à l’aide d’un réticule et l’administration précise dans le sac vitellin au stade unicellulaire garantissent des injections cohérentes de Morpholino avec des taux de survie élevés. Des alternatives telles que les injections liposomiques de clodronate (Clodrosome) pour la déplétion des macrophages se sont révélées prometteuses, mais nécessitent une validation supplémentaire pour ce pipeline34,35.
Préparation cellulaire
Une population cellulaire suffisamment dense et viable est essentielle pour une expansion réussie de BCP-ALL dans ce protocole. CellTrace Violet (CTV) est utilisé pour le marquage fluorescent afin d’évaluer le succès de l’implantation à 0 dpi et de suivre les taux de prolifération tout au long de l’expérience. Contrairement à d’autres étiquettes, la CTV ne modifie pas le comportement des cellules, ce qui permet une analyse précise de la prolifération au niveau d’une seule cellule. Cela offre des avantages par rapport à la coloration des anticorps Ki-67, qui ne capture que les cellules pendant la prolifération, mais pas les cellules divisées qui sont déjà sorties du cycle cellulaire.
La CTV surpasse également le CellTracker CM-DiI (DiI) en ce qui concerne la viabilité cellulaire. DiI et ses dérivés sont des fluorophores plus stables, persistant souvent au-delà de la mort cellulaire, ce qui peut fausser les résultats expérimentaux2. De plus, l’inclusion d’un anticorps spécifique de BCP-ALL contre CD19 dans la cytométrie en flux permet une identification précise des cellules greffées. Les anticorps spécifiques à l’homme, tels que l’anti-HLA, peuvent servir d’alternatives pour d’autres types de cellules cancéreuses36.
Greffe de cellules cancéreuses
Une greffe constante nécessite une dilution et une concentration optimales de la suspension cellulaire. La suspension doit maintenir une densité suffisante tout en évitant une viscosité qui nuit à l’injection. Ce protocole privilégie l’injection dans la cavité péricardique ou l’espace périvitellin (PVS) plutôt que dans le sac vitellin, car ces sites offrent une meilleure vascularisation et moins de conditions hypoxiques37. La transplantation de sac vitellin, bien qu’accessible, entraîne souvent des taux de mortalité élevés et une faible viabilité cellulaire21.
L’obstruction des aiguilles par les microparticules reste un défi procédural. La filtration de la suspension cellulaire et le recalibrage des volumes d’injection après la coupe des aiguilles bouchées sont des étapes essentielles. Seuls les embryons avec un péricarde densément rempli doivent être utilisés pour les traitements médicamenteux ultérieurs21,36.
La température d’incubation suggérée de 35 °C équilibre la température naturelle des cellules cancéreuses humaines (37 °C) et la température standard du logement du poisson-zèbre (28 °C)21. Les embryons de poisson-zèbre s’adaptent à cette température avec des déformations de développement minimales, et l’environnement améliore la prolifération et la survie des cellules fraîches dérivées de patients38.
Traitement médicamenteux
Des modèles de xénogreffes de poisson-zèbre ont été développés pour faciliter le criblage de médicaments à haut débit. Cependant, le traitement médicamenteux reste l’un des aspects les plus difficiles du test ZefiX. De nombreux médicaments standard et thérapies ciblées n’atteignent pas efficacement les cellules greffées in vivo. Cela pourrait également nécessiter l’essai d’un plus grand panel de concentrations de drogues. Les exemples réussis, tels que le vénétoclax et le dasatinib, nécessitent des concentrations nettement plus élevées que dans les tests de culture 2D conventionnels21.
Alternativement, le prétraitement des cellules in vitro avant la transplantation permet également d’étudier certains effets systémiques et localisés. Par exemple, cette approche peut convenir aux traitements à base de virus adéno-associés (AAV) dans le glioblastome39.
Si des effets du traitement médicamenteux sont observés in vitro mais pas in vivo à l’aide de ce pipeline, une alternative pourrait être, par exemple, de transplanter dans le stade 1k-cell (3 hpf) ou le stade blastula et de commencer le traitement médicamenteux à 24 hpf40,41. Cela pourrait permettre aux médicaments d’atteindre les cellules greffées qui ne réussissent pas dans les embryons âgés de 48 h ou à la co-injection de cellules et de médicaments en même temps25.
Analyse de dissociation et cytométrie en flux
La dissociation tissulaire est essentielle pour analyser le nombre total de cellules greffées et interpréter de manière fiable les résultats expérimentaux. Une combinaison de dissociation mécanique et enzymatique garantit une suspension unicellulaire de haute qualité tout en maintenant l’intégrité des protéines de surface cellulaire. Il peut être nécessaire d’ajuster les conditions de dissociation (p. ex., composition enzymatique, pipetage ou utilisation d’un homogénéisateur Dounce) pour différents types de cancer.
Les échantillons doivent être filtrés pour éviter l’obstruction du cytomètre en flux, et les protéines ou lipides collants peuvent être atténués par l’EDTA ou le déyolme embryonnaire avant la dissociation.
Résumé
Le protocole ZefiX fournit un pipeline expérimental rapide et rentable pour la recherche préclinique sur le cancer, les études de résistance aux médicaments et les évaluations de traitement personnalisées. Bien que les modèles de xénogreffes de poisson-zèbre aient des limites et ne puissent pas s’adapter à tous les types de médicaments, ce protocole standardisé permet l’expansion in vivo de cellules et de lignées cellulaires de leucémie de patients frais. Adaptable à d’autres types de cancer, il offre un outil prometteur pour la prédiction rapide et personnalisée de la réponse aux médicaments dans le cadre de la prise de décision clinique.
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) au sein du Centre de recherche collaborative CRC1588, projet numéro 493872418 et la Dr. Kleist Stiftung, Berlin, ainsi que par la Deutsche José Carreras Leukämie Stiftung (R03/2016), la Berliner Krebsgesellschaft (HEFF201633KK) et le Consortium allemand contre le cancer (DKTK, Joint Funding Call 2016). Nous remercions Julia Köppke et Mareike Wolff pour leur lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
Références
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon