Method Article
Predição rápida de resposta a medicamentos in vivo usando enxertos de células de leucemia em embriões de peixe-zebra
Neste Artigo
Resumo
Este protocolo fornece instruções passo a passo para gerar e solucionar problemas de xenoenxertos de leucemia linfoblástica aguda humana (LLA) de linhagens celulares e material fresco do paciente em embriões de peixe-zebra imunossuprimidos transitoriamente, juntamente com diretrizes para avaliação de resposta a medicamentos usando citometria de fluxo. O pipeline experimental também pode ser adaptado para tumores sólidos.
Resumo
O xenotransplante de peixe-zebra é uma técnica fundamental para investigar a patogênese do câncer humano e prever respostas individuais a medicamentos. Este documento apresenta um protocolo simplificado (ZefiX) para expandir amostras primárias de pacientes com leucemia linfoblástica aguda precursora de células B (BCP-ALL) ou linhagens celulares imortalizadas em embriões de peixe-zebra imunossuprimidos transitoriamente, utilizando citometria de fluxo para análise de célula única de alta resolução das respostas ao tratamento. Em comparação com enxertos de tumores sólidos, as células de leucemia lucram significativamente com uma supressão baseada em oligonucleotídeos morfolinos antisense de fatores diferenciadores de macrófagos e neutrófilos durante o ensaio. A análise por citometria de fluxo de células de enxerto dissociadas permite uma avaliação precisa da contagem de células, taxa de proliferação e vitalidade após o tratamento por célula. Essa abordagem foi validada usando terapias direcionadas, como venetoclax e dasatinibe, com resultados de tratamento comparados a registros clínicos de amostras de pacientes relacionadas e controles de cultura 2D tradicionais. Notavelmente, o protocolo é concluído em 7 dias, alinhando-se com os cronogramas de tomada de decisão clínica. A metodologia é adaptável para testar medicamentos selecionados em vários tipos de câncer, incluindo tumores sólidos, apoiando estratégias terapêuticas personalizadas. No entanto, limitações no número de medicamentos que podem ser avaliados, provavelmente devido a restrições farmacocinéticas em embriões de peixe-zebra, devem ser consideradas.
Introdução
O xenotransplante de peixe-zebra tornou-se um modelo in vivo crucial para entender a patogênese do câncer e prever as respostas aos medicamentos 1,2,3,4,5. Os modelos animais continuam sendo críticos para testes pré-clínicos de medicamentos, e o modelo de peixe-zebra oferece vantagens significativas sobre outros sistemas in vivo, incluindo alto rendimento e custo-benefício 6,7,8. Este modelo também pode ajudar nas previsões personalizadas de resposta ao tratamento, incluindo terapias moleculares direcionadas e terapia com células CAR-T 9,10,11,12.
A BCP-LLA pode se beneficiar particularmente do xenoenxerto de peixe-zebra, pois a expansão das células primárias do paciente em cultura continua sendo um desafio13. Há uma necessidade inegável de novas abordagens de tratamento na LLA. Apesar de uma alta taxa de remissão de 80%-85% em crianças com LLA-BCP, as taxas de sobrevida em longo prazo para pacientes com doença recidivante ou refratária variam apenas entre aproximadamente 30%-60%14,15,16. Nesses casos, o teste de drogas usando o pipeline proposto pode ser integrado ao ambiente clínico para identificar a terapia ideal específica para o paciente14,15. Essa abordagem personalizada pode ser crucial ao lidar com múltiplas resistências a medicamentos, reduzindo significativamente a carga de tratamento para os pacientes, evitando medicamentos ineficazes ou abaixo do ideal com efeitos colaterais graves.
Várias características tornam o xenoenxerto de embrião de peixe-zebra um modelo adequado. As semelhanças genéticas entre humanos e peixes-zebra - 70% de homologia genética e 84% de genes ligados a doenças compartilhados - apóiam estudos de interação gene-droga17. O uso de um embrião hospedeiro transgênico pode, portanto, revelar predisposições genéticas que afetam a suscetibilidade a drogas18. Alternativamente, células com modificações genéticas específicas podem ser transplantadas para avaliar se a sensibilidade ou resistência ao medicamento se alinha com os achados in vitro . Os xenoenxertos de embriões de peixe-zebra também fornecem informações sobre os potenciais efeitos sistêmicos das drogas. Embora o desenvolvimento dos órgãos em embriões de 2-3 dias de idade não esteja totalmente maduro, os órgãos estão corretamente localizados e compartilham parcialmente a composição celular com seus homólogos adultos19.
Outras vantagens deste modelo incluem que apenas algumas células cancerígenas são necessárias para o enxerto, a manutenção dos embriões hospedeiros é simples, pois não é necessária alimentação nos primeiros 5 dias de vida e o sucesso da injeção pode ser avaliado rapidamente devido à transparência e tamanho dos embriões. Uma característica única é que apenas a imunidade inata está ativa neste estágio de desenvolvimento, facilitando o enxerto eficiente20. No protocolo ZefiX descrito aqui (ver resumo na Figura 1), a imunodeficiência é ainda mais aumentada pela supressão do sistema imunológico inato durante os primeiros 4 dias de vida usando oligonucleotídeos antisense morfolinos estáveis direcionados a spi1 e csf3r, que bloqueiam a diferenciação de macrófagos e neutrófilos 21,22,23.
Este protocolo também difere dos protocolos anteriores de xenotransplante de peixe-zebra, que foram desenvolvidos principalmente para enxertos de tumores sólidos e normalmente usam métodos de avaliação de resposta a medicamentos baseados em imagens de montagem total. O ZefiX é otimizado para células cancerígenas líquidas, como células BCP-LLA, e tem sido usado com sucesso para expandir material de paciente fresco ou congelado21. O ZefiX também pode ser adaptado para células cancerígenas aderentes, selecionando enzimas apropriadas para a dissociação do tecido.
Outra grande vantagem é a análise a jusante usando citometria de fluxo, que oferece vários benefícios: (i) um grande número de células de enxerto pode ser processado rapidamente, permitindo uma análise estatística robusta no nível de uma única célula, (ii) a taxa de proliferação e a viabilidade podem ser avaliadas simultaneamente em células individuais e (iii) os citômetros de fluxo estão comumente disponíveis em ambientes de pesquisa clínica, permitindo a avaliação da resposta medicamentosa de células de enxerto em um único nível de célula em poucas horas. Para garantir a reprodutibilidade, este protocolo fornece um pipeline padronizado desde a preparação até o transplante e a análise por citometria de fluxo, permitindo a previsão da resposta ao medicamento em células LLA em uma semana.
Protocolo
Todos os experimentos com peixe-zebra estão em conformidade com as diretrizes do Charité-Universitätsmedizin Berlin Research Institutes for Experimental Medicine e autoridades oficiais. Todos os estudos envolveram embriões de peixe-zebra < 6 dias após a fertilização (dpf), isentando-os da Lei de Proteção dos Animais. O peixe-zebra (Danio rerio) foi criado e mantido no biotério da Charité-Universitätsmedizin Berlin, Berlim, Alemanha, de acordo com os protocolos padrão. Eles foram alojados a 28 ° C com um ciclo de 14 h de luz e 10 h de escuridão. Peixes selvagens das linhagens AB ou TüLF foram usados para todos os experimentos.
NOTA: Estabelecer condições ideais de tratamento para cada medicamento desejado antes de sua aplicação no ZefiX inclui várias etapas necessárias. Primeiro, determine a concentração inibitória semimáxima (IC50) de cada medicamento usando uma linhagem celular adequada dentro de um sistema de cultura 2D convencional. Com base na experiência anterior, as concentrações efetivas de medicamentos para o tratamento com ZefiX podem ser 5x - 50x maiores do que aquelas usadas em condições típicas de cultura de células21,24. Antes de tratar embriões enxertados, é essencial avaliar a toxicidade dentro dos embriões hospedeiros não transplantados usando a faixa de concentração estabelecida. Depois de avaliar a toxicidade, exponha os embriões enxertados em linhagem celular a uma variedade de concentrações de drogas em torno de 50x o valor de IC50 previamente determinado em cultura 2D. Se as células enxertadas não apresentarem resposta a dosagens de até 100x o IC50, o medicamento pode ser considerado ineficaz para o ZefiX. Para potencialmente aumentar a eficácia, uma opção é pré-condicionar as células do enxerto com a droga pouco antes de seu transplante em embriões25. Consulte a Tabela 1 para todas as soluções usadas aqui.
1. Dia 1: Preparação para o experimento
- Preparação do meio E3: Prepare 2 L de meio E3 autoclavado para ser usado na manutenção do embrião.
- Preparação de oligonucleotídeos morfolinos antisense (MO): Prepare uma solução estoque de 50 μM contendo ambos os MOs em um tubo de microcentrífuga de 1,5 mL usando água livre de nuclease. Armazene a solução estoque em temperatura ambiente (RT). Preparar os OM para injeção incubando a solução num bloco de aquecimento a 65 °C durante 10 min.
NOTA: Os MOs são direcionados contra spi1 e csf3r para inibir a diferenciação de células de macrófagos e neutrófilos, conforme descrito nas referências 22,23,26. - Preparação de placas de injeção
- Para preparar 4-5 placas, dissolva a agarose a 1% em meio E3 para criar uma solução de 100 mL. Para placas de transplante, despeje ~ 20 mL da solução em cada placa de Petri de 10 cm, certificando-se de que estejam cheias pela metade. Agite para distribuir uniformemente o líquido.
- Para placas de injeção de Morpholino, coloque o molde de injeção na agarose líquida em duas placas de Petri, garantindo que não se formem bolhas. Cubra a louça inclinando as tampas e deixe-a em RT até que a agarose solidifique. Depois de solidificado, remova o molde e guarde as placas de cabeça para baixo a 4 °C em um saco plástico lacrado.
- Preparação de agulhas de injeção
- Para injeções de Morpholino: Gere agulhas a partir de capilares de 10 cm usando um extrator de agulha e quebre as pontas para atingir um diâmetro estimado de 10 μm (conforme descrito em27).
- Para transplante de células: Use agulhas de injeção de extremidade romba pré-puxadas disponíveis comercialmente com um diâmetro externo de 20 μm.
- Cultura de células de enxerto: Células divididas (por exemplo, Nalm6) visando uma densidade alvo de 70% -80% no dia 4 em um frasco de cultura de células T175 com meio RPMI suplementado com 10% FCS e 1% P/S (RPMI-completo). Divida as células 3-4 vezes antes de usar para garantir uma taxa de proliferação adequada.
NOTA: Para a preparação de material de paciente fresco ou fresco/congelado para transplante, as instruções podem ser encontradas na etapa 4.3. As células são então preparadas no dia do transplante. - Criação de peixe-zebra: Instale o peixe-zebra selvagem em tanques de reprodução à tarde, mantendo machos e fêmeas separados.
NOTA: Os peixes-zebra foram criados e encenados conforme descrito na referência28. As referências de tempo (hpf ou dpf) denotam horas ou dias após a fertilização.
2. Dia 2: Injeção de morfolino
- Suplementar 500 mL de meio E3 autoclavado com penicilina/estreptomicina a 1% (E3/P/S) e encher duas placas de Petri de 10 cm. Retire a placa de injeção da geladeira para pré-aquecer em RT.
- Escalonar a abertura do portão dos tanques de reprodução para que a fertilização só possa ocorrer em uma fração de tanques de cada vez (dependendo da velocidade de injeção) para garantir microinjeções oportunas de solução de morfolino em embriões de peixe-zebra no estágio de uma célula28,29. Comece abrindo um ou dois portões, dependendo da velocidade do injetor, quando um lote de ovos for prontamente injetado, abra outro portão ou dois portões e assim por diante.
- Transfira os óvulos fertilizados em lotes de 100 com o mínimo de líquido possível para a placa de injeção feita anteriormente. Alinhe os embriões nas ranhuras da placa.
- Injete 1 nL de uma mistura de 50 μM de ambos os morfolinos na célula ou no saco vitelino logo abaixo da célula durante o estágio de uma célula29. Injete óvulos suficientes para procedimentos subsequentes (por exemplo, para uma placa de 96 poços, injete até 200 óvulos para ter backup suficiente para uma possível desistência antes do transplante).
- Transferir os ovos injetados para placas de Petri contendo E3/P/S. Incubar os ovos injetados a 28 °C. Reter ovos não injetados como peixes de controlo para análise por citometria de fluxo a 5 dpf. Conservar o restante meio E3/P/S a 4 °C.
3. Dia 3: Descorionação
- Descorionação de embriões de peixe-zebra: Descorionar manualmente os embriões quando tiverem mais de 24 hpf usando duas pinças de precisão29.
- Remova todos os embriões mortos que não mostram batimentos cardíacos ou movimento e aparecem opacos ou embriões com formas irregulares dos pratos com uma pipeta Pasteur.
- Aperte o córion com uma pinça de precisão para mantê-lo no lugar. Aperte bem ao lado da ponta da pinça de precisão, segurando o embrião no lugar com a segunda pinça, e puxe cuidadosamente o córion para liberar o embrião
NOTA: Para descorionar embriões com menos de 24 hpf, eles devem ser mantidos em um prato revestido de agarose para evitar que grudem no plástico. A descorionação manual é preferida, pois é mais suave para os embriões. Um método alternativo de descorionação enzimática é descrito em outro artigo30.
- Incubar embriões descorionados a 28 °C durante a noite.
4. Dia 4: Xenotransplante e tratamento medicamentoso
- Preparação de embriões hospedeiros: Remova as placas de agarose preparadas e E3 / P / S da geladeira e deixe-os atingir RT. Faça a triagem dos embriões para o estágio de desenvolvimento apropriado a 48 hpf usando um microscópio estéreo. Inclua apenas embriões adequadamente estadiados e morfologicamente típicos no fluxo de trabalho, conforme descrito em outro lugar29. Conte todos os embriões saudáveis e planeje o tratamento adicional. Não conservar mais de 100 embriões por placa de Petri de 10 cm a 28 °C para evitar velocidades de desenvolvimento desiguais causadas pela falta de oxigénio.
NOTA: Siga a Etapa 4.2. para linhas celulares. Para material fresco/congelado, prossiga diretamente para a Etapa 4.3. - Preparação de linhagens celulares
- Para preparar células BCP-ALL marcadas com fluorescência para citometria de fluxo e transplante, lave as células (da etapa 1.5.) com 1x PBS: centrifugue a 350 x g por 5 min e ressuspenda em 20 mL de PBS.
- Conte as células e transfira 3 x 105 células não coradas para um tubo FACS para análise de citometria de fluxo no dia 0 (0 dias após a injeção, dpi). Armazene no gelo.
- Placa 3 x 105 células em 3 mL de RPMI - completa em um poço de uma placa de 6 poços e mantenha a 37 ° C para controle de 3 dpi.
- Transfira 1 x 107 células para um tubo de centrífuga de 15 mL para rotulagem de CTV. Centrifugue a 350 x g por 5 min em RT, despeje o sobrenadante (use uma pipeta para o resto) e ressuspenda o pellet em 2,5 mL de PBS (RT) com 1 μL de solução estoque de CTV.
- Incube por 5 min no escuro a 37 °C, pare a reação com 12,5 mL de RPMI-complete e, em seguida, incube por 10 min no escuro a 37 °C.
- Centrifugue a 350 x g por 5 min em RT e lave uma vez com 10 mL de RPMI-completo. Centrifugue novamente e ressuspenda em 10 mL de RPMI-completo.
- Filtrar as células com um filtro de 10 μm, centrifugando a 350 x g durante 5 min. Ressuspenda o pellet, conte as células e transfira 3 x 105 células marcadas com CTV para um tubo FACS. Placa 3x 10 ^ 5 células com 3 mL de RPMI-completo em um poço de uma placa de 6 poços e mantenha a 37 ° C para controle de proliferação de 3 dpi. Armazene as células restantes em 1 mL de PBS no gelo até o transplante.
- Preparação de material de paciente fresco/congelado
- Pré-aqueça dois tubos de centrífuga de 15 mL com 10 mL de RPMI - completos cada um a 37 °C. Descongele um frasco contendo 5-10 x 106 células em banho-maria a 37 °C.
- Quando restar apenas uma pequena quantidade de gelo, transfira as células para o tubo de centrífuga com o meio pré-aquecido. Centrifugar a 350 x g durante 5 min à RT, rejeitar o sobrenadante e ressuspender o pellet no segundo tubo de RPMI-complete pré-aquecido.
- Conte as células viáveis usando azul de tripano. Alíquota 1x 10^5 células num tubo de centrifugação de 1,5 ml e centrifugar esta alíquota de células num tubo FACS a 350 x g durante 5 min em RT, rejeitar o sobrenadante e ressuspender o sedimento em 300 μl de PBS.
- Armazenar a alíquota ressuspensa no gelo como um controlo não tratado para análise por citometria de fluxo.
NOTA: Se o tamanho da amostra suficiente permitir, mantenha um controle não tratado em cultura para medição de citometria de fluxo no dia 7. - Adicione 1 μL da solução-mãe de CTV a 2,5 mL de PBS (RT) para cada 1 x 106 células. Ajustar o volume da solução-mãe de VFC se houver menos células disponíveis.
- Incube as células com CTV por 5 min a 37 ° C no escuro, pare a reação adicionando 12,5 mL de RPMI-complete pré-aquecido (37 ° C) e incube por 10 min no escuro a 37 ° C.
- Centrifugue as células a 350 x g por 5 min em RT e lave as células uma vez com 10 mL de RPMI-complete. Centrifugue novamente a 350 x g por 5 min em RT e ressuspenda as células em 10 mL de RPMI-complete.
- Filtrar a suspensão celular para um tubo de centrifugação novo de 50 ml utilizando um filtro de 10 μm e centrifugar a 350 x g durante 5 min.
- Não descarte o sobrenadante. Ressuspenda o pellet e conte as células. Transfira 3 x 105 células marcadas com CTV para um tubo FACS.
- Centrifugar as células restantes a 350 x g durante 5 min em RT e rejeitar o sobrenadante. Ressuspenda as células restantes em 1 mL de PBS e armazene no gelo até o uso no transplante.
NOTA: Se restarem células positivas para CTV suficientes, elas podem ser mantidas em cultura 2D paralela aos xenoenxertos para comparação da taxa de proliferação.
- Medição por citometria de fluxo
NOTA: A citometria de fluxo a 0 dpi deve ser realizada por uma segunda pessoa para minimizar o tempo que as células permanecem no gelo antes do transplante. Antes da primeira medição de citometria de fluxo usando o painel de coloração designado (CTV, CD19-Alexa488, APC-Anexina V e 7AAD), execute um teste de compensação seguindo as instruções do fabricante.- Prepare dois tubos FACS da seguinte forma: Tubo 1: Células de controle não coradas; Tubo 2: Células coradas com CTV, CD19, 7AAD e anexina.
NOTA: Coloração e marcadores: CellTrace Violet (CTV) identifica células de enxerto marcadas versus células de peixes hospedeiros e avalia a taxa de proliferação após 3 dias. O anticorpo CD19, um marcador de superfície celular, serve como um marcador adicional para identificar células de enxerto de BCP-LLA humana. Para outros tipos de câncer, anticorpos marcadores alternativos podem ser necessários. A anexina V marca a apoptose em estágio inicial para avaliação da viabilidade celular. 7AAD marca apoptose ou necrose em estágio avançado para avaliação da viabilidade celular. - Tubos de centrífuga (um contendo células coradas com CTV e as outras células não coradas) a 350 x g durante 5 min em RT e rejeitar o sobrenadante do tubo 1. Ressuspenda o pellet em 310 μL de tampão de ligação de anexina (ABB).
- Tubo 2: Realize a coloração de anticorpos e viabilidade conforme descrito abaixo.
NOTA: Este protocolo de coloração é otimizado para coloração de células B CD19. Para outros anticorpos humanos usados para rotular diferentes tipos de células, o protocolo pode precisar de adaptação.- Adicione 98 μL de ABB ao Tubo 2 (contendo células marcadas com CTV). Adicione 2 μL de anticorpo CD19-Alexa488 (diluição 1:50) aos 98 μL de ABB adicionados. Misture bem.
- Incubar a mistura a 4 °C durante 30 min e adicionar 500 μL de ABB para interromper a reação. Centrifugue o tubo a 350 x g durante 5 min a 4 °C. Remova o sobrenadante e repita a etapa de lavagem.
- Ressuspenda o pellet celular em 100 μL de ABB e prossiga para a coloração com 7AAD e APC-Anexina V. Realize a coloração 7AAD e APC Anexina V e a medição da citometria de fluxo conforme descrito abaixo.
- Adicione 5 μL de 7AAD e 5 μL de APC-Anexina V às células ressuspensas. Vortex suavemente para misturar. Incubar o tubo durante 15 min no escuro à temperatura de saída. Adicionar 200 μL de ABB para atingir um volume final de 310 μL.
- Realize a análise de citometria de fluxo no dia do transplante na seguinte ordem para evitar contaminação cruzada: Células de controle não coradas (Tubo 1), células marcadas com CTV coradas com Alexa488-CD19, APC-Anexina V e 7AAD (Tubo 2). Registre pelo menos 10.000 eventos por amostra para análise suficiente.
- Prepare dois tubos FACS da seguinte forma: Tubo 1: Células de controle não coradas; Tubo 2: Células coradas com CTV, CD19, 7AAD e anexina.
5. Transplante
- Placa de transplante: Prepare duas placas de Petri de 10 cm preenchidas com E3/P/S e coloque na incubadora a 28 °C por pelo menos 30 min para pré-aquecer.
- Preparação celular: Centrifugue as células a 350 x g durante 5 min à RT, elimine o sobrenadante e remova o líquido restante com uma micropipeta. Adicionar PBS para obter um volume final de 20 μL. Manter a suspensão celular concentrada em gelo.
NOTA: As células não devem permanecer no gelo por mais de 2 h durante o procedimento de transplante. - Agulha de transplante e preparação do embrião hospedeiro
- Transferir 25-30 embriões para uma das placas de Petri pré-aquecidas contendo E3/P/S utilizando uma pipeta de vidro Pasteur para servir de controlo. Carregue 4 μL da suspensão celular na agulha de transplante usando uma ponta micro carregadora.
NOTA: O carregamento deve ocorrer sem problemas dentro de 1-2 min. Se este não for o caso, adicione cuidadosamente mais PBS à suspensão celular. - Calibre a pressão de injeção e o comprimento do pulso ajustando o microinjetor. Ajuste até que uma injeção expulse aproximadamente 1.000 células LLA ou 2 nL de suspensão celular (para 1x 107 células em 20 μL). Para estimar 1.000 células, expulse um volume da suspensão em uma superfície de agarose coberta com meio. Conte 100 células em uma pequena área, extrapole sua distribuição para a população total de células e estime o número total.
- Prepare 50 mL de E3 contendo tricaína (concentração final: 80 mg/L). Transfira os embriões hospedeiros para a solução de tricaína e incube por pelo menos 2 minutos para garantir a anestesia adequada. O embrião é devidamente anestesiado quando nenhuma resposta motora é observável
NOTA: Uma ponta de micro carregador ou fórceps pode ser usada para se aproximar e/ou tocar cuidadosamente o embrião. - Transfira 15-20 embriões descorionados para uma placa de injeção revestida com agarose (consulte as instruções de preparação anteriores) usando o mínimo de líquido possível para evitar que os embriões escorreguem.
- Organize os embriões conforme ilustrado na Figura 2A. Injete aproximadamente 1.000 células BCP-ALL positivas para CTV na cavidade pericárdica. Introduza a agulha em um ângulo de 45° em relação à direção dorso-caudal, conforme mostrado na Figura 2B para injetar as células.
NOTA: Use agulhas pré-puxadas e sem corte disponíveis comercialmente com um diâmetro de abertura de 20 μm, projetadas especificamente para pequenas células de leucemia (consulte a lista de materiais). Se a agulha ficar bloqueada, corte-a conforme necessário, mas recalibre o volume de injeção e a contagem de células depois. - Uma vez injectados os 15-20 embriões, transferi-los para a placa de Petri pré-aquecida preenchida com E3/P/S e manter a 28 °C.
- Repita as etapas até que aproximadamente 100 a 150 embriões sejam transplantados para um ensaio de tratamento medicamentoso, que deve incluir três concentrações de medicamentos e um controle.
- Incubar os embriões transplantados e os controles não transplantados a 28 ° C por 1-3 h antes de iniciar o tratamento medicamentoso.
- Transferir 25-30 embriões para uma das placas de Petri pré-aquecidas contendo E3/P/S utilizando uma pipeta de vidro Pasteur para servir de controlo. Carregue 4 μL da suspensão celular na agulha de transplante usando uma ponta micro carregadora.
- Tratamento medicamentoso in vivo (placa de 96 poços)
- Usando estereomicroscopia fluorescente, rastreie os embriões para confirmar o enxerto bem-sucedido (Figura 2C). Certifique-se de que a gema esteja intacta, pois o ambiente da gema pode ser tóxico para as células do enxerto21. Descarte os embriões com células na gema.
- Prepare 2,5 mL de uma solução concentrada 2x para cada condição de medicamento a ser testada em E3/P/S com 0,5% de DMSO. Além disso, prepare uma solução de controle veicular de 5 mL contendo 0,5% de DMSO em E3/P/S.
- Adicione 100 μL de E3/P/S + 0,5% de DMSO a cada poço de uma placa de 96 poços. Esta etapa evita a transferência não intencional de quantidades mínimas de medicamentos entre os poços.
- Transfira cuidadosamente um embrião enxertado em cada poço. Use uma pipeta Pasteur de vidro para pegar cada embrião no mínimo de meio E3 possível.
- Deixe o embrião afundar até o fundo da ponta da pipeta inclinando suavemente a pipeta e liberando-o no poço usando forças capilares. Evite tocar no meio no poço durante a transferência.
- Adicione soluções de medicamentos à placa: Encha 24 poços (2 fileiras) da placa de 96 poços com 100 μL da solução de controle do veículo ou uma das três soluções de medicamentos concentradas 2x.
NOTA: As concentrações efetivas do medicamento devem ser determinadas em experimentos anteriores específicos para cada medicamento que está sendo testado. - Manter os embriões a 35 °C por 72 h, incluindo os embriões não transplantados, que servirão como controles para análise de citometria de fluxo no dia 7.
6. Dia 7
- Dissociação embrião/enxerto
- Examine a placa de 96 poços usando estereomicroscopia para identificar e selecionar embriões saudáveis de peixe-zebra. Agrupe aleatoriamente 10 embriões hospedeiros saudáveis de cada condição em um tubo de microcentrífuga de 1,5 mL (idealmente resultando em 2 tubos por condição).
- Remova o máximo de líquido possível de cada tubo contendo embriões e sacrifique os embriões por choque hipotérmico, incubando os tubos em gelo por 1 h.
- Adicione 500 μL de solução salina balanceada de Hank (HBSS) sem cálcio e magnésio a cada tubo. Dissocie mecanicamente os embriões e as células do enxerto por trituração usando uma ponta de micropipeta de 200 μL, pipetando para cima e para baixo aproximadamente 15x.
- Pulverizar os fragmentos de tecido por centrifugação a 350 x g durante 5 min a RT. Enquanto isso, prepare os tubos FACS com uma tampa de filtro de malha fina de 35 μm contendo 2 mL de PBS por condição (4 tubos no total).
- Ressuspenda cada pellet em 500 μL de mistura enzimática (0,01% de papaína, 0,1% de dispase II, 0,01% de desoxirribonuclease I e 12,4 mM de MgSO4 em HBSS livre de cálcio e magnésio) para dissociação enzimática. Incubar em RT por 15 min.
- Durante a incubação, pipete a mistura para cima e para baixo a cada 5 minutos repetidamente usando a mesma ponta de pipeta para cada tubo individual para evitar perda de tecido.
- Medição por citometria de fluxo
- Transferir as células dissociadas para a tampa do filtro de malha fina de 35 μm dos tubos FACS e centrifugar a 350 x g durante 5 min.
- Durante a centrifugação, prepare uma mistura principal para a coloração da superfície das células B CD19. Combine 98 μL de ABB com 2 μL de anticorpo Alexa Fluor 488 anti-CD19 humano para cada condição.
- Rejeitar o sobrenadante do sedimento de células dissociadas e ressuspender o sedimento em 100 μL da mistura principal de coloração CD19.
- Execute o protocolo de coloração CD19, 7AAD e APC Anexina V para todas as amostras ZefiX, incluindo 3 x 105 células positivas para CTV de cultura de células paralelas, se disponível.
- Realize a análise de citometria de fluxo seguindo a ordem e registre o número de eventos descritos na Tabela 2. Execute todas as amostras contendo células hospedeiras e de enxerto o mais completamente possível para avaliar o número total de células do enxerto.
- Análise de resultados utilizando software comercial.
- Estratégia de bloqueio para amostra de cultura de células: abra o software e carregue os arquivos FCS no espaço de trabalho. Crie um gráfico de pontos com CD19 e CTV para garantir que o sinal esteja sobreposto e para confirmar a presença das células cancerígenas. Em seguida, crie um gráfico de pontos com FSC-A (eixo x) e SSC-A (eixo y) para distinguir células intactas (Q2) de detritos (Q4; Figura 3A').
- Use a população de células intactas para criar um novo gráfico com SSC-H (eixo x) e SSC-A (eixo y) para identificar células únicas (Figura 3A'').
- Crie outro gráfico de pontos com Anexina V (eixo x) e 7AAD (eixo y) usando a população de células únicas (Figura 3A'''). Distinguir células em quatro populações: Células viáveis: Anexina V negativa, 7AAD negativa (Q4); Células apoptóticas precoces: Anexina V positiva, 7AAD negativa (Q3); Células apoptóticas/necróticas tardias: Anexina V positiva, 7AAD positiva (Q2); Células necróticas: Anexina V negativa, 7AAD positiva (Q1).
- Repita essas etapas para amostras de 3 dpi (Figura 3B).
- Estratégia de gating para células embrionárias de enxerto e hospedeiro
- Separe as células de enxerto humano das células hospedeiras usando um gráfico de pontos com CTV (eixo x) e CD19 (eixo y). Identifique e isole as células do enxerto duplamente positivas CTV/CD19 (Figura 3C).
- Aplique a mesma estratégia de gating descrita para células de cultura de 3 dpi (Figura 3B '- B''') à população de células do enxerto. Copie a estratégia de controle para consistência.
- Mescle todas as populações de células negativas para anexina V e 7AAD em um histograma com valores de CTV no eixo x (Figura 3D). Calcule a média geométrica para todas as cinco amostras para determinar as taxas de proliferação.
- Cálculos para avaliação da resposta ao tratamento
- Para determinar o número de divisões celulares após 3 dias, use a fórmula:
n = log2 (I0/I)
Onde, I0 = Intensidade inicial de fluorescência do CTV (média geométrica, 0 dpi), I = Intensidade de fluorescência do CTV em 72 h, n = Número de divisões celulares.
Exemplo: Células de pacientes recém-congeladas divididas 2,6x no log ZefiX2 (88317/14644) = 2,6
e 2,8x no log de cultura 2D2 (88317/12992) = 2,8 - Para determinar o número total de células de enxerto por peixe após 3 dias, divida o número total de células cancerígenas (incluindo células apoptóticas, mas excluindo detritos) pelo número de peixes agrupados na amostra (normalmente n = 10).
- Para determinar a viabilidade das células de enxerto positivas para CTV após 3 dias, use a fórmula:
V = (C/100) x A
Onde: V = Viabilidade, C = fração de células individuais intactas sem detritos (em porcentagem), A = Fração de células negativas em anexina V e 7AAD (em porcentagem).
- Para determinar o número de divisões celulares após 3 dias, use a fórmula:
Resultados
Para uma avaliação científica detalhada do protocolo ZefiX, incluindo o xenoenxerto e o tratamento medicamentoso de amostras de células BCP-ALL primárias recém-congeladas, consulte o manuscritopublicado anteriormente 21. A aprovação para o uso de amostras de pacientes em pesquisas para testes pré-clínicos de medicamentos foi concedida como parte de estudos complementares ao estudo ALL-REZ BFM 2002 (NCT00114348) e ao registro e biobanco ALL-REZ BFM (EA2/055/12) pelos comitês locais de ética em pesquisa médica, bem como ao estudo internacional IntReALL SR 2010 (NCT01802814) pela autoridade nacional. O consentimento informado foi obtido dos pacientes e/ou de seus responsáveis por meio do respectivo estudo ou registro em que foram incluídos.
A Figura 2 ilustra um exemplo de alinhamento embrionário em uma placa de agarose antes da injeção, o que ajuda a agilizar o processo de injeção. A injeção deve ser realizada no ângulo representado para atingir com precisão a cavidade ao redor do coração em desenvolvimento. Além disso, a Figura 2C fornece uma referência de 2 embriões dpf injetados com sucesso contendo células de enxerto humano (azul), que foram marcadas com CTV antes da injeção. Embriões com resultados de injeção diferentes dos mostrados na Figura 2C foram excluídos, com foco particular em evitar a perfuração do saco vitelino para garantir a viabilidade das células do enxerto durante a incubação subsequente de três dias.
Após o período de incubação de três dias, os embriões hospedeiros são processados em grupos de 10 para análise de citometria de fluxo. Após a dissociação enzimática, as suspensões celulares são coradas com um anticorpo anti-CD19 humano e dois marcadores de viabilidade: Anexina V para células apoptóticas precoces e 7AAD para células apoptóticas e necróticas tardias.
A Figura 3 apresenta dados de citometria de fluxo de células BCP-ALL expandidas com ZefiX de um paciente com BCP-LLA. Os painéis A, A', A'' e A''' mostram dados coletados a 0 dpi no dia do transplante. A Figura 3A exibe os valores de fluorescência CTV e CD19 para um total de 10.000 células como referência para a estratégia de gating aplicada a suspensões de células do enxerto hospedeiro a 3 dpi (Figura 3C). Na Figura 3A, os detritos são excluídos por meio de gating regular de células usando a Área de Dispersão Direta (FSC-A) e a Área de Dispersão Lateral (SSC-A). Na Figura 3A'', células únicas são separadas de dupletos usando um gráfico de altura SSC (SSC-H) versus SSC-A. Esta população unicelular é usada para avaliação de viabilidade na Figura 3A''', onde as células viáveis (Q4) são diferenciadas das células apoptóticas precoces (Q3, valores mais altos de Anexina V) e células apoptóticas ou necróticas tardias (Q2, níveis mais altos de 7AAD).
Para comparação, as células dos pacientes cultivadas em condições 2D convencionais também são analisadas por citometria de fluxo após três dias (Figuras 3B, B ', B ', B ''', seguindo a mesma estratégia de gating. A viabilidade das células do paciente após 72h em cultura 2D é calculada a partir de Q2 na Figura 2B' e Q4 na Figura 2B''': (95,0%/100)*61,9% = 58,8%.
Na Figura 3C, o material de partida é a suspensão celular de embriões hospedeiros contendo células de enxerto. Ao contrário das medições in vitro, todas as células do tubo são analisadas por citometria de fluxo. As células de enxerto CD19 e CTV-positivas são fechadas para separá-las das células de peixe CD19 e CTV-negativas. A população de células intactas do enxerto é analisada mais detalhadamente na Figura 3C ', onde os detritos são excluídos. A viabilidade de células de enxerto único é então avaliada usando a mesma estratégia de gating das Figuras 3B.
Os resultados indicam que a porcentagem de células individuais viáveis expandidas em embriões é de 95,2%, o que é 1,6 vezes maior do que a viabilidade de células cultivadas em uma placa (Figura 3B'''). As taxas de divisão celular foram calculadas in vivo e in vitro analisando a diminuição da intensidade de fluorescência do CTV em cada população de 0 dpi para 3 dpi (Figura 3D). O número de divisões celulares foi determinado usando a fórmula da Seção 6.4.1 e a média geométrica de cada curva de CTV (Figura 3D). As taxas de divisão calculadas (2,59 divisões in vivo e 2,77 divisões in vitro) sugerem que as células viáveis se dividem a uma taxa semelhante em ambas as condições ao longo de três dias.
Finalmente, o número médio de células intactas do enxerto por embrião após três dias foi determinado dividindo-se o número de células intactas do enxerto (excluindo detritos, Figura 3C ') pelo número de embriões agrupados em um tubo21.
Em conclusão, amostras frescas de BCP-ALL enxertadas em embriões de peixe-zebra exibem maior viabilidade após três dias em comparação com a cultura convencional em uma placa e as células viáveis se dividem a uma taxa comparável em ambas as condições.
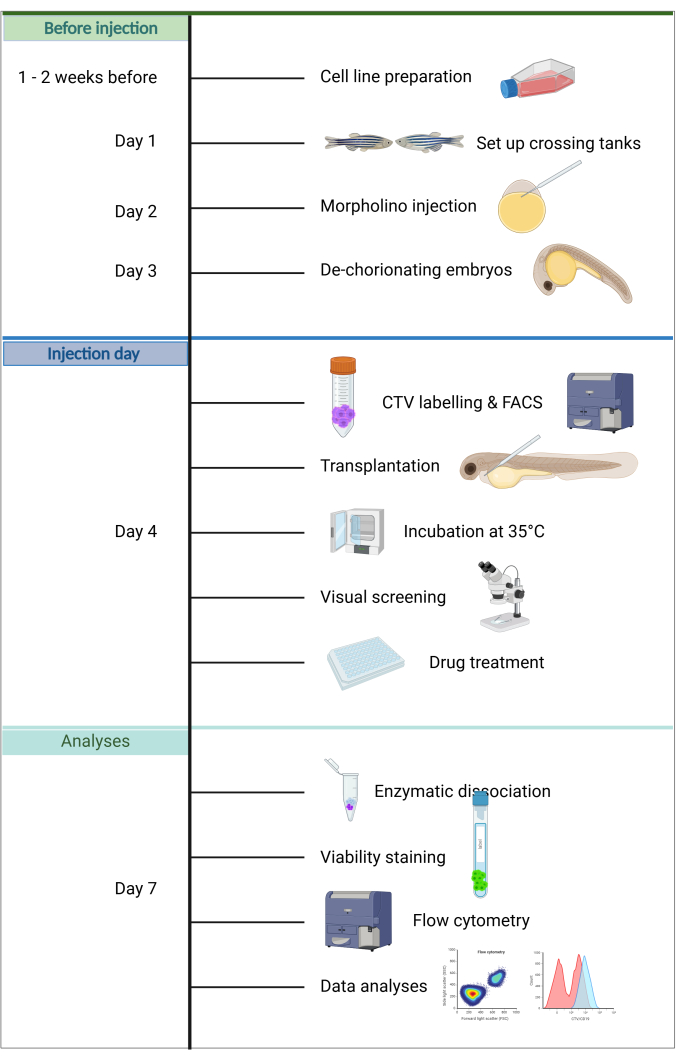
Figura 1. Fluxo de trabalho do pipeline ALL-ZefiX. Criado em https://BioRender.com. Clique aqui para ver uma versão maior desta figura.
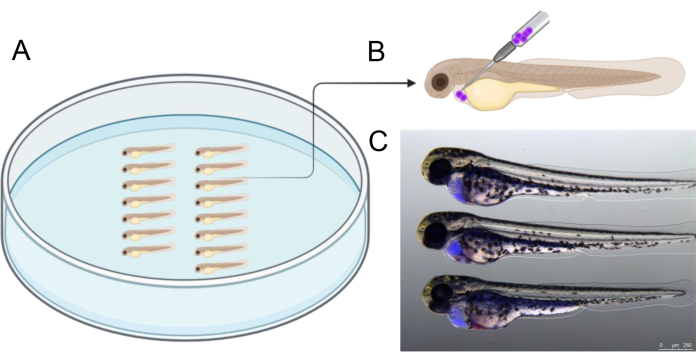
Figura 2: Arranjo de injeção. (A) Organizar os embriões conforme ilustrado facilita a injeção. Os embriões podem ser dispostos usando uma pinça ou com uma ponta de pipeta microcarregadora de 20 μL que foi cortada para ter uma ponta de 2,5 a 3 cm de comprimento. (B) Representação esquemática do ângulo de injeção recomendado para enxertar células no pericárdio de 2 embriões dpf. (C) Auxílios visuais para estimar corretamente a quantidade de células cancerígenas transplantadas. Esta imagem mostra um embrião de 48 hpf 3 h após a injeção com células cancerígenas humanas previamente marcadas com CellTrace Violet). Criado em https://BioRender.com. Clique aqui para ver uma versão maior desta figura.
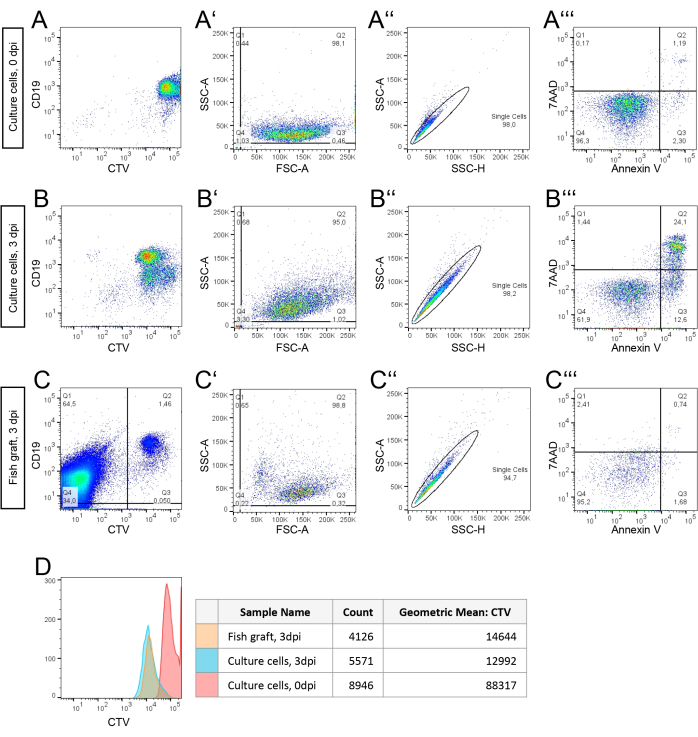
Figura 3: Estratégia de gating e análise de citometria de fluxo de uma amostra congelada fresca derivada de paciente de células blásticas BCP-ALL isoladas após cultura 2D de enxerto em embriões de peixe-zebra. (A, B) As células dos pacientes foram marcadas com CellTrace Violet (CTV) antes da cultura. As células foram cultivadas em plástico de cultura de tecidos a 37 °C por 0h (A) ou 72 h (B) antes da análise por citometria de fluxo. (C) Células de pacientes marcadas com CTV e cultivadas a 35 ° C por 72 h como enxertos em embriões de peixe-zebra hospedeiros. Um grupo de 10 embriões foi agrupado antes da dissociação de célula única para análise de citometria de fluxo. A estratégia de gating em (B) foi aplicada e a fração de células do enxerto viável foi identificada e quantificada. Para fazer isso, as células do enxerto positivas para CTV (Q2) foram separadas das células de peixe-zebra autofluorescentes (Q1/4) para classificar a população de células do enxerto para análise. A intensidade de marcação do CTV foi analisada nesta população de células do enxerto. (D) Contagem de células e intensidade média dos rótulos do CTV apenas da seleção de células viáveis. Observe a mudança da intensidade da CTV após 3 dias (3 dpi). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Tabela de soluções utilizadas. Clique aqui para baixar esta tabela.
Tabela 2: Amostras medidas por citometria de fluxo. Clique aqui para baixar esta tabela.
Discussão
Os embriões de peixe-zebra tornaram-se um modelo de xenoenxerto cada vez mais popular para triagem de drogas e pesquisa do câncer devido à sua alta capacidade de rendimento e custo-benefício. Esses xenoenxertos são promissores como um pilar crítico da medicina translacional, auxiliando a pesquisa pré-clínica e a tomada de decisões 9,21. No entanto, os modelos de xenoenxerto de peixe-zebra para expansão e tratamento de células de leucemia humana permanecem sub-representados em comparação com o extenso corpo de trabalho em enxertos de tumores sólidos. Este protocolo oferece orientação detalhada para alavancar xenoenxertos de peixe-zebra na pesquisa de leucemia, mantendo-se adaptável para uso em tumores sólidos.
Alcançar um transplante consistente de células cancerígenas pode ser um desafio, destacando a necessidade de análise padronizada e maior confiabilidade estatística. Este protocolo aborda esses problemas apresentando um pipeline abrangente para preparação, transplante e análise de citometria de fluxo a jusante, juntamente com recomendações de solução de problemas.
Injeção de morfolino para imunossupressão transitória
Os embriões de peixe-zebra dependem de seu sistema imunológico inato durante os primeiros dias de desenvolvimento, o que define o prazo para esse pipeline experimental20. Os macrófagos primitivos emergem em torno de 12 hpf, com alguns se diferenciando em neutrófilos em 33 hpf 20,31,32. As células T entram em circulação aproximadamente 8 dias após a fertilização20,33. Macrófagos e neutrófilos, como parte da resposta imune inata, têm sido implicados na redução da sobrevida das células BCP-LLA, observada três dias após o transplante em estudos anteriores21.
A imunossupressão temporal mediada por morfolino, visando spi1 e csf3r, inibe efetivamente a diferenciação de macrófagos e neutrófilos, levando a um melhor enxerto de células BCP-LLA sem afetar a viabilidade embrionária21. Embora esse método não possa atingir o esgotamento permanente, pois o nocaute completo de spi1 e csf3r é letal, ele continua sendo a melhor abordagem para esse pipeline.
A calibração dos volumes de injeção usando uma retícula e a entrega precisa no saco vitelino no estágio de uma célula garante injeções consistentes de morfolino com altas taxas de sobrevivência. Alternativas como injeções lipossomais de clodronato (Clodrosome) para depleção de macrófagos têm se mostrado promissoras, mas requerem validação adicional para este pipeline34,35.
Preparação celular
Uma população de células suficientemente densa e viável é fundamental para a expansão bem-sucedida da LLA-BCP neste protocolo. O CellTrace Violet (CTV) é usado para marcação fluorescente para avaliar o sucesso da implantação a 0 dpi e rastrear as taxas de proliferação ao longo do experimento. Ao contrário de outros rótulos, o CTV não altera o comportamento celular, permitindo uma análise precisa da proliferação em nível de célula única. Isso oferece vantagens sobre a coloração de anticorpos Ki-67, que captura apenas células durante a proliferação, mas não células divididas que já saíram do ciclo celular.
O CTV também supera o CellTracker CM-DiI (DiI) em refletir a viabilidade celular. DiI e seus derivados são fluoróforos mais estáveis, muitas vezes persistindo além da morte celular, o que pode confundir os resultados experimentais2. Além disso, a inclusão de um anticorpo específico para LLA-BCP contra CD19 na citometria de fluxo permite a identificação precisa das células do enxerto. Anticorpos humanos específicos, como o anti-HLA, podem servir como alternativas para outros tipos de células cancerígenas36.
Transplante de células cancerígenas
O enxerto consistente requer diluição e concentração ideais da suspensão celular. A suspensão deve manter densidade suficiente, evitando viscosidade que prejudique a injeção. Esse protocolo prioriza a injeção na cavidade pericárdica ou no espaço perivitelino (SPV) sobre o saco vitelino, pois esses locais oferecem melhor vascularização e menos condições hipóxicas37. O transplante de saco vitelino, embora acessível, muitas vezes resulta em altas taxas de mortalidade e baixa viabilidade celular21.
O entupimento da agulha devido a micropartículas continua sendo um desafio processual. Filtrar a suspensão da célula e recalibrar os volumes de injeção após aparar as agulhas bloqueadas são etapas essenciais. Apenas embriões com pericárdia densamente preenchida devem ser usados para tratamentos medicamentosos subsequentes21,36.
A temperatura de incubação sugerida de 35 °C equilibra a temperatura natural das células cancerígenas humanas (37 °C) e a temperatura padrão do alojamento do peixe-zebra (28 °C)21. Os embriões de peixe-zebra se adaptam a essa temperatura com deformações mínimas de desenvolvimento, e o ambiente aumenta a proliferação e a sobrevivência de células frescas derivadas de pacientes38.
Tratamento medicamentoso
Modelos de xenoenxerto de peixe-zebra foram desenvolvidos para facilitar a triagem de drogas de alto rendimento. No entanto, o tratamento medicamentoso continua sendo um dos aspectos mais desafiadores do ensaio ZefiX. Muitos medicamentos padrão e terapias direcionadas não atingem efetivamente as células do enxerto in vivo. Também pode exigir o teste de um painel maior de concentrações de drogas. Exemplos bem-sucedidos, como venetoclax e dasatinibe, requerem concentrações significativamente mais altas do que nos ensaios convencionais de cultura2D 21.
Alternativamente, o pré-tratamento de células in vitro antes do transplante também permite que certos efeitos sistêmicos e localizados sejam estudados. Por exemplo, essa abordagem pode ser adequada para tratamentos baseados em vírus adeno-associados (AAV) no glioblastoma39.
Se os efeitos do tratamento medicamentoso forem observados in vitro, mas não in vivo usando esse pipeline, uma alternativa poderia ser, por exemplo, transplantar para o estágio de 1k células (3 hpf) ou o estágio de blástula e iniciar o tratamento medicamentoso em 24 hpf40,41. Isso poderia permitir que os medicamentos atingissem as células do enxerto que não são bem-sucedidos em embriões de 48 horas ou a co-injeção de células e medicamentos ao mesmo tempo25.
Análise de dissociação e citometria de fluxo
A dissociação tecidual é fundamental para analisar o número total de células do enxerto e interpretar de forma confiável os resultados experimentais. Uma combinação de dissociação mecânica e enzimática garante uma suspensão unicelular de alta qualidade, mantendo a integridade da proteína da superfície celular. O ajuste das condições de dissociação (por exemplo, composição enzimática, pipetagem ou uso de um homogeneizador Dounce) pode ser necessário para diferentes tipos de câncer.
As amostras devem ser filtradas para evitar o entupimento do citômetro de fluxo, e proteínas pegajosas ou lipídios podem ser mitigados com EDTA ou desgemamento de embriões antes da dissociação.
Resumo
O protocolo ZefiX fornece um pipeline experimental rápido e econômico para pesquisas pré-clínicas sobre câncer, estudos de resistência a medicamentos e avaliações de tratamento personalizadas. Embora os modelos de xenoenxerto de peixe-zebra tenham limitações e não possam acomodar todos os tipos de medicamentos, esse protocolo padronizado permite a expansão in vivo de células e linhas celulares de leucemia de pacientes frescos. Adaptável para outros tipos de câncer, oferece uma ferramenta promissora para previsão rápida e personalizada de resposta a medicamentos dentro do prazo de tomada de decisão clínica.
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pela Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) no âmbito do Centro de Pesquisa Colaborativa CRC1588, projeto número 493872418 e da Dr. Kleist Stiftung, Berlim, bem como pela Deutsche José Carreras Leukämie Stiftung (R03/2016), a Berliner Krebsgesellschaft (HEFF201633KK) e o Consórcio Alemão de Câncer (DKTK, Joint Funding Call 2016). Agradecemos a Julia Köppke e Mareike Wolff pela leitura crítica do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Petri dish (10 cm) | Greiner | P7237 | |
| 7-AAD viability staining solution | Invitrogen | 00-6993-50 | |
| Agarose (LE, analytic grade) | Biozym | 840004 | |
| Air pressure injector | Narishige | IM400 | with external gas supply |
| Alexa Fluor 488 anti-human CD19 antibody | Biolegend | 302219 | |
| Annexin binding buffer | Biolegend | 422201 | Or see solutions for preparation |
| APC annexin V | Biolegend | 640941 | |
| Capillaries (10 cm, OD 1.0 mm, with filaments) | WPIINC | TW100F-4 | 1.0 OD; 0.75 ID |
| Cell culture flask (T-175) | Sarstedt | 83,39,12,002 | |
| CellTrace Violet | Invitrogen | C34557 | |
| Dimethyl sulphoxide (DMSO) | Roth | A994.1 | |
| Dispase II | Sigma Aldrich | D4693-1g | |
| DNase I | AppliChem GmbH | A3778 | |
| Eppendorf tubes (1.5 ml) | Eppendorf | 30120086 | |
| FACS tube (Polystyrene round botton Tube with Cell strainer Cap, 5 ml) | Falcon | 352235 | |
| Falcon tubes (50 ml) | Falcon | 352070 | |
| Fetal calf serum (FCS) | Sigma Aldrich | C8056 | |
| Fine mesh filter (10 µm) | PluriStrainer | 435001050 | |
| Fine mesh filter (20 µm) | PluriStrainer | 431002040 | |
| Flow cytometer | Becton Dickinson | BD LSRFortessa X-20 | |
| Fluorescent stereomicroscope | Leica | ||
| Fluorescent stereomicroscope with camera | Leica | M165 FC | Camera: DFC7000 T |
| Hank’s Balanced Salt Solution (HBSS, Calcium and Magnesium free ) | Sigma Aldrich | 88284 | |
| Injection mold (Zebrafish MI/Transplant KIT) | World Precision Instruments | Z-MOLDS | |
| Injection needles (without filament) | Biomedical instruments | VZIPbl-20-10-55 | Zebrafish injection pipette, blunt, OD: 20μm ± 1, TL:~10mm, PL: 55mm, Glass: BM100T-10P |
| Macro-centrifuge | Eppendorf | ||
| Micro-centrifuge | |||
| Morpholino (csf3r) | Gene Tools LLC | csf3r (GAAGCACAAGCGA GACGGATGCCA) | |
| Morpholino (spi1) | Gene Tools LLC | spi1(GATATACTGATAC TCCATTGGTGGT) | |
| Papain | Sigma Aldrich | P3125 | |
| Penicillin-Streptomycin (Penstrep; 10.000 U/ml) | Gibco | 15140122 | |
| Plates (4-well) | Greiner Bio one | 657160 | |
| Plates (96-well) | Greiner Bio one | 657180 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Gibco | 21875-034 | |
| Tricaine (MS-222) | Sigma Aldrich | E10521-50G | Ethy-3 aminobenzoate methanesulfenate |
Referências
- Fontana, C. M., Van Doan, H. Zebrafish xenograft as a tool for the study of colorectal cancer: a review. Cell Death Dis. 15, 1-12 (2024).
- Sturtzel, C., et al. Refined high-content imaging-based phenotypic drug screening in zebrafish xenografts. NPJ Precis Oncol. 7 (1), 1-16 (2023).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24, 2288(2023).
- Gamble, J. T., Elson, D. J., Greenwood, J. A., Tanguay, R. L., Kolluri, S. K. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology. 10 (4), 252(2021).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish avatars towards personalized medicine-A comparative review between avatar models. Cells. 9 (2), 293(2020).
- Wang, W., et al. Progress in building clinically relevant patient-derived tumor xenograft models for cancer research. Animal Model Exp Med. 6 (5), 381-398 (2023).
- Xiao, J., Glasgow, E., Agarwal, S. Zebrafish xenografts for drug discovery and personalized medicine. Trend Cancer. 6 (7), 569-579 (2020).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer. 20 (5), 263-273 (2020).
- Costa, B., et al. Zebrafish avatar-test forecasts clinical response to chemotherapy in patients with colorectal cancer. Nat Comm. 15 (1), 4771(2024).
- Grissenberger, S., et al. Chapter 8 - Preclinical testing of CAR T cells in zebrafish xenografts. Method Cell Biol. 167, 133-147 (2022).
- Yan, C., et al. Single-cell imaging of T cell immunotherapy responses in vivo. J Exp Med. 218 (10), 20210314(2021).
- Pascoal, S., et al. A preclinical embryonic zebrafish xenograft model to investigate CAR T cells in vivo. Cancers. 12 (3), 567(2020).
- Pal, D., et al. Long-term in vitro maintenance of clonal abundance and leukaemia-initiating potential in acute lymphoblastic leukaemia. Leukemia. 30 (8), 1691-1700 (2016).
- Beneduce, G., et al. Blinatumomab in children and adolescents with relapsed/refractory B cell precursor acute lymphoblastic leukemia: A real-life multicenter retrospective study in seven AIEOP (Associazione Italiana di Ematologia e Oncologia Pediatrica) Centers. Cancers. 14 (2), 426(2022).
- Xie, J., et al. Short-course blinatumomab for refractory/relapse precursor B acute lymphoblastic leukemia in children. Front Pediatr. 11, 1187607(2023).
- Mengxuan, S., Fen, Z., Runming, J. Novel treatments for pediatric relapsed or refractory acute B-cell lineage lymphoblastic leukemia: Precision medicine era. Front Pediatr. 10, 923419(2022).
- Howe, K. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Lee, H. C., Lin, C. Y., Tsai, H. J. Zebrafish, an in vivo platform to screen drugs and proteins for biomedical use. Pharmaceuticals. 14 (6), 500(2021).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Investigation. 122 (7), 2337-2343 (2012).
- Miao, K. Z., Kim, G. Y., Meara, G. K., Qin, X., Feng, H. Tipping the scales with zebrafish to understand adaptive tumor immunity. Front Cell Dev Biol. 9, 660969(2021).
- Gauert, A., et al. Fast, in vivo model for drug-response prediction in patients with B-cell precursor acute lymphoblastic leukemia. Cancers. 12 (7), 1883(2020).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. Mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- Pase, L., et al. Neutrophil-delivered myeloperoxidase dampens the hydrogen peroxide burst after tissue wounding in zebrafish. Current Biol. 22 (19), 1818-1824 (2012).
- Wijk, R. C. V., et al. Mechanistic and quantitative understanding of pharmacokinetics in Zebrafish larvae through nanoscale blood sampling and metabolite modeling of paracetamol. J Pharmacol Exp Ther. 371 (1), 15-24 (2019).
- Lázaro-Navarro, J., et al. Inhibiting casein kinase 2 sensitizes acute lymphoblastic leukemia cells to venetoclax via MCL1 degradation. Blood Advances. 5 (24), 5501(2021).
- Rhodes, J., et al. Interplay of pu.1 and gata1 determines myelo-erythroid progenitor cell fate in zebrafish. Developmental Cell. 8 (1), 97-108 (2005).
- Zakaria, Z. Z., Eisa-Beygi, S., Benslimane, F. M., Ramchandran, R., Yalcin, H. C. Design and microinjection of Morpholino antisense oligonucleotides and mRNA into zebrafish embryos to elucidate specific gene function in heart dvelopment. J Vis Exp. (186), e63324(2022).
- ZFIN: Zebrafish Book: Contents. , https://zfin.org/zf_info/zfbook/cont.html (2025).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Hasegawa, E. H., Gist H Farr, I. I. I., Maves, L. Comparison of pronase versus manual dechorionation of zebrafish embryos for small molecule treatments. J Dev Biol. 11 (2), 16(2023).
- Wattrus, S. J., Zon, L. I. Stem cell safe harbor: the hematopoietic stem cell niche in zebrafish. Blood Adv. 2 (21), 3063-3069 (2018).
- Harvie, E. A., Huttenlocher, A. Neutrophils in host defense: new insights from zebrafish. J Leukocyte Biol. 98 (4), 523-537 (2015).
- Page, D. M., et al. An evolutionarily conserved program of B-cell development and activation in zebrafish. Blood. 122 (8), e1-e11 (2013).
- Nguyen-Chi, M., et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death Dis. 8 (8), e2979-e2979 (2017).
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Dis Models Mech. 13 (1), dmm041889(2020).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Comm Biol. 3 (1), 1-13 (2020).
- Pringle, E. S., et al. The zebrafish xenograft platform-A novel tool for modeling KSHV-associated diseases. Viruses. 12 (1), 12(2020).
- Pype, C., et al. Incubation at 32.5 °C and above causes malformations in the zebrafish embryo. Reprod Toxicol. 56, 56-63 (2015).
- Xu, X., et al. Adeno-associated virus (AAV)-based gene therapy for glioblastoma. Cancer Cell Int. 21 (1), 76(2021).
- Siebert, J., et al. Rhabdomyosarcoma xenotransplants in zebrafish embryos. Pediat Blood Cancer. 70 (1), e30053(2023).
- van Bree, N., et al. Development of an orthotopic medulloblastoma zebrafish model for rapid drug testing. Neuro-Oncol. noae210, (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados