Method Article
Macroscopa de globos não neoplásicos, incluindo olhos fetais
Neste Artigo
Resumo
O macroscopamento completo e o corte padronizado de globos não neoplásicos são importantes para a obtenção de cortes histopatológicos reprodutíveis de alta qualidade. Diretrizes para um macroscopo padronizado de globos não neoplásicos adultos e fetais são fornecidas aqui. Diferentes opções para o corte do globo são demonstradas e discutidas, incluindo critérios para a tomada de decisão baseada em casos.
Resumo
O macroscopamento e a secção dos globos fetais e adultos são etapas críticas na avaliação histopatológica das doenças oculares. O manuseio adequado do globo ocular é essencial para o diagnóstico preciso de condições como tumores e alterações não neoplásicas, incluindo traumas, infecções e procedimentos cirúrgicos anteriores. A orientação do globo é seguida por um exame externo, documentando características como tamanho, forma e qualquer lesão ou anormalidade visível. Atenção específica deve ser dada à presença de tumores, alterações infecciosas ou degenerativas, bem como sinais de trauma ou cirurgia prévia. Medições do globo e estruturas associadas, incluindo a córnea e o nervo óptico, e - nos olhos fetais - desenvolvimento anatômico e oportuno são registrados. A transiluminação é essencial para detectar uma sombra, que pode ser causada por uma massa ou hemorragia, bem como aumento da transmissão de luz em áreas de atrofia, como o coloboma.
A fixação do globo é realizada rotineiramente em paraformaldeído a 4% para preservar o tecido. Após fixação por 24 horas, o globo é seccionado sistematicamente para examinar as estruturas intraoculares, como a câmara anterior, o estado do cristalino, a úvea, a retina, o vítreo e o nervo óptico. O globo adulto é geralmente trisseccionado ao longo do plano horizontal ou - dependendo das indicações clínicas - vertical / oblíquo para criar uma seção do nervo óptico pupilar (PO). Seções adicionais das calotas podem ser tomadas para avaliar áreas de interesse, como massas suspeitas ou áreas de atrofia. Para fins de pesquisa, vários protocolos de fixação e seccionamento podem ser considerados.
Cada seção macroscópica é cuidadosamente inspecionada, documentada e processada para exame microscópico para garantir que qualquer achado patológico seja amostrado adequadamente. O macroscopo e o corte precisos são essenciais para correlacionar achados clínicos e histológicos, facilitar o diagnóstico, orientar as decisões de tratamento e, por fim, melhorar os resultados dos pacientes. A padronização do macroscópico e da seccionamento garante uma avaliação abrangente do globo ocular e contribui para o avanço da oftalmologia.
Introdução
O exame macroscópico e a secção dos globos oculares são procedimentos essenciais na patologia oftálmica, fornecendo informações valiosas sobre várias doenças oculares e cicatrização de feridas após a cirurgia1. O olho, como órgão altamente especializado, é propenso a uma ampla gama de alterações fisiopatológicas e/ou patológicas, incluindo tumores (por exemplo, melanoma uveal, retinoblastoma), processos inflamatórios (por exemplo, uveíte, endoftalmite) e doenças neurodegenerativas (por exemplo, glaucoma, degeneração macular relacionada à idade)2,3,4. A cicatrização de feridas após procedimentos cirúrgicos também pode resultar em complicações que ameaçam a visão.
Os olhos adultos que são avaliados em um laboratório de patologia oftálmica geralmente são enucleados por razões clínicas, como um tumor ou um olho cego e dolorido. Na maioria dos países, a investigação de olhos de doadores em autópsias é restrita a projetos de pesquisa. Em contraste, os olhos fetais e neonatais são geralmente espécimes de autópsia (exceto para olhos com suspeita clínica de tumor intraocular)5,6. Assim, os olhos fetais e neonatais são investigados em relação aos achados de outras disciplinas, como patologia pediátrica ou como parte de uma autópsia forense7. Tanto para os olhos fetais quanto para adultos, o conhecimento da história do paciente antes do macroscopo é fundamental para entender a indicação da análise histopatológica, que tem um impacto significativo na forma como o olho é (foto) documentado e seccionado 1,3.
No entanto, o exame macroscópico, o corte e a documentação precisos não são apenas críticos para a avaliação histopatológica, que contribui para o diagnóstico, prognóstico e manejo das doenças oculares, mas também para casos forenses (por exemplo, traumatismo cranioencefálico violento ou aspectos médico-legais)8,9. Durante o macroscopamento, um exame externo completo do globo é realizado sob um microscópio de dissecação ou um microscópio de cirurgia oftálmica descartado, com foco em características como tamanho, forma e características da superfície (Figura Suplementar S1). As medições de todo o globo ocular (ântero-posterior, horizontal e vertical), da córnea e do nervo óptico devem ser cuidadosamente realizadas por uma régua de paquímetro e documentadas (Figura 1). Os músculos oblíquos e a artéria ciliar horizontal são úteis na orientação do globo. As suturas restantes podem ser indicativas de um procedimento cirúrgico e não precisam ser removidas durante o macroscopamento. No entanto, alguns cirurgiões colocam uma sutura em um dos músculos retos durante a enucleação, o que pode ser útil não apenas para a remoção do globo, mas também para orientação (se a localização for relatada). A documentação precisa de qualquer lesão, descoloração ou outra anormalidade é crucial, pois esses achados podem fornecer pistas precoces sobre a patologia subjacente. A transiluminação é obrigatória para detectar tumores intraoculares ou defeitos de desenvolvimento, como colobomas, e identificar um local de um procedimento cirúrgico anterior.
A secção do globo ocular é normalmente realizada após a fixação em paraformaldeído a 4% (4% PFA) ou formalina a 10% para preservar a arquitetura do tecido. A fixação de rotina com PFA a 4% é realizada por 24 h. Para microscopia eletrônica, fixadores alternativos podem ser usados para amostras de pesquisa, por exemplo, fixador de Karnovsky (incluindo glutaraldeído) ou glutaraldeído a 2,5%. Uma incisão ou injeção de fixador não é recomendada, pois causa artefatos desnecessários. No entanto, para fins de pesquisa, o globo pode ser aberto para ter melhor penetração do PFA, em particular, para fixação da retina, mas isso não é aconselhável para espécimes de rotina. Em relação aos olhos do doador, eles podem ser brutos no total ou após a remoção de um botão esclero-corneano para um banco de olhos.
A escolha do plano de secção - horizontal, vertical ou oblíquo - depende da suspeita clínica e das estruturas anatômicas de interesse, incluindo locais de cirurgia prévia (por exemplo, trabeculectomia para glaucoma, geralmente na posição de 12 horas)10. Rotineiramente, um globo é seccionado no meridiano horizontal para obter uma seção do nervo óptico pupilar (seção PO) com a córnea, a pupila, o cristalino, a mácula e o nervo óptico em uma seção. Uma seção PO também pode ser alcançada se uma seção vertical ou oblíqua for executada. No entanto, neste cenário, a mácula não aparecerá na mesma seção que o nervo óptico. A seção PO é o padrão-ouro para o exame histopatológico.
Após o macroscópico e secção, as estruturas intraoculares são minuciosamente inspecionadas, fotodocumentadas e descritas (Figura 1). Cada estrutura ocular (córnea, status do cristalino, íris, corpo ciliar, coroide, retina, corpo vítreo, nervo óptico) deve ser examinada separadamente. Sempre que possível, um corte transversal do nervo óptico deve ser obtido e submetido separadamente. Todo esse exame fornece a base para pelo menos uma correlação macroscópica-histológica, se não uma correlação clínico-patológica.
Portanto, um processo preciso de macroscopia e seccionamento é altamente relevante na prática clínica, pois os globos enucleados são submetidos à análise histopatológica após trauma grave, suspeita de malignidades ou infecções resistentes ao tratamento. Um protocolo de exame macroscópico padronizado permitirá que os patologistas oftalmológicos refaçam a história de um globo para fornecer os diagnósticos histopatológicos mais precisos com relevância não apenas para o outro olho do paciente, mas também para futuros pacientes. O protocolo a seguir descreve e documenta o manuseio de olhos fetais e adultos (não neoplásicos) para diagnóstico clínico de rotina, investigações forenses e abordagens de pesquisa.
Protocolo
Certifique-se de seguir as instruções de segurança ao manusear amostras fixadas em formalina, pois é irritante para a pele, cancerígena e embriotóxica 11,12,13.
1. Orientação
- Identifique os quatro músculos retos (Figura 2A).
- Identifique o músculo oblíquo superior por sua aparência tendínea (Figura 2B). Ele se insere na esclera na superfície póstero-temporal do globo nas proximidades da inserção do músculo reto superior.
- Identifique o músculo oblíquo inferior. Ele se insere temporalmente inferiormente na esclera entre o músculo reto lateral e o nervo óptico (Figura 2C).
- Identificar a artéria ciliar posterior longa (Figura 2B).
NOTA: Nos olhos fetais, a artéria ciliar posterior longa é fundamental para identificar o meridiano horizontal, uma vez que os músculos não são tão proeminentes quanto nos olhos adultos7. - Determine a lateralidade do globo com precisão com base nas etapas 1.1.1-1.1.3 (olho direito versus olho esquerdo).
2. Bilheteria
- Meça o diâmetro ântero-posterior (diâmetro AP), bem como o diâmetro horizontal e vertical em mm (Figura 3A,B).
NOTA: Para os olhos fetais, o diâmetro AP deve ser comparado a um nomograma para avaliar a microftalmia7. - Descreva quaisquer anormalidades do aspecto externo do globo, incluindo, mas não se limitando a, cicatrizes, suturas, material estranho médico (por exemplo, banda circundante para descolamento de retina ou dispositivo de drenagem de glaucoma), corpos estranhos, deformação (Figura 4A-D).
- Meça a córnea em seu diâmetro horizontal e vertical em mm (Figura 3A).
- Descreva o aspecto da córnea, incluindo, mas não se limitando a, transparência, cicatrizes, sinal de ceratoplastia, suturas, vascularização (Figura 3A).
- Descreva a íris (se visível) em relação à cor, configuração da pupila e possíveis anormalidades. Use a transiluminação para avaliar defeitos da íris (relacionados a traumas ou anormalidades congênitas).
- Meça o nervo óptico quanto ao comprimento e anormalidades (por exemplo, hemorragia nas bainhas do nervo óptico) (Figura 3B).
- Se possível, faça um corte transversal através do nervo óptico e envie-o separadamente.
- Transilumine o globo usando um tubo de LED com ênfase especial para defeitos da íris e uma sombra escleral que possa resultar de um tumor, hemorragia ou material estranho (Figura 3C, D).
- Realize documentação fotográfica do globo.
3. Seção de espécimes de rotina
- Coloque a córnea do globo para baixo (Figura 5A).
- Marque o meridiano horizontal ou o plano de corte com uma caneta (Figura 5A-C) de modo que o corte fique próximo ao nervo óptico e passe pela córnea periférica. Isso também se aplica se a seção for vertical ou sagital.
NOTA: Não corte as áreas de interesse, em vez disso, corte perto delas - caso contrário, elas podem não ser cobertas na seção histológica à medida que o tecido encolhe com o processamento posterior. - Corte cuidadosamente com uma lâmina de micrótomo ao longo da linha marcada, segurando o globo com a outra mão.
NOTA: O material iatrogênico, como uma faixa envolvente, não precisa ser removido (Figura 4). - Remova a calota e inspecione cuidadosamente quanto a anormalidades (Figura 5D). Armazene em formalina ou submeta-o a processamento histológico adicional. Se o globo estiver cheio de óleo de silicone (usado como tamponamento) durante a cirurgia de descolamento de retina, tome cuidado com o equipamento, pois é bastante pegajoso.
- Para melanoma uveal, remova a veia do vórtice; em olhos não tumorais, isso não é feito rotineiramente.
- Inspecionar as estruturas oculares internas: câmara anterior; estado do cristalino (fácico ou pseudofácico, afácico, catarata, catarata secundária); íris; corpo ciliar; Coróide; retina central; retina periférica; nervo óptico (por exemplo, atrofia); esclera (pode estar espessada nos olhos tísicos ou afinada, em trauma ou estafiloma).
- Remova a outra calota para obter uma seção PO adequada (Figura 5E e Figura 6A); Coloque o globo aberto com cuidado com a abertura para baixo.
- Segure o globo com uma mão e corte-o em uma direção paralela (mas acima do nervo óptico e, novamente, idealmente através da córnea periférica). O globo é menos estável depois de aberto.
- Remova a calota e inspecione cuidadosamente quanto a anormalidades. Armazene em formalina ou envie para processamento histológico adicional (Figura 6).
- Realize a documentação fotográfica da seção PO e envie-a para posterior processamento histológico.
4. Seção de espécimes fetais
NOTA: Estes são apenas ajustes ao protocolo principal descrito nas seções 1 (orientação), 2 (macroscopia) e 3 (seção de espécimes de rotina).
- Posicione o globo com a córnea para baixo.
- Identifique a artéria ciliar posterior longa comprimindo suavemente o globo ocular (Figura 7).
- Disseque o globo horizontalmente próximo ao nervo óptico, colocando uma leve pressão na lâmina do micrótomo. Certifique-se de que a periferia da córnea também esteja dentro da seção.
NOTA: A trissecção não é recomendada devido ao pequeno tamanho do globo fetal. - Avalie as estruturas intraoculares minuciosamente e documente-as com foto, conforme descrito na etapa 3.6.
NOTA: Atenção especial deve ser dada às estruturas fetais (por exemplo, vasculatura fetal) ou anormalidades de desenvolvimento (por exemplo, coloboma). - Envie a parte principal do globo para processamento posterior.
- Arquive a calota restante em formalina ou envie para processamento posterior.
5. Seção de espécimes forenses
- Familiarize-se com a questão forense antes de seccionar. Na patologia forense, prepare-se para analisar partes do globo toxicologicamente (vítreo) ou usá-las para estimar o tempo desde a morte (córnea)2,14.
- Para traumatismo cranioencefálico violento (TCA), realize uma dissecção horizontal seguida de inspeção completa e documentação fotográfica de hemorragias retinianas e hemorragias da bainha do nervo óptico. Faça uma coloração de ferro (por exemplo, coloração azul da Prússia de Perl) para avaliar sinais de hemorragias já degradadas.
NOTA: Um protocolo mais detalhado é fornecido por Gilliland et al., que recomendam a remoção e análise dos olhos e seu conteúdo orbital15.
Existem muitas outras condições que levam a hemorragias retinianas em um recém-nascido, além do AHT 7,16,17,18,19,20. - Para questões relacionadas à cirurgia (por exemplo, endoftalmite4), realize a dissecção horizontal do globo ocular e a avaliação conforme descrito na seção 3. Para olhos com histórico de trabeculectomia, faça uma seção vertical próxima ao local da bolha (que pode ser uma entrada para bactérias).
- Corpos estranhos: Meça e fotografe o objeto e sua localização in situ ou no espaço vazio onde o objeto foi alojado (corpos estranhos metálicos requerem remoção antes do corte, pois não podem ser seccionados). Descreva a cor, a forma e a consistência. Mantenha o corpo estranho armazenado, pois pode ser reinvestigado para fins legais.
6. Abordagens alternativas
NOTA: Uma abordagem alternativa pode ser usada se a retina precisar ser investigada antes da secção 10,21,22. Essa abordagem é semelhante aos globos de doadores em que o tecido esclerocorneano foi removido para um banco de olhos.
- Use um bisturi e corte circunferencialmente dentro da pars plana (Figura 8A).
- Remover o segmento anterior (córnea, borda escleral, cristalino), bissetriz e submeter à avaliação histopatológica de rotina (Figura 8B).
- Visualize a retina e visualize-a multimodalmente (antes e/ou depois da fixação) (Figura 8B).
- Remova as duas calotas para processamento de rotina adicional. Como o segmento anterior já foi removido, o globo ocular remanescente é instável; portanto, estabilize-o firmemente com uma mão enquanto remove a calota conforme descrito nas etapas 3.1-3.4.
- Avalie as estruturas intraoculares minuciosamente e fotografe conforme descrito na etapa 3.6.
- Remova a segunda calota conforme descrito nas etapas 3.7 a 3.10 (Figura 8D).
NOTA: Para espécimes apenas de pesquisa, outras abordagens são possíveis21.
7. Processamento posterior
- Após o processamento de rotina e a inclusão de parafina, prepare seções de degraus de 5 μm de espessura até que o nervo óptico e a mácula estejam na seção.
- Determine individualmente a distância entre as seções do degrau.
NOTA: Esta distância entre as seções do degrau é rotineiramente de ~ 250 μm em nosso laboratório de patologia oftálmica. - Prepare seções seriadas para globos de pesquisa. Se forem necessárias colorações imuno-histoquímicas, monte as seções em lâminas revestidas.
Resultados
Após a orientação, deve ser viável determinar a lateralidade para olhos adultos. No entanto, isso geralmente é impossível para os olhos fetais. A lateralidade é importante para confirmar que o olho correto foi removido e que corresponde ao relato. As medições antes do corte são documentadas. Em particular, para os olhos fetais, um nomograma é útil para descartar anomalias de tamanho ocular, como microftalmia.
Com base na história e transiluminação do paciente, a secção é planejada. O globo é geralmente seccionado horizontalmente, o que requer a identificação adequada do plano horizontal, conforme descrito acima. Se houver áreas específicas de interesse (por exemplo, coloboma, lesões insuspeitas identificadas na transiluminação ou locais cirúrgicos, como trabeculectomia), a secção é adaptada, respectivamente. O resultado de destino do seccionamento é uma seção PO adequada (Figura 5 e Figura 6).
Um globo ocular desajeitadamente seccionado prejudica uma correlação clínico-patológica precisa e a interpretação dos achados histológicos com um impacto potencial no acompanhamento do paciente. Por exemplo, um dos diagnósticos mais ameaçadores a serem considerados é a oftalmia simpática23 , uma inflamação granulomatosa crônica bilateral da úvea, potencialmente levando à cegueira do outro olho remanescente (olho simpatizante). Essa entidade precisa ser descartada em todos os globos e, em particular, em olhos cegos e doloridos. Como isso é fundamental para preservar o olho remanescente, seções representativas do globo são obrigatórias para avaliação, de preferência como seções PO.
No caso de um corte ser feito erroneamente em toda a córnea em vez de seccionar a periferia, envie a calota com córnea e segmento anterior e a seção PO falhada. A segunda calota precisa ser removida conforme descrito acima para que o globo caiba no. Notavelmente, os olhos tísicos podem exibir metaplasia óssea do epitélio pigmentar da retina, tornando quase impossível seccionar o globo. Descalcifique o globo em ácido nítrico a 5% por 24 h, seguido de solução de lítio ou sulfato de sódio a 5% por 24 h, armazene em água da torneira por 24-48 h e tente novamente cortar o globo. Repita a descalcificação até que o globo possa ser seccionado. Por fim, a fotodocumentação de cada globo deve ser realizada. Isso não é apenas por razões forenses, mas também útil se ocorrerem achados histológicos inesperados.
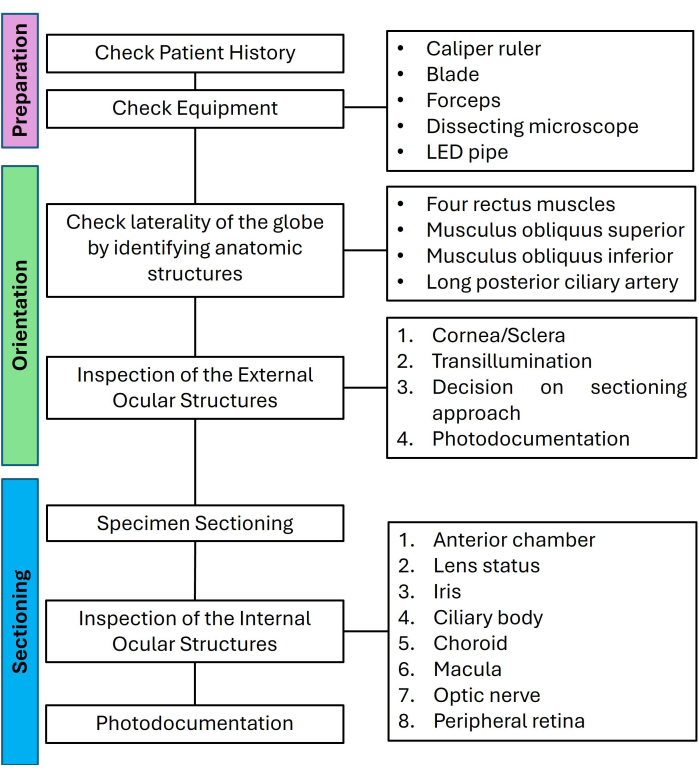
Figura 1: Fluxograma para preparação, orientação e secção de olhos não tumorais listando as etapas relevantes em uma abordagem semelhante a uma lista de verificação. Abreviatura: LED = diodo emissor de luz. Clique aqui para ver uma versão maior desta figura.
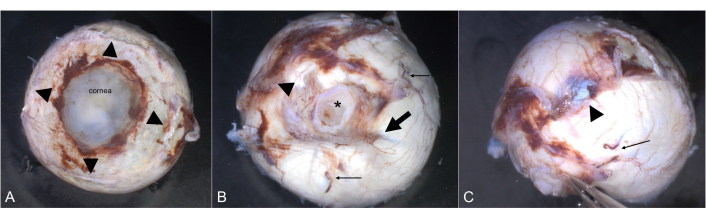
Figura 2: Orientação. A córnea é claramente visível de uma vista anterior. (A) As inserções dos quatro músculos retos são destacadas por pontas de setas. (B) O nervo óptico (asterisco) é visível de uma vista posterior. A artéria ciliar longa (seta) marca o meridiano horizontal. A inserção tipicamente carnuda do músculo oblíquo inferior (cabeça de seta) é aproximadamente temporal. Duas das veias do vórtice são destacadas por setas finas. (C) A inserção tendínea do músculo oblíquo superior (cabeça de seta) é superiormente entre o músculo reto superior e o nervo óptico. Uma veia de vórtice é marcada por uma flecha fina. Clique aqui para ver uma versão maior desta figura.
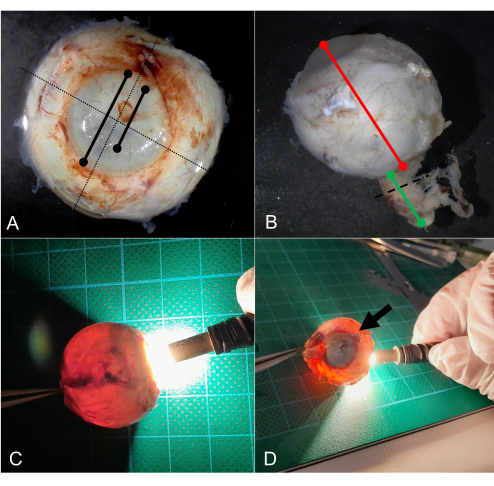
Figura 3: Macroscopagem. (A) Medição do diâmetro horizontal e vertical em mm (linha pontilhada). Medição do diâmetro da córnea e, por exemplo, do diâmetro da ceratoplastia. (B) Meça o diâmetro ântero-posterior em mm (linha vermelha) e o comprimento do nervo óptico (linha verde). O nervo óptico é seccionado transversalmente (linha pontilhada) e submetido separadamente para processamento posterior. (C) Transiluminação regular de um globo por uma luz LED. (D) Na transiluminação, uma sombra é vista causada por um tumor de coróide (seta). Abreviatura: LED = diodo emissor de luz. Clique aqui para ver uma versão maior desta figura.
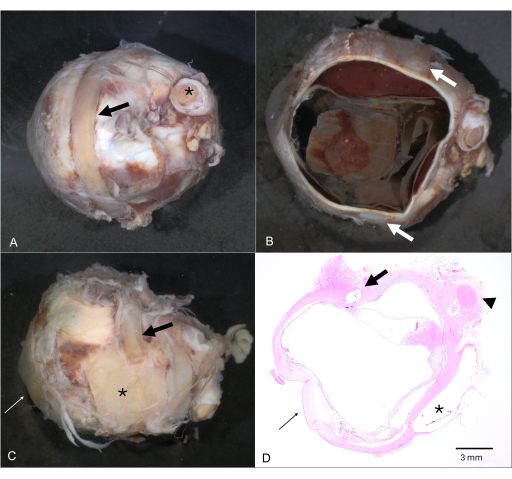
Figura 4: Material estranho extraocular. (A) Globo ocular com uma banda envolvente/cerclagem (seta; o nervo óptico é marcado por um asterisco). (B) Após a dissecção horizontal, a faixa circundante ainda está presa ao globo (setas). (C) Múltiplas aplicações externas de materiais estranhos para cirurgia histórica de descolamento de retina consistindo em placas (asterisco) e várias fivelas esclerais (seta). (D) A seção correspondente de Hematoxilina e Eosina mostra a localização intraescleral de uma fivela (seta), bem como a imagem negativa de uma placa extraescleral (asterisco). A córnea é marcada em C e D por uma seta fina e o nervo óptico por uma ponta de seta em D. Clique aqui para ver uma versão maior desta figura.
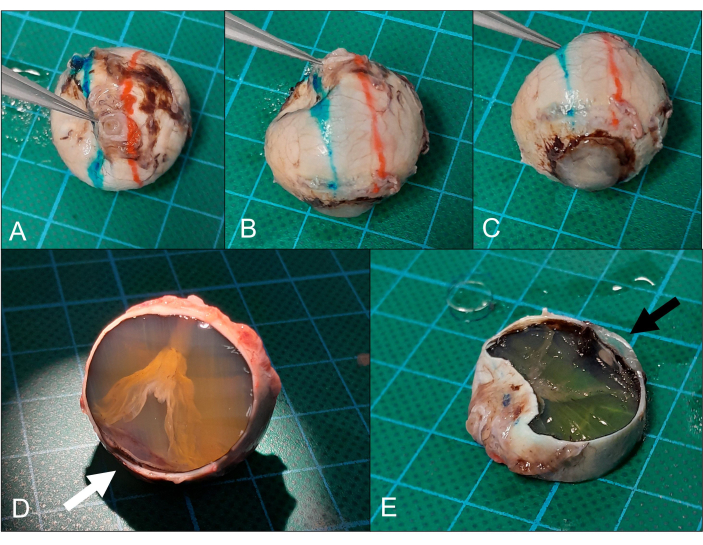
Figura 5: Seccionamento. (A) O globo é colocado com a córnea para baixo (mesmo olho da Figura 2) e (B) os planos de seção superior (vermelho) e inferior (azul) são marcados. (C) O plano de corte passa idealmente pela córnea periférica / área límbica. (D) Após a remoção da calota superior, um descolamento de retina em forma de funil pode ser visto. A seção está apenas próxima à córnea periférica (seta), mas isso também é suficiente para análise. (E) A remoção da calota inferior (observe a córnea periférica na seção, seta) produz a seção do nervo óptico pupila pretendida. Clique aqui para ver uma versão maior desta figura.
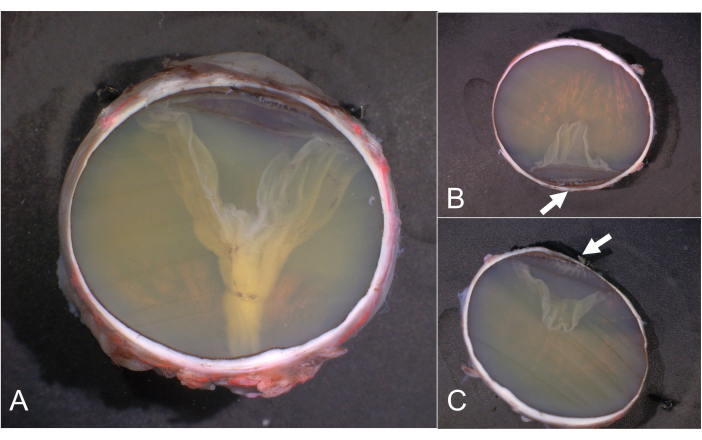
Figura 6: Cortes e calotas PO. (A) Corte PO, (B) calota superior e (C) inferior. A pars plicata do corpo ciliar é destacada por setas em B e C. As calotas sem detalhes clinicamente relevantes não precisam ser processadas posteriormente e, em vez disso, são arquivadas. Abreviatura: PO = nervo óptico pupilar. Clique aqui para ver uma versão maior desta figura.

Figura 7: Olhos fetais e microftálmicos. (A) Olho fetal regular, 21 semanas de gestação e 10 mm de diâmetro AP. (B) Empurrar suavemente com uma pinça revela a artéria ciliar posterior longa (pontas de setas), que indica o meridiano horizontal. (C) Após a bissecção, as estruturas intraoculares podem ser inspecionadas, incluindo a artéria hialóide (seta). (D) Olho microftálmico de um adulto. A córnea é destacada por uma seta. (E) Os globos foram divididos ao meio; A artéria ciliar posterior longa não pôde ser identificada. Abreviatura: AP = ântero-posterior. Clique aqui para ver uma versão maior desta figura.
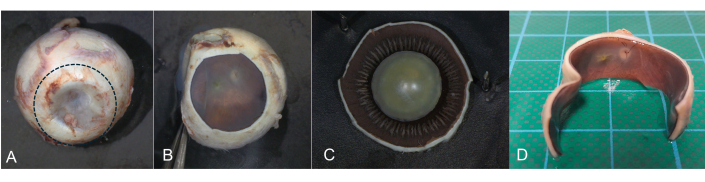
Figura 8: Incisão coronal. Uma incisão coronal é útil se a aquisição de imagens post-mortem do fundo do olho for pretendida. Durante a transiluminação, a pars plana do corpo ciliar pode ser identificada como uma estrutura circular em forma de banda. (A) Usando um bisturi, uma incisão circular é feita na área da pars plana (linha pontilhada) e o segmento anterior é removido. (B) A retina e o nervo óptico podem ser documentados e visualizados. (C) O segmento anterior é então investigado separadamente. (D) Corte horizontal com segmento anterior removido. Clique aqui para ver uma versão maior desta figura.
Figura suplementar S1: Unidade de microscópio de dissecação. Unidade de trabalho com microscópio de cirurgia oftálmica descartado. (A) Um tubo de LED (seta) e o equipamento necessário para grossura e seccionamento. Os materiais necessários são (B) régua, régua de paquímetro, pinça e (C) micrótomo/lâminas de barbear. Para seccionamento de globos adultos, lâminas de micrótomo (direita) são recomendadas; Para olhos fetais ou outras amostras oculares, lâminas de barbear (esquerda) são suficientes. (D) Microscópio de dissecação com uma câmera conectada para documentar a amostra. Clique aqui para baixar este arquivo.
Discussão
Este protocolo visa padronizar o exame macroscópico de globos oculares não neoplásicos. As diretrizes macroscópicas da literatura enfocam principalmente os olhos com tumor intraocular 24,25. Os respectivos protocolos de seccionamento são encontrados no site da Academia Americana de Oftalmologia26, em vários sites de universidades, no site do College of American Pathologists, bem como em livros didáticos de patologia oftálmica 7,10. Existem também protocolos específicos para fins de pesquisa, por exemplo, fluorescência de folha de luz para a vasculatura ocular 27,28,29.
Até onde sabemos, não há diretriz publicada para macroscopagem sistemática de globos não tumorais enucleados. Notavelmente, nossa diretriz visa melhorar a avaliação de espécimes de enucleação, que difere dos olhos tumorais porque o foco principal de investigação pode não ser predeterminado. Além disso, os olhos não tumorais geralmente têm uma longa história ocular, incluindo cirurgia, com múltiplas alterações intraoculares elucidando a fisiopatologia das doenças oculares e a cicatrização de feridas. A evisceração - as estruturas intraoculares são removidas enquanto a esclera e o nervo óptico permanecem no paciente - não permite uma localização precisa dos achados oculares.
Nos casos em que a enucleação é necessária para outras indicações que não um tumor, todas as outras opções de tratamento disponíveis falharam e os pacientes geralmente relatam um olho cego e dolorido devido a glaucoma secundário (por exemplo, após retinopatia diabética proliferativa ou oclusão da veia central da retina), trauma ocular grave, doenças perfurantes da córnea não controladas ou cirurgia frustrante de descolamento de retina (que se tornou rara devido a técnicas aprimoradas de cirurgia de retina). Como a oftalmologia é uma disciplina cirúrgica altamente especializada, existem muitas opções para preservar a visão dos pacientes ou pelo menos manter o olho em um estado indolor e as razões acima mencionadas para a enucleação são felizmente raras. Muitos pacientes submetidos à enucleação têm, portanto, uma história de múltiplas intervenções cirúrgicas, como ceratoplastia, redução de pressão ou cirurgia de retina. Traçar o histórico do paciente, que nem sempre é mencionado em detalhes no formulário de solicitação de patologia, é fundamental para a decisão de como seccionar o olho.
Um exame abrangente de amostras de enucleação melhora o atendimento ao paciente, entendendo melhor as condições oculares graves que podem levar a esse procedimento cirúrgico final. O macroscopia adequado também aumenta a correlação entre a imagem multimodal e os achados histológicos, conforme descrito por Eagle21. Além disso, o exame macroscópico dos globos oculares tem grande valor educacional, pois ajuda estudantes e residentes a entender melhor a complexidade e a extensão de várias doenças oculares e as implicações das intervenções cirúrgicas.
Para os olhos fetais, o exame padronizado ajuda no diagnóstico morfológico exato das malformações oculares. Juntamente com os outros achados obtidos durante a autópsia fetal, muitas vezes permite uma classificação exata de uma síndrome e, assim, um melhor aconselhamento genético para os pais em relação ao risco de recorrência em gestações subsequentes.
O posicionamento correto da amostra é uma etapa crítica na aplicação deste protocolo. Um erro nessa fase do exame pode comprometer a descrição e localização dos achados, produzindo um laudo incorreto. Um fator-chave limitante desse método é a preservação do globo. Um espécime deixado sem formalina por muitas horas pode apresentar sinais de autólise, o que pode comprometer a avaliação histopatológica, incluindo a coloração imuno-histoquímica1. Além disso, distorções arquitetônicas, que são freqüentemente encontradas em olhos tísicos, podem dificultar o posicionamento correto do globo e fazer uma incisão precisa e simétrica. Para superar isso, procure as principais estruturas anatômicas.
Em conclusão, propomos um protocolo sistemático para um exame abrangente de olhos enucleados, com o objetivo de melhorar o atendimento ao paciente por meio de maior precisão diagnóstica e fornecer oportunidades educacionais. Nossa abordagem se concentra na identificação adequada das estruturas anatômicas e na orientação espacial do espécime, garantindo a correta avaliação e documentação das alterações patológicas. A padronização do exame macroscópico de globos não neoplásicos deve ser implementada em laboratórios de patologia para melhorar a patologia oftálmica descritiva e diagnóstica para fins clínicos e educacionais e apoiar estudos futuros sobre correlações clínico-patológicas.
Divulgações
Martina C. Herwig-Carl é coautora do livro "Fetal and Neonatal Eye Pathology", Springer 2020; Secretário da Sociedade Internacional de Patologia Oftálmica (ISOP); Membro do comitê da seção "patologia oftálmica" da Sociedade Oftalmológica Alemã (DOG); Membro do "Comitê de Programa da Reunião Anual" da ARVO para a seção "Anatomia Patologia (AP)". Frank G. Holz: Acucela (C, F, R), Alcon (C, F, R), Alexion, Apellis (C, R), Allergan / AbbVie company (F, R), Bayer (C, F, R), Boehringer Ingelheim (C), CenterVue (F), Ellex (R), Genentech / Roche (C, F, R), Geuder (C), Grayburg Vision (C, R), Kanghong (C, F), Heidelberg Engineering (C, F, R), Lin BioScience (C, R), NightStarX (F), Novartis (C,F,R), Optos (F), Oxurion (C,R), Pixium Vision (C,F,R), Stealth Biotherapeutics (C,R), Zeiss (F,R). Os demais autores não têm conflitos de interesse a declarar. [C: consultor; F: apoio financeiro; R: destinatário]
Agradecimentos
Este trabalho foi apoiado pelo Fundo de Publicação de Acesso Aberto da Universidade de Bonn.
Materiais
| Name | Company | Catalog Number | Comments |
| Caliper ruler | Mauser | out of market | INOX Messchieber 0- 200 mm |
| Dissecting microscope or discarded ophthalmic surgery microscope | Möller Wedel | out of market | |
| Forceps | Fine Science | 11203-23 | SS INOX |
| HistoBond | Marienfeld, Germany | DIN ISO 8037-1 | coated slides |
| LED pipe for transillumination in a dark room | Schott, Mainz | out of market | KL150 |
| Microtome blade | Feather microtome blades | N/A | A35 type |
Referências
- Torczynski, E. Preparation of ocular specimens for histopathologic examination. Ophthalmology. 88 (12), 1367-1371 (1981).
- Atreya, A., Ateriya, N., Menezes, R. G. The eye in forensic practice: In the dead. Med Leg J. , (2024).
- Herwig-Carl, M. C., Holz, F. G., Löffler, K. U. Die Geschichte eines Auges – Untersuchung enukleierter Bulbi. Der Ophthalmologe. 117 (12), 1171-1179 (2020).
- Herwig-Carl, M. C., Holz, F., Löffler, K. U. Endophthalmitis aus ophthalmopathologischer Sicht. Klin Monbl Augenheilkd. 239 (7), 867-875 (2022).
- Herwig-Carl, M. C., Loeffler, K. U., Müller, A. M. Bedeutung der Untersuchung fetaler Augen : Ergänzung der Fetobduktion. Pathologe. 38 (4), 231-240 (2017).
- Herwig, M. C., Müller, A. M., Holz, F. G., Loeffler, K. U. Analyse eines ophthalmopathologischen Kollektivs humaner fetaler Augen unter besonderer Berücksichtigung außergewöhnlicher Befunde. Der Ophthalmologe. 107 (11), 1051-1058 (2010).
- Verdijk, R. M., Herwig-Carl, M. C. . Fetal and Neonatal Eye Pathology. , (2020).
- Breazzano, M. P., Unkrich, K. H., Barker-Griffith, A. E. Clinicopathological findings in abusive head trauma: analysis of 110 infant autopsy eyes. Am J Ophthalmol. 158 (6), 1146-1154.e2 (2014).
- Watts, P., et al. Abusive head trauma and the eye in infants and children - clinical guideline update by the royal college of ophthalmologists and the royal college of paediatrics and child health: executive summary. Eye (Lond). 38 (10), 1783-1786 (2024).
- Spencer, W. H. . Ophthalmic pathology: An atlas and textbook. , (1985).
- Khoshakhlagh, A. H., Mohammadzadeh, M., Sicard, P., Bamel, U. Human exposure to formaldehyde and health risk assessment: a 46-year systematic literature review. Environ Geochem Health. 46 (6), 206 (2024).
- Protano, C., et al. The carcinogenic effects of formaldehyde occupational exposure: A systematic review. Cancers. 14 (1), 165 (2021).
- Duong, A., Steinmaus, C., McHale, C. M., Vaughan, C. P., Zhang, L. Reproductive and developmental toxicity of formaldehyde: a systematic review. Mutat Res. 728 (3), 118-138 (2011).
- Ang, J. L., Collis, S., Dhillon, B., Cackett, P. The eye in forensic medicine: A narrative review. Asia Pac J Ophthalmol (Phila). 10 (5), 486-494 (2021).
- Gilliland, M. G. F., et al. Guidelines for postmortem protocol for ocular investigation of sudden unexplained infant death and suspected physical child abuse. Am J Forensic Med Pathol. 28 (4), 323-329 (2007).
- Bhardwaj, G., et al. A systematic review of the diagnostic accuracy of ocular signs in pediatric abusive head trauma. Ophthalmology. 117 (5), 983-992.e17 (2010).
- Herwig, M. C., Müller, A. M., Kuchelmeister, K., Loeffler, K. U. Pre- and intraretinal haemorrhages in a 22-week-old fetus of a mother suffering from HELLP syndrome and factor V Leiden mutation with deep vein thrombosis. Acta. 95 (1), e83-e84 (2017).
- Thau, A., et al. Retinal hemorrhage and bleeding disorders in children: A review. Child abuse Negl. 112, 104901 (2021).
- Mattheij, M., et al. Retinal haemorrhages in a university hospital: not always abusive head injury. Acta Neurol Belg. 117 (2), 515-522 (2017).
- Maguire, S. A., et al. Retinal haemorrhages and related findings in abusive and non-abusive head trauma: a systematic review. Eye (London). 27 (1), 28-36 (2013).
- Eagle, R. C. Optical coherence tomography: Clinicopathologic correlations - The 2016 Gordon K. Klintworth lecture. Ocul Oncol Pathol. 4 (4), 203-212 (2018).
- Stockinger, P., et al. Vergleichende In-vivo-/Ex-vivo-Bildgebung des hinteren Augenabschnitts - Version. Der Ophthalmologe. 118 (Suppl 2), 153-159 (2021).
- Agarwal, M., et al. Sympathetic ophthalmia - An Overview. Ocul Immunol Inflamm. 31 (4), 793-809 (2023).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with uveal melanoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1177-1182 (2001).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with retinoblastoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1183-1188 (2001).
- . American Academy of Ophthalmology (AAO) Available from: https://www.aao.org/education/image/gross-dissection-of-globe (2025)
- Lu, W., et al. Corrigendum to 'Recent progress in optical clearing of eye tissues' Exp. Eye Res (Nov; 2021) 212 108796. Exp Eye Res. 214, 108896 (2022).
- Lu, W., et al. Recent progress in optical clearing of eye tissues. Exp Eye Res. 212, 108796 (2021).
- Darche, M., et al. Three-dimensional characterization of developing and adult ocular vasculature in mice using in toto clearing. Commun Biol. 5 (1), 1135 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados