Method Article
Grossissement de globes non néoplasiques, y compris les yeux fœtaux
Dans cet article
Résumé
Une macroscopie approfondie et une section standardisée des globes non néoplasiques sont importantes pour obtenir des coupes histopathologiques reproductibles de haute qualité. Des lignes directrices pour une macroscopie normalisée des globes non néoplasiques adultes et fœtaux sont fournies ici. Différentes options de coupe de globe sont présentées et discutées, y compris les critères de prise de décision au cas par cas.
Résumé
La macroscopie et la coupe des globes fœtaux et adultes sont des étapes essentielles dans l’évaluation histopathologique des maladies oculaires. Une bonne manipulation du globe est essentielle pour un diagnostic précis d’affections telles que les tumeurs et les changements non néoplasiques, y compris les traumatismes, les infections et les interventions chirurgicales antérieures. L’orientation du globe est suivie d’un examen externe, documentant les caractéristiques telles que la taille, la forme et toute lésion ou anomalie visible. Une attention particulière doit être accordée à la présence de tumeurs, de modifications infectieuses ou dégénératives, ainsi qu’aux signes de traumatisme ou d’intervention chirurgicale antérieure. Les mesures du globe et des structures associées, y compris la cornée et le nerf optique, et - dans les yeux fœtaux - le développement anatomique et opportun sont enregistrés. La transillumination est essentielle pour détecter une ombre, qui peut être causée par une masse ou une hémorragie, ainsi que par une transmission accrue de la lumière dans les zones d’atrophie, telles que le colobome.
La fixation du globe est systématiquement réalisée dans du paraformaldéhyde à 4 % pour préserver le tissu. Après une fixation de 24 h, le globe est sectionné systématiquement pour examiner les structures intraoculaires, telles que la chambre antérieure, l’état du cristallin, l’uvée, la rétine, le vitré et le nerf optique. Le globe adulte est généralement coupé en trois le long du plan horizontal ou, selon les indications cliniques, vertical/oblique pour créer une section pupille-nerf optique (PO). Des sections supplémentaires des calottes peuvent être prélevées pour évaluer les zones d’intérêt, telles que les masses suspectes ou les zones d’atrophie. À des fins de recherche, divers protocoles de fixation et de sectionnement peuvent être envisagés.
Chaque section macroscopique est soigneusement inspectée, documentée et traitée pour un examen microscopique afin de s’assurer que tout résultat pathologique est échantillonné adéquatement. Une macroscopie et une sectionnement précis sont essentielles pour corréler les résultats cliniques et histologiques, faciliter le diagnostic, guider les décisions de traitement et, en fin de compte, améliorer les résultats pour les patients. La standardisation de la macroscopie et de la coupe assure une évaluation complète du globe oculaire et contribue à l’avancement de l’ophtalmologie.
Introduction
L’examen macroscopique et la section des globes oculaires sont des procédures essentielles en pathologie ophtalmique, fournissant des informations précieuses sur diverses maladies oculaires et la cicatrisation des plaies après une intervention chirurgicale1. L’œil, en tant qu’organe hautement spécialisé, est sujet à un large éventail de changements physiopathologiques et/ou pathologiques, y compris les tumeurs (par exemple, le mélanome uvéal, le rétinoblastome), les processus inflammatoires (par exemple, l’uvéite, l’endophtalmie) et les maladies neurodégénératives (par exemple, le glaucome, la dégénérescence maculaire liée à l’âge)2,3,4. La cicatrisation des plaies à la suite d’interventions chirurgicales peut également entraîner des complications menaçant la vision.
Les yeux adultes qui sont évalués dans un laboratoire de pathologie ophtalmique sont généralement énucléés pour des raisons cliniques, telles qu’une tumeur ou un œil aveugle et douloureux. Dans la plupart des pays, l’investigation des yeux des donneurs à partir d’autopsies se limite à des projets de recherche. En revanche, les yeux fœtaux et néonatals sont généralement des échantillons d’autopsie (à l’exception des yeux présentant une suspicion clinique d’une tumeur intraoculaire)5,6. Ainsi, les yeux fœtaux et néonatals sont étudiés en relation avec les résultats d’autres disciplines, telles que la pathologie pédiatrique ou dans le cadre d’une autopsie médico-légale7. Pour les yeux fœtaux et adultes, la connaissance des antécédents du patient avant la macroplastie est essentielle pour comprendre l’indication de l’analyse histopathologique, qui a un impact significatif sur la façon dont l’œil est (photo-) documenté et sectionné 1,3.
Cependant, un examen macroscopique, une section et une documentation précis sont non seulement essentiels pour l’évaluation histopathologique, qui contribue au diagnostic, au pronostic et à la prise en charge des maladies oculaires, mais aussi pour les cas médico-légaux (par exemple, les traumatismes crâniens abusifs ou les aspects médico-légaux)8,9. Au cours de la macroscopie, un examen externe approfondi du globe est effectué à l’aide d’un microscope de dissection ou d’un microscope de chirurgie ophtalmique mis au rebut, en se concentrant sur des caractéristiques telles que la taille, la forme et les caractéristiques de la surface (figure supplémentaire S1). Les mesures de l’ensemble du globe (antéro-postérieur, horizontal et vertical), de la cornée et du nerf optique doivent être soigneusement effectuées à l’aide d’une règle à coulisse et documentées (Figure 1). Les muscles obliques et l’artère ciliaire horizontale sont utiles pour orienter le globe. Les sutures restantes peuvent indiquer une intervention chirurgicale et n’ont pas besoin d’être retirées pendant la macroplastie. Cependant, certains chirurgiens placent une suture dans l’un des muscles droits pendant l’énucléation, ce qui peut être utile non seulement pour l’ablation du globe, mais aussi pour l’orientation (si la localisation est signalée). Une documentation précise de toute lésion, décoloration ou autre anomalie est cruciale, car ces résultats peuvent fournir des indices précoces sur la pathologie sous-jacente. La transillumination est obligatoire pour détecter les tumeurs intraoculaires ou les défauts de développement tels que les colobomes et identifier un site d’une intervention chirurgicale antérieure.
La section du globe est généralement effectuée après fixation dans 4 % de paraformaldéhyde (4 % de PFA) ou 10 % de formol pour préserver l’architecture tissulaire. La fixation de routine avec 4 % de PFA est effectuée pendant 24 h. Pour la microscopie électronique, des fixateurs alternatifs peuvent être utilisés pour les échantillons de recherche, par exemple, le fixateur de Karnovsky (y compris le glutaraldéhyde) ou le glutaraldéhyde à 2,5 %. Une incision ou une injection de fixateur n’est pas recommandée car elle provoque des artefacts inutiles. Cependant, à des fins de recherche, le globe peut être ouvert pour avoir une meilleure pénétration du PFA, en particulier pour la fixation de la rétine, mais cela n’est pas conseillé pour les échantillons de routine. En ce qui concerne les yeux de donneurs, ils peuvent être grossiers en totalité ou après l’ablation d’un bouton scléro-cornéen pour une banque d’yeux.
Le choix du plan de coupe - horizontal, vertical ou oblique - dépend de la suspicion clinique et des structures anatomiques d’intérêt, y compris les sites de chirurgie antérieure (par exemple, trabéculectomie pour glaucome, généralement à la position 12 heures)10. Régulièrement, un globe est sectionné au méridien horizontal pour obtenir une section du nerf pupillaire-optique (section PO) avec la cornée, la pupille, le cristallin, la macula et le nerf optique sur une section. Une section PO peut également être réalisée si une section verticale ou oblique est réalisée. Cependant, dans ce scénario, la macula n’apparaîtra pas sur la même section que le nerf optique. La section PO est la référence en matière d’examen histopathologique.
Après la macroscopie et la section, les structures intraoculaires sont minutieusement inspectées, photodocumentées et décrites (figure 1). Chaque structure oculaire (cornée, état du cristallin, iris, corps ciliaire, choroïde, rétine, corps vitré, nerf optique) doit être examinée séparément. Dans la mesure du possible, une coupe transversale du nerf optique doit être obtenue et soumise séparément. Tout cet examen fournit la base d’une corrélation macroscopique-histologique au moins, sinon d’une corrélation clinico-pathologique.
Par conséquent, un processus précis de macroscopie et de sectionnement est très pertinent dans la pratique clinique, car les globes énucléés sont soumis à une analyse histopathologique à la suite d’un traumatisme grave, d’une suspicion de tumeurs malignes ou d’infections résistantes au traitement. Un protocole d’examen macroscopique standardisé permettra aux pathologistes ophtalmologistes de retracer l’histoire d’un globe terrestre afin de fournir les diagnostics histopathologiques les plus précis et pertinents non seulement pour l’œil du patient, mais aussi pour les futurs patients. Le protocole suivant décrit et documente la manipulation des yeux fœtaux et adultes (non néoplasiques) pour le diagnostic clinique de routine, les investigations médico-légales et les approches de recherche.
Protocole
Assurez-vous de respecter les consignes de sécurité lors de la manipulation d’échantillons fixés au formol, car il est irritant pour la peau, cancérigène et embryotoxique 11,12,13.
1. L’orientation
- Identifiez les quatre muscles droits (Figure 2A).
- Identifiez le muscle oblique supérieur par son aspect tendineux (Figure 2B). Il s’insère dans la sclérotique sur la surface postérotemporale du globe à proximité immédiate de l’insertion du muscle droit supérieur.
- Identifiez le muscle oblique inférieur. Il s’insère temporal en dessous dans la sclérotique entre le muscle droit latéral et le nerf optique (Figure 2C).
- Identifiez la longue artère ciliaire postérieure (Figure 2B).
REMARQUE : Dans les yeux fœtaux, la longue artère ciliaire postérieure est essentielle pour identifier le méridien horizontal car les muscles ne sont pas aussi proéminents que dans les yeux adultes7. - Déterminez la latéralité du globe avec précision en vous basant sur les étapes 1.1.1-1.1.3 (œil droit ou œil gauche).
2. Recettes brutes
- Mesurez le diamètre antéro-postérieur (diamètre AP) ainsi que le diamètre horizontal et vertical en mm (Figure 3A,B).
REMARQUE : Pour les yeux fœtaux, le diamètre AP doit être comparé à un nomogramme pour évaluer la microphtalmie7. - Décrivez toute anomalie de la face externe du globe, y compris, mais sans s’y limiter, les cicatrices, les sutures, les corps étrangers médicaux (par exemple, la bande d’encerclement pour le décollement de la rétine ou le dispositif de drainage du glaucome), les corps étrangers, la déformation (Figure 4A-D).
- Mesurez la cornée dans son diamètre horizontal et vertical en mm (Figure 3A).
- Décrivez l’aspect cornéen, y compris, mais sans s’y limiter, la transparence, les cicatrices, le signe de kératoplastie, les sutures, la vascularisation (Figure 3A).
- Décrivez l’iris (s’il est visible) en ce qui concerne la couleur, la configuration de la pupille et les anomalies possibles. Utilisez la transillumination pour évaluer les défauts de l’iris (liés à un traumatisme ou à des anomalies congénitales).
- Mesurez la longueur et les anomalies du nerf optique (p. ex., hémorragie dans les gaines du nerf optique) (Figure 3B).
- Si possible, faites une coupe transversale à travers le nerf optique et soumettez-la séparément.
- Transilluminez le globe à l’aide d’un tuyau LED avec un accent particulier sur les défauts de l’iris et une ombre sclérale qui pourraient résulter d’une tumeur, d’une hémorragie ou d’un corps étranger (Figure 3C, D).
- Effectuer la documentation photographique du globe.
3. Coupe des échantillons de routine
- Placez la cornée du globe vers le bas (Figure 5A).
- Marquez le méridien horizontal ou le plan de la section avec un stylo (Figure 5A-C) de sorte que la section soit proche du nerf optique et traverse la cornée périphérique. Cela s’applique également si la section est verticale ou sagittale.
REMARQUE : Ne coupez pas à travers les zones d’intérêt, coupez plutôt près de celle-ci - sinon, elles risquent de ne pas être couvertes sur la coupe histologique car le tissu rétrécit au cours d’un traitement ultérieur. - Sectionnez soigneusement avec une lame microtome le long de la ligne marquée, en tenant le globe avec l’autre main.
REMARQUE : Il n’est pas nécessaire d’enlever les matières iatrogènes, telles qu’une bande d’encerclement (Figure 4). - Retirez la calotte et inspectez soigneusement pour détecter toute anomalie (Figure 5D). Conserver dans du formol ou soumettre pour un traitement histologique plus approfondi. Si le globe est rempli d’huile de silicium (utilisée comme tamponnade) lors d’une chirurgie de décollement de la rétine, prenez soin de l’équipement car il est assez collant.
- Pour le mélanome uvéal, enlever la veine vortex ; Dans les yeux non tumoraux, cela n’est pas fait régulièrement.
- Inspecter les structures oculaires internes : chambre antérieure ; état du cristallin (phaque ou pseudophaque, aphaque, cataracte, cataracte secondaire) ; iris; corps ciliaire ; choroïde ; rétine centrale ; rétine périphérique ; nerf optique (p. ex., atrophie) ; sclérotique (peut être épaissie dans les yeux phtisiques ou amincie dans un traumatisme ou un staphylome).
- Retirez l’autre calotte pour obtenir une section PO appropriée (Figure 5E et Figure 6A) ; Placez soigneusement le globe ouvert avec l’ouverture vers le bas.
- Tenez le globe d’une main et sectionnez-le dans une direction parallèle (mais au-dessus du nerf optique et à nouveau, idéalement à travers la cornée périphérique). Le globe est moins stable une fois ouvert.
- Retirez la calotte et inspectez soigneusement pour détecter toute anomalie. Conserver dans du formol ou soumettre à un traitement histologique plus approfondi (figure 6).
- Effectuer une documentation photographique de la section PO et la soumettre pour un traitement histologique ultérieur.
4. Section d’échantillons fœtaux
REMARQUE : Il ne s’agit que d’ajustements au protocole principal décrit aux sections 1 (orientation), 2 (macroscopie) et 3 (section des échantillons de routine).
- Positionnez le globe avec la cornée vers le bas.
- Identifiez la longue artère ciliaire postérieure en comprimant doucement le globe (Figure 7).
- Disséquez le globe horizontalement près du nerf optique, en exerçant une légère pression sur la lame du microtome. Assurez-vous que la périphérie de la cornée se trouve également à l’intérieur de la section.
REMARQUE : La trisection n’est pas recommandée en raison de la petite taille du globe fœtal. - Évaluez soigneusement les structures intraoculaires et documentez-les avec une photo comme décrit à l’étape 3.6.
REMARQUE : Une attention particulière doit être portée aux structures fœtales (par exemple, vascularisation fœtale) ou aux anomalies du développement (par exemple, colobome). - Soumettez la partie principale du globe pour un traitement ultérieur.
- Archivez la calotte restante dans du formol ou soumettez-la pour un traitement ultérieur.
5. Section des échantillons médico-légaux
- Familiarisez-vous avec la question médico-légale avant de sectionner. En médecine légale, préparez-vous à analyser des parties du globe sur le plan toxicologique (vitré) ou utilisez-les pour estimer le temps écoulé depuis la mort (cornée)2,14.
- Pour un traumatisme crânien abusif (AHT), effectuez une dissection horizontale suivie d’une inspection approfondie et d’une documentation photographique des hémorragies rétiniennes et des hémorragies de la gaine du nerf optique. Effectuez une coloration au fer (par exemple, la coloration au bleu de Prusse de Perl) pour évaluer les signes d’hémorragies déjà dégradées.
REMARQUE : Un protocole plus détaillé est fourni par Gilliland et al. qui recommandent de retirer et d’analyser les yeux et leur contenu orbital15.
Il existe de nombreuses autres affections entraînant des hémorragies rétiniennes chez un nouveau-né en dehors de AHT 7,16,17,18,19,20. - Pour les questions liées à la chirurgie (par exemple, l’endophtalmie4), effectuez une dissection horizontale du globe et une évaluation comme décrit dans la section 3. Pour les yeux ayant des antécédents de trabéculectomie, effectuez une section verticale près du site de la bulle (qui peut être une entrée pour les bactéries).
- Corps étrangers : Mesurez et photographiez l’objet et son emplacement in situ ou dans l’espace vide où l’objet a été logé (les corps étrangers métalliques doivent être retirés avant d’être coupés car ils ne peuvent pas être sectionnés). Décrivez la couleur, la forme et la consistance. Conservez le corps étranger car il peut faire l’objet d’une nouvelle enquête à des fins juridiques.
6. Autres approches
REMARQUE : Une approche alternative peut être utilisée si la rétine doit être examinée avant la section 10,21,22. Cette approche est similaire aux globes donneurs où du tissu sclérocornéen a été retiré pour une banque d’yeux.
- À l’aide d’un scalpel, coupez sur la circonférence de la pars plana (figure 8A).
- Retirer le segment antérieur (cornée, bord scléral, cristallin), le couper en deux et le soumettre à une évaluation histopathologique de routine (figure 8B).
- Visualiser la rétine et l’imager de manière multimodale (avant et/ou après fixation) (Figure 8B).
- Retirez les deux calories pour un traitement de routine ultérieur. Comme le segment antérieur a déjà été enlevé, le globe restant est instable ; Par conséquent, stabilisez-le solidement d’une main tout en retirant la calotte comme décrit aux étapes 3.1-3.4.
- Évaluez soigneusement les structures intraoculaires et photographiez comme décrit à l’étape 3.6.
- Retirez la deuxième calotte comme décrit aux étapes 3.7-3.10 (Figure 8D).
REMARQUE : Pour les échantillons destinés uniquement à la recherche, d’autres approches sont possibles21.
7. Poursuite de la traitement
- Après le traitement de routine et l’incorporation de paraffine, préparez des sections d’étapes de 5 μm d’épaisseur jusqu’à ce que le nerf optique et la macula soient sur la section.
- Déterminez individuellement la distance entre les sections de marche.
REMARQUE : Cette distance entre les sections de pas est régulièrement de ~250 μm dans notre laboratoire d’anatomopathologie ophtalmique. - Préparer des sections en série pour des globes de recherche. Si des colorations immunohistochimiques sont nécessaires, montez les sections sur des lames revêtues.
Résultats
Après l’orientation, il devrait être possible de déterminer la latéralité des yeux adultes. Cependant, cela est souvent impossible pour les yeux fœtaux. La latéralité est importante pour confirmer que le bon œil a été enlevé et qu’il correspond au rapport. Les mesures avant le sectionnement sont documentées. En particulier, pour les yeux fœtaux, un nomogramme est utile pour exclure les anomalies de taille oculaire telles que la microphtalmie.
En fonction des antécédents du patient et de la transillumination, une section est prévue. Le globe est généralement sectionné horizontalement, ce qui nécessite une identification correcte du plan horizontal comme décrit ci-dessus. S’il y a des zones d’intérêt spécifiques (par exemple, un colobome, des lésions insoupçonnées identifiées lors de la transillumination ou des sites chirurgicaux tels qu’une trabéculectomie), la section est adaptée respectivement. Le résultat visé du sectionnement est une section PO appropriée (Figure 5 et Figure 6).
Un globe terrestre mal sectionné nuit à la corrélation clinicopathologique précise et à l’interprétation des résultats histologiques, ce qui peut avoir un impact sur le suivi des patients. Par exemple, l’un des diagnostics les plus menaçants à considérer est l’ophtalmie sympathique23 , une inflammation granulomateuse bilatérale et chronique de l’uvée pouvant conduire à la cécité de l’œil restant (œil compatissant). Cette entité doit être exclue dans tous les globes et, en particulier, dans les yeux aveugles et douloureux. Comme cela est essentiel pour préserver l’œil restant, des coupes représentatives du globe sont obligatoires pour l’évaluation, de préférence sous forme de coupes PO.
Dans le cas où une incision est faite par erreur à travers toute la cornée au lieu de sectionner la périphérie, soumettez la calotte avec la cornée et le segment antérieur et la section PO échouée. La deuxième calotte doit être retirée comme décrit ci-dessus pour que le globe s’insère dans la cassette. Notamment, les yeux phtisiques peuvent présenter une métaplasie osseuse de l’épithélium pigmentaire rétinien, ce qui rend presque impossible la section du globe. Détartrez le globe dans de l’acide nitrique à 5 % pendant 24 h, suivi d’une solution de sulfate de lithium ou de sodium à 5 % pendant 24 h, stockez-le dans l’eau du robinet pendant 24 à 48 h et essayez à nouveau de couper le globe. Répétez le détartrage jusqu’à ce que le globe puisse être sectionné. Enfin, une photodocumentation de chaque globe doit être effectuée. Ce n’est pas seulement pour des raisons médico-légales, mais aussi utile si des résultats histologiques inattendus se produisent.
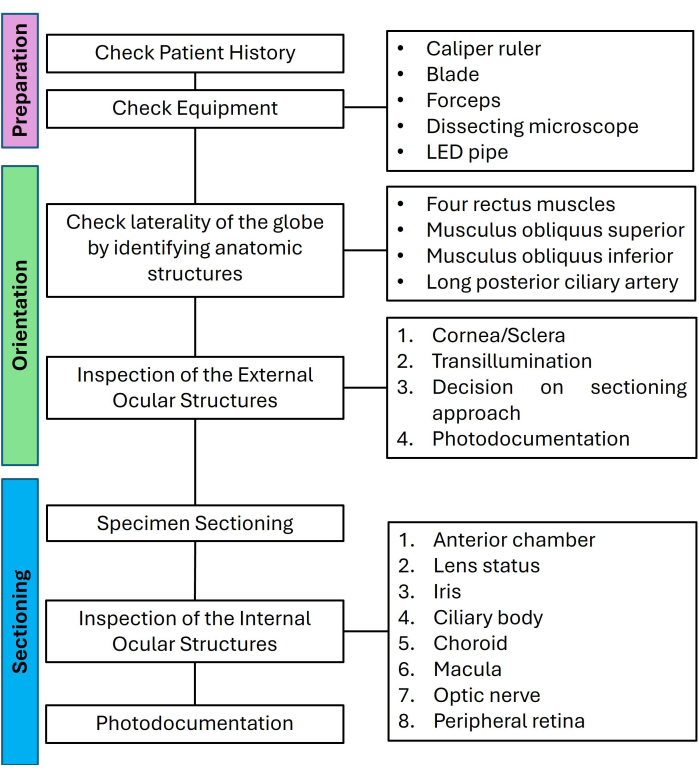
Figure 1 : Organigramme pour la préparation, l’orientation et la coupe d’yeux non tumoraux énumérant les étapes pertinentes d’une approche de type liste de contrôle. Abréviation : LED = diode électroluminescente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
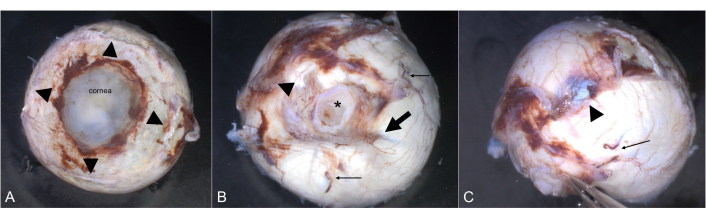
Figure 2 : Orientation. La cornée est clairement visible depuis une vue antérieure. (A) Les insertions des quatre muscles droits sont mises en évidence par des pointes de flèches. (B) Le nerf optique (astérisque) est visible depuis une vue postérieure. La longue artère ciliaire (flèche) marque le méridien horizontal. L’insertion typiquement charnue du muscle oblique inférieur (pointe de flèche) est à peu près temporale. Deux des veines du vortex sont mises en évidence par de fines flèches. (C) L’insertion tendineuse du muscle oblique supérieur (pointe de flèche) se fait de manière supérieure entre le muscle droit supérieur et le nerf optique. Une veine vortex est marquée par une fine flèche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
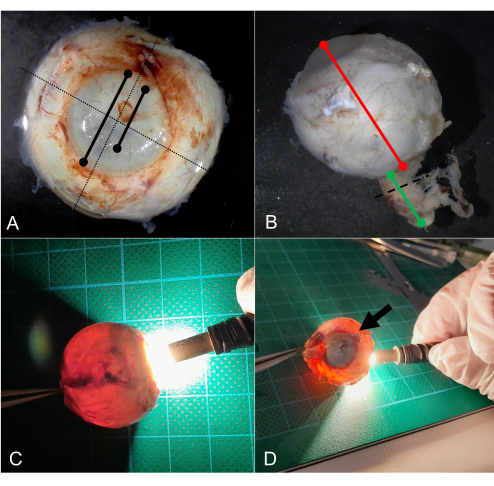
Figure 3 : Grossage. (A) Mesure du diamètre horizontal et vertical en mm (ligne pointillée). Mesure du diamètre de la cornée, et par exemple, du diamètre de la kératoplastie. (B) Mesurez le diamètre antéro-postérieur en mm (ligne rouge) et la longueur du nerf optique (ligne verte). Le nerf optique est sectionné (ligne pointillée) et soumis séparément pour un traitement ultérieur. (C) Transillumination régulière d’un globe par une lumière LED. (D) Lors de la transillumination, une ombre est observée causée par une tumeur choroïdienne (flèche). Abréviation : LED = diode électroluminescente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
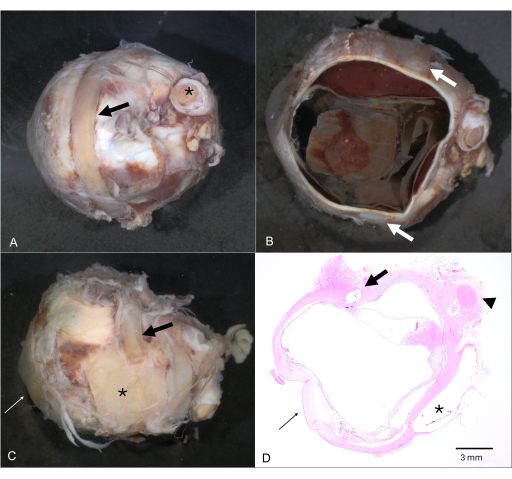
Figure 4 : Corps étranger extraoculaire. (A) Globe avec une bande/cerclage qui l’entoure (flèche ; le nerf optique est marqué d’un astérisque). (B) Après dissection horizontale, la bande qui l’entoure est toujours attachée au globe (flèches). (C) Multiples applications de corps étrangers externes pour la chirurgie historique du décollement de la rétine composée de plaques (astérisque) et de plusieurs boucles sclérales (flèche). (D) La coupe correspondante de l’hématoxyline et de l’éosine montre l’emplacement intrascléral d’une boucle (flèche) ainsi que l’image négative d’une plaque extrasclérale (astérisque). La cornée est marquée en C et D par une flèche fine et le nerf optique par une pointe de flèche en D. Veuillez cliquer ici pour voir une version agrandie de cette figure.
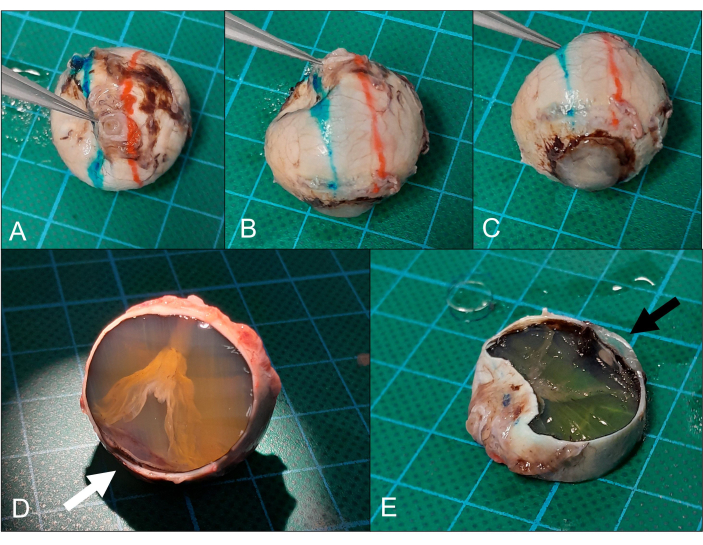
Figure 5 : Sectionnement. (A) Le globe est placé la cornée vers le bas (même œil que sur la figure 2) et (B) les plans de section supérieur (rouge) et inférieur (bleu) sont marqués. (C) Le plan de coupe traverse idéalement la zone périphérique de la cornée/limbe. (D) Après l’ablation de la calotte supérieure, un décollement de la rétine en forme d’entonnoir peut être observé. La section n’est proche que de la cornée périphérique (flèche), mais cela est également suffisant pour l’analyse. (E) L’ablation de la calotte inférieure (notez la cornée périphérique sur la section, flèche) donne la section du nerf pupille-optique prévue. Veuillez cliquer ici pour voir une version agrandie de cette figure.
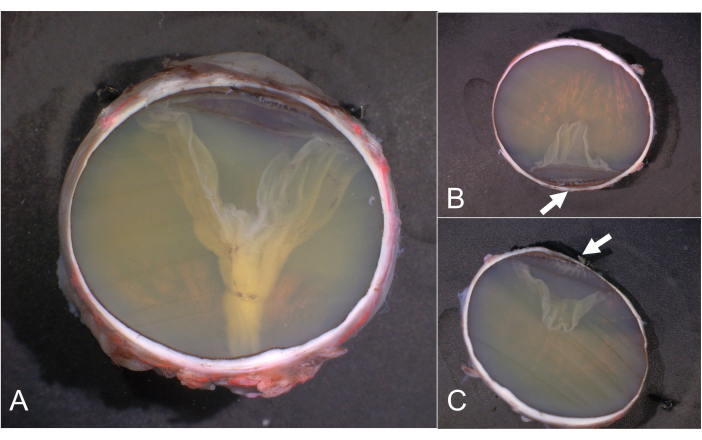
Figure 6 : Sections PO et calottes. (A) Section PO, (B) Calotte supérieure et (C) Calotte inférieure. La pars plicata du corps ciliaire est mise en évidence par des flèches en B et C. Les calories sans détails cliniquement pertinents n’ont pas besoin d’être traitées ultérieurement et sont archivées à la place. Abréviation : PO = nerf pupille-optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Yeux fœtaux et microphtalmiques. (A) Œil fœtal régulier, 21 semaines de gestation et 10 mm de diamètre AP. (B) En poussant doucement avec des pinces, on découvre la longue artère ciliaire postérieure (pointes de flèches), qui indique le méridien horizontal. (C) Après la bissection, les structures intraoculaires peuvent être inspectées, y compris l’artère hyaloïde (flèche). (D) Œil microphtalique d’un adulte. La cornée est mise en évidence par une flèche. (E) Les globes ont été coupés en deux ; La longue artère ciliaire postérieure n’a pas pu être identifiée. Abréviation : AP = antériopostérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
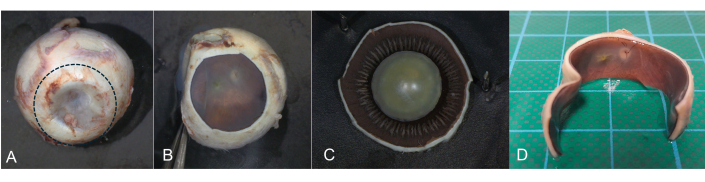
Figure 8 : Incision coronale. Une incision coronale est utile si l’imagerie post-mortem du fond d’œil est prévue. Lors de la transillumination, la pars plana du corps ciliaire peut être identifiée comme une structure circulaire en forme de bande. (A) À l’aide d’un scalpel, une incision circulaire est pratiquée dans la zone de la pars plana (ligne pointillée) et le segment antérieur est retiré. (B) La rétine et le nerf optique peuvent être documentés et imagés. (C) Le segment antérieur est ensuite examiné séparément. (D) Section horizontale avec segment antérieur enlevé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : Unité de microscope de dissection. Unité de travail avec un microscope de chirurgie ophtalmique mis au rebut. (A) Un tuyau LED (flèche) et l’équipement nécessaire au dégrossage et au sectionnement. Les matériaux nécessaires sont (B) une règle, une règle d’étrier, une pince et (C) des lames de microtome/rasoir. Pour la coupe de globes adultes, il est recommandé d’utiliser des lames de microtome (à droite) ; Pour les yeux fœtaux ou d’autres échantillons oculaires, des lames de rasoir (à gauche) suffisent. (D) Microscope de dissection avec une caméra connectée pour documenter l’échantillon. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce protocole vise à normaliser l’examen macroscopique des globes oculaires non néoplasiques. Les directives grossières dans la littérature se concentrent principalement sur les yeux avec une tumeur intraoculaire 24,25. Les protocoles de sectionnement respectifs se trouvent sur le site Web de l’American Academy of Ophthalmology26, sur divers sites Web universitaires, sur le site Web du College of American Pathologists, ainsi que dans les manuels d’ophtalmologie 7,10. Il existe également des protocoles spécifiques à des fins de recherche, par exemple, la fluorescence de la feuille de lumière pour le système vasculaire oculaire 27,28,29.
À notre connaissance, il n’existe aucune directive publiée pour le grossissement systématique des globes non tumoraux énucléés. Notamment, notre ligne directrice vise à améliorer l’évaluation des échantillons d’énucléation, qui diffère de celle des yeux tumoraux en ce que l’objectif principal de l’investigation peut ne pas être prédéterminé. De plus, les yeux non tumoraux ont généralement une longue histoire oculaire, y compris la chirurgie, avec de multiples modifications intraoculaires élucidant la physiopathologie des maladies oculaires et la cicatrisation des plaies. L’éviscération - les structures intraoculaires sont retirées tandis que la sclérotique et le nerf optique restent chez le patient - ne permet pas de localiser précisément les signes oculaires.
Dans les cas où l’énucléation est nécessaire pour des indications autres qu’une tumeur, toutes les autres options de traitement disponibles ont échoué et les patients signalent généralement un œil aveugle et douloureux en raison d’un glaucome secondaire (par exemple, à la suite d’une rétinopathie diabétique proliférative ou d’une occlusion de la veine centrale de la rétine), d’un traumatisme oculaire grave, de maladies cornéennes perforantes incontrôlées ou d’une chirurgie de décollement de la rétine frustrante (qui est devenue rare en raison de l’amélioration des techniques de chirurgie rétinienne). L’ophtalmologie étant une discipline chirurgicale hautement spécialisée, il existe de nombreuses options pour préserver la vision des patients ou au moins maintenir l’œil dans un état indolore et les raisons d’énucléation mentionnées ci-dessus sont heureusement rares. De nombreux patients subissant une énucléation ont donc des antécédents d’interventions chirurgicales multiples telles que la kératoplastie, l’abaissement de la pression ou la chirurgie rétinienne. Le suivi des antécédents du patient, qui n’est pas toujours mentionné en détail sur le formulaire de demande de pathologie, est essentiel pour décider de la section de l’œil.
Un examen complet des échantillons d’énucléation améliore les soins aux patients en comprenant mieux les affections oculaires graves qui peuvent conduire à cette intervention chirurgicale ultime. Une macroscopie adéquate améliore également la corrélation entre l’imagerie multimodale et les résultats histologiques, comme décrit par Eagle21. De plus, l’examen grossier des globes a une grande valeur éducative, car il aide les étudiants et les résidents à mieux comprendre la complexité et l’étendue de diverses maladies oculaires et les implications des interventions chirurgicales.
Pour les yeux fœtaux, l’examen standardisé permet d’établir un diagnostic morphologique précis des malformations oculaires. Avec les autres résultats obtenus lors de l’autopsie fœtale, il permet souvent une classification exacte d’un syndrome et donc un meilleur conseil génétique pour les parents concernant le risque de récidive lors des grossesses ultérieures.
Le positionnement correct de l’échantillon est une étape critique dans l’application de ce protocole. Une erreur dans cette phase de l’examen peut compromettre la description et la localisation des constatations, produisant un rapport incorrect. L’un des facteurs clés limitatifs de cette méthode est la préservation du globe. Un échantillon laissé sans formol pendant de nombreuses heures peut présenter des signes d’autolyse, ce qui peut compromettre l’évaluation histopathologique, y compris la coloration immunohistochimique1. De plus, les distorsions architecturales, que l’on trouve souvent dans les yeux phtisiques, peuvent rendre difficile le positionnement correct du globe et la réalisation d’une incision précise et symétrique. Pour surmonter cela, recherchez les structures anatomiques clés.
En conclusion, nous proposons un protocole systématique pour un examen complet des yeux énucléés, visant à améliorer les soins aux patients grâce à une plus grande précision diagnostique et à offrir des possibilités d’éducation. Notre approche se concentre sur l’identification correcte des structures anatomiques et l’orientation spatiale de l’échantillon, en assurant une évaluation et une documentation correctes des altérations pathologiques. La normalisation de l’examen macroscopique des globes non néoplasiques devrait être mise en œuvre dans les laboratoires de pathologie afin d’améliorer la pathologie ophtalmique descriptive et diagnostique à des fins cliniques et éducatives et de soutenir les études futures sur les corrélations clinicopathologiques.
Déclarations de divulgation
Martina C. Herwig-Carl est co-auteure du livre « Fetal and Neonatal Eye Pathology », Springer 2020 ; secrétaire de la Société internationale de pathologie ophtalmique (ISOP) ; Membre du comité de section « pathologie ophtalmique » au sein de la Société allemande d’ophtalmologie (DOG) ; Membre du « Comité de Programme des Rencontres Annuelles » de l’ARVO pour la section « Anatomie Anatomopathologie (AP) ». Frank G. Holz : Acucela (C, F, R), Alcon (C, F, R), Alexion, Apellis (C, R), Allergan/AbbVie company (F, R), Bayer (C, F, R), Boehringer Ingelheim (C), CenterVue (F), Ellex (R), Genentech/Roche (C, F, R), Geuder (C), Grayburg Vision (C, R), Kanghong (C, F), Heidelberg Engineering (C, F, R), Lin BioScience (C, R), NightStarX (F), Novartis (C,F,R), Optos (F), Oxurion (C,R), Pixium Vision (C,F,R), Stealth Biotherapeutics (C,R), Zeiss (F,R). Les autres auteurs n’ont aucun conflit d’intérêts à déclarer. [C : consultant ; F : soutien financier ; R : destinataire]
Remerciements
Ce travail a été soutenu par le Fonds de publication en libre accès de l’Université de Bonn.
matériels
| Name | Company | Catalog Number | Comments |
| Caliper ruler | Mauser | out of market | INOX Messchieber 0- 200 mm |
| Dissecting microscope or discarded ophthalmic surgery microscope | Möller Wedel | out of market | |
| Forceps | Fine Science | 11203-23 | SS INOX |
| HistoBond | Marienfeld, Germany | DIN ISO 8037-1 | coated slides |
| LED pipe for transillumination in a dark room | Schott, Mainz | out of market | KL150 |
| Microtome blade | Feather microtome blades | N/A | A35 type |
Références
- Torczynski, E. Preparation of ocular specimens for histopathologic examination. Ophthalmology. 88 (12), 1367-1371 (1981).
- Atreya, A., Ateriya, N., Menezes, R. G. The eye in forensic practice: In the dead. Med Leg J. , (2024).
- Herwig-Carl, M. C., Holz, F. G., Löffler, K. U. Die Geschichte eines Auges – Untersuchung enukleierter Bulbi. Der Ophthalmologe. 117 (12), 1171-1179 (2020).
- Herwig-Carl, M. C., Holz, F., Löffler, K. U. Endophthalmitis aus ophthalmopathologischer Sicht. Klin Monbl Augenheilkd. 239 (7), 867-875 (2022).
- Herwig-Carl, M. C., Loeffler, K. U., Müller, A. M. Bedeutung der Untersuchung fetaler Augen : Ergänzung der Fetobduktion. Pathologe. 38 (4), 231-240 (2017).
- Herwig, M. C., Müller, A. M., Holz, F. G., Loeffler, K. U. Analyse eines ophthalmopathologischen Kollektivs humaner fetaler Augen unter besonderer Berücksichtigung außergewöhnlicher Befunde. Der Ophthalmologe. 107 (11), 1051-1058 (2010).
- Verdijk, R. M., Herwig-Carl, M. C. . Fetal and Neonatal Eye Pathology. , (2020).
- Breazzano, M. P., Unkrich, K. H., Barker-Griffith, A. E. Clinicopathological findings in abusive head trauma: analysis of 110 infant autopsy eyes. Am J Ophthalmol. 158 (6), 1146-1154.e2 (2014).
- Watts, P., et al. Abusive head trauma and the eye in infants and children - clinical guideline update by the royal college of ophthalmologists and the royal college of paediatrics and child health: executive summary. Eye (Lond). 38 (10), 1783-1786 (2024).
- Spencer, W. H. . Ophthalmic pathology: An atlas and textbook. , (1985).
- Khoshakhlagh, A. H., Mohammadzadeh, M., Sicard, P., Bamel, U. Human exposure to formaldehyde and health risk assessment: a 46-year systematic literature review. Environ Geochem Health. 46 (6), 206 (2024).
- Protano, C., et al. The carcinogenic effects of formaldehyde occupational exposure: A systematic review. Cancers. 14 (1), 165 (2021).
- Duong, A., Steinmaus, C., McHale, C. M., Vaughan, C. P., Zhang, L. Reproductive and developmental toxicity of formaldehyde: a systematic review. Mutat Res. 728 (3), 118-138 (2011).
- Ang, J. L., Collis, S., Dhillon, B., Cackett, P. The eye in forensic medicine: A narrative review. Asia Pac J Ophthalmol (Phila). 10 (5), 486-494 (2021).
- Gilliland, M. G. F., et al. Guidelines for postmortem protocol for ocular investigation of sudden unexplained infant death and suspected physical child abuse. Am J Forensic Med Pathol. 28 (4), 323-329 (2007).
- Bhardwaj, G., et al. A systematic review of the diagnostic accuracy of ocular signs in pediatric abusive head trauma. Ophthalmology. 117 (5), 983-992.e17 (2010).
- Herwig, M. C., Müller, A. M., Kuchelmeister, K., Loeffler, K. U. Pre- and intraretinal haemorrhages in a 22-week-old fetus of a mother suffering from HELLP syndrome and factor V Leiden mutation with deep vein thrombosis. Acta. 95 (1), e83-e84 (2017).
- Thau, A., et al. Retinal hemorrhage and bleeding disorders in children: A review. Child abuse Negl. 112, 104901 (2021).
- Mattheij, M., et al. Retinal haemorrhages in a university hospital: not always abusive head injury. Acta Neurol Belg. 117 (2), 515-522 (2017).
- Maguire, S. A., et al. Retinal haemorrhages and related findings in abusive and non-abusive head trauma: a systematic review. Eye (London). 27 (1), 28-36 (2013).
- Eagle, R. C. Optical coherence tomography: Clinicopathologic correlations - The 2016 Gordon K. Klintworth lecture. Ocul Oncol Pathol. 4 (4), 203-212 (2018).
- Stockinger, P., et al. Vergleichende In-vivo-/Ex-vivo-Bildgebung des hinteren Augenabschnitts - Version. Der Ophthalmologe. 118 (Suppl 2), 153-159 (2021).
- Agarwal, M., et al. Sympathetic ophthalmia - An Overview. Ocul Immunol Inflamm. 31 (4), 793-809 (2023).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with uveal melanoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1177-1182 (2001).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with retinoblastoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1183-1188 (2001).
- . American Academy of Ophthalmology (AAO) Available from: https://www.aao.org/education/image/gross-dissection-of-globe (2025)
- Lu, W., et al. Corrigendum to 'Recent progress in optical clearing of eye tissues' Exp. Eye Res (Nov; 2021) 212 108796. Exp Eye Res. 214, 108896 (2022).
- Lu, W., et al. Recent progress in optical clearing of eye tissues. Exp Eye Res. 212, 108796 (2021).
- Darche, M., et al. Three-dimensional characterization of developing and adult ocular vasculature in mice using in toto clearing. Commun Biol. 5 (1), 1135 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon