É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese de grânulos de pH carregados com óleo de semente preta, à base de alginato e sensíveis ao pH usando a técnica de eletropulverização
Neste Artigo
Resumo
É apresentada uma técnica que emprega alta tensão elétrica e uma emulsão direcionada e carregada de ingredientes ativos para fabricar microesferas uniformes e responsivas ao pH.
Resumo
O óleo de semente preta (BSO), derivado das sementes da planta Nigella sativa , chamou a atenção por suas potenciais propriedades anticancerígenas, particularmente no contexto do câncer de cólon. Seu composto ativo, a timoquinona, pode ajudar a inibir o crescimento de células cancerígenas e induzir a apoptose em células cancerígenas de cólon. Além disso, os efeitos anti-inflamatórios e antioxidantes do óleo de semente preta podem contribuir para um ambiente intestinal mais saudável, reduzindo potencialmente o risco de câncer. Portanto, este estudo sintetizou grânulos de alginato sensíveis ao pH para fornecer BSO no cólon de maneira controlada sem liberar o medicamento em pH 1,2 (estômago), fornecendo assim um padrão de liberação bem definido em pH 6,8. O uso da tecnologia de eletrospray melhora o desempenho do processo, facilitando a formulação de esferas pequenas e homogêneas com maior taxa de inchaço e difusão no meio gastrointestinal.
Os grânulos formulados foram caracterizados por um teste de força mucoadesiva ex-vivo , tamanho do grânulo, fator de esfericidade (SF), eficiência de encapsulação (EE), microscópio eletrônico de varredura (MEV), comportamento de inchamento in vitro (SB) e liberação in vitro do fármaco em meio ácido e tampão. Todos esses grânulos fabricados demonstraram tamanhos modestos de 0,58 ± 0,01 mm e formato esférico de 0,03 ± 0,00 mm neste teste. A formulação apresentou propriedades promissoras de flutuação e liberação in vitro. Com uma porcentagem cumulativa muito baixa de grânulos, o EE de óleo de 90,13% ± 0,93% foi alto, e o estudo de liberação demonstrou mais de 90% em pH 6,8 com boa natureza flutuante no estômago. Além disso, as contas foram espaçadas uniformemente em todo o intestino. A abordagem de eletropulverização usada neste protocolo pode ser reprodutível, produzindo resultados consistentes. Portanto, este protocolo pode ser usado para produção em larga escala para fins de comercialização.
Introdução
A semente preta, e mais especialmente a BSO, tem sido usada há séculos para curar uma ampla gama de doenças devido às suas propriedades medicinais bem estabelecidas. A timoquinona é talvez um dos fitoquímicos mais importantes encontrados no BSO1. Nos últimos anos, os pesquisadores estudaram os potenciais benefícios terapêuticos da timoquinona in vivo e in vitro, produzindo evidências empíricas para apoiar o uso de BSO. Propriedades anti-hipertensivas, antibacterianas, anti-histamínicas, antifúngicas, analgésicas, antidiabéticas, hipolipemiantes e anti-inflamatórias foram demonstradas por esses estudos para BSO, que podem ser usadas para tratar sintomas como eczema, hipertensão, asma, tosse, dor de cabeça, gripe, febre, anticâncer, tontura e atividade 2,3.
A aplicação de coberturas relativamente finas em pequenas gotículas de líquidos e dispersões, ou partículas de material sólido, é conhecida como microencapsulação. Quando se trata de óleo, o óleo microencapsulado geralmente é bastante valioso porque algumas formas de óleo, como o BSO, são consideradas alimentos nutritivos e oferecem vantagens medicinais4. No entanto, a adição de óleos diretamente à matriz do alimento pode levar à volatilização, o que pode fazer com que as atividades desapareçam rapidamente como resultado da exposição ao oxigênio e à luz ultravioleta5. Além disso, a falta de controle sobre a taxa de liberação dos óleos resulta em um efeito imediato e transitório. Criar um revestimento polimérico ao redor do óleo essencial por microencapsulação ou microesferificação é um método para superar essas desvantagens6.
As microcápsulas, também conhecidas como microesferas, protegem os óleos de condições ambientais prejudiciais7. Esse processo tem sido amplamente utilizado para aumentar a eficácia do medicamento, preservar o conteúdo do medicamento, permitir comprimidos de liberação prolongada, melhorar o mascaramento do sabor, reduzir a perda de sabor durante a vida útil do produto, prolongar a sensação na boca e separar ingredientes incompatíveis em uma única dosagem8. A microencapsulação também ajuda a manter a absorção metabólica, controlar a taxa de liberação de óleo e manter as concentrações apropriadas para produzir o resultado pretendido em um determinado local9.
O encapsulamento eletro-hidrodinâmico é um método simples e adaptável. A substância ativa está alojada no núcleo interno de uma microcápsula, que é composta por um invólucro externo. Nesse sentido, apresenta uma matriz bastante forte para garantir que o componente ativo possa ser disseminado de forma mais eficaz do que um núcleo claramente definido. Antes da esfericiclação, a substância ativa e a solução polimérica devem ser combinadas para produzir as microesferas9. Por outro lado, como o óleo é volátil, microencapsulá-lo pode ser extremamente difícil e requer um controle cuidadoso da temperatura.
Existem vários métodos para encapsular óleos. Por exemplo, certos óleos precisam ser encapsulados em baixas temperaturas para evitar a quebra ou volatilização de seus componentes bioativos. Para criar estruturas de tamanho micro e nanométrico, a atomização eletrohidrodinâmica (EHDA) tem sido extensivamente estudada por pesquisadores10. Nesse sentido, as condições de processamento, que incluem vazão, tensão aplicada e tamanho do bico, bem como as propriedades de distância de coleta da solução polimérica, são os dois principais fatores que devem ser levados em consideração para produzir o tamanho de partícula ou morfologia desejado11,12.
Nesta investigação, alginatos - um tipo de polissacarídeos naturais adequados para ingestão oral - foram usados para encapsular o BSO. As algas marrons contêm alginato, um polímero aniônico que ocorre naturalmente. É composto por duas estruturas monoméricas: ácido α-L-gulurônico (G) e ácido 1-4βD-manurônico (M)13. Seu polímero não é tóxico14, possui alto grau de biocompatibilidade, é barato e se degrada efetivamente15. É, portanto, frequentemente empregado nos setores de biotecnologia e engenharia.
Os alginatos são o material de escolha para encapsulamento por gelificação iônica porque podem criar uma estrutura reticulada entre os grupos G de várias cadeias de alginato, formando conexões iônicas com cátions divalentes como íons Sr2+, Ca2+ ou Zn2+. O processo de gelificação pode ser adequadamente caracterizado pelo modelo de caixa de ovo, que limita o cátion divalente a dois grupos carboxila nas moléculas de alginato lado a lado. Tem sido sugerido que as características do hidrogel dos grânulos de alginato de sódio podem regular a liberação de macromoléculas e pequenas moléculas. As esferas de alginato de sódio podem aderir à mucosa intestinal por um longo período de tempo devido às suas qualidades mucoadesivas. Além disso, o alginato oferece um escudo que pode proteger os óleos de elementos externos, como meios ácidos16 e transfere óleos para os canais de entrega do trato gastrointestinal17. Desde então, tem sido empregado em pesquisas para auxiliar na administração sítio-específica de medicamentos aos tecidos da mucosa 18,19.
A abordagem eletro-hidrodinâmica foi usada neste estudo para investigar a viabilidade de emulsionar óleos comerciais para criar cápsulas20. Aqui, a abordagem eletro-hidrodinâmica foi usada para gerar e analisar microesferas carregadas de alginato-BSO20. Este estudo avaliou uma série de outros fatores, incluindo as propriedades SF, ex-vivo, mucoadesivas das microesferas, EE%, aparência física, distribuição de tamanho e potencial zeta; a espectroscopia de infravermelho com transformada de Fourier total atenuada (ATR-FTIR) foi utilizada para testar a compatibilidade química20.
Protocolo
1. Preparação da emulsão de alginato-BSO
- Disperse 10% p/v de BSO em solução de alginato de sódio a 1% p/v contendo 1, 3 e 5% p/v de lecitina em um béquer de 50 mL.
- Obtenha uma nanoemulsão usando um homogeneizador ultrassônico. Defina o nível de potência para 20%. Execute o homogeneizador por 55 s clicando no botão Iniciar para concluir o processo.
2. Caracterização da emulsão alginato-BSO
- Analise o potencial zeta e a distribuição do tamanho das partículas
- Pegue 0,1 mL da emulsão recém-preparada em um copo de vidro de 25 mL e dilua com 9,9 mL de água destilada.
- Pegue 2,5 mL desta solução diluída em uma cubeta de quartzo de 3 mL e coloque a cubeta em uma câmara de medição.
- Abra a tampa e coloque a cubeta dentro do dispositivo, certificando-se de que a cubeta esteja orientada corretamente em relação ao caminho do feixe de luz. Clique no ícone de medição .
- Retire a cubeta. Recupere a amostra ou descarte-a adequadamente.
- Salve os dados como um arquivo pdf em uma pasta pessoal para uso posterior.
- Determinar a estabilidade da emulsão (ES)
- Tome 5 mL de emulsão recém-preparada em tubos de centrífuga de 10 mL. Centrifugar as emulsões (n = 3) durante 5 min a 894 × g.
- Utilizando a equação (1), determinar o ES com base na posição da interface de separação de fases.
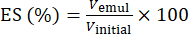 Características (1)
Características (1)
Onde Vemul é o volume de emulsão restante após centrifugação e Vinicial é o volume de emulsão inicial.
- Preparação do grânulo
- Grânulos de alginato BSO
- Prepare grânulos de alginato BSO usando a técnica de eletrospray chamada EHDA. Empregue uma emulsão BSO peso por volume (p / v) composta de 10% de BSO, 1% de alginato de sódio e 3% de solução de lecitina).
- Usando uma bomba de seringa para regular a taxa de fluxo, coloque a emulsão em uma seringa de plástico de 10 mL e empurre-a através de uma agulha de 22 G. Conecte a ponta da agulha ao eletrodo positivo de um alto voltage fonte de alimentação.
- Como coletor, use um béquer aterrado com 50 mL de cloreto de cálcio a 1% (banho de gelificação). Alterne a vazão de gotejamento entre 1 mL/min e 3 mL/min em tensões de 3, 5 e 7 kV, mantendo uma distância de 10 cm acima da superfície da solução de cloreto de cálcio.
- Para confirmar a gelificação completa, deixe as esferas no banho de gelificação por 30 min enquanto as agita. Use um filtro de aço inoxidável para remover as esferas do banho de gelificação e lave as contas reunidas com água destilada ultrapura.
- Deixe as contas secarem por 16 h em temperatura ambiente em uma bancada de laboratório. Use a Equação (2) para calcular o rendimento percentual dos grânulos.
 (2)
(2)
- Grânulos de alginato sem BSO
- Prepare uma solução a 1% p/v de alginato de sódio. Adicione lecitina em concentrações de 1%, 3% e 5% p / v à solução. Misture bem a solução até que a lecitina esteja completamente dissolvida.
- Utilizar a solução do passo 2.3.2.1 para preparar grânulos de alginato isentos de BSO, conforme descrito nos passos 2.3.1.2-2.3.1.5. Calcule o rendimento usando a equação (2).
- Grânulos de alginato BSO
3. Caracterização do grânulo
- Determinação do tamanho e da forma
- Para verificar o tamanho e a forma das contas, use um analisador de imagem. Tire fotos usando uma câmera digital das contas molhadas e secas.
- Em seguida, meça o diâmetro do cordão usando a barra de escala pré-instalada do instrumento. Usando os valores de diâmetro, calcule o SF a partir dos valores de diâmetro obtidos usando a equação (3):
SF =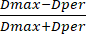 (3)
(3)
Onde Dmax representa o maior diâmetro que passa pelo centro de um cordão (em mm), enquanto Dper se refere ao diâmetro que é perpendicular a Dmax e passa pelo centro do cordão (em mm).
NOTA: Um SF de zero denota um grânulo idealmente esférico, com valores crescentes de SF significando maior desvio de uma forma esférica. Além disso, as contas são consideradas esféricas se seu SF for 0,05 ou inferior.
4. Determinação da EE%
- Desintegre as esferas em solução salina tamponada com fosfato (PBS) para devolvê-las à emulsão. Medir a absorvância da emulsão resultante a 600 nm com um espectrofotómetro UV-vis.
- Use o valor de absorbância para representar a turbidez da emulsão. Crie uma curva padrão usando uma quantidade conhecida de BSO na emulsão.
- Calcule o EE% usando a equação (4):
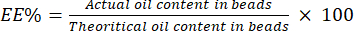 Eletrônicos (4)
Eletrônicos (4)
5. Microscopia eletrônica de varredura (SEM)
NOTA: Use SEM para observar a microestrutura e a morfologia da superfície dos grânulos de alginato BSO.
- Para inspecionar o interior das contas secas, corte algumas delas. Identifique as contas cortadas em tocos de alumínio e cole-as usando fitas adesivas de carbono.
- Revestir os grânulos com um módulo de pulverização catódica de carbono em um evaporador a vácuo em uma atmosfera de argônio. Aplique uma espessura de 100 Å e 50 Å para o revestimento de carbono.
- Adquira imagens dos grânulos revestidos em alto vácuo com um acelerador de tensão entre 10 kV e 15 kV.
6. Determinar a interação medicamento-excipiente usando ATR-FTIR
- Defina os números de onda do instrumento entre 4.000 cm−1 e 400 cm−1 usando o ar ambiente como plano de fundo e uma resolução de 1 cm−1. Consulte o Arquivo Suplementar 1.
- Registre espectros de BSO, alginato de sódio, lecitina, cloreto de cálcio, grânulos livres de BSO, grânulos de alginato-BSO e mistura física de ingrediente ativo e excipientes (alginato de sódio, lecitina, cloreto de cálcio e BSO) separadamente.
- Colocar a amostra (5-10 mg) na área de amostragem. Ajuste 20 varreduras, resolução 4, força manométrica 80, braço de pressão com ponta plana. Verifique se o Incremento automático permanece definido como a opção Em branco para que o espectro seja armazenado automaticamente na pasta desejada.
- Para iniciar a medição da amostra, clique no botão [Amostra]. Depois de selecionar [Amostra], como não há período de espera, certifique-se de ter a amostra pronta e a pinça de pressão reduzida. Analise todas as amostras individualmente. Analise individualmente todos os espectros registrados usando software de espectroscopia.
7. Calorimetria exploratória diferencial (DSC)
NOTA: As propriedades térmicas e a compatibilidade dos grânulos carregados com BSO foram investigadas usando DSC (Arquivo Suplementar 1).
- Sele grânulos pesando ~ 3,20 mg em uma panela de alumínio comum. Aquecer as amostras a uma taxa de 10 °C/min enquanto são analisadas a uma faixa de temperatura de 50-350 °C sob uma corrente de nitrogênio fluindo a uma taxa de 20 L/min.
8. Características de inchaço dos grânulos
- Prepare 100 mg de grânulos secos de alginato-BSO.
- Prepare o fluido intestinal simulado (SIF) e o fluido gástrico simulado (SGF) em um recipiente de mistura limpo e seco de tamanho adequado - 6 L, 10 L ou 25 L. Adicione água purificada a aproximadamente 33% do volume necessário - 2 L, 3 L ou 8 L e transfira o conteúdo do frasco de concentrado para o recipiente. Enxágue a garrafa com água purificada e adicione os enxágues e a água purificada ao recipiente de mistura para obter o volume necessário; Homogeneizar. Meça o pH e proceda se estiver dentro da especificação; ajuste o pH, se necessário.
- Mergulhe as esferas em 50 mL de meio contendo fluido intestinal simulado (SIF) e fluido gástrico simulado (SGF). Manter as condições durante 2 h a 37 ± 0,5 °C.
- Remova os grânulos inflados e filtre-os através de uma malha de metal em intervalos predefinidos de 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 e 120 min ou mais. Use uma toalha de papel para remover o fluido extra das contas inchadas.
- Meça o peso das contas limpas usando uma balança analítica eletrônica. Determine a porcentagem do índice de inchaço (%SI) usando a equação (5):
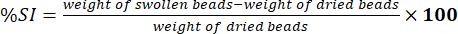 Acessórios (5)
Acessórios (5)
Resultados
Preparação de microesferas de alginato carregadas com BSO
A Figura 1 representa a configuração experimental para preparar microesferas de alginato carregadas com BSO. A quantidade de lecitina utilizada teve um impacto considerável na estabilidade da emulsão BSO. As emulsões feitas com todas as três concentrações de lecitina foram comparativamente estáveis. O método de centrifugação (894 × g, 5 min) foi utilizado n...
Discussão
Usando o processo EHDA, microesferas de alginato carregadas com BSO foram criadas como um transportador sensível ao pH. A rede de grânulos exibiu inchaço dependente de pH e comportamento de liberação de drogas devido à presença abundante de grupos de ácido carboxílico. A forte ligação de hidrogênio intermolecular entre as cadeias poliméricas foi revelada como a razão por trás da diminuição do caráter de inchaço dos grânulos carregados com BSO em pH 1,2. Grânulos carr...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este estudo foi apoiado pelo Projeto de Apoio aos Pesquisadores da Universidade Princesa Nourah bint Abdulrahman número (PNURSP2024R30), Universidade Princesa Nourah bint Abdulrahman, Riad, Arábia Saudita. Esta pesquisa foi financiada pelo número do Projeto de Apoio aos Pesquisadores (RSPD2024R811), Universidade King Saud, Riad, Arábia Saudita.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Referências
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados