Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse de billes sensibles au pH à base d’huile de nigelle et à base d’alginate à l’aide d’une technique d’électropulvérisation
Dans cet article
Résumé
Une technique utilisant une tension électrique élevée et une émulsion ciblée chargée en matière active pour fabriquer des microbilles uniformes et sensibles au pH est présentée.
Résumé
L’huile de nigelle (BSO), dérivée des graines de la plante Nigella sativa , a attiré l’attention pour ses propriétés anticancéreuses potentielles, en particulier dans le contexte du cancer du côlon. Son composé actif, la thymoquinone, peut aider à inhiber la croissance des cellules cancéreuses et à induire l’apoptose dans les cellules cancéreuses du côlon. De plus, les effets anti-inflammatoires et antioxydants de l’huile de nigelle pourraient contribuer à un environnement intestinal plus sain, réduisant potentiellement le risque de cancer. Par conséquent, cette étude a synthétisé des billes d’alginate sensibles au pH pour libérer du BSO dans le côlon de manière contrôlée sans libérer le médicament à un pH de 1,2 (estomac), fournissant ainsi un modèle de libération bien défini à un pH de 6,8. L’utilisation de la technologie d’électropulvérisation améliore les performances du processus en facilitant la formulation de petites billes homogènes avec un taux de gonflement et de diffusion plus élevé dans le milieu gastro-intestinal.
Les billes formulées ont été caractérisées par un test de force mucoadhésive ex-vivo , la taille de la bille, le facteur de sphéricité (SF), l’efficacité d’encapsulation (EE), le microscope électronique à balayage (MEB), le comportement de gonflement in vitro (SB) et la libération in vitro de médicament dans des milieux acides et tampons. Toutes ces billes fabriquées ont montré des tailles modestes de 0,58 ± 0,01 mm et une forme sphérique de 0,03 ± 0,00 mm lors de ces tests. La formulation a montré des propriétés prometteuses de flottaison et de libération in vitro. Avec un très faible pourcentage cumulatif de billes, l’EE de l’huile de 90,13 % ± 0,93 % était élevé, et l’étude de libération a montré plus de 90 % à un pH de 6,8 avec une bonne nature flottante dans l’estomac. De plus, les billes étaient uniformément espacées dans tout l’intestin. L’approche d’électropulvérisation utilisée dans ce protocole peut être reproductible, ce qui donne des résultats cohérents. Par conséquent, ce protocole peut être utilisé pour la production à grande échelle à des fins de commercialisation.
Introduction
La graine noire, et plus particulièrement le BSO, est utilisée depuis des siècles pour guérir un large éventail de maladies en raison de ses propriétés médicinales bien établies. La thymoquinone est peut-être l’un des composés phytochimiques les plus importants trouvés dans BSO1. Au cours des dernières années, les chercheurs ont étudié les avantages thérapeutiques potentiels de la thymoquinone in vivo et in vitro, produisant des preuves empiriques à l’appui de l’utilisation du BSO. Des propriétés antihypertenseurs, antibactériennes, antihistaminiques, antifongiques, analgésiques, antidiabétiques, hypolipidémiantes et anti-inflammatoires ont toutes été démontrées par ces études pour le BSO, qui peut être utilisé pour traiter des symptômes tels que l’eczéma, l’hypertension artérielle, l’asthme, la toux, les maux de tête, la grippe, la fièvre, l’anticancer, les étourdissements et l’activité 2,3.
L’application de revêtements relativement minces sur de petites gouttelettes de liquides et de dispersions, ou des particules de matériau solide, est connue sous le nom de microencapsulation. En ce qui concerne l’huile, l’huile microencapsulée est généralement très précieuse car certaines formes d’huile, comme le BSO, sont considérées comme des aliments nutritifs et offrent des avantages médicinaux4. Cependant, l’ajout d’huiles directement sur la matrice de l’aliment peut entraîner une volatilisation, ce qui peut rapidement faire disparaître les activités à la suite de l’exposition à l’oxygène et à la lumière UV5. De plus, le manque de contrôle sur le taux de libération des huiles entraîne un effet immédiat et transitoire. La création d’un enrobage polymère autour de l’huile essentielle par microencapsulation ou microsphérification est une méthode pour surmonter ces inconvénients6.
Les microcapsules, également appelées microsphères, protègent les huiles des conditions environnementales nocives7. Ce processus a été largement utilisé pour augmenter l’efficacité des médicaments, préserver le contenu des médicaments, permettre l’utilisation de comprimés à libération prolongée, améliorer le masquage du goût, réduire la perte de saveur pendant la durée de conservation du produit, prolonger la sensation en bouche et séparer les ingrédients incompatibles en une seule dose8. La microencapsulation aide également à maintenir l’absorption métabolique, à contrôler le taux de libération d’huile et à maintenir les concentrations appropriées pour donner le résultat escompté à un endroit particulier9.
L’encapsulation électro-hydrodynamique est une méthode simple et adaptable. La substance active est logée dans le noyau interne d’une microcapsule, qui est composée d’une coquille externe. À cet égard, il présente une matrice assez solide pour garantir que le composant actif peut être disséminé plus efficacement plutôt qu’un noyau clairement défini. Avant la sphéricyclation, la substance active et la solution polymère doivent être combinées pour produire les microsphères9. D’autre part, comme l’huile est volatile, sa microencapsulation peut être extrêmement difficile et nécessite un contrôle minutieux de la température.
Il existe différentes méthodes d’encapsulation des huiles. Par exemple, certaines huiles doivent être encapsulées à basse température pour éviter la décomposition ou la volatilisation de leurs composants bioactifs. Pour créer des structures de taille micro et nanométrique, l’atomisation électrohydrodynamique (EHDA) a été largement étudiée par les chercheurs10. En ce sens, les conditions de traitement, qui comprennent le débit, la tension appliquée et la taille de la buse, ainsi que les propriétés de distance de collecte de la solution polymère, sont les deux principaux facteurs qui doivent être pris en compte pour produire la taille ou la morphologie de particule souhaitée11,12.
Dans cette étude, des alginates - un type de polysaccharides naturels adaptés à l’ingestion orale - ont été utilisés pour encapsuler le BSO. Les algues brunes contiennent de l’alginate, un polymère anionique qui se produit naturellement. Il est constitué de deux structures monomères : l’acide α-L-guluronique (G) et l’acide 1-4βD-mannuronique (M)13. Son polymère est non toxique14, a un haut degré de biocompatibilité, est peu coûteux et se dégrade efficacement15. Il est donc fréquemment utilisé dans les secteurs de la biotechnologie et de l’ingénierie.
Les alginates sont le matériau de choix pour l’encapsulation par gélification ionique, car ils peuvent créer une structure réticulée entre les groupes G de diverses chaînes d’alginates en formant des connexions ioniques avec des cations divalents comme les ions Sr2+, Ca2+ ou Zn2+. Le processus de gélification peut être caractérisé de manière adéquate par le modèle de la boîte à œufs, qui limite le cation divalent à deux groupes carboxyle sur les molécules d’alginate côte à côte. Il a été suggéré que les caractéristiques hydrogel des billes d’alginate de sodium peuvent réguler la libération de macromolécules et de petites molécules. Les billes d’alginate de sodium peuvent s’accrocher à la muqueuse intestinale pendant une longue période en raison de leurs qualités muco-adhésives. De plus, l’alginate offre un bouclier qui peut protéger les huiles des éléments externes tels que les milieux acides16 et transfère les huiles dans les canaux d’administration du tractus gastro-intestinal17. Il a depuis été utilisé dans la recherche pour aider à l’administration spécifique de médicaments aux tissus de la muqueuse 18,19.
L’approche électro-hydrodynamique a été utilisée dans cette étude pour étudier la viabilité de l’émulsification des huiles commerciales pour créer des capsules20. Ici, l’approche électro-hydrodynamique a été utilisée pour générer et analyser des microsphères chargées d’alginate-BSO20. Cette étude a évalué un certain nombre d’autres facteurs, notamment les propriétés SF, ex-vivo, muco-adhésives des microsphères, l’EE %, l’apparence physique, la distribution de la taille et le potentiel zêta ; la spectroscopie infrarouge à transformée de Fourier à réflectance totale atténuée (ATR-FTIR) a été utilisée pour tester la compatibilité chimique20.
Protocole
1. Préparation de l’émulsion alginate-BSO
- Disperser 10 % p/v de BSO dans une solution d’alginate de sodium à 1 % p/v contenant 1, 3 et 5 % p/v de lécithine dans un bécher de 50 ml.
- Obtenir une nano-émulsion à l’aide d’un homogénéisateur à ultrasons. Réglez le niveau de puissance sur 20 %. Faites fonctionner l’homogénéisateur pendant 55 s en cliquant sur le bouton de démarrage pour terminer le processus.
2. Caractérisation de l’émulsion alginate-BSO
- Analysez le potentiel zêta et la distribution granulométrique
- Prenez 0,1 ml de l’émulsion fraîchement préparée dans un bécher en verre de 25 ml et diluez-le avec 9,9 ml d’eau distillée.
- Prenez 2,5 ml de cette solution diluée dans une cuvette à quartz de 3 ml et placez la cuvette dans une chambre de mesure.
- Ouvrez le couvercle et placez la cuvette à l’intérieur de l’appareil, en vous assurant que la cuvette est correctement orientée par rapport à la trajectoire du faisceau lumineux. Cliquez sur l’icône de mesure .
- Sortez la cuvette. Récupérez l’échantillon ou éliminez-le correctement.
- Enregistrez les données sous forme de fichier pdf dans un dossier personnel pour une utilisation ultérieure.
- Déterminer la stabilité de l’émulsion (ES)
- Prendre 5 mL d’émulsion fraîchement préparée dans des tubes à centrifuger de 10 mL. Centrifuger les émulsions (n = 3) pendant 5 min à 894 × g.
- À l’aide de l’équation (1), déterminez l’ES en fonction de la position de l’interface de séparation de phase.
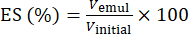 (1)
(1)
Où Vemul est le volume d’émulsion restante après centrifugation et Vinitial est le volume d’émulsion initiale.
- Préparation des billes
- Perles d’alginate BSO
- Préparez des billes d’alginate BSO en utilisant la technique d’électronébulisation appelée EHDA. Utiliser une émulsion de BSO en poids par volume (p/v) composée de 10 % de BSO, de 1 % d’alginate de sodium et de 3 % de lécithine.
- À l’aide d’une pompe à seringue pour réguler le débit, chargez l’émulsion dans une seringue en plastique de 10 ml et poussez-la à travers une aiguille de 22 G. Fixez la pointe de l’aiguille à l’électrode positive d’une alimentation haute tension.
- Comme collecteur, utilisez un bécher mis à la terre contenant 50 ml de chlorure de calcium à 1 % p/p (bain gélifiant). Alterner le débit d’égouttement entre 1 mL/min et 3 mL/min à des tensions de 3, 5 et 7 kV tout en maintenant une distance de 10 cm au-dessus de la surface de la solution de chlorure de calcium.
- Pour confirmer la gélification complète, laissez les billes dans le bain gélifiant pendant 30 min en les agitant. Utilisez un filtre en acier inoxydable pour retirer les billes du bain gélifiant et lavez les billes rassemblées avec de l’eau distillée ultra-pure.
- Laissez sécher les billes pendant 16 h à température ambiante sur une paillasse de laboratoire. Utilisez l’équation (2) pour calculer le rendement en pourcentage des billes.
 (2)
(2)
- Billes d’alginate sans BSO
- Préparez une solution à 1 % p/v d’alginate de sodium. Ajouter de la lécithine à des concentrations de 1 %, 3 % et 5 % p/v à la solution. Mélangez soigneusement la solution jusqu’à ce que la lécithine soit complètement dissoute.
- Utilisez la solution de l’étape 2.3.2.1 pour préparer des billes d’alginate sans BSO comme décrit aux étapes 2.3.1.2 à 2.3.1.5. Calculez le rendement à l’aide de l’équation (2).
- Perles d’alginate BSO
3. Caractérisation des billes
- Détermination de la taille et de la forme
- Pour déterminer la taille et la forme des billes, utilisez un analyseur d’images. Prenez des photos à l’aide d’un appareil photo numérique des perles humides et séchées.
- Ensuite, mesurez le diamètre de la perle à l’aide de la barre d’échelle préinstallée de l’instrument. À l’aide des valeurs de diamètre, calculer le FS à partir des valeurs de diamètre obtenues à l’aide de l’équation (3) :
SF =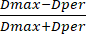 (3)
(3)
Où Dmax représente le plus grand diamètre qui passe par le centre d’une perle (en mm), tandis que Dper fait référence au diamètre qui est perpendiculaire à Dmax et passe par le centre de la perle (en mm).
REMARQUE : Un SF de zéro indique une perle idéalement sphérique, avec des valeurs SF croissantes signifiant un écart plus important par rapport à une forme sphérique. De plus, les perles sont considérées comme sphériques si leur SF est de 0,05 ou moins.
4. Détermination du pourcentage EE
- Désintégrez les billes dans une solution saline tamponnée au phosphate (PBS) pour les ramener en émulsion. Mesurez l’absorbance de l’émulsion résultante à 600 nm à l’aide d’un spectrophotomètre UV-vis.
- Utilisez la valeur d’absorbance pour représenter la turbidité de l’émulsion. Créez une courbe standard en utilisant une quantité connue de BSO dans l’émulsion.
- Calculer le pourcentage EE à l’aide de l’équation (4) :
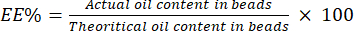 (4)
(4)
5. Microscopie électronique à balayage (MEB)
REMARQUE : Utilisez le MEB pour observer la microstructure et la morphologie de surface des billes d’alginate BSO.
- Pour inspecter l’intérieur des perles séchées, coupez-en quelques-unes. Repérez les perles coupées sur des bouts d’aluminium et collez-les à l’aide de rubans adhésifs en carbone.
- Vaporisez les billes avec un module de pulvérisation en carbone dans un évaporateur sous vide dans une atmosphère d’argon. Appliquer une épaisseur de 100 Å et 50 Å pour le revêtement carbone.
- Acquérir des images des billes enrobées sous vide poussé avec un accélérateur de tension entre 10 kV et 15 kV.
6. Déterminer l’interaction médicament-excipient à l’aide de l’ATR-FTIR
- Réglez les numéros d’onde de l’instrument entre 4 000 cm−1 et 400 cm−1 en utilisant l’air ambiant comme arrière-plan et une résolution de 1 cm−1. Voir le dossier supplémentaire 1.
- Enregistrer séparément les spectres du BSO, de l’alginate de sodium, de la lécithine, du chlorure de calcium, des billes sans BSO, des billes d’alginate-BSO et du mélange physique de matière active et d’excipients (alginate de sodium, lécithine, chlorure de calcium et BSO).
- Placez l’échantillon (5-10 mg) sur la zone d’échantillonnage. Ajustez 20 balayages, résolution 4, force manométrique 80, bras de pression avec une pointe plate. Vérifiez que l’option Incrément automatique reste définie sur l’option Vide afin que le spectre soit automatiquement stocké dans le dossier souhaité.
- Pour commencer la mesure de l’échantillon, cliquez sur le bouton [Échantillon]. Après avoir sélectionné [Échantillon], puisqu’il n’y a pas de période d’attente, assurez-vous que l’échantillon est prêt et que la pince de pression est réduite. Analysez tous les échantillons individuellement. Analysez individuellement tous les spectres enregistrés à l’aide d’un logiciel de spectroscopie.
7. Calorimétrie différentielle à balayage (DSC)
REMARQUE : Les propriétés thermiques et la compatibilité des billes chargées par BSO ont été étudiées à l’aide de l’ASN (fichier supplémentaire 1).
- Scellez les billes pesant ~3,20 mg dans une casserole en aluminium ordinaire. Chauffer les échantillons à une vitesse de 10 °C/min tout en étant analysés à une température de 50 à 350 °C sous un courant d’azote s’écoulant à une vitesse de 20 L/min.
8. Caractéristiques de gonflement des billes
- Préparez 100 mg de billes d’alginate-BSO séchées.
- Préparez le liquide intestinal simulé (SIF) et le liquide gastrique simulé (SGF) dans un récipient de mélange propre et sec d’une taille appropriée de 6 L, 10 L ou 25 L. Ajoutez de l’eau purifiée à environ 33 % du volume requis (2 L, 3 L ou 8 L) et transférez le contenu de la bouteille de concentré dans le récipient. Rincez la bouteille à l’eau purifiée et ajoutez les rinçages et l’eau purifiée dans le récipient de mélange pour obtenir le volume requis ; Mélanger. Mesurez le pH et procédez si vous respectez les spécifications ; ajustez le pH si nécessaire.
- Immergez les billes dans 50 mL de milieu contenant du liquide intestinal simulé (SIF) et du liquide gastrique simulé (SGF). Maintenir les conditions pendant 2 h à 37 ± 0,5 °C.
- Retirez les billes gonflées et filtrez-les à travers un treillis métallique à des intervalles prédéfinis de 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 et 120 min ou plus. Utilisez une serviette en papier pour enlever l’excès de liquide des perles gonflées.
- Mesurez le poids des billes essuyées à l’aide d’une balance analytique électronique. Déterminer le pourcentage de l’indice de gonflement ( %SI) à l’aide de l’équation (5) :
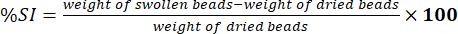 (5)
(5)
Résultats
Préparation de microbilles d’alginate chargées en BSO
La figure 1 représente le dispositif expérimental de préparation de microbilles d’alginate chargées de BSO. La quantité de lécithine utilisée a eu un impact considérable sur la stabilité de l’émulsion BSO. Les émulsions faites avec les trois concentrations de lécithine étaient relativement stables. La méthode de centrifugation (894 × g, 5 min) a été u...
Discussion
À l’aide du procédé EHDA, des microbilles d’alginate chargées de BSO ont été créées comme vecteur sensible au pH. Le réseau des billes a montré un gonflement dépendant du pH et un comportement de libération de médicament en raison de la présence abondante de groupes d’acide carboxylique. Il a été révélé que la forte liaison hydrogène intermoléculaire entre les chaînes polymères était à l’origine de la diminution du caractère gonflant des billes chargées...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été financée par le numéro de projet de soutien aux chercheurs de l’Université Princess Nourah bint Abdulrahman (PNURSP2024R30), Université Princess Nourah bint Abdulrahman, Riyad, Arabie saoudite. Cette recherche a été financée par le numéro de projet de soutien aux chercheurs (RSPD2024R811), Université du roi Saoud, Riyad, Arabie saoudite.
matériels
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Références
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon