Method Article
글라이칸 분석을 위한 Microglia의 미토콘드리아 제제
요약
미세아교세포에서 정제된 미토콘드리아를 준비하고, N-글리칸 방출을 위한 미토콘드리아 단백질을 분리하고, 고해상도 정밀 질량 분석기 질량 분석기와 결합된 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화를 사용하여 세포 내 미토콘드리아 글라이칸을 신속하게 검출하기 위한 프로토콜이 개발되었습니다.
초록
미세아교세포에서 미토콘드리아 단백질의 당화(glycosylation) 패턴을 이해하는 것은 신경퇴행성 질환에서 미토콘드리아 단백질의 역할을 결정하는 데 중요합니다. 여기에서는 배양된 미세아교세포에서 분리된 미토콘드리아 단백질의 당(glycomic) 분석을 위한 새로운 고처리량 방법론을 제시합니다. 이 방법에는 미세아교세포 배양에서 미토콘드리아를 분리하고, 미토콘드리아 샘플의 품질 평가를 거친 후 글라이칸 검출을 극대화하기 위한 최적화된 단백질 추출, 미토콘드리아 당화에 대한 자세한 프로파일을 제공하기 위한 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화(IR-MALDESI) 고분해능 정밀 질량(HRAM) 질량 분석법이 포함됩니다.
이 프로토콜은 분리 중 미토콘드리아 무결성 유지의 중요성을 강조하고 추출 후 미토콘드리아 순도 측정을 포함하여 재현성을 보장하기 위해 엄격한 품질 관리를 사용합니다. 이 접근 방식을 사용하면 in vitro의 다양한 실험 조건에서 미세아교세포 미토콘드리아의 당화(glycosylation) 변화를 종합적으로 프로파일링할 수 있으며, 이를 통해 신경퇴행성 질환과 관련된 미토콘드리아 변화에 대한 통찰력을 얻을 수 있습니다. 이 접근법은 다른 체외 처리, 다른 배양 세포 유형 또는 일차 세포에 적용할 수 있습니다. 이 표준화된 접근 방식을 통해 우리는 미세아교세포 미토콘드리아 글라이칸에 대한 이해를 증진하여 더 넓은 신경 퇴행성 연구 분야에 기여하는 것을 목표로 합니다.
서문
미세아교세포(Microglia)는 뇌에 상주하는 우세한 선천면역세포(innate immune cell)이며 성인 뇌 세포의 10-15%를 차지합니다 1,2. 그들은 수용체 레퍼토리를 사용하여 뇌 미세환경을 동적으로 모니터링하고 정상적인 뇌 기능을 조절하여 뇌 항상성을 유지합니다3. 미세아교세포는 미세환경의 변화에 매우 민감하며 병리학적 상태나 다양한 자극에 따라 세포 형태, 면역표현형, 기능 등의 변화를 겪습니다. 미세아교세포 활성화 상태는 식세포작용(phagocytosis), 사이토카인 생산 또는 조직 복구와 같은 기능에 필요한 세포 에너지 요구량의 영향을 받습니다. 따라서 세포 에너지 대사는 미세아교세포 기능의 변화를 조절하는 데 중요한 역할을 합니다4. 미세아교세포 조절 장애는 전염증성 사이토카인(예: IL-1β, TNF-α)과 활성산소종(ROS)의 과도한 방출을 유발하여 뇌를 신경염증에 취약하게 만듭니다 5,6. 만성 미세아교세포 조절 장애와 그로 인한 신경염증성 환경은 신경퇴행의 토대를 마련한다7.
뇌는 체중의 2%에 불과하지만 신체 전체 에너지 소비량의 20%를 차지합니다. 미토콘드리아는 뇌세포의 주요 에너지원이며 급성 및 만성 뇌 질환의 발병기전에서 중요한 역할을 합니다8. 이전 연구에서는 노화 9 및 알츠하이머병과 같은 노화 관련 질환에서 미세아교세포 활성화와 대사 기능 장애 사이에 강력한 상관관계가 있음을 입증했으며, 10,11 세포 노화 및 신경 퇴행에서 미토콘드리아의 중추적인 역할을 강조했습니다. 미토콘드리아 기능이 손상되면 노화 및 노화 관련 질병 중 에너지 생산 감소, 산화 스트레스 증가, 신경 염증 증가로 이어집니다.
광범위한 연구를 통해 에너지 대사, 노화 및 뇌 질환에서 미토콘드리아의 역할이 밝혀졌지만, 미토콘드리아 생물학 및 기능에서 당화(glycosylation)와 같은 일반적인 번역 후 변형의 역할은 충분히 연구되지 않았습니다. 당화(glycosylation)는 당화(glycosylation) 효소에 의해 글리칸(glycans)이라고 하는 당 부분을 단백질에 효소적으로 첨가하는 것으로, 미세아교세포(microglia)를 포함한 대부분의 뇌세포에서 가장 흔한 번역 후 변형입니다. 활성화된 미세아교세포는 세포 내 또는 세포 표면 글리칸 발현을 조절하여 염증 자극 하에서 면역 기능을 조절합니다12. 자극 후 미세아교세포에 의해 나타나는 전염증 및 항염증 반응은 또한 글라이칸에 의해 조절됩니다13. 미토콘드리아 단백질은 또한 이러한 글리칸 변형을 가지고 있으며, 이는 기능과 국소화를 조절합니다. 그러나 미세아교세포의 세포 특이적 미토콘드리아 당화(mitochondrial glycosylation) 패턴에 대한 자세한 분석은 세포 내 당화(subcellular glycosylation)를 조사하는 데 있어 기술적인 문제로 인해 부족합니다. 미세아교세포(microglial) 표현형을 조절하는 글리코실화(glycosylation)의 잘 규명된 역할에도 불구하고, 미토콘드리아 기능을 조절하는 글리칸의 역할과 그에 따른 미세아교세포의 세포 면역표현형(cellular immunophenotype)은 잘 이해되지 않고 있습니다.
미토콘드리아 단백질 당화(glycosylation)를 조사하는 제한된 연구는 주로 렉틴 기반 당화(glycosylation) 패턴의 식별에 초점을 맞추었습니다. 렉틴은 생체 분자 글라이칸 부분14,15에 결합하는 글리칸 결합 단백질로, 글리칸 구성에 대한 자세한 정보를 제공할 수 있는 특이성과 능력이 부족합니다. 질량 분석 양식은 렉틴 분석에서 발생하는 분석적 문제를 극복하기 위해 글라이칸 조성을 자세히 식별합니다. 이러한 방식 중 하나인 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화(IR-MALDESI)는 하이브리드 이온화 전략을 사용하는데, 중적외선 레이저를 사용하여 생물학적 표본16에서 발견된 물을 공진적으로 여기시켜 중성 종을 탈착하고 직교 전기 분무 기둥을 가한 다음 고분해능 정밀 질량 Orbitrap 질량분석기를 사용하여 분석합니다. IR-MALDESI는 이전에 조직 대사 산물17의 직접 분석을 위해 입증되었으며, 신속한 분석18, 소프트 이온화 방법 및 염소화 글라이칸 부가물의 동위원소 분포 패턴을 기반으로 한 N-결합 글라이칸의 시알산 함량 예측 가능성이라는 뚜렷한 장점이 있습니다19. 그러나 세포 내 글라이칸의 직접 분석을 위한 이 플랫폼의 적응은 입증되지 않았습니다.
여기에서는 IR-MALDESI 질량 분석법을 사용하여 미세아교세포에서 미토콘드리아 분리, 미토콘드리아 N-글라이칸 분리, 미토콘드리아 N-글라이칸 검출 및 분석을 위한 고처리량 프로토콜을 보고합니다. 이 프로토콜은 미토콘드리아 기능에서 당화(glycosylation)의 역할에 대한 새로운 통찰력을 발견하는 데 기초가 될 것이며, 잠재적으로 신경염증성 및 신경퇴행성 질환에 대한 새로운 치료 표적을 식별할 수 있습니다.
프로토콜
1. BV2 미세아교세포 세포주 배양
- 10% 소 태아 혈청(FBS), 1% 페니실리움-스트렙토마이신(PenStrep) 및 1% 비필수 아미노산(NEAA)이 보충된 DMEM 저혈당 배지에서 BV-2 세포(C57BL/6 마우스에서 유래한 미세아교세포)를 유지합니다.
- T-175 플라스크에서 세포를 성장시키고 70-80% 농도에 도달하도록 합니다.
- 37°C에서 5%CO2로 세포 해리 효소를 5분 동안 배양하여 세포를 분할한 다음 동일한 부피의 세포 배지로 효소를 비활성화하고 실온(RT )에서 500×g에서 5분 동안 세포를 원심분리합니다.
참고: 여기에 사용된 세포 해리 효소는 트립신보다 BV2 세포에 더 순하며 세포 표면 항원 발현을 보호하는 데 사용할 수 있습니다. - 배지를 흡인하고, 세포 펠렛을 1mL의 성장 배지에 재현탁시키고, 트리판 블루를 사용하여 세포를 계수합니다( 재료 표 참조).
참고: 이 단계에서는 자동 셀 카운터를 사용하여 셀을 계수했습니다. - 미토콘드리아 분리를 수행하려면 세포 펠릿에 2 × 107 (2천만 세포/펠릿)이 포함되어 있는지 진행하십시오.
2. 미세아교세포에서 미토콘드리아의 분리
알림: 절차 내내 모든 것을 얼음 위에 유지하면서 신속하게 작업하십시오. 미토콘드리아 분리에 사용되는 미토콘드리아 분리 키트에는 시약 A(세포 용해 완충액), 시약 B(안정화 완충액) 및 시약 C(미토콘드리아 세척 완충액)의 세 가지 구성 요소가 있습니다. 프로테아제 억제제를 시약 A와 시약 C에 사용 직전에 첨가하십시오.
- 2.0mL 마이크로 원심분리 튜브에서 500 × g에서 5분 동안 수확된 세포를 원심분리하여2 × 10 7 세포를 펠릿화합니다. 조심스럽게 흡입하고 상층액을 버리십시오.
- 800μL의 미토콘드리아 분리 시약 A(세포 용해 완충액)를 추가하고 중간 속도로 5초 동안 와류를 일으킨 다음 정확히 2분 동안 얼음 위에서 튜브를 배양합니다.
알림: 2 분의 배양을 초과하지 마십시오. - 10μL의 미토콘드리아 분리 시약 B(안정화 완충액)를 추가하고 5초 동안 최대 속도로 와류를 일으킨 다음 얼음 위에서 튜브를 5분 동안 배양하여 1분마다 최대 속도로 와류를 일으킵니다.
- 800μL의 미토콘드리아 분리 시약 C(미토콘드리아 세척 완충액)를 첨가하고 튜브를 여러 번 뒤집어 혼합한 다음 700°C에서 10 분 동안 4g의 튜브를 원심분리×.
알림: 와류하지 마십시오. - 상층액을 새 2.0mL 튜브로 옮기고 3,000 × g 에서 4 °C에서 15분 동안 회전합니다.
- 상층액(세포질 부분)을 새 튜브로 옮깁니다. 펠릿에는 분리된 미토콘드리아가 포함되어 있습니다.
- 펠릿에 500μL의 미토콘드리아 분리 시약 C를 추가하고 12,000×g에서 5 분 동안 원 심분리합니다.
- 단백질 정량 분석 및 가공을 위해 펠릿을 사용하거나 나중에 사용할 때까지 펠릿을 -80°C에서 보관하십시오.
3. microBCA assay를 사용한 단백질 추정
참고: 이 프로토콜에 대한 단백질 추정은 다양한 시약과 분석을 사용하여 수행할 수 있습니다. 세포질 또는 미토콘드리아 단백질의 정량화는 분석에 사용된 총 단백질 농도에 대해 정규화하여 수행할 수 있습니다.
- 0 μg/mL - 200 μg/mL (0 μg/mL, 0.5 μg/mL, 1 μg/mL, 2.5 μg/mL, 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 200 μg/mL) 사이의 소 혈청 알부민(BSA) 표준물질을 준비하고 용해 버퍼만 있는 블랭크를 준비합니다.
- 각 표준물질 150μL를 샘플이 들어 있는 바닥이 평평한 96웰 플레이트에 추가합니다.
- Micro BCA 시약 MA(bicinchoninic acid (BCA) 용액) 25부와 시약 MB(황산구리 용액) 24부를 시약 MC(안정화 완충액) 1부(25:24:1, 시약 MA:MB:MC)와 혼합하여 작동하는 시약을 만듭니다. 150μL의 혼합 BCA 시약을 각 샘플과 표준물질에 추가합니다.
- 37°C에서 2시간 동안 배양합니다.
- 플레이트 리더를 사용하여 562nm에서 흡광도를 측정하고 표준 곡선으로 단백질 농도를 정량화합니다. 다른 모든 개별 표준물질 및 알려지지 않은 시료 반복의 흡광도 측정에서 blank standard absorbance를 빼서 시료 단백질 농도를 구합니다.
4. 미토콘드리아 제제 품질 관리 (웨스턴 블롯)
- 방사성 면역침전 분석 완충액(RIPA) 완충액에 미토콘드리아 펠릿을 재현탁하여 단백질 정량화를 수행합니다. micro BCA assay를 사용하여 각 샘플의 단백질 농도를 측정합니다.
- 샘플 버퍼의 샘플을 94 oC에서 5분 동안 변성시킵니다.
- 동일한 양(20μg)의 미토콘드리아 단백질을 분자량 마커와 함께 프리캐스트 겔( 재료 표 참조)에 로드합니다.
- 100V에서 50분 동안 젤을 실행합니다.
참고: 실행 시간은 다를 수 있으므로 단백질이 샘플 버퍼의 염료로 표시된 겔 끝에 도달하면 겔을 중지해야 합니다. - 웨스턴 블롯 전달 시스템에서 건조 전달 프로토콜을 사용하여 20V에서 7분 동안 겔의 단백질을 PVDF(폴리비닐리덴 플루오라이드) 멤브레인으로 전달합니다.
- 멤브레인을 꺼내고 차단 용액(표 1)을 사용하여 실온에서 1시간 동안 차단합니다.
- 4 oC(COXIV= 1:3,000, GAPDH = 1:3,000)에서 밤새 차단 완충액의 멤브레인에 적절한 1차 항체 희석액을 추가합니다.
참고: 미토콘드리아 제제에서 핵, 소포체(ER) 오염이 없는 경우 서부 블롯에서 lamin(핵 마커) 및 ERp57(ER 마커)과 같은 추가 마커를 사용하여 테스트할 수 있습니다. - 세척 버퍼로 멤브레인을 3 x 15분 동안 세척합니다(표 1).
- HRP-conjugated secondary antibody를 적절하게 희석하여 차단 완충액에 넣고 멤브레인을 실온에서 1시간 동안 배양합니다.
- 세척 버퍼로 멤브레인을 3 x 15분 동안 세척합니다.
- 현상을 위해서는 화학발광 기판 키트를 사용하십시오.
- 젤과 멤브레인 이미저를 사용하여 멤브레인을 스캔합니다.
5. 미세아교세포에서 N-글라이칸 추출을 위한 미토콘드리아 단백질 분리
- 분리된 미토콘드리아를 50μL의 단백질 분리 완충액(표 1)에 재현탁시키고 20분 동안 얼음 위에 둡니다.
- 세 번 흡입하고 분주하고 20분 동안 얼음 위에 두십시오(사용 전 소용돌이). 미토콘드리아 펠릿이 완전히 용해되지 않은 경우 분리 완충액 50μL를 더 추가하고 동일한 튜브에 풀링합니다.
- 13,000 × g 에서 10분 동안 원심분리기
- 상층액을 회수하고 최소 80시간 동안 -1 °C에서동결한 다음 진공 농축기에서 최대한 건조시킵니다.
- IR-MALDESI에 대한 PNGase 분해 버퍼(표 1)를 사용하여 글라이칸 분리 전에 재현탁합니다.
6. IR-MALDESI를 위한 미토콘드리아 N -글리칸 준비
- 25-250 μg의 단백질(최대 250 μL 용량)의 분리된 미토콘드리아 단백질을 10 kDa 분자량 컷오프(MWCO) 필터에 로드합니다.
- 필터의 각 샘플에 2μL의 1M 디티오트레이톨(DTT)을 추가하여 단백질 샘플을 줄여 글라이칸 부분을 노출시킵니다.
- 샘플을 200μL의 PNGase 분해 버퍼로 희석하고 필터를 방해하지 않도록 가볍게 와동시킵니다.
- 샘플을 56°C에서 30분 동안 배양하여 미토콘드리아 단백질을 변성시킵니다.
- 50μL의 1M 요오드아세트아미드를 사용하여 미토콘드리아를 알킬화하여 ~200mM의 최종 농도를 제공하고 37°C에서 60분 동안 배양합니다.
- 변성 미토콘드리아 방법을 더욱 농축하기 위해 14,000 × g 에서 40분 동안 샘플을 원심분리합니다. 플로우스루를 폐기합니다.
- 100 μL의 PNGase 분해 버퍼로 시료를 세척합니다.
- 당단백질을 14,000× g 으로 필터에 20분 동안 농축하고 플로우스루를 버립니다. 세척 및 농축 단계를 2x, 총 3x에 대해 반복하여 필터 데드 볼륨(~5μL)의 농축액을 생성합니다. 모든 플로우스루를 폐기합니다.
- 세척이 완료되면 수집 바이알을 폐기하십시오. 향후 모든 용리액 및 세척을 위해 새 수집 바이알을 사용하십시오.
- 변성된 미토콘드리아 당패턴에서 글라이칸을 절단하려면 새로운 수집 바이알로 옮기고 글리세롤이 없는 PNGase 2μL(75,000 units/mL)를 필터에 추가합니다. 98 μL의 PNGase 분해 완충액을 추가하여 총 부피를 100 μL로 만들고 필터를 위아래로 부드럽게 피펫팅하여 혼합합니다.
- 37°C에서 18시간 동안 샘플을 배양하여 미토콘드리아 단백질에서 모든 N-글리칸을 효소로 절단합니다.
- 방출된 미토콘드리아 N-글리칸을 14,000 × g 에서 20°C에서 20분 동안 원심분리하여 용리합니다.
- 필터에 PNGase 분해 완충액 100μL를 추가하고 14,00×0g에서 20°C에서 20 분 동안 원 심분리하여 미토콘드리아 글라이칸을 세척합니다. 용리액과 동일한 채취 바이알에 남아 있는 N-글라이칸이 포함된 세척액을 수집합니다. 2회 반복하고 수집 바이알에서 필터를 제거합니다.
- 미토콘드리아 글라이칸 샘플을 -80°C 냉동고에서 냉동(30-60분)할 때까지 배양하고 진공 농축기(400μL의 경우 4-6시간)에서 실온에서 완전히 건조시킵니다.
참고: N-글라이칸은 분석 전에 최대 6개월 동안 -20°C에서 보관할 수 있습니다. - IR-MALDESI 분석 직전에 건조된 N-결합 글라이칸을 50μL의 LC/MS 등급 물에 재현탁시킵니다.
7. IR-MALDESI 질량 분석법에 의한 방출된 글라이칸 검출
- 실험이 진행되는 동안 매일 질량 보정을 수행합니다. 교정 용액을 주사기 펌프에 로드하고 1.2 μL/min의 속도로 밀어 넣습니다. 3.5kV의 전압을 적용하여 포지티브 및 네거티브 모드 모두에서 질량 교정을 위한 안정적인 전기 분무 기둥을 달성합니다.
- 5μL의 재현유탁된 미토콘드리아 글라이칸을 테프론 마이크로웰 슬라이드의 샘플 스폿에 피펫팅합니다.
- 버스트당 1.8mJ의 에너지로 절제를 위해 2.97μm의 파장에서 작동하는 mid-IR 레이저를 사용합니다.
- 음이온 이온화 모드에서 N-글라이칸을 이온화하고 검출합니다. 60% 아세토니트릴과 1mM 아세트산으로 구성된 전기 분무 용매를 사용하여 3.2kV의 전압에서 2μL/min의 유속으로 안정적인 전기 분무 기둥을 생성합니다.
- 분석을 수행하려면 IR-MALDESI를 m/z 200에서 240,000FWHM의 질량 분해능으로 설정된 HRAM 질량 분석기에 연결하고 음이온 모드에서 500 및 2,000m/z 사이를 분석합니다.
- 자동 게인 제어(AGC)를 끄고 주입 시간을 90ms로 고정합니다. EasyIC 소스를 사용하여 모든 스펙트럼의 실시간 내부 교정을 통해 높은 질량 측정 정확도(MMA)를 달성할 수 있습니다.
8. 미토콘드리아 N- 글라이칸 데이터 분석
- 단일 동위원소 질량을 검색하고 m/z 간격을 사용하여 동위원소 분포를 확인하여 최소 이온 플럭스 임계값이 1,000 ions/s인 이중 및 삼중 전하를 띤 이온을 측정하여 N-결합 글라이칸을 수동으로 식별합니다.
- 원시 질량 스펙트럼을 m/z 비율에서 중성 단일 동위원소 질량으로 변환합니다.
- 단동위원소 덩어리를 온라인 올리고당 구조 예측 도구에 업로드하여 잠재적인 글라이칸 조성을 결정합니다. 실험적으로 선별된 당체 데이터베이스(glycomic database)를 사용하여 주석을 확인하는 단계(20); 각 식별이 2.5ppm MMA의 범위 내에 있고, 코어 N-결합 글라이칸 구조(Hex3HexNAc2)를 포함하며, 펜토스, KDN 또는 HexA 단당류를 제외해야 합니다.
- SNFG 명명법21을 사용하여 확인된 글라이칸 구조를 그립니다.
- 원시 질량 스펙트럼에서 상대적 글리칸 함량을 얻고 미토콘드리아 단백질의 양(μg)에 대해 정규화하여 이온/s/μg을 얻습니다.
- 카이 제곱 분석을 사용하여 N-연결 글라이칸의 이론적 분포와 실험적 분포 간의 적합도를 테스트하여 염소 부가물의 수를 확인할 수 있습니다. 이를 통해 시알산의 수를 직접 측정할 수 있습니다19.
결과
그림 1은 질량 분광 글라이칸 분석을 위해 BV2 미세아교세포주에서 미토콘드리아를 분리하는 데 관련된 단계의 개략도를 나타냅니다. 미세아교세포의 동일한 시작 밀도에서 서로 다른 미토콘드리아 제제 간 미토콘드리아 단백질 분리의 재현성은 그림 2에 나타나 있으며, 이는 마이크로 BCA 분석을 사용하여 추정된 미토콘드리아 단백질 농도 간에 큰 차이가 없음을 보여줍니다.
그림 3은 COX IV 및 GAPDH의 웨스턴 블롯 분석을 사용한 미토콘드리아 분리의 순도를 나타냅니다. 여기서, 우리는 프로토콜에 사용된 시약 기반 분리의 마지막 단계에서 분리된 미토콘드리아 분획에서 미토콘드리아 단백질 COX IV의 발현을 볼 수 있습니다. 면역블롯은 분리된 미토콘드리아 분획에서 두드러진 COX IV 밴드를 보여주는 반면, GAPDH는 동일한 노출에서 세포질 분획에서만 검출됩니다. 노출 시간이 길면 희미한 GAPDH 대역이 감지될 수 있습니다. 비미토콘드리아 마커 GAPDH의 발현은 CoxIV 밴드 없이 미토콘드리아를 분리한 후 전체 세포 용해물에서 분명하며, 이는 미토콘드리아 분획의 완전한 분리와 최소한의 비미토콘드리아 오염을 나타냅니다. 미토콘드리아 분획에서 COX IV 발현은 유사한 시작 세포 밀도를 가진 다른 제제간에 일관됩니다 2 × 107 세포.
그림 4에서 IR-MALDESI를 사용하여 검출된 방출된 N-글리칸의 대표적인 질량 스펙트럼은 PNGase 처리를 사용하여 미토콘드리아 단백질 추출물에서 방출된 여러 인산화, 황산화 및 시알릴화 전하를 띤 N-글라이칸의 존재를 보여줍니다. 표 2는 전체 스펙트럼에서 확인되었지만 GlyConnect에서는 보고되지 않은 모든 글라이칸 조성을 보고합니다. 적합도(goodness-of-fit)를 테스트하는 카이 제곱 값은 1개 및 2개의 염소 부가물을 가진 N-결합 글라이칸의 검출을 확인하며, 그림 5의 IR-MALDESI를 사용하여 이러한 글라이칸 조성의 검출을 확인합니다.
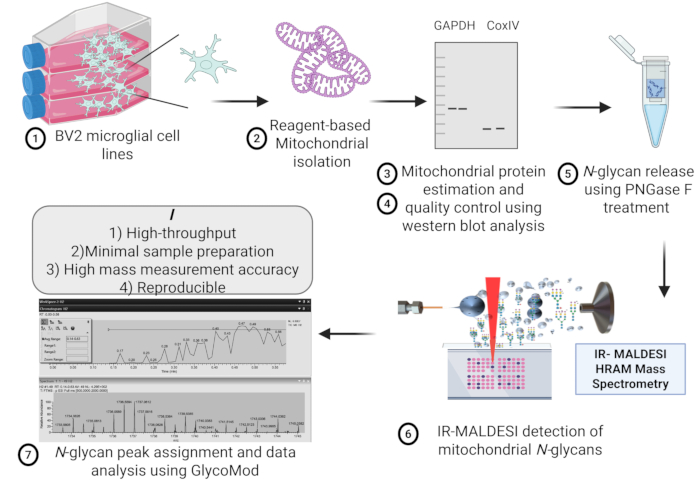
그림 1: 프로토콜 개요. 미토콘드리아 N-글라이칸의 고처리량 검출을 위해 BV2 미세아교세포주에서 IR-MALDESI HRAM 질량 분석법을 사용한 미토콘드리아 분리, 품질 관리, 단백질 추출, N-글라이칸 방출 및 추정의 개략적인 개요. 약어 : IR-MALDESI HRAM = 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화 고해상도 정확한 질량 분석기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
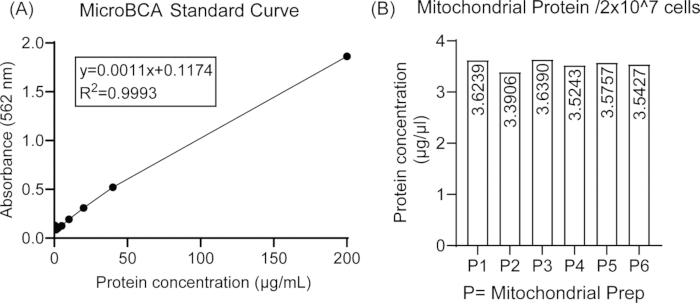
그림 2: BV2 세포에서 미토콘드리아 단백질 분리. (A) 다양한 농도의 BSA를 사용한 마이크로 BCA 분석의 표준 곡선. (B) 6개의 독립적인 미토콘드리아 제제에서 2 × 107 세포의 일관된 단백질 함량으로 표시되는 미토콘드리아 단백질 분리의 재현성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
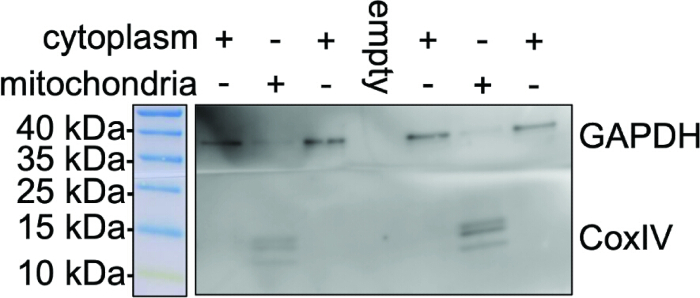
그림 3: 미토콘드리아 제제의 순도. 세포질 분획에 대한 대표적인 웨스턴 블롯과 BV2 미세아교세포에서 분리된 미토콘드리아. 이 그림은 세포질 분획과 분리된 미토콘드리아를 COX IV 항체(미토콘드리아 마커) 및 GAPDH 항체(세포질 대조군)로 면역 블로팅을 나타냅니다. 분리된 미토콘드리아에 GAPDH 밴드가 없다는 것은 교차 오염이 최소화되고 후속 N-글라이칸 분석을 위한 미토콘드리아 제제의 순도를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
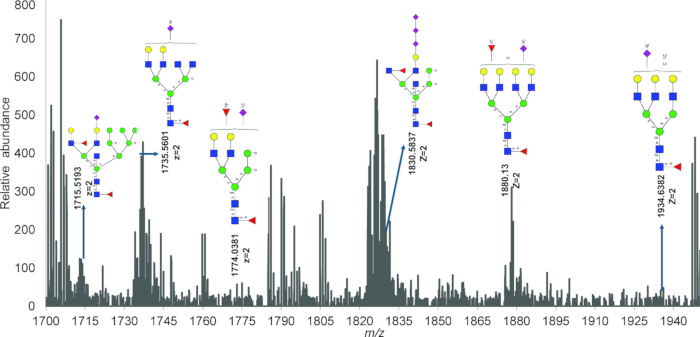
그림 4: IR-MALDESI HRAM 질량 분석법을 사용한 미토콘드리아 N-글라이칸 식별 조성 측정. 1,700-2,000m /z 범위의 글라이칸 질량 스펙트럼은 Glycomod를 사용하여 결정된 주석이 달린 구조와 함께 상당한 수의 다중 전하를 띤 피크를 보여줍니다. 약어 : IR-MALDESI HRAM = 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화 고해상도 정확한 질량 분석기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
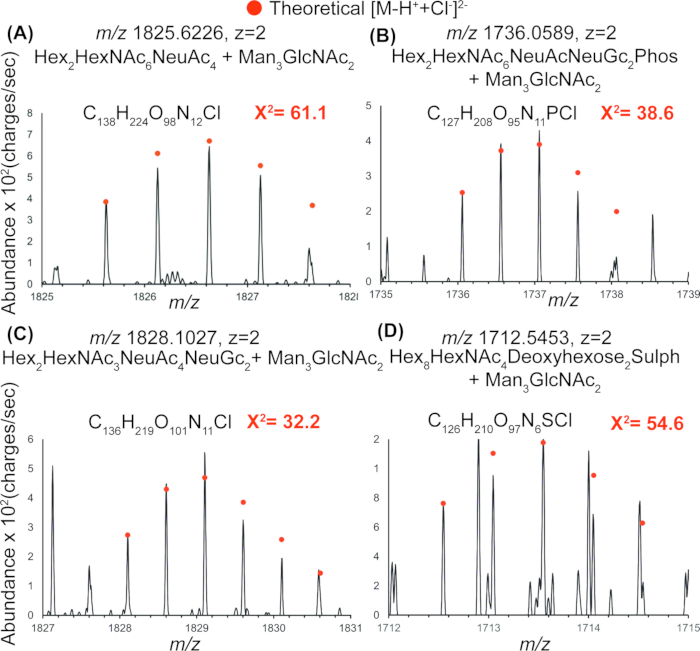
그림 5: 검출된 미토콘드리아 N-글라이칸의 검증. 4개(A-D) 미토콘드리아 N-연결 글라이칸에 대한 대표적인 동위원소 분포는 관찰된 분포와 염소 및 탈양성자화된 부가물의 이론적 분포와 중첩을 보여줍니다. 중첩된 스펙트럼의 카이 제곱 값은 적합도를 나타내며 1개 및 2개의 염소 부가물로 N-결합 글라이칸의 검출을 확인합니다. 이는 IR-MALDESI를 사용하여 이러한 글라이칸 조성을 검출했다는 추가 확인입니다. 약어 : IR-MALDESI = 적외선 매트릭스 보조 레이저 탈착 전기 분무 이온화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 프로토콜에 사용된 용액 및 버퍼 레시피. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 글리코모드에서 높은 질량 측정 정확도로 미토콘드리아에서 검출된 M 최종 전하를 띤 탈양성자화된 N-결합 글라이칸. 글라이칸 단축식 표기법: H = hexose; N = N-아세틸글루코사민; F = 푸코스; S = N-아세틸뉴라민산; Phos = 인산염; Sulph = 황산염 개질. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
미세아교세포는 뇌에 상주하는 면역 세포이며, 글리칸 변형은 미세아교세포의 면역표현형과 기능을 조절합니다. 이러한 면역 기능은 상당한 세포 에너지를 필요로 하며, 이는 주로 미토콘드리아에 의해 공급됩니다. 특히, 미토콘드리아 단백질은 또한 글리칸 변형을 나타내는데, 이는 세포 내 글리코실화(subcellular glycosylation)를 조사하는 데 있어 기술적 어려움으로 인해 상당히 연구되지 않은 상태로 남아 있습니다. 미토콘드리아 당화(mitochondrial glycosylation)를 조사하는 대부분의 연구는 렉틴 기반 글라이칸 패턴 식별에 의존하지만(22), 이러한 접근법은 렉틴의 낮은 결합 특이성으로 인해 제한적입니다. 이 연구에서 제시된 기술적 접근 방식의 근본적인 발전은 i) 미세아교세포에서 미토콘드리아 N-글리칸의 재현 가능한 분리 및 ii) IR-MALDESI HRAM 질량 분석법을 사용한 미토콘드리아 N-글라이칸의 검출 및 식별입니다. 여기에 설명된 워크플로우는 미세아교세포에서 생리학적 수준으로 발현된 미토콘드리아 당단백질에서 방출되는 N-글리칸의 검출에 대한 첫 번째 보고서입니다.
본 프로토콜에서는 시약 기반 분리 방법을 사용하여 미토콘드리아 분리를 극대화합니다. 이는 Dounce 균질화 방법과 결합하여 미토콘드리아 수율을 향상시킬 수 있습니다. 시약 기반 분리와 비교하여 균질화기를 사용할 때의 단점은 작업자 간 유봉의 힘과 속도가 달라져 실험 변동이 증가하고 재현성이 감소한다는 것입니다. 이전 연구에서는 23,24 개의이 방법의 사용과 미토콘드리아 분획에 핵 (lamin, histone H3) 및 ER 마커 (calnexin, Erp57)가 없음을 나타내며 미토콘드리아 분획의 순도를 나타냅니다. 이 프로토콜의 잠재적인 한계는 미토콘드리아 분리를 위한 출발 물질로 2,000만 개의 세포가 필요하다는 것입니다. 그러나 본 연구에서 관찰된 높은 미토콘드리아 단백질 농도는 N-글리칸 신호를 잃지 않고이전 연구에서 수행된 최적화를 기반으로 미토콘드리아 분리를 위한 초기 미세아교세포 수를 10배 축소할 수 있습니다. 또한, 미토콘드리아 분리를 위한 더 높은 세포 수를 얻기 위해 생물학적 샘플을 풀링하는 것은 효율적인 글라이칸 검출을 위해 조직과 같은 1차 공급원에서 세포 수를 낮추기 위해 프로토콜 확장성이 제한된 경우 수행할 수 있습니다. 또한 이 프로토콜에서는 글라이칸 방출 단계가 매우 중요합니다. N-글리코시다아제 F(PNGase F)는 가장 안쪽의 N-아세틸글루코사민(GlcNAc)과 아스파라긴 잔기 사이의 아미드 연결을 가수분해하여 완전하고 손상되지 않은 N-결합 글라이칸을 방출하는 데 사용됩니다27. N-글라이칸 분석의 경우 미토콘드리아 단백질의 완전한 탈당화를 달성하기 위해 PNGase F의 활성을 최적화하는 것이 중요합니다. 용매 노출과 과도한 효소를 사용한 단백질 변성은 미토콘드리아 단백질에서 N-글리칸의 효율적이고 완전한 절단 및 방출을 보장하는 데 도움이 됩니다. 18-20 시간의 분해 시간은 PNGase F 반응26을 완료하여 N- 글리칸 방출에 최적입니다.
이 프로토콜의 잠재적인 한계는 이 방법에서 당단백질에 대한 미토콘드리아 추출물의 농축이 부족하다는 것입니다. 저농도 당단백질은 분석에서 검출되지 않을 수 있지만, 이 방법은 렉틴 친화성 정제 또는 화학적 농축으로 인해 발생하는 오류와 편향을 최소화합니다. IR-MALDESI는 식별된 글라이칸의 조성에 대한 높은 신뢰도의 식별을 제공하지만, 글리칸 잔기 간의 연결에 대한 정확한 정보를 얻으려면 교차 고리 절단28 또는 엑소글리코시다아제 분해를 향상시키기 위해 리튬 첨가 글라이칸의 탠덤 질량 분석법을 사용한 추가 조사가 필요합니다. 또는 LC-MS/MS를 IR-MALDESI 접근법에 추가하거나 대안으로 사용할 수 있으며, 이는 더 많은 구조적 세부 사항과 함께 더 깊은 글라이칸 커버리지를 제공할 수 있습니다. 그러나 이전 연구에서는 대사산물에 대한 IR-MALDESI의 평균 이온 함량과 LC-MS/MS 29에 의해 결정된 절대량 간의 상관관계를 보여주었으며, 이는 IR-MALDESI를 사용하여 대사산물을 직접 정량화하기 위한 기반을 구축했습니다. MS2 분석을 수행하여 신뢰도가 높은 구조적 확인을 제공할 수 있는 IR-MALDESI의 고처리량 특성은 잠재적인 글라이칸 바이오마커 및 질병 진단을 위한 전임상 및 임상 샘플의 신속한 스크리닝에 중요한 역할을 합니다. 또한, 12,000 × g 대신 3000 × g 에서 핵 후 상등액을 원심분리하면 과산화소체 및 리소좀 오염 물질 이 최소화되지만 , 미토콘드리아 제제에 이러한 단백질이 여전히 미량으로 존재할 수 있다는 점에 유의해야 합니다.
결론적으로, 이 연구는 미세아교세포의 미토콘드리아 글리콤 분석을 위한 최소한의 시료 준비와 신경퇴행성 질환에 대한 새로운 글라이칸 기반 치료 표적 식별에 적용할 수 있는 큰 잠재력을 갖춘 간단하고 처리량이 많은 방법을 제시합니다. 이 프로토콜은 미세아교세포에서 미토콘드리아 분리를 위한 분석 방법의 포괄적인 평가 및 표준화와 미토콘드리아 글리컴의 후속 분석을 제공하여 대규모 전임상 및 임상 연구를 위한 스케일업을 가능하게 합니다. 이 프로토콜은 N-글라이칸 분리 및 검출에 대한 몇 가지 이점을 제공합니다: i) 시약 기반 프로토콜에 대한 미토콘드리아 분리 시간이 짧습니다(≤40분). ii) 글리칸 방출을 위한 단백질의 수율이 높다. iii) N-글리칸 분석을 위해 제조된 동일한 미토콘드리아 샘플은 단백질체학 분석, 렉틴 분석 및 미토콘드리아 흐름 분석과 같은 다른 분자 생물학적 조사에 사용할 수 있습니다. iv) IR-MALDESI HRAM 질량 분석법은 시알로글리칸 및 설포글리칸30과 같은 전하를 띤 글라이칸의 화학적 유도체화가 필요 없는 하이브리드 및 소프트 이온화 전략28으로 인해 N-글리칸의 빠르고 향상된 검출을 가능하게 합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는 NCSU Muddiman Lab의 대학원생인 Seth Eisenberg에게 질량 분석 프로토콜의 비디오 녹화에 도움을 준 것에 대해 감사를 표합니다. 이 연구는 버밍엄에 있는 앨라배마 대학교(University of Alabama at Birmingham)의 공학 혁신 펠로우 프로그램(School of Engineering Innovation Fellows Program)의 일부 지원을 받았으며, AG068309 D.J.T.와 R01GM087964-12가 D.C.M.에 지원되었습니다. 이 원고의 회로도는 BioRender를 사용하여 그려졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amersham 600 imager | Cytvia | 29194217 | Gel and membrane imager |
| Countess 3 automated cell counter | Fisher Scientific | X003SZ1LY9 | |
| Dry Bath Stdrd 4 blck 100-120V | Thermofisher scientific | 88870003 | |
| i-Blot2 Gel Transfer Device | Invitrogen | IB21001 | Western blot transfer system |
| Inverted microscope | Cell Treat | 04355223EA | |
| Microplate reader | 82050-760 | ||
| Mini gel tank | Invitrogen | A25977 | |
| Open Air Rocker | Fisher Brand | 88861025 | |
| Pipet boy | BioTek | 229310 | |
| Vortex mixer | Integra- VWR | ||
| Mitochondria isolation reagents | |||
| Mitochondrial Isolation kit | Thermofisher scientific | 89874 | |
| Phosphotase Inhibitor | Thermofisher scientific | 1861274 | |
| Protease Inhibitor | Thermofisher scientific | 1861281 | |
| N-glycan isolation and IR-MALDESI reagents | |||
| Acetic acid | Fisher Scientific | A11350 | 50% in ESI solvent |
| Acetonitrile | Sigma Aldrich | 34851-4L | 1 mM in ESI solvent |
| Ammonium bicarbonate | Fisher Scientific | A643500 | 100 mM |
| Calibration Solution | Thermofisher Scientific | A39239 | Pierce FlexMix |
| Dithiothreitol | Sigma Aldrich | AC426380100 | 1 M |
| Iodoacetamide | Sigma Aldrich | A322-10VL | |
| LC/MS grade water | Thermofisher Scientific | 047146.M6 | |
| PNGase F | Bulldog Bio | NZPP010 | 75000 U/mL, enzyme for N-glycan release |
| N-glycan isolation and IR-MALDESI consumables | |||
| Amicon centrifugal filters | Fisher Scientific | UFC501024 | 10 kDa MWCO |
| Mass spectrometer | Orbitrap Exploris 240 | ||
| Mid-IR Laser | JGM Associates, Burlington, MA, USA | ||
| Teflon microwell slide | Prosolia, Indianapolis, IN, USA | ||
| N-glycan analysis softwares | |||
| GlycoMod | Expasy | https://web.expasy.org/glycomod/ | |
| GlyConnect | Expasy | https://glyconnect.expasy.org/ | |
| Protein isolation and western blot consumables | |||
| Basix gel loading tips ( 10 µL) | Basix | 13-611-102 | |
| Basix gel loading tips ( 200 µL) | Basix | 13-611-116 | |
| Cell scrapper | VWR labs | 14-388-100 | |
| i-Blot NC regular stacks | Invitrogen | IB23001 | |
| i-Blot2 PVDF Regular Stacks | Invitrogen | IB24001 | |
| 10 µL micropipette | Fisher Scientific | FBE00010 | |
| 20 µL micropipette | Invitrogen | FBE00020 | |
| 200 µL micropipette | Fisher Brand | FBE00200 | |
| 1000 µL micropipette | Fisher brand | FBE01000 | |
| 10 µL pipet tips | VWR labs | 76322-528 | |
| 20 µL pipet tips | VWR labs | 76322-134 | |
| 200 µL pipet tips | VWR labs | 76322-150 | |
| 1000 µL pipet tips | VWR labs | 76322-154 | |
| Well plate | Fisher brand | 14-388-100 | |
| Protein isolation and western blot reagents | |||
| Actin antibody ( Host : Rabbit ) | Cell Signaling Technologies | 8457T | |
| Anti-Rabbit IgG HRP Linked | Cell Signaling Technologies | 7074S | |
| Bolt 4-12% Bis-Tris Plus | Invitrogen | NW04120BOX | |
| Bovine Serum Albumin | Fisher bioreagents | BP9700-100 | |
| COXIV antibody ( Host : Rabbit) | Cell Signaling Technologies | 4844S | |
| GAPDH antibody ( Host : Rabbit) | Cell Signaling Technologies | 2118S | |
| MicroBCA protein assay Kit | Thermofisher scientific | 23235 | |
| Nupage MOPS SDS Runing Buffer [20x] | Thermofisher scientific | NP0001 | |
| PAGE Ruler prestained protein ladder | Thermofisher scientific | 815-968-0747 | Dilution= Use 7 µL to load onto first well |
| Phosphate buffered saline | Aniara Diagnostics | A12-9423-5 | Prepare 1x PBS from 10x powder |
| Pierce ECL Western Blotting Substrate | Thermofisher scientific | 32106 | Chemiluminescent substrate kit |
| RIPA Buffer | Thermofisher scientific | 89901 | |
| Sample Buffer | Novex | B0007 | The bolt LDS sample buffer is prepared in 3:1 ratio of sample to sample buffer |
| Tween-20 | MP Biomedicals | TWEEN201 | |
| Tissue culture consumables | |||
| Countess Slides | Avantor | 229411 | |
| Eppendorf tubes | Cell Treat | 414004-265612-5884 | |
| 2 mL aspirating pipet | Vista lab | 5090-0010E | |
| 5 mL serological pipet | Fisher Scientific | 13-678-11D | |
| 10 mL serological pipet | Basix | 13-678-11E | |
| 25 mL serological pipet | Vista lab | FB012937 | |
| 50 mL serological pipet | Vista lab | 14955233 | |
| 15 mL Conical tube | Avantor | 229225A | |
| 50 mL conical tube | Cell treat | 4190-0050 | |
| T-75 cm2 Tissue culture flask | Fisher Scientific | FB012937 | |
| T-180 cm2 Tissue culture flask | Fisher Scientific | FB012939 | |
| Tissue culture reagents | |||
| BV2 microglial cell line | Creative Bioarray | CSC-I2227Z | Immortalized Mouse Microglia (BV2) derived from C57/BL6 neonatal microglia |
| Cell dissociation enzymes | Thermofisher scientific | 12563029 | TrypLE |
| Dulbecco's Modified Eagle Medium (DMEM) Low Glucose Media | Gibco | 10567014 | |
| Fetal Bovine Serum | Cytiva | SH30071.03HI | |
| Minimum Essential Medium (MEM) Non-essential Amino Acids | Gibco | 11140050 | |
| Penicillium Streptomycin | Cytivia | SV30010 | |
| Phosphate buffer saline | Corning | 21-040-CV | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 |
참고문헌
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유