Method Article
הכנה מיטוכונדריאלית ממיקרוגליה לניתוח גליקן
In This Article
Summary
פותח פרוטוקול להכנת מיטוכונדריה מטוהרת מתאי מיקרוגליה, בידוד חלבונים מיטוכונדריאלים לשחרור N-גליקן, וזיהוי מהיר של גליקנים תת-תאיים, מיטוכונדריאלים באמצעות יינון אלקטרו-ספריי לייזר בעזרת מטריצת אינפרא אדום יחד עם ספקטרומטריית מסה מדויקת ברזולוציה גבוהה.
Abstract
הבנת דפוסי הגליקוזילציה של חלבונים מיטוכונדריאלים במיקרוגליה היא קריטית לקביעת תפקידם במחלות ניווניות. כאן, אנו מציגים מתודולוגיה חדשה ובעלת תפוקה גבוהה לניתוח גליקומי של חלבונים מיטוכונדריאלים המבודדים ממיקרוגליה מתורבתת. שיטה זו כוללת בידוד של מיטוכונדריה מתרביות מיקרוגליה, הערכת איכות של דגימות מיטוכונדריה, ואחריה מיצוי חלבון אופטימלי כדי למקסם את זיהוי הגליקן, וספקטרומטריית מסה ברזולוציה גבוהה (HRAM) של יינון לייזר בעזרת מטריצת אינפרא אדום (IR-MALDESI) כדי לספק פרופילים מפורטים של גליקוזילציה מיטוכונדריאלית.
פרוטוקול זה מדגיש את החשיבות של שמירה על שלמות המיטוכונדריה במהלך הבידוד ומשתמש בבקרת איכות קפדנית כדי להבטיח שחזור, כולל מדידת טוהר המיטוכונדריה לאחר המיצוי. גישה זו מאפשרת פרופיל מקיף של שינויי גליקוזילציה במיטוכונדריה של מיקרוגליה בתנאי ניסוי שונים במבחנה, מה שמציע תובנה לגבי שינויים מיטוכונדריאלים הקשורים למחלות ניווניות. גישה זו יכולה להיות מותאמת לטיפולים אחרים במבחנה , סוגי תאים מתורבתים אחרים או תאים ראשוניים. באמצעות גישה סטנדרטית זו, אנו שואפים לקדם את ההבנה של גליקנים מיטוכונדריאלים של מיקרוגליה, ולתרום לתחום הרחב יותר של מחקר נוירודגנרטיבי.
Introduction
מיקרוגליה הם תאי החיסון המולדים הדומיננטיים במוח ומהווים 10-15% מהתאים במוח הבוגר 1,2. הם משתמשים ברפרטואר הקולטנים שלהם כדי לנטר באופן דינמי את המיקרו-סביבה במוח ולווסת את תפקוד המוח הרגיל כדי לשמור על הומאוסטזיס במוח3. מיקרוגליה רגישים מאוד לשינויים במיקרו-סביבה שלהם ועוברים שינויים במורפולוגיה של התא, באימונופנוטיפ ובתפקוד עם מצבים פתולוגיים או גירויים שונים. מצבי הפעלה של מיקרוגליה מושפעים מדרישות האנרגיה התאית הנדרשות לתפקודם, כגון פגוציטוזיס, ייצור ציטוקינים או תיקון רקמות. לכן, חילוף החומרים של האנרגיה התאית ממלא תפקיד מכריע בוויסות שינויים בתפקוד המיקרוגליה4. חוסר ויסות מיקרוגליה מוביל לשחרור מוגזם של ציטוקינים פרו-דלקתיים (למשל, IL-1β, TNF-α) ומיני חמצן תגובתיים (ROS), מה שגורם למוח לדלקת עצבית 5,6. חוסר ויסות כרוני של מיקרוגליה והסביבה הנוירו-דלקתית הנובעת מכך מניחים את הבסיס לניוון עצבי7.
המוח מהווה רק 2% ממשקל הגוף אך 20% מסך צריכת האנרגיה של הגוף. מיטוכונדריה הם מקור האנרגיה העיקרי בתאי המוח ופועלים כשחקני מפתח בפתוגנזה של הפרעות מוח חריפות וכרוניותכאחד. מחקרים קודמים ביססו מתאם חזק בין הפעלת מיקרוגליה ותפקוד מטבולי לקוי בגיל9 והפרעות הקשורות לגיל כמו מחלת אלצהיימר10,11, והדגישו את התפקיד המרכזי של המיטוכונדריה בהזדקנות תאית וניוון עצבי. תפקוד לקוי של המיטוכונדריה מוביל לירידה בייצור האנרגיה, לעקה חמצונית מוגברת ולעלייה בדלקת עצבית במהלך הזדקנות ומחלות הקשורות לגיל.
בעוד שמחקר מקיף הבהיר את תפקיד המיטוכונדריה בחילוף חומרים אנרגטי, הזדקנות והפרעות מוחיות, תפקידם של שינויים נפוצים לאחר תרגום, כגון גליקוזילציה, בביולוגיה ובתפקוד המיטוכונדריה עדיין לא נחקר מספיק. גליקוזילציה, התוספת האנזימטית של חלקי סוכר הנקראים גליקנים לחלבונים על ידי אנזימי גליקוזילציה, היא השינוי הנפוץ ביותר לאחר התרגום ברוב תאי המוח, כולל מיקרוגליה. מיקרוגליה מופעלת מווסתת את תפקודם החיסוני תחת גירויים דלקתיים על ידי ויסות ביטוי הגליקן התוך-תאי או פני התא12. התגובות הפרו-דלקתיות והאנטי-דלקתיות המוצגות על ידי מיקרוגליה לאחר גירוי מווסתות גם על ידי הגליקנים13. לחלבונים מיטוכונדריאלים יש גם שינויים גליקניים אלה, המווסתים את תפקודם ולוקליזציה. עם זאת, ניתוח מפורט של דפוסי הגליקוזילציה המיטוכונדריאלית הספציפיים לתא במיקרוגליה חסר בשל האתגרים הטכניים בחקירת גליקוזילציה תת-תאית. למרות התפקידים המאופיינים היטב של גליקוזילציה בוויסות הפנוטיפ של המיקרוגליה, תפקידם של גליקנים בוויסות תפקוד המיטוכונדריה וכתוצאה מכך, אימונופנוטיפ תאי במיקרוגליה נותר לא מובן היטב.
מחקרים מוגבלים שחקרו גליקוזילציה של חלבון מיטוכונדריאלי התמקדו בעיקר בזיהוי מבוסס לקטין של דפוסי גליקוזילציה. לקטינים הם חלבונים קושרי גליקן הקושרים חלקי גליקן ביומולקולריים14,15, חסרי הספציפיות והיכולת לספק מידע מפורט על הרכב הגליקן. שיטות ספקטרומטריות מסה מציעות זיהוי מפורט של הרכבי הגליקן כדי להתגבר על האתגרים האנליטיים שמציב ניתוח הלקטין . שיטה אחת כזו, יינון אלקטרו-ספריי בלייזר בעזרת מטריצת אינפרא אדום (IR-MALDESI), משתמשת באסטרטגיית יינון היברידית, תוך שימוש בלייזר אמצע IR כדי לעורר באופן מהדהד מים המצויים בדגימות ביולוגיות16 כדי לספוג את המינים הנייטרליים ולהכפיף אותם לפלומת אלקטרוספריי אורתוגונלית, ולאחר מכן ניתוח באמצעות ספקטרומטר מסה מדויק ברזולוציה גבוהה של Orbitrap. IR-MALDESI הוכח בעבר לניתוח ישיר של מטבוליטים של רקמות17, עם יתרונות מובהקים של ניתוח מהיר18, שיטת יינון רך ויכולת החיזוי של תכולת חומצה סיאלית של גליקנים מקושרים ל-N בהתבסס על דפוסי ההתפלגות האיזוטופיים של תוספות גליקן כלוריות19. עם זאת, לא הוכחה התאמה של פלטפורמה זו לניתוח ישיר של גליקנים תת-תאיים.
כאן, אנו מדווחים על פרוטוקול תפוקה גבוהה לבידוד מיטוכונדריאלי מתאי מיקרוגליה, בידוד של N-גליקנים מיטוכונדריאלים וזיהוי וניתוח N-גליקן מיטוכונדריאלי באמצעות ספקטרומטריית מסה IR-MALDESI. פרוטוקול זה יהיה בסיסי בחשיפת תובנות חדשות לגבי תפקיד הגליקוזילציה בתפקוד המיטוכונדריה, ועשוי לזהות מטרות טיפוליות חדשות להפרעות נוירו-דלקתיות ונוירודגנרטיביות.
Protocol
1. תרבית קו תאים BV2 Microglial
- שמור על תאי BV-2 (תאי מיקרוגליה שמקורם בעכברים C57BL/6) במצע גלוקוז נמוך DMEM בתוספת 10% סרום בקר עוברי (FBS), 1% פניציליום-סטרפטומיצין (PenStrep) ו-1% חומצות אמינו לא חיוניות (NEAA).
- לגדל את התאים בצלוחיות T-175 ולאפשר להם להגיע למפגש של 70-80%.
- פיצול התאים על ידי דגירה עם אנזימי דיסוציאציה של התאים למשך 5 דקות ב-37 מעלות צלזיוס ב-5% CO2, ולאחר מכן השבתת האנזימים עם נפח שווה של מדיה תאית, וצנטריפוגה של תאים למשך 5 דקות ב-500 × גרם בטמפרטורת החדר (RT).
הערה: אנזימי הדיסוציאציה של התאים המשמשים כאן עדינים יותר על תאי BV2 מאשר טריפסין וניתן להשתמש בהם כדי להגן על ביטוי האנטיגן על פני התא. - שאפו את המדיה, השעו מחדש את כדור התא ב-1 מ"ל של מצע גידול, וספרו את התאים באמצעות טריפן כחול (ראה טבלת החומרים).
הערה: השתמשנו במונה תאים אוטומטי לשלב זה כדי לספור תאים. - כדי לבצע את הבידוד המיטוכונדריאלי, המשך אם כדור התא מכיל 2 × 107 (20 מיליון תאים / גלולה).
2. בידוד המיטוכונדריה מתאי מיקרוגליה
הערה: עבדו במהירות, שמרו על הכל על הקרח לאורך כל ההליך. ערכת הבידוד המיטוכונדריאלי המשמשת לבידוד מיטוכונדריאלי כוללת שלושה מרכיבים: ריאגנטים A (מאגר ליזיס תאים), מגיב B (מאגר מייצב) ומגיב C (מאגר שטיפה מיטוכונדריאלי). הוסף מעכבי פרוטאז למגיב A ולמגיב C מיד לפני השימוש.
- גלולה 2 × 107 תאים על ידי צנטריפוגה של תאים שנקטפו בצינור מיקרו-צנטריפוגה של 2.0 מ"ל ב-500 × גרם למשך 5 דקות. שאפו בזהירות והשליכו את הסופרנטנט.
- הוסף 800 מיקרוליטר של מגיב בידוד מיטוכונדריאלי A (מאגר ליזיס תאים), מערבולת במהירות בינונית למשך 5 שניות, ודגר את הצינור על קרח למשך 2 דקות בדיוק.
הערה: אל תחרוג מהדגירה של 2 דקות. - הוסף 10 מיקרוליטר של מגיב בידוד מיטוכונדריאלי B (חיץ מייצב), מערבולת במהירות מקסימלית למשך 5 שניות, ודגר את הצינור על קרח למשך 5 דקות, מערבולת במהירות מקסימלית בכל דקה.
- הוסף 800 מיקרוליטר של מגיב בידוד מיטוכונדריה C (מאגר שטיפה מיטוכונדריאלי), הפוך את הצינור מספר פעמים לערבוב, וצנטריפוגה את הצינור ב-700 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
הערה: אין מערבולת. - העבירו את הסופרנטנט לצינור חדש של 2.0 מ"ל וסובבו ב-3,000 × גרם למשך 15 דקות ב-4 מעלות צלזיוס.
- העבירו את הסופרנטנט (חלקים ציטוזוליים) לצינור חדש. הגלולה מכילה את המיטוכונדריה המבודדת.
- הוסף לגלולה 500 מיקרוליטר של מגיב בידוד מיטוכונדריה C, וצנטריפוגה ב-12,000 × גרם למשך 5 דקות.
- השתמש בגלולה לכימות ועיבוד חלבון או אחסן את הגלולה ב-80 מעלות צלזיוס עד לשימוש נוסף.
3. הערכת חלבון באמצעות בדיקת microBCA
הערה: ניתן לבצע הערכת חלבון לפרוטוקול זה באמצעות ריאגנטים ובדיקות שונות. ניתן לבצע כימות של חלבונים ציטוזוליים או מיטוכונדריאלים על ידי נורמליזציה כנגד ריכוז החלבון הכולל המשמש בבדיקה.
- הכן תקני אלבומין בסרום בקר (BSA) בין 0 מיקרוגרם/מ"ל ל-200 מיקרוגרם/מ"ל (0 מיקרוגרם/מ"ל, 0.5 מיקרוגרם/מ"ל, 1 מיקרוגרם/מ"ל, 2.5 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל, 10 מיקרוגרם/מ"ל, 20 מיקרוגרם/מ"ל, 40 מיקרוגרם/מ"ל, 200 מיקרוגרם/מ"ל) וריקים עם מאגר ליזה בלבד.
- הוסף 150 מיקרוליטר מכל תקן לצלחת 96 הבארות בעלת התחתית השטוחה המכילה את הדגימות.
- מערבבים 25 חלקים של Micro BCA Reagent MA (תמיסת חומצה ביצינצ'ונינית (BCA)) ו-24 חלקים Reagent MB (תמיסת נחושת גופרתית) עם חלק אחד של Reagent MC (מאגר מייצב) (25:24:1, Reagent MA:MB:MC) ליצירת מגיב עובד. הוסף 150 מיקרוליטר של מגיב BCA מעורב לכל דגימה ותקן.
- יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים.
- השתמש בקורא צלחות כדי למדוד את הספיגה ב-562 ננומטר ולכמת את ריכוז החלבון עם העקומה הסטנדרטית. הפחיתו את הספיגה הסטנדרטית הריקה ממדידת הספיגה של כל התקנים הבודדים האחרים ושכפולי דגימה לא ידועים כדי לקבל את ריכוזי החלבון בדגימה.
4. בקרת איכות תכשיר מיטוכונדריאלי (כתם מערבי)
- השעו מחדש את הגלולה המיטוכונדריאלית במאגר בדיקת הרדיו-אימונו-משקעים (RIPA) כדי לבצע כימות חלבון. קבע את ריכוז החלבון עבור כל דגימה באמצעות בדיקת מיקרו BCA.
- דנטורציה של הדגימות במאגר הדגימה בטמפרטורה של 94 מעלותצלזיוס למשך 5 דקות.
- טען כמויות שוות (20 מיקרוגרם) של חלבון מיטוכונדריאלי לג'לים טרומיים (ראה טבלת חומרים), יחד עם סמן המשקל המולקולרי.
- הפעל את הג'ל למשך 50 דקות ב 100 וולט.
הערה: זמן הריצה עשוי להשתנות, לכן הקפד לעצור את הג'ל כאשר החלבונים הגיעו לקצה הג'ל המצוין על ידי הצבע במאגר הדגימה. - העבירו את החלבונים מהג'ל לקרום פלואוריד פוליווינילידן (PVDF) באמצעות פרוטוקול ההעברה היבשה במערכת העברת כתמים מערבית למשך 7 דקות ב-20 וולט.
- הוצא את הממברנה וחסום באמצעות תמיסת החסימה (טבלה 1) למשך שעה בטמפרטורת החדר.
- הוסף דילולים מתאימים של נוגדן ראשוני לממברנה בחסימת המאגר למשך הלילה ב-4 מעלות צלזיוס(COXIV = 1:3,000, GAPDH = 1:3,000).
הערה: ניתן לבדוק את היעדר זיהום גרעיני, רשתית אנדופלזמית (ER) בתכשיר המיטוכונדריאלי על ידי שימוש בסמנים נוספים כמו למין (סמן גרעיני) ו-ERp57 (סמן ER) בכתמים מערביים. - שטפו את הממברנה למשך 3 x 15 דקות עם מאגר הכביסה (טבלה 1).
- לדגור את הממברנה עם הדילול המתאים של נוגדן משני מצומד HRP בחסימת מאגר בטמפרטורת החדר למשך שעה
- שטפו את הממברנה למשך 3X15 דקות עם מאגר הכביסה.
- לפיתוח, השתמש בערכת מצע כימילומינסצנטית.
- סרוק את הממברנה באמצעות הדמיית ג'ל וממברנה.
5. בידוד חלבון מיטוכונדריאלי למיצוי N-glycan ממיקרוגליה
- השעו מחדש את המיטוכונדריה המבודדת ב-50 מיקרוליטר של מאגר בידוד חלבון (טבלה 1) והשאירו על הקרח למשך 20 דקות.
- יש לשאוב ולהוציא שלוש פעמים ולהשאיר 20 דקות על קרח (מערבולת לפני השימוש). אם הגלולה המיטוכונדריאלית אינה מסיסה במלואה, הוסף עוד 50 מיקרוליטר של מאגר הבידוד ובריכה לאותו צינור.
- צנטריפוגה במשקל 13,000 × גרם למשך 10 דקות.
- שחזרו את הסופרנטנט, הקפיאו בטמפרטורה של -80 מעלות צלזיוסלמשך שעה אחת לפחות, וייבשו כמה שיותר ברכז ואקום.
- השעו לפני בידוד הגליקן באמצעות מאגר העיכול PNGase (טבלה 1) עבור IR-MALDESI.
6. הכנת N-glycan מיטוכונדריאלית עבור IR-MALDESI
- טען 25-250 מיקרוגרם חלבון (בנפח מקסימלי של 250 מיקרוליטר) של חלבונים מיטוכונדריאלים מבודדים על מסנן חיתוך משקל מולקולרי (MWCO) של 10 kDa.
- צמצם את דגימות החלבון כדי לחשוף את חלקי הגליקן על ידי הוספת 2 מיקרוליטר של 1 M dithiothreitol (DTT) לכל דגימה במסנן.
- יש לדלל את הדגימה ב-200 מיקרוליטר של מאגר עיכול PNGase ומערבולת קלות כדי למנוע הפרעה למסנן.
- דנטורציה של החלבונים המיטוכונדריאלים על ידי דגירה של הדגימה ב-56 מעלות צלזיוס למשך 30 דקות.
- השתמש ב-50 מיקרוליטר של 1 M יודואצטמיד כדי לאלקילאט את המיטוכונדריה כדי לתת ריכוז סופי של ~200 מ"מ, ולדגור ב-37 מעלות צלזיוס למשך 60 דקות.
- כדי לרכז עוד יותר את השיטות המיטוכונדריאליות המפורקות, צנטריפוגה את הדגימות ב-14,000 × גרם למשך 40 דקות. השלך את הזרימה.
- שטפו את הדגימה עם 100 מיקרוליטר של מאגר עיכול PNGase.
- רכז את הגליקופרוטאין על המסנן ב-14,000 × גרם למשך 20 דקות והשליך את הזרימה. חזור על שלב הכביסה והתרכיז פעמיים, בסך הכל פי 3, ומניב תרכיז בנפח המת של המסנן (~5 מיקרוליטר). השליכו את כל הזרימה.
- השלך את בקבוקון האיסוף לאחר השלמת השטיפות. השתמש בבקבוקון אוסף חדש לכל חומרי הניקוי והשטיפות העתידיות.
- כדי לבקע את הגליקנים מתבניות גליכונדריאליות שעברו דנטורציה, העבירו לבקבוקון איסוף טרי והוסיפו 2 מיקרוליטר של PNGase נטול גליצרול (75,000 יחידות/מ"ל) למסנן. הוסף 98 מיקרוליטר של מאגר עיכול PNGase, והביא את הנפח הכולל ל-100 מיקרוליטר וערבב על ידי פיפטינג עדין למעלה ולמטה על המסנן.
- דגירה של דגימות בטמפרטורה של 37 מעלות צלזיוס למשך 18 שעות כדי לבקע אנזימטית את כל ה-N-גליקנים מחלבונים מיטוכונדריאליים.
- לחסל את ה-N-גליקנים המיטוכונדריאלים המשוחררים על ידי צנטריפוגה של הדגימה ב-14,000 × גרם למשך 20 דקות ב-20 מעלות צלזיוס.
- שטפו את הגליקנים המיטוכונדריאלים על ידי הוספת 100 מיקרוליטר של חוצץ עיכול PNGase למסנן ולצנטריפוגה ב-14,000 × גרם למשך 20 דקות ב-20 מעלות צלזיוס. אסוף את הכביסה המכילה את כל ה-N-גליקנים שנותרו באותו בקבוקון איסוף כמו חומר הנוזל. חזור על הפעולה פעמיים והסר את המסנן מבקבוקון האיסוף.
- דגרו את דגימות הגליקן המיטוכונדריאלי במקפיא של -80 מעלות צלזיוס עד להקפאה (30-60 דקות) וייבשו עד להשלמה בטמפרטורת החדר ברכז ואקום (4-6 שעות עבור 400 מיקרוליטר).
הערה: ניתן לאחסן N-גליקנים בטמפרטורה של -20 מעלות צלזיוס עד 6 חודשים לפני הניתוח. - השעו מחדש את הגליקנים המיובשים המקושרים ל-N ב-50 מיקרוליטר של מים בדרגת LC/MS ישירות לפני ניתוח IR-MALDESI.
7. איתור גליקנים משוחררים על ידי ספקטרומטריית מסה IR-MALDESI
- בצע כיול מסה בכל יום של הניסוי. טען את תמיסת הכיול על משאבת מזרק ודחף דרכה בקצב של 1.2 מיקרוליטר לדקה. הפעל מתח של 3.5 קילו וולט כדי להשיג פלומת אלקטרוספריי יציבה לכיול מסה במצב חיובי ושלילי כאחד.
- פיפטה 5 מיקרוליטר של גליקנים מיטוכונדריאלים תלויים על נקודת דגימה על מגלשת מיקרובאר טפלון.
- השתמש בלייזר אמצע IR הפועל באורך גל של 2.97 מיקרומטר לאבלציה עם אנרגיה של 1.8 mJ לכל פרץ.
- יינון וזיהוי N-גליקנים במצב יינון שלילי. השתמש בממס אלקטרוספריי המורכב מ-60% אצטוניטריל וחומצה אצטית של 1 מ"מ כדי ליצור פלומת אלקטרו-ספריי יציבה עם קצב זרימה של 2 מיקרוליטר לדקה במתח של 3.2 קילו וולט.
- כדי לבצע את הניתוח, חבר IR-MALDESI לספקטרומטר מסה HRAM המוגדר לעוצמת פתרון מסה של 240,000FWHM ב-m/z 200, תוך ניתוח בין 500 ל-2,000 m/z במצב יינון שלילי.
- כבה את בקרת הרווח האוטומטית (AGC) והגדר זמן הזרקה קבוע של 90 אלפיות השנייה. השתמש במקור EasyIC עבור כיול פנימי בזמן-אמת של כל ספקטרום כדי להשיג דיוק מדידת מסה גבוה (MMA).
8. ניתוח נתוני N-glycan מיטוכונדריאלי
- זהה ידנית את הגליקנים המקושרים ל-N על ידי חיפוש מסות מונואיזוטופיות ואישור התפלגויות איזוטופיות באמצעות מרווח m/z כדי לקבוע יונים טעונים כפולים ומשולשים בעלי סף שטף יונים מינימלי של 1,000 יונים לשנייה.
- המר את ספקטרום המסה הגולמי מיחסי m/z למסות מונואיזוטופיות ניטרליות.
- העלה את המסות המונואיזוטופיות לכלי מקוון לחיזוי מבנה אוליגוסכריד כדי לקבוע הרכבי גליקן פוטנציאליים. אשר ביאורים באמצעות מסד נתונים גליקומי שנאסף בניסוי20; ודא שכל זיהוי נמצא בשוליים של 2.5 ppm MMA, מכיל את מבנה הליבה הגליקני המקושר ל-N (Hex3HexNAc2), ואינו כולל פנטוז, KDN או HexA חד-סוכרים.
- צייר את מבני הגליקן המאושרים באמצעות מינוח SNFG21.
- השג את השפע היחסי של גליקנים מספקטרום המסה הגולמית ונרמל כנגד כמות החלבון המיטוכונדריאלי במיקרוגרם כדי להשיג יונים/ש/מיקרוגרם.
- השתמש בניתוח חי בריבוע כדי לבדוק את מידת ההתאמה בין ההתפלגות התיאורטית והניסויית של הגליקנים המקושרים ל-N כדי לקבוע את מספר תוספות הכלור. זה מאפשר קביעה ישירה של מספר החומצות הסיאליות19.
תוצאות
איור 1 מייצג מתאר סכמטי של השלבים הכרוכים בבידוד המיטוכונדריה מקו תאי המיקרוגליה BV2 לניתוח גליקן ספקטרומטרי מסה. יכולת השחזור של בידוד חלבון מיטוכונדריאלי בין תכשירים מיטוכונדריאלים שונים מאותה צפיפות התחלתית של תאי המיקרוגליה מיוצגת באיור 2, אשר אינו מראה הבדל משמעותי בין ריכוז החלבון המיטוכונדריאלי המוערך באמצעות בדיקת מיקרו BCA.
איור 3 מייצג את טוהר הבידוד המיטוכונדריאלי באמצעות ניתוח כתמים מערביים של COX IV ו-GAPDH. כאן, אנו רואים את הביטוי של החלבון המיטוכונדריאלי COX IV במקטע המיטוכונדריאלי המבודד בשלב האחרון של הבידוד מבוסס הריאגנט המשמש בפרוטוקול. הכתמים החיסוניים מראים פס COX IV בולט במקטע המיטוכונדריאלי המבודד, בעוד ש-GAPDH מתגלה רק במקטע הציטופלזמי באותה חשיפה. זמני חשיפה ארוכים יותר עלולים לגרום לזיהוי של פס GAPDH חלש. ביטוי הסמן הלא מיטוכונדריאלי GAPDH ניכר בליזאט התא כולו לאחר בידוד המיטוכונדריה, ללא רצועות CoxIV, מה שמעיד על בידוד מוחלט של המקטע המיטוכונדריאלי וזיהום מינימלי שאינו מיטוכונדריאלי. ביטוי COX IV בשברים המיטוכונדריאלים עקבי בין תכשירים שונים עם צפיפות תאים התחלתית דומה של 2 × 107 תאים.
ספקטרום מסה מייצג של ה-N-גליקנים המשוחררים שזוהה באמצעות IR-MALDESI באיור 4 מראה את נוכחותם של מספר N-גליקנים טעונים זרחניים, סולפטיים וסיאליליים המשתחררים מתמצית החלבון המיטוכונדריאלי באמצעות טיפול ב-PNGase. טבלה 2 מדווחת על כל הרכבי הגליקן שזוהו בכל הספקטרום אך לא דווחו ב-GlyConnect. ערכי חי בריבוע הבודקים התאמה טובה מאשרים את הזיהוי של גליקנים המקושרים ל-N עם תוספות כלור אחת ושתיים, ומאשרים את הזיהוי של קומפוזיציות גליקן אלה באמצעות IR-MALDESI באיור 5.
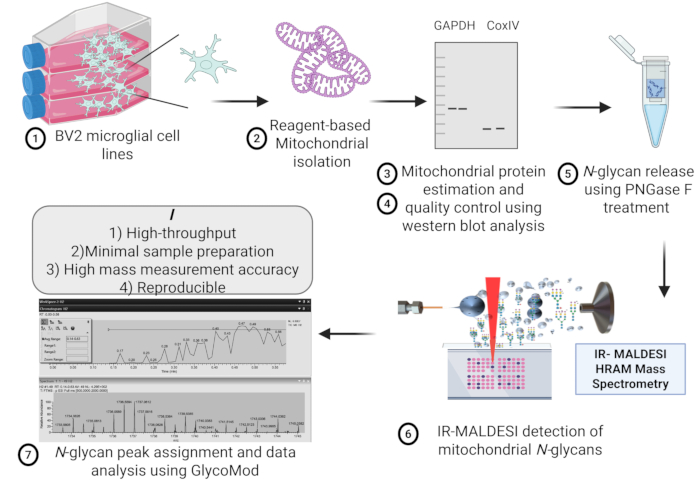
איור 1: מתווה פרוטוקול. מתאר סכמטי של הבידוד המיטוכונדריאלי, בקרת איכות, מיצוי חלבון, שחרור N-גליקן והערכה באמצעות ספקטרומטריית מסה IR-MALDESI HRAM מקו תאי מיקרוגליה BV2 לזיהוי תפוקה גבוהה של N-גליקנים מיטוכונדריאלים. קיצור: IR-MALDESI HRAM = מנתח מסה מדויק ברזולוציה גבוהה של ספיגת לייזר בסיוע מטריקס אינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
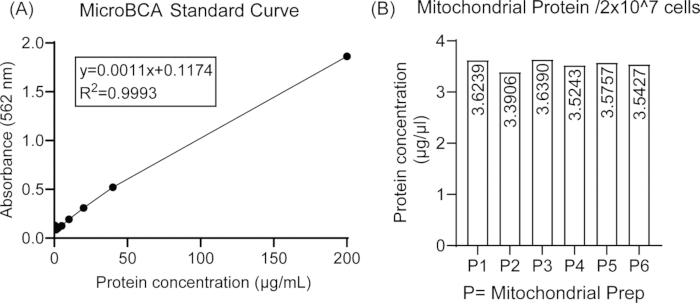
איור 2: בידוד חלבון מיטוכונדריאלי מתאי BV2. (A) עקומה סטנדרטית לבדיקת מיקרו BCA באמצעות ריכוזים שונים של BSA. (B) שחזור של בידוד החלבון המיטוכונדריאלי המיוצג על ידי תכולת חלבון עקבית מ-2 × 107 תאים בשישה תכשירים מיטוכונדריאלים עצמאיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
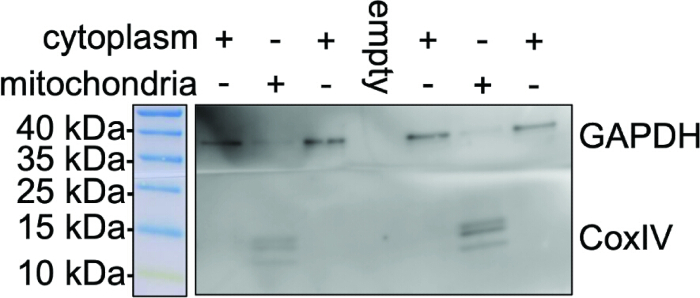
איור 3: טוהר ההכנה המיטוכונדריאלית. כתם מערבי מייצג לשבר ציטופלזמי כמו גם מיטוכונדריה מבודדת מתאי מיקרוגליה BV2. האיור מייצג אימונובלוטינג של המקטע הציטופלזמי והמיטוכונדריה המבודדת עם נוגדן COX IV (סמן מיטוכונדריאלי) ונוגדני GAPDH (בקרה ציטופלזמית). היעדר רצועות GAPDH במיטוכונדריה המבודדת מעיד על זיהום צולב מינימלי וטוהר ההכנה המיטוכונדריאלית לניתוח N-גליקן לאחר מכן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
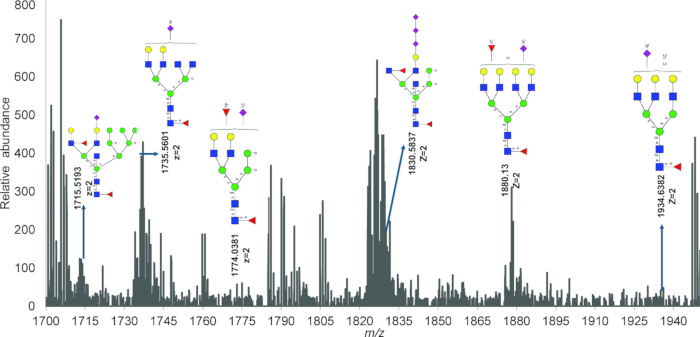
איור 4: קביעת הרכב זיהוי N-גליקן מיטוכונדריאלי באמצעות ספקטרומטריית מסה IR-MALDESI HRAM. ספקטרום מסת גליקן בטווח של 1,700-2,000 m/z המציג מספר משמעותי של פסגות טעונות כפולות עם המבנים המבוארים שנקבעו באמצעות גליקומוד. קיצור: IR-MALDESI HRAM = מנתח מסה מדויק ברזולוציה גבוהה של ספיגת לייזר בסיוע מטריקס אינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
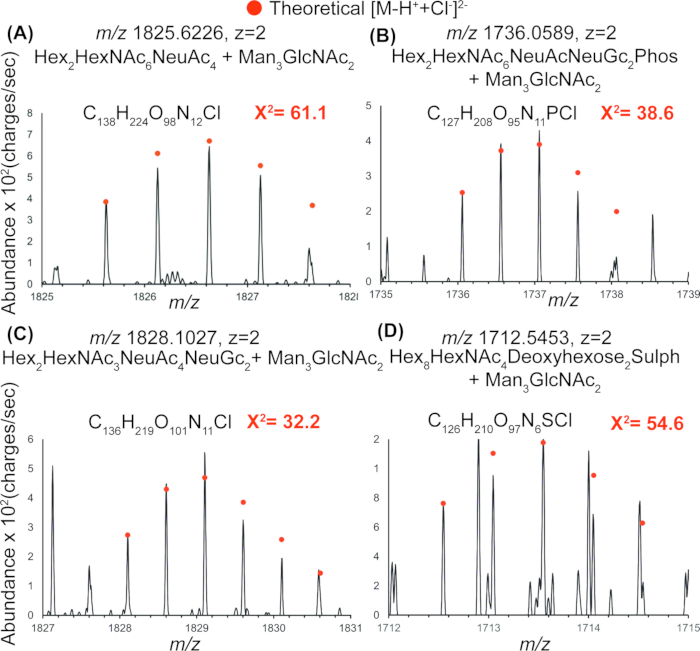
איור 5: אימות ה-N-גליקנים המיטוכונדריאלים שזוהו. התפלגויות איזוטופיות מייצגות עבור ארבעה גליקנים מקושרים ל-N מיטוכונדריאלי (A-D) המראים שכבת-על של ההתפלגות הנצפית עם התפלגויות תיאורטיות של כלור ותוספות דה-פרוטונציות. ערכי חי בריבוע על הספקטרום המונח מייצגים את טוב ההתאמה ומאשרים את הזיהוי של גליקנים המקושרים ל-N עם תוספות כלור אחת ושתיים. זהו אישור נוסף לזיהוי תרכובות גליקן אלה באמצעות IR-MALDESI. קיצור: IR-MALDESI = יינון אלקטרו-ספריי לייזר בעזרת מטריצת אינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: מתכוני תמיסה ומאגר המשמשים בפרוטוקול. אנא לחץ כאן להורדת טבלה זו.
טבלה 2: M גליקנים מקושרים ל-N טעונים באופן אולטימטיבי שזוהו במיטוכונדריה עם דיוק מדידת מסה גבוה בגליקומוד. סימון קצר גליקן: H = hexose; N = N-אצטיל גלוקוזאמין; F = פוקוז; S = חומצה N-אצטילנוראמינית; פוס = פוספט; גופרית = שינוי סולפט. אנא לחץ כאן להורדת טבלה זו.
Discussion
מיקרוגליה הם תאי החיסון השוכנים במוח, ושינויים בגליקן מווסתים את האימונופנוטיפ והתפקוד של מיקרוגליה. תפקודים חיסוניים אלה דורשים אנרגיה תאית משמעותית, המסופקת בעיקר על ידי מיטוכונדריה. יש לציין כי החלבונים המיטוכונדריאלים מציגים גם שינויים בגליקן, שנותרו לא נחקרים באופן משמעותי בשל האתגרים הטכנולוגיים בחקירת גליקוזילציה תת-תאית. רוב המחקרים החוקרים גליקוזילציה מיטוכונדריאלית מסתמכים על זיהוי מבוסס לקטין של דפוסי גליקן22, אם כי גישות אלה מוגבלות על ידי ספציפיות הקישור הירודה של לקטינים. ההתקדמות החיונית של הגישה הטכנית המוצגת במחקר זה היא 1) בידוד ניתן לשחזור של N-גליקנים מיטוכונדריאלים מתאי מיקרוגליה ו-2) זיהוי וזיהוי של N-גליקנים מיטוכונדריאלים באמצעות ספקטרומטריית מסה IR-MALDESI HRAM. זרימת העבודה המתוארת כאן היא הדיווח הראשון על זיהוי N-גליקנים המשתחררים מגליקופרוטאינים מיטוכונדריאלים המתבטאים ברמות פיזיולוגיות בתאי מיקרוגליה.
בפרוטוקול הנוכחי, בידוד המיטוכונדריה ממקסם על ידי שימוש בשיטת בידוד מבוססת ריאגנטים. ניתן לשלב זאת עם שיטת ההומוגניזציה של Dounce כדי לשפר את התשואה המיטוכונדריאלית. החיסרון בשימוש בהומוגניזטור בהשוואה לבידוד מבוסס ריאגנט הוא השונות בכוח ובמהירות של העלי בין המפעילים, מה שמביא לשונות ניסיונית מוגברת ולהפחתת יכולת השחזור. מחקרים קודמים23,24 הצביעו על שימוש בשיטה זו ועל היעדר סמנים גרעיניים (למין, היסטון H3) ו-ER (קלנקסין, Erp57) בשבר המיטוכונדריאלי, המעידים על טוהר השבר המיטוכונדריאלי. מגבלה פוטנציאלית של הפרוטוקול היא הדרישה של 20 מיליון תאים כחומר מוצא לבידוד המיטוכונדריה. עם זאת, ריכוז החלבון המיטוכונדריאלי הגבוה שנצפה במחקר שלנו מאפשר הקטנת קנה מידה של פי עשרה של מספר תאי המיקרוגליה הראשוני לבידוד מיטוכונדריאלי בהתבסס על האופטימיזציה שבוצעה במחקרים קודמים25,26 (25-250 מיקרוגרם חלבונים) מבלי לאבד אותות N-גליקן. יתר על כן, איגום דגימות ביולוגיות להשגת מספרי תאים גבוהים יותר לבידוד מיטוכונדריאלי יכול להתבצע במקרה של מדרגיות פרוטוקול מוגבלת כדי להוריד את מספר התאים ממקורות ראשוניים כמו רקמות לזיהוי גליקן יעיל. בנוסף, שלב שחרור הגליקן הוא קריטי בפרוטוקול זה. N-glycosidase F (PNGase F) משמש לשחרור גליקנים מלאים ושלמים המקושרים ל-N על ידי הידרוליזה של קישור האמיד בין ה-N-אצטיל-גלוקוזאמין הפנימי ביותר (GlcNAc) לשאריות האספרגין27. לניתוח N-גליקן, חיוני לייעל את הפעילות של PNGase F כדי להשיג דה-גליקוזילציה מלאה של החלבונים המיטוכונדריאליים. דנטורציה של חלבונים באמצעות חשיפה לממס ועודף אנזימים מסייעת להבטיח חיתוך ושחרור יעילים ושלמים של ה-N-גליקנים מהחלבונים המיטוכונדריים. זמן עיכול של 18-20 שעות הוא אופטימלי לשחרור N-גליקן על ידי השלמת תגובת PNGase F26.
מגבלה פוטנציאלית של פרוטוקול זה היא היעדר העשרה של תמצית המיטוכונדריה לגליקופרוטאינים בשיטה זו. בעוד שהגליקופרוטאינים בשפע נמוך עשויים שלא להתגלות בניתוח, שיטה זו ממזערת את השגיאה וההטיה המוכנסים מטיהור זיקה ללקטין או העשרה כימית. בעוד ש-IR-MALDESI נותן זיהוי בביטחון גבוה של הרכב הגליקנים המזוהים, מידע מדויק על הקשרים בין שאריות הגליקן דורש חקירה נוספת באמצעות ספקטרומטריית מסה טנדם של גליקנים צמודים לליתיום כדי לשפר את המחשופים הצולבים28 או עיכול אקסוגליקוזידאז. לחלופין, ניתן להשתמש ב-LC-MS/MS בנוסף או כחלופה לגישת IR-MALDESI, שעשויה לספק כיסוי גליקן עמוק יותר עם פרטים מבניים יותר. עם זאת, מחקרים קודמים הראו את המתאם בין שפע היונים הממוצע מ-IR-MALDESI עבור מטבוליטים עם הכמויות המוחלטות שנקבעו על ידי LC-MS/MS29, מה שיוצר בסיס לכימות ישיר של מטבוליטים באמצעות IR-MALDESI. האופי בעל התפוקה הגבוהה של IR-MALDESI עם היכולת לבצע ניתוח MS2 כדי לספק אישור מבני בביטחון גבוה הוא חיוני לסריקה מהירה של דגימות פרה-קליניות וקליניות לסמנים ביולוגיים פוטנציאליים של גליקן ואבחון מחלות. בנוסף, יש לציין כי למרות שהצנטריפוגה של הסופרנטנט הפוסט-גרעיני ב-3000 × גרם במקום ב-12,000 × גרם ממזערת את המזהמים הפרוקסיזומלים והליזוזומליים, עדיין עשויים להיות עקבות של חלבונים אלה בתכשיר המיטוכונדריאלי.
לסיכום, מחקר זה מציג שיטה פשוטה בעלת תפוקה גבוהה, עם הכנת דגימה מינימלית לניתוח הגליקום המיטוכונדריאלי בתאי מיקרוגליה ופוטנציאל גדול ליישום בזיהוי מטרות טיפוליות חדשות מבוססות גליקן למחלות ניווניות. פרוטוקול זה מציג הערכה מקיפה וסטנדרטיזציה של השיטות האנליטיות לבידוד מיטוכונדריאלי ממיקרוגליה וניתוח עוקב של הגליקום המיטוכונדריאלי כדי לאפשר הרחבה למחקרים פרה-קליניים וקליניים בקנה מידה גדול. פרוטוקול זה מציג מספר יתרונות לבידוד וזיהוי N-גליקן: 1) זמן הבידוד המיטוכונדריאלי לפרוטוקול מבוסס ריאגנט נמוך (≤40 דקות); ii) תפוקת החלבונים לשחרור גליקן גבוהה; iii) ניתן להשתמש באותן דגימות מיטוכונדריאליות שהוכנו לניתוח N-glycan לחקירות ביולוגיות מולקולריות אחרות כגון ניתוח פרוטאומי, ניתוח לקטין וניתוח זרימה מיטוכונדריאלית; ו-4) ספקטרומטריית מסה IR-MALDESI HRAM מאפשרת זיהוי מהיר ומשופר של N-גליקנים עקב אסטרטגיית היינון ההיברידית והרכה28 ללא צורך בנגזרת כימית של הגליקנים הטעונים כמו סיאלוגליקנים וסולפוגליקנים30.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
המחברים רוצים להודות לסת' אייזנברג, סטודנט לתואר שני במעבדת מודימן ב-NCSU, על עזרתו בהקלטת וידאו של פרוטוקול ספקטרומטרי מסה. מחקר זה נתמך בחלקו על ידי תוכנית העמיתים של בית הספר לחדשנות הנדסית באוניברסיטת אלבמה בברמינגהם, AG068309 ל-D.J.T. ו-R01GM087964-12 ל-D.C.M. הסכמות בכתב היד הזה שורטטו באמצעות BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amersham 600 imager | Cytvia | 29194217 | Gel and membrane imager |
| Countess 3 automated cell counter | Fisher Scientific | X003SZ1LY9 | |
| Dry Bath Stdrd 4 blck 100-120V | Thermofisher scientific | 88870003 | |
| i-Blot2 Gel Transfer Device | Invitrogen | IB21001 | Western blot transfer system |
| Inverted microscope | Cell Treat | 04355223EA | |
| Microplate reader | 82050-760 | ||
| Mini gel tank | Invitrogen | A25977 | |
| Open Air Rocker | Fisher Brand | 88861025 | |
| Pipet boy | BioTek | 229310 | |
| Vortex mixer | Integra- VWR | ||
| Mitochondria isolation reagents | |||
| Mitochondrial Isolation kit | Thermofisher scientific | 89874 | |
| Phosphotase Inhibitor | Thermofisher scientific | 1861274 | |
| Protease Inhibitor | Thermofisher scientific | 1861281 | |
| N-glycan isolation and IR-MALDESI reagents | |||
| Acetic acid | Fisher Scientific | A11350 | 50% in ESI solvent |
| Acetonitrile | Sigma Aldrich | 34851-4L | 1 mM in ESI solvent |
| Ammonium bicarbonate | Fisher Scientific | A643500 | 100 mM |
| Calibration Solution | Thermofisher Scientific | A39239 | Pierce FlexMix |
| Dithiothreitol | Sigma Aldrich | AC426380100 | 1 M |
| Iodoacetamide | Sigma Aldrich | A322-10VL | |
| LC/MS grade water | Thermofisher Scientific | 047146.M6 | |
| PNGase F | Bulldog Bio | NZPP010 | 75000 U/mL, enzyme for N-glycan release |
| N-glycan isolation and IR-MALDESI consumables | |||
| Amicon centrifugal filters | Fisher Scientific | UFC501024 | 10 kDa MWCO |
| Mass spectrometer | Orbitrap Exploris 240 | ||
| Mid-IR Laser | JGM Associates, Burlington, MA, USA | ||
| Teflon microwell slide | Prosolia, Indianapolis, IN, USA | ||
| N-glycan analysis softwares | |||
| GlycoMod | Expasy | https://web.expasy.org/glycomod/ | |
| GlyConnect | Expasy | https://glyconnect.expasy.org/ | |
| Protein isolation and western blot consumables | |||
| Basix gel loading tips ( 10 µL) | Basix | 13-611-102 | |
| Basix gel loading tips ( 200 µL) | Basix | 13-611-116 | |
| Cell scrapper | VWR labs | 14-388-100 | |
| i-Blot NC regular stacks | Invitrogen | IB23001 | |
| i-Blot2 PVDF Regular Stacks | Invitrogen | IB24001 | |
| 10 µL micropipette | Fisher Scientific | FBE00010 | |
| 20 µL micropipette | Invitrogen | FBE00020 | |
| 200 µL micropipette | Fisher Brand | FBE00200 | |
| 1000 µL micropipette | Fisher brand | FBE01000 | |
| 10 µL pipet tips | VWR labs | 76322-528 | |
| 20 µL pipet tips | VWR labs | 76322-134 | |
| 200 µL pipet tips | VWR labs | 76322-150 | |
| 1000 µL pipet tips | VWR labs | 76322-154 | |
| Well plate | Fisher brand | 14-388-100 | |
| Protein isolation and western blot reagents | |||
| Actin antibody ( Host : Rabbit ) | Cell Signaling Technologies | 8457T | |
| Anti-Rabbit IgG HRP Linked | Cell Signaling Technologies | 7074S | |
| Bolt 4-12% Bis-Tris Plus | Invitrogen | NW04120BOX | |
| Bovine Serum Albumin | Fisher bioreagents | BP9700-100 | |
| COXIV antibody ( Host : Rabbit) | Cell Signaling Technologies | 4844S | |
| GAPDH antibody ( Host : Rabbit) | Cell Signaling Technologies | 2118S | |
| MicroBCA protein assay Kit | Thermofisher scientific | 23235 | |
| Nupage MOPS SDS Runing Buffer [20x] | Thermofisher scientific | NP0001 | |
| PAGE Ruler prestained protein ladder | Thermofisher scientific | 815-968-0747 | Dilution= Use 7 µL to load onto first well |
| Phosphate buffered saline | Aniara Diagnostics | A12-9423-5 | Prepare 1x PBS from 10x powder |
| Pierce ECL Western Blotting Substrate | Thermofisher scientific | 32106 | Chemiluminescent substrate kit |
| RIPA Buffer | Thermofisher scientific | 89901 | |
| Sample Buffer | Novex | B0007 | The bolt LDS sample buffer is prepared in 3:1 ratio of sample to sample buffer |
| Tween-20 | MP Biomedicals | TWEEN201 | |
| Tissue culture consumables | |||
| Countess Slides | Avantor | 229411 | |
| Eppendorf tubes | Cell Treat | 414004-265612-5884 | |
| 2 mL aspirating pipet | Vista lab | 5090-0010E | |
| 5 mL serological pipet | Fisher Scientific | 13-678-11D | |
| 10 mL serological pipet | Basix | 13-678-11E | |
| 25 mL serological pipet | Vista lab | FB012937 | |
| 50 mL serological pipet | Vista lab | 14955233 | |
| 15 mL Conical tube | Avantor | 229225A | |
| 50 mL conical tube | Cell treat | 4190-0050 | |
| T-75 cm2 Tissue culture flask | Fisher Scientific | FB012937 | |
| T-180 cm2 Tissue culture flask | Fisher Scientific | FB012939 | |
| Tissue culture reagents | |||
| BV2 microglial cell line | Creative Bioarray | CSC-I2227Z | Immortalized Mouse Microglia (BV2) derived from C57/BL6 neonatal microglia |
| Cell dissociation enzymes | Thermofisher scientific | 12563029 | TrypLE |
| Dulbecco's Modified Eagle Medium (DMEM) Low Glucose Media | Gibco | 10567014 | |
| Fetal Bovine Serum | Cytiva | SH30071.03HI | |
| Minimum Essential Medium (MEM) Non-essential Amino Acids | Gibco | 11140050 | |
| Penicillium Streptomycin | Cytivia | SV30010 | |
| Phosphate buffer saline | Corning | 21-040-CV | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved