Method Article
糖鎖分析のためのミクログリアからのミトコンドリア調製
要約
ミクログリア細胞からの精製ミトコンドリアの調製、 N型糖鎖放出のためのミトコンドリアタンパク質の単離、および赤外マトリックス支援レーザー脱離エレクトロスプレーイオン化と高分解能精密質量分析装置質量分析法を組み合わせた細胞内ミトコンドリア糖鎖の迅速な検出のためのプロトコールが開発されました。
要約
ミクログリアにおけるミトコンドリアタンパク質のグリコシル化パターンを理解することは、神経変性疾患におけるミトコンドリアタンパク質の役割を決定するために重要です。ここでは、培養ミクログリアから単離されたミトコンドリアタンパク質のグリコミクス分析のための新しいハイスループットな方法論を紹介します。この分析法では、ミクログリア培養物からのミトコンドリアの単離、ミトコンドリアサンプルの品質評価、糖鎖検出を最大化するための最適化されたタンパク質抽出、およびミトコンドリアのグリコシル化の詳細なプロファイルを提供するための赤外線マトリックス支援レーザー脱離エレクトロスプレーイオン化(IR-MALDESI)高分解能精密質量(HRAM)質量分析が含まれます。
このプロトコルは、単離中にミトコンドリアの完全性を維持することの重要性を強調し、抽出後のミトコンドリアの純度の測定など、再現性を確保するために厳格な品質管理を採用しています。このアプローチにより、 in vitroでのさまざまな実験条件下でのミクログリアミトコンドリアのグリコシル化変化の包括的なプロファイリングが可能になり、神経変性疾患に関連するミトコンドリアの変化に関する洞察が得られます。このアプローチは、他の in vitro 治療、他の培養細胞タイプ、または初代細胞に適応できる可能性があります。この標準化されたアプローチを通じて、ミクログリアミトコンドリア糖鎖の理解を深め、神経変性研究の幅広い分野に貢献することを目指しています。
概要
ミクログリアは、脳内に優勢に存在する自然免疫細胞であり、成体脳の細胞の10-15%を占めている1,2。彼らは、受容体のレパートリーを使用して、脳の微小環境を動的に監視し、正常な脳機能を調節して脳の恒常性を維持します3。ミクログリアは、その微小環境の変化に非常に敏感で、病的状態やさまざまな刺激によって細胞の形態、免疫表現型、機能に変化が生じます。ミクログリアの活性化状態は、食作用、サイトカイン産生、組織修復など、その機能に必要な細胞エネルギー需要の影響を受けます。したがって、細胞のエネルギー代謝は、ミクログリア機能の変化を調節する上で重要な役割を果たします4。ミクログリアの調節不全は、炎症誘発性サイトカイン(IL-1β、TNF-αなど)と活性酸素種(ROS)の過剰な放出につながり、脳が神経炎症を起こしやすくなる5,6。慢性的なミクログリアの調節不全とそれに伴う神経炎症環境は、神経変性の基礎を築きます7。
脳は体重のわずか2%を占めていますが、体の総エネルギー消費量の20%を占めています。ミトコンドリアは、脳細胞の主要なエネルギー源であり、急性および慢性の脳障害の病因における主要なプレーヤーとして機能します8。これまでの研究で、老化9やアルツハイマー病などの加齢性疾患10,11におけるミクログリアの活性化と代謝機能障害との間に強い相関関係があることが明らかになっており、細胞の老化と神経変性におけるミトコンドリアの重要な役割が浮き彫りになっています。ミトコンドリアの機能障害は、老化や加齢性疾患の際のエネルギー産生の低下、酸化ストレスの増加、神経炎症の増加につながります。
エネルギー代謝、老化、脳障害におけるミトコンドリアの役割は、広範な研究によって解明されてきましたが、ミトコンドリアの生物学と機能におけるグリコシル化などの一般的な翻訳後修飾の役割については、まだ十分に調査されていません。グリコシル化は、グリコシル化酵素によってグリカンと呼ばれる糖部分がタンパク質に酵素的に付加されるもので、ミクログリアを含むほとんどの脳細胞で最も一般的な翻訳後修飾です。活性化されたミクログリアは、炎症刺激下で細胞内または細胞表面の糖鎖発現を調節することにより、免疫機能を調節します12。刺激後にミクログリアが示す炎症誘発性および抗炎症性応答は、糖鎖によっても調節される13。ミトコンドリアタンパク質にもこれらの糖鎖修飾があり、その機能と局在が制御されています。しかし、ミクログリアにおける細胞特異的なミトコンドリアのグリコシル化パターンの詳細な解析は、細胞内グリコシル化の研究には技術的な課題があるため、不足しています。ミクログリアの表現型の調節におけるグリコシル化の役割は十分に特徴付けられていますが、ミトコンドリア機能の調節、ひいてはミクログリアの細胞免疫表現型における糖鎖の役割については、まだ十分に理解されていません。
ミトコンドリアタンパク質のグリコシル化を調査した研究は限定的であり、主にレクチンに基づくグリコシル化パターンの同定に焦点を当ててきました。レクチンは、生体分子の糖鎖部分に結合する糖鎖結合タンパク質であり、14,15、糖鎖組成に関する詳細な情報を提供する特異性と能力を欠いています。質量分析モダリティは、レクチン分析によってもたらされる分析上の課題を克服するための糖鎖組成の詳細な同定を提供します。そのようなモダリティの1つである赤外線マトリックス支援レーザー脱離エレクトロスプレーイオン化(IR-MALDESI)は、中赤外レーザーを使用して生体試料16に見られる水を共鳴励起し、中性種を脱着させ、それらを直交するエレクトロスプレープルームにさらした後、高分解能精密質量Orbitrap質量分析計を使用して分析するハイブリッドイオン化戦略を採用しています。IR-MALDESIは、組織代謝物の直接分析17でこれまでに実証されており、迅速分析18、軟イオン化法、および塩素化糖鎖付加物19の同位体分布パターンに基づくN-結合型糖鎖のシアル酸含量の予測可能性という明確な利点があります。しかし、このプラットフォームが細胞内糖鎖の直接分析に適応していることは実証されていません。
ここでは、ミクログリア細胞からのミトコンドリア単離、ミトコンドリア N型糖鎖の単離、およびIR-MALDESI質量分析を用いたミトコンドリア N型糖鎖の検出と分析のためのハイスループットプロトコールを報告します。このプロトコルは、ミトコンドリア機能におけるグリコシル化の役割に関する新たな洞察を明らかにするための基礎となり、神経炎症性疾患および神経変性疾患の新たな治療標的を特定する可能性があります。
プロトコル
1. BV2ミクログリア細胞株培養
- 10%ウシ胎児血清(FBS)、1%ペニシリウムストレプトマイシン(PenStrep)、および1%非必須アミノ酸(NEAA)を補給したDMEM低グルコース培地でBV-2細胞(C57BL / 6マウス由来のミクログリア細胞)を維持します。.
- T-175フラスコで細胞を増殖させ、70〜80%の密度に達するようにします。
- 細胞解離酵素と5%CO2中、37°Cで5分間インキュベートし、続いて等量の細胞培地で酵素を不活性化し、室温(RT)で500× g で細胞を5分間遠心分離します。
注:ここで使用される細胞解離酵素は、トリプシンよりもBV2細胞に優しく、細胞表面の抗原発現を保護するために使用できます。 - 培地を吸引し、細胞ペレットを1 mLの増殖培地に再懸濁し、トリパンブルーを使用して細胞をカウントします( 材料の表を参照)。
注:このステップでは、自動セルカウンターを使用してセルをカウントしました。 - ミトコンドリア単離を行うには、細胞ペレットに2 × 107 (2000万細胞/ペレット)が含まれている場合に進みます。
2. ミクログリア細胞からのミトコンドリアの単離
注:手順全体を通してすべてを氷の上に保ちながら、迅速に作業します。ミトコンドリア単離に用いるミトコンドリア単離キットは、試薬A(細胞溶解緩衝液)、試薬B(安定化緩衝液)、試薬C(ミトコンドリア洗浄緩衝液)の3つの成分で構成されています。使用直前に試薬Aと試薬Cにプロテアーゼ阻害剤を添加してください。
- 回収した細胞を2.0 mLの微量遠心チューブで500 × gで5分間遠心分離することにより、2 × 107個の細胞をペレット化します。上清を慎重に吸引して捨てます。
- 800 μLのミトコンドリア単離試薬A(細胞溶解バッファー)を加え、中速で5秒間ボルテックスし、チューブを氷上で正確に2分間インキュベートします。
注:2分間のインキュベーションを超えないようにしてください。 - 10 μLのミトコンドリア単離試薬B(安定化バッファー)を添加し、最高速度で5秒間ボルテックスし、チューブを氷上で5分間インキュベートし、毎分最高速度でボルテックスします。
- 800 μLのミトコンドリア単離試薬C(ミトコンドリア洗浄バッファー)を加え、チューブを数回反転させて混合し、チューブを700 × g で4°Cで10分間遠心分離します。
注意: 渦巻きにしないでください。 - 上清を新しい2.0 mLチューブに移し、3,000 × g で4°Cで15分間遠心します。
- 上清(細胞質部分)を新しいチューブに移します。.ペレットには単離されたミトコンドリアが含まれています。
- 500 μLのミトコンドリア単離試薬Cをペレットに加え、12,000 × g で5分間遠心分離します。
- ペレットをタンパク質の定量化と処理に使用するか、さらに使用するまで-80°Cで保存します。
3. microBCAアッセイを用いたタンパク質推定
注:このプロトコルのタンパク質推定は、異なる試薬とアッセイを使用して実行できます。細胞質タンパク質またはミトコンドリアタンパク質の定量は、アッセイで使用される総タンパク質濃度に対して標準化することで実行できます。
- 0 μg/mL から 200 μg/mL までのウシ血清アルブミン(BSA)標準試料(0 μg/mL、0.5 μg/mL、1 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、200 μg/mL)および溶解バッファーのみを含むブランクを調製します。
- 各標準試料150 μLを、サンプルを含む平底の96ウェルプレートに加えます。
- Micro BCA Reagent MA (ビシンコニン酸 (BCA) 溶液) 25 部と Reagent MB (硫酸銅溶液) 24 部を 1 部の Reagent MC (安定化バッファー) (25:24:1、試薬 MA:MB:MC) に混ぜて、動作する試薬を作成します。混合したBCA試薬150 μLを各サンプルおよび標準試料に加えます。
- 37°Cで2時間インキュベートします。
- プレートリーダーを使用して 562 nm での吸光度を測定し、標準曲線でタンパク質濃度を定量します。他のすべての個々の標準と未知のサンプルの繰り返しの吸光度測定値からブランク標準吸光度を差し引いて、サンプルタンパク質濃度を取得します。
4. ミトコンドリア調製物の品質管理(ウェスタンブロット)
- ミトコンドリアペレットをラジオ免疫沈降アッセイバッファー(RIPA)バッファーに再懸濁して、タンパク質の定量を行います。micro BCAアッセイを使用して、各サンプルのタンパク質濃度を決定します。
- サンプルバッファー中のサンプルを94 °Cで5分間変性させます。
- 等量(20 μg)のミトコンドリアタンパク質をプレキャストゲル( 材料表を参照)に、分子量マーカーとともにロードします。
- ゲルを100Vで50分間泳がせます。
注:実行時間は異なる場合があるため、タンパク質がサンプルバッファー内の色素で示されるゲルの端に到達したら、必ずゲルを停止してください。 - タンパク質をゲルからポリフッ化ビニリデン(PVDF)メンブレンに、ウェスタンブロット転写システムでドライ転写プロトコルを使用して、20 Vで7分間転写します。
- メンブレンを取り出し、ブロッキング溶液(表1)を使用して室温で1時間ブロッキングします。
- ブロッキングバッファーで、一次抗体の適切な希釈液をメンブレンに1晩4 °C(COXIV= 1:3,000、GAPDH = 1:3,000)で一晩加えます。
注:ミトコンドリア調製物に核小胞体(ER)汚染がないことは、ウェスタンブロットのラミン(核マーカー)やERp57(ERマーカー)などの追加マーカーを使用してテストできます。 - メンブレンを洗浄バッファーで3 x 15分間洗浄します(表1)。
- 適切な希釈量のHRP標識二次抗体とメンブレンをブロッキングバッファー中で室温で1時間インキュベートします
- メンブレンを洗浄バッファーで3 x 15分間洗浄します。
- 現像には、化学発光基質キットを使用してください。
- ゲルとメンブレンイメージャーを使用してメンブレンをスキャンします。
5. ミクログリアからのN型糖鎖抽出のためのミトコンドリアタンパク質の単離
- 単離したミトコンドリアを50 μLのタンパク質単離バッファー(表1)に再懸濁し、氷上に20分間放置します。
- 吸引して3回分注し、氷上で20分間放置します(使用前にボルテックスします)。ミトコンドリアペレットが完全に可溶化されていない場合は、さらに50 μLのアイソレーションバッファーとプールを同じチューブに加えます。
- 13,000 × g で10分間遠心分離します。
- 上清を回収し、-80 °Cで最低1時間凍結し、真空濃縮器でできるだけ乾燥させます。
- 糖鎖単離前に、IR-MALDESIのPNGase消化バッファー(表1)を使用して再懸濁します。
6. IR-MALDESIのためのミトコンドリア N 糖鎖調製
- 単離されたミトコンドリアタンパク質のタンパク質25-250 μg(最大容量250 μL)を10 kDaの分子量カットオフ(MWCO)フィルターにロードします。
- タンパク質サンプルを減らして糖鎖部分を露出させるには、フィルター内の各サンプルに 2 μL の 1 M ジチオスレイトール (DTT) を添加します。
- サンプルを200 μLのPNGase消化バッファーで希釈し、フィルターを乱さないように軽くボルテックスします。
- ミトコンドリアタンパク質を変性させるには、サンプルを56°Cで30分間インキュベートします。
- 50 μL の 1 M ヨードアセトアミドを使用してミトコンドリアをアルキル化し、最終濃度を ~200 mM にした後、37 °C で 60 分間インキュベートします。
- 変性ミトコンドリア法をさらに濃縮するには、サンプルを14,000 × g で40分間遠心分離します。フロースルーを破棄します。
- サンプルを100 μLのPNGase消化バッファーで洗浄します。
- 糖タンパク質を14,000 × g で20分間フィルター上に濃縮し、フロースルーを廃棄します。洗浄と濃縮のステップを2回、合計3回繰り返し、フィルターのデッドボリューム(~5 μL)に濃縮物が得られます。すべてのフロースルーを破棄します。
- 洗浄が完了したら、コレクションバイアルを廃棄します。今後のすべての溶離液と洗浄には、新しいコレクションバイアルを使用してください。
- 変性したミトコンドリアグリコパターンからグリカンを切断するには、新しいコレクションバイアルに移し、2 μL のグリセロールフリー PNGase (75,000 units/mL) をフィルターに加えます。98 μLのPNGase消化バッファーを加え、総容量を100 μLにし、フィルター上で静かにピペッティングして混合します。
- サンプルを37°Cで18時間インキュベートし、ミトコンドリアタンパク質からすべての N型糖鎖を酵素的に切断します。
- 遊離したミトコンドリア N 型糖鎖を溶出するには、サンプルを 14,000 × g で 20 分間、20 °C で遠心分離します。
- 100 μL の PNGase 消化バッファーをフィルターに添加してミトコンドリア糖鎖を洗浄し、14,000 × g で 20 °C で 20 分間遠心分離します。 残った N-glycans を含む洗浄液を、溶離液と同じ収集バイアルに集めます。2回繰り返して、フィルターをコレクションバイアルから取り出します。
- ミトコンドリア糖鎖サンプルを-80°Cの冷凍庫で凍結するまでインキュベートし(30〜6分)、真空濃縮器で室温で乾燥させます(400μLで4〜6時間)。
注: N型糖鎖は、分析前に-20°Cで最大6ヶ月間保存できます。 - IR-MALDESI分析の直前に、乾燥 したN結合型糖鎖を50 μLのLC/MSグレードの水に再懸濁します。
7. IR-MALDESI質量分析法による遊離糖鎖の検出
- 実験の毎日、質量キャリブレーションを行います。キャリブレーション溶液をシリンジポンプにロードし、1.2 μL/minの速度で押し込みます。3.5kVの電圧を印加して、正と負の両方のモードで質量校正のための安定したエレクトロスプレープルームを実現します。
- 再懸濁したミトコンドリア糖鎖5 μLをテフロンマイクロウェルスライド上のサンプルスポットにピペットで移します。
- 波長2.97μmで動作する中赤外レーザーを使用して、バーストあたり1.8mJのエネルギーでアブレーションを行います。
- N型糖鎖をイオン化し、ネガティブイオン化モードで検出します。60% アセトニトリルと 1 mM 酢酸からなるエレクトロスプレー溶媒を使用して、3.2 kV の電圧で 2 μL/min の流量で安定したエレクトロスプレープルームを作成します。
- 分析を実行するには、IR-MALDESIをm/z 200で240,000FWHMの質量分解能に設定されたHRAM質量分析計に結合し、ネガティブイオン化モードで500〜2,000 m/zを分析します。
- 自動ゲイン制御(AGC)をオフにし、固定注入時間を90msに設定します。EasyICソースを使用して、すべてのスペクトルのリアルタイム内部キャリブレーションを行い、高い質量測定精度(MMA)を実現します。
8. ミトコンドリア N- 糖鎖データ解析
- モノアイソトピック質量を検索し、m/z 間隔を使用して同位体分布を確認することで、N 結合型糖鎖を手動で同定し、最小イオンフラックス閾値が 1,000 イオン/秒の二重荷電イオンおよび三重荷電イオンを決定します。
- 生の質量スペクトルを m/z 比から中性モノアイソトピック質量に変換します。
- モノアイソトピック質量をオンラインのオリゴ糖構造予測ツールにアップロードして、潜在的な糖鎖組成を決定します。実験的にキュレーションされたグリコミクスデータベース20を使用してアノテーションを確認する。各同定が 2.5 ppm MMA のマージン内にあり、コア N 結合型糖鎖構造 (Hex3HexNAc2) を含み、ペントース、KDN、または HexA 単糖類を除外していることを確認してください。
- 確認された糖鎖構造を SNFG 命名法21 を用いて描画します。
- 生のマススペクトルから糖鎖の相対存在量を取得し、ミトコンドリアタンパク質の量に対して μg 単位で正規化して、イオン/s/μg を得ます。
- カイ二乗解析を使用して、 N 結合型糖鎖の理論分布と実験分布の間の適合度を検定し、塩素付加物の数を決定します。これにより、シアル酸19の数を直接決定することができます。
結果
図1は、質量分析糖鎖分析のためのBV2ミクログリア細胞株からのミトコンドリアの単離に関与するステップの概略図を示しています。ミクログリア細胞の同じ開始密度からの異なるミトコンドリア調製物間のミトコンドリアタンパク質単離の再現性を 図2に示しますが、マイクロBCAアッセイを使用して推定したミトコンドリアタンパク質濃度との間に有意差はありません。
図3は、COX IVおよびGAPDHのウェスタンブロット分析を使用したミトコンドリア単離の純度を示しています。ここでは、プロトコールで使用される試薬ベースの単離の最終ステップで単離されたミトコンドリア画分におけるミトコンドリアタンパク質COX IVの発現が見られます。イムノブロットは、単離されたミトコンドリア画分に顕著なCOX IVバンドを示しますが、GAPDHは同じ曝露で細胞質画分でのみ検出されます。露光時間が長いと、かすかなGAPDHバンドが検出される可能性があります。非ミトコンドリアマーカーGAPDHの発現は、ミトコンドリアの単離後の全細胞ライセートで明らかであり、CoxIVバンドはなく、ミトコンドリア画分の完全な単離と最小限の非ミトコンドリア汚染を示しています。ミトコンドリア画分におけるCOX IVの発現は、2細胞×107 細胞の同様の開始細胞密度を持つ異なる調製物間で一貫しています。
図 4 の IR-MALDESI を使用して検出された遊離 N 型糖鎖の代表的な質量スペクトルは、PNGase 処理を使用してミトコンドリアタンパク質抽出物から遊離したリン酸化、硫酸化、およびシアル化の荷電 N 型糖鎖の存在を示しています。表 2 は、全スペクトルで同定されたが GlyConnect では報告されなかったすべての糖鎖組成を示しています。適合度を検定するカイ二乗値により、1 つおよび 2 つの塩素付加体を持つ N 結合型糖鎖の検出が確認され、図 5 の IR-MALDESI を使用してこれらの糖鎖組成が検出されたことが確認されます。
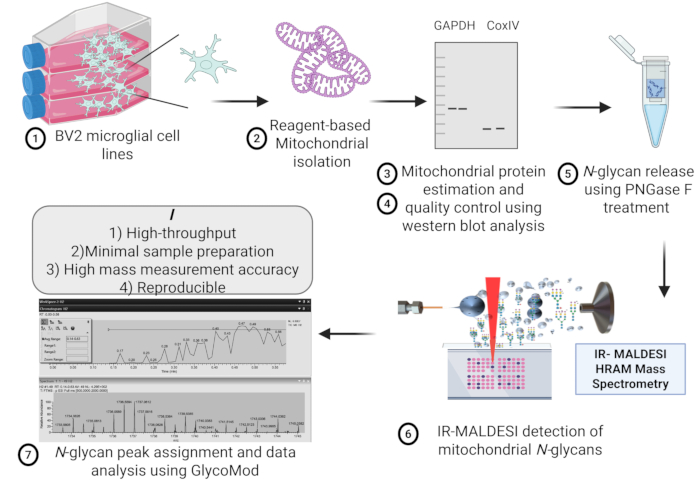
図1:プロトコルの概要。ミトコンドリアN型糖鎖のハイスループット検出のためのBV2ミクログリア細胞株からのIR-MALDESI HRAM質量分析を用いたミトコンドリア単離、品質管理、タンパク質抽出、N型糖鎖放出、および推定の概略図。略語:IR-MALDESI HRAM = 赤外線マトリックス支援レーザー脱離エレクトロスプレーイオン化高分解能精密質量分析装置。この図の拡大版を表示するには、ここをクリックしてください。
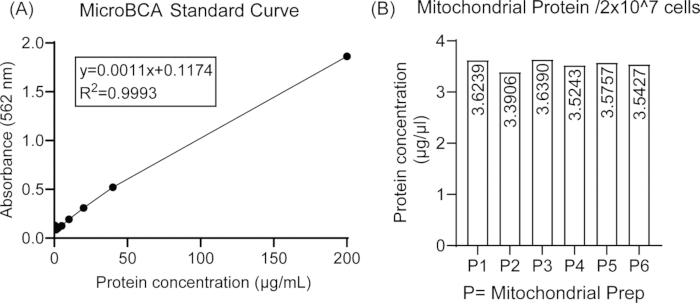
図2:BV2細胞からのミトコンドリアタンパク質の単離(A)異なる濃度のBSAを使用したマイクロBCAアッセイの標準曲線。(B)6つの独立したミトコンドリア調製物中の2細胞×107細胞からの一貫したタンパク質含有量によって表されるミトコンドリアタンパク質単離の再現性。この図の拡大版を表示するには、ここをクリックしてください。
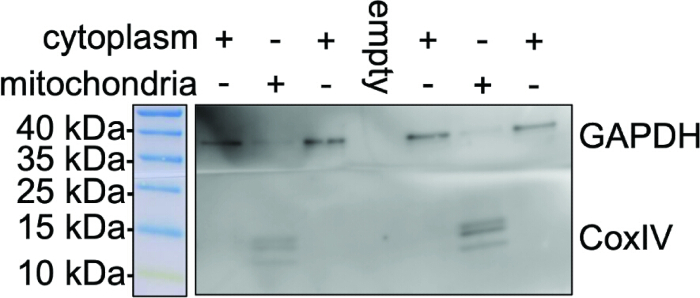
図3:ミトコンドリア調製物の純度。 細胞質画分およびBV2ミクログリア細胞から単離されたミトコンドリアの代表的なウェスタンブロット。この図は、COX IV抗体(ミトコンドリアマーカー)とGAPDH抗体(細胞質制御)による細胞質画分と単離されたミトコンドリアの免疫ブロッティングを表しています。単離されたミトコンドリアにGAPDHバンドが存在しないことは、クロスコンタミネーションが最小限に抑えられ、その後の N型糖鎖分析のためのミトコンドリア調製物の純度が高いことを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
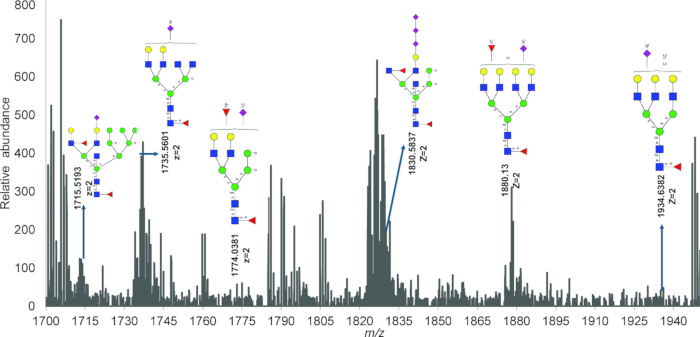
図4:IR-MALDESI HRAM質量分析法を用いたミトコンドリア N型糖鎖同定組成測定。 1,700 〜 2,000 m/z の範囲の糖鎖質量スペクトルは、Glycomod を使用して決定されたアノテーション構造を持つ多数の多価ピークを示しています。略語:IR-MALDESI HRAM = 赤外線マトリックス支援レーザー脱離エレクトロスプレーイオン化高分解能精密質量分析装置。 この図の拡大版を表示するには、ここをクリックしてください。
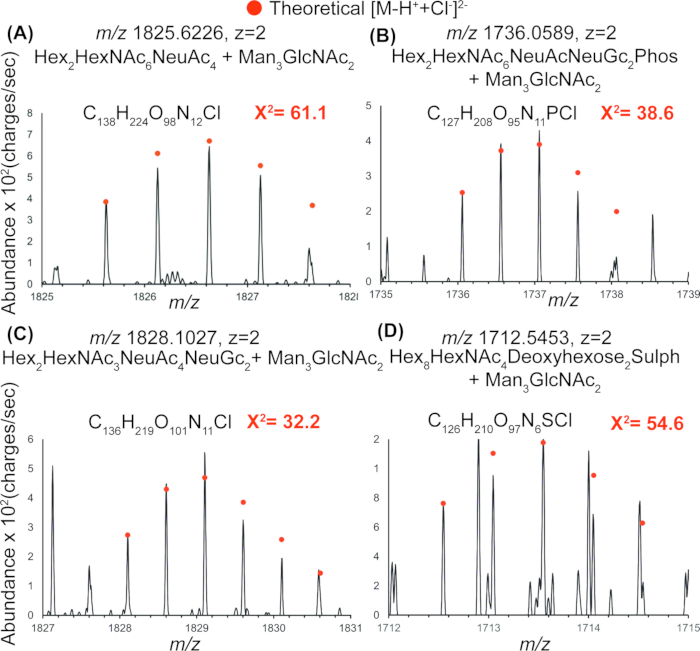
図5:検出されたミトコンドリア のN型糖鎖の検証。 4つの(A-D)ミトコンドリア N結合型糖鎖の代表的な同位体分布を示し、観察された分布と塩素および脱プロトン化付加体の理論分布との重ね合わせを示しています。重ね合わせたスペクトル上のカイ二乗値は適合度を表し、1 つまたは 2 つの塩素付加物を持つ N 結合型糖鎖の検出を確認します。これは、IR-MALDESIを用いたこれらの糖鎖組成物の検出をさらに確認するものです。略語:IR-MALDESI = 赤外線マトリックス支援レーザー脱着エレクトロスプレーイオン化。 この図の拡大版を表示するには、ここをクリックしてください。
表1:プロトコールで使用した溶液およびバッファーレシピ。この表をダウンロードするには、ここをクリックしてください。
表2:ミトコンドリアで検出されたMの最終荷電脱プロトン化N結合型糖鎖は、Glycomodで高い質量測定精度を示しました。糖鎖の短縮表記: H = ヘキソース;N = N-アセチルグルコサミン;F =フコース;S = N-アセチルノイラミン酸;Phos =リン酸塩;硫黄=硫酸塩修飾。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ミクログリアは脳に常在する免疫細胞であり、糖鎖修飾はミクログリアの免疫表現型と機能を調節します。これらの免疫機能は、主にミトコンドリアによって供給される大量の細胞エネルギーを必要とします。特に、ミトコンドリアタンパク質は糖鎖修飾も示しますが、細胞内グリコシル化の研究における技術的課題のために、これは大幅に研究が進んでいません。ミトコンドリアのグリコシル化を調査するほとんどの研究は、レクチンによる糖鎖パターンの同定に依存しています22が、これらのアプローチはレクチンの結合特異性が低いために制限されています。この研究で提示された技術的アプローチの本質的な進歩は、i)ミクログリア細胞からのミトコンドリア N型糖鎖の再現性のある単離、およびii)IR-MALDESI HRAM質量分析法を使用したミトコンドリア N型糖鎖の検出と同定です。ここで説明するワークフローは、ミクログリア細胞の生理学的レベルで発現するミトコンドリア糖タンパク質から遊離した N型糖鎖の検出に関する最初の報告です。
本プロトコールでは、試薬ベースの単離法を用いてミトコンドリアの単離が最大化されます。これをDounce均質化法と組み合わせることで、ミトコンドリアの収量を向上させることができます。試薬ベースの単離と比較してホモジナイザーを使用することの欠点は、オペレーター間で乳棒の力と速度が異なるため、実験のばらつきが増加し、再現性が低下することです。先行研究23,24は、この方法の使用と、ミトコンドリア画分中に核マーカー(ラミン、ヒストンH3)およびERマーカー(カルネキシン、Erp57)が存在しないことを示しており、ミトコンドリア画分の純度を示しています。このプロトコルの潜在的な制限は、ミトコンドリア単離の出発物質として2,000万個の細胞が必要であることです。しかし、私たちの研究で観察された高いミトコンドリアタンパク質濃度により、以前の研究で行われた最適化に基づいて、ミトコンドリア単離の初期ミクログリア細胞数を10倍に縮小することができます25,26(25-250μgタンパク質)N-グリカンシグナルを失うことなく。さらに、組織などの一次供給源からの細胞数を減らすためのプロトコルのスケーラビリティが限られている場合、ミトコンドリア単離のために生物学的サンプルをプールしてより高い細胞数を得ることができるかもしれません。さらに、このプロトコールでは糖鎖の放出ステップが重要です。N-グリコシダーゼF(PNGase F)は、最も内側のN-アセチルグルコサミン(GlcNAc)とアスパラギン残基との間のアミド結合を加水分解することにより、完全で無傷のN結合型糖鎖を放出するために使用されます27。N型糖鎖分析では、PNGase Fの活性を最適化して、ミトコンドリアタンパク質の完全な脱グリコシル化を達成することが重要です。溶媒への曝露と過剰な酵素によるタンパク質の変性により、ミトコンドリアタンパク質からのN型糖鎖の効率的かつ完全な切断と放出が確実に行われます。18-20時間の消化時間は、PNGase F反応26を完了することにより、N-グリカンの放出に最適です。
このプロトコルの潜在的な制限は、この方法では糖タンパク質のミトコンドリア抽出物が濃縮されていないことです。微量糖タンパク質は分析では検出されない場合がありますが、この方法により、レクチンアフィニティー精製や化学濃縮によって生じる誤差やバイアスを最小限に抑えることができます。IR-MALDESIは、同定された糖鎖の組成を高い信頼性で同定しますが、糖鎖残基間の結合に関する正確な情報を得るには、リチウム付加型糖鎖のタンデム質量分析を使用して、クロスリング切断28またはエキソグリコシダーゼ消化を強化するためのさらなる研究が必要です。あるいは、LC-MS/MS を IR-MALDESI アプローチに加えて、またはそれに代わるものとして使用することもでき、これにより、より深いグリカンカバレッジとより構造的な詳細が得られる可能性があります。しかし、これまでの研究では、IR-MALDESIによる代謝物の平均イオン量とLC-MS/MS29で決定される絶対量との間に相関関係があることが示されており、IR-MALDESIを用いた代謝物の直接定量の基盤が確立されています。IR-MALDESIのハイスループットな性質とMS2分析を実行して信頼性の高い構造確認を提供できることは、潜在的な糖鎖バイオマーカーおよび疾患診断のための前臨床および臨床サンプルの迅速なスクリーニングに役立ちます。さらに、核後上清を12,000 × gではなく3000 × gで遠心分離すると、ペルオキシソームおよびリソソームの汚染物質が最小限に抑えられますが、ミトコンドリア調製物にはこれらのタンパク質の痕跡が依然として存在する可能性があることに注意する必要があります。
結論として、この研究は、ミクログリア細胞のミトコンドリアグリコームの分析のための最小限のサンプル調製と、神経変性疾患の新規糖鎖ベースの治療標的の同定への応用に大きな可能性を秘めた、シンプルでハイスループットな方法を提示しています。このプロトコルは、ミクログリアからのミトコンドリア単離とその後のミトコンドリア糖質の分析方法の包括的な評価と標準化を提示し、大規模な前臨床および臨床研究のスケールアップを可能にします。このプロトコルには、N-グリカンの単離と検出にいくつかの利点があります:i)試薬ベースのプロトコールのミトコンドリア単離時間が短い(≤40分)。ii)糖鎖遊離のためのタンパク質の収量が高い。iii) N型糖鎖分析用に調製したミトコンドリアサンプルは、プロテオミクス分析、レクチン分析、ミトコンドリアフロー分析などの他の分子生物学的研究にも使用できます。iv)IR-MALDESI HRAM質量分析は、ハイブリッドイオン化およびソフトイオン化戦略28により、シアログライカンやスルホグリカン30のような荷電糖鎖の化学的誘導体化を必要とせずに、N型糖鎖の迅速かつ改善された検出を可能にする。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
著者らは、質量分析プロトコルのビデオ録画に協力してくれたNCSUのMuddiman研究室の大学院生であるSeth Eisenbergに感謝します。この研究は、アラバマ大学バーミンガム校の工学部イノベーションフェロープログラムによって部分的に支援され、AG068309はD.J.T.、R01GM087964-12はD.C.M.でした。この原稿の回路図は、BioRenderを使用して描画されました。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amersham 600 imager | Cytvia | 29194217 | Gel and membrane imager |
| Countess 3 automated cell counter | Fisher Scientific | X003SZ1LY9 | |
| Dry Bath Stdrd 4 blck 100-120V | Thermofisher scientific | 88870003 | |
| i-Blot2 Gel Transfer Device | Invitrogen | IB21001 | Western blot transfer system |
| Inverted microscope | Cell Treat | 04355223EA | |
| Microplate reader | 82050-760 | ||
| Mini gel tank | Invitrogen | A25977 | |
| Open Air Rocker | Fisher Brand | 88861025 | |
| Pipet boy | BioTek | 229310 | |
| Vortex mixer | Integra- VWR | ||
| Mitochondria isolation reagents | |||
| Mitochondrial Isolation kit | Thermofisher scientific | 89874 | |
| Phosphotase Inhibitor | Thermofisher scientific | 1861274 | |
| Protease Inhibitor | Thermofisher scientific | 1861281 | |
| N-glycan isolation and IR-MALDESI reagents | |||
| Acetic acid | Fisher Scientific | A11350 | 50% in ESI solvent |
| Acetonitrile | Sigma Aldrich | 34851-4L | 1 mM in ESI solvent |
| Ammonium bicarbonate | Fisher Scientific | A643500 | 100 mM |
| Calibration Solution | Thermofisher Scientific | A39239 | Pierce FlexMix |
| Dithiothreitol | Sigma Aldrich | AC426380100 | 1 M |
| Iodoacetamide | Sigma Aldrich | A322-10VL | |
| LC/MS grade water | Thermofisher Scientific | 047146.M6 | |
| PNGase F | Bulldog Bio | NZPP010 | 75000 U/mL, enzyme for N-glycan release |
| N-glycan isolation and IR-MALDESI consumables | |||
| Amicon centrifugal filters | Fisher Scientific | UFC501024 | 10 kDa MWCO |
| Mass spectrometer | Orbitrap Exploris 240 | ||
| Mid-IR Laser | JGM Associates, Burlington, MA, USA | ||
| Teflon microwell slide | Prosolia, Indianapolis, IN, USA | ||
| N-glycan analysis softwares | |||
| GlycoMod | Expasy | https://web.expasy.org/glycomod/ | |
| GlyConnect | Expasy | https://glyconnect.expasy.org/ | |
| Protein isolation and western blot consumables | |||
| Basix gel loading tips ( 10 µL) | Basix | 13-611-102 | |
| Basix gel loading tips ( 200 µL) | Basix | 13-611-116 | |
| Cell scrapper | VWR labs | 14-388-100 | |
| i-Blot NC regular stacks | Invitrogen | IB23001 | |
| i-Blot2 PVDF Regular Stacks | Invitrogen | IB24001 | |
| 10 µL micropipette | Fisher Scientific | FBE00010 | |
| 20 µL micropipette | Invitrogen | FBE00020 | |
| 200 µL micropipette | Fisher Brand | FBE00200 | |
| 1000 µL micropipette | Fisher brand | FBE01000 | |
| 10 µL pipet tips | VWR labs | 76322-528 | |
| 20 µL pipet tips | VWR labs | 76322-134 | |
| 200 µL pipet tips | VWR labs | 76322-150 | |
| 1000 µL pipet tips | VWR labs | 76322-154 | |
| Well plate | Fisher brand | 14-388-100 | |
| Protein isolation and western blot reagents | |||
| Actin antibody ( Host : Rabbit ) | Cell Signaling Technologies | 8457T | |
| Anti-Rabbit IgG HRP Linked | Cell Signaling Technologies | 7074S | |
| Bolt 4-12% Bis-Tris Plus | Invitrogen | NW04120BOX | |
| Bovine Serum Albumin | Fisher bioreagents | BP9700-100 | |
| COXIV antibody ( Host : Rabbit) | Cell Signaling Technologies | 4844S | |
| GAPDH antibody ( Host : Rabbit) | Cell Signaling Technologies | 2118S | |
| MicroBCA protein assay Kit | Thermofisher scientific | 23235 | |
| Nupage MOPS SDS Runing Buffer [20x] | Thermofisher scientific | NP0001 | |
| PAGE Ruler prestained protein ladder | Thermofisher scientific | 815-968-0747 | Dilution= Use 7 µL to load onto first well |
| Phosphate buffered saline | Aniara Diagnostics | A12-9423-5 | Prepare 1x PBS from 10x powder |
| Pierce ECL Western Blotting Substrate | Thermofisher scientific | 32106 | Chemiluminescent substrate kit |
| RIPA Buffer | Thermofisher scientific | 89901 | |
| Sample Buffer | Novex | B0007 | The bolt LDS sample buffer is prepared in 3:1 ratio of sample to sample buffer |
| Tween-20 | MP Biomedicals | TWEEN201 | |
| Tissue culture consumables | |||
| Countess Slides | Avantor | 229411 | |
| Eppendorf tubes | Cell Treat | 414004-265612-5884 | |
| 2 mL aspirating pipet | Vista lab | 5090-0010E | |
| 5 mL serological pipet | Fisher Scientific | 13-678-11D | |
| 10 mL serological pipet | Basix | 13-678-11E | |
| 25 mL serological pipet | Vista lab | FB012937 | |
| 50 mL serological pipet | Vista lab | 14955233 | |
| 15 mL Conical tube | Avantor | 229225A | |
| 50 mL conical tube | Cell treat | 4190-0050 | |
| T-75 cm2 Tissue culture flask | Fisher Scientific | FB012937 | |
| T-180 cm2 Tissue culture flask | Fisher Scientific | FB012939 | |
| Tissue culture reagents | |||
| BV2 microglial cell line | Creative Bioarray | CSC-I2227Z | Immortalized Mouse Microglia (BV2) derived from C57/BL6 neonatal microglia |
| Cell dissociation enzymes | Thermofisher scientific | 12563029 | TrypLE |
| Dulbecco's Modified Eagle Medium (DMEM) Low Glucose Media | Gibco | 10567014 | |
| Fetal Bovine Serum | Cytiva | SH30071.03HI | |
| Minimum Essential Medium (MEM) Non-essential Amino Acids | Gibco | 11140050 | |
| Penicillium Streptomycin | Cytivia | SV30010 | |
| Phosphate buffer saline | Corning | 21-040-CV | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved