Method Article
두 번째 상부 대구치에서 나일론 결찰에 의해 유발된 진행성 치주염의 쥐 모델
요약
본 연구는 생쥐에서 치주염을 유발하기 위한 변형된 6-0 나일론 결찰 방법을 설명하며, 이는 재현성이 높으며 연구자들이 치주 질환의 발병에서 병리학적 결과에 이르기까지 치주염을 연구할 수 있는 대안을 제시합니다.
초록
치주 질환(PD)은 치아의 지지 조직에 영향을 미치는 염증성 질환으로 전 세계적으로 가장 널리 퍼진 질병 중 하나입니다. 이 병의 심각한 형태인 치주염은 연조직, 치아 및 뼈를 파괴합니다. 치주염의 동물 모델은 영장류, 개, 소형 돼지 및 생쥐를 사용하여 개발되었습니다. 이 중 ligature-induced mouse model은 인간 치주염의 주요 측면을 효과적으로 복제하는 동시에 빠른 질병 진행, 재현성, 예측 가능성 및 저렴한 비용과 같은 이점을 제공합니다. 결찰자를 사용하는 마우스 모델은 치주 조직의 미생물학 및 면역학적 미세환경에 대한 귀중한 통찰력을 제공하여 면역 반응에서 생물막의 중요한 역할과 전신 질환과의 연관성을 강조했습니다. 이 연구는 마우스에서 치주염을 유발하기 위한 변형된 나일론 결찰 방법을 제시합니다. 수정에는 실크 봉합사 대신 나일론 봉합사를 사용하고 접점을 통과하지 않고 치간 접촉 부위 아래에 배치하는 것이 포함됩니다. 이 접근법은 치주염을 효과적으로 유발하는 동시에 기술을 단순화합니다. 봉합사 배치에 대한 자세한 방법론이 그래픽으로 설명되어 있으며 조직학적 및 조직학적 분석을 통해 치주염의 진행을 보여줍니다.
서문
치주 질환(PD)은 치아를 지지하는 조직의 염증성 질환으로 세계에서 가장 흔한 질환중 하나입니다 1; 파킨슨병 발병률은 전 세계적으로 20%-50%인 것으로 보고되었습니다2. PD는 진행 정도가 다릅니다. 치은염(gingivitis)이라고 하는 가벼운 형태는 연조직에만 영향을 미치며, 치주염(periodontitis, PT)이라고 하는 심각한 형태는 뼈와 같은 단단한 조직에 영향을 미칩니다3. PT는 염증성 질환이기 때문에 당뇨병5, 심혈관 질환6, 임신 부작용7 또는 자간전증8과 같은 호르몬 상호작용, 염증성 질환9, 심지어 안구 변화10 또는 치매11와 같은 질병 진행을 변화시킬 수 있는 여러 위험 요인4에 의해 변형될 수 있는 복잡한 면역 반응으로 간주되어야 한다.
그러므로, PT의 발병 또는 유병률과 관련된 병인을 이해하거나, 새롭거나 더 효과적인 치료 전략을 시험하거나, 전신 질환과 PT 또는 치주 미생물군 사이의 상관관계를 확인하기 위해서는 동물 모델이 필요하다12.
효과적인 연구 방법을 선택하는 것은 PT의 발달을 이해하고 연구 질문에 적절하게 답변하는 데 중요합니다13. 수년에 걸쳐 PT 연구를 위해 다양한 동물 모델이 개발되었습니다. 그러나 영장류, 개, 토끼, 미니어처 돼지와 같은 모델은 비용이 많이 들고 사용하기가 복잡하다 14,15,16. PT의 쥐 모델, 특히 ligation-induced PT 모델은 빠른 개발, 재현성, 예측 가능성 및 저비용 등 많은 장점을 가지고 있습니다 17,18,19.
PT를 유도하기 위해 경구용 세균 접종, 지질다당류 주사 및 결찰 유도 10,20과 같은 여러 방법이 사용되지만 각각 장점과 단점이 있습니다17, 나일론 결찰에 의해 유도된 PT의 쥐 모델은 인간의 발달 메커니즘과 유사했습니다 20,21,22,23. PT는 상주 미생물총(microbiota)의 보유를 통해 발생하여 염증을 유발하고 조직 손실을 유발합니다. 또한, 마우스는 PT 연구를 위해 관심 있는 다른 세포 집단 또는 분자를 연구하기 위해 유전적으로 변형될 수 있습니다.
치과 결찰은 교정 와이어, 실크 봉합사(24,25) 또는 나일론 봉합사(26)와 같은 다양한 재료를 사용하여 수행할 수 있습니다. 생쥐에서 결찰에 의해 PT를 유도하는 가장 일반적인 재료는 실크입니다. 이 방법론은 Marchesan et al.18, Abe et al.27 및 Chadwick et al.22과 같은 다른 저자에 의해 설명되었으며, 각각 고유한 수정 사항이 있으며, 이러한 모든 방법은 여러 연구자에 의해 성공적으로 사용되었습니다28. 그러나 생쥐의 위쪽 어금니 주위에 실크 봉합사를 배치하는 것은 복잡할 수 있습니다. Marchesan et al.은 "ligature holder"의 사용을 제안했습니다. Abe et al. 및 Chadwick et al.은 접촉점을 통해 봉합사를 배치했지만 Chadwick et al.은 어금니 M1 및 M2 주위에 봉합사를 배치했습니다.
다양한 두께의 나일론 봉합사는 다양한 동물 모델에서 PT 개발에 사용되었습니다 29,30,31. Lima et al.31은 5-0 나일론 봉합사를 사용했습니다. 이전 연구에서는 6-0 나일론 봉합사를 사용했으며, 결과는 비슷했다28.
멀티필라멘트 봉합사와 비교하여, 나일론 봉합사는 비흡수성 모노필라멘트 합성물이며 염증성 조직 반응이 더 낮다32; 또한, 나일론 봉합사는 미생물 축적 33,34을 허용하며, 나일론 봉합사 12,14,17,19,24,27,35,37 의 통성 혐기성 박테리아와 함께 Fusobacterium nucleatum과 Porphyromona intermedia35,36의 접착에 대한 증거가 있습니다 (표 1).
이러한 특성으로 인해 염증 반응이 물질 축적보다는 박테리아 축적에 주로 집중될 수 있습니다. 또한 나일론은 실크보다 인장 강도와 같은 기계적 특성이 우수합니다38.
따라서, 본 연구에서, 치간 접촉 영역 아래에 M2 주위에 배치된 6-0 나일론 봉합사는 마우스에서 진행성 치주염의 발병을 유도했습니다. 이 접근 방식을 사용하면 일반 핀셋으로 합자를 배치할 수 있으며 결과는 일관됩니다. 30일 후, PT의 발달은 조직 측정 및 조직학적 분석을 통해 확인할 수 있습니다.
프로토콜
실험 동물과 관련된 모든 절차는 멕시코의 공식 표준 NOM-062-ZOO-1999에 따라 '실험 동물에 대한 생물 의학 연구를 위한 윤리적 프레임워크'를 엄격히 준수하여 수행되었습니다. 이 연구는 CE/FESI/072024/1765 프로토콜에 따라 FES-Iztacala(Facultad de Estudios Superiores Izzacala)의 윤리 위원회에 의해 승인되었습니다. 생쥐는 FES-Iztacala 동물 시설의 병원체가 없는 환경에서 음식과 물을 자유롭게 이용할 수 있는 동물 방에 수용되었습니다. 이 프로토콜은 이전에 Abe et al.27에 의해 설명된 방법을 수정한 것입니다. 생후 6주에서 8주 된 암컷 BALB/c 마우스(체중 16g)를 대조군(CTL)과 치주염(PT) 그룹으로 나누었습니다. 치주염은 지속적인 박테리아 부착을 촉진하고 심각한 만성 질환 진행을 유발하기 위해 0일차에 6-0 나일론 봉합사를 배치하여 유발되었습니다. 30일 후, 조직 분석을 통해 조직 손상 및 부착 손실(AL)을 평가하기 위해 모든 마우스를 안락사시켰습니다(기관 승인 프로토콜에 따라). 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 마취 준비
- 자일라진과 케타민의 희석액(1:10)을 주사 가능한 물(스톡)로 준비합니다. 4 °C에서 보관하고 4 주 이내에 사용하십시오.
- 각 마우스를 식별하고 무게를 측정합니다. 인슐린 주사기를 사용하여 근육 주사를 위해 자일라진(1mg/kg)과 케타민(2mg/kg)의 체중 기준 용량을 준비합니다.
- 마취액 총 용량의 50%를 뒷다리에 주입합니다. 반대쪽에서도 절차를 반복합니다.
- 쥐를 깊은 상자(10cm³)에 넣고 잠들게 하는데 약 3-5분이 걸립니다.
- 마우스가 완전히 깨어나 정상적으로 눈을 깜박일 수 있을 때까지 15분마다 각 눈에 하이프로멜로스 방울을 바르면 마취로 인한 안구 건조증과 각막 손상을 예방할 수 있습니다.
참고: 마우스는 대략적인 마취 시간인 45분 동안 관찰해야 합니다. 절차가 완료되기 전에 마우스가 깨어나면 절차를 일시 중단하고 마우스를 교체해야 합니다.
2. 동물 포지셔닝
- 마우스가 절전 모드로 전환되면 머리가 작업자를 향하도록 하여 작업대에 놓습니다. 긴장 없이 각 다리를 부드럽게 당기고 미세 기공 테이프로 고정하여 갑작스러운 비자발적 움직임을 방지합니다. 체온을 유지하기 위해 담요나 거즈로 마우스를 덮으십시오.
- 주둥이를 열어 두려면 교정 고무줄의 한쪽 끝을 위쪽 앞니에 놓고 다른 쪽 끝을 장력 없이 위쪽 홀더에 고정합니다. 아래 앞니 주위에 두 번째 교정 고무줄을 놓고 고무 밴드로 아래 홀더에 고정합니다.
- 볼 세퍼레이터를 놓고 더 잘 보이도록 혀를 한쪽으로 조심스럽게 움직입니다.
- 가장 낮은 배율의 대물렌즈부터 시작하여 위쪽 어금니를 적절하게 시각화할 수 있도록 현미경을 배치합니다. 위치를 찾으면 배율을 조정하여 작업자가 최적의 편안함과 집중력을 얻을 수 있도록 합니다.
3. 합자 배치
- 이미지가 선명해지면 3개의 위쪽 어금니, 즉 가장 큰 근위 어금니(M1), 다음 어금니(M2), 가장 작고 원위 어금니(M3)를 식별합니다. 6-0 나일론 봉합사는 직경이 합자 배치를 용이하게 하고 넓은 봉합사보다 조직에 기계적 손상을 덜 일으키기 때문에 배치합니다.
- M2의 말단부를 찾아 핀셋으로 6-0 나일론 봉합사의 끝을 잡고 팁을 구개에서 유두 바닥에 놓습니다. 치간 구개 공간의 기저부를 통해 협측 표면을 향해 가벼운 압력을 가합니다(그림 2A).
- 6-0 나일론 봉합사가 교차하면 치간 공간을 통해 협측 쪽으로 당깁니다(그림 2B).
- 6-0 나일론 봉합사의 끝을 협측 측에서 M2의 근심 표면에 있는 치간 영역의 기저부에 놓습니다. 봉합사의 끝을 부드럽게 밀어 치간 공간 아래를 가로지르고 협측 공간을 통해 구개로 다시 통과시킵니다(그림 2C).
- 6-0 나일론 봉합사를 부드럽게 당기고 핀셋으로 팁을 잡고 M2 주변으로 조정하고 세 개의 간단한 매듭으로 봉합사를 고정합니다.
- 가는 가위로 6-0 나일론 봉합사를 자릅니다(그림 2D).
4. 동물 회복
- 마우스를 해제하려면 뺨 분리기, 다리의 미세 기공 테이프 및 교정 고무줄을 제거하십시오. 먼저 아래 앞니 주위의 고무줄을 제거한 다음 위 앞니 주위의 고무줄을 제거합니다.
- 작업대에서 마우스를 제거하고 거즈나 천으로 싸서 앞면이 위로 향하게 놓습니다. 기도를 열고 막히는 것을 방지하기 위해 혀를 옆으로 유지하십시오.
- 동물을 따뜻하게 하고 천이나 거즈로 덮고 완전히 깨어날 때까지 관찰하십시오. 그런 다음 일반 케이지에 넣으십시오.
- 마우스가 정상적으로 깜박일 수 있을 때까지 각 눈에 하이프로멜로스 방울을 바르십시오.
- 동물을 표준 조건에서 유지하십시오.
5. 합자 확인
- 매주 나일론 합자의 영속성을 확인하십시오(그림 3A, B).
- 마우스를 잡고 머리와 몸통을 단단히 잡고 핀셋을 사용하여 주둥이를 엽니다. 램프 조명 아래에서 M2 주변의 6-0 나일론 봉합사를 관찰하십시오.
- 생물막 축적과 기계적 자극을 기반으로 한 치주 질환의 발병을 확립합니다. 조직학적 분석을 통해 이를 확인하십시오.
6. 조직학
- 30일 후, CO2 챔버에서 마우스를 안락사시킵니다(기관에서 승인한 프로토콜에 따름). 이전에 보고된 대로 상악골을 수확합니다39. 채취한 조직을 0.9% NaCl 용액으로 세척하고 라벨이 부착된 새 마이크로 원심분리기 튜브에 넣습니다.
- 교반과 함께 4% 파라포름알데히드 용액에 샘플을 2시간 동안 고정합니다.
- 샘플을 수돗물로 2시간 동안 씻습니다.
- 뼈에서 미네랄을 제거하고 고품질 파라핀 절편을 준비하기 위해 마이크로 원심분리기 튜브에서 20일 동안 4% EDTA(pH 7.3) 용액 20부피에 샘플을 석회질화하고 4일마다 EDTA를 교체합니다40.
- 샘플을 파라핀에 넣습니다. M2 영역의 5μm 절편을 절단하고 Hematoxylin 및 Eosin (H&E)41로 염색합니다.
7. 데이터 분석
- 광학 현미경으로 염색된 조직학적 단면을 관찰하여 열구 상피, 치은 섬유, 치주 섬유, 높이 및 폐포 능선 무결성의 구성 변화에 대한 설명 분석을 수행합니다.
- 시멘트 에나멜 접합부(CEJ)와 골마루의 가장 높은 지점 사이의 거리를 측정하여 부착 손실(AL)을 측정합니다. 디지털 편집 프로그램을 사용하여 이 두 점 사이에 선을 긋습니다. Semenoff et al.42 (그림 4)에 설명된 방법론에 따라 협측 및 구개 표면에 대한 조직 분석을 수행합니다.
8. 통계 분석
- Mann-Whitney U 검정을 사용하여 CTL 및 PT 그룹에서 얻은 데이터를 분석합니다. p < 0.05를 통계적으로 유의한 것으로 간주합니다. 분석을 위해 통계 및 그래프 소프트웨어를 사용하십시오.
결과
이 방법론을 통해 유도된 마우스는 2주째부터 치주염(PT)이 발생할 수 있습니다. 생쥐는 결찰의 존재를 확인하기 위해 매주 모니터링되었습니다. 안락사는 30일째에 시행되었다. 모든 그룹의 임상적 특성을 평가했다. 대조군은 시간이 지남에 따라 색깔과 가장자리 치은의 구조와 같은 정상적인 특성을 유지했습니다. CTL 그룹과 비교했을 때, PT 그룹 조직은 염증, 출혈 및 치주낭 형성을 보였으며, 이는 유도된 마우스의 치은 가장자리에서 관찰되었습니다(그림 5).
이 질병의 진행은 두 그룹 모두에서 M2의 치주 조직의 AL에 대한 조직학적 및 조직학적 분석을 수행하여 확인되었습니다. CTL 그룹은 건강한 조직과 유사한 조직학적 특성을 나타냈습니다: 가장자리 및 열구 치은의 상피, 치은 섬유(그림 6A, CTL 파란색 화살표), 접합 상피 및 폐포 능선(그림 6A, CTL 녹색 화살표); 결합 조직 섬유는 정상적인 위치와 높이에 있었습니다. Sharpey의 섬유는 치조골과 뿌리 시멘트에 삽입될 때 손상되지 않았습니다. 그리고 뿌리 주위의 대칭 두께(그림 6A, CTL 주황색 화살표)가 관찰되었으며, 특히 협측과 구개구 보기 모두의 부착물에서 관찰되었습니다. 치주인대(PDL) 섬유, 결합 조직 및 치조골의 골세포에 있는 세포핵이 명확하게 보였다(40x). PT 그룹에서는 치주 조직이 심각한 손상을 보였으며, 치주 낭(神街)이 존재하며, 치조능선(自鳴賳)의 소실(그림 6A, PT, 녹색 화살표), 상피의 정점 이동 및 뿌리 표면의 샤피 섬유(Sharpey fibers)의 박리(그림 6A, PT, 주황색 화살표)를 특징으로 합니다. 결합 조직에서 치은과 협측과 구개측의 뼈에는 세포핵이 부족하며(그림 6A, PT, 파란색 화살표), 모두 치주 질환의 특징입니다.
조직학적 분석은 CTL 그룹의 경우 골마루의 위치가 협측과 구개 양쪽에서 일정하다는 것을 보여주었습니다. 더욱이, CTL 그룹과 비교했을 때, PT 그룹은 조직 손실로 인해 협측 표면의 AL 깊이가 유의하게 증가했다(p=0.0001, 117.5 nm ± 6 vs. 209.17 nm ± 10). CTL 그룹과 비교했을 때, PT 그룹의 구개 표면적은 유의하게 컸다(p = 0.03, 175.25 nm ± 8 vs. 254.03 nm ± 50). 비록 양쪽 모두 조직 파괴를 나타냈지만, 이는 협측 표면보다 구개 표면에서 더 뚜렷하게 나타났으며, 깊이가 더 깊고 부착 손실이 더 컸습니다(그림 6B,C). 이러한 결과는 유사한 행동을 보인 이전에 발표된 결과와 일치한다28.
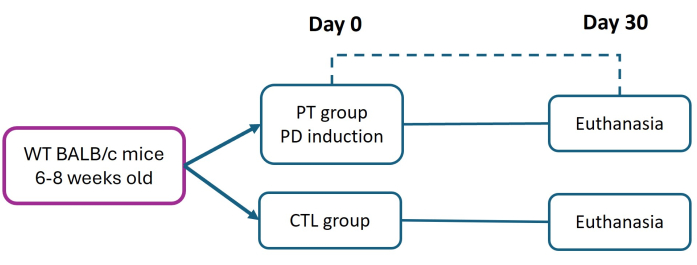
그림 1: 실험 설계. 치주염(PT)은 6-0 나일론 합자 모델(0일차)을 사용하여 6주에서 8주 된 BALB/c 마우스(16g)에서 유발되었습니다. 유도 후 30일, PT 및 건강한(CTL) 마우스는 치주 조직 평가를 위해 안락사되었습니다. 세 가지 독립적인 실험이 수행되었습니다. CTL 및 PT 그룹 모두에서 마우스의 총 수는 n = 9였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 치주염을 유발하기 위한 결찰 배치를 위한 단계별 절차. 마우스의 두 번째 상부 어금니에서 치주염을 유발하는 데 사용되는 일련의 단계에 대한 대표적인 이미지: (A) 6-0 나일론 봉합사가 구개에서 협측까지 M2의 원위부에 삽입되는 방법을 보여줍니다. (B)는 접촉 영역 아래에 압력을 부드럽게 가하는 방법을 보여줍니다. (C)는 나일론 봉합사가 구개에서 협측까지 M2의 근심 부분을 어떻게 통과해야 하는지를 보여줍니다. (D)는 나일론 봉합사가 M2 주위로 조정되고 합자 역할을 하기 위해 삼중 매듭으로 고정되는 방법을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
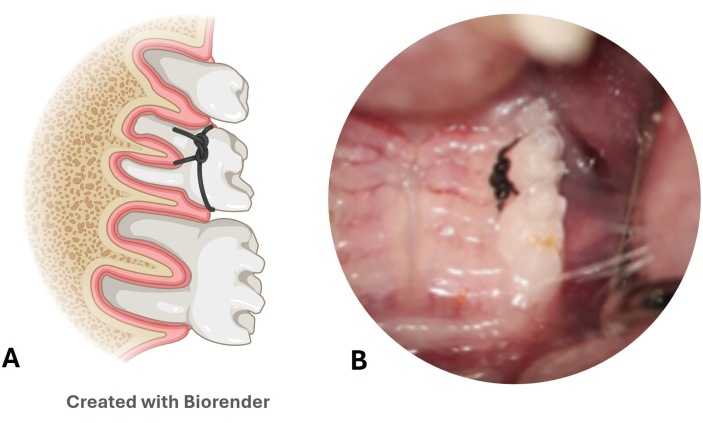
그림 3: 나일론 결찰 치주 질환 모델. (A) 두 번째 상부 어금니의 결찰 위치에 대한 그림. (B) 마우스 모델에 배치된 나일론 합자의 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 조직량 분석. 부착 손실(AL)은 시멘트에나멜 접합부(CEJ)와 치조능의 가장 가까운 지점 사이의 거리를 고려하여 결정되었으며, 협측 및 구개 표면의 두 지점 사이에 선을 그렸습니다. 참고: V(B): 협측, P 구개. 배율 : 10 배; 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
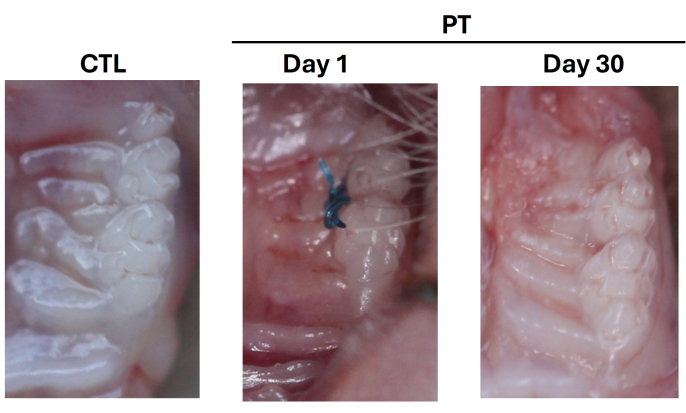
그림 5: WT 마우스에서 치주염의 임상 징후 발달. 치주 조직의 대표적인 임상 이미지, CTL 대조군; PT, 치주 질환 1 일 나일론 6-0 봉합사 배치 후; 봉합사 제거 후 30일째. 세 가지 독립적인 실험의 대표 이미지가 수행되었습니다. CTL 및 PT 그룹 모두에서 마우스의 총 수는 n = 9였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
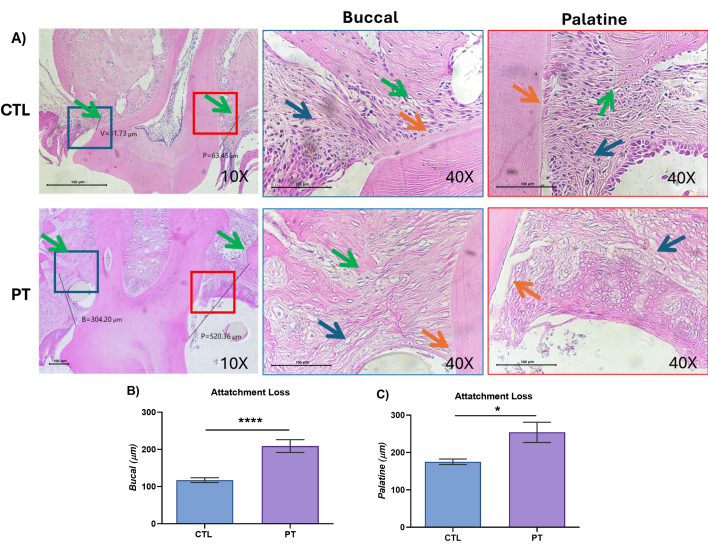
그림 6: 치주조직은 나일론에 의한 치주염 모델에서 부착 손실과 조직 손상을 보였다. (A) 치주 조직의 H&E 염색을 통한 대표적인 조직학적 이미지, 대조군(CTL); 치주염(PT), 왼쪽 패널 10x, 조직 분석 결과가 표시되며, 시멘트 에나멜 접합부(CEJ)에서 폐포 능선의 가장자리, 협측(B), 구개(P)까지 선이 표시되며, 파란색 상자 협측 빨간색 상자 구개로 표시됩니다. 오른쪽 패널: buccal 및 palatine, 40x에서 근접 배율. 파란색 화살표, 결합 조직; 주황색 화살표, 치주 시멘트에 치주 인대 삽입; 녹색 화살표, 뼈 볏. 스케일 바 = 100μm. (B, C) CEJ 및 폐포 능선의 가장 높은 지점의 조직 측정 분석. 세 가지 독립적인 실험의 대표 이미지가 수행되었습니다. CTL 및 PT 그룹 모두에서 마우스의 총 수는 n = 9였습니다. 데이터는 SEM± 평균으로 표현되며, Mann-Whitney U 검정에 따라 *p < 0.05 및 ****p < 0.0001의 값이 통계적으로 유의한 것으로 간주되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 재료 | 유도 | 장점 | 단점 |
| 비단 | 치간 공간을 통과 | 높은 박테리아 부착력 | 삽입하려면 기술이 필요합니다. |
| 멀티필라멘트 봉합사 | 쉽게 찢어짐 | ||
| 자연적 기원 | 합자 손실 | ||
| 교정 와이어 | 치간 부위에 삽입 | 더 쉽게 배치할 수 있습니다. | 조직 손상을 방지하기 위해 조심스럽게 삽입해야 합니다. |
| 저항 | |||
| 나일론 | 접점 아래 삽입 | 더 쉽게 배치할 수 있습니다. | 확대 필요 |
| 재료에 의한 조직 손상 없음 | 매듭은 변위될 수 있습니다. | ||
| 저항성 및 유연성 | |||
| 치주균 부착 |
표 1: 생쥐의 결찰에 의해 치주 질환을 유발하는 데 사용되는 다양한 재료.
토론
미생물 및 면역 반응과 같은 다양한 측면을 평가하기 위해 여러 동물 치주염 동물 모델이 사용되었으며, 인간 질병과 몇 가지 유사점이 있다43. 이러한 발견은 생물막의 역할, 면역 반응 및 전신 상태와의 상호 작용과 같은 치주 질환의 틀에 대한 증거를 제공합니다44,45.
치주염의 동물 모델은 서로 다른 복잡성과 유사점을 가지고 있습니다. 예를 들어, 인간이 아닌 영장류, 개 또는 미니어처 돼지는 인간의 치주 질환과 가장 유사하지만, 이를 다루고 유지하기 위한 비용과 필요성으로 인해 이러한 모델은 실용적이지 않다. 또한 치주염의 마우스 모델은 비용이 저렴하고 다루기가 쉽습니다. 더욱이, 마우스는 특정 관심 분자 또는 세포를 생성하도록 유전적으로 변형될 수 있으며46, 그 방법론은 잘 확립되어 있습니다47.
생쥐는 자연적으로 PT를 개발하지는 않지만 다른 방법론에 의해 유도될 수 있습니다. 가장 일반적으로 사용되는 모델은 합자 유도 모델이며, 이는 교정 와이어, 실크 또는 나일론과 같은 여러 재료가 사용되었기 때문에 재현성이 높습니다22,23.
특히, 나일론은 PT를 유도하는 실행 가능한 옵션일 수 있습니다. 그 특성 중 일부로 인해 합성 모노 필라멘트로서 조직 반응이 최소화되고 Fusobacterium nucleatum 및 Porphyromona intermedia와 같은 치주 박테리아의 접착을 허용합니다 35 , 36 . 이로 인해 염증 반응이 "정상적인" 박테리아 축적으로 이어질 수 있습니다.
본 연구는 6-0 나일론 봉합사를 유도 모델로 사용하여 PT를 개발할 수 있는 대안을 제안하고, CTL 및 PT 마우스의 임상 및 조직학적 데이터를 분석하였다. 우리는 PT 그룹에 존재하는 치은 가장자리의 출혈, 염증 및 치주 주머니 형성과 같은 특성을 확인했습니다. 이러한 관찰은 조직 측정 분석을 통해 확증되었습니다. 특히 PT 손실의 정도가 유의하게 달랐다. 협측과 구개 표면 모두 조직 파괴를 보였지만 구개 표면에서 더 컸습니다. 이것은 아마도 협측벽이 인간보다 쥐에서 더 넓기 때문일 것입니다.
Lima 등[31 ]은 나일론 합자가 PT를 유도한다고 보고하였다. 그들은 5-0 봉합사를 사용했지만 협측 표면에 매듭을 놓고 15일 후 6 마이크로 CT로 직선형 뼈 손실을 측정했습니다. 6-0 나일론 봉합사를 사용하면서 매듭을 구개 표면에 놓고 30일 후에 조직 분석을 수행하여 심한 PT를 유도했습니다. 그 결과, M2 주위의 6-0 나일론 봉합사는 PT를 초래하는 것으로 밝혀졌다. Liberman 등은 뼈 손실을 평가하는 데 사용된 방법 간에 차이가 없다고 보고했다48.
이러한 결과는 제안된 모델이 재현 가능하고 몇 가지 장점이 있음을 보여줍니다. 첫째, 스레더를 사용하는 것과 유사하기 때문에 사용하기가 더 쉽습니다. 따라서 반드시 봉합사를 치간 공간 쪽으로 밀어내는 것은 아니며, 제한된 공간으로 인해 마우스의 구강 손상 위험이 증가합니다. 둘째, 이 모델은 자연적인 방식으로 생물막의 축적을 통해 PT의 발달을 가능하게 하고 치주 조직에서 만성 염증을 유발합니다.
이 모델에는 학습 곡선, 시각 보조 도구의 필요성, 현미경 또는 돋보기 사용과 관련된 문제 등 몇 가지 제한 사항이 있습니다. 또한 매듭과 결찰을 잃을 가능성이 존재하므로 자극적인 자극이 계속 존재하는지 확인하기 위해 결찰의 영속성을 확인하는 것이 필수적입니다.
요약하면, 이 프로토콜은 합자 배치를 용이하게 하는 6-0 나일론 봉합사에 의해 유도되는 고급 PT의 강력한 모델을 구축하는 데 필요한 단계를 설명합니다. 또한 마취제 투여, 확대 및 부착 손실 평가를 위한 방법론에 대해서도 자세히 설명합니다. 또한, 이 모델은 PT로 인한 염증성 뼈 손실과 관련된 숙주 특이적 메커니즘과 감염성, 종양성, 자가면역 또는 호르몬 기원의 질병 또는 장애 발병에서 PT의 역할을 조사하는 데 사용할 수 있습니다. 따라서 이 모델을 사용하여 생물막 축적 및 염증으로 인한 PT를 연구하면 치료적 의미가 있는 기본 지식을 생성하고 진단을 개선할 수 있는 잠재력이 있습니다.
공개
저자는 이 논문의 출판과 관련하여 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 멕시코주 과학기술위원회(COMECYT) 보조금 번호[FICDTEM-2021-072]와 연구 프로젝트 및 기술 혁신 지원 프로그램(PAPIIT)-UNAM(보조금 번호[IN-217021]의 일부 자금 지원을 받았습니다. 이 비디오를 제작하기 위해 제공된 시설에 대해 Endoperiodontología, FES Iztacala, UNAM의 전문 프로그램과 이 비디오 제작을 지원한 Rosalba Yañez Ortiz, DDS에 감사드립니다. 일부 피규어는 Biorender 프로그램(계약 번호 ME282NWCI1)으로 제작되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
참고문헌
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유