JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Improving Outcomes in Anteromesial Temporal Lobe Resections - A Demonstration of Resecting the Temporal Piriform Petition(전방측두엽 절제술의 결과 개선) - 측두엽 피질 절제에 대한 시연
요약
여기에서는 전방 측두엽 절제술에서 수술 중 신경외과적 지침에 대한 접근 방식을 보여주며, 특히 약물 내성 근심 측두엽 간질에서 점점 더 중요한 수술 표적으로 간주되는 영역인 이상피질의 측두엽 부분의 안전한 절제를 돕기 위해 tractography 및 해부학적 마스크의 사용을 강조합니다.
초록
전측두엽 절제술(ATLR)은 약물 내성 근심 측두엽 간질(DRmTLE)에 유용한 치료 옵션입니다. 이상형 피질(piriform cortex)이 DRmTLE에서 발작의 생성 및 전파에 중요한 역할을 하며, 이상형 피질의 측두부 부분의 절제는 발작 자유율의 현저한 향상과 관련이 있음을 시사하는 증거가 증가하고 있습니다.
여기에서는 고해상도 수술 전 확률론적 견인 조영술 알고리즘을 사용하고 관심 구조의 해부학적 마스크를 수술 중 신경 탐색 및 현미경 헤드업 디스플레이(HUD)에 융합하여 ATLR에서 이상형 피질의 측두엽 부분을 절제하는 방법을 제시합니다.
DRmTLE에 대한 포괄적인 수술 전 평가 및 조사를 받는 모든 환자는 수술 중 시술의 비디오를 녹화하는 데 정보에 입각한 서면 동의를 제공했습니다. 환자는 대규모 간질 수술 센터에서 간질 전문의, 간질 신경외과 의사, 신경 심리학자, 신경 정신과 의사 및 전기 생리학자로 구성된 전문 다학제 팀에 의해 식별되었습니다. 수술 전 이미징 파이프라인에는 중요한 구조의 묘사가 포함되었습니다. 여기에는 측두엽 피질(temporal piriform cortex)과 위험에 처한 필수 요관(예: 시신경 방사선 및 하전두-후두근막)에 대한 고해상도 확률론적 견인 검사가 포함되었습니다. 이들은 수술 전 체적 신경 항법 스캔에 공동 등록되었으며 수술 중 신경 항법 시스템에 업로드되었습니다.
여기에 제시된 것은 이상형 피질의 측두 부분의 절제를 포함하여 ATLR의 단계별 절차입니다. 이 프로토콜은 고급 구조 및 확산 MR 이미징과 수술 중 시각 보조 도구를 결합하여 중요한 회백질 구조와 백질 관의 해부학적 마스크를 수술실의 수술 워크플로우에 통합합니다.
서문
전측두엽 절제술(Anteromesial temporal lobe resection, ATLR)은 약물 내성 근심측두엽 간질(DRmTLE)에 대한 가장 효과적인 치료법이며1,2, 50%-70%의 발작 자유율과 상대적으로 낮은 이환율 3,4,5. 또한 이 시술은 삶의 질6,7,8, 고용률5, 심리사회적 웰빙9을 향상시키는 것으로 나타났습니다.
Spencer et al.10에 의해 기술된 표준 ATLR은 측두극, uncus, 편도체, 해마, parahippocampal gyrus 및 fusiform gyrus의 절제를 포함합니다. 시각(시방사선, 특히 마이어의 고리(Meyer's loop)11,12) 및 언어(예: 하전두-후두근막(inferior fronto-occipital fasciculus)13 및 아치형 근막(arcuate fasciculus)14,15)과 관련된 중요한 백질 경로는 외측심실의 측두각(temporal horn)에 접근할 때 부상의 위험이 있습니다. 다음 프로토콜은 고해상도 수술 전 확률론적 요로조영술과 관심 구조의 해부학적 마스크를 수술 중 신경 항행 및 현미경 헤드업 디스플레이(HUD)에 융합하여 이러한 백질 관을 피하는 접근 방식을 간략하게 설명합니다.
이 분야의 전통적인 이해는 최대 해마 절제술이 수술 후 발작 자유율을 극대화하는 데 유익하다는 것입니다. 그러나 ATLR 후 사례에 대한 최근의 복셀 분석은 ATLR에서 이상형 피질의 측두부 부분을 절제하면 발작이 자유로워질 가능성을 크게 증가시킨다는 것을 보여줍니다. 그들은 또한 후방 해마 절제술과 발작 자유 사이에 연관성이 없음을 보여주었다16,17. 따라서, 기억 기능을 보존하기 위해 언어 우세 반구 ATLR에서 해마 절제술을 해마의 전방 55%로 제한함으로써 스펜서의 기술을 업데이트하는 것이 제안되었습니다16,18.
새로운 최소 침습 요법, 특히 레이저 간질성 열 요법(LITT)의 사용에 대한 관심이 높아지고 있지만, 외과적 절제술은 여전히 약물 내성 국소 간질에 대한 표준 치료법으로 남아있으며1, LITT의 효능은 ATLR(60%-70%)에 비해 엥겔 1 발작 결과의 비율이 더 낮은(58%-59%)1,19 것으로 나타났습니다3, 4,5,20, 그리고 여전히 추가 조사가 필요한 영역입니다21.
이상형 피질(그림 1)이 근막 측두엽 간질이 있는 성인 16,17,22,23,24 및 소아25에서 발작의 전파 및/또는 간질 형성에 중요한 영역이라는 가설을 뒷받침하는 증거가 점점 더 많아지고 있습니다. piriform cortex는 측두엽26,27에 대한 entorhinal sulcus mesial 주위에 드리워진 3 층 allocortex (해마 피질의 배열과 유사)의 리본이며, 따라서 측두 엽과 전두엽의 합류점을 형성합니다. 따라서 그것은 문헌 22,25,28,29,30에 자세히 설명 된 전두엽 및 측두부 분할로 구성된 것으로 쉽게 간주 될 수 있습니다.

그림 1: 뇌의 근심 측두 구조의 반투명 3차원 렌더링. 이 그림은 piriform cortex(cyan)와 주변 mesial temporal lobe 해부학의 해부학적 연관성을 보여줍니다. 왼쪽 내측, 중앙 상부 및 오른쪽 전방 시야. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이상형 피질(piriform cortex)은 편도체(amygdala)의 상부(supero-mesial)이며, 간질성 방전을 퍼뜨리는 네트워크의 공통 노드로 오랫동안 동물 연구에서 연루되어 왔으며 31-33 편도체와 해마를 포함한 주변 근심 구조보다 전기 자극에 따른 발작을 더 쉽게 일으킵니다 34. 시상(thalamus), 후각구(olfactory bulb), 편도체(amygdala) 및 해마(hippocampus)뿐만 아니라 내후피질(entorhinal, limbic, orbitofrontal, insular cortices)과 광범위하게 연결되어 있는 이 식물의 위치는 국소 간질에서 간질 방출의 주요 전파 경로로서의 역할에도 적합합니다30.
EEG-fMRI 및 양전자 방출 단층 촬영 (PET) 연구는 DRmTLE에서 이상형 피질의 중요한 역할을 더욱 뒷받침하여 간간 활성화를 보여주고 이상형 피질에서 γ-Aminobutyric acid type A (GABAA) 수용체 결합이 발작 활성 증가와 관련이 있음을 보여줍니다 35,36,37.
DRmTLE에 대한 두 가지 중요한 최근 이미징 연구는 수술 후 발작의 자유가 이상형 피질의 더 큰 절제 범위와 관련이 있음을 보여주었습니다. Galovic 등은 대규모 후향적 코호트에서 이상피질의 절반 이상을 제거하면 발작이 없어질 확률이 16배 증가한다고 입증했다(95% CI, 5-47; p < 0.001)17. 또한 다른 근심 측두엽 구조의 절제 용적이 발작 자유와 관련이 없다는 것이 입증되었는데, 이는 좌측 TLE의 이상형 피질 절제술만이 발작 자유와 관련이 있음을 보여준 Sone 등이 수행한 복셀 단위 분석에 의해 복제되고 뒷받침되는 발견입니다16 (그림 2).
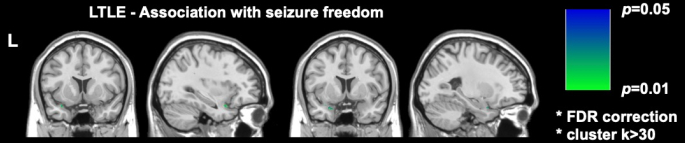
그림 2: 좌측 TLE에서 수술 후 발작 자유와 복셀 현명한 연관성. 발작 자유와 유의미한 상관관계가 있는 유일한 영역은 이상형 피질의 측두 부분, p = 0.01(관상 및 시상 T1 가중 MRI 절편에서 녹색)입니다. Sone et al.16 에서 발췌한 내용을 허락을 받아 발췌함. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Borger 등은 또한 대규모 후향적 코호트에서 절제된 측두엽 이상피질의 비율만이1년3 과 더 긴 추적 관찰(평균 3.75년)에서 발작 자유율 향상과 관련이 있음을 입증했습니다23. 그들은 또한 해마와 편도체의 절제 부피가 발작 자유를 예측하지 않는다는 것을 확증했습니다.
mTLE에서 이상피질(piriform cortex)이 비정상적인 간질형성 네트워크(aberrant epileptogenic network)와 단절되는 것의 중요성은 LITT에서도 입증되었는데, Hwang 등은 6개월 추적 관찰에서 이상피질 절제 비율이 ILAE class 1 결과38 (OR 1.051, 95% CI 1.001-1.117, p = 0.045)와 연관되어 있음을 보여주었으나, 이는 1년째 시점에서 유의하지 않은 경향이었다5. 이는 LITT에 관한 새로운 데이터, 즉 발작 결과의 긍정적이지만 잠재적으로 덜 영구적인 개선이 있다는 것을 뒷받침하는 것으로 보이며, 이로 인해 LITT는 일반적으로 "1단계" 절차로 사용되며 LITT로 인해 발작이 자유롭지 않은 사람들에게 절제 수술이 제공됩니다.
그러므로, 이상피질의 측두엽 부분의 절제가 약물 내성 근심 측두엽 간질에서 발작 자유를 달성하는 데 있어 핵심 목표라는 강력한 증거가 있습니다. 그러나 Galovic 등의 후향적 코호트에서 입증한 바와 같이, 이 내후각 피질의 리본은 ATLR을 수행할 때 외과적으로 표적화하기 어려운 위치에 있으며, 이는 직접 표적화되지 않은 경우 항상 성공적으로 제거되는 것은 아님을 의미합니다. 본 연구에서는 수술 후 발작 자유율 향상에 미치는 영향을 평가하기 위해 진행 중인 전향적 외과 연구의 일환으로 이상피질의 측두엽 부분을 안전하게 표적으로 삼고 절제하는 방법을 보여주었다39.
다음 프로토콜의 초점은 이미지 획득 및 처리의 기술적 측면, 수술 접근 방식 및 ATLR에서 이상형 피질의 측두엽 부분의 절제를 보장하는 동시에 고해상도 수술 전 확률론적 관료와 관심 구조의 융합된 해부학적 마스크를 수술 중 신경 항법 및 현미경 헤드업 디스플레이(HUD)에 통합하는 방법에 있습니다. 프로토콜은 또한 수술 검토 및 계획을 위한 다중 모드 이미징의 3차원 보기 및 통합을 허용하는 특정 계획 소프트웨어 플랫폼(40)과 수술 현미경과의 통합을 허용하는 신경 항법 시스템을 사용합니다(자세한 내용은 재료 표에 자세히 설명되어 있음).
프로토콜
이러한 방법 및 프로토콜은 2020년 10월 9일 보건 연구 당국(Health Research Authority, Research Ethics Committee(REC) London 참조: 20/LO/0966에 의해 승인된 진행 중인 전향적 수술 시험의 일부입니다. 프로토콜은 전향적으로 등록되었습니다: ISRCTN72646265는 2020년 9월 25일에 온라인39에서 사용할 수 있으며, 전국 컨퍼런스에서 발표되었습니다41.
다음 프로토콜은 18-70세 환자(성인 간질 수술 센터에서 DRmTLE를 위해 수술한 연령대의 환자)에서 DRmTLE에 대한 ATLR을 받는 모든 환자에게 적용되며, 모두 동일한 외과의(AWM, AM)가 수술합니다. 모든 참가자는 연구에 포함되기 전에 정보에 입각한 동의를 제공했습니다. 모든 참가자는 신경외과 의사, 간질 신경과 전문의, 신경심리학자, 정신과 의사, 신경방사선 전문의, 기타 전문 간질 치료 서비스 구성원으로 구성된 저자의 종합 간질 수술 센터의 전문 외과 간질 다학제 팀의 지시에 따라 철저한 수술 전 평가와 조사를 받았습니다. 수술 전, 모든 환자는 아래 프로토콜에 설명된 대로 최신 용적 T1, T2 및 FLAIR MRI를 받았고, 표준 수술 전 혈액 및 신경 마취 팀의 검토를 통해 전신 마취 하에 수술을 진행하는 것이 안전한지 확인했습니다. 이 연구에 사용된 시약 및 장비의 상업적 세부 사항은 재료 표에 나와 있습니다.
1. 이미징 획득 및 처리
참고: 고해상도 수술 전, 수술 후 3개월 및 1년 자기공명영상(MRI) 스캔은 저희 센터에서 간질 수술을 받는 환자를 대상으로 일상적으로 이루어집니다. MRI 데이터는 일관성을 위해 2020년 3월부터 2024년 3월 사이에 동일한 MRI 스캐너에서 획득했습니다. 표준화된 이미지 획득 및 많은 처리 구성 요소는 이전에 문헌에 설명되어 있으며 아래에 요약된 프로토콜에서 적절하게 참조됩니다.
- 다음 MRI 시퀀스를 획득합니다.
- IR-FSPGR(inversion-recovery fast spoiled gradient recall) 에코[에코 시간(TE) 3.1ms, 반복 시간(TR) = 7.4ms, 반전 시간 = 400ms, 시야(FOV) = 224 × 256 × 256mm, 매트릭스 = 224 × 256 × 256, 복셀 크기 = 1.00 × 1.00 × 1.00mm = 1.00mm = 1.00mm3, 병렬 이미징 가속 계수 = 2] 및;
- T2 이완 측정42에 사용되는 코로나 이중 에코 빠른 복구 빠른 스핀 에코 양성자 밀도/T2 가중치 시퀀스(TE = 30/119ms, TR = 7600ms, FOV = 220 × 220mm, 매트릭스 = 512 × 512, 슬라이스 두께 = 4mm, 복셀 크기 = 0.43 × 0.43 × 4.00mm = 0.74mm3, SENSE 계수 = 2).
- 위의 T1 가중 시퀀스를 측지 정보 흐름(GIF v3) 알고리즘에 대한 입력으로 사용하여 NiftyWeb43을 사용하여 뇌를 162개의 해부학적 영역으로 분류합니다.
- GIF 소포(parahippocampal gyrus, fusiform gyrus, hippocampal profiling, Hipposeg44를 사용하여 해마를 전방 55% 및 후방 45%로 분할)를 사용하여 관심 구조의 해부학적 마스크를 생성하고, 이를 환자의 체적 수술 전 영상의 계획 소프트웨어에서 오버레이합니다(1.1단계 참조).
- 자동화된 이상형 피질 분할을 수행하고 연구실 17,45,46의 이전 작업에서 설명한 체적 기법에서 이상형 피질을 전두엽 및 측두엽 구성 요소로 분할합니다. 생성되면 이 마스크를 환자의 수술 전 영상에 오버레이합니다.
- 다음과 같은 확산 MRI 이미지를 획득합니다.
- 표준 해상도 다중 쉘 획득(2mm 등방성 해상도, b-값 0, 300, 700, 2500 s/mm2에서 11, 8, 32 및 64 그라디언트 방향) 및;
- 고해상도 다중 쉘 획득(1.6mm 등방성 해상도, 101 방향, 14 b0, b 값: 300, 700 및 2500 s/mm2).
- MRtrix3 (https://mrtrix.org)47을 사용하여 획득한 확산 데이터를 다음에 대해 수정합니다.
- MRtrix3에서 "dwidenoise"를 사용한 노이즈48.
- 신호 드리프트49.
- MRtrix350에서 "mrdegibs"를 사용한 Gibbs-ringing.
- FSL TOPUP 알고리즘을 사용한 역위상 인코딩 그래디언트를 사용한 왜곡(https://fsl.fmrib.ox.ac.uk/fsl51).
- FSL의 와류 알고리즘 (https://fsl.fmrib.ox.ac.uk/fsl)52를 사용하여 와전류 및 이동 아티팩트, b 벡터53을 회전합니다.
- ANT 알고리즘을 사용한 바이어스 필드(https://mrtrix.org47,54).
- 다중 껍질, 다중 조직 CSD(Constrained Spherical Deconvolution)55 를 사용하여 백색질 및 회백질, 뇌척수액(CSF)에 대한 반응 함수를 추정합니다.
- 관심 섬유 다발 12,56,57을 재구성하기 위해 해부학적으로 표적화된 자동 트랙토그래피를 수행합니다: 광학 방사선, 하전두-후두근막(IFOF; 언어 우세 사례) 및 중종방향 근막(MLF, 언어 비우세 사례). 아래 단계를 따르세요.
- 각 파이버 번들에 대한 피질 종결점을 추출하고 시드 및 종결 ROI로 그룹화합니다.
- Non-terminating cortical regions를 사용하여 exclusion cortical regions와 ROI를 생성합니다.
- MRtrix347의 하이브리드 표면 및 부피 분할을 사용하여 확률론적 섬유 추적 알고리즘 iFOD259를 통해 해부학적으로 제한된 트랙토그래피(58)를 수행하고, 3억 개의 씨앗에서 최대 5,000개의 유선을 선택합니다.
- 각 파이버 번들에 대해 1.8.3단계의 tractography를 두 번 수행하여 시드 및 종료 ROI를 전환합니다.
- 결과 파이버 번들을 0.01 값으로 임계값이 지정된 확률적 맵으로 변환하고, 이를 추가 제외 기준으로 사용하여 스퓨리어스 유선을 제거합니다.
- 계획 소프트웨어에서 결과 섬유 다발(2mm 확장)과 해부학적 마스크를 검토하여 해부학적으로 정확한지 확인합니다(이 단계는 우리 병동에서 두 명의 간질 신경외과 의사가 수행합니다).
- 생성된 해부학적 회백질 및 백질 관 마스크를 1.1단계에서 참조 T1 가중치 MR 이미지에 공간적으로 등록하고 수술 중 MRI(iMRI) 수술실의 수술 중 내비게이션 시스템에 로드합니다.
- 수술 직전(< 24시간) 환자의 두피에 피부 기준점이 있는 T1, T2 및 T2-FLAIR 가중 체적 MRI 이미지를 획득합니다. 이러한 이미지를 서로 등록하고, 위에서 설명하고 그림 3에 설명된 T1 가중 참조 이미지 및 마스크를 함께 등록합니다.
- 표면 매칭 레이저와 스마트 포인터로 신경 내비게이션 시스템에 환자를 등록합니다.
- 정확성을 보장하기 위해 사례가 시작되기 전에 두 명의 간질 신경외과 의사와 함께 이미지 공동 등록 및 환자의 정확성을 확인합니다.

그림 3: 오른쪽 ATLR에서 수술 중 사용된 해부학적 마스크와 관을 겹쳐서 사용한 체적 T2 가중 MRI를 보여주는 신경항법 시스템의 스크린샷. 왼쪽 상단 패널: 해부학적 마스크를 보여주는 환자 머리의 3차원 재구성. 오른쪽 상단: 축방향, 왼쪽 하단: 시상, 오른쪽 하단: T2 가중치 체적 MRI 스캔에서 오버레이된 해부학적 마스크를 보여주는 관상 사진. 표시된 해부학적 마스크: 이상형 피질의 측두 부분(분홍색), 해마의 앞쪽 55%(빨간색), 해마의 뒤쪽 45%(짙은 녹색, 시상 이미지에서만 볼 수 있음), 광학 방사선(중간 녹색), 중간 세로 근막(파란색). 파란색 십자선은 현미경 초점의 통합 위치이고 녹색 십자선은 수술 영역 내에서 사용되는 신경 항행 포인터의 위치입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 외과 기술
참고: 아래 단계는 저자 센터에서의 실습을 요약한 것으로, ATLR에 대한 유일한 외과적 접근법에 대한 설명이 아니라 저자가 측두엽 피질 절제를 포함하여 신뢰할 수 있고 재현 가능한 절제술을 제공하기 위해 이 절차에 대한 접근 방식을 어떻게 표준화했는지를 보여주기 위한 것입니다.
- 포지셔닝 및 접근 방식
- 표준 수술 전 점검 및 안전 조치에 따라 환자를 누운 자세로 놓고 롤로 동측 어깨를 들어 올린 다음 머리를 반대쪽 쪽으로 돌립니다.
- 머리를 옆으로 구부려 말라 돌출부가 수술 영역의 가장 높은 지점이 되도록 하고 핀(3점 두개골 고정 장치 - 재료 표의 수술 중 [iMRI] 극장과 호환되는 것을 포함한 예 참조)을 고정합니다.
참고: 포지셔닝은 근심 및 후방 측두엽 구조, 특히 측면 굴곡에 대한 적절한 접근을 허용하여 말라 돌출부가 수술 영역의 가장 높은 지점이 되도록 하는 데 중요합니다. - 국소 마취제를 핀 부위와 피부 절개 부위에 침투시킵니다.
- 피부 기준점과 표면 추적(사용되는 신경 항법 시스템 브랜드에 따라 다름)의 조합을 사용하여 환자 공간을 신경 항법 시스템에 등록합니다. 만질 수 있거나 눈에 보이는 뼈/기타 해부학적 랜드마크에 대한 등록 정확도를 확인합니다.
- 이마선과 접합체의 뿌리를 표시합니다(수동 촉진으로 식별). neuronavigation을 사용하여 Sylvian 열구의 경과를 식별하고 표시하며, 계획된 곡선 전두측두엽 '물음표' 피부 절개를 합니다.
- 전기 이발기를 사용하여 계획된 피부 절개 부위를 따라 털을 제거합니다.
- 전두측두엽 1cm 전방에서 전두측두엽 절개를 물음표 모양으로 구부려 안면 신경의 전두측두엽 분지의 손상을 방지합니다. 가능한 경우 표재성 측두 동맥을 확인하고 보존합니다. 피부 절개 부위의 위치 및 표시는 그림 4에 나와 있습니다.
- 항균제에 적신 유양돌기 면봉과 Raney 클립으로 상처 가장자리를 덮고 고정합니다.
- 측두근을 절개하여 근피 또는 근막간/근막하 피판으로 들어 올립니다(안면 신경의 전두측두엽 분지 손상 방지).
- 항균 용액에 적신 거즈로 피부 피판을 감싸고 앞쪽으로 집어넣습니다(iMRI 극장에서 금속 고정 기구를 사용하지 마십시오).
- 천공기 드릴로 두개골에 2개의 버 구멍을 만듭니다: 첫 번째는 접합체의 뿌리 바로 위에 있어 하부 노출을 최대화하고, 두 번째 하부 정면은 실비안 열구의 시각화를 용이하게 합니다.
- 표준 전두측두엽 개두술60,61,62를 수행하여 실비안 열구에서 1cm 위의 상측두회와 중측두회를 노출시킵니다.
- 개두술의 앞쪽과 아래쪽 가장자리를 뚫어 중간 측두골 바닥과 앞쪽의 측두극에 쉽게 접근할 수 있도록 합니다. 유양돌기 공기 세포를 발견하면 뼈에 표면적인 층을 닫기 전에 뼈 왁스와 피브린 접착제로 밀봉하십시오.
참고: 개두술이 중간 두개골 포사의 바닥에 접근할 수 있도록 하는 것이 중요한데, 이는 측부 열구를 통해 외측 뇌실의 측두엽 뿔에 접근하기 때문입니다. 또한 유양돌기 공기 세포를 완전히 봉쇄하여 수술 후 CSF 누출 및 그에 따른 증상 및 잠재적 감염을 방지하는 것이 중요합니다. - U자형 방식으로 경막을 열고 베이스가 앞쪽으로 반사되고 별모양 방식으로 확장됩니다. 봉합사(예: 3-0 실크)로 경막을 수술 필드에서 멀리 매십시오.
- 중간 두개골 와사(middle cranial fossa) 기저부와 중간 두개골 포사(middle cranial fossa)의 앞쪽 측면에서 CSF를 방출합니다.
참고: CSF 방출 단계는 기저 측두엽에 대한 수축 및 긴장 없이 아래에서 중간 두개골 바닥과 측부 열구에 외과적으로 접근할 수 있는 충분한 작업 공간을 확보하는 데 중요합니다.
- 외측 신피질 제거
- 두개골 기저부에 수직인 선과 외측심실의 측두뿔의 전방 돌기와 일치하는 선으로 중간 및 하부 측두회(각각 MTG 및 ITG)의 피아를 응고합니다(신경 항행 시스템에서 확인됨). 이 선의 전방-후방 범위를 사례별로 조정하고, 발작 발병/전파에 측면 신피질이 관여했다는 수술 전 증거에 따라 다릅니다.
참고: 외측 신피질 절제술의 전후 범위는 발작 전파에 관여한다는 수술 전 증거(또는 증거의 부족)를 고려해야 하며, 이는 개별 환자에 맞게 조정됩니다. - ITG에서 경피질적 접근법을 사용하여 중간 두개골 포바닥을 노출시키고 부해마회(parahippocampal gyrus)의 측면이고 방추형 이랑(fusiform gyrus)의 내측에 있는 측부 열구(collateral sulcus)를 확인합니다.
- 위의 외측 신피질 절개 앞쪽에 있는 상측두회(STG)의 피아(pia)를 실비안 열구(Sylvian fissure)의 방향과 평행하게 응고합니다. 이것은 2.16단계에서 설명한 선에 수직이며 측두 극까지 앞쪽으로 확장됩니다.
- 중대뇌동맥의 가지를 보호하고, subpial dispir dispir 기법을 사용하여 STG와 Sylvian fissure 사이의 평면을 개발하고, 이 dissection을 insula의 하부 limiting sulcus 수준까지 Sylvian fissure의 수평 부분까지 운반합니다.
참고: 2.2.4단계에서 하부 절개를 수행하는 동안 실비안 열구와 접하는 STG의 pia의 무결성을 유지하기 위해 주의를 기울여야 하는데, 이는 열구의 중대뇌동맥 가지뿐만 아니라 안구 운동 신경 및 후방 통신 동맥(단계 2.2.14) 및 시신경(단계 2.3)과 같은 다른 구조를 보호하기 때문입니다. - 현미경을 신경 항법 시스템과 통합합니다.
- 섹션 1에 설명된 해부학적 마스크의 물체 오버레이의 정확도를 확인하고 이를 현미경 HUD에서 시각화합니다.
- STG의 절제를 최소화하기 위해 후방 절제선을 앞쪽 상부로 기울어지게 하고, MTG 및 ITG를 통해 방추회를 통해 측부 열구까지 점진적으로 확장한다.
- 가시화된 광학 방사선(OR) 마스크와 신경항법 시스템에 대한 후방 절제 가장자리의 관계를 확인합니다.
- 현미경에서 OR 마스크의 최대 전방 범위를 시각화하고 현미경 HUD의 절제 가장자리 뒤쪽에 있는지 확인하여 그림 5에서 볼 수 있듯이 수술 후 시야 결손을 초래할 수 있는 수술실의 손상이 없는지 확인합니다.
참고: 2.2.9단계는 시신경 방사선의 Meyer's loop 손상으로 인한 수술 후 시야 결손을 방지하기 위한 중요한 단계입니다. 뇌의 이동이 많고 외과의가 시신경 방사선의 손상 위험을 더욱 최소화하기를 원하거나 현미경의 HUD에 있는 투영이 제대로 작동하지 않는 경우, 저자는 신경 항행 포인터를 사용하여 외측 심실의 측두 뿔의 가장 앞쪽 끝에 접근하는 것을 목표로 할 것을 제안합니다. 이렇게 하면 OR 부상의 위험이 최소화됩니다. - 그림 6과 같이 측두엽 뿔(temporal horn)을 만날 때까지 측두열구(collateral sulcus)를 우월하게 따라갑니다(신경 항행 시스템에서 확인). 측두뿔의 벽은 푸른 빛을 띤 뇌실막으로 식별할 수 있습니다.
참고: 병리학이 해마 경화증이 아니고 해마 머리가 부피가 큰 개인의 경우 심실을 찾기 어려울 수 있습니다. 이러한 경우 문제 해결 옵션은 이동이 없는 내측 측두구 기저부에 있는 신경 탐색 포인터를 사용하여 심실 끝이 돌출된 위치를 찾는 것입니다. 일반적으로 코로나 평면에서 이것을 찾는 것이 도움이 됩니다. 심실을 찾을 수 없는 경우 먼저 극을 제거한 다음 초음파 흡인기로 심실을 찾는 것이 좋습니다. - 기저 측두엽 렙토메닝(basal temporal leptomeninges)을 측두뿔 노출(temporal horn exposure) 측면으로 나눕니다.
- 심실을 앞쪽으로 열어 해마 머리를 노출시킵니다( 그림 6 참조).
- 후방 절제 가장자리를 확장하여 심실에 대한 분리와 결합하면 신피질 블록의 분리가 가능합니다.
- tentorial edge의 가장자리에 있는 해부선을 따라 측두극을 동원합니다. 안구 운동 신경과 후방 통신 동맥을 포함한 근심 구조의 부상을 방지하기 위해 텐트 가장자리에서 분리를 수행하지 않도록 주의하십시오.
알림: 수조 cruralis 의 구조물이 손상될 위험을 줄이려면 텐트 가장자리를 넘지 않고 텐트 가장자리 모양을 따르십시오. uncus는 제자리에 남아 별도의 표본으로 취할 수 있습니다.
- 두개골 기저부에 수직인 선과 외측심실의 측두뿔의 전방 돌기와 일치하는 선으로 중간 및 하부 측두회(각각 MTG 및 ITG)의 피아를 응고합니다(신경 항행 시스템에서 확인됨). 이 선의 전방-후방 범위를 사례별로 조정하고, 발작 발병/전파에 측면 신피질이 관여했다는 수술 전 증거에 따라 다릅니다.
- 측두엽 피질(temporal piriform cortex)을 포함한 근심 측두엽 절제술(mesial temporal resection, including the temporal piriform cortex)
- 안구 운동 신경과 후방 통신 동맥이 보일 때까지 초음파 흡인기의 해부와 mesially 사용으로 uncus의 조직을 제거합니다. pes(해마두의 가장 근심 범위)가 시각화될 때 후방 절제의 범위를 중지합니다.
- 초음파 흡인기로 편도체 절제술을 수행하고, 내열구의 pia에 의해 우월하게 제한되며, 시신경이 시각화될 때까지, 그리고 기저 수조의 pial plane에 의해 mesially 제한됩니다.
참고: 2.3.2단계를 수행할 때 측두엽을 보존하고 전두엽에 들어가지 않도록 주의하십시오. 때때로, 뇌의 변화로 인해, 신경 항법은 절제의 정도를 과대 평가할 수 있습니다. 이와 관련하여, 절제술은 시신경이 PIA를 통해 가시화될 때까지 계속하는 것이 안전하며, 이는 절제술의 근심 경계를 나타냅니다. 이것은 또한 Usui et al.63에 설명되어 있습니다.편도체의 등쪽 가장자리는 일반적으로 맥락막점을 근위 중간 대뇌 동맥 분기점(proximal middle cerebral artery bifurcation)에 연결하는 가상의 선에 의해 근사화되는 것으로 설명됩니다64. - 인슐라의 하부 원형 열구의 정맥이 시각화될 때까지 실비안 열구의 측두부에서 열등하게 진행되는 하부 절개를 통해 잔류 조직을 제거하여 이상형 피질의 측두 부분이 절제되도록 합니다. 이것은 Usui et al.이 편도체-uncal 병변을 절제할 때 설명한 것과 유사한 절제 가장자리입니다63.
참고: uncus(2.3.1단계에서) 또는 이상형 피질을 제거하기 어려운 경우(때때로 pia mater에 매우 부착될 수 있음) 저자는 pia mater의 손상을 최소화하기 위해 초음파 흡인기 대신 Rhoton 해부기를 사용할 것을 제안합니다. - 그림 7과 같이 현미경 HUD에 오버레이된 1.4단계에서 설명한 해부학적 마스크를 사용하여 이상형 피질의 측두부 절제를 확인합니다.
- 해마 절제술
- 맥락막신경총(및 전방 맥락막 동맥)을 중측으로 후퇴시키기 위해 린틴(또는 이와 유사한 넓은 코튼노이드)을 배치하여 핌브리아 해마를 쉽게 시각화할 수 있습니다.
- fimbria hippocampi를 거미류 부착물에서 분리하여 Ammon의 뿔 동맥 혈관 아케이드를 운반하는 해마 열구를 노출시킵니다.
- 꼬리에서 해마를 분리합니다(16에 설명된 대로 언어 기억 결핍을 최소화하기 위해 이 절제술을 언어 우세 반구 절제술에서 해마의 전방 55%로 제한하거나 비언어 우세 반구 절제술에서 중뇌의 구조 수준만큼 후방으로 확장).
- pes hippocampi에서 해마 머리를 분리합니다. 필요에 따라 해마 동맥 아케이드를 응고시킵니다.
- 연결이 끊긴 해마 를 일괄적으로 제거합니다.
- parahippocampal gyrus 및 subiculum의 subpial dispiration을 수행하고 결과 수술 구멍에서 지혈을 보장합니다. 해마를 제거하여 뇌간을 시각화하고 보호합니다.
참고: 2.4.7 단계에서는 pes와 brainstem 사이에 보호 경계가 없으므로 2.4.7 단계를 수행할 때 주의해야 합니다.
- 수술 중 영상 및 봉합
- 수술 부위에서 모든 금속 부위를 제거하고 상처를 덮은 다음 일반적으로 체적 T1, T2, FLAIR 및 DWI 시퀀스를 포함한 수술 중 MRI 스캔을 수행합니다.
- 두 명의 간질 컨설턴트 신경외과 전문의와 함께 신경방사선 전문의와 함께 수술 중 영상을 검토하여 원하는 양의 근심 측두엽 구조(이상형 피질의 측두엽 부분 및 위에서 2.36단계에서 설명한 다양한 양의 해마 포함)가 성공적으로 절제되었는지 확인합니다. 또한 DWI 영상을 검토하여 시술 중 허혈 부위가 발생하지 않았는지 확인합니다.
- 위와 같은 사실이 확인되면 환자를 다시 수술대로 옮기고 환자를 위해 정상 긴장 상태에서 수술강 내 지혈을 확인합니다.
- 표준 방식으로 상처를 봉합하고, 뼈 피판을 교체하고, 3개 지점에 플레이트와 나사로 고정하고, 근육, 근막 및 피부층을 봉합사로 표준 봉합하여 수술용 상처 배액관을 24시간 동안 제자리에 둡니다.
참고: 수술 후 관리는 저자 센터에서 이루어지며, 일반적으로 처음 24시간 동안은 신경외과 의존도가 높은 병동에서 이루어지며, 의존도가 높은 병동에서 적절하다고 판단되는 경우 신경외과 전문 병동으로 내려갑니다. 환자는 신경학적 관찰을 위해 모니터링되며, 요소 및 전해질을 포함한 수술 후 혈액, 전체 혈구 수 및 감별을 가지고 있으며, 일반적으로 수술 후 약 72시간 후에 퇴원합니다. 그런 다음 4-6주 후에 외래 환자로 추적 관찰하고, 수술 후 최소 3-4개월 및 1년에 인터벌 이미징을 통해 추적 관찰합니다.
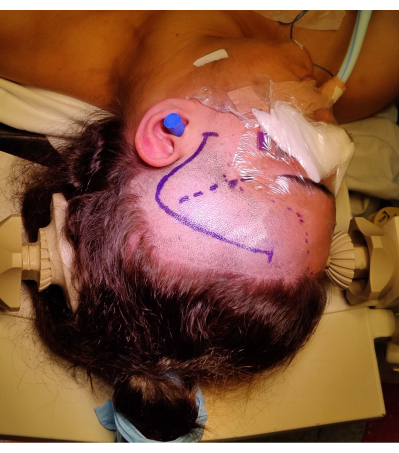
그림 4: 우측 ATLR에 대한 환자의 위치 이미지, '물음표' 우측 전두측두엽 피부 절개, 헤어라인 및 실비안 열구의 표시를 보여줍니다. 그림에는 나타나지 않은 것은 환자의 목에 과도한 부담을 주지 않고 정맥 복귀를 방해하지 않고 머리의 위치 각도를 허용하기 위해 환자의 왼쪽 어깨 아래로 왼쪽 어깨를 굴리는 것입니다. 이미지를 캡처하여 환자의 동의하에 포함시켰습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 오른쪽 ATLR에서 외측 신피질 절제 가장자리를 보여주는 현미경의 수술 중 이미지, 시신경 방사선의 오버레이된 해부학적 마스크(청록색)와 함께 절제 가장자리가 수술실 앞쪽에 있음을 보여줍니다. 레이블은 수술 보기의 방향을 보여줍니다: A = 전방, P = 후방, I = 하측, S = 상회, STG = 상측두회, MTG = 중간 측두회, ITG = 하측두회, TP = 측두극. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
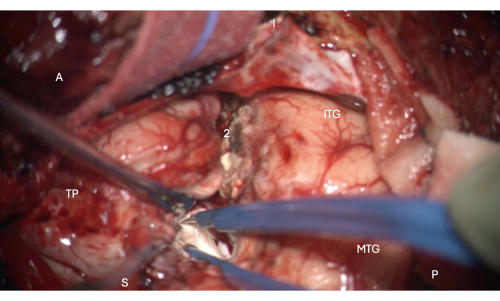
그림 6: 외심실의 측두뿔의 앞쪽 부분으로 들어가는 것을 보여주는 현미경의 수술 중 이미지, 그 안에 있는 해마의 머리(옅은 흰색, 1). 라벨: A = 전방, P = 후방, I= 하측두회, S = 상회, MTG = 중측두회, ITG = 하측두회, 2 = 외측 신피질 절제 가장자리, 측심실의 측두뿔을 찾기 위해 깊이에서 측두열구를 상위로 따라, TP = 측두극. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 이상형 피질의 측두부 해부학적 마스크의 HUD 오버레이를 보여주는 현미경의 수술 중 이미지(분홍색 윤곽선, Pi로 표시됨). 이 그림은 완전한 절제를 보여줍니다 - 남아 있는 뇌 조직은 없고, 절제에 대한 내측 열구의 pial 경계만 있으며, 이 이미지에서는 현미경 HUD의 중앙 흰색 십자선 바로 위에 있는 이미지에서 세로 패티로 보호됩니다. 라벨: A = 전방, P = 후방, I = 하측두회, S = 상측두회, STG = 상측두회, MTG = 중측두회, ITG = 하측두회, FL = 전두엽, SV = 실비안 정맥(실비안 열구 위에 위치), Pi = 이상형 피질의 측두부. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
이 프로토콜과 수술 기법은 DRmTLE에 대한 ATLR 후 측두이상피질 절제술의 효과와 발작 자유에 미치는 영향을 조사하는 진행 중인 연구에 적용되었습니다. 이 연구의 목적은 문헌에서 증가하는 후향적 데이터가 시사하는 바와 같이 측두엽 이상피질 제거 후 발작 자유가 실제로 DRmTLE의 발작 자유를 향상시키는지 여부를 전향적으로 결정하는 것입니다.
?...
토론
이 프로토콜은 간질 형성 및 근심 측두엽 간질 네트워크 16,17,24,25,30의 간질 형성 및 증식에 중요한 구조로 상정된 이상형 피질의 측두엽 부분의 신뢰할 수 있고 표적화된 절제를 제공합니다.
우리 센터에서 수행하는 표준 ATLR 기...
공개
저자 Debayan Dasgupta와 John S. Duncan은 Wellcome Trust Innovation Program(218380/Z/19/Z)에서 자금을 지원받습니다. Lawrence P. Binding은 Epilepsy Research UK(보조금 번호 P1904)의 지원을 받습니다. 앞서 언급한 저자와 Sjoerd B. Vos는 미국 국립보건연구소(National Institute for Health Research) 칼리지 런던 병원 생물의학 연구 센터(National Institute for Health Research University College London Hospitals Biomedical Research Centre, NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269)의 일부 자금 지원을 받고 있습니다. 저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었다고 선언합니다. 우리는 윤리적 출판과 관련된 문제에 대한 저널의 입장을 읽었음을 확인하고 이 보고서가 해당 지침과 일치함을 확인합니다.
감사의 말
이 연구는 Epilepsy Research UK(보조금 번호 P1904)와 Wellcome Trust Innovation Program(218380/Z/19/Z)의 지원을 받았습니다. 이 연구는 미국 국립보건연구소(National Institute for Health Research), 유니버시티 칼리지, 런던, 병원, 생물의학 연구 센터(National Institute for Health Research University, College London, Hospitals Biomedical Research Centre, NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269)의 일부 자금 지원을 받았습니다. 저자는 서호주 대학교(University of Western Australia)의 현미경, 특성화 및 분석 센터(Center for Microscopy, Characterization, and Analysis)에서 NCRIS(National Collaborative Research Infrastructure Strategy) 기능인 National Imaging Facility의 시설과 과학 및 기술 지원을 인정합니다. 이 연구는 웰컴 트러스트(Wellcome Trust)[WT 218380]의 전체 또는 일부 자금 지원을 받았습니다. 오픈 액세스의 목적으로, 저자는 이 제출물에서 발생하는 모든 저자 수락 원고 버전에 CC BY 공개 저작권 라이선스를 적용했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
참고문헌
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유