Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verbesserung der Ergebnisse bei Resektionen des anteromesialen Temporallappens - Eine Demonstration der Resektion des temporalen piriformen Kortex
In diesem Artikel
Zusammenfassung
Hier zeigen wir einen Ansatz zur intraoperativen neurochirurgischen Führung bei anteromesialen Temporallappenresektionen, wobei insbesondere der Einsatz von Traktographie und anatomischen Masken zur Unterstützung einer sicheren Resektion des temporalen Teils des piriformen Kortex hervorgehoben wird - ein Bereich, der zunehmend als entscheidendes chirurgisches Ziel bei medikamentenresistenter mesialer Temporallappenepilepsie angesehen wird.
Zusammenfassung
Die anteromesiale Temporallappenresektion (ATLR) ist eine nützliche Behandlungsoption für die medikamentenresistente mesiale Temporallappenepilepsie (DRmTLE). Es gibt immer mehr Hinweise darauf, dass der piriforme Kortex eine entscheidende Rolle bei der Entstehung und Ausbreitung von Anfällen bei DRmTLE spielt - und dass die Resektion des temporalen Teils des piriformen Kortex mit einer signifikant verbesserten Rate der Anfallsfreiheit verbunden ist.
Hier präsentieren wir die Resektion des temporalen Anteils des piriformen Kortex in der ATLR unter Verwendung hochauflösender präoperativer probabilistischer Traktographie-Algorithmen und fusionierter anatomischer Masken der interessierenden Strukturen in der intraoperativen Neuronavigation und dem Mikroskop-Head-up-Display (HUD).
Alle Patienten, die sich einer umfassenden präoperativen Untersuchung und Untersuchung auf DRmTLE unterzogen, gaben ihre informierte, schriftliche Zustimmung zur Aufzeichnung eines intraoperativen Videos des Eingriffs. Die Patienten wurden von einem multidisziplinären Expertenteam aus Epileptologen, Epilepsie-Neurochirurgen, Neuropsychologen, Neuropsychiatern und Elektrophysiologen in einem großen Zentrum für Epilepsiechirurgie identifiziert. Die präoperative Bildgebungspipeline umfasste die Abgrenzung kritischer Strukturen. Dazu gehörten der temporale piriforme Kortex und eine hochauflösende probabilistische Traktographie für essentielle Risikobahnen (z. B. optische Strahlung und inferiorer fronto-occipitaler Fasciculus). Diese wurden für den präoperativen volumetrischen Neuronavigationsscan mitregistriert und in das intraoperative Neuronavigationssystem hochgeladen.
Hier wird ein Schritt-für-Schritt-Verfahren der ATLR vorgestellt, einschließlich der Resektion des temporalen Teils des piriformen Kortex. Das Protokoll kombiniert fortschrittliche strukturelle und diffuse MRT-Bildgebung und intraoperative Sehhilfen, um anatomische Masken kritischer Strukturen der grauen Substanz und der Bahnen der weißen Substanz in den chirurgischen Arbeitsablauf im Operationssaal zu integrieren.
Einleitung
Die anteromesiale Temporallappenresektion (ATLR) ist die wirksamste Behandlung der medikamentenresistenten mesialen Temporallappenepilepsie (DRmTLE)1,2 mit einer Anfallsfreiheitsrate von 50 % bis 70 % und einer relativ niedrigen Morbidität 3,4,5. Es hat sich auch gezeigt, dass das Verfahren die Lebensqualität 6,7,8, die Beschäftigungsquoten5 und das psychosoziale Wohlbefinden9 verbessert.
Die kanonische ATLR, die von Spencer et al.10 beschrieben wird, beinhaltet eine Resektion des Schläfenpols, des Uncus, der Amygdala, des Hippocampus, des parahippocampalen Gyrus und des Gyrus fusiformis. Kritische Bahnen der weißen Substanz, die am Sehen (die optische Strahlung, insbesondere die Meyersche Schleife11,12) und der Sprache beteiligt sind (z. B. der untere fronto-occipitale Fasciculus13 und der Fasciculus arcuatus14,15), sind beim Zugang zum Schläfenhorn des lateralen Ventrikels verletzungsgefährdet. Das folgende Protokoll skizziert einen Ansatz zur Vermeidung dieser Bahnen der weißen Substanz unter Verwendung einer hochauflösenden präoperativen probabilistischen Traktographie und fusionierter anatomischer Masken der interessierenden Strukturen in der intraoperativen Neuronavigation und dem mikroskopischen Head-up-Display (HUD).
Das traditionelle Verständnis des Feldes ist, dass eine maximale Hippocampus-Resektion vorteilhaft ist, um die Raten der postoperativen Anfallsfreiheit zu maximieren. Neuere voxelweise Analysen von Post-ATLR-Fällen zeigen jedoch, dass die Resektion des temporalen Teils des piriformen Kortex bei ATLR die Chance auf Anfallsfreiheit stark erhöht. Sie zeigten auch, dass es keinen Zusammenhang zwischen der posterioren Hippocampusresektion und der Anfallsfreiheit gab16,17. Dementsprechend wurde vorgeschlagen, Spencers Technik zu aktualisieren, indem die Hippocampus-Resektion auf die vorderen 55% des Hippocampus bei sprachdominierten Hemisphären-ATLRs beschränkt wird, um die Gedächtnisfunktion zu erhalten16,18.
Obwohl das Interesse an der Verwendung neuartiger minimal-invasiver Therapien, insbesondere der interstitiellen Laser-Wärmetherapie (LITT), gestiegen ist, bleibt die chirurgische Resektion der Behandlungsstandard für arzneimittelresistente fokale Epilepsie1, und es hat sich gezeigt, dass die Wirksamkeit der LITT zu einem geringeren Anteil der Engel-1-Anfallsergebnisse (58 %-59 %)1,19 im Vergleich zur ATLR (60 %-70 %)3 führt. 4,5,20, und damit ist immer noch ein Bereich, der weiterer Untersuchungen bedarf21.
Es gibt immer mehr Beweise für die Hypothese, dass der piriforme Kortex (Abbildung 1) eine kritische Region bei der Ausbreitung und/oder Epileptogenese von Anfällen bei Erwachsenen 16,17,22,23,24 und Kindern25 mit mesialer Temporallappenepilepsie ist. Der piriforme Kortex ist ein Band aus dreischichtigem Allokortex (ähnlich der Anordnung des hippokampalen Kortex), das um den entorhinalen Sulcusmesial zum temporalen Stammdrapiert ist 26,27 und daher den Zusammenfluss des Temporallappens und des Frontallappens bildet. Es kann daher leicht als aus frontalen und temporalen Unterteilungen bestehend angesehen werden, die in der Literatur ausführlich beschrieben sind 22,25,28,29,30.

Abbildung 1: Halbtransparente 3-dimensionale Darstellung mesialer temporaler Strukturen des Gehirns. Diese Abbildung zeigt die anatomischen Assoziationen des piriformen Kortex (cyan) mit der umgebenden Anatomie des mesialen Temporallappens. Linke mediale, mittlere obere und rechte anteriore Ansicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der piriforme Kortex ist supero-mesial zur Amygdala und wurde in Tierversuchen lange Zeit als häufiger Knoten in Netzwerken angesehen, die epileptogene Entladungenverbreiten 31-33, und erzeugt Anfälle nach elektrischer Stimulation leichter als benachbarte mesiale Strukturen, einschließlich der Amygdala und des Hippocampus34. Seine Lage mit ausgedehnten Verbindungen zum entorhinalen, limbischen, orbitofrontalen und insularen Kortex sowie zum Thalamus, zum Riechkolben, zur Amygdala und zum Hippocampus eignet sich auch für eine Rolle als wichtiger Fortpflanzungsweg epileptogener Entladungen bei fokaler Epilepsie30.
EEG-fMRT- und Positronen-Emissions-Tomographie (PET)-Studien unterstützen außerdem eine wichtige Rolle des piriformen Kortex bei DRmTLE, indem sie eine interiktale Aktivierung zeigen, und eine verminderte Bindung an γ-Aminobuttersäure Typ A (GABAA)-Rezeptoren im piriformen Kortex ist mit einer erhöhten Anfallsaktivität verbunden 35,36,37.
Zwei bedeutende neuere bildgebende Studien bei DRmTLE haben gezeigt, dass die postoperative Anfallsfreiheit mit einem größeren Ausmaß der Resektion des piriformen Kortex verbunden ist; Galovic et al. zeigten in einer großen retrospektiven Kohorte, dass die Entfernung von mindestens der Hälfte des piriformen Kortex die Chancen, anfallsfrei zu werden, um den Faktor 16 verbesserte (95% CI, 5-47; S. < 0,001)17. Es wurde auch gezeigt, dass die Resektionsvolumina anderer mesialer temporaler Strukturen nicht mit der Anfallsfreiheit assoziiert waren, ein Befund, der repliziert und durch die voxelweisen Analysen von Sone et al. unterstützt wurde, die zeigten, dass nur die Resektion des piriformen Kortex im linken TLE mit der Anfallsfreiheit assoziiert war16 (Abbildung 2).
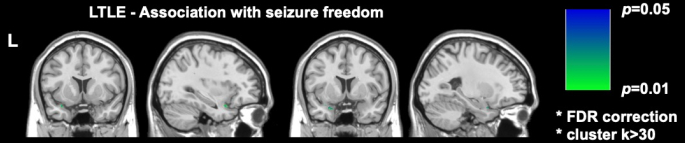
Abbildung 2: Voxel-weiser Zusammenhang mit postoperativer Anfallsfreiheit bei linker TLE. Der einzige Bereich, der signifikant mit der Anfallsfreiheit korreliert, ist der temporale Teil des piriformen Kortex, p = 0,01 (grün in koronalen und sagittalen T1-gewichteten MRT-Schnitten). Adaptiert von Sone et al.16 mit Genehmigung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Borger et al. zeigten auch in einer großen retrospektiven Kohorte, dass nur der Anteil des resezierten temporalen piriformen Kortex mit einer verbesserten Rate der Anfallsfreiheit sowohl nach 1 Jahr3 als auch nach längerer Nachbeobachtung (Mittelwert 3,75 Jahre) verbunden ist23. Sie bestätigten ferner, dass das resezierte Volumen des Hippocampus und der Amygdala keine Anfallsfreiheit vorhersagte.
Wie wichtig es ist, dass der piriforme Kortex bei mTLE vom aberranten epileptogenen Netzwerk getrennt ist, wurde auch in der LITT gezeigt, wobei Hwang et al. bei der 6-monatigen Nachbeobachtung zeigten, dass eine prozentuale Ablation des piriformen Kortex mit ILAE-Klasse-1-Ergebnissen assoziiert war38 (OR 1,051, 95% CI 1,001-1,117, p = 0,045), dass dies jedoch ein Trend war, der nach 1 Jahr nicht signifikant war5. Dies scheint die aufkommenden Daten über die LITT zu unterstützen, dass es eine positive, aber möglicherweise weniger dauerhafte Verbesserung der Anfallsergebnisse gibt, was dazu geführt hat, dass die LITT häufig als Verfahren der "ersten Phase" eingesetzt wird, wobei die resektive Operation denjenigen angeboten wird, bei denen die Anfallsfreiheit durch die LITT nicht erreicht wird.
Es gibt daher starke Hinweise darauf, dass die Resektion des temporalen Teils des piriformen Kortex ein Schlüsselziel für das Erreichen der Anfallsfreiheit bei medikamentenresistenter mesialer Temporallappenepilepsie ist. Wie die retrospektive Kohorte von Galovic et al. jedoch zeigte, befindet sich dieses Band des entorhinalen Kortex an einer schwierigen Stelle, um es chirurgisch zu erreichen, wenn eine ATLR durchgeführt wird, was bedeutet, dass es nicht immer erfolgreich entfernt wird, wenn es nicht direkt angegriffen wird. In dieser Studie zeigen wir, wie der temporale Teil des piriformen Kortex im Rahmen einer laufenden prospektiven chirurgischen Studie sicher anvisiert und reseziert werden kann, um seinen Einfluss auf die postoperative Verbesserung der Anfallsfreiheitsraten zu bewerten39.
Der Schwerpunkt des folgenden Protokolls liegt auf den technischen Aspekten der Bildaufnahme und -verarbeitung, dem chirurgischen Ansatz und der Frage, wie wir die Resektion des temporalen Teils des piriformen Kortex bei ATLR sicherstellen, während wir gleichzeitig eine hochauflösende präoperative probabilistische Traktographie und fusionierte anatomische Masken der interessierenden Strukturen in die intraoperative Neuronavigation und das Mikroskop-Head-up-Display (HUD) integrieren. Das Protokoll verwendet auch eine spezifische Planungssoftwareplattform40, die eine 3-dimensionale Betrachtung und Integration der multimodalen Bildgebung für die chirurgische Überprüfung und Planung ermöglicht, sowie ein Neuronavigationssystem, das die Integration mit dem operativen Mikroskop ermöglicht (Einzelheiten sind in der Materialtabelle aufgeführt).
Protokoll
Diese Methoden und Protokolle sind Teil einer laufenden prospektiven chirurgischen Studie, die am 10.09.2020 von der Health Research Authority genehmigt wurde, Research Ethics Committee (REC) London-Referenz: 20/LO/0966. Das Protokoll wurde prospektiv registriert: ISRCTN72646265, am 25.09.2020, ist onlineverfügbar 39 und wurde auf einer nationalen Konferenzvorgestellt 41.
Das folgende Protokoll wird auf alle Patienten angewendet, die sich einer ATLR für DRmTLE bei Patienten im Alter von 18 bis 70 Jahren unterziehen (die Altersgruppe der Patienten, die für diese Indikation in unserem spezialisierten Zentrum für Epilepsiechirurgie bei Erwachsenen operiert werden), die alle von denselben Chirurgen (AWM, AM) operiert wurden. Alle Teilnehmer gaben vor der Aufnahme in die Studie eine Einverständniserklärung ab. Alle Teilnehmer wurden einer gründlichen präoperativen Bewertung und Untersuchung unterzogen, die von dem multidisziplinären Expertenteam für chirurgische Epilepsie im umfassenden Epilepsiechirurgiezentrum der Autoren geleitet wurde, das aus Neurochirurgen, Epilepsie-Neurologen, Neuropsychologen, Psychiatern, Neuroradiologen und anderen Mitgliedern der spezialisierten Epilepsietherapiedienste besteht. Vor der Operation hatten alle aktuelle volumetrische T1-, T2- und FLAIR-MRTs, wie im folgenden Protokoll beschrieben, sowie standardmäßiges präoperatives Blut und eine Überprüfung durch das Neuroanästhesieteam, um sicherzustellen, dass sie sicher mit der Operation unter Vollnarkose fortfahren konnten. Die kommerziellen Details der Reagenzien und der in dieser Studie verwendeten Geräte sind in der Materialtabelle aufgeführt.
1. Aufnahme und Verarbeitung von Bildern
HINWEIS: Hochauflösende präoperative, 3-monatige und 1-jährige postoperative Magnetresonanztomographie-Scans (MRT) werden routinemäßig bei Menschen durchgeführt, die sich in unserem Zentrum einer Epilepsieoperation unterziehen. Die MRT-Daten wurden aus Gründen der Konsistenz zwischen März 2020 und März 2024 mit demselben MRT-Scanner erfasst. Die standardisierte Bilderfassung und viele der Verarbeitungskomponenten wurden bereits in der Literatur beschrieben und werden in dem im Folgenden zusammengefassten Protokoll entsprechend referenziert:
- Erfassen Sie die folgenden MRT-Sequenzen:
- Eine isometrische (1 mm) Standard-T1-gewichtete 3D-Sequenz mit einem IR-FSPGR-Echo (Inversion-Recovery Fast Spoiled Gradient Recall) [Echozeit (TE) 3,1 ms, Wiederholzeit (TR) = 7,4 ms, Inversionszeit = 400 ms, Sichtfeld (FOV) = 224 × 256 × 256 mm, Matrix = 224 × 256 × 256, Voxelgröße = 1,00 × 1,00 × 1,00 mm = 1,00 mm3, Beschleunigungsfaktor für parallele Bildgebung = 2] und;
- Eine koronale Dual-Echo-Sequenz mit schneller Wiederherstellung und schneller Spin-Resonanz und Protonendichte/T 2-gewichteter Sequenz, die für die T2-Relaxometrieverwendet wird 42 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, Matrix = 512 × 512, Schichtdicke = 4 mm, Voxelgröße = 0,43 × 0,43 × 4,00 mm = 0,74 mm3, SENSE-Faktor = 2).
- Verwenden Sie die obige T1-gewichtete Sequenz als Eingabe für den geodätischen Informationsflussalgorithmus (GIF v3), um das Gehirn mit NiftyWeb43 in 162 anatomische Regionen zu unterteilen.
- Erstellen Sie anatomische Masken der interessierenden Strukturen unter Verwendung der GIF-Parzellierungen (parahippocampaler Gyrus, gyrus fusiformis, Erstellung von Hippocampus-Profilinformationen und Segmentierung des Hippocampus in die anterioren 55% und posterioren 45% mit Hipposeg44), überlagern Sie diese in der Planungssoftware mit der volumetrischen präoperativen Bildgebung des Patienten (wie in Schritt 1.1).
- Führen Sie eine automatisierte Segmentierung des piriformen Kortex durch und teilen Sie den piriformen Kortex in frontale und zeitliche Komponenten auf, basierend auf den volumetrien Techniken, die in früheren Arbeiten aus unserem Labor erläutert wurden 17,45,46. Sobald diese Masken erstellt sind, überlagern Sie sie mit der präoperativen Bildgebung des Patienten.
- Nehmen Sie die folgenden Diffusions-MRT-Bilder auf:
- Eine Mehrschalenerfassung mit Standardauflösung (2 mm isotrope Auflösung, 11, 8, 32 und 64 Gradientenrichtungen bei b-Werten 0, 300, 700, 2500 s/mm2) und;
- Eine hochauflösende Mehrschalenerfassung (1,6 mm isotrope Auflösung, 101 Richtungen, 14 b0, b-Werte: 300, 700 und 2500 s/mm2).
- Korrigieren Sie die erfassten Diffusionsdaten mit MRtrix3 (https://mrtrix.org)47 für:
- Rauschen mit "dwidenoise" in MRtrix348.
- Signaldrift49.
- Gibbs-Ringing mit "mrdegibs" in MRtrix350.
- Verzerrung unter Verwendung eines Gradienten der Umkehrphasenkodierung mit dem FSL TOPUP-Algorithmus (https://fsl.fmrib.ox.ac.uk/fsl51).
- Wirbelströme und Bewegungsartefakte unter Verwendung des Wirbelalgorithmus (https://fsl.fmrib.ox.ac.uk/fsl)52 von FSL, der die b-Vektoren53 dreht.
- Bias-Feld mit dem ANTs-Algorithmus (https://mrtrix.org47,54).
- Verwenden Sie die eingeschränkte sphärische Dekonvolution (CSD)55 mit mehreren Schalen und mehreren Geweben, um die Reaktionsfunktionen für weiße und graue Substanz und Liquor cerebrospinalis (CSF) abzuschätzen.
- Durchführung einer anatomisch gezielten automatisierten Traktographie zur Rekonstruktion von Faserbündeln von Interesse 12,56,57: die optische Strahlung, der untere fronto-occipitale Fasciculus (IFOF; sprachdominante Fälle) und der mittlere longitudinale Fasciculus (MLF; sprachliche nicht-dominante Fälle). Führen Sie die folgenden Schritte aus.
- Extrahieren Sie kortikale Endpunkte für jedes Faserbündel und gruppieren Sie sie in Seed- und Terminierungs-ROI.
- Erstellen Sie kortikale Ausschlussregionen und ROI mit nicht terminierenden kortikalen Regionen.
- Durchführung einer anatomisch eingeschränkten Traktographie58 über den probabilistischen Faserverfolgungsalgorithmus iFOD259 unter Verwendung der hybriden Oberflächen- und Volumensegmentierung in MRtrix347 unter Auswahl von maximal 5.000 Stromlinien aus 300 Millionen Samen.
- Führen Sie die Traktographie in Schritt 1.8.3 zweimal für jedes Faserbündel aus und schalten Sie den Startwert und den Terminierungs-ROI um.
- Konvertieren Sie die resultierenden Faserbündel in probabilistische Karten, die auf einen Schwellenwert von 0,01 festgelegt sind – verwenden Sie diese als zusätzliches Ausschlusskriterium, um unerwünschte Stromlinien zu entfernen.
- Überprüfen Sie die resultierenden Faserbündel (um 2 mm erweitert) und anatomischen Masken in der Planungssoftware, um sicherzustellen, dass sie anatomisch korrekt sind (dieser Schritt wird von zwei Epilepsie-Neurochirurgen in unserer Abteilung durchgeführt).
- Registrieren Sie die resultierenden anatomischen Masken der grauen Substanz und der weißen Substanz räumlich im Referenz-T1-gewichteten MRT-Bild in Schritt 1.1 und laden Sie sie in das intraoperative Navigationssystem im Operationssaal für intraoperative MRT (iMRT).
- Erfassen Sie T1-, T2- und T2-FLAIR-gewichtete volumetrische MRT-Bilder unmittelbar vor der Operation (< 24 Stunden) mit Hautpassern auf der Kopfhaut des Patienten. Registrieren Sie diese Bilder untereinander und mit dem T1-gewichteten Referenzbild und den Masken, die oben beschrieben und in Abbildung 3 dargestellt sind.
- Registrieren Sie den Patienten auf dem Neuronavigationssystem mit einem oberflächenpassenden Laser und einem Smart-Pointer.
- Überprüfen Sie die Genauigkeit der Bild-Co-Registrierung und des Patienten mit zwei Epilepsie-Neurochirurgen vor Beginn des Falls, um die Genauigkeit sicherzustellen.

Abbildung 3: Screenshot des Neuronavigationssystems, das die volumetrische T2-gewichtete MRT mit überlagerten anatomischen Masken und intraoperativ verwendeten Trakten bei einer rechten ATLR zeigt. Oben links: 3-dimensionale Rekonstruktion des Kopfes des Patienten mit anatomischen Masken. Oben rechts: axial, unten links: sagittal und unten rechts: Koronale Ansichten, die auch überlagerte anatomische Masken auf einem T2-gewichteten volumetrischen MRT-Scan zeigen. Dargestellte anatomische Masken: temporaler Teil des piriformen Kortex (rosa), anterior 55% des Hippocampus (rot), posterior 45% des Hippocampus (dunkelgrün, nur auf dem sagittalen Bild zu sehen), optische Strahlung (mittelgrün), mittlerer longitudinaler Fasciculus (blau). Das blaue Fadenkreuz ist die integrierte Position des Fokus des Mikroskops, und das grüne Fadenkreuz ist die Position des Neuronavigationszeigers, der im Operationsfeld verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Operationstechnik
HINWEIS: Die folgenden Schritte fassen die Praxis im Zentrum der Autoren zusammen und sollen keine Darstellung des einzigen chirurgischen Ansatzes für eine ATLR sein, sondern eine Demonstration dessen, wie die Autoren den Ansatz für dieses Verfahren standardisiert haben, um zuverlässige und reproduzierbare Resektionen zu ermöglichen, einschließlich der Resektion des temporalen piriformen Kortex.
- Positionierung und Anfahrt
- Positionieren Sie den Patienten nach den üblichen präoperativen Kontrollen und Sicherheitsmaßnahmen in Rückenlage, heben Sie die ipsilaterale Schulter mit einer Rolle an und drehen Sie den Kopf zur kontralateralen Seite.
- Beugen Sie den Kopf seitlich, um sicherzustellen, dass die Malareminenz der höchste Punkt des Operationsfeldes ist, und fixieren Sie ihn in Stiften (3-Punkt-Schädelfixationsvorrichtung - siehe Beispiele, einschließlich solcher, die mit intraoperativen [iMRT]-Theatern in der Materialtabelle kompatibel sind).
HINWEIS: Die Positionierung ist entscheidend, um einen angemessenen Zugang zu den mesialen und hinteren Temporallappenstrukturen, insbesondere der lateralen Flexion, zu ermöglichen, um sicherzustellen, dass die Eminenz malar der höchste Punkt des Operationsfeldes ist. - Infiltrieren Sie das Lokalanästhetikum, um die Stellen und den Hautschnitt zu fixieren.
- Registrieren Sie den Patientenraum im Neuronavigationssystem mit einer Kombination aus Hauttreuern und Oberflächenverfolgung (spezifisch für die Marke des verwendeten Neuronavigationssystems). Bestätigen Sie die Registrierungsgenauigkeit anhand tastbarer oder sichtbarer knöcherner/anderer anatomischer Orientierungspunkte.
- Markieren Sie den Haaransatz und die Wurzel des Zygoms (identifiziert durch manuelles Abtasten). Identifizieren und markieren Sie den Verlauf der Sylvian-Fissur mit Hilfe der Neuronavigation und des geplanten krummlinigen frontotemporalen "Fragezeichen"-Hautschnitts.
- Entfernen Sie Haare entlang des geplanten Hautschnitts mit einer elektrischen Haarschneidemaschine.
- Führen Sie einen frontotemporalen Schnitt 1 cm vor dem Tragus durch, der sich fragezeichenartig krümmt, um eine Verletzung des frontotemporalen Astes des Gesichtsnervs zu vermeiden. Identifizieren und erhalten Sie nach Möglichkeit die oberflächliche Schläfenarterie. Die Positionierung und Markierung des Hautschnitts ist in Abbildung 4 dargestellt.
- Decken Sie die Wundränder mit antimikrobiell getränkten Mastoidtupfern und Raney-Clips ab und sichern Sie sie.
- Den Musculus temporalis einschneiden und entweder in einem myokutanen oder interfaszialen/subfaszialen Lappen anheben (um eine Verletzung des frontotemporalen Astes des Nervus facialis zu verhindern).
- Wickeln Sie den Hautlappen in mit antimikrobieller Lösung getränkte Gaze ein und ziehen Sie ihn nach vorne zurück (vermeiden Sie die Verwendung von Metallsicherungsinstrumenten in iMRT-Sälen).
- Mit einem Perforatorbohrer werden 2 Bohrlöcher in den Schädel gebohrt: das erste direkt über der Wurzel des Zygoms, um die untere Belichtung zu maximieren, das zweite untere Frontalloch, um die Sichtbarkeit der Sylvian-Fissur zu erleichtern.
- Es wird eine standardmäßige frontotemporale Kraniotomie 60,61,62 durchgeführt, bei der der Gyrus temporalis superior und der mittlere Gyrus temporalis 1 cm über der Sylvian-Fissur freigelegt werden.
- Bohren Sie den vorderen und unteren Rand der Kraniotomie weg, um einen einfachen Zugang zum Boden der mittleren Schläfengrube sowie zum Schläfenpol nach anterior zu ermöglichen. Wenn Sie auf Mastoid-Luftzellen stoßen, versiegeln Sie diese mit Knochenwachs und Fibrinkleber, sowohl beim Auftreffen auf sie als auch am Ende des Eingriffs, bevor Sie die oberflächlichen Schichten des Knochens schließen.
HINWEIS: Es ist wichtig sicherzustellen, dass die Kraniotomie den Zugang zum Boden der mittleren Schädelgrube ermöglicht, da dies der Zugang zum Schläfenhorn des lateralen Ventrikels über den Sulcus collateralis ist. Es ist auch wichtig, alle angetroffenen Mastoid-Luftzellen gründlich abzudichten, um ein postoperatives Liquorleck und daraus resultierende Symptome und mögliche Infektionen zu vermeiden. - Öffnen Sie die Dura U-förmig, wobei die Basis nach vorne reflektiert und sternförmig verlängert wird. Befestigen Sie die Dura mit Nähten (z. B. 3-0 Seide) vom Operationsfeld weg.
- Liquor aus dem Boden der mittleren Schädelgrube und dem vorderen Aspekt der mittleren Schädelgrube freisetzen.
HINWEIS: Der Schritt der Liquorfreisetzung ist wichtig, um ausreichend Arbeitsraum für den chirurgischen Zugang zum Boden der mittleren Schädelgrube und zum Kollateralsulkus von unten zu ermöglichen, ohne dass der basale Temporallappen zurückgezogen und belastet werden muss.
- Laterale neokortikale Entfernung
- Koagulation der Pia der mittleren und unteren Schläfengyri (MTG bzw. ITG) in einer Linie senkrecht zur Schädelbasis und in einer Linie mit der vorderen Projektion des Schläfenhorns des lateralen Ventrikels (bestätigt durch das Neuronavigationssystem). Passen Sie die anterior-posteriore Ausdehnung dieser Linie von Fall zu Fall an, abhängig von den präoperativen Beweisen für eine laterale neokortikale Beteiligung am Beginn/der Ausbreitung von Anfällen.
HINWEIS: Die anterior-posteriore Ausdehnung der lateralen neokortikalen Resektion sollte die präoperative Evidenz (oder deren Fehlen) für ihre Beteiligung an der Anfallsausbreitung berücksichtigen, und dies ist auf den individuellen Patienten zugeschnitten. - Verwenden Sie einen transkortikalen Zugang in der ITG, um den Boden der mittleren kranialen Fossa freizulegen und den kollateralen Sulcus zu identifizieren, der lateral des Gyrus parahippocampalis und medial des Gyrus fusiformis liegt.
- Koagulation der Pia des Gyrus temporalis superior (STG) vor dem obigen lateralen neokortikalen Schnitt, parallel zur Richtung der Sylvian-Fissur. Dieser verläuft senkrecht zu der in Schritt 2.16 beschriebenen Linie und erstreckt sich anterior bis zum Schläfenpol.
- Entwickeln Sie die Ebene zwischen STG und Sylvianischer Fissur mit Hilfe von subpialen Dissektionstechniken, schützen Sie die Äste der mittleren Hirnarterie und führen Sie diese Dissektion bis zum horizontalen Teil der Sylvianischen Fissur bis zur Höhe des unteren begrenzenden Sulcus der Insula durch.
HINWEIS: Bei der subpialen Dissektion in Schritt 2.2.4 ist darauf zu achten, dass die Integrität der Pia des STG, die an die Sylvian-Fissur grenzt, erhalten bleibt, da dies die Äste der mittleren Hirnarterie in der Fissur sowie andere Strukturen wie den Nervus oculomotorius und die hintere kommunisierende Arterie (Schritt 2.2.14) und den Sehtrakt (Schritt 2.3) im späteren Verlauf der Operation schützt. - Integrieren Sie das Mikroskop in das Neuronavigationssystem.
- Bestätigen Sie die Genauigkeit der Objektüberlagerungen der in Abschnitt 1 beschriebenen anatomischen Masken und visualisieren Sie diese auf dem Mikroskop-HUD.
- Schrägen Sie die hintere Resektionslinie anterior superior, um die Resektion des STG zu minimieren, und verlängern Sie sie progressiv durch das MTG und ITG, durch den Gyrus fusiformis bis zum Sulcus collateralis.
- Überprüfen Sie das Verhältnis des hinteren Resektionsrandes zum Neuronavigationssystem mit der visualisierten OP-Maske.
- Visualisieren Sie die maximale vordere Ausdehnung der OP-Maske auf dem Mikroskop und stellen Sie sicher, dass sie sich hinter dem Resektionsrand auf dem Mikroskop-HUD befindet, um sicherzustellen, dass der OP nicht beschädigt wird, was postoperativ zu einem Gesichtsfelddefizit führen würde, wie in Abbildung 5 gezeigt.
HINWEIS: Schritt 2.2.9 ist ein kritischer Schritt, um ein postoperatives Gesichtsfelddefizit aufgrund einer Schädigung der Meyerschen Schleife der optischen Strahlung zu verhindern. Wenn es zu einer starken Verschiebung des Gehirns kommt und der Chirurg das Risiko einer Schädigung der optischen Strahlung weiter minimieren möchte oder wenn die Projektionen auf dem HUD des Mikroskops nicht richtig funktionieren, schlagen die Autoren vor, den Neuronavigationszeiger zu verwenden, um die Annäherung an die vorderste Spitze des Schläfenhorns des lateralen Ventrikels zu richten. da dies das Risiko von OP-Verletzungen minimiert. - Folgen Sie dem Sulcus collateralis superior, bis Sie auf das Schläfenhorn stoßen (bestätigen Sie dies auf dem Neuronavigationssystem), wie in Abbildung 6 gezeigt. Die Wand des Schläfenhorns ist an einem bläulich gefärbten Ependym zu erkennen.
HINWEIS: Bei Personen, bei denen es sich nicht um eine Hippocampussklerose handelt und der Hippocampuskopf voluminös ist, kann der Ventrikel schwer zu finden sein. In diesen Fällen besteht eine Option zur Fehlerbehebung darin, den Neuronavigationszeiger an der Basis der medialen Schläfengrube zu verwenden, wo es keine Verschiebung gibt, um zu finden, wo die Spitze des Ventrikels hervorsteht. Normalerweise ist es hilfreich, dies auf einer koronalen Ebene zu suchen. Wenn der Ventrikel nicht gefunden werden kann, empfehlen wir, zuerst den Pol zu entfernen und dann den Ventrikel mit dem Ultraschallsauger zu finden. - Teilen Sie die basalen temporalen Leptomeningen lateral zur Exposition des Schläfenhorns.
- Öffnen Sie den Ventrikel anterior, um den Hippocampuskopf freizulegen (wie in Abbildung 6 gezeigt).
- Verlängern Sie den hinteren Resektionsrand, um die Trennung mit dem Ventrikel zu verbinden, und dies ermöglicht die Trennung des neokortikalen Blocks.
- Mobilisieren Sie den Schläfenpol entlang der Dissektionslinie am Rand des Tentorialrandes. Achten Sie darauf, die Trennung nicht über den Rand des Tentoriums durchzuführen, um Verletzungen der mesialen Strukturen, einschließlich des Nervus oculomotorius und der hinteren Kommunikationsarterie, zu vermeiden.
HINWEIS: Um das Risiko einer Beschädigung der Strukturen in der Cisterna cruralis zu verringern, folgen Sie der Form der Kante des Tentoriums, ohne über die Kante des Zeltes zu gehen. Der Uncus bleibt an Ort und Stelle und kann als separate Probe entnommen werden.
- Koagulation der Pia der mittleren und unteren Schläfengyri (MTG bzw. ITG) in einer Linie senkrecht zur Schädelbasis und in einer Linie mit der vorderen Projektion des Schläfenhorns des lateralen Ventrikels (bestätigt durch das Neuronavigationssystem). Passen Sie die anterior-posteriore Ausdehnung dieser Linie von Fall zu Fall an, abhängig von den präoperativen Beweisen für eine laterale neokortikale Beteiligung am Beginn/der Ausbreitung von Anfällen.
- Mesiale temporale Resektion, einschließlich des temporalen piriformen Kortex
- Befreien Sie das Gewebe vom Uncus durch Dissektion und Verwendung des Ultraschallaspirators mesial, bis der Nervus oculomotorius und die hintere Kommunikationsarterie sichtbar sind. Stoppen Sie das Ausmaß der posterioren Resektion, wenn der Pes (die mesialste Ausdehnung des Hippocampuskopfes) sichtbar gemacht wird.
- Die Resektion der Amygdala wird mit dem Ultraschallsauger durchgeführt, wobei die Pia des Sulcus endorhinalis bis zur Darstellung des Tractus opticus und mesial durch die Pialebene der basalen Zisternen begrenzt ist.
HINWEIS: Achten Sie darauf, dass der Schläfenschaft erhalten bleibt und nicht in den Frontallappen eindringt, wenn Sie Schritt 2.3.2 ausführen. Manchmal kann die Neuronavigation aufgrund von Gehirnverschiebungen das Ausmaß der Resektion mesial überschätzen; In dieser Hinsicht kann die Resektion sicher fortgesetzt werden, bis der Sehtrakt durch die PIA sichtbar gemacht wird, und dies stellt die mesiale Grenze der Resektion dar. Dies wird auch in Usui et al. beschrieben.63Der dorsale Rand der Amygdala wird allgemein als durch eine imaginäre Linie angenähert beschrieben, die den Aderhautpunkt mit der proximalen Bifurkation der mittleren Hirnarterie verbindet64. - Stellen Sie sicher, dass der temporale Teil des piriformen Kortex reseziert wird, indem Sie jegliches Restgewebe durch subpiale Dissektion entfernen, die von der temporalen Seite der Sylvian-Fissur nach unten fortschreitet, bis die Vene des unteren zirkulären Sulcus der Insula sichtbar ist. Dies ist ein ähnlicher Resektionsrand wie von Usui et al. bei der Resektion von amygdalar-unkalen Läsionen beschrieben63.
HINWEIS: Wenn der Uncus (in Schritt 2.3.1) oder der piriforme Kortex schwer zu entfernen sind (manchmal können sie sehr an der Pia mater haften), schlagen die Autoren die Verwendung eines Rhoton-Dissektors anstelle des Ultraschallaspirators vor, um die Verletzung der Pia mater zu minimieren. - Bestätigen Sie die Resektion des temporalen Teils des piriformen Kortex mit der in Schritt 1.4 beschriebenen anatomischen Maske, die auf dem Mikroskop-HUD überlagert ist, wie in Abbildung 7 gezeigt.
- Hippocampus-Resektion
- Platzieren Sie linteens (oder ähnliche breite Cottonoide), um den Plexus choroideus (und die Arteria choroidalis anterior) mesial zurückzuziehen, um die Visualisierung der Fimbria hippocampi zu erleichtern.
- Trennen Sie die Fimbria hippocampi von ihrem Arachnoidalansatz und legen Sie den Sulcus hippocampalis frei, der die arterielle Gefäßarkade des Ammon-Horns trägt.
- Trennen Sie den Hippocampus von seinem Schwanz (entweder beschränken Sie diese Resektion auf die vorderen 55% des Hippocampus bei sprachdominanten Hemisphärenresektionen, um die verbalen Gedächtnisdefizite zu minimieren, wie in16 beschrieben, oder dehnen Sie sich so posterior aus wie das Tectum des Mittelhirns bei Resektionen der nicht-sprachdominanten Hemisphäre).
- Trennen Sie den Hippocampuskopf vom Pes hippocampi. Koagulieren Sie die arterielle Arkade des Hippocampus nach Bedarf.
- Entfernen Sie den getrennten Hippocampus en bloc.
- Führen Sie eine subpiale Dissektion des Gyrus und des Subiculums parahippocampalis durch und stellen Sie die Blutstillung in der resultierenden Operationshöhle sicher. Entfernen Sie den Pes hippocampi, um den Hirnstamm sichtbar zu machen und zu schützen.
HINWEIS: Bei der Durchführung von Schritt 2.4.7 ist Vorsicht geboten, da es auf dieser Ebene keine schützende Pial-Grenze zwischen dem PES und dem Hirnstamm gibt.
- Intraoperative Bildgebung und Verschluss
- Entfernen Sie alle metallischen Gegenstände aus dem Operationsfeld, decken Sie die Wunde ab und führen Sie einen intraoperativen MRT-Scan durch, der in der Regel volumetrische T1-, T2-, FLAIR- und DWI-Sequenzen umfasst.
- Überprüfen Sie die intraoperative Bildgebung mit einem beratenden Neuroradiologen zusammen mit zwei beratenden Epilepsie-Neurochirurgen, um sicherzustellen, dass die gewünschte Menge an mesialen Temporallappenstrukturen (einschließlich des temporalen Teils des piriformen Kortex sowie der variablen Mengen an Hippocampus, wie oben in Schritt 2.36 beschrieben) erfolgreich reseziert wurde. Überprüfen Sie auch die DWI-Bildgebung, um sicherzustellen, dass während des Eingriffs keine Bereiche mit Ischämie verursacht wurden.
- Sobald das oben Gesagte bestätigt ist, bringen Sie den Patienten zurück auf den Operationstisch und bestätigen Sie die Blutstillung in der Operationshöhle bei Normotension für den Patienten.
- Verschließen Sie die Wunde auf standardmäßige Weise, indem Sie den Knochenlappen ersetzen, diesen mit Platten und Schrauben an 3 Punkten befestigen und die Muskel-, Faszien- und Hautschichten standardmäßig mit Nähten verschließen, so dass eine chirurgische Wunddrainage für 24 Stunden an Ort und Stelle bleibt.
HINWEIS: Die postoperative Versorgung erfolgt im Zentrum der Autoren, in der Regel in den ersten 24 Stunden auf der neurochirurgischen Abteilung für hohe Abhängigkeit, gefolgt von einer Verlegung auf eine neurochirurgische Fachabteilung, wenn die Abteilung für hohe Abhängigkeit dies für angemessen hält. Die Patienten werden auf ihre neurologischen Beobachtungen hin überwacht, haben postoperatives Blut einschließlich Harnstoff und Elektrolyte, ein vollständiges Blutbild und Differentiale und werden in der Regel etwa 72 h postoperativ entlassen. Sie werden dann ambulant in 4-6 Wochen und nach 3-4 Monaten und mindestens 1 Jahr postoperativ mit Intervallbildgebung nachbeobachtet.
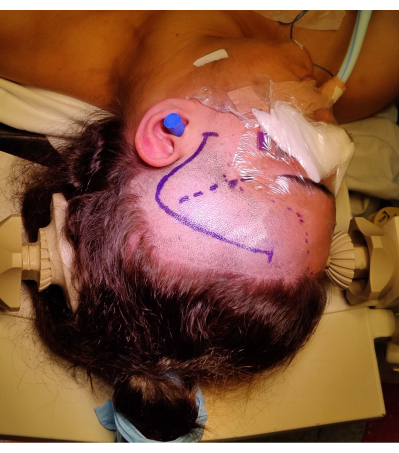
Abbildung 4: Bild der Positionierung des Patienten für eine rechte ATLR, die Markierung des "Fragezeichens" des rechten frontotemporalen Hautschnitts, des Haaransatzes und der Sylvian-Fissur zeigt. Nicht abgebildet ist die Rolle der linken Schulter unter der linken Schulter des Patienten, um den Winkel der Positionierung des Kopfes zu ermöglichen, ohne den Nacken des Patienten übermäßig zu belasten und den venösen Rückfluss nicht zu behindern. Die Bilder wurden mit dem Einverständnis des Patienten aufgenommen und eingebunden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Intraoperatives Bild aus dem Mikroskop, das den lateralen neokortikalen Resektionsrand in einem rechten ATLR zeigt, mit der überlagerten anatomischen Maske der optischen Strahlung (cyan) - was zeigt, dass der Resektionsrand vor dem OP liegt. Beschriftungen zeigen die Orientierung der Operationsansicht: A = anterior, P = posterior, I = inferior, S = superior, STG = Gyrus temporalis superior, MTG = Gyrus temporalis media, ITG = Gyrus temporalis inferior, TP = Temporalpol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
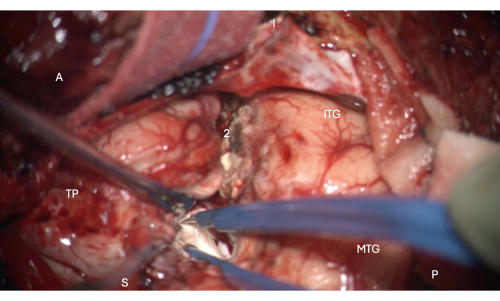
Abbildung 6: Intraoperatives Bild des Mikroskops, das den Eintritt in den vorderen Teil des Schläfenhorns des lateralen Ventrikels zeigt und den Hippocampuskopf darin zeigt (blassweiß, 1). Beschriftungen: A = anterior, P = posterior, I= inferior, S = superior, MTG = mittlerer temporaler Gyrus, ITG = inferer temporaler Gyrus, 2 = lateraler neokortikaler Resektionsrand, dem Collateralsulcus superior in der Tiefe folgend, um das Schläfenhorn des lateralen Ventrikels zu finden, TP = Temporalpol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Intraoperatives Bild aus dem Mikroskop, das die HUD-Überlagerung der anatomischen Maske des temporalen Teils des piriformen Kortex zeigt (rosa Umrandung, beschriftet mit Pi). Diese Abbildung zeigt die vollständige Resektion - es gibt kein verbleibendes Hirngewebe, nur die Pialgrenze des endorhinalen Sulcus mesial zur Resektion, die in diesem Bild mit der darüber liegenden Längsfladene im Bild geschützt ist, direkt über dem zentralen weißen Fadenkreuz des Mikroskop-HUD. Beschriftungen: A = anterior, P = posterior, I = inferior, S = superior, STG = Gyrus temporalis superior, MTG = Gyrus temporalis media, ITG = Gyrus temporalis inferior, FL = Frontallappen, SV = Vena sylvian (über der Fissur Sylvian), Pi = temporaler Teil des piriformen Kortex. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Dieses Protokoll und die Operationstechniken wurden im Rahmen einer laufenden Studie angewendet, in der die Auswirkungen der temporalen piriformen Kortexresektion und ihre Auswirkungen auf die Anfallsfreiheit nach ATLR bei DRmTTLE untersucht wurden. Das Ziel dieser Studie ist es, prospektiv zu bestimmen, ob die Anfallsfreiheit nach Entfernung des temporalen piriformen Kortex tatsächlich die Anfallsfreiheit bei DRmTLE verbessert, wie die wachsende Zahl retrospektiver Daten in der Literat...
Diskussion
Dieses Protokoll ermöglicht eine zuverlässige, gezielte Resektion des temporalen Teils des piriformen Kortex - der als entscheidende Struktur bei der Epileptogenese und Ausbreitung des mesialen Temporallappen-Epilepsienetzwerks gilt 16,17,24,25,30.
Komponenten der Standard-ATLR-Technik, die wir in...
Offenlegungen
Die Autoren Debayan Dasgupta und John S. Duncan erhalten eine Förderung durch das Wellcome Trust Innovation Program (218380/Z/19/Z). Lawrence P. Binding wird unterstützt von Epilepsy Research UK (Fördernummer P1904). Die oben genannten Autoren und Sjoerd B. Vos werden teilweise vom National Institute for Health Research des University College London Hospitals Biomedical Research Centre (NIHR BRC UCLH/UCL High Impact Initiative BW.mn.BRC10269) finanziert. Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten. Wir bestätigen, dass wir die Position des Journals zu Fragen der ethischen Veröffentlichung gelesen haben und bestätigen, dass dieser Bericht mit diesen Richtlinien übereinstimmt.
Danksagungen
Diese Arbeit wurde unterstützt von Epilepsy Research UK (Fördernummer P1904) und dem Wellcome Trust Innovation Program (218380/Z/19/Z). Diese Arbeit wurde teilweise vom National Institute for Health Research des University College London Hospitals Biomedical Research Centre (NIHR BRC UCLH/UCL High Impact Initiative BW.mn.BRC10269) finanziert. Die Autoren würdigen die Einrichtungen und die wissenschaftliche und technische Unterstützung der National Imaging Facility, einer Einrichtung der National Collaborative Research Infrastructure Strategy (NCRIS), am Center for Microscopy, Characterization, and Analysis der University of Western Australia. Diese Forschung wurde ganz oder teilweise vom Wellcome Trust [WT 218380] finanziert. Für die Zwecke des Open Access hat der Autor eine CC BY-Lizenz für das öffentliche Urheberrecht auf jede vom Autor akzeptierte Manuskriptversion angewendet, die sich aus dieser Einreichung ergibt.
Materialien
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Referenzen
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten