È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Miglioramento dei risultati nelle resezioni del lobo temporale anteromesiale: una dimostrazione della resezione della corteccia piriforme temporale
In questo articolo
Riepilogo
Qui, dimostriamo un approccio alla guida neurochirurgica intraoperatoria nelle resezioni del lobo temporale anteromesiale, evidenziando in particolare l'uso della trattografia e delle maschere anatomiche per aiutare la resezione sicura della porzione temporale della corteccia piriforme, un'area sempre più considerata un bersaglio chirurgico cruciale nell'epilessia del lobo temporale mesiale resistente ai farmaci.
Abstract
La resezione anteromesiale del lobo temporale (ATLR) è un'opzione terapeutica utile per l'epilessia del lobo temporale mesiale resistente ai farmaci (DRmTLE). Prove crescenti suggeriscono che la corteccia piriforme svolge un ruolo cruciale nella generazione e nella propagazione delle convulsioni nella DRmTLE e che la resezione della porzione temporale della corteccia piriforme è associata a tassi significativamente migliorati di libertà dalle crisi.
Qui, presentiamo la resezione della porzione temporale della corteccia piriforme in ATLR, utilizzando algoritmi di trattografia probabilistica preoperatoria ad alta risoluzione e maschere anatomiche fuse delle strutture di interesse nella neuronavigazione intraoperatoria e nell'head-up display (HUD) del microscopio.
Tutti i pazienti sottoposti a valutazione preoperatoria completa e indagini per DRmTLE hanno fornito il consenso informato e scritto alla registrazione di un video intraoperatorio della procedura. I pazienti sono stati identificati da un team multidisciplinare di esperti epilettologi, neurochirurghi dell'epilessia, neuropsicologi, neuropsichiatri ed elettrofisiologi presso un grande centro di chirurgia dell'epilessia. La pipeline di imaging preoperatorio includeva la delineazione delle strutture critiche. Ciò includeva la corteccia piriforme temporale e la trattografia probabilistica ad alta risoluzione per i tratti essenziali a rischio (ad esempio, radiazioni ottiche e fascicolo fronto-occipitale inferiore). Questi sono stati co-registrati nella scansione di neuronavigazione volumetrica preoperatoria e caricati nel sistema di neuronavigazione intraoperatoria.
Qui viene presentata una procedura passo-passo di ATLR, inclusa la resezione della porzione temporale della corteccia piriforme. Il protocollo combina l'imaging RM strutturale e di diffusione avanzato e gli ausili visivi intraoperatori per integrare maschere anatomiche di strutture critiche della sostanza grigia e tratti di sostanza bianca nel flusso di lavoro chirurgico in sala operatoria.
Introduzione
La resezione anteromesiale del lobo temporale (ATLR) è il trattamento più efficace per l'epilessia del lobo temporale mesiale resistente ai farmaci (DRmTLE)1,2, con tassi di libertà dalle crisi del 50%-70% e una morbilità relativamente bassa 3,4,5. È stato inoltre dimostrato che la procedura migliora la qualità della vita 6,7,8, i tassi di occupazione5 e il benessere psicosociale9.
L'ATLR canonico, descritto da Spencer et al.10, comporta la resezione del polo temporale, dell'uncus, dell'amigdala, dell'ippocampo, del giro paraippocampale e del giro fusiforme. Le vie critiche della sostanza bianca coinvolte nella visione (la radiazione ottica, in particolare, l'ansa di Meyer11,12) e nel linguaggio (ad esempio, il fascicolo fronto-occipitale inferiore13 e il fascicolo arcuato14,15) sono a rischio di lesioni quando accedono al corno temporale del ventricolo laterale. Il seguente protocollo delinea un approccio per evitare questi tratti di sostanza bianca utilizzando la trattografia probabilistica preoperatoria ad alta risoluzione e le maschere anatomiche fuse delle strutture di interesse nella neuronavigazione intraoperatoria e nell'head-up display microscopico (HUD).
La comprensione tradizionale del campo è che la resezione ippocampale massimale è utile per massimizzare i tassi di libertà dalle crisi postoperatorie. Tuttavia, recenti analisi voxel-wise di casi post-ATLR dimostrano che la resezione della porzione temporale della corteccia piriforme in ATLR aumenta notevolmente la possibilità di libertà dalle crisi. Hanno anche dimostrato che non vi era alcuna associazione tra la resezione ippocampale posteriore e la libertà dalle convulsioni16,17. Di conseguenza, è stato proposto di aggiornare la tecnica di Spencer limitando la resezione ippocampale al 55% anteriore dell'ippocampo, negli ATLR dell'emisfero a dominanza del linguaggio, per preservare la funzione di memoria16,18.
Sebbene vi sia stato un crescente interesse per l'uso di nuove terapie minimamente invasive, in particolare la terapia termica interstiziale laser (LITT), la resezione chirurgica rimane lo standard di cura per l'epilessia focale 1 resistente ai farmaci e l'efficacia della LITT ha dimostrato di produrre una percentuale inferiore di esiti delle crisi di Engel 1 (58%-59%)1,19 rispetto all'ATLR (60%-70%)3, 4,5,20, e quindi è ancora un'area che richiede ulteriori indagini21.
C'è un numero crescente di prove a sostegno dell'ipotesi che la corteccia piriforme (Figura 1) sia una regione critica nella propagazione e/o nell'epilettogenesi delle convulsioni negli adulti 16,17,22,23,24 e nei bambini25 con epilessia del lobo temporale mesiale. La corteccia piriforme è un nastro di allocorteccia a tre strati (simile alla disposizione della corteccia ippocampale) che è drappeggiato attorno al solco entorinale mesiale fino allo stelo temporale26,27, e quindi forma la confluenza dei lobi temporali e frontali. Può, quindi, essere facilmente considerato come costituito da divisioni frontali e temporali, descritte in dettaglio nella letteratura 22,25,28,29,30.

Figura 1: Rendering tridimensionale semitrasparente delle strutture temporali mesiali del cervello. Questa figura dimostra le associazioni anatomiche della corteccia piriforme (ciano) con l'anatomia del lobo temporale mesiale circostante. Viste mediale sinistra, centrale superiore e anteriore destra. Clicca qui per visualizzare una versione più grande di questa figura.
La corteccia piriforme è supero-mesiale all'amigdala ed è stata a lungo implicata negli studi sugli animali per essere un nodo comune nelle reti che disseminano le scariche epilettogene31-33 e genera convulsioni a seguito di stimolazione elettrica più facilmente rispetto alle strutture mesiali vicine, tra cui l'amigdala e l'ippocampo34. La sua posizione, con ampie connessioni con le cortecce entorinale, limbica, orbitofrontale e insulare, nonché con il talamo, il bulbo olfattivo, l'amigdala e l'ippocampo, si presta anche a un ruolo come via di propagazione chiave delle scariche epilettogene nell'epilessia focale30.
Gli studi EEG-fMRI e la tomografia a emissione di positroni (PET) supportano ulteriormente un ruolo importante della corteccia piriforme nella DRmTLE, mostrando l'attivazione interictale, e il ridotto legame del recettore dell'acido γ-aminobutirrico di tipo A (GABAA) nella corteccia piriforme è associato ad un aumento dell'attività convulsiva 35,36,37.
Due significativi studi di imaging recenti in DRmTLE hanno dimostrato che la libertà da crisi postoperatorie è associata a una maggiore estensione della resezione della corteccia piriforme; Galovic et al. hanno dimostrato in un'ampia coorte retrospettiva che la rimozione di almeno metà della corteccia piriforme ha migliorato le probabilità di diventare liberi da convulsioni di un fattore 16 (IC 95%, 5-47; p < 0,001)17. È stato anche dimostrato che i volumi di resezione di altre strutture temporali mesiali non erano associati alla libertà dalle crisi, un risultato replicato e supportato dalle analisi per voxel eseguite da Sone et al., che hanno dimostrato che solo la resezione della corteccia piriforme nel TLE sinistro era associata alla libertà dalle crisi16 (Figura 2).
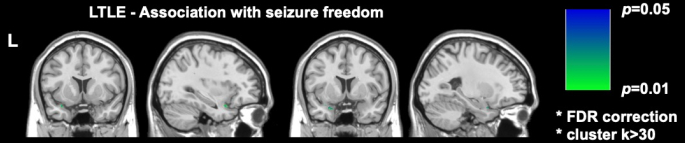
Figura 2: Associazione voxel-wise con la libertà convulsiva postoperatoria nella TLE sinistra. L'unica area significativamente correlata con la libertà dalle crisi è la porzione temporale della corteccia piriforme, p = 0,01 (verde nelle sezioni di risonanza magnetica coronale e sagittale pesate in T1). Adattato da Sone et al.16 con permesso. Clicca qui per visualizzare una versione più grande di questa figura.
Borger et al. hanno anche dimostrato in un'ampia coorte retrospettiva che solo la proporzione di corteccia piriforme temporale resecata è associata a un miglioramento dei tassi di libertà dalle crisi sia a 1 anno3 che a un follow-up più lungo (media 3,75 anni)23. Hanno inoltre confermato che il volume resecato dell'ippocampo e dell'amigdala non prediceva la libertà dalle convulsioni.
L'importanza della disconnessione della corteccia piriforme dalla rete epilettogena aberrante nel mTLE è stata dimostrata anche in LITT, con Hwang et al. che hanno mostrato al follow-up di 6 mesi che l'ablazione percentuale della corteccia piriforme era associata agli esiti ILAE di classe 138 (OR 1,051, IC 95% 1,001-1,117, p = 0,045), ma che questa era una tendenza che non era significativa a 1 anno5. Questo sembra supportare i dati emergenti riguardanti la LITT, che c'è un miglioramento positivo, ma potenzialmente meno permanente, negli esiti delle crisi, che ha portato alla LITT ad essere utilizzata comunemente come procedura di "primo stadio", con la chirurgia resettiva offerta a coloro in cui la libertà dalle crisi non è raggiunta dalla LITT.
Vi è, quindi, una forte evidenza che la resezione della porzione temporale della corteccia piriforme è un obiettivo chiave per raggiungere la libertà dalle crisi nell'epilessia del lobo temporale mesiale resistente ai farmaci. Tuttavia, come ha dimostrato la coorte retrospettiva di Galovic et al., questo nastro di corteccia entorinale si trova in una posizione difficile da colpire chirurgicamente quando si esegue un ATLR, il che significa che se non è direttamente mirato, non sempre viene rimosso con successo. In questo studio mostriamo come indirizzare e resecare in modo sicuro la porzione temporale della corteccia piriforme come parte di uno studio chirurgico prospettico in corso, per valutare il suo impatto sul miglioramento dei tassi di libertà dalle crisi postoperatorie39.
Il seguente protocollo si concentra sugli aspetti tecnici dell'acquisizione e dell'elaborazione delle immagini, sull'approccio chirurgico e su come garantiamo la resezione della porzione temporale della corteccia piriforme in ATLR, integrando al contempo la trattografia probabilistica preoperatoria ad alta risoluzione e le maschere anatomiche fuse delle strutture di interesse nella neuronavigazione intraoperatoria e nell'head-up display (HUD) del microscopio. Il protocollo utilizza anche una specifica piattaforma softwaredi pianificazione 40, che consente la visualizzazione tridimensionale e l'integrazione dell'imaging multimodale per la revisione e la pianificazione chirurgica, e un sistema di neuronavigazione che consente l'integrazione con il microscopio operatorio (le specifiche sono dettagliate nella Tabella dei Materiali).
Protocollo
Questi metodi e protocolli fanno parte di uno studio chirurgico prospettico in corso che è stato approvato dalla Health Research Authority il 10/09/2020, Research Ethics Committee (REC) London reference : 20/LO/0966. Il protocollo è stato registrato prospetticamente: ISRCTN72646265, il 25/09/2020, è disponibile online39, ed è stato presentato in occasione di un convegno nazionale41.
Il seguente protocollo viene applicato a tutti i pazienti sottoposti ad ATLR per DRmTLE in pazienti di età compresa tra 18 e 70 anni (la fascia di età dei pazienti operati per questa indicazione presso il nostro centro specializzato in chirurgia dell'epilessia per adulti), tutti operati dagli stessi chirurghi (AWM, AM). Tutti i partecipanti hanno fornito il consenso informato prima dell'inclusione nello studio. Tutti i partecipanti sono stati sottoposti a un'approfondita valutazione preoperatoria e a indagini dirette dal team multidisciplinare di esperti in epilessia chirurgica presso il centro completo di chirurgia dell'epilessia degli autori, composto da neurochirurghi, neurologi dell'epilessia, neuropsicologi, psichiatri, neuroradiologi e altri membri dei servizi specialistici di terapie per l'epilessia. Prima dell'intervento chirurgico, tutti erano sottoposti a risonanza magnetica volumetrica T1, T2 e FLAIR aggiornata, come indicato nel protocollo seguente, nonché sangue preoperatorio standard e una revisione da parte del team di neuroanestesia, che garantiva che fossero sicuri di procedere all'intervento chirurgico in anestesia generale. I dettagli commerciali dei reagenti e delle attrezzature utilizzate in questo studio sono forniti nella Tabella dei materiali.
1. Acquisizione ed elaborazione delle immagini
NOTA: Le scansioni di risonanza magnetica (MRI) prechirurgiche ad alta risoluzione, a 3 mesi e 1 anno vengono acquisite di routine nelle persone sottoposte a chirurgia dell'epilessia presso il nostro centro. I dati MRI sono stati acquisiti tra marzo 2020 e marzo 2024 sullo stesso scanner MRI per coerenza. L'acquisizione standardizzata delle immagini e molti dei componenti di elaborazione sono stati precedentemente descritti in letteratura e sono citati in modo appropriato nel protocollo riassunto di seguito:
- Acquisire le seguenti sequenze di risonanza magnetica:
- Una sequenza isometrica 3D standard (1 mm) pesata T1 con eco IR-FSPGR (IR-FSPGR) isometrica standard (1 mm) con recupero di inversione, richiamato rapido del gradiente (TE), 3,1 ms, tempo di ripetizione (TR) = 7,4 ms, tempo di inversione = 400 ms, campo visivo (FOV) = 224 × 256 × 256 mm, matrice = 224 × 256 × 256, dimensione del voxel = 1,00 × 1,00 × 1,00 mm = 1,00 mm3, fattore di accelerazione dell'imaging parallelo = 2] e;
- Una sequenza coronale a doppia eco a recupero rapido rapida spin echo densità protonica/T 2-pesata utilizzata per la rilassometria T242 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, matrice = 512 × 512, spessore della fetta = 4 mm, dimensione del voxel = 0,43 × 0,43 × 4,00 mm = 0,74 mm3, fattore SENSE = 2).
- Utilizza la sequenza pesata in T1 di cui sopra come input per l'algoritmo dei flussi di informazioni geodetiche (GIF v3) per suddividere il cervello in 162 regioni anatomiche utilizzando NiftyWeb43.
- Produrre maschere anatomiche delle strutture di interesse utilizzando le parcellazioni GIF (giro paraippocampale, giro fusiforme, creare informazioni di profilazione ippocampale e segmentare l'ippocampo nel 55% anteriore e nel 45% posteriore utilizzando Hipposeg44), sovrapporle nel software di pianificazione all'imaging volumetrico preoperatorio del paziente (come nel passaggio 1.1).
- Eseguire la segmentazione automatizzata della corteccia piriforme e dividere la corteccia piriforme in componenti frontali e temporali dalle tecniche di volumetria spiegate in precedenti lavori del nostro laboratorio 17,45,46. Una volta generate, sovrapponi queste maschere all'imaging preoperatorio del paziente.
- Acquisire le seguenti immagini di risonanza magnetica di diffusione:
- Un'acquisizione multi-shell a risoluzione standard (risoluzione isotropa di 2 mm, 11, 8, 32 e 64 direzioni del gradiente ai valori b 0, 300, 700, 2500 s/mm2) e;
- Un'acquisizione multi-shell ad alta risoluzione (risoluzione isotropa 1,6 mm, 101 direzioni, 14 b0, valori b: 300, 700 e 2500 s/mm2).
- Correggere i dati di diffusione acquisiti utilizzando MRtrix3 (https://mrtrix.org)47 per:
- Rumore utilizzando "dwidenoise" in MRtrix348.
- Deriva del segnale49.
- Anello di Gibbs utilizzando "mrdegibs" in MRtrix350.
- Distorsione utilizzando un gradiente di codifica di fase inversa con algoritmo FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- Correnti parassite e artefatti di movimento utilizzando l'algoritmo eddy di FSL (https://fsl.fmrib.ox.ac.uk/fsl)52, ruotando i vettori b53.
- Campo di polarizzazione utilizzando l'algoritmo ANTs (https://mrtrix.org47,54).
- Utilizzare la deconvoluzione sferica vincolata (CSD) multi-guscio e multi-tessuto55 per stimare le funzioni di risposta per la sostanza bianca e grigia e il liquido cerebrospinale (CSF).
- Eseguire la trattografia automatizzata anatomicamente mirata per ricostruire i fasci di fibre di interesse 12,56,57: la radiazione ottica, il fascicolo fronto-occipitale inferiore (IFOF; casi dominanti del linguaggio) e il fascicolo longitudinale medio (MLF; casi non dominanti del linguaggio). Segui i passaggi seguenti.
- Estrarre i punti di terminazione corticale per ogni fascio di fibre e raggrupparli in seme e ROI di terminazione.
- Crea regioni corticali di esclusione e ROI utilizzando regioni corticali non terminanti.
- Eseguire la trattografia anatomicamente vincolata58 tramite l'algoritmo probabilistico di tracciamento delle fibre iFOD259 utilizzando la segmentazione ibrida di superficie e volume in MRtrix347 selezionando un massimo di 5.000 linee di flusso da 300 milioni di semi.
- Eseguire la trattografia al punto 1.8.3 due volte per ogni fascio di fibre, cambiando il ROI del seme e della terminazione.
- Converti i fasci di fibre risultanti in mappe probabilistiche, con soglia a un valore di 0,01 - usali come criteri di esclusione aggiuntivi per rimuovere le linee di flusso spurie.
- Esamina i fasci di fibre risultanti (dilatati di 2 mm) e le maschere anatomiche nel software di pianificazione per assicurarti che siano anatomicamente accurati (questo passaggio viene eseguito da due neurochirurghi dell'epilessia nella nostra unità).
- Registrare spazialmente le maschere anatomiche del tratto di sostanza grigia e bianca risultanti nell'immagine RM pesata in T1 di riferimento nella fase 1.1 e caricarle nel sistema di navigazione intraoperatoria nella sala operatoria MRI intraoperatoria (iMRI).
- Acquisire immagini di risonanza magnetica volumetrica pesata T1, T2 e T2-FLAIR immediatamente prima dell'intervento chirurgico (< 24 ore) con fiduciali cutanei sul cuoio capelluto del paziente. Co-registrare queste immagini l'una con l'altra e l'immagine di riferimento pesata T1 e le maschere descritte sopra e dimostrate nella Figura 3.
- Registra" il paziente sul sistema di neuronavigazione con un laser di corrispondenza della superficie e uno smart-pointer.
- Verificare l'accuratezza della co-registrazione dell'immagine e del paziente con due neurochirurghi dell'epilessia prima dell'inizio del caso per garantire l'accuratezza.

Figura 3: Screenshot del sistema di neuronavigazione che dimostra la risonanza magnetica volumetrica pesata in T2 con maschere anatomiche sovrapposte e tratti utilizzati intraoperatoriamente in un ATLR destro. Pannello in alto a sinistra: ricostruzione tridimensionale della testa del paziente, dimostrazione delle maschere anatomiche. In alto a destra: assiale, in basso a sinistra: sagittale e in basso a destra: viste coronali che mostrano anche maschere anatomiche sovrapposte alla risonanza magnetica volumetrica pesata in T2. Maschere anatomiche mostrate: porzione temporale della corteccia piriforme (rosa), 55% anteriore dell'ippocampo (rosso), 45% posteriore dell'ippocampo (verde scuro, visibile solo nell'immagine sagittale), radiazione ottica (verde medio), fascicolo longitudinale medio (blu). Il mirino blu è la posizione integrata della messa a fuoco del microscopio e il mirino verde è la posizione del puntatore di neuronavigazione utilizzato nel campo chirurgico. Clicca qui per visualizzare una versione più grande di questa figura.
2. Tecnica chirurgica
NOTA: I passaggi seguenti riassumono la pratica nel centro degli autori e non intendono essere un'esposizione dell'unico approccio chirurgico a un ATLR, piuttosto una dimostrazione di come gli autori abbiano standardizzato l'approccio a questa procedura per fornire resezioni affidabili e riproducibili, inclusa la resezione della corteccia piriforme temporale.
- Posizionamento e approccio
- Seguendo i controlli preoperatori standard e le misure di sicurezza, posizionare il paziente in posizione supina, sollevare la spalla omolaterale con una rotolata e girare la testa sul lato controlaterale.
- Flettere la testa lateralmente per assicurarsi che l'eminenza malare sia il punto più alto del campo chirurgico e fissarla con i perni (dispositivo di fissazione del cranio a 3 punti - vedere esempi, compresi quelli compatibili con le sale operatorie intraoperatorie [iMRI] nella Tabella dei materiali).
NOTA: Il posizionamento è fondamentale per consentire un adeguato accesso alle strutture mesiali e posteriori del lobo temporale, in particolare la flessione laterale, per garantire che l'eminenza malare sia il punto più alto del campo chirurgico. - Infiltrarsi nell'anestetico locale per individuare i siti e l'incisione cutanea.
- Registrare lo spazio del paziente nel sistema di neuronavigazione utilizzando una combinazione di fiduciali cutanei e tracciamento della superficie (specifico per la marca del sistema di neuronavigazione utilizzato). Confermare l'accuratezza della registrazione rispetto a punti di riferimento ossei/altri punti di riferimento anatomici palpabili o visibili.
- Segnare l'attaccatura dei capelli e la radice dello zigoma (identificata dalla palpazione manuale). Identificare e segnare il decorso della fessura silviana utilizzando la neuronavigazione e l'incisione cutanea curvilinea frontotemporale pianificata "punto interrogativo".
- Rimuovere i peli lungo l'incisione cutanea pianificata utilizzando un tagliacapelli elettrico.
- Eseguire un'incisione frontotemporale da 1 cm anteriormente al trago, curvandola a modo di un punto interrogativo, per evitare lesioni al ramo frontotemporale del nervo facciale. Identificare e preservare l'arteria temporale superficiale, se possibile. Il posizionamento e la marcatura dell'incisione cutanea sono mostrati nella Figura 4.
- Coprire e fissare i bordi della ferita con tamponi mastoidei imbevuti di antimicrobici e clip di Raney.
- Incidere il muscolo temporale ed elevarlo in un lembo miocutaneo o interfasciale/sottofasciale (prevenendo lesioni al ramo frontotemporale del nervo facciale).
- Avvolgere il lembo cutaneo in una garza imbevuta di soluzione antimicrobica e ritrarlo anteriormente (evitando l'uso di strumenti di fissaggio metallici se in sale iMRI).
- Crea 2 fori di bava nel cranio con un trapano perforatore: il primo appena sopra la radice dello zigoma per massimizzare l'esposizione inferiore, il secondo frontale inferiore per facilitare la visualizzazione della fessura silviana.
- Eseguire una craniotomia frontotemporale standard 60,61,62, esponendo il giro temporale superiore e medio 1 cm sopra la fessura silviana.
- Perforare i margini anteriore e inferiore della craniotomia per consentire un facile accesso al pavimento della fossa temporale media e al polo temporale anteriormente. Se si incontrano celle d'aria mastoidee, sigillarle con cera ossea e colla di fibrina sia al momento dell'incontro che alla fine della procedura prima di chiudere gli strati superficiali all'osso.
NOTA: È importante assicurarsi che la craniotomia consenta l'accesso al pavimento della fossa cranica media, poiché questo sarà l'approccio al corno temporale del ventricolo laterale attraverso il solco collaterale. È anche importante sigillare accuratamente tutte le celle d'aria mastoidee incontrate per prevenire una perdita postoperatoria di liquido cerebrospinale e i conseguenti sintomi e potenziali infezioni. - Aprire la dura madre a forma di U con la base riflessa anteriormente ed estesa a stella. Agganciare la dura madre lontano dal campo operatorio con punti di sutura (come la seta 3-0).
- Rilasciare il liquido cerebrospinale dal pavimento della fossa cranica media e dalla faccia anteriore della fossa cranica media.
NOTA: La fase di rilascio del liquido cerebrospinale è importante per consentire uno spazio di lavoro sufficiente per accedere chirurgicamente al pavimento della fossa cranica media e al solco collaterale dal basso senza retrazione e tensione sul lobo temporale basale.
- Rimozione neocorticale laterale
- Coagulare la pia del giro temporale medio e inferiore (MTG e ITG, rispettivamente) in una linea perpendicolare alla base del cranio e in linea con la proiezione anteriore del corno temporale del ventricolo laterale (confermata dal sistema di neuronavigazione). Personalizzare l'estensione antero-posteriore di questa linea caso per caso, in base all'evidenza prechirurgica di coinvolgimento neocorticale laterale nell'insorgenza/propagazione delle crisi.
NOTA: L'estensione antero-posteriore della resezione neocorticale laterale deve tenere conto dell'evidenza preoperatoria (o della sua mancanza) del suo coinvolgimento nella propagazione delle crisi, e questo è adattato al singolo paziente. - Utilizzare un approccio transcorticale nell'ITG per esporre il pavimento della fossa cranica media e identificare il solco collaterale, che è laterale al giro paraippocampale e mediale al giro fusiforme.
- Coagulare la pia del giro temporale superiore (STG) anteriormente all'incisione neocorticale laterale soprastante, parallelamente alla direzione della fessura silviana. Questa è perpendicolare alla linea descritta nel passaggio 2.16 e si estende anteriormente al polo temporale.
- Sviluppare il piano tra STG e fessura silviana utilizzando tecniche di dissezione subpiale, proteggendo i rami dell'arteria cerebrale media, e portare questa dissezione fino alla parte orizzontale della fessura silviana fino al livello del solco limitante inferiore dell'insula.
NOTA: Prestare attenzione a mantenere l'integrità della pia dell'STG che confina con la fessura silviana durante l'esecuzione della dissezione subpiale nel passaggio 2.2.4, poiché ciò protegge i rami dell'arteria cerebrale media nella fessura, così come altre strutture come il nervo oculomotore e l'arteria comunicante posteriore (passaggio 2.2.14) e il tratto ottico (passaggio 2.3) più avanti nell'operazione. - Integrare il microscopio con il sistema di neuronavigazione.
- Confermare l'accuratezza delle sovrapposizioni degli oggetti delle maschere anatomiche descritte nella sezione 1 e visualizzarle sull'HUD del microscopio.
- Inclinare la linea di resezione posteriore anteriormente superiormente per ridurre al minimo la resezione di STG ed estenderla progressivamente attraverso l'MTG e l'ITG, attraverso il giro fusiforme fino al solco collaterale.
- Verificare la relazione del margine di resezione posteriore con il sistema di neuronavigazione con la maschera di radiazione ottica (OR) visualizzata.
- Visualizzare l'estensione anteriore massima della maschera operatoria sul microscopio e assicurarsi che sia posteriore al margine di resezione sull'HUD del microscopio per garantire che non vengano danneggiati gli operatori ortrici, che comporterebbero un deficit del campo visivo dopo l'intervento, come dimostrato nella Figura 5.
NOTA: Il passaggio 2.2.9 è un passaggio fondamentale per prevenire un deficit del campo visivo postoperatorio dovuto a danni all'ansa di Meyer della radiazione ottica. Se c'è molto spostamento cerebrale e il chirurgo desidera ridurre ulteriormente il rischio di danni alla radiazione ottica, o se le proiezioni sull'HUD del microscopio non funzionano correttamente, gli autori suggeriscono di utilizzare il puntatore di neuronavigazione per puntare l'approccio alla punta più anteriore del corno temporale del ventricolo laterale, in quanto ciò riduce al minimo il rischio di lesioni in sala operatoria. - Seguire il solco collaterale superiormente fino a quando non si incontra il corno temporale (confermarlo sul sistema di neuronavigazione), come mostrato nella Figura 6. La parete del corno temporale può essere identificata dall'ependima sfumato di blu.
NOTA: Nei soggetti in cui la patologia non è la sclerosi ippocampale e la testa ippocampale è ingombrante, il ventricolo può essere difficile da trovare. In questi casi, un'opzione per la risoluzione dei problemi consiste nell'utilizzare il puntatore di neuronavigazione sulla base della fossa temporale mediale dove non c'è spostamento per trovare dove sporge la punta del ventricolo. Normalmente è utile cercare questo su un piano coronale. Se il ventricolo non viene trovato, si consiglia di rimuovere prima l'asta e poi di trovare il ventricolo con l'aspiratore ad ultrasuoni. - Dividere le leptomeningi temporali basali lateralmente all'esposizione del corno temporale.
- Aprire il ventricolo anteriormente per esporre la testa dell'ippocampo (come mostrato nella Figura 6).
- Estendere il margine di resezione posteriore per unire la disconnessione al ventricolo e questo permette la disconnessione del blocco neocorticale.
- Mobilizzare il polo temporale seguendo la linea di dissezione sul margine del bordo tentoriale. Fare attenzione a non eseguire la disconnessione oltre il bordo del tentorio per evitare lesioni alle strutture mesiali, compreso il nervo oculomotore e l'arteria comunicante posteriore.
NOTA: Per ridurre il rischio di danneggiare le strutture della cisterna cruralis, seguire la forma del bordo del tentorio senza superare il bordo della tenda. L'uncus rimarrà in posizione e potrà essere preso come campione separato.
- Coagulare la pia del giro temporale medio e inferiore (MTG e ITG, rispettivamente) in una linea perpendicolare alla base del cranio e in linea con la proiezione anteriore del corno temporale del ventricolo laterale (confermata dal sistema di neuronavigazione). Personalizzare l'estensione antero-posteriore di questa linea caso per caso, in base all'evidenza prechirurgica di coinvolgimento neocorticale laterale nell'insorgenza/propagazione delle crisi.
- Resezione temporale mesiale, compresa la corteccia piriforme temporale
- Liberare il tessuto dell'uncus con la dissezione e l'uso dell'aspiratore ad ultrasuoni mesialmente fino a quando il nervo oculomotore e l'arteria comunicante posteriore sono visibili. Arrestare l'estensione della resezione posteriore quando viene visualizzato il piede (l'estensione più mesiale della testa dell'ippocampo).
- Eseguire la resezione dell'amigdala con l'aspiratore ad ultrasuoni, limitato superiormente dalla pia del solco endorinale, e fino alla visualizzazione del tratto ottico, e mesialmente dal piano piale delle cisterne basali.
NOTA: Fare attenzione a preservare lo stelo temporale e a non entrare nel lobo frontale quando si esegue il passaggio 2.3.2. A volte, a causa dello spostamento cerebrale, la neuronavigazione può sovrastimare l'entità della resezione mesiale; A questo proposito, la resezione può continuare in sicurezza fino a quando il tratto ottico non viene visualizzato attraverso il PIA, e questo rappresenta il confine mesiale della resezione. Questo è descritto anche in Usui et al.63Il margine dorsale dell'amigdala è comunemente descritto come approssimato da una linea immaginaria che collega il punto coroideale alla biforcazione dell'arteria cerebrale media prossimale64. - Assicurarsi che la porzione temporale della corteccia piriforme sia resecata rimuovendo qualsiasi tessuto residuo tramite dissezione subpiale, che progredisce inferiormente dal lato temporale della fessura silviana fino a visualizzare la vena del solco circolare inferiore dell'insula. Questo è un margine di resezione simile a quello descritto da Usui et al. quando si resecano lesioni amigdalari-uncali63.
NOTA: Se l'uncus (nel passaggio 2.3.1) o la corteccia piriforme sono difficili da rimuovere (a volte, possono essere molto aderenti alla pia madre), gli autori suggeriscono l'uso di un dissettore Rhoton piuttosto che dell'aspiratore a ultrasuoni per ridurre al minimo le lesioni alla pia madre. - Confermare la resezione della porzione temporale della corteccia piriforme utilizzando la maschera anatomica descritta al punto 1.4 sovrapposta all'HUD del microscopio, come dimostrato nella Figura 7.
- Resezione dell'ippocampo
- Posizionare le linteens (o cotonoidi larghi simili) per ritrarre il plesso coroideo (e l'arteria coroideale anteriore) mesialmente per facilitare la visualizzazione della fimbria ippocampale.
- Scollegare la fimbria ippocampo dal suo attacco aracnoideo, esponendo il solco ippocampale che trasporta l'arcata vascolare arteriosa del corno di Ammon.
- Scollegare l'ippocampo dalla sua coda (limitando questa resezione al 55% anteriore dell'ippocampo nelle resezioni dell'emisfero dominante del linguaggio nel tentativo di minimizzare i deficit della memoria verbale come descritto in16, o estendendo il più indietro possibile come il livello del tectum del mesencefalo nelle resezioni dell'emisfero dominante non linguistico).
- Scollegare la testa dell'ippocampo dal piede ippocampo. Coagulare l'arcata arteriosa ippocampale secondo necessità.
- Rimuovere l'ippocampo disconnesso in blocco.
- Eseguire la dissezione subpiale del giro paraippocampale e del subiculum e garantire l'emostasi nella cavità chirurgica risultante. Rimuovere il piede ippocampo, visualizzando e proteggendo il tronco encefalico.
NOTA: Prestare attenzione quando si esegue il passaggio 2.4.7, poiché a questo livello non esiste un confine pial protettivo tra il piede e il tronco encefalico.
- Imaging e chiusura intraoperatoria
- Rimuovere tutti gli elementi metallici dal campo chirurgico, coprire la ferita ed eseguire una risonanza magnetica intraoperatoria, che in genere include sequenze volumetriche T1, T2, FLAIR e DWI.
- Rivedere l'imaging intraoperatorio con un consulente neuroradiologo insieme a due neurochirurghi consulenti per l'epilessia, per assicurarsi che la quantità desiderata di strutture del lobo temporale mesiale (inclusa la porzione temporale della corteccia piriforme, nonché le quantità variabili di ippocampo come descritto sopra nel passaggio 2.36) siano state resecate con successo. Rivedere anche l'imaging DWI per assicurarsi che non siano state causate aree di ischemia durante la procedura.
- Una volta confermato quanto sopra, trasferire nuovamente il paziente sul tavolo operatorio e confermare l'emostasi nella cavità chirurgica alla normotensione per il paziente.
- Chiudere la ferita in modo standard, sostituendo il lembo osseo, fissandolo con placche e viti in 3 punti e una chiusura standard del muscolo, della fascia e degli strati cutanei con punti di sutura, lasciando un drenaggio della ferita chirurgica in posizione per 24 ore.
NOTA: L'assistenza postoperatoria si svolge nel centro autori, in genere nell'unità neurochirurgica ad alta dipendenza per le prime 24 ore, seguita da un passaggio a un reparto specializzato in neurochirurgia quando l'unità ad alta dipendenza lo ritiene appropriato. I pazienti sono monitorati per le loro osservazioni neurologiche, hanno sangue postoperatorio tra cui urea ed elettroliti, emocromo completo e differenziali e vengono in genere dimessi circa 72 ore dopo l'intervento. Vengono quindi seguiti in regime ambulatoriale in 4-6 settimane e almeno a 3-4 mesi e 1 anno dopo l'intervento con imaging a intervalli.
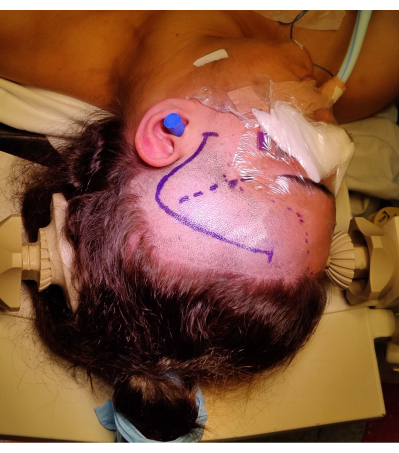
Figura 4: Immagine del posizionamento del paziente per un ATLR destro, che dimostra la marcatura del "punto interrogativo" dell'incisione cutanea frontotemporale destra, dell'attaccatura dei capelli e della fessura silviana. Non è raffigurato il rotolamento della spalla sinistra sotto la spalla sinistra del paziente per consentire l'angolo di posizionamento della testa senza esercitare uno sforzo eccessivo sul collo del paziente e non ostacolare il ritorno venoso. Le immagini sono state catturate e incluse con il consenso del paziente. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Immagine intraoperatoria al microscopio che dimostra il margine di resezione neocorticale laterale in un ATLR destro, con la maschera anatomica sovrapposta della radiazione ottica (ciano) - che dimostra che il margine di resezione è anteriore all'OR. Le etichette dimostrano l'orientamento della vista operativa: A = anteriore, P = posteriore, I = inferiore, S = superiore, STG = giro temporale superiore, MTG = giro temporale medio, ITG = giro temporale inferiore, TP = polo temporale. Clicca qui per visualizzare una versione più grande di questa figura.
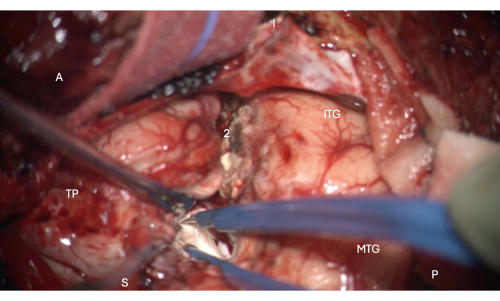
Figura 6: Immagine intraoperatoria al microscopio che mostra l'ingresso nella porzione anteriore del corno temporale del ventricolo laterale, che mostra la testa dell'ippocampo al suo interno (bianco pallido, 1). Etichette: A = anteriore, P = posteriore, I= inferiore, S = superiore, MTG = giro temporale medio, ITG = giro temporale inferiore, 2 = margine di resezione neocorticale laterale, seguendo il solco collaterale superiormente alla profondità per trovare il corno temporale del ventricolo laterale, TP = Polo Temporale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Immagine intraoperatoria dal microscopio che mostra la sovrapposizione HUD della maschera anatomica della porzione temporale della corteccia piriforme (contorno rosa, etichettato Pi). Questa figura mostra la resezione completa: non c'è tessuto cerebrale rimasto, solo il confine piale del solco endorinale mesiale alla resezione, protetto in questa immagine con il tortino longitudinale sovrastante nell'immagine, appena sopra il mirino bianco centrale dell'HUD del microscopio. Etichette: A = anteriore, P = posteriore, I = inferiore, S = superiore, STG = giro temporale superiore, MTG = giro temporale medio, ITG = giro temporale inferiore, FL = lobo frontale, SV = vene silviane (sovrastanti la fessura silviana), Pi = porzione temporale della corteccia piriforme. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Questo protocollo e le tecniche chirurgiche sono state applicate nell'ambito di uno studio in corso, che esamina gli effetti della resezione della corteccia piriforme temporale e il suo impatto sulla libertà dalle crisi epilettiche dopo ATLR per DRmTLE. Lo scopo di questo studio è quello di determinare in modo prospettico se la libertà dalle crisi dopo la rimozione della corteccia piriforme temporale migliora effettivamente la libertà dalle crisi in DRmTLE, come suggerisce il crescen...
Discussione
Questo protocollo fornisce una resezione affidabile e mirata della porzione temporale della corteccia piriforme, che si ritiene sia una struttura cruciale nell'epilettogenesi e nella propagazione della rete di epilessia del lobo temporale mesiale 16,17,24,25,30.
I componenti della tecnica ATLR stand...
Divulgazioni
Gli autori Debayan Dasgupta e John S. Duncan ricevono finanziamenti dal Wellcome Trust Innovation Program (218380/Z/19/Z). Lawrence P. Binding è supportato da Epilepsy Research UK (numero di sovvenzione P1904). Gli autori sopra citati e Sjoerd B. Vos sono in parte finanziati dal National Institute for Health Research, University College London Hospitals Biomedical Research Centre (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269). Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi. Confermiamo di aver letto la posizione della Rivista sulle questioni relative alla pubblicazione etica e affermiamo che questo rapporto è coerente con tali linee guida.
Riconoscimenti
Questo lavoro è stato supportato da Epilepsy Research UK (numero di sovvenzione P1904) e dal Wellcome Trust Innovation Program (218380/Z/19/Z). Questo lavoro è stato in parte finanziato dal National Institute for Health Research, University College, London Hospitals Biomedical Research Centre (NIHR, BRC, UCLH/UCL, High Impact Initiative, BW.mn.BRC10269). Gli autori riconoscono le strutture e l'assistenza scientifica e tecnica della National Imaging Facility, una capacità della National Collaborative Research Infrastructure Strategy (NCRIS), presso il Center for Microscopy, Characterization, and Analysis, University of Western Australia. Questa ricerca è stata finanziata in tutto o in parte dal Wellcome Trust [WT 218380]. Ai fini dell'Open Access, l'autore ha applicato una licenza di copyright pubblica CC BY a qualsiasi versione del manoscritto accettato dall'autore derivante da questa presentazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Riferimenti
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon