Method Article
Separación y caracterización diferencial de vesículas extracelulares microbianas intestinales en ratas sensibles a la sal en condiciones de dieta alta en sal
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo describe el aislamiento de VE microbianos intestinales de ratas sensibles a la sal alimentadas con HSD mediante centrifugación en gradiente de densidad. Los VE se caracterizaron mediante seguimiento de nanopartículas, ensayos TEM, LPS/BCA y secuenciación de ARNr 16S para analizar el tamaño, la morfología, la composición y el origen de la microbiota.
Resumen
El alto consumo de sal es un factor de riesgo importante para la hipertensión, y su mecanismo subyacente puede estar estrechamente relacionado con las vesículas extracelulares (VE) secretadas por la microbiota intestinal. Estos VE, producidos por la microbiota intestinal, transportan varios componentes bioactivos que pueden desempeñar un papel crucial en el desarrollo de la hipertensión inducida por una dieta alta en sal (HSD). Para investigar este mecanismo, desarrollamos un método de extracción eficiente basado en la centrifugación en gradiente de densidad para aislar los VE de la microbiota intestinal de ratas sensibles a la sal alimentadas con una HSD. Mediante el análisis del tamaño de las partículas, la microscopía electrónica de transmisión (TEM) y la detección de lipopolisacáridos (LPS), identificamos la distribución del gradiente de los VE de la microbiota intestinal y logramos una extracción precisa. Además, se empleó la secuenciación del gen ARNr 16S para analizar el origen y las diferencias de composición de las VE entre los grupos normales y HSD, revelando el impacto de una ingesta elevada de sal en las características genéticas de las VE de la microbiota intestinal. Este estudio proporciona valiosas herramientas y conocimientos científicos sobre los mecanismos de la microbiota intestinal que subyacen a la hipertensión inducida por la sal y ofrece nuevas perspectivas para la prevención y el tratamiento de enfermedades relacionadas.
Introducción
La microbiota intestinal, también conocida como microflora de la microbiota intestinal o microecología intestinal, es un complejo de decenas de miles de microorganismos ubicados en el tracto gastrointestinal biológico y desempeña un papel crucial en el mantenimiento de la salud humana1. En los últimos años, con más investigaciones, se ha descubierto que la microbiota intestinal puede producir vesículas extracelulares (VE)2. Los VE son pequeñas vesículas liberadas por las células, que transportan varias moléculas en la célula, como proteínas, ácidos nucleicos y lípidos 3,4. Pueden interactuar con otros microbios5, células epiteliales intestinales e incluso tejidos y órganos distantes6, afectando así la salud del cuerpo humano 7,8. Existe una estrecha relación entre las VE producidas por estas microbiotas intestinales y la dieta9.
Las VE producidas por la microbiota intestinal pueden ser agentes importantes a través de los cuales una dieta alta en sal (HSD) afecta a la salud del organismo. La HSD no solo altera directamente el equilibrio de la microbiota intestinal10, lo que conduce a una reducción significativa del número de bacterias beneficiosas (como Lactobacillus)11, sino que también promueve la proliferación de bacterias dañinas (como Bacteroides, etc.)12. Este desequilibrio reduce la función de barrera intestinal y aumenta el riesgo de inflamación intestinal. Además, una HSD también afecta aún más al equilibrio ácido-base y a la absorción de nutrientes en el intestino al modificar las actividades metabólicas13 de la microbiota intestinal, como la reducción de la producción de ácidos grasos de cadena corta14,15 con múltiples funciones fisiológicas.
Estos cambios no solo afectan la salud intestinal, sino que también pueden regular indirectamente la producción y liberación de VE y alterar la composición y función del VE. El ambiente rico en sal puede afectar las funciones fisiológicas normales de las células intestinales, incluida la liberación y el transporte de VE, alterando así el papel de las VE en la transmisión de información intercelular y la regulación inmunitaria. Al mismo tiempo, la inflamación intestinal puede promover una variedad de EV con funciones especiales16 y diseminarse a todo el cuerpo a través del eje intestino-órgano y otras formas17,18, lo que está estrechamente relacionado con la aparición y desarrollo de hipertensión19,20, enfermedades cardiovasculares21 y cerebrovasculares22,23, obesidad24,25, diabetes26 y otras enfermedades crónicas.
Por lo tanto, el objetivo general de este estudio era desarrollar un método eficaz y fiable para extraer los VE de la microbiota intestinal de ratas sensibles a la sal alimentadas con HSD y estudiar sistemáticamente sus propiedades físicas, composición y funciones. Debido a las características del aumento significativo de la presión arterial después de una dieta alta en sal, se seleccionaron ratas sensibles a la sal y se reveló el efecto de la HSD en la EV de la microbiota intestinal mediante la construcción de un método de extracción eficiente. El método se basó en la centrifugación en gradiente de densidad y combinó varias técnicas de identificación dinámica, como la detección del tamaño de partícula, la medición de LPS/BCA, la microscopía electrónica de transmisión y el análisis proteómico. El protocolo tiene como objetivo revelar los efectos de la HSD en la EV de la microbiota intestinal y sus mecanismos en la enfermedad cardiovascular. Con su alta eficiencia, reproducibilidad y amplia aplicabilidad, este enfoque no solo proporciona una herramienta importante para explorar el mecanismo de las VE de la microbiota intestinal en la hipertensión inducida por la sal, sino que también sienta las bases teóricas para desarrollar estrategias de intervención en enfermedades basadas en las VE. A través de este estudio, esperamos abrir nuevas vías para la prevención y el tratamiento de enfermedades cardiovasculares, como la hipertensión 27,28.
Protocolo
Este estudio experimental en animales cumple con las directrices éticas y las normas internacionales pertinentes. Los estudios con animales fueron aprobados por el Comité de Ética y Bienestar de Animales de Laboratorio de la Universidad de Medicina China de Chengdu (institución: Universidad de Medicina China de Chengdu; número de protocolo: 2018-21).
1. Preparación animal y régimen dietético
- Aclimatar ratas Dahl macho sensibles a la sal de 6 semanas de edad, peso corporal de 180 a 200 g, criándolas con una humedad del 50% ± del 10%; Ciclo de luz de 12 h / 12 h; 20,0 ± 2,0 °C durante 1 semana en condiciones específicas libres de patógenos.
- Posteriormente, divida las ratas en partes iguales en dos grupos (n = 6). Proporcionar a cada grupo una dieta diferente que dure 6 semanas: una dieta normal de sal (NSD) con 0,5% de cloruro de sodio y una HSD con 8% de cloruro de sodio, que es comúnmente utilizada en los estudios publicados 29,30,31. Los ratones tuvieron acceso ilimitado a comida y agua durante todo el estudio.
2. Monitorización de la presión arterial
NOTA: La pletismografía con manguito de cola se utilizó como método no invasivo para la medición de la presión arterial, y se utilizó el registro de la presión volumétrica (VPR) cuando la presión arterial se midió a partir del volumen sanguíneo de la cola.
- Coloque las ratas individualmente en jaulas pequeñas con aserrín, calentadas durante 10 minutos a aproximadamente 37 ° C y colóquelas en un sistema de retención de roedores personalizado con una nariz y puerta ajustables para la entrada de animales. Coloque a las ratas en una almohadilla térmica en posición prona para mantener su temperatura corporal a 37 °C.
- Conecte el sensor VPR a la parte inferior de la cola y establezca al menos 10 ciclos de adaptación para estabilizar el BP28.
- Llene el brazalete inflable en la raíz de la cola y coloque el sensor pletismográfico (o sensor fotoeléctrico) debajo. Infle lentamente hasta superar la presión sistólica (generalmente 200 mmHg) y luego suelte lentamente. El instrumento detecta automáticamente el valor de la presión de la desaparición de la onda de pulso (presión arterial sistólica) y la recuperación (presión arterial diastólica). Mida de 3 a 5 veces consecutivas y tome el valor promedio.
- Entrene a todas las ratas para que se adapten al procedimiento de restricción y realice este estudio en un laboratorio tranquilo alrededor de las 9 a.m. para minimizar los efectos de la variación circadiana.
- Mida la presión arterial sistólica (PAS) y la presión arterial diastólica (PAD) cada dos días antes del sacrificio. Estimación de la presión arterial media (PAM) a partir de la PAS y la PAD
MAPA = (SBP + 2 DBP)/3
3. Extracción de vehículos eléctricos
- Recogida de muestras
- Sumerge un hisopo de algodón estéril en alcohol al 75% y úsalo para estimular el ano de la rata. La estimulación estaba destinada a promover el peristaltismo intestinal y relajar el esfínter anal, favoreciendo así la defecación. Una vez expulsadas las heces, recójalas con pinzas estériles en recipientes estériles del tamaño adecuado y guárdelas inmediatamente a -80 °C.
- Preparación de la muestra
- Con una cuchara, transfiera 5 g de heces a un tubo de centrífuga de 50 ml previamente pesado. Añada 50 ml de PBS precalentado a 37 °C libre de endotoxinas (concentración máxima de muestra del 10%) al tubo y gírelo durante 30 min. Enfríe la centrífuga de alta velocidad a 4 °C.
- Centrifugar a 8.000 x g durante 15 minutos después de colocar las muestras simétricamente para permitir que la centrífuga se equilibre. Después de la centrifugación, aspire el sobrenadante y transfiéralo a un nuevo tubo de centrífuga estéril.
- Vuelva a centrifugar a 8.000 x g durante 15 min. Aspire el sobrenadante y utilícelo para un análisis posterior.
- Preparación del extracto crudo
- Utilice una unidad de filtro estéril de 0,22 μm. Coloque la unidad de filtro sobre hielo y sujete firmemente la bomba de vacío. Transfiera el sobrenadante obtenido a la parte superior del filtro. Encienda la bomba de vacío para recoger las muestras filtradas.
- Transfiera el filtrado a un filtro centrífugo (10 kDa, 15 mL), centrifugue a 4 °C, 3.000 x g durante 30 min y concentre la muestra a al menos 1400 μL.
- Recoger la muestra concentrada y, si es necesario, diluirla a 1400 μL utilizando PBS libre de endotoxinas preenfriado. Mantenga la muestra en hielo inmediatamente después de la dilución.
NOTA: El extracto crudo puede utilizarse inmediatamente o almacenarse a -80 °C durante varios meses.
- Separación de vehículos eléctricos
- Prepare la zona de influencia de degradado A y la zona de influencia de degradado B como se describe a continuación. Prepare el tampón con un día de anticipación, ya que el compuesto tarda varias horas en disolverse por completo. El tampón preparado puede almacenarse a 4 °C durante 6 meses.
- Preparación del tampón de gradiente A: Disolver 0,25 M de sacarosa, 6 mM de EDTA y 60 mM de Tris en 800 mL de agua libre de endotoxinas mediante agitación magnética con mezclador, con el pH ajustado a 7,4 utilizando ácido clorhídrico. Diluir hasta 1 L con agua libre de endotoxinas. Utilice un filtro de tapa de botella de 0,22 μm para filtrar el tampón.
- Preparación del tampón de gradiente B: Disolver 0,25 M de sacarosa, 1 mM de EDTA y 10 mM de Tris en 800 mL de agua libre de endotoxinas mediante agitación magnética con mezclador, con pH ajustado a 7,4 con ácido clorhídrico. Diluido a 1 L con agua libre de endotoxinas. Utilice un filtro superior de botella de 0,22 μm para filtrar el tampón.
- Mezcle 1 volumen de tampón de gradiente A y 5 volúmenes de medio de gradiente de densidad (el medio es una solución de yodixanol al 60%) para preparar la solución de trabajo.
- Preparación de la solución de iodixanol (10%, 20%, 40%): Para preparar una solución de iodixanol al 10%, mezcle 1 unidad de solución de trabajo y 4 unidades de tampón B; para una solución de yodixanol al 20%, mezcle 2 unidades de solución de trabajo y 3 unidades de tampón B; para una solución de yodixanol al 40%, mezcle 4 unidades de solución de trabajo y 1 unidad de tampón B. Prepare cada solución fresca y guárdela en hielo.
NOTA: Se deben preparar nuevas soluciones de trabajo para cada experimento, y se puede preparar un volumen adicional de soluciones del 10% para dar cuenta del error experimental. - Mezcle la solución preparada en el paso 3.3.3 con 7 mL de medio de gradiente de densidad para hacer una solución de yodixanol al 50%.
- Para preparar un gradiente de densidad, agregue una solución de azul de tripano a la solución al 40% y una solución de yodixanol al 10% (peso / vol) para proporcionar un contorno claro entre las distintas capas.
- Transfiera 8 mL de solución de yodixanol al 50% al fondo del tubo de centrífuga de polipropileno de pared delgada. Incline el tubo a 70° y transfiera 8 mL de solución de yodixanol al 40% a la superficie líquida. Agregue 8 mL de solución de yodixanol al 20%, luego 7 mL de solución de iodixanol al 10% y finalmente 2 mL de PBS libre de endotoxinas.
NOTA: La preparación de un gradiente de densidad requiere práctica. La calidad del gradiente de densidad tiene un gran impacto en los resultados experimentales. No coloque el tubo en posición vertical entre los diferentes pasos del proceso de adición, ya que esto afecta negativamente la calidad del gradiente de densidad. - Enfríe previamente la centrífuga y coloque el gradiente de densidad preparado en la ultracentrífuga. Parámetros de entrada para iniciar, valores de parámetros: 100.000 x g, 20 h, 10 °C.
- Para la separación manual de la densidad en gradiente, extraiga lentamente 2 mL de la solución desde el centro de la superficie del sistema que contiene un total de 34 mL de líquido. Cada 2 ml es un gradiente, dividiendo así la solución del gradiente de densidad en 17 gradientes.
- Transfiera las fracciones de densidad a un tubo de muestra estéril con una pipeta y colóquelas inmediatamente en hielo. Sujete el tubo de centrífuga entre el pulgar y el índice para asegurarse de que permanezca en posición vertical.
- Prepare la zona de influencia de degradado A y la zona de influencia de degradado B como se describe a continuación. Prepare el tampón con un día de anticipación, ya que el compuesto tarda varias horas en disolverse por completo. El tampón preparado puede almacenarse a 4 °C durante 6 meses.
- Recuperación de vehículos eléctricos
- Utilizando un sistema de extracción de EV totalmente automatizado que aplica oscilación de presión negativa a través de un sistema de oscilación ultrasónica de doble acoplamiento en el chip de ultrafiltración, elimine las impurezas de ácido nucleico y proteínas en la muestra a través del nanoporo e intercepte los EV, lo que conduce al enriquecimiento y purificación de los EV.
- Retire el filtrado en el paso 3.4.7 y agréguelo al chip de ultrafiltración.
- Opere el instrumento de acuerdo con las instrucciones del instrumento y recoja el filtrado filtrado, es decir, la solución enriquecida con exosomas. El proceso principal se muestra en la Figura 1.
- Utilizando un sistema de extracción de EV totalmente automatizado que aplica oscilación de presión negativa a través de un sistema de oscilación ultrasónica de doble acoplamiento en el chip de ultrafiltración, elimine las impurezas de ácido nucleico y proteínas en la muestra a través del nanoporo e intercepte los EV, lo que conduce al enriquecimiento y purificación de los EV.
4. Identificación de vehículos eléctricos
- Detección de tamaño y concentración de partículas
- Evalúe la distribución de tamaño y el potencial zeta utilizando un contador de nanoculoómetro basado en detección de pulso resistivo (RPS). Seleccione chips de nanoporos con un rango de medición de 60-200 nm para este experimento. Además, evalúe la distribución del tamaño de partícula y el potencial zeta de los EV utilizando un contador de nanobibliotecas.
- Tome una cantidad adecuada de solución de EVs y dilúyala en (1/10, 1/100, 1/1000, 1/10000).
- Se colocaron diferentes diluciones de soluciones de vehículos eléctricos en el instrumento para realizar pruebas.
- Se seleccionó el múltiple de dilución con mejor estabilidad y se volvió a probar para obtener datos más precisos.
- Evalúe la distribución de tamaño y el potencial zeta utilizando un contador de nanoculoómetro basado en detección de pulso resistivo (RPS). Seleccione chips de nanoporos con un rango de medición de 60-200 nm para este experimento. Además, evalúe la distribución del tamaño de partícula y el potencial zeta de los EV utilizando un contador de nanobibliotecas.
- Ensayo de LPS y BCA
- Ensayo de BCA: Lisar los EV con tampón RIPA y, a continuación, separar las proteínas. Determine el contenido de proteínas de los EV utilizando el kit de determinación de la concentración de proteínas BCA.
- Ensayo LPS: Usando el kit de detección de endotoxinas, agregue muestras, un detector de endotoxinas y cromogénicos de acuerdo con los pasos del kit. Mida la absorbancia a 545 nm y calcule la expresión de LPS de las vesículas externas de acuerdo con la curva estándar.
- Evaluación TEM: Para la tinción negativa y el análisis TEM, aplique muestras a una rejilla de cobre luminiscente recubierta con una película de carbono continua y tiña con formiato de uranilo al 0,75%. Para crio-EM, absorba los vehículos eléctricos en una rejilla de carbono EM de malla 300 con una superficie hidrofílica y congele en nitrógeno líquido. Observe y analice las rejillas utilizando el Cryo-TEM y grabe las imágenes a 22.000 aumentos32.
- Caracterización de proteínas: Lisar EVs utilizando tampón RIPA y luego separar las proteínas. Determine la concentración de proteínas utilizando el kit de ensayo de proteínas BCA, separe cantidades iguales de proteínas de cada muestra mediante SDS-PAGE y tiña con una solución de colorante azul de Coomassie después de la electroforesis para visualizar los perfiles de proteínas33,34.
- Secuenciación y análisis S: Extraiga el ADN genómico de las muestras fecales utilizando un kit de extracción de ADN fecal. Evaluar la integridad y concentración de ADN mediante electroforesis en gel de agarosa y un espectrofotómetro. Amplifique la región V3 - V4 del gen 16S rRNA con cebadores universales, purifique los productos de PCR, cuantifique y secuséntelos en la plataforma Illumina. Realice análisis de datos mediante la canalización QIIME235.
- Clasifique las variantes de secuencia de amplicones (ASV) mediante DADA2 y compárelas con la base de datos Silva mediante el algoritmo VSEARCH. Utilice el análisis de α-diversidad para evaluar la riqueza y diversidad de especies dentro de las muestras, utilizando principalmente índices como el índice de Shannon y el índice Chao1. El análisis de β-diversidad compara la composición de la comunidad microbiana entre muestras y generalmente se visualiza mediante análisis de coordenadas principales (PCoA). Utilice métodos de análisis diferencial, como el análisis discriminante lineal del tamaño del efecto (LEfSe) y el análisis de diagramas volcánicos, para identificar taxones microbianos con condiciones significativamente diferentes o entre grupos.
Resultados
Las concentraciones de EVs se determinaron en diferentes fracciones (Figura 2A). Los resultados experimentales mostraron que la concentración de los EV exhibió un patrón de distribución normal típico en una serie de soluciones de gradiente de densidad (Figura 2B). En concreto, en la fracción 9, la concentración de VE alcanzó su punto más alto (3,85 x 109), lo que sugiere que la principal fracción de distribución de los VE puede ser de 936.
Para la determinación del contenido de proteína, se utilizaron kits de BCA para evaluar el contenido de proteína en diferentes fracciones (Figura 2C). En este método, el contenido de proteína en la fracción 9 fue de 0,417 μg/μL, lo que demuestra aún más la distribución de los EV. Dado que el LPS es un componente único de las bacterias Gram-negativas37,38, también se utilizaron kits de detección de endotoxinas para determinar la expresión de LPS (Figura 2D) con el fin de evaluar la distribución de los VE en diferentes fracciones. Los resultados experimentales mostraron que en las fracciones 9 y 10, la expresión de LPS fue significativamente mayor que las otras fracciones (absorbancia para la fracción 9 = 0.8086, para la fracción 10 = 0.8515), y su distribución mostró una distribución normal, lo que demostró que las EV se distribuyen principalmente en la fracción 9. También se observaron cantidades relativamente mayores de proteína en la fracción 9 en la electroforesis en gel SDS-PAGE de EVs aisladas de diferentes fracciones (Figura 2E).
Este estudio examinó los vehículos eléctricos utilizando microscopía electrónica de transmisión (TEM; Figura 2F). A través de imágenes de alta resolución de TEM, pudo visualizar claramente la estructura morfológica de los VE, con estructuras circulares en forma de membrana, lo cual es crucial para comprender la biología de los VE.
Los cambios en la presión arterial se determinaron en los grupos NSD y HSD después de 2 meses de crianza en los grupos NSD y HSD de las ratas. Podemos ver que la PAS (Figura 3A), la PAD (Figura 3B) y la PAM (Figura 3C) aumentaron significativamente en el grupo HSD, lo que indica que el modelo de hipertensión de este estudio se construyó con éxito.
En este estudio, se detectó la concentración de VE en diferentes grupos (Figura 3D), y los resultados mostraron que la concentración de VE en el grupo HSD fue significativamente mayor que la de las ratas en el grupo NSD. Esto sugiere que la HSD afecta al nivel de VE, posiblemente debido a cambios en la composición de la microbiota intestinal de la que proceden las VE.
A continuación, se midió el tamaño de partícula de los vehículos eléctricos en este estudio. Los resultados de la medición indican que el tamaño de partícula de los EV es predominantemente de alrededor de 60 nm (Figura 3E), y el tamaño de partícula del grupo HSD es ligeramente inferior al del grupo NSD. Los datos medidos proporcionan información importante para evaluar la distribución del tamaño y la homogeneidad de los VE, lo que facilita el posterior diseño experimental y el desarrollo de aplicaciones.
Luego, en este estudio, se examinó la cantidad de expresión de LPS de EV en el grupo HSD y el grupo NSD (Figura 3F). Los resultados mostraron que la expresión de LPS por EV en el grupo HSD también fue significativamente mayor que en el grupo NSD. Esto puede deberse al aumento de bacterias gramnegativas en la microbiota intestinal derivada de exovesículas o a la mayor concentración de VE en el grupo HSD que en el grupo NSD.
Para respaldar aún más las diferencias entre los VE en los grupos HSD y NSD, este estudio investigó la microbiota intestinal derivada y realizó una secuenciación del ARNr 16S de muestras de VE de los grupos NSD y HSD para aclarar aún más el efecto de la HSD en los VE en la microbiota intestinal en ratones.
El análisis de α-Diversity mostró que la diversidad de la microbiota intestinal se redujo significativamente en el grupo HSD, con una disminución de los índices de Shannon y ACE (Figura 4A). β -El análisis de diversidad, basado en PCoA (Figura 4B), distinguió los fenotipos microbianos entre los grupos a nivel de ASV. La intervención con alto contenido de sal revirtió parcialmente los cambios fenotípicos en la microflora intestinal y encontró diferencias significativas en la composición de la microbiota intestinal derivada de vesículas externas entre los grupos (p = 0,001).
Después de filtrar las bacterias de baja abundancia y estandarizar los datos, la anotación taxonómica identificó diferentes rangos de comunidades microbianas en las muestras. La microbiota intestinal derivada de exovesículas estaba constituida principalmente por Proteobacteria (93,19 %), Firmicutes (4,57 %) y Bacteroidota (1,19 %; Figura 4C). El grupo HSD aumentó significativamente la abundancia de vesículas externas de Firmicutes (Figura 4D). A nivel de género, los resultados mostraron que géneros como Nevskia y Acinetobacter fueron más abundantes en el grupo NSD, mientras que Delftia, Burkholderia_Ca y Clostridium_sen fueron más abundantes en el grupo HSD (Figura 4E). Además, este estudio también utilizó mapas de calor para mostrar las diferencias en las VE de la microbiota intestinal entre el grupo HSD y el grupo NSD (Figura 4F). Después de la intervención con alto contenido de sal, la abundancia de algunas bacterias, Delftia y Burkholderia_Ca, aumentó significativamente, y Nevskia y Acinetobacter disminuyeron significativamente (Figura 4G). En conclusión, la intervención con alto contenido de sal cambió significativamente la diferencia en la producción de VE derivadas de la microflora intestinal, principalmente porque cambió la distribución de sus bacterias parentales, y las principales características fueron disminuciones en la diversidad, cambios en la estructura de equilibrio y cambios en la abundancia de diferentes bacterias.
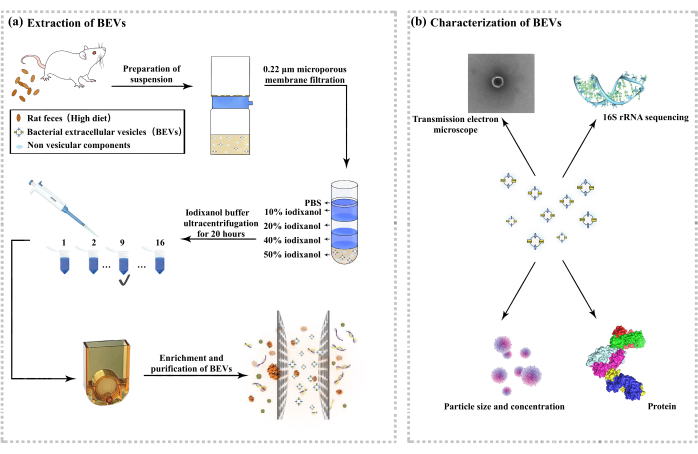
Figura 1: Extracción y caracterización de vesículas externas derivadas de microbios intestinales. (A) Diagrama de flujo de la extracción de vesículas externas. (B) Caracterización de las vesículas externas. Haga clic aquí para ver una versión más grande de esta figura.
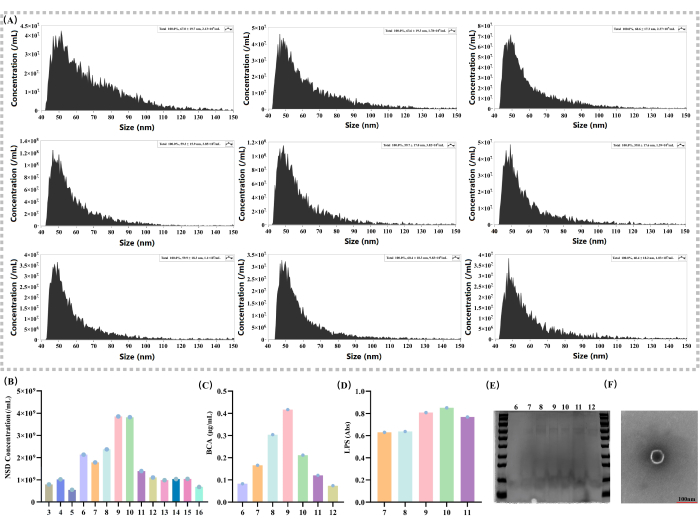
Figura 2: Caracterización básica de los EVs y análisis del gradiente de densidad local. (A) Mediciones de concentración de extravesículas y tamaño de partícula con diferentes gradientes de densidad (nm; partículas/mL). (B) Comparación de las concentraciones de vesículas externas en solución por gradiente de densidad 3 - 16 (partículas/mL). (C) Determinación del contenido de proteína en solución en el gradiente de densidad 6-12 mediante el kit BCA (μg/mL). (D) Medición de la expresión de LPS en solución por gradiente de densidad 7-11 con un kit de detección de endotoxinas (Abs). (E) Las soluciones con un gradiente de densidad de 6 a 12 se sometieron a electroforesis en gel SDS-PAGE y se tiñeron con azul brillante de Coomassie. (F) TEM: La barra de escala es de 100 nm; Las vesículas individuales se muestran en la imagen. Haga clic aquí para ver una versión más grande de esta figura.
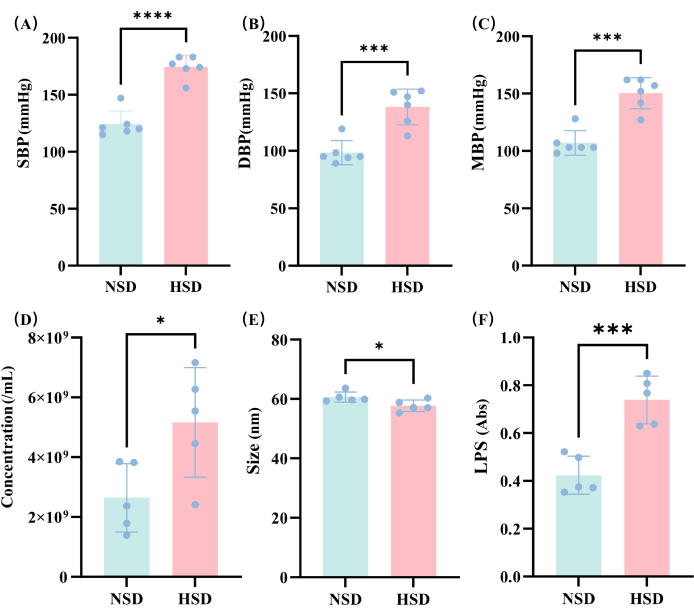
Figura 3: Análisis de los cambios en la presión arterial y los VE bajo diferentes dietas. a) SBP; (B) DBP; (C) MBP; (D) Comparación de las concentraciones de vesículas externas en los grupos HSD y NSD; (E) Comparación del tamaño de la vesícula externa en los grupos HSD y NSD. (F) LPS en las muestras NSD y HSD determinadas por espectrofotometría. *p < 0,05, ** p < 0,01, *** p < 0,001 y NS significa sin significación, prueba t. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis de la prueba de ARNr 16s bajo las diferentes dietas. (A) El análisis de la diversidad α; B) Análisis de coordenadas principales; C) la abundancia de microbiota intestinal a nivel de filos; (D) Cambios en las bacterias a nivel de filo; (E) Resultado de LEfSe; (F) el análisis del mapa de calor del conglomerado basado en géneros bacterianos diferenciales; (G) Cambios en el nivel de género bacteria. *p < 0,05, ** p < 0,01, *** p < 0,001 y NS significa sin significación, prueba t. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este estudio, nos centramos en las VE de la microbiota intestinal en ratas sensibles a la sal en un HSD y logramos una serie de logros clave. En primer lugar, se construyó con éxito un método de extracción eficiente basado en la centrifugación en gradiente de densidad para aislar los VE de la microbiota intestinal de rata sensible a la sal en HSD, y la mayoría de los componentes no EV se aislaron mediante un meticuloso y estandarizado proceso de procesamiento de muestras y manipulación experimental en animales. El método de extracción de EV de centrifugación en gradiente de densidad es altamente eficiente y reproducible, mejor que el método de ultracentrifugación convencional, y puede retener mejor la integridad y funcionalidad de los EV, lo que garantiza la calidad de la muestra y la viabilidad del estudio.
En segundo lugar, los vehículos eléctricos se identificaron de forma exhaustiva a través de diversas tecnologías dinámicas: la detección del tamaño y la concentración de partículas indica que los vehículos eléctricos tienen una distribución de tamaño específica; Las mediciones de LPS y BCA cuantifican el contenido de proteínas y la expresión de LPS de los EV; La TEM muestra claramente la estructura morfológica de los VE; y las características de las proteínas definen el espectro proteico. Estos resultados de identificación revelan de forma exhaustiva las propiedades físicas y bioquímicas de los vehículos eléctricos, proporcionando un apoyo de datos fiable para estudios posteriores.
Además, la tecnología de secuenciación del gen 16S rRNA mediante un análisis en profundidad de las diferencias entre el origen y la composición de las VE normales y HSD, y un análisis de la diversidad de la α y la β diversidad, mostró que la ingesta elevada de sal afecta significativamente a las características genéticas de las VE microbianas intestinales, incluida la estructura de la comunidad microbiana, la riqueza de especies y la diversidad, para resolver de forma más exhaustiva los efectos de una dieta alta en sal en las VE de la microbiota intestinal. Proporciona múltiples niveles de evidencia para los estudios mecanicistas.
Aunque este método tiene algunas ventajas sobre el método convencional de centrifugación a sobrevelocidad en términos de recuperación e integridad de exosomas, todavía existen algunas limitaciones, como la alta demanda de muestras y la dificultad para distinguir el huésped de la fuente de microflora. Sin embargo, en comparación con los métodos existentes, la centrifugación en gradiente de densidad tiene ventajas únicas para mantener la integridad funcional de los exosomas, lo que proporciona un apoyo técnico confiable para una mayor investigación sobre el mecanismo por el cual una dieta alta en sal afecta la presión arterial del huésped a través de la flora intestinal. Además, para la estratificación de gradiente poco clara encontrada durante el experimento, también mejoramos extendiendo el tiempo de centrifugación o reemplazando el rotor de mayor rendimiento.
En el futuro, podemos explorar más a fondo el mecanismo de las VE de la microbiota intestinal en la hipertensión inducida por una dieta alta en sal, especialmente su interacción con el sistema inmunitario, como las células T proinflamatorias39,40; o utilizar productos derivados de plantas para intervenir en los VE de la microbiota intestinal41,42, seguir interviniendo en enfermedades y explorar su papel en la regulación del metabolismo del huésped y la respuesta inmunitaria.
En conclusión, este estudio no solo proporciona una herramienta importante para explorar el mecanismo de la hipertensión inducida por la sal en la microbiota intestinal, a través del modelo de rata sensible a la sal, sino que profundiza en la comprensión de la relación entre la HSD, la microbiota intestinal y las VE, y también abre una nueva vía para la prevención y el tratamiento de enfermedades cardiovasculares como la hipertensión, sino que proporciona una perspectiva única para el estudio de la interacción dieta-microbio-huésped.
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contrapuestas que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (82205240), la Fundación de Ciencias Naturales de la Provincia de Sichuan (2025ZNSFSC1836) y el Proyecto Clínico Básico del Hospital Ortopédico Provincial de Sichuan (PY202414).
Materiales
| Name | Company | Catalog Number | Comments |
| Essential Supplies | |||
| Centrifugal Filter (10nkDa 2 mL) | Millipore | UFC903096 | |
| Centrifuge Tude(50 mL) | BKMAN | 20220404 | |
| Centrifuge Tudes | BECKMAN COULTER | Z30815SCA | |
| Vacuum Filtration System | Biosharp | 24902581 | |
| Reagents | |||
| Chromogenic LAL Endotoxin Assay Kit | Beyotime | 022124240705 | |
| Coomassie Blue Fast Staining Solution | Beyotime | Z972241010 | |
| EDTA | Damas-beta | P3117308 | |
| Enhanced BCA Protein Assay Kit | Beyotime | A006241112 | |
| Ethanol | KESH | ||
| HCl | |||
| OptiPrep (60% wt/vol, iodixanol) | Serumwerk | 00124 | |
| PBS | Labshark | 130114005 | |
| phosphotungstic acid | RUIXIN | ||
| Sucrose | Damas-beta | P1917057 | |
| Tris (VWR) | Damas-beta | P3061764 | |
| Trypan blue staining solution (0.4%) | Beyotime | BD07242904 | |
| Equipment | |||
| Absorbance Microplate Reader | SpectraMax | ABP01690 | |
| Biomicroscope | Motic | BA210Digital | |
| Desk centrifuge | Cence | CHT210R | |
| Desktop high-speed micro centrifuge | DLAB | D3024 | |
| Fixed Angle Aluminum Rotor + 500 mL Centrifugal Cup | Cence | ||
| High precision electronic balance | SKR | BN-200 | |
| Laminar flow cabinet | Nantong Hunan Scientific Instrument Co., Ltd. | SW-CJ-2FDS | |
| SW 32.1 Ti Swing bucket turn+ SW 32.1 Ti Rotor bucket | BECKMAN COULTER | ||
| Transmission electron microscope | JEOL | JEM-1400FLASH | |
| Tube rotator | |||
| Ultracentrifuge | BECKMAN COULTER | Optima XE-100 | |
| Ultra-pure water system | ULPHW | UPR-II-15TNZ | |
| Water-Cieculation Multifunction Vacuum Pump | Qiang Qiang | SHZ-D(III) |
Referencias
- Thursby, E., Juge, N. Introduction to the human gut microbiota. Biochem J. 474 (11), 1823-1836 (2017).
- Aschtgen, M. S., et al. Rotation of Vibrio fischeri Flagella Produces Outer Membrane Vesicles That Induce Host Development. J Bacteriol. 198 (16), 2156-2165 (2016).
- Gurung, S., Perocheau, D., Touramanidou, L., Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Comm Signal. 19 (1), 47(2021).
- Avila-Calderón, E. D., et al. Outer Membrane Vesicles of Gram-Negative Bacteria: An Outlook on Biogenesis. Front Microbiol. 12, 557902(2021).
- Melo-Marques, I., Cardoso, S. M., Empadinhas, N. Bacterial extracellular vesicles at the interface of gut microbiota and immunity. Gut Microbes. 16 (1), 2396494(2024).
- Kim, N. Y., et al. Effect of gut microbiota-derived metabolites and extracellular vesicles on neurodegenerative disease in a gut-brain axis chip. Nano Converg. 11 (1), 7(2024).
- Ahmadi Badi, S., et al. Microbiota-Derived Extracellular Vesicles as New Systemic Regulators. Front Microbiol. 8, 1610(2017).
- Barathan, M., Ng, S. L., Lokanathan, Y., Ng, M. H., Law, J. X. The Profound Influence of Gut Microbiome and Extracellular Vesicles on Animal Health and Disease. Int J Mol Sci. 25 (7), 4024(2024).
- Maukonen, J., Saarela, M. Human gut microbiota: does diet matter. Proc Nutri Soc. 74 (1), 23-36 (2015).
- Bier, A., et al. A High Salt Diet Modulates the Gut Microbiota and Short Chain Fatty Acids Production in a Salt-Sensitive Hypertension Rat Model. Nutrients. 10 (9), 1154(2018).
- Aghamohammad, S., et al. Anti-inflammatory and immunomodulatory effects of Lactobacillus spp. as a preservative and therapeutic agent for IBD control. Immun Inflamm Dis. 10 (6), e635(2022).
- Dong, Z., et al. The Effects of High-Salt Gastric Intake on the Composition of the Intestinal Microbiota in Wistar Rats. Med Sci Monit. 26, e922160(2020).
- Yan, X., et al. Intestinal Flora Modulates Blood Pressure by Regulating the Synthesis of Intestinal-Derived Corticosterone in High Salt-Induced Hypertension. Circ Res. 126 (7), 839-853 (2020).
- Wang, X., Lang, F., Liu, D. High-Salt Diet and Intestinal Microbiota: Influence on Cardiovascular Disease and Inflammatory Bowel Disease. Biology. 13 (9), 674(2024).
- Qi, L., et al. Microbiome-metabolome analysis insight into the effects of high-salt diet on hemorheological functions in SD rats. Front Nutri. 11, 1408778(2024).
- Wu, Q., et al. Insights into the unique roles of extracellular vesicles for gut health modulation: Mechanisms, challenges, and perspectives. Curr Res Microb Sci. 7, 100301(2024).
- Zhang, H., et al. Effects of bacterial extracellular vesicles derived from oral and gastrointestinal pathogens on systemic diseases. Microbiol Res. 285, 127788(2024).
- Wang, H. X., Wang, Y. P. Gut Microbiota-brain Axis. Chinese Med J. 129 (19), 2373-2380 (2016).
- Huang, S., et al. A cross-tissue transcriptome association study identifies key genes in essential hypertension. Front Genet. 14, 1114174(2023).
- Gao, H., et al. Microbial DNA Enrichment Promotes Adrenomedullary Inflammation, Catecholamine Secretion, and Hypertension in Obese Mice. J Am Heart Assoc. 11 (4), e024561(2022).
- Chen, P. Gut Microbiota and Pathogenesis of Organ Injury. , Springer. Singapore. (2020).
- Xie, N., et al. hPSCs-derived brain organoids for disease modeling, toxicity testing and drug evaluation. Exp Neurol. 385, 115110(2024).
- Liu, N., et al. The underlying mechanisms of DNA methylation in high salt memory in hypertensive vascular disease. Sci Rep. 14 (1), 925(2024).
- Li, M., et al. Wheat β-glucan reduces obesity and hyperlipidemia in mice with high-fat and high-salt diet by regulating intestinal flora. Int J Biol Macromol. 288, 138754(2024).
- Kerem, G., et al. Small intestinal microbiota composition altered in obesity-T2DM mice with high salt fed. Sci Rep. 13 (1), 8256(2023).
- Díez-Sainz, E., Milagro, F. I., Riezu-Boj, J. I., Lorente-Cebrián, S. Effects of gut microbiota-derived extracellular vesicles on obesity and diabetes and their potential modulation through diet. J Physiol Biochem. 78 (2), 485-499 (2022).
- Wu, S., et al. Liuzijue training improves hypertension and modulates gut microbiota profile. Front Cardiovasc Med. 10, 1075084(2023).
- Qi, L. M., et al. Salvia miltiorrhiza bunge extract improves the Th17/Treg imbalance and modulates gut microbiota of hypertensive rats induced by high-salt diet. J Funct Foods. 117, 106211(2024).
- Wilck, N., et al. Salt-responsive gut commensal modulates T(H)17 axis and disease. Nature. 551 (7682), 585-589 (2017).
- Jiang, X., et al. Intestinal Gastrin/CCKBR (Cholecystokinin B Receptor) Ameliorates Salt-Sensitive Hypertension by Inhibiting Intestinal Na(+)/H(+) Exchanger 3 Activity Through a PKC (Protein Kinase C)-Mediated NHERF1 and NHERF2 Pathway. Hypertension. 79 (8), 1668-1679 (2022).
- Zheng, T., et al. Hypertension of liver-yang hyperactivity syndrome induced by a high salt diet by altering components of the gut microbiota associated with the glutamate/GABA-glutamine cycle. Front Nutr. 9, 964273(2022).
- Mulligan, S. K., et al. Multiplexed TEM Specimen Preparation and Analysis of Plasmonic Nanoparticles. Microsc Microanal. 21 (4), 1017-1025 (2015).
- Olson, B. Assays for Determination of Protein Concentration. Curr Protoc Pharmacol. 73, A.3a.1-a.3a.32 (2016).
- Matsumoto, H., Haniu, H., Komori, N. Determination of Protein Molecular Weights on SDS-PAGE. Methods Mol Biol. 1855, 101-105 (2019).
- Sanschagrin, S., Yergeau, E. Next-generation Sequencing of 16S Ribosomal RNA Gene Amplicons. J Vis Exp. (90), e51709(2014).
- Tulkens, J., De Wever, O., Hendrix, A. Analyzing bacterial extracellular vesicles in human body fluids by orthogonal biophysical separation and biochemical characterization. Nat Protoc. 15 (1), 40-67 (2020).
- Ruhal, R., Kataria, R. Biofilm patterns in gram-positive and gram-negative bacteria. Microbiol Res. 251, 126829(2021).
- Maldonado, R. F., Sá-Correia, I., Valvano, M. A. Lipopolysaccharide modification in Gram-negative bacteria during chronic infection. FEMS Microbio Rev. 40 (4), 480-493 (2016).
- Honda, K., Littman, D. R. The microbiota in adaptive immune homeostasis and disease. Nature. 535 (7610), 75-84 (2016).
- Guzik, T. J., et al. Role of the T cell in the genesis of angiotensin II induced hypertension and vascular dysfunction. J Exp Med. 204 (10), 2449-2460 (2007).
- Huang, J., et al. Extracellular vesicles as a novel mediator of interkingdom communication. Cytokine Growth Factor Rev. 73, 173-184 (2023).
- Li, W., et al. Alleviation of colitis by honeysuckle MIR2911 via direct regulation of gut microbiota. J Control Release. 376, 123-137 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados